
42 minute read
Arnold Honig
from Jahrbuch 2016
by bigdetail
❙ Arnold Honig † ❙
Zur Rolle der arteriellen Chemorezeptoren bei der Umstellung und der Regulation des Salz- Wasserhaushalt in akuter Höhenhypoxie
On the role of arterial chemoreceptors in the adjustment and the regulation of salt water balance in acute altitude hypoxia
Prof. Dr. Arnold Honig † ist am 3.6.2016 verstorben. Es war ihm ein besonderes Anliegen, diesen Beitrag im Jahrbuch zu veröffentlichen. Das Redaktionsteam dankt Herrn Dr. Bert Flemming für die Unterstützung zur Fertigstellung dieses Beitrags.
SUMMARY
The acute adjustment to well-tolerated high-altitude hypoxia is brought about by initial hemoconcentration as indicated by increases in hematocrit and plasma protein concentration. This rapid hemoconcentration can only be related to a decrease in body water that relies on both reduced water intake and increased water excretion. Given the constancy of the osmolality of body fluids, this must be accompanied by a decrease in NaCl intake and/or increased NaCl excretion. In fact, studies in healthy young subjects report on a so-called altitude natriuresis and diuresis. From several studies in humans as well as various animal species it is concluded, that the reflexes that bring about the decrease in NaCl intake and increase in NaCl excretion are triggered by arterial chemoreceptors located in the aorta and the carotid arteries. In addition, the chemoreceptors actuate respiratory and cardiovascular changes via neuronal and humoral pathways. The responses to stimulation of the chemoreceptors are modulated or may even be abolished by conditions such as old age and various diseases including hypertension. The physiological acute adaptation to high-altitude hypoxia can by supported
47
by deliberate reduction in NaCl intake as well as by enhancing natriuresis and diuresis by consuming caffeine-containing drinks and low-salt drinks, and by the use of diuretic drugs. Measurements of the respiratory response and the response of the ratio of urinary sodium-to-potassium concentrations to acute stimulation of the arterial chemoreceptors may help in the assessment of an individual’s tolerance to high altitude. Keywords: acute high-altitude hypoxia, initial hemoconcentration, arterial chemoreceptors, renal sodium excretion
ZUSAMMENFASSUNG
Die akute Anpassung an gut tolerierbare Höhenhypoxie erfolgt durch eine initiale Hämokonzentration, erkennbar am Anstieg des Hämatokrits und der Plasmaproteinkonzentration. Dies kann nur durch eine Abnahme des Körperwassers erklärt werden, die sowohl auf einer verminderten Wasser-Aufnahme als auch auf einer vermehrten Wasser-Ausscheidung beruht. Aufgrund der osmotischen Konstanz der Körperflüssigkeiten muss dies mit einer verminderten Aufnahme und/oder einer vermehrten Ausscheidung von Kochsalz verbunden sein. Tatsächlich wird bei gesunden jungen Menschen und Tieren eine sogenannte Höhennatriurese und Höhendiurese beschrieben. Aus vielen Untersuchungen am Menschen und verschiedenen Tierarten konnte der Angriffspunkt dieser reflexartigen Natriumausscheidung und der Verminderung der freiwilligen Natriumaufnahme in den arteriellen Chemorezeptoren der Aorta und der Halsschlagader lokalisiert werden. Neben diesen Effekten der Chemorezeptoren werden unabhängig davon über Nerven und Hormone die Atmung und der Kreislauf beeinflusst. Die Reaktionen der Chemorezeptorenreizung werden jedoch durch Alter und durch verschiedene Erkrankungen wie Hypertonie modifiziert oder blockiert. Die akute physiologische Anpassung an Höhenhypoxie kann durch eine bewusst verminderte Natriumaufnahme und eine induzierte verstärkte renale Ausscheidung durch koffeinhaltige Getränke, Medikamente, die die Salzausscheidung steigern und Trinken von natriumarmer Flüssigkeit aktiv unterstützt werden. Die Beurteilung der Höhentoleranz könnte durch die Erfassung von Atemreaktionen und/oder des Quotienten der Urinkonzentration von Natrium und Kalium nach Reizung der arteriellen Chemorezeptoren ergänzt werden. Schlüsselwörter: akute Höhenhypoxie, initiale Hämokonzentration, arterielle Chemorezeptoren, renale Natriumausscheidung
48
EINLEITUNG
Ständig im Hochgebirge (<2.500 m) lebende Säugetiere und Menschen haben eine höhere Konzentration von Erythrozyten und Hämoglobin in ihrem Blut und können daher mehr Sauerstoff ins Gewebe transportieren. Da bei ihnen die O2-Abgabe aus einem steileren Teil der O2-Bindungskurve heraus stattfindet, kann ihr Blut beim Durchgang durch das Gewebe auch stärker ausgeschöpft werden, was eine größere arteriovenöse O2-Gehaltsdifferenz (AVD- O2) möglich macht (1). Bei chronisch in großen Höhen lebenden und damit höhenadaptierten Menschen und Säugetieren kann dann die in der Zeiteinheit benötigte O2- Menge zumindest in körperlicher Ruhe mit einem relativ normalen oder sogar kleineren Herzminutenvolumen geliefert werden (2).
Die initiale Hämokonzentration in akuter Höhenhypoxie
Wie aber erreichen nicht höhenangepasste Säugetiere oder Menschen in möglichst kurzer Zeit einen Anstieg der Erythrozyten- und Hämoglobinkonzentration in ihrem Blut, wenn sie einer akuten aber gut tolerierten Höhe von über 2.500 m ausgesetzt werden? Dazu ergibt sich aus der Literatur ein sehr übereinstimmendes Bild: Junge, gesunde aber noch nicht höhenadaptierte Säugetiere und Menschen reagieren in körperlicher Ruhe auf arterielle Hypoxie oft schon am ersten Tage mit einem deutlichen Anstieg der Konzentration der Erythrozyten und des Hämoglobins in ihrem Blut, doch das gilt aber offenbar nur, wenn die Höhenexposition gut toleriert wird (1,3–9). Im Englischen wird dieses Phänomen „the initial hemoconcentration in acute high-altitude hypoxia“ genannt (Abb. 1). Einige Tiere sind in der Lage, Blut mit hohem Erythrozytengehalt in der Milz vorzuhalten, es am Beginn eines arteriellen O2-Mangels auszustoßen und so eine Hämokonzentration in akuter arterieller Hypoxie zu bewerkstelligen (10–12). Die Milz des Menschen und auch die der Ratte ist aber zu klein, um das auch bei ihnen beobachtete Ausmaß der „initialen Hämokonzentration im akuten arteriellen O2- Mangel“ zu erreichen (8). Außerdem würde eine Milzentleerung die nachfolgend zu diskutierende Abnahme des extrazellulären Körperwassers und des Blutplasmavolumens in arterieller Hypoxie nicht erklären. Die Zunahmen der Blutzell- und Hämoglobinkonzentration oft schon innerhalb des ersten Tages eines Höhenaufenthaltes kann auch nicht durch einen raschen und vermehrten Ausstoß neuer Blutzellen aus dem Knochenmark verursacht sein, denn die Zahl der Retikulocyten steigt in der Regel erst ab dem zweiten Tag in der Höhe an (6,8,13,14). Es ist daher schon frühzeitig
49
angenommen und auch gemessen worden, dass die Anstiege der Erythrozyten-, Hämoglobin- und Proteinkonzentrationen im Blut in akuter arterieller Hypoxie durch Abnahme des Blutplasmavolumens zustande kommen (1,3–7,9,15,52). Als Beispiel sei hier die Abbildung 1 vorgestellt, die auf Daten von Hurtado et al. (6) basiert.
Abb. 1: Die Reaktionen der Hämoglobinkonzentration (HB), der Retikulozytenzahl und des Proteingehaltes nicht höhenangepasster junger Männer in den ersten Tagen eines Höhenaufenthaltes. Nach einer Abbildung von (6); modifiziert.
50
Es gilt heute als gesichert, dass die Reduktion des Plasmavolumens im akuten und gut tolerierten arteriellen O2-Mangel das Resultat von sowohl Neuverteilung der Flüssigkeit innerhalb des Körpers wie auch eines echten Verlustes von Körperwasser ist. Letzteres erklärt dann auch, zumindest teilweise, die immer wieder beschriebene schnelle Abnahme des Körpergewichts auch in akuter gut tolerierter Höhenhypoxie (1,2,5,14–17).
„... freiwillige Dehydratation in akuter gut tolerierter Höhenhypoxie ...“ „... voluntary dehydration in acute well-tolerated high-altitude hypoxia ...“
Die Verminderung allein des Körperwassers in den ersten Tagen im Hochgebirge wäre leicht zu erklären: Denn wenn die Luft in den Bergen trocken und kalt ist, dann wird sowohl viel Wasser durch die verstärkte Belüftung der Lungen abgeatmet wie auch durch meist nicht bemerkte Verdunstung über die Haut verloren. Bei diesem über die Lungen und die Haut abgedampften Wasser kann es sich aber immer nur um reines, also „osmotisch freies“ Wasser handeln. Würde es aber im akuten arteriellen O2-Mangel nur zu einem alleinigen Verlust von mineralfreiem Wasser kommen, dann würden die Konzentrationen der Salze, vor allem die des Kochsalzes, in der extrazellulären Flüssigkeit ansteigen müssen. Die Salzkonzentrationen aber, speziell die des NaCl, in der extrazellulären Flüssigkeit werden in biologischen Organismen extrem genau kontrolliert und konstant gehalten. Eine Verminderung des Extrazellulär- und Plasmavolumens und damit auch des Körperwassers insgesamt in der Höhe ist daher nur möglich, wenn dabei der Gehalt des Körpers an Salz und Wasser im gleichen Ausmaß vermindert wird. Das Kochsalz können Säugetiere und Menschen in physiologisch bedeutsamen Mengen nur über die Nieren eliminieren. Damit wäre also zu erwarten, dass es in akuter aber gut tolerierter arterieller Hypoxie zu einer vermehrten Kochsalz- und auch Wasserausscheidung durch die Nieren kommt, dass also eine „Höhennatriurese“ und „Höhendiurese“ auftreten. Das ist tatsächlich auch immer wieder beschrieben worden (1,5,16,18,19,21,23–28,30,36,37,71,76,79). Die Natriurese und Diurese der Säugetiere in gut tolerierter Höhenhypoxie sind physiologische Anpassungsreaktionen und gelten als prognostische Zeichen guter Höhenfestigkeit (1,5,21,23,24,36). Erfahrene Bergsteiger wissen das seit langem und nehmen sich deshalb oft auch Medikamente (Saluretika oder Diuretika) mit, um damit die „Höhennatriurese“ und „Höhendiurese“ notfalls pharmakologisch zu erzwingen. Man kann aber auch versuchen, eine „Höhendiurese“ durch einen Pott von (koffeinhaltigem) Kaffee anzuschieben.
51
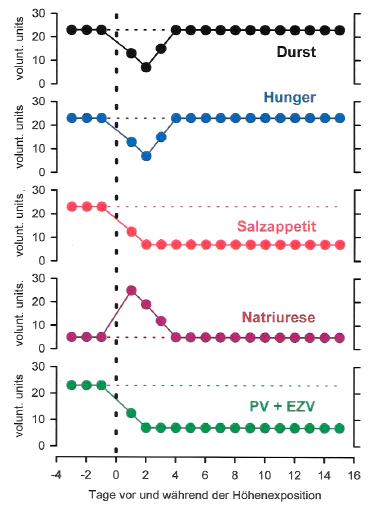
Die Natriurese und Diurese im akuten arteriellen Sauerstoffmangel wurden zunächst als Folge einer vermehrten Bikarbonatexkretion der Nieren im Dienste der Regulation des arteriellen pH-Wertes angesehen. Diese Erklärung ist nicht zu halten, denn die durch akute arterielle Hypoxie induzierte vermehrte renale Salz- und Wasserexkretion treten auch an narkotisierten, relaxierten und konstant mit O2-Mangelgemischen beatmeten Tieren auf. Also auch dann, wenn sich arterieller pCO2- und pH-Wert beim Übergang von Normoxie auf Hypoxie nicht ändern können (34,37). In schwerer und schlecht tolerierter Höhenhypoxie, nach Literatur zu erwarten bei einem arteriellen pO2 unterhalb von etwa 40 mm Hg, werden in der Regel keine Höhennatriurese und kein vermehrter Harnfluss beobachtet, sondern die Tendenz geht zu Antinatriurese und Antidiurese (1,5,28–34,36,83–85). Die Abnahme des Extrazellulär- und Plasmavolumens in akuter gut tolerierter Hypoxie entsteht aber nicht nur durch eine vermehrte Ausscheidung von Kochsalz und Wasser durch die Nieren, sondern ist auch Folge verminderten Durstes und Kochsalzappetits und somit auch einer Suppression der spontanen Salz- und Wasseraufnahme (5,16–18,20,26,38–41). Die Reduktion des extrazellulären Flüssigkeitsraumes in akuter gut tolerierter Höhenhypoxie kann also zustande kommen durch sowohl verminderte spontane Aufnahme wie auch vermehrte renale Ausscheidung von Kochsalz und Wasser oder auch durch eine Kombination beider Reaktionen. Aus einigen Literaturstellen (16,18,20,26,38) ergibt sich der Eindruck, dass, wenn Tiere und wohl auch Menschen in der Hypoxie freien Zugang zu Salz und Wasser haben, sie vorwiegend mit der „Eingang Seite“ und nicht mit der Exkretion reagieren, d.h. sie steigern nicht ihre renale Wasser- und Salzausscheidung, sondern vermindern in erster Linie ihre spontane Salz- und Wasseraufnahme. Die Darstellung in Abbildung 2 gibt eine Vorstellung vom Ablauf dieser Anpassungsreaktionen des Salz- und Wasserhaushaltes bei akuter Höhenexposition bei jungen und gesunden Säugetieren in körperlicher Ruhe. Die Abbildung 2 wurde unter Verwendung von Daten vieler Literaturquellen entwickelt. Es ist dies also eine recht willkürliche zeitliche Zuordnung („Synopsis“) der Abläufe von Durst- und Hungergefühl, von Salzappetit und renaler Kochsalzexkretion sowie Plasma- und Extrazellulärvolumen zueinander.
Arterielle Chemorezeptoren und Salz- und Wasserbilanz in akuter gut tolerierter Höhenhypoxie
Es kann heute als gesichert gelten, dass die physiologischen Umstellungen des Salz- und Wasserhaushaltes im akuten arteriellen Sauerstoffmangel vom zen-
52
tralen Nervensystem (ZNS) aus gesteuert werden. Das ZNS kann eine solches „resetting“ aber nur bewirken, wenn es darüber informiert wird, dass eine arterielle Hypoxie eingetreten ist bzw. besteht. Nach unserem heutigen Wissenstand können nur die sog. arteriellen Chemorezeptoren den O2-Partialdruck des arteriellen Blutes „messen“ und dem Gehirn melden.
Abb. 2: Das Verhalten von Durst, Hunger, Salzappetit, renaler Kochsalzexkretion sowie des Plasma- (PV) und Extrazellulärvolumens (EZV) bei nicht höhenangepassten Säugern in akuter aber gut tolerierter Höhenhypoxie. Da nur die Richtung der Reaktionen angedeutet werden soll, stehen auf den Ordinaten nur „voluntary units“ / „willkürliche Einheiten“.
53
Die „peripheren arteriellen Chemorezeptoren“ kommen in den beiden Glomera carotica und aortica vor und sind biologische pO2-Messfühler des Arterienbaumes. Bekommt das ZNS von diesen pO2a-Sensoren die Meldung „pO2a abgefallen“, dann werden reflektorisch über Hormone und efferente Nerven nicht nur Atmung und Kreislauf, sondern eben auch die Nierenfunktion sowie auch das Durst- und Appetitgefühl auf den O2-Mangel umgestellt.
Zur Rolle der arteriellen Chemorezeptoren bei der Steuerung der freiwilligen Salz- und Wasseraufnahme in akuter gut tolerierter Höhenhypoxie
Werden Säugetiere einem akuten arteriellen O2-Mangel ausgesetzt, dann kommen die dadurch evozierten Reaktionen entweder durch direkte Gewebewirkungen der Hypoxie zustande, oder aber es handelt sich um Reflexeffekte der arteriellen Chemorezeptoren. Um das zu unterscheiden, kann man Tiere, meist Ratten, mit intakten und denervierten arteriellen Chemorezeptoren der Hypoxie aussetzen und ihre Reaktionen vergleichen. Man kann aber auch die arteriellen Chemorezeptoren von Tieren und auch Menschen pharmakologisch, z.B. mit dem Wirkstoff Almitrin Bismesylate, stimulieren. Mit Hilfe dieses Pharmakons ließ sich z. B. zeigen, dass Ratten in Seehöhe (Normoxie), deren arterielle Chemorezeptoren durch orale Gabe von Almitrin chronisch stimuliert wurden, darauf mit einer Abnahme ihres Plasmavolumens aber ohne Änderung ihrer Erythrozytenmasse reagierten (52). Die arteriellen Chemorezeptoren haben also einen Einfluss auf das Extrazellulär- und Plasmavolumen aber nicht auf die Blutzellmenge. Beim Studium der Reaktionen der spontanen Salz-, Futter- und Wasseraufnahme von Ratten im arteriellen O2-Mangel stellte sich heraus, dass Tiere mit intakten arteriellen Chemorezeptoren in gut vertragener Höhenhypoxie eine Abnahme ihrer freiwilligen Salz-, Wasser- und Futteraufnahme zeigen (5,17,18,20,26,38–41,44). Im Gegensatz dazu zeigten Ratten mit denervierten arteriellen Chemorezeptoren keine Reduktion der Salzaufnahme in Höhenhypoxie (39). Stimulierte man die arteriellen Chemorezeptoren von in Seehöhe (Normoxie) gehaltenen Ratten pharmakologisch mit Almitrin Bismesylate, dann reagierten nur die Tiere mit intakten Chemorezeptoren nicht aber die Ratten mit den denervierten pO2-Sensoren mit einer Abnahme ihrer freiwilligen Salzaufnahme (39). Dagegen war die spontane Reduktion der Wasseraufnahme in den ersten Tagen der Höhenhypoxie durch Denervierung der arteriellen Chemorezeptoren nicht zu beeinflussen und auch eine pharmakologische Stimulation der Chemorezeptoren bei intakten Ratten führte nicht zu
54
vermindertem Trinken (39). Das bedeutet insgesamt: Die Verminderung der freiwilligen Salzaufnahme von Ratten in Höhenhypoxie steht unter der Kontrolle der arteriellen Chemorezeptoren nicht aber das spontane Wassertrinken.
Zur Rolle der arteriellen Chemorezeptoren bei der reflektorischen Kontrolle der Nierenfunktion im akuten aber gut tolerierten arteriellen Sauerstoffmangel
Schon sehr frühzeitig konnte wiederholt gezeigt werden, dass ein schwerer arterieller O2–Mangel, der bereits die Funktionen des Gehirns selbst in Mitleidenschaft zieht, keine Natriurese und Diurese erzeugt, sondern im Gegenteil über eine generalisierte Aktivierung des sympathischen Nervensystems zu einer Antinatriurese und Antidiurese führt. Diese durch schwere Gesamtkörper- und Gehirnhypoxie erzeugbare Antinatriurese und Antidiurese gehen mit Abnahmen der Nierendurchblutung und der glomerulären Filtration einher und sind durch Ausschalten der arteriellen Chemorezeptoren nicht zu verhindern (29–34). Weiterhin wurde gefunden, dass eine sehr schwere Hypoxie der isolierten Nieren selbst die renale Salz- und Wasserausscheidung auch steigert (35), doch muss die dazu notwendige Senkung des O2-Gehaltes im Blut der Nierenarterien so extrem sein, dass das am ganzen Menschen immer eine Antinatriurese und Antidiurese erzeugen würde. Damit blieb als weitere Erklärungsvariante und war im Experiment zu prüfen, ob es sich bei den im akuten und gut vertragenen arteriellen Sauerstoffmangel auftretenden Zunahmen des Salz- und Wasserausscheidung der Nieren um physiologische Reflexwirkungen der arteriellen Chemorezeptoren handelt. Um das festzustellen, kann man heute auch am Menschen die arteriellen Chemorezeptoren pharmakologisch stimulieren, wobei der Körper weiter in Normoxie bleibt. Wie erwähnt kann man dazu das Pharmakon Almitrin Bismesylat einsetzen. Die Abbildung 3 zeigt für die intrarenale Hämodynamik die Ergebnisse eines solchen Vorgehens. In diesen Experimenten wurden die Wirkungen einer Hypoxie des ganzen Körpers (Atmung von 12% O2 in N2) verglichen mit den Effekten, die sich durch eine pharmakologische Stimulation (100 mg Almitrin oral) der arteriellen Chemorezeptoren bei normoxischen Probanden auslösen ließen (45). Die Versuche fanden an 12 jungen Männern in Wasserdiurese statt. Das Erzwingen einer Diurese ist unvermeidbar, wenn mit der sog. Clearancetechnik sowohl die renale Hämodynamik wie auch die Funktion der Nierentubuli untersucht werden sollen (70). In der Abbildung 3 dargestellt sind nicht die Absolutwerte, sondern die durch die
55
Hypoxie bzw. das Almitrine provozierten Reaktionen (∆-Werte) gegenüber der Ausgangslage. Aus der Abbildung 3 ergibt sich, dass sowohl in Ganzkörperhypoxie wie auch nach der Applikation von Almitrin bei einem nur wenig angestiegenen mittleren arteriellen Blutdruck (MBP) und nur geringer Zunahme der glomerulären Filtration (GFR) eine leichte Abnahme der renalen Durchblutung (RBF) zu beobachten war. Damit musste die Filtrationsfraktion (FF), also der Quotient aus
Abb. 3: Die Reaktionen (∆-Werte) des arteriellen Mitteldruckes (MBP), der glomerulären Filtrationsrate (GFR), des renalen Blutflusses (RBF), und des Durchflusswiderstandes der Nieren (MBP/ERBF) junger gesunder Männer bei Atmung von 12% O2 in N2 oder oraler Gabe von 100 mg Almitrin. Nach einer Abbildung von (45); modifiziert.

56
GFR und effektivem renalem Plasmafluss (GFR/ERPF) zunehmen. Der renale hämodynamische (Blutdurchfluss-) Widerstand, berechnet als der Quotient „MBP/RBF“, stieg an. Sowohl in akuter wie auch chronischer arterieller Hypoxie des gesamten Körpers wurden immer wieder Zunahmen des renalen Durchflusswiderstandes und der Filtrationsfraktion beschrieben (1,5,28,69). Beide Reaktionen können im Tierexperiment sowohl durch Denervierung der arteriellen Chemorezeptoren wie auch der Nieren aufgehoben werden, was bedeutet, dass es sich bei diesen Phänomenen um Reflexwirkungen der arteriellen Chemorezeptoren handeln muss (1,5,48,62). Sowohl arterielle Hypoxie des ganzen Körpers wie auch pharmakologische Stimulation der arteriellen Chemorezeptoren am normoxischen Tier können reflektorisch zu einer Abnahme der Durchblutung in der Nierenrinde führen, lassen aber den Blutfluss im Nierenmark unbeeinflusst (67,68). Eine andere an normoxischen Tieren anwendbare und vor dem Vorhandensein von Almitrin unvermeidbare Technik zu Stimulation der Chemorezeptoren der Glomera carotica ist es, die beiden Karotisgabeln bei intakt bleibender Innervation vaskulär zu isolieren und mit hypoxischem Blut zu durchströmen (46,47,53–55). Die Abbildung 4 stellt neben dem arteriellen Mitteldruck (MBP) die Reaktionen (∆-Werte) der sog. „fraktionalen renalen Exkretionen“ des Urins (RFVU) und des Natriums (RFNa) bei hypoxischer Perfusion der vaskulär isolierten Karotiskörperchen an Katzen in Vollnarkose vor. Diese RF-Werte geben an, wieviel Prozent der pro Minute filtrierten Mengen einer Substanz oder der filtrierten Volumina in einer Minute im Harn eliminiert wurden. Ein RFVU von 2,0% z.B. besagt, dass 2,0% des Filtratvolumens (GFR) während der Tubuluspassage nicht rückresorbiert, sondern „abgestoßen = rejected“ und als Urin ausgeschieden wurden. Eine Zunahme der RF-Werte zeigt eine Abnahme der tubulären Reabsorption der betreffenden Substanz an; eine Verminderung der RF-Werte dagegen signalisiert eine vermehrte tubuläre Reabsorption. Die Daten der Abbildung 4 wurden in Tierexperimenten gewonnen, bei denen die Glomera carotica zunächst mit arteriellem („–50 min bis 0 min“), dann mit venösem („0 min bis 60 min“) und dann erneut mit arteriellem Blut („60 min bis 120 min“) durchströmt wurden. Die Tiere selbst und damit auch die Nieren blieben dabei immer normoxisch. Auf einer Seite wurden die Nierennerven durchschnitten. Aus der Abbildung 4 wird ersichtlich, dass die anhaltende Perfusion der Karotiskörperchen mit dem O2-armen venösen Blut bei den normoxischen Tieren eine Zunahme der renalen fraktionalen Ausscheidungen des Urins (RFVU) und Natriums (RFNa) insbesondere in den denervierten Nieren zur Folge hatte. Das bedeutet, dass die Perfusion der Glomera carotica mit hy-
57
Abb. 4: Die durch hypoxische Perfusion der Glomera carotica induzierten Reaktionen (∆-Werte) des mittleren arteriellen Blutdruckes (MBP) und der renalen fraktionalen Exkretionen des Urins (RFVU) und des Natriums (RFNa). Nach eine Abbildung von (1): modifiziert. Experimente an voll narkotisierten, vagotomierten, kurarisierten und maschinell konstant beatmeten Katzen in osmotischer Diurese.

58
poxischem Blut eine Hemmung der tubulären Reabsorption insbesondere des Natriums bewirkt hatte, die durch Nierendenervierung nicht zu verhindern war. Heute lässt sich sicher sagen: Die Hemmung der renalen tubulären Reabsorption des Natriums in akuter gut tolerierter arterieller Hypoxie und/oder bei Reizung der arteriellen Chemorezeptoren im normoxischen Körper ist:
– Unabhängig von dem bei Chemorezeptorenreizung und bei einigen Spezies in arterieller Hypoxie manchmal auftretenden Anstieg arteriellen Blutdruckes, also keine „Drucknatriurese“ (22,46,53–55,58,63,64). – Unabhängig von der in arterieller Hypoxie und bei Stimulation der arteriellen
Chemorezeptoren immer gegebenen Hyperventilation und damit also keine
Begleiterscheinung einer respiratorischer Alkalose (34,37,47,53,54,62–64). – Unabhängig von den Reaktionen der renalen Durchblutung und der glomerulären Filtrationsrate (30,43,53–55,57,58,62,63,71). – Unabhängig von der efferenten renalen Innervation, denn die Natriurese bei
Stimulation der arteriellen Chemorezeptoren wird durch Denervieren der
Nieren nicht behoben (43,48,53,62,63). – Aber sie ist gebunden an die intakte afferente Innervation der Glomera carotica und Glomera aortica, denn Ausschalten der arteriellen Chemorezeptoren hebt die Natriurese bei Reizung der arteriellen Chemorezeptoren auf (62–64,98).
Was ganz allgemein die Reaktionen der Hormonsysteme in Ganzköperhypoxie und bei isolierter Stimulation der arteriellen Chemorezeptoren angeht, so gewinnt man aus der Literatur der Eindruck, dass diese Umstellungen in körperlicher Ruhe in der Regel derart sind, dass sie die Entwicklung einer Natriurese und Diurese sowie der Hemmung von Durst und Salzappetit unterstützen. Die antinatriuretisch und antidiuretisch wirkenden Hormone Aldosterone und Vasopressin (ADH), wenn auf das zugehörige Renin oder die Osmolarität im Plasma bezogen, nehmen in körperlicher Ruhe und gut tolerierter Hypoxie entweder ab oder zumindest nicht zu (1,5,21,23,27,49,50,56,61,63,65,75–79,82). Für die natriuretisch wirkenden Peptide (ANF, ANP) lässt sich aus der Literatur kein klares Reaktionsmuster ableiten (1,5,19,21,23,27,28,42,56,59, 61,76). Erkrankungen, die den O2- und CO2-Transport im Organismus beeinträchtigen oder auch körperliche Arbeit sowie durch andere Ursachen eingeschränkte Höhentoleranz können dieses Verhalten aber modifizieren (1,5,73,74,). Die im Zusammenhang mit Salz- Wasserhaushalt gegebenen Fragen nach den en-
59
dokrinen Umstellungen in akuter arterieller Höhenhypoxie werden wohl Gegenstand der wissenschaftlichen Diskussion bleiben (1,5,21,28,43,61,72).
Praxisrelevante Schlussfolgerungen sich ergebend aus den Reaktionen der Kochsalz- und Wasserbilanz in akuter gut tolerierter Höhenexposition
Die Abbildungen 1 und 5 sollen zusammen deutlich machen, dass die von den arteriellen Chemorezeptoren aus reflektorisch induzierten Zunahmen der renalen Kochsalz- und Wasserexkretion sowie die simultan stattfindenden Suppressionen von Durst und Salzappetit via „initiale Hämokonzentration im akuten arteriellen Sauerstoffmangel“ nicht nur die O2-Bindung des Blutes in den Lungen, sondern auch die O2-Abgabe durch das Blut an die Gewebe verbessern. Erfahrene Bergsteiger und Bergführer wissen aus Überlieferung und aus eigenem Erleben, dass nicht höhenangepasste Menschen, wenn sie oberhalb von 2.500 m mit kräftiger Diurese reagieren, die Höhe in der Regel gut vertragen. Man kann versuchen, diese physiologische „Höhennatriurese“ und „Höhendiurese“ auch ohne starke Natriuretika und Diuretika einfach mit Bohnenkaffee in Gang zu bringen. Koffein erhöht die Nierenmarkdurchblutung, mindert so Osmolarität und Konzentrierungsfähigkeit des Haarnadelgegenstromsystems im Nierenmark und fördert damit die Diurese, allerdings nur bei starken Kaffeetrinkern. Es soll auch die pO2-Sensitivität und damit die Reflexeffekte der arteriellen Chemorezeptoren steigern. Beide Wirkungen des Koffeins würden also die „freiwillige Dehydratation“ in akuter Höhenhypoxie unterstützen. Es ist auch zu vermuten, dass wenn vor geplanter Höhenexposition eine Präakklimatisation von Menschen insbesondere auch durch Schlafen in simulierter Höhe durchgeführt wird (92), dadurch auch die Neueinstellung des Salz- und Wasserhaushaltes unterstützt wird; das wäre zu testen. Was das immer wieder empfohlene ausgiebige Trinken in akuter Höhe angeht, so sollten aus Sicht der Physiologie vor allem salzfreie Getränke konsumiert werden. Obwohl es auf den ersten Blick paradox erscheint: Ausgiebiges Trinken von salzfreiem Wasser kann die „voluntary dehydration in acute high-altitude hypoxia“ sogar unterstützen. Die Nieren können absolut salzfreien Urin nämlich nicht ausscheiden und so gehen mit der willkürlich erzeugten Harnflut auch Salze verloren, die ihrerseits dann noch aus osmotischen Gründen Wasser mit sich nehmen. Eine Retention von salzfreiem Wasser im Gefolge forcierten Trinkens ist bei Gesunden in der Höhe nicht zu befürchten, denn reines Wasser kann der Organismus nicht nur über die Nieren, sondern und
60
auch über Haut und Lungen problemlos eliminieren. Dagegen würde die Aufnahme stark salzhaltiger Getränke in den ersten Tagen eines Höhenaufenthaltes aus Sicht der Theorie kontraproduktiv sein können und sollte daher bewusst vermieden werden. Herz- und Nierengesunde müssten damit allerdings auch fertig werden können. Physiologen glauben an die Weisheit der Natur: Von alleine geht’s am besten“. Wenn so, dann sollten gesunde aber nicht höhenangepasste Menschen in den ersten Tagen in der Höhe vor allem auf die Signale ihres eigenen Körpers, also Hunger, Durst, Salzappetit, achten und ihnen folgen. Wer sich jedoch diese seine physiologische „Eingangsregulation“ durch Fresssucht, Alkohol, Drogen und Tabak „versaut“ hat, der hat wenig Chancen, von den eigenen Signalen sicher bei der (Verhaltens-) Höhenanpassung geführt zu werden.

61
Abb. 5: Zusammenfassung der wichtigsten Mechanismen und Neueinstellungen des Salz- und Wasserhaushaltes in akuter aber gut tolerierter Höhenhypoxie bei nicht höhenadaptierten Säugetieren in den ersten 1–3 Tagen der Höhenexposition. Auch angedeutet sind die Auswirkungen dieses „resetting“ auf die Sauerstoffbewegungen in Lunge und Gewebe. Nach einer Abbildung von (5); modifiziert.
Was die Nahrungszusammensetzung in den ersten Tagen eines Höhenaufenthaltes angeht, so sollten aus Sicht der Theorie stark salzhaltige und evtl. auch sehr fette Speisen gemieden und stattdessen Kohlehydrate bevorzugt werden. Die Angaben der Literatur scheinen diese Ansicht zu bestätigen (80,81). Bei der Verbrennung von Kohlehydraten entstehen im Körper letztlich nur Wasser und CO2. Das Handling dieser beiden Komponenten macht dem Organismus keine Probleme. Was die Mengen der konsumierten Nahrungsmittel angeht, so sollten sich Gesunde eigentlich ebenfalls auf die Signale ihres eigenen Körpers verlassen können.
Spezielle Bedingungen, welche die Natriurese und Diurese in Höhenhypoxie oder bei Reizung der arteriellen Chemorezeptoren verhindern oder sogar zur Antinatriurese und Antidiurese führen könnten – einige Beispiele
Nach dem gegenwärtigen und recht unbefriedigenden Stand der Literatur ist die primäre Reaktion der Nierentubuli in Höhenhypoxie mit Reizung der arteriellen Chemorezeptoren eine hormonal vermittelte Hemmung der Na+- und damit auch H2O-Reabsorption in den glomerulumnahen, also den proximalen Nierentubuli (58,64,65,71). So stellt sich natürlich die Frage, warum die Natriurese und Diurese in gut tolerierter Höhe nach einer gewissen Zeit, beim Menschen in der Regel innerhalb der ersten 1–3 Tage, aufhören. Ein Grund dafür könnte die durch die „freiwillige Dehydratation“ in der Hypoxie entstehende Reduktion des Plasmavolumens und damit der Kreislauffüllung sein. Die Füllung sowohl der großen Arterien wie auch Venen wird ständig von Dehnungsrezeptoren überwacht und dem Gehirn gemeldet. Nimmt also in Höhenhypoxie wegen „voluntary dehydration“ die Kreislauffüllung ab, dann signalisieren das die Dehnungs-, Druck- oder „Füllungsrezeptoren“ dem ZNS. Von dort aus werden dann reflektorisch die efferenten Nierennerven aktiviert oder auch antinatriuretisch bzw. antidiuretisch wirkende Hormone ausgeschüttet. Das erhöht in den distalen Tubulusabschnitten der Nieren die Salz- und manchmal auch Wasserreabsorption, was dann der in arterieller Hypoxie proximal generierten Natriurese und Diurese entgegenwirkt. Für ein solches Zusammenwirken der arteriellen Chemorezeptoren mit den Dehnungs- oder Füllungsrezeptoren des Kreislaufes bei der nervösen Kontrolle und Steuerung das Salz- Wasserhaushaltes im arterielle O2- Mangel gibt es experimentelle Belege (54,55). Eine andere Situation, bei der es zur Aktivierung des Sympathikus-Nervensystems und damit der efferenten Nierennerven und auch der Ausschüttung
62
antinatriuretisch und antidiuretisch wirkender Hormone kommen kann, ist körperliche Arbeit. Damit wäre eine „Höhennatriurese und -diurese“ während der Belastung nicht unbedingt zu erwarten. In solchen Fällen würde das osmotisch freie Wasser über Lunge und Haut angedampft, während das in den Nierenbecken und der Harnblase konzentriert gesammelte Kochsalz dann in Ruhepausen, z. B. in der Nacht, mit dem Urin eliminiert werden könnte.
Abb. 6: Aus Sicht der Physiologie sich ergebende Hinweise zu Essen und Trinken in den ersten Tagen eines Höhenaufenthaltes. Ausgegangen wird von der Annahme, dass die nicht höhenangepassten Personen gesund und nicht zu alt sind.

63
Eine über längere Zeit hinweg und noch vor der Höhenexposition eingetretene Verarmung des Körpers an Kochsalz, z.B. durch zu geringes Angebot in der Nahrung oder auch durch Magen- und Darmerkrankungen mit z. B. Durchfall, könnte ebenfalls der Entwicklung der „Höhennatriurese/-diurese“ entgegen wirken. Wenn bereits Höhenadaptierte erneut einem arteriellen Sauerstoffmangel ausgesetzt werden, dann wären auch schwächere Zunahmen der renalen Salz- und Wasserexkretion zu erwarten, denn bei ihnen hat es die „voluntary dehydration“ ja bereits vor der wiederholten Höhenexposition gegeben (23). Es ist auch anzunehmen, dass alle Erkrankungen, die den O2-Transport im Körper beeinträchtigen, z. B. der Lungen, des Kreislaufes und des Blutes (Anämie), die Umstellung des Salz- Wasserhaushaltes bei akuter Höhenexposition beeinträchtigen und die physiologische Natriurese und Diurese verhindern oder abschwächen. Wie bereits erwähnt aber hier noch einmal zu betonen: Wenn die arterielle Hypoxie so schwer ist, dass auch O2-Versorgung und Funktionen des Gehirns betroffen sind, dann kann es zu einer unspezifischen Alarmreaktion des sympathischen Nervensystems kommen, was dann auch von Zunahme der Aktivität in den efferenten Nierennerven und Ausschüttung von antinatriuretisch und antidiuretisch wirkenden Hormonen begleitet ist. Typisch für diese Situation ist eine renale Vasokonstriktion und mit Abnahme der Wasser- und Salzausscheidung der Nieren (25,29–34,82,83,85). Anders als bei der in gut tolerierter Hypoxie durch Stimulation der arteriellen Chemorezeptoren induzierten Salurese und Diurese sind die im schwerem arteriellen Sauerstoffmangel auftretenden Antinatriurese und Antidiurese durch Denervierung der Karotisgabeln nicht zu beheben (29,31,33). Sowohl für Theorie wie auch Klinik von besonderem Interesse sind die Reaktionen der Nierenfunktion bei primär arterieller Hypertonie von Menschen in akuter arterieller Hypoxie und/oder bei Reizung der arteriellen Chemorezeptoren in Normoxie. Immerhin kommt diese familiär gehäuft auftretende Form des Bluthochdrucks bei 20–30% der Bevölkerung in den sog. Industrieländern vor. Es wurde berichtet, dass primär hypertensive junge Männer in Normoxie, verglichen normotensiven Probanden, auf eine pharmakologische Reizung ihrer arteriellen Chemorezeptoren nicht mit Steigerung sondern sogar mit Abnahme ihrer fraktionalen renalen Kochsalz- und Urinexkretion reagieren können (60,66). Diese auffällige Reaktion wäre mit der Arbeitshypothese erklärbar, dass primär hypertensive Menschen und Tiere auffällig starke Reflexwirkungen ihrer peripheren arteriellen Chemorezeptoren haben und dass daher deren Stimulation zu einer abnorm hohen Aktivität ihres sympathischen
64
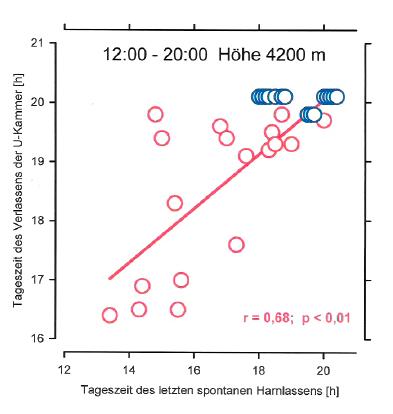
Nervensystems und damit auch in ihren efferenten Nierennerven führen kann. Eine unphysiologisch hohe Ausschüttung von Adrenalin und Noradrenalin wäre ebenfalls möglich. Sowohl die potenzierte Reaktion der efferenten Nierennerven wie auch der Ausschüttung von Adrenalin und Noradrenalin aber würden am Nierenkreislauf stark vasokonstriktorisch und an den Nierentubuli antinatriuretisch und antidiuretisch wirken. Eine erste Studie (84) zur Höhenresistenz bei primärer arterieller Hypertonie ergab, dass normotensive junge Männer eine simulierte hypobare Hypoxie (Unterdruckkammer; 4.000 m) über die volle Zeit von 8 Stunden tolerierten, aber nur 10 von18 hypertensiven aber altersgleichen Probanden beendeten die Höhenexposition nach Zeitplan (Abb. 7). Ihrem von ihnen selbst geforderten vorzeitigen Ausschleusen ging immer ein Versiegen der Urinexkretion voraus. Das Sistieren des Harnflusses wäre als Zeichen beginnender Aktivierung des sympathischen Nervensystems deutbar (66,84). Es ist vermutet worden, dass eine solche Sympathikusaktivierung wie auch die Ausschüttung antinatriuretisch wirkender Hormone in Höhenhypoxie Folge der Ausbildung eines Hirnödems bei den hypertensiven jungen Männern sein könnte (51). Eine Anurie in der Höhe ist wiederholt als Zeichen drohenden AMS und geringer Höhentoleranz gewertet worden (16,40,88,90). Wie ganz allgemein bei Atmungs- und Kreislaufproblemen so ist auch eine arterielle Hypertonie, vorsichtiges Vorgehen in der Vorbereitung und während der Exposition vorausgesetzt, offenbar keine Kontraindikation für einen Höhenaufenthalt (87,89). Ständig im arteriellen Sauerstoffmangel lebende Personen oder Tiere zeigen sogar eine Tendenz zur Abnahme ihres arteriellen Systemblutdruckes, was durch Verarmung des Körpers an Kochsalz, sowie durch Neubildung und Umbau im Bereich der Arteriolen erklärt werden könnte (86,88,90).
Beurteilung der Höhenadaptation und Salz- und Wasserhaushalt. – Offene Fragen
Frauen und Männer – Junioren und Senioren: Bei der Durchsicht der Literatur fällt auf, dass zu den im vorliegenden Artikel behandelten Problemen fast nur Studien an jüngeren Männer oder vereinzelt auch an gemischten Gruppen vorliegen. Systematische und vergleichende Untersuchungen zu den Reaktionen des Salz- und Wasserhaushaltes sowie der Nierenfunktion in akuter Höhenhypoxie bei jungen versus älteren Menschen sowie Frauen versus Männer sind bisher selten (3,4,76,91). Dieser Problematik wird man in der Zukunft mehr Aufmerksamkeit widmen müssen.
65
Beurteilung von Höhenresistenz und Anpassung in akuter arterieller Hypoxie: Seit dem Aufkommen von Höhenmedizin und Höhenphysiologie wurde und wird immer wieder die Frage gestellt, ob und wie sich, wenn möglich noch vor der Höhenexposition, erkennen lässt, welche Personen eine akute arterielle Hypoxie tolerieren werden und wann während des Höhenaufenthaltes „Acute Mountain Sickness“ droht (16,19,21,36,51,73,82–85, 93–96). Die Problematik dabei: Die dafür benötigten Tests und Prozeduren sollten bereits vorhandene Programme nicht stören sondern optimieren. Sie müssen bei großen Probandenzahlen anwendbar und bezahlbar sein und dürfen den normalen Tagesablauf der Probanden oder Patienten nicht alterieren.
Abb. 7: Die Beziehung zwischen der Zeit des letzten spontanen Harnlassens und der Zeit des von den Probanden selbst geforderten Ausschleusens aus der U- Kammer. Studie an 15 normotensiven (blau) und 18 primär hypertensiven (rot) jungen Männern. Beginn der Höhenexposition um 12:00. Nach einer Abbildung von (84); modifiziert.
66
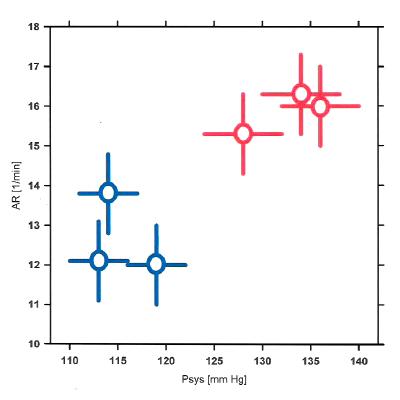
Bei der Suche nach neuen Möglichkeiten für die Beurteilung von Höhenresistenz wie auch für die Frühdiagnose der primären arteriellen Hypertonie wurden neben biochemischen auch Parameter der Atmung und des arteriellen Blutgasstatus ins Blickfeld genommen (51,93–96). Dabei hat es sich herausgestellt, dass evt. auch schon die technisch einfach bestimmbare Atemrate (Atemfrequenz) eine verwendbar Größe sein könnte, um sowohl junge Hypertoniker als auch durch akute Höhenkrankheit (AMS) gefährdete Menschen zu erkennen. Als Beispiel dazu zeigt die Abbildung 8, dass drei unabhängig voneinander tätige Teams fanden, dass gesunde aber primär hypertensive junge Männer höhere Atemraten hatten als Normotensive, wenn die Bestimmung der Atemraten wirklich stressfrei und im „steady state“ erfolgte (51). Die Ermittlung der Atemrate ist heute kein technisches sondern ein psychologisches Problem, denn sie ist extrem von externen und psychischen Einflüssen abhängig. Um die für eine gegebene Person charakteristische Atemrate zu bestimmen, würde es sich daher anbieten, diese mit tragbaren und über 24 h arbeitenden Registriersystemen im Schlaf zu ermitteln und zu speichern (51). Bei der Beurteilung solcher Registrierungen wäre aber zu beachten, dass die Atemrate alters- und geschlechtsabhängig ist und daher nur alters- und geschlechtsgleiche Gruppen verglichen werden sollten.
Einfach bestimmbare Parameter des Salz- und Wasserhaushaltes bei der Beurteilung der Höhentoleranz: Es wäre in der Praxis durchaus nicht immer nötig, aufwendig die Größe des Urinvolumens in der Minute (V), die glomeruläre Filtration und die fraktionalen Exkretionen zu bestimmen, wenn es um das Erkennen unterschiedlicher Reaktionstypen und den Ablauf ihrer Höhenanpassung geht. Dazu folgende Überlegung (95): Die fraktionale renale Exkretion des Natriums ist der Quotient aus der Clearance des Natriums und Clearance des Kreatinins, also CNa/CKr. Die CNa berechnet sich als CNa = UNa/ PNa*V und die Kreatininclearance als CKr = UKr/PKr*V. Der Quotient CNa/CKr ist dem gemäß = UNa/PNa*V geteilt durch UKr/PKr*V. Da V sich wegkürzt, bleiben UNa/PNa geteilt durch UKr/PKr übrig. PNa und PKr ändern sich in den in Frage kommenden Zeiträumen nur selten und wenig. So bleibt UNa/UKr als leicht zu bestimmender Index übrig. Dieses Vorgehen erspart es, die Größe der Urinvolumina und die Konzentrationen der Ionen bzw. des Kreatinins im Blutplasma bestimmen zu müssen. Der Quotient UNa/UKr gibt nur die Richtung der Reaktionen der renalen tubulären NaCl-Reabsorption wieder. Das genügt jedoch, um unterschiedliche Reaktionstypen in akuter arterieller Hypoxie zu erkennen. So ist z. B. zu erwarten, dass Personen, die eine akute Höhenhypoxie gut
67
vertragen, darauf in körperlicher Ruhe mit Zunahme von UNa/UKr reagieren; verglichen mit den Werten vor der Hypoxie, Dagegen wäre für Probanden, welche die Höhe schlecht tolerieren eine Abnahme von UNa/UKr zu erwarten sein (95). Ließe man also dafür vorgesehene Personen vor dem Höheneinsatz jeweils eine Nacht in einer Unterdruckkammer einmal bei Seehöhe und einmal in simulierter Höhe von >3.000 m schlafen, dann wäre zu erwarten, dass die Probanden mit guter Höhentoleranz in der ersten Nacht auf die Höhe mit einer Zunahme von UNa/UKr reagieren, während Personen mit wahrscheinlich geringer Höhenfestigkeit in der nächtlichen Hypoxie eine Abnahme von UNa/ UKr zeigen müssten.
Abb. 8: Die Mittelwerte mit ihren mittleren Fehlern der systolischen Blutdrücke (Psys) sowie der Atemraten (AR) bei normotensiven (blau) und primär hypertensiven (rot) jungen Männern. Die zwischen den beiden Gruppen festgestellten Unterschiede waren für beide Parameter mit p<0,05 signifikant. Nach einer Abbildung von (51); modifiziert
68
Da Schlafen in einer Hypoxiekammer bei verschiedenen Höhen ohnehin als Möglichkeit der Präakklimatisation für Höheneinsatz in der Diskussion ist (92), könnte man damit auch leicht die Bestimmung des UNa/UKr - Quotienten im Urin sowie des nachfolgend diskutierten Na+/K+ - Quotienten im Harn und im Speichel verbinden. Ohne große Mühe ließen sich in höhenmedizinischen Studien die Konzentrationen von Natrium (Na+) und Kalium (K+) nicht nur im Urin sondern auch im Speichel bestimmen. Das macht Sinn, denn es ist berichtet worden, dass in gut tolerierter Höhenhypoxie der Quotient „Na+/K+“ im Speichel ansteigt (97). Ein solches Reaktionsmuster deutet auf adaptive endokrinologische Umstellungen, z.B. Abnahme der Wirkungen des Aldosterons, in der Höhe hin. Wie schon bei der Bestimmung der Harnkonzentrationen sowohl an Natrium und Kreatinin wie auch Kalium und würde dann auch im Falle des Speichels die Frage nach den Flüssigkeitsvolumina belanglos werden.
LITERATUR
(1)
(2)
(3)
(4)
(5)
(6)
(7) (8)
(9) Honig A. Peripheral arterial chemoreceptors and reflex control of sodium and water homeostasis (invited review). Amer J Physiol 1989; 257: R1282–R1302. Baggish A.L., Wolfel E.E., Levine B.D. Heart and systemic circulation. In E. R. Swenson and P. Bärtsch (Editors): High Altitude Human Adaptation to Hypoxia. Springer Sci + Bus Media New York 2014; 217–236. Dill D.B., Hall F.G., Hall K.D. et al. Blood, plasma and red cells volumes: age, exercise, and environment. J Appl Physiol 1966; 21: 597–602. Dill D.B., Horvath S.M., Dahms T.E. et al. Hemoconcentration at altitude. J Appl Physiol 1969; 27: 574–578. Hoyt R.W., Honig A. Body fluid and energy metabolism at high altitude. In: Blatteis C. M. and Fregly M. F. Eds.). American Handbook of Physiology, Section 4: Environmental Physiology, New York, Oxford University Press 1996; 1277–1289. Hurtado A.C., Merino C., Delgado E. Influence of anoxemia on hemopoietic activity. Arch Intern Med 1945; 75: 284–323. Schneider E.C. Physiological effects of altitude. Physiol Rev 1921; 1: 637–659. Tribukait B. Über den initialen Anstieg der O2-Kapazität des Blutes der Ratte in Hypoxie. Acta Physiol Scand 1963; 57: 90–98. Sanchez C., Merino C., Figallo M. Simultaneous measurement of plasma volume and cell mass in polycythemia of high altitude. J Appl Physiol 1970; 28: 775–778.
69
(10)
(11)
(12)
(13)
(14)
(15)
(16)
(17)
(18)
(19)
(20)
(21)
(22)
(23)
(24) Krame K., Luft U.C. Mobilization of red cells and oxygen from the spleen in severe hypoxia. Amer J Physiol 1951; 165: 215–228. Wells R.M.G., Weber R.E. The spleen in hypoxic and exercised rainbow trout. J Exp Biol 1990; 150: 461–466.
Yamamoto K.I., Itazawa Y., Kobayashi H. Direct observations of fish spleen by an abdominal window method and its application to exercised and hypoxic yellowtail. Japan. J of Ichthyology 1985; 31: 427–433. Mertens U. Das Verhalten der Retykulocyten im peripheren Blut bei kurzfristigem O2- Mangel. Zellforschg 1957, 46: 484–488. Saathoff J. Über die Latenzzeit des Retykulocytenanstieges bei Sauerstoffmangel. Virchows Arch 1950; 319: 107–115.
Surks M.I., Chinn K.K., O’Matoush L.R. Alterations in body composition in man after acute exposure to high altitude. J Appl Physiol 1966; 21: 1741–1746. Howell A., Cove D.H. Birmingham Medical Research Expeditionary Society 1977 Expedition: The diuresis and related changes during a trek to high altitude. Postgrad J 1979; 471–474. Koob G.F., Annau Z., Rubin R.J. Effect of hypoxic hypoxia and carbon monoxide on food intake, water intake, and body weight in two strains of rats. Life Sc 1974; 14: 1511–1520. Swann H.G., Collings W.D., Cline J.K. et al. Negative water balance during exposures to low barometric pressure. Science 1942; 96: 588–589. Feddersen B., Ausserer H., Haditsch B. Brain natriuretic peptide at altitude: Relationship to diuresis, natriuresis and mountain sickness. Aviat Space Environ Med 2009; 80(2): 108–111. Fregly M.J., Nelson E.L., Tyler P.E. Water exchange in rats exposed to cold, hypoxia, and both combined. Aviat Space Environ Med 1976; 47: 600–607. Goldfarb-Rumyantzev, Alper S.I. Short-term responses of the kidney to high altitude mountain climbers. Nephrol Dial Transplant 2014; 29: 497–506. Habermann G., Huckstorf C. Cardiovascular and renal effects of systemic hypoxia in chronically instrumented conscious WKY and SHR rats. Exp Clin Endocrinol Diabetes 1997; 105/suppl. 2: 26–28. Koller E.A., Bührer A., Felder I. Altitude diuresis: endocrine and renal responses to acute hypoxia of acclimatized and non-acclimatized subjects. Europ J Appl Physiol 1991; 62: 228–234.
Stämpfli R., Eberle A. Menge, spezifisches Gewicht und Leitfähigkeit des menschlichen Harnes im Hochgebirge. Helv Physiol Acta 1944; Suppl. Iii: 221–232.
70
(25)
(26)
(27)
(28)
(29)
(30)
(31)
(32)
(33)
(34)
(35)
(36)
(37)
(38)
(39)
(40) Stickney J.C., Northup D.W., van Liere E.J. The effect of anoxic anoxia on urine secretion in anesthetized dogs. Amer J Physiol 1946; 147: 616–621 Swann H.G., Collings W.D. The extent of water loss by rats at lowered barometric pressures. J Aviat Med 1943; 14: 114–118. Swenson E.R., Duncan T.B., Goldberg S.V. et al. The diuretic effect of acute hypoxia in humans: relationship to hypoxic ventilatory responsiveness and renal hormones. J Appl Physiol 1995; 78: 377–383. Swenson E.R., OlseN.V. Renal Function and Fluid homeostasis. In E. R. Swenson and P. Bärtsch (Editors): High Altitude Human Adaptation to Hypoxia.Springer Sci. + Bus. Media New York 2014; pp 217–236. Anderson R.J., Pluss R.C., Berns A.S. et al. Mechanism of effect of hypoxia on renal water excretion. J Clin Invest 1978; 62: 769–777. Bruns F.J. Decrease in renal perfusion, glomerular filtration, and sodium excretion by hypoxia in the dog. Proc Soc Ex Boi Med 1978; 159: 468–472. Földi M., Kovach A.G.B., Takacs L. et al. Natriumausscheidung in Hypoxämie. Acta Med Hung 1955; 8: 19–36. Franklin K. ., McGee L.E., UllmannE.A. Effects of severe asphyxia on the kidney and urine flow. J Physiol (London) 1951; 112: 43–53. Gömöri P., Kovach A.G.B., Takacs L. et al. The control of renal circulation in hypoxia. Acta Med Hung 1960; 16: 43–60. Gotshall R.W., Miles D.S., Sexson W.R. The combined effects of hypoxemia and mechanical ventilation on renal function. Aviat Space Environm Med 1986; 57: 782–786. Selkurt E.E. Influence of hypoxia on renal circulation and on excretion of electrolytes and water. Amer J Physiol 1953; 172: 700–708. Singh I., Khanna P.K., Srivastava N.C. et al. Acute Mountain Sickness. New Engl J Med 1969; 280: 175–184.
Bursaux E., Poyart C., Bohn B. Renal hemodynamics and renal O2 uptake during hypoxia in the anesthetized rabbit. Pflügers Arch 1976; 365: 213–220. Behm, R., Honig A., Griethe M. et al. Sustained suppression of voluntary sodium intake of spontaneously hypertensive rats (SHR) in hypobaric hypoxia. Biomed Biochim Acta 1984; 43: 975–985. Behm R., Gerber B., Habeck J.O. et al. Effect of hypobaric hypoxia and almitrine on voluntary salt and water intake in carotid body denervated spontaneously hypertensive rats. Biomed Biochim Acta 1989; 48: 689–695. Jones R.M., Terhaard C., Zullo J. et al. Mechanism of reduced water intake in rats at high altitude. Amer J Physiol 1981; 240: R187–R191.
71
(41) Fregly M.J. Thirst immediately following removal of rats from graded levels of hypoxia. Proc. Soc. Exp Biol Med 1971; 138: 448–453. (42) Al-Obaidi M., Whitaker E.M., Karim F. The effect of discrete stimulation of the carotid body chemoreceptors on atrial natriuretic peptide in anaesthetized dogs. J Physiol 1999; 443: 519–531. (43) Bardsley P.A., Johnson B.F., Stewart A.G. et. al. Natriuresis secondary to carotid chemoreceptor stimulation with almitrine bismesylate in the rat: The effect on kidney function and the response to renal denervation and deficiency of antidiuretic hormone.
Biomed Biochim Acta 1991; 50: 175–182. (44) Behm R., Barthelt S., Gerber B. et al. Decrease of salt appetite of spontaneously hypertensive rats by chronic application of almitrine. Biomed Biochim Acta 1987; 46: 611–617. (45) Brauer H., Gens A., Ledderhos C. et al. Cardiorespiratory and renal responses to arterial chemoreceptor stimulation by hypoxia or almitrine in men. Clin Exp Pharmacol
Physiol 1996; 23: 1021–1027. (46) Flemming B., Honig A., Pötzschke B.et al. Der Einfluss langzeitiger hypoxischer Perfusion der Karotissinus narkotisierter Katzen auf die renale Natrium- und Wasserausscheidung. Acta Biol Med Germ 1971; 27: 723–728. (47) Flemming B., Honig A., Rauhut U. et al. Die Elektrolytausscheidung der Nieren während Reizung der Karotischemorezeptoren an konstant beatmeten Katzen. Ergebn Exp
Med 1976; 23: 251–256. (48) Honig A., Wedler B., Zingler C. et al. Kidney function during arterial chemoreceptor stimulation. III. Longlasting inhibition of renal tubular sodium reabsorption due to pharmacological stimulation of the peripheral arterial chemoreceptors with almitrine bismesylate. Biomed Biochim Acta 1955; 44: 1659–1672. (49) Honig A., Wedler B., Schmidt M. et al. Suppression of the plasma aldosterone to renin activity ratio in anaesthetized cats after pharmacological stimulation of the peripheral arterial chemoreceptors with almitrine bismesylate. Biomed Biochim Acta 1987; 46: 1055–1059. (50) Honig A., Wedler B., Oppermann H. et al. Effect of arterial chemoreceptor stimulation with almitrine bismesylate on plasma renin activity, aldosterone, ACTH, and cortisol in anaesthetized, artificially ventilated cats. Clin Exp harmacol Physio 1996; 23: 106–110. (51) Honig A. Drei wehrmedizinisch relevante Phänomene der primären arteriellen Hypertonie: Atemmuster, Höhentoleranz und kardiorespiratorische Reaktionen auf Blutverlust und Sauerstoffatmung. Wehrmed Monatsschrift 2014; 58: 322–327: (52) Huckstorf C., Behm R., Habeck J.O. et al Blood volume and carotid body size responses in spontaneously hypertensive rats during chronic treatment with hypobaric hypoxia or almitrine bismesylate. Biomed.Biochim Acta 1987; 46: 979–982.
72
(53) Karim F., Poucher S.M., Summerill R.A. The effects of stimulating carotid chemoreceptors on renal hemodynamics and function in dogs. J Physiol 1987; 392: 451–462. (54) Karim F., Al-Obaidi M. Effects of left atrial receptor stimulation on carotid chemoreceptor- induced renal responses in dogs. J Physiol 1992; 456: 529–539. (55) Karim F., Al-Obaidi M. Modification of carotid chemoreceptor-induced changes in renal haemodynamics and function by carotid baroreflex in dogs. J Physiol 1993; 466: 599–610. (56) Koller E.A., Schopen M., Keller M et al. Ventilatory, circulatory, endocrine, and renal effects of almitrine infusion in man: a contribution to high altitude physiology. Europ
J Appl Physiol 1989; 58: 419–425. (57) Ledderhos C., Quies W., Schuster R. et al. Renal hemodynamics and excretory function of healthy young men during stimulation of their peripheral arterial chemoreceptors by almitrine bismesylate. Biomed Biochim Acta 1987; 46: 1035–1042. (58) Ledderhos C., Sanchez R., Quies W. et al. Does the stimulation of the peripheral arterial chemoreceptors in human by almitrine bismesylate inhibit proximal tubular reabsorption? In: Acker H., Trzebski A.,O’Regan R.G. (Eds.). Chemoreceptors and chemoreceptor reflexes. Plenum Press, New York 1990; 417–423. (59) Ledderhos C., Quies W., Bub A. et al. Normotensive normoxic men undergoing water diuresis fail to respond to stimulation of their peripheral arterial chemoreceptors by almitrine with an increase in plasma concentrations of atrial natriuretic factor. Europ
J Appl Physiol 1992; 65: 104–109. (60) Ledderhos C., Brauer H., Gens A. et al. Cardiorespiratory and renal responses to arterial chemoreceptor stimulation in early hypertension. Internat J Clin Pharmacol Therap 1996; 34: 470–476. (61) Raff H. Endocrine Adaptation to Hypoxia. In: Blatteis C. M., Fregly M.F.: (Eds.). American Handbook of Physiology, Section 4: Environmental Physiology, New York, Oxford University Press 1996; 1259–1275. (62) Schmidt M., Ledderhos C., Honig A. Kidney function during arterial chemoreceptor stimulation. I. Influence of unilateral renal nerve section, bilateral cervical vagotomy, constant artificial ventilation, and carotid body chemoreceptor inactivation. Biomed
Biochim Acta 1985; 44: 695–799. (63) Schmidt M., Wedler B., Zingler C. et al. Kidney function during arterial chemoreceptor stimulation. II. Suppression of plasma aldosterone concentration due to hypoxic-hypercapnic perfusion of the carotid bodies in anaesthetized cats. Biomed Biochim Acta 1985; 44: 711–722. (64) Schmidt M., Kretschmann B., Schuster R. et al. Influence of sorbitol and mannitol on the reactions of kidney excretory function evoked by arterial chemoreceptor stimulation with almitrine in anaesthetized and artificially ventilated cats. Biomed Biochim
Acta 1990; 49: 1067–1080.
73
(65) Wiersbitzky M., Landgraf R., Gruska S. et al. Hormonal and renal responses to arterial chemoreceptor stimulation by almitrine in healthy and normotensive men. Biomed
Biochim Acta 1990; 49: 1155–1163. (66) Wiersbitzky M., Schuster R., Balke F. et. al. The reactions of renal excretory function in normotensive and essentially hypertensive men in response to oral administration of almitrine bismesylate. In: H. Acker, A. Trzebski and O’REGAN, R. G. (Eds.). Chemoreceptors and chemoreceptor reflexes. Plenum Press, New York 1990; 417–423. (67) Ledderhos C., Gross V., Cowley A.W. Pharmacological stimulation of arterial chemoreceptors in conscious rats produces differential responses in renal cortical and medullary blood flow. Clin Exp Pharmacol Physiol 1998; 25: 536–540. (68) Leonard B.L., Malpas S., Denton K.M. et al. Differential control of intrarenal blood flow during reflex increase in sympathetic nerve activity. Amer J Physiol 2001; 280:
R62–R68. (69) Hurtado A., Escudero E., Pando J. et al. Cardiovascular and renal effects of chronic exposure to high altitude. Nephrol Dial Transplant 2012; 27/suppl. 4: iv11–iv16. (70) Seldin D.W., Eknoyan G., Suki W.N. et al. Localization of diuretic action from the pattern of water and electrolyte excretion. Ann N Y Acad Sci 1966; 139: 328–343. (71) Olsen N.V., Hansen J.M., Kanstrup I.L. et al. Renal hemodynamics, tubular function and response to low-dose dopamine during acute hypoxia in humans. J Appl Physiol 1993; 74: 2166–2173. (72) Richalet J.P. Endocrine function. In E. R. Swenson and P. Bärtsch (Editors): High Altitude Human Adaptation to Hypoxia. Springer Sci + Bus Media New York 2014; pp 217–236. (73) Bärtsch P., Maggiorini M, Schobersberger W. et al. Enhanced exercise-induced rise of aldosterone and vasopressin preceding mountain sickness. J Appl Physiol 1991; 71: 136–143. (74) Bouissou P., Guezenmec C.Y., Galen F.X. et al. Dissociated response of aldosterone from plasma renin activity during prolonged exercise under hypoxia. Horm metabol
Res 1988; 20: 517–521. (75) Colice G.L., Ramirez G. Effect of hypoxemia on the renin- angiotensin- aldosterone system in humans. J Appl Physiol 1985; 58: 724–730. (76) Haditsch B., Roessler A., Frisch H. et al. Volume regulation and renal function at high altitude across gender. PloS ONE 2015; 10(3): e0118730. (77) Milledge J.S., Catley D.M., Ward M.P. et al. Renin- aldosterone and angiotensin converting enzyme during prolonged altitude exposure. J Appl Physiol 1983; 55: 699–702. (78) Bestle M.H., Olsen N.V., Poulsen T.D. et al. Prolonged hypobaric hypoxemia attenuates vasopressin secretion and renal response to osmostimulation in men. J Appl Physiol 2002; 92: 1911–1922.
74
(79) Curran-Everett J., Claybaugh R., Miki K. et al. Hormonal and electrolyte responses of conscious sheep to 96 h of hypoxia. Amer J Physiol 1988; 255: R274–R283. (80) Brooks G.A. Nutrition and metabolism. In E. R. Swenson and P. Bärtsch (Eds.): High
Altitude Human Adaptation to Hypoxia. Springer Sci + Bus Media New York 2014; 217–236. (81) Lawles N.P., Dollard T.A., Torrington K.G. et al. Improvement in hypoxemia at 4600 meters of simulated altitude with carbohydrate ingestion. Aviat Space Environm Med 1999; 70: 874–878. (82) Claybaugh J.R., Hansen J.E., Wozniak D.B. Response of antidiuretic hormone to acute exposure to mild and severe hypoxia in men. J Endocr 1978; 77: 157–160. (83) Hackett P.H., Rennie D, Grover R.E. et al. Acute mountain sickness and the edemas of high altitude: a common pathogenesis? Resp Physiol 1981; 46: 383–390. (84) Ledderhos C., Pongratz H., Exner J. et al. Reduced tolerance of simulated altitude (4200 m) in young men with borderline hypertension. Aviat Space Environm Med 2002; 73: 1063–1066. (85) Hackett P.H., Rennie D., Hofmeister S.E. et al. Fluid retention and relative hypoventilation in acute mountain sickness. Respiration 1982; 43: 321–329. (86) Behm R., Habeck J.O., Huckstorf C, et al. Blood pressure adjustment, left ventricular weight, and carotid body size in young spontaneously hypertensive rats growing up in hypoxia. Biomed Biochim Acta 1986; 45: 787–793. (87) Burtscher M. Auswirkungen akuter Höhenexposition: Welche Höhe ist gesundheitlich verträglich. Wiener Med Wschr 2010; 160: 362–371. (88) Herrmann H.J., Behm R., Huckstorf C. et al. Hypoxia- induced regression of adaptive structural microvessel reactions caused by long-term contraction influences in spontaneously hypertensive rats (SHR). Biomed Biochim Acta 1987; 46: 983–986. (89) Domej W., Trapp M., Miggitsch E.M. et al. Arterielle Hypertonie unter Höheneinfluss.
Wiener Med Wschr 2008; 158/17–18: 503–508. (90) Meerson F.Z., Barbarash N.A. Natriuretic and antihypertensive effects of acute hypoxia in spontaneously hypertensive animals. (Russisch). Bull Exp Biol Med UdSSR 1980; 90/8: 142–144. (91) Hannon J.P., Shields J.L., Harris C.W. Effects of altitude acclimatization on blood composition of women. J Appl Physiol 1969; 26: 540–547. (92) Küpper T.E.A.H., Schöffl V. Preacclimatization in hypoxic chambers for altitude sojourns. Sleep Breath 2010; 14: 187–191. (93) Burtscher M., Platz M., Faulhaber M. Prediction of susceptibility to acute mountain sickness by SaO2 values during short-term exposure to hypoxia. High Altitude Med &
Biol 2004; 5: 335–340.
75
(94) Faulhaber M., Wille M., Gatterer H. et al. Resting arterial oxygen saturation and breathing frequency as predictors for acute mountain sickness development: A prospective cohort study. Sleep and Breathing 2014; 18: 669–674. (95) Honig A., Pongratz H., Gens A. et al. Neue und technisch einfache Möglichkeiten zur
Identifikation unterschiedlicher Reaktionstypen in arterieller Hypoxie und Hyperkapnie. Wehrmed. Monatsschrift 1997; 41: 210–216. (96) Tannheimer M. Früherkennung der Höhenkrankheit und Beurteilung des Akklimatisationsgrades. Alpenmed Rundbrief 2015; 52: 5–14. (97) Williams E.S. Salivary electrolyte composition at high altitude. Clin Sci 1961; 21: 37–42. (98) Honig A., Schmidt M., Arndt H. et al. Über die Regulation des Blutvolumens und der
Nierenfunktion im akuten arteriellen Sauerstoffmangel. Das Deutsche Gesundheitswesen 1975; 30: I. Teil 2257–2262; II. Teil 2353–2358.







