





































Behandling av kvinner med HR+/HER2- mBC:







































Behandling av kvinner med HR+/HER2- mBC:
Klinisk effekt PALOMA-studiene 1-2
Real-world data > 600 000 pasienter er behandlet med Ibrance3
Langtidssikkerhetsdata >5 års oppfølging i PALOMA-studiene 4
En gang daglig

INDIKASJONER:
En tablett daglig for alle styrker5 Doseres én gang daglig i 21 påfølgende dager etterfulgt av 7 dager uten behandling (doseringsskjema 3/1)
Behandling av hormonreseptor (HR) positiv, human epidermal vekstfaktorreseptor 2 (HER2) negativ lokalavansert eller metastatisk brystkreft: - i kombinasjon med en aromatasehemmer - i kombinasjon med fulvestrant hos kvinner som tidligere har fått endokrinbehandling Hos pre- eller perimenopausale kvinner skal endokrin behandling kombineres med en LHRH -agonist (luteiniserende hormonfrigivende hormon)
IBRANCE «Pfizer»
Antineoplastisk middel, proteinkinasehemmer. ATC-nr.: L01E F01
TABLETTER, filmdrasjerte 75 mg, 100 mg og 125 mg: Hver tablett inneh.: Palbociklib 75 mg, resp. 100 mg og 125 mg, hjelpestoffer. Fargestoff: 75 mg og 125 mg: Indigokarminaluminiumslakk (E 132), rødt jernoksid (E 172), titandioksid (E 171). 100 mg: Indigokarminaluminiumslakk (E 132), gult jernoksid (E 172), titandioksid (E171). Indikasjoner: Behandling av hormonreseptorpositiv, HER2-negativ lokalavansert eller metastatisk brystkreft i kombinasjon med en aromatasehemmer, eller i kombinasjon med fulvestrant hos kvinner som tidligere har fått endokrinbehandling. Hos pre- eller perimenopausale kvinner skal endokrin behandling kombineres med en LHRH-agonist. Dosering: Behandling bør startes og overvåkes av lege med erfaring i bruk av kreftlegemidler. Voksne inkl. eldre: Anbefalt dose: 125 mg 1 gang daglig i 21 påfølgende dager etterfulgt av 7 dager uten behandling, som gir en komplett syklus på 28 dager (doseringsskjema 3/1). Behandlingen bør fortsette så lenge pasienten har klinisk nytte eller til uakseptabel toksisitet oppstår. Dosejusteringer: Ved bivirkninger kan dosen reduseres til 100 mg og deretter ev. til 75 mg. Ved behov for ytterligere dosereduksjon skal behandlingen seponeres. Dersom samtidig bruk av sterk CYP3A-hemmer er nødvendig, skal palbociklibdosen reduseres til 75 mg. Ved seponering av sterk CYP3A-hemmer skal palbociklibdosen økes til dosen før oppstart av hemmeren. Se SPC. Ved hematologisk toksisitet: Fullstendig hematologisk status bør kontrolleres før behandlingsstart og ved starten av hver syklus, samt ved dag 15 i de første 2 syklusene, og ellers ved klinisk indikasjon. For pasienter som ikke får grad >1 eller 2 nøytropeni i de første 6 syklusene skal det tas fullstendig hematologisk status hver 3. måned før oppstart av etterfølgende sykluser, og ellers ved klinisk indikasjon. Før behandling anbefales absolutt nøytrofiltall (ANC) ≥1000/mm3 og trombocyttall ≥50 000/mm3
Grad (CTCAE)1
Grad 1 eller 2
Grad 3
Dosejustering
Ingen dosejustering.
Dag 1 av syklusen: Behandling avventes inntil bedring til grad ≤2, og gjenta kontroll av fullstendig hematologisk status innen 1 uke. Når grad ≤2 er nådd, kan neste syklus påbegynnes med samme dose.
Dag 15 av første 2 sykluser: Hvis grad 3 på dag 15, fortsett med gjeldende dose for å fullføre syklusen. Gjenta fullstendig hematologisk status på dag 22. Hvis grad 4 på dag 22, se retningslinjer for dosejustering. Vurder dosereduksjon i tilfeller med langvarig (>1 uke) bedring fra nøytropeni grad 3, eller tilbakevendende nøytropeni grad 3 på dag 1 av påfølgende sykluser.
Grad 3 ANC + feber ≥38,5°C og/eller infeksjon Når som helst: Avbryt behandlingen inntil bedring til grad ≤2. Fortsett deretter med den neste lavere dosen.
Grad 4 Når som helst: Avbryt behandlingen inntil bedring til grad ≤2. Fortsett deretter med den neste lavere dosen.
Gradering i samsvar med Common Terminology Criteria for Adverse Events (CTCAE) 4.0.
Ved ikke-hematologisk toksisitet: Grad 1-2: Ingen dosejustering. Grad ≥3 som vedvarer til tross for medisinsk behandling: Avbryt behandlingen inntil bedring til grad ≤1 eller ≤2 (hvis det ikke vurderes som en sikkerhetsrisiko for pasienten). Fortsett deretter med den neste lavere dosen. Glemt dose/Oppkast: Ved glemt dose eller oppkast skal ikke ekstra dose tas. Neste dose tas til vanlig tid. Spesielle pasientgrupper: Nedsatt leverfunksjon: Ingen dosejustering ved lett/moderat nedsatt leverfunksjon. Ved alvorlig nedsatt leverfunksjon (Child-Pugh C) er anbefalt dose 75 mg 1 gang daglig med doseringsskjema 3/1. Se også Forsiktighetsregler. Nedsatt nyrefunksjon: Ingen dosejustering nødvendig ved ClCR ≥15 ml/minutt. Utilstrekkelige data for å gi anbefaling om dosejustering ved hemodialyse. Se også Forsiktighetsregler. Barn og ungdom <18 år: Ingen data. Administrering: Tas til omtrent samme tid hver dag. Samtidig inntak av grapefrukt/-juice skal unngås. Kan tas med eller uten mat. Skal svelges hele. Ødelagt, sprukket eller ikke intakt tablett skal ikke inntas. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Bruk av plantebaserte legemidler som inneholder johannesurt. Forsiktighetsregler: Moderat eller alvorlig nedsatt lever-/nyrefunksjon: Bør gis med forsiktighet. Følg nøye med på toksisitetstegn. Kritisk visceral sykdom: Sikkerhet og effekt er ukjent. Interstitiell lungesykdom (ILD)/pneumonitt: Alvorlig ILD og/eller pneumonitt, inkl. livstruende/fatal, er sett i kombinasjon med endokrinbehandling. Pasienten bør overvåkes for lungesymptomer som indikerer ILD/pneumonitt. Ved nye/ forverrede luftveissymptomer og mistanke om ILD/pneumonitt skal behandling avbrytes umiddelbart og pasienten evalueres. Ved alvorlig ILD/pneumonitt skal behandling seponeres permanent. Infeksjoner: Kan predisponere for infeksjoner pga. myelosuppresive egenskaper. Lege bør kontaktes umiddelbart ved feber. Venøs tromboembolisme: Er sett. Pasienten bør overvåkes for tegn/symptomer på dyp venetrombose og lungeembolisme, og egnet medisinsk behandling bør igangsettes om dette oppstår. Bilkjøring og bruk av maskiner: Liten påvirkning på evnen til å kjøre bil og bruke maskiner, men kan gi fatigue. Pasienten bør være forsiktig ved bilkjøring/bruk av maskiner. Interaksjoner: For utfyllende informasjon om relevante interaksjoner, bruk interaksjonsanalyse. Sterke CYP3A4-hemmere kan gi økt toksisitet. Samtidig bruk av sterke
Referanser:
CYP3A-hemmere bør unngås, og samtidig bruk bør kun vurderes etter nøye nytte-/risikovurdering. Samtidig bruk av CYP3A-induktorer kan gi redusert eksponering for palbociklib og risiko for manglende effekt. Samtidig bruk av sterke CYP3A4-induktorer bør unngås. Palbociklib er en svak CYP3A-hemmer, og dosereduksjon av sensitive CYP3A-substrater med smalt terapeutisk vindu kan være nødvendig. Palbociklib kan hemme P-gp og BCRP, og P-gp- og BCRP-substrater kan få økt effekt og økt risiko for bivirkninger. Palbociklib kan hemme OCT1 og øke eksponeringen for OCT1-substrater. Graviditet, amming og fertilitet: Graviditet: Ingen humane data. Anbefales ikke under graviditet eller hos fertile kvinner som ikke bruker prevensjon. Fertile kvinner eller deres mannlige partnere må bruke sikker prevensjon (f.eks. dobbel-barriereprevensjon) under og i minst 3 uker (kvinner) eller 14 uker (menn) etter avsluttet behandling. Amming: Overgang i morsmelk er ukjent. Skal ikke brukes under amming. Fertilitet: Mannlig fertilitet kan reduseres. Sædkonservering før behandingsstart bør vurderes.
Bivirkninger:
Frekvens Bivirkning
Svært vanlige
Blod/lymfe Anemi (inkl. redusert Hb, redusert hematokrit), leukopeni (inkl. redusert leukocyttall), nøytropeni (inkl. redusert nøytrofiltall), trombocytopeni (inkl. redusert trombocyttall)
Gastrointestinale Diaré, kvalme, oppkast, stomatitt1
Generelle Asteni, fatigue, feber
Hud Alopesi, tørr hud, utslett2
Infeksiøse Infeksjon
Stoffskifte/ernæring Redusert appetitt
Undersøkelser Økt ALAT, økt ASAT
Vanlige
Blod/lymfe Febril nøytropeni
Hud Palmar-plantar erytrodysestesisyndrom
Kar Venøs tromboembolisme
Luftveier Epistakse, interstitiell lungesykdom/pneumonitt
Nevrologiske Dysgeusi
Øye Tåkesyn, tørre øyne, økt lakrimasjon
Mindre vanlige
Hud Kutan lupus erythematosus
Inkl. aftøs stomatitt, keilitt, glossitt, glossodyni, sår i munnen, mukositt, orale smerter, orofaryngealt ubehag, orofarynkssmerter.
2Inkl. makulopapuløst utslett, kløende utslett, erytematøst utslett, papuløst utslett, dermatitt, akneiform dermatitt, toksisk huderupsjon. Overdosering/Forgiftning: Symptomer: Både gastrointestinal og hematologisk toksisitet kan oppstå.
Behandling: Støttende. Se Giftinformasjonens anbefalinger L01E F01 på www.felleskatalogen.no.
Egenskaper: Virkningsmekanisme: Sterkt selektiv, reversibel hemmer av de syklinavhengige kinasene (CDK) 4 og 6. Syklin D1 og CDK4/6 er nedstrøms for flere signalveier som fører til celleproliferasjon. Blokkerer progresjonen av cellen fra G1 inn i S-fase av cellesyklusen. Absorpsjon: Biotilgjengelighet 46% ved dose 125 mg. Tmax 4-12 timer. Proteinbinding: Ca. 85%. Gjennomsnittlig ubundet fraksjon øker gradvis med forverring av leverfunksjonen. Halveringstid: Gjennomsnittlig t1/2 28,8 timer. Steady state innen 8 dager ved dosering 1 gang daglig. Akkumuleres ved gjentatt dosering 1 gang daglig. Metabolisme: Omfattende hepatisk metabolisme, primært via CYP3A og SULT2A1. Utskillelse: Primært som metabolitter i feces (74%), i mindre grad i urin (17%). En liten del av dosen gjenfinnes uendret i feces (2%) og urin (7%).
Oppbevaring og holdbarhet:Skal oppbevares i originalemballasjen for å beskytte mot fuktighet.
IBRANCE, TABLETTER filmdrasjerte:
Sist endret: 01.06.2023
Basert på SPC godkjent av SLV/EMA: 26.05.2023
Styrke Pakning / Varenr. Refusjon1 Pris (kr)2 R.gr.3
mg 21 stk. (blister) / 523284
mg 21 stk (blister) / 477864
mg 21 stk. (blister) / 566929
474,70
474,70
474,70
1. Blåresept (T) gjelder forhåndsgodkjent refusjon. For informasjon om individuell stønad, se HELFO For H-resept, se Helsedirektoratet
2. Angitt pris er maksimal utsalgspris fra apotek.
3. Reseptgruppe. Utleveringsgruppe.

HOVEDREDAKSJONEN
René van Helvoirt
Spesialist i onkologi, Senter for kreftbehandling Sørlandet sykehus, Kristiansand rene.helvoirt@sshf.no
Eva Hofsli
Spesialist i onkologi, St. Olavs hospital, førsteamanuensis NTNU eva.hofsli@ntnu.no
Kathrine F. Vandraas
Spesialist i onkologi, avd. for kreftbehandling, Oslo universitetssykehus, Radiumhospitalet katvan@ous-hf.no
MEDVIRKENDE REDAKTØRER
Anniken Jørlo Fuglestad Stipendiat, phd kandidat Akershus universitetssykehus a.j.fuglestad@studmed.uio.no
Henrik Horndalsveen
Spesialist i onkologi, avd for kreftbehandling Kreftsenteret, Ullevål, Oslo universitetssykehus henrik.horndalsveen@ous-hf.no
Mohsan Ali Syed
Spesialist i onkologi, kreftavdelingen, Akershus universitetssykehus mohsan.ali.syed@ahus.no
STYRET I NORSK ONKOLOGISK FORENING
Daniel Heinrich, leder
Hanne Astrid Eide, nestleder
Kristin Loge Aanestad, sekretær
Dalia Dietzel, økonomiansvarlig/kasserer
Marie Søfteland Sandvei, nettredaktør
Andreas Ullern, nettredaktør
SPESIALITETSKOMITÉEN I ONKOLOGI
Olav Engebråten, OUS
Mirjam Alsaker, St Olavs hospital
Silje Songe-Møller, Sykehuset i Østfold - Kalnes
Cecilie Nordstrand, Ålesund sykehus
Hanna Josefine Abrahamsson, AHUS (LiS)
Olav Toai Duc Nguyen, Levanger sykehus (varamedlem)
Alina Carmen Porojnicu, Drammen sykehus (varamedlem)
Christina Power Sjo, Stavanger Universitetssykehus (LIS-varamedlem)
ÆRESMEDLEMMER
Prof. Herman Høst
Prof. Sophie Dorothea Fosså
Prof. Olav Dahl
Prof. Olbjørn Klepp
Prof. Stein Olav Kvaløy
Prof. Erik Wist
Prof. Øyvind Bruland
Prof. Steinar Aamdal
Prof. Terje Risberg
Prof. Stein Sundstrøm
Dr. Kirsten Sundby Hall
Dr. Harald Holte
Prof. Marit Slaaen
Prof. Olav Mella
Prof. Hans Petter Eikesdal (†2023)
Norsk onkologisk forening ble stiftet i 1986
Antall medlemmer: 706 ordinære

VIKTIG SIKKERHETS- OG FORSKRIVNINGSINFORMASJON
OPDIVO® (nivolumab)
Reseptbelagt legemiddel.Reseptgruppe C. Indikasjoner
Melanom: Monoterapi eller i kombinasjon med ipilimumab til behandling av avansert (inoperabel eller metastatisk) melanom hos voksne og ungdom som er 12 år og eldre. Sammenlignet med nivolumab som monoterapi gir kombinasjonen av nivolumab med ipilimumab en økning i progresjonsfri overlevelse (PFS) og total overlevelse (OS) kun hos pasienter med lav PD-L1ekspresjon i tumor. Adjuvant behandling av melanom: Som monoterapi til adjuvant behandling av voksne og ungdom som er 12 år og eldre med melanom stadium IIB eller IIC eller melanom med lymfeknuteinvolvering eller metastatisk sykdom som har gjennomgått fullstendig reseksjon. Ikke-småcellet lungekreft (NSCLC): I kombinasjon med ipilimumab og 2 sykluser med platinabasert kjemoterapi til førstelinjebehandling av metastatisk ikke-småcellet lungekreft hos voksne som har tumorer uten sensitiviserende EGFR-mutasjoner eller ALK-translokasjoner. Som monoterapi til behandling av lokalavansert eller metastatisk ikke-småcellet lungekreft etter tidligere kjemoterapi hos voksne. I kombinasjon med platinabasert kjemoterapi til neoadjuvant behandling av operabel ikke-småcellet lungekreft med høy risiko for tilbakefall hos voksne hvor tumorer har PD-L1-ekspresjon ≥ 1 %. Malignt pleuralt mesoteliom (MPM): I kombinasjon med ipilimumab til førstelinjebehandling av ikke-resekterbar malignt pleuralt mesoteliom hos voksne. Nyrecellekarsinom (RCC): Monoterapi til behandling av avansert nyrecellekarsinom etter tidligere behandling hos voksne. Kombinasjonsterapi med ipilimumab til førstelinjebehandling av voksne med avansert nyrecellekarsinom med intermediær/høy risiko. Kombinasjonsterapi med kabozantinib til førstelinjebehandling av voksne pasienter med avansert nyrecellekarsinom. Klassisk Hodgkins lymfom (klassisk HL): Som monoterapi til behandling av voksne med residiverende eller refraktær klassisk Hodgkins lymfom etter autolog stamcelletransplantasjon (ASCT) og behandling med brentuksimabvedotin. Plateepitelkreft i hode og hals (SCCHN): Som monoterapi til behandling av tilbakevendende eller metastatisk plateepitelkreft i hode og hals hos voksne med progresjon under eller etter platinabasert behandling. Urotelialt karsinom: Som monoterapi til behandling av lokalavansert inoperabelt eller metastatisk urotelialt karsinom hos voksne der tidligere platinabasert behandling har mislyktes. Adjuvant behandling av urotelialt karsinom: Som monoterapi til adjuvant behandling av voksne med muskelinvasivt urotelialt karsinom (MIUC) med PD-L1-ekspresjon i tumorceller ≥ 1 %, som har høy risiko for tilbakefall etter å ha gjennomgått radikal reseksjon av MIUC. «Mismatch repair deficient» (dMMR) eller «microsatellite instabilityhigh» (MSIH) kolorektal kreft (CRC): I kombinasjon med ipilimumab til behandling av voksne pasienter med dMMR eller MSIH metastatisk kolorektal kreft etter tidligere fluoropyrimidinbasert kombinasjonskjemoterapi. Plateepitelkarsinom i øsofagus (ESCC): I kombinasjon med ipilimumab eller fluoropyrimidin- og platinabasert kombinasjonskjemoterapi til førstelinjebehandling av voksne pasienter med inoperabel, avansert, tilbakevendende eller metastatisk plateepitelkarsinom i øsofagus med PD-L1-ekspresjon i tumorceller ≥ 1 %. Som monoterapi til behandling av voksne med inoperabel, avansert, tilbakevendende eller metastatisk plateepitelkarsinom i øsofagus, etter tidligere fluoropyrimidin- og platinabasert kombinasjonskjemoterapi. Adjuvant behandling av kreft i øsofagus eller den gastroøsofageale overgangen (OC eller GEJC): som monoterapi til adjuvant behandling av voksne pasienter med kreft i øsofagus eller den gastroøsofageale overgangen, og som har residual patologisk sykdom etter tidligere neoadjuvant kjemoradioterapi. Adenokarsinom i ventrikkel, gastroøsofageal overgang (GEJ) eller øsofagus: i kombinasjon med fluoropyrimidin og platinabasert kombinasjonskjemoterapi til førstelinjebehandling av voksne med HER2-negativ avansert eller metastatisk adenokarsinom i ventrikkel, gastroøsofageal overgang (GEJ) eller øsofagus, hvor tumorene har PD-L1-ekspresjon med en kombinert positiv score (CPS) ≥ 5. For fullstendig oversikt over godkjente indikasjoner, fullstendig forskrivningsinformasjon se preparatomtale for Opdivo (nivolumab) og Yervoy (ipilimumab) på www. felleskatalogen.no. Bivirkninger og frekvensen av disse er avhengig av krefttype, dosering og eventuell kombinasjon med andre legemidler mot kreft, se preparatomtale. Advarsler og forsiktighetsregler: Immunrelaterte bivirkninger: Som for all immunterapi kan immunrelaterte bivirkninger oppstå i alle kroppens organer både under og etter avsluttet behandling. Immunrelaterte bivirkninger som påvirker mer enn ett system i kroppen, kan oppstå samtidig. Ved kombinasjonsbehandling med Opdivo og Yervoy (ipilimumab) kan immunrelaterte bivirkninger oppstå tidligere og i flere organsystemer samtidig sammenliknet med Opdivo monoterapi. Les mer om bivirkninger i preparatomtalene for Opdivo og Yervoy. Alt helsepersonell som forskriver immunterapi må ha kunnskap om behandlingsalgorimer for immunrelaterte bivirkninger og hvordan disse klassifiseres. Tidlig identifisering og håndtering av immunrelaterte bivirkninger er viktig, og pasienter som behandles med immunterapi skal ha tett oppfølging både under og i etterkant av behandling. Andre viktige advarsler: Kan øke risikoen for transplantatavstøtning hos mottakere av solide organer. Alvorlige infusjonsreaksjoner er rapportert. Interaksjoner: Bruk av systemiske kortikosteroider og andre immunsuppressiva ved baseline skal unngås. Pasientkort finnes tilgjengelig på www.felleskatalogen.no eller ved å kontakte BMS. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning til Statens Legemiddelverk på www.legemiddelverket.no/meldeskjema. Bivirkninger bør også meldes til BMS på telefon 23 12 06 37. Opdivo gis som intravenøs infusjon og doseres ulikt avhengig av tumortype og hvorvidt behandlingen gis i monoterapi eller i kombinasjon med andre legemidler mot kreft, se preparatomtalen. Pakninger, priser, refusjon: Opdivo: 10 mg/ml 4 ml (hettegl) 5 607,50 kr, 10 ml (hettegl) 13 957,40 kr, 12 ml (hettegl) 16 741,70 kr, 24 ml (hettegl) 33 447,10 kr. Yervoy: 5 mg/ml 10 ml (hettegl), 44 626,20 kr, 40 ml (hettegl) 178 397,80 kr. LIS anbud 2022/2023 PD-1/PD-L1-hemmer og legemidler i kombinasjon med disse. For fullstendig oversikt over godkjente indikasjoner inkludert restriksjoner innført av Beslutningsforum for nye metoder se link www.nyemetoder.no. Bristol Myers Squibb Norge, Lysaker Torg 35 1366 Lysaker, telefon: 23 12 06 37, www.bms.com/no
Versjon 11
 René van Helvoirt
René van Helvoirt
 Eva Hofsli
Eva Hofsli




Når denne utgaven av Onkonytt kommer ut, befinner vi oss allerede godt på vei inn i 2024. Det ble en særdeles kald start på året for mange av oss. Og når man reflekterer over året som har gått, og verden slik den er i dag, føles det enda litt kaldere. Krig og konflikter, helsepersonell i skuddlinjen, meningsløse tap av menneskeliv, både fjernt og veldig nært. Hvis det noe vi skal lære av fjoråret, så er det viktigheten av å ta vare på hverandre.
Innholdet i denne utgaven er, som alltid, preget av et ønske om og en velvilje til å dele kunnskap. Vi gleder oss over rapporter fra ESMO og ESTRO. Man kan lese om behandling av pancreascancer, et område mange kanskje føler har stått nokså stille. Eller CAR-T-behandling av lymfom, en behandling som uten tvil kan kalles for banebrytende. Et område som heller ikke har stått stille er den stadig mer allmennkjente presisjonsmedisinen. Det er ikke lenger et begrep som kun benyttes av leger og onkologer, men et begrep som i økende grad brukes av media, pasientgrupper, pasienter og deres pårørende. Spennende er derfor presenteringen av den nylig etablerte Norsk Presisjonsmedisinsk Cancer Gruppe.
Odd Monge har igjen bidratt med et fint stykke onkohistorie. Han leter nesten som en privatdetektiv etter fakta fra pionertiden i stråleonkologi.
I 2023 feiret Onkonytt faktisk 20-års jubileum! Det er vi særdeles stolte over. De siste årene har bydd på en ansiktsløftning både visuelt og innholdsmessig, og vi ser at bladet blir lest, både på nett og den fysiske utgaven. Det er kjempegøy og vi står på videre med stor motivasjon. Vi i redaksjonen takker alle som har bidratt med innlegg både nå og til tidligere utgivelser, og finner spennende lesestoff i årets første utgave av Onkonytt.
På vegne av redaksjonen ønsker jeg alle et riktig godt og fredelig 2024.
Anniken Jørlo Fuglestad medvirkende redaktør
Vi har lagt bak oss 2023, et år som har vært fullt av utfordringer, både globalt med fortsatt krig i Ukraina og nå også i den nære Østen, men også triste hendelser her hjemme. La oss håpe at vi har et bedre år i vente!
Året 2024 er i gang, og det er mye å se frem til i år. Til sommeren blir for eksempel EM i fotball i Tyskland (... nå glemte jeg et øyeblikk at mesterskapet går uten Norge ��) og når vi kommer til desember skal de første pasientene få proton-strålebehandling i Norge. Dette blir en spennende prosess å følge. Ikke minst blir det spennende å følge med på hvordan lik tilgang til behandlingen sikres for pasienter fra hele landet og hvordan man skal få gitt en stor del av behandlingene som ledd i kliniske studier.
Noe annet å se frem til i år, i hvert fall for en gruppe heldige LiS, er reise til ESMO-kongressen i Barcelona. Fjorårets premiere ble (ryktes det) en stor suksess, og med støtte fra årsmøtet inviterer NOF også i år en LiS fra hver onkologisk avdeling til en felles reise. Dette er et av flere tiltak som
vi håper vil skape positiv stemning rundt onkologi-faget og -utdanningen. Se annonsen i denne utgaven av OnkoNytt for mer informasjon (det vil også bli sendt ut informasjon til alle avdelingen i løpet av februar).
NOF sender ikke bare LiS på tur, men lyser også i år ut reisestipend som alle medlemmer kan søke på. Vi har de senere årene hatt flere stipend å dele ut enn søkere så her er sjansene gode! Også annonsen om fagstipend finner dere i denne utgaven av OnkoNytt.
Som dere er klar over, har onkologifaget slitt med rekruttering de siste årene. NOF ønsker å bidra til flere søkere med tiltak som kan øke interessen for vårt fagfelt. Har du konkrete forslag til slike tiltak er det kjærkomment – ta i så fall kontakt med en av oss i styret.
Å sitte i NOF styret er meget givende. Man blir konfrontert med mange ulike spørsmål og problemstillinger, fra medlemmer (dere), media, myndigheter og andre interessegrupper. Ofte krever slike henvendelser rask respons. Vi håper at vi som regel treffer deres

felles oppfatning med våre uttalelser –men vi tar gjerne imot tilbakemelding der dette ikke er tilfelle ... Selvsagt er vi også takknemlig for tilbakemeldinger når vi treffer bra.
Som alltid leverer OnkoNytt en utgave med interessant lesestoff for alle og enhver!
Derfor ønsker jeg på vegne av hele styret i NOF at alle medlemmer tar en pust i bakken og koser seg med spennende og opplysende lektyre. Nyt vinteren og våren!
Vi ses forhåpentligvis ved den ene eller andre anledningen, og ikke nøl med å ta kontakt dersom dere har forslag eller innspill til vårt arbeid!
Daniel Heinrich
Jeg er oppvokst i Sarpsborg og studerte medisin og tok forskerlinja i Trondheim. Jeg var stipendiat før jeg dro til Bodø i turnus, og disputerte i løpet av turnusperioden med en avhandling om risikofaktorer for subaraknoidalblødning. Mannen min og jeg trivdes så godt i Bodø at vi ble der i 7,5 år og fikk to barn før vi flyttet tilbake til Trondheim. I Bodø jobbet jeg på medisinsk avdeling før jeg byttet til onkologi, og det har jeg ikke angret på! Siden 2019 har jeg jobbet
på Kreftklinikken på St Olavs hospital, og jeg ble ferdig spesialist i overgangen 2022-23. Jeg jobber for tiden med kombinert klinikk og forskning (nå innen kreft) og trives godt med det. På fritida er jeg mye med familien, hjemme og på hytta på Oppdal, samt strikker og trener så mye jeg får til, blant annet med «Mandagstrimmen». Jeg ble med som observatør i NOFstyret før sommeren i fjor og ble valgt inn i høst.

KRISTIN LØGE AANESTAD, 39 ÅR.
Jeg er oppvokst på Bryne, studerte medisin i Oslo 2006-2013 og vendte hjem til Stavanger etter studiene. Her bor jeg sammen med mann og fire barn. Jeg har vært ansatt ved kreftavdelingen i Stavanger siden 2016 og ble ferdig spesialist i onkologi i 2023. Nå arbeider jeg 50% klinisk og 50% med brystkreftforskning. På fritiden
er jeg opptatt med å følge opp ungene på litt for mange fritidsaktiviteter, ellers så liker jeg å være sammen med familie og venner, trene og lese litt. Akkurat nå gleder jeg meg til våren. Jeg ser frem til å være en del av styret i NOF, og ønsker å bidra til godt samarbeid mellom de ulike sykehusene.
90%
AV PASIENTENE OPPRETTHOLDER LAVE TESTOSTERONNIVÅER UNDER 0,7 NMOL/L. UANSETT FORMULERING. 1

37 6
ÅRS ERFARING. 3
MÅNEDERS FORMULERING. LIKE GOD EFFEKT. 2
Til behandling av lokalavansert eller metastaserende, hormonavhengig prostatacancer
Referanser:
1. Breul J, et al. Adv therapy 2017;34:513-523. 2. Ploussard G, Monglat-Artus P. Future Oncol. 2013;9(1):93-102. 3. Fischer, Jnos; Ganellin, C. Robin (2006). Analoguebased Drug Discovery. John Wiley & Sons. p. 514. ISBN 9783527607495
For fullstendig informasjon se preparatomtale (SPC) på felleskatalogen.no FK-tekst kommer på neste side.
Pamorelin «triptorelin» pulver og væske til depotinjeksjonsvæske, suspensjon
Reseptgruppe C
Indikasjoner: Alle styrker: Behandling av lokalavansert eller metastaserende, hormonavhengig prostatacancer. Behandling av høyrisiko lokalisert eller lokalavansert, hormonavhengig prostatacancer, i kombinasjon med strålebehandling. 3,75 mg: Adjuvant behandling i kombinasjon med tamoksifen eller en aromatasehemmer ved hormonreseptorpositiv brystkreft i tidlig stadium hos kvinner med høy risiko for tilbakefall, som er bekreftet premenopausale etter fullført kjemoterapi. 22,5 mg: Behandling av sentral pubertas precox (SPP) hos barn ≥2 år med inntreff av SPP før 8 år hos jenter og før 10 år hos gutter.
Anbefalt dosering: Prostatacancer: 1 hetteglass à 3,75 mg 1 gang hver 4. uke, 1 hetteglass à 11,25 mg hver 3. mnd. eller 1 hetteglass à 22,5 mg hver 6. mnd. Anbefalt varighet er 2-3 år. Brystkreft: 1 hetteglass à 3,75 mg 1 gang hver 4. uke som i.m. injeksjon i kombinasjon med tamoksifen eller en aromatasehemmer etter fullført kjemoterapi og bekreftet premenopausalstatus og minst 6-8 uker før start med aromatasehemmer. Anbefalt behandlingsvarighet er opptil 5 år. Pubertas precox (<8 år hos jenter og <10 år hos gutter): 1 hetteglass à 22,5 mg hver 6. mnd. som én i.m. injeksjon. Behandling avbrytes ved pubertetsalder hos gutter og jenter, og ved benmodning (jenter: >12-13 år, gutter: >13-14 år). Kontraindikasjoner: Alle styrker: Overfølsomhet for GnRH, dets analoger eller for innholdsstoffene. Graviditet og amming. 3,75 mg: Premenopausal brystkreft: Oppstart av aromatasehemmer før adekvat ovariesuppresjon med triptorelin er oppnådd. Forsiktighetsregler: Kan gi nedsatt benmineraltetthet. Samtidig bruk av bisfosfonat kan redusere benmineraltap. Utvis ekstra forsiktighet ved tilleggsrisiko for osteoporose. Behandling kan avdekke ukjente gonadotrope hypofyseadenomer. Økt risiko for depressive episoder (inkl. alvorlige). Prostatacancer: Gir forbigående økt serumtestosteron, og kan gi forbigående symptomforverring med økte urineringssymptomer og forbigående økt metastatisk smerte. Forverring av ryggmargskompresjon og urinveisobstruksjon kan oppstå. Langtidsbruk kan føre til osteoporose og økt risiko for benbrudd, som kan gi ukorrekt diagnose av benmetastaser. Kan forlenge QT-intervallet. Nytte-/risiko, inkl. risiko for torsades de pointes, bør vurderes. Metabolske endringer eller økt kardiovaskulær sykdomsrisiko kan oppstå. Gir suppresjon av hypofyse-gonadesystemet som ofte normaliseres etter behandlingsstopp. Økt lymfocyttall er sett. Brystkreft hos kvinner: Kan gi en reduksjon i benmineraltetthet. Nytte må oppveie risiko. Ovariesuppresjon må oppnås før start med aromatasehemmer. Høy osteoporoserisiko ved Triptorelin med tamoksifen eller aromatasehemmer. Benmineraltetthet evalueres før oppstart. Nytte-/risikovurdering ved HR+ brystkreft i tidlig stadium ved triptorelin med tamoksifen eller aromatasehemmer. Risiko for muskelskjelettlidelser ved triptorelin med aromatasehemmer eller tamoksifen. Risiko for diabetes ved triptorelin med eksemestan eller tamoksifen. Depresjon er sett ved triptorelin med tamoksifen eller eksemestan. Sentral pubertas precox: Nytte/risiko-vurdering ved progressive hjernetumorer. Perifer pubertas precox og gonadotropinuavhengig pubertas precox bør utelukkes. 1. måneds vaginalblødning er sett. Behandlingen
er langvarig og justeres individuelt. Epiphysiolysis capitis femoris kan sees etter avsluttet behandling. Idiopatisk intrakraniell hypertensjon (pseudotumor cerebri/IIH): Er sett hos barn. Pasienter bør advares om tegn og symptomer på IIH, inkl. alvorlig eller tilbakevendende hodepine, synsforstyrrelser og tinnitus. Seponering bør vurderes ved IIH. Interaksjoner: Antikoagulantiabehandling, legemidler som påvirker hypofyseutskillelsen av gonadotropiner og legemidler som forlenger QT-intervallet eller som kan indusere torsades de pointes. Graviditet, amming og fertilitet: Skal ikke brukes ved graviditet og amming.
Bivirkninger: Prostatacancer: Svært vanlige: Hetetokter, hyperhidrose, erektil dysfunksjon, ryggsmerter, parestesi i nedre lemmer, nedsatt libido, asteni. Vanlige: Munntørrhet, kvalme, hypertensjon, overfølsomhet, bekkensmerter, muskel-skjelettsmerter, smerte i ekstremitet, svimmelhet, hodepine, tap av libido, depresjon, humørforandringer, vektøkning, reaksjon på injeksjonsstedet (inkl. erytem, betennelse og smerte), ødem. Andre: Anafylaktisk reaksjon. Kvinner ved ulike triptorelinformuleringer og andre indikasjoner enn brystkreft, og klasseeffekt av GnRH-agonister: Svært vanlige/vanlige: Hetetokter, akne, hyperhidrose, seborré, brystlidelse, dyspareuni, genital blødning, ovarial hyperstimuleringssyndrom, ovarial hypertrofi, bekkensmerter, vaginal tørrhet, hodepine, søvnforstyrrelse, humørforstyrrelser, redusert libido, asteni, kvalme, magesmerte, magebesvær, overfølsomhet, brystsmerter, artralgi, muskelspasme, smerte i ekstremitet, svimmelhet. depresjon, nervøsitet, vektøkning, reaksjon ved injeksjonsstedet, perifert ødem. Andre: Anafylaktisk sjokk. Brystkreft (kombinasjonsbehandling): I tillegg til bivirkninger hos menn og kvinner nevnt ovenfor. Svært vanlige/vanlige: Kvalme, hetetokter, hypertensjon, hyperhidrose, dyspareuni, vaginal tørrhet, muskuloskeletale forstyrrelser, osteoporose, urininkontinens, insomni, redusert libido, depresjon, fatigue, diabetes mellitus, hyperglykemi, overfølsomhet, benbrudd, reaksjon ved injeksjonsstedet. Andre: Myokardial iskemi, cerebral iskemi, CNS-blødning. Sentral pubertas precox: Svært vanlige/vanlige: Vaginal blødning, abdominalsmerte, hetetokter, akne, overfølsomhet, hodepine, vektøkning, reaksjon på injeksjonsstedet. Andre: Nedsatt syn, anafylaktisk sjokk, idiopatisk intrakraniell hypertensjon. For mer informasjon, se felleskatalogen eller preparatomtalen (SPC) Basert på SPC godkjent av SLV/EMA: 27.03.2023
Innehaver av markedsføringstillatelsen: Institut Produits Synthèse (IPSEN) AB.
Kontakt: Telefon: +46 8 451 60 00. E-post: info.se@ipsen.com. Pakninger og priser per 01.06.2023: 3,75 mg: 1 sett kr 1190,10. 11,25 mg: 1 sett kr 2977,70. 22,5 mg: 1 sett kr 5759,70. 1 sett = hettegl. + amp. Priser og ev. refusjon oppdateres hver 14. dag.
Refusjon: Kan forskrives på blå resept: Refusjonsberettiget bruk: Behandling av lokalavansert eller metastaserende, hormonavhengig prostatacancer. ICPC: Y77: Ondartet svulst prostata. ICD-10: C61 Ondartet svulst i blærehalskjertel. Behandlingen skal være instituert i sykehus, sykehuspoliklinikk eller av spesialist i vedkommende disiplin.
Dato: 25.05.2023
Den 18. oktober 2022 besluttet Nye Metoder at behandling med kimær antigenreseptor (CAR) T-celle terapi kunne tas i bruk i Norge ved residivert eller refraktært diffust storcellet B-cellelymfom (r/r DLBCL) etter to eller flere linjer med systemisk behandling. Her følger noen av de erfaringene vi har gjort ved seksjon for lymfom og indremedisin ved Radiumhospitalet gjennom dette første året med CAR T-celle terapi

MARIANNE BRODTKORB
Overlege
Avdeling for kreftbehandling Oslo Universitetssykehus
BENTE LOFTUM WOLD
Overlege
Avdeling for kreftbehandling Oslo Universitetssykehus
ALEXANDER FOSSÅ
Overlege
Avdeling for kreftbehandling Oslo Universitetssykehus
MACARENA IRARRAZABAL
Sykepleier
Avd for kreftbehandling A8
Koordinator for HMAS og CAR T
INGUNN HOLUMSNES SANDVEN
Sykepleier
Avd for kreftbehandling A8
Koordinator for HMAS og CAR T
JON RIISE
Overlege
Avdeling for kreftbehandling Oslo Universitetssykehus
Siden de første pasientene med maligne blodsykdommer og lymfomer fikk CAR T-celle terapi for omtrent 15 år siden har det vært knyttet store forventninger til innføringen av denne banebrytende behandlingen. Det første barnet i verden som fikk behandling med CAR T-celler var syv år gamle Emily Whitehead ved Childrens Hospital i Philadelphia. Hun var i 2012 alvorlig syk med tilbakefall av akutt B-lymfoblastisk leukemi og er frisk i dag, 11 år senere. Siden 2012 har utviklingen av CAR T-celle terapi kommet langt og får stor oppmerksomhet i litteraturen og på de store konferansene innen maligne blodsykdommer og lymfomer.
Det skulle gå ti år fra Emily Whitehead til Nye Metoder godkjente Axicabtagen ciloleucel (Yescarta®) fra Kite Gilead i oktober 2022, under forutsetning av at behandlingen skulle gis ved Oslo Universitetssykehus (OUS). Bakgrunnen for innføringen av behandlingen var ZUMA-1 studien, en fase-2 studie som ble publisert 5 år tidligere, i 2017. Yescarta er ett av seks CAR T-celle produkter som er godkjent av Food and Drug Administration (FDA) og European Medicinal Agency (EMA).
Fire av disse produktene har indikasjoner ved undergrupper av leukemier og non-Hodgkins lymfomer og to ved myelomatose (tabell 1).
Seksjon for lymfom og indremedisin ved Radiumhospitalet hadde på forhånd erfaringer med CAR T-celle terapi til pasienter med r/r DLBCL gjennom deltagelse i tre kliniske studier med Tisagenlecleucel (Kymriah®) fra Novartis i perioden 2015-2021. På bakgrunn av dette fikk seksjonen i oppdrag å etablere et nasjonalt behandlingstilbud. Vi som forfattere av denne artikkelen var sentrale i dette arbeidet og ønsker på vegne av alle som har vært involvert å rapportere om prosessen og foreløpige resultater.
Da godkjenningen av CAR T-celle behandling for denne pasientgruppen kom en god del senere enn i andre land, opplevde både fagmiljøet og pasienter at arbeidet hastet. Innføringen av en ny og kompleks behandlingsmodalitet skulle foregå innenfor eksisterende budsjettramme. I løpet av de to siste månedene av 2022 la avdelingen og seksjonen derfor ned en betydelig innsats for å etablere nødvendige rutiner og prosedyrer. Disse
omfattet rutiner for henvisning, pasientutredning, logistikk, kvalitetssikring av T-cellehøsting, forsendelse og mottak av ferdig CAR T-celle produkt, forberedelse av pasientene, infusjon av CAR T-celler, monitorering av pasienter etter infusjon og håndtering av bivirkninger. Vi etablerte samarbeidsrutiner med andre avdelinger på sykehuset, som avdeling for celleterapi og spesialistgrupper med støttefunksjoner innen anestesi og nevrologi. Vi underviste sykepleiere og leger ved onkologisk-, anestesiologisk- og nevrologisk avdeling ved OUS, i tillegg til fagpersonell













på henvisende sykehus. For å sikre tilgang til denne nye behandlingen for alle landets pasienter, etablerte vi også ukentlig multi-disiplinært team (MDT) -møte på Norsk Helsenett hvor de fagansvarlige for lymfom-pasienter ved alle de fire regionsykehusene og andre henvisende sykehus deltar.
Det første MDT-møtet gikk av stabelen i starten av desember 2022. Første pasient fikk høstet T-celler midt i desember samme år og mottok Yescarta i begynnelsen av januar 2023. Vi ser nå tilbake på ett år med CAR T-celle terapi i rutinen.













ER CAR T-CELLE TERAPI?
Ved CAR T-celle terapi utstyres pasientens egne T-celler med en ny, kunstig reseptor som er rettet mot et overflatemolekyl på kreftceller (tumor antigen). Den kunstige reseptoren kalles CAR (fra engelsk chimeric antigen receptor) fordi den er sammensatt av flere deler med ulik opprinnelse. Den indre delen representerer den intracellulære delen av T-celle reseptoren som genererer T-cellens aktiveringssignal. Den ytre delen stammer fra et antistoff og kan binde seg til tumor antigener. I tillegg består CAR av et såkalt kostimulatorisk domene
Tabell 1: Oversikt over CAR T- celle produkt, diagnoser og innføringstidspunkt i klinisk praksis
Produktnavn Generisk navn (kortnavn) Antigen spesifisitet
Kymriah Tisagenlecleucel (tisa-cel)
CD19
Yescarta Axicabtagene ciloleucel (axi-cel)
Diagnose Pasientpopulasjon Referanse FDA Nye Metoder
B-ALL Barn og unge (<25 år) med tilbakefall/refraktær B-ALL
DLBCL Voksne 3. linje, tilbakefall/refraktær DLBCL
Voksne 2. linje, tilbakefall innen 12 mnd/primært refraktær DLBCL
FL Voksne 3. linje, tilbakefall/refraktær FL
Maude et al NEJM 2018 (ELIANA)
Schuster et al NEJM 2019 (JULIET)
Bishop et al al NEJM 2022 (BELINDA)
Fowler et al Nature Medicine 2022 (ELARA)
CD19
Breyanzi Lisocabtagene maraleucel (liso-cel)
Tecartus Brexucabtagene autoleucel (brexu-cel)
CD19
DLBCL Voksne 3. linje, tilbakefall/refraktær DLBCL
Voksne 2. linje, tilbakefall innen 12 mnd/primært refraktær DLBCL
Neelapu et al NEJM 2017 (ZUMA-1)
Locke et al NEJM 2022 (ZUMA-7)
FL Voksne 3.linje tilbakefall/refraktær FL Jacobsen el al Lancet 2021 (ZUMA-5)
DLBCL Voksne 3. linje tilbakefall/refraktær DLBCL
Voksne 2. linje tilbakefall innen 12 mnd/refraktær DLBCL
CD19 B-ALL Voksne med tilbakefall/refraktær B-ALL
Abramson et al Lancet 2020 (Transcend)
Kamdar et al Lancet 2022 (Transform)
Shah et al Lancet 2021 (ZUMA-3)
30 Aug 2017 Innført 17 Des 2018
01 Mai 2018 -
Avslått (23.09.2019 og 18.10.2022)
Ikke søkt
27 Mai 2022 Til metodevurdering 13.12.2021
18 Okt 2017
01 Apr 2022
05 Mar 2021
02 Mai 2021
24 Jun 2022
01 Okt 2021
Innført 18.10.2022
Innført 28.08.2023
Til metodevurdering 25.10.2021
Avbestilt 28.08.2023
Ikke søkt
Til metodevurdering 25.10.2022
MCL Voksne 3. linje (etter BTKhemmer) tilbakefall/refraktær MCL
Wang et al NEJM 2020 (ZUMA-2)
24 Jul 2020
Til metodevurdering 26.10.2020
Carvykti Ciltacabtagene autoleucel (cilta-cel)
Abecma Idecabtagene vicleucel (ideca-cel)
BCMA Myelomatose Myelomatose 4.linje
Berdeja et al Lancet 2021 (CARTITUDE-1)
BCMA Meylomatose Myelomatose 4.linje
Munshi et al NEJM 2021 (KarMMA)
28 Feb 2022 Metodevurdering ferdig 15.07.2022, beslutning ventes
26 Mar 2021
Til metodevurdering 26.10.20
som blant annet skal sørge for at de genmodifiserte T-cellene kan proliferere bedre og overleve lengre i pasienten. Det første trinnet i CAR T-celle terapi er høsting av pasientens egne T-celler fra perifert blod (såkalt leukaferese). Det syntetiske genet som koder for en CAR føres inn i pasientens T-celler ved hjelp av en virusvektor. CAR-genet blir dermed inkorporert i T-cellenes DNA, og den nye reseptoren kommer til uttrykk på T-cellenes overflate. Pasientens T-celler er da forvandlet til CAR T-celler som kan gjenkjenne og binde seg til tumorantigenet på kreftcellene. Ved hjelp av CAR tvinges T-cellene til å binde seg til kreftceller uavhengig av T-cellens egen reseptor og tumorcellens eventuelle vevsantigener av typen «major histocompatibility antigen» (MHC)klasse I og klasse II molekyler. Det spiller ingen rolle om kreftcellene har sluttet å presentere peptidantigener på MHC for å unnvike immunforsvaret, den kunstige reseptoren er designet for å gjenkjenne og binde seg til et annet (og gjerne kreftspesifikt) molekyl på kreftcellen. Ved denne bindingen kommer CAR T-cellene i tett kontakt med kreftcellene og aktiveres til målrettet og spesifikt drap av kreftcellene. Produksjonen av CAR T-celler inkluderer også en ekspansjonsprosess der cellene mangfoldiggjøres i kultur utenfor pasienten. Slik det gjøres i dag blir cellene frosset etter ferdig produksjon og sendt tilbake fra produsent til sykehuset. De siste dagene før CAR T-celleinfusjonen får pasienten en cellegift kur, enten en kombinasjon av fludarabin og cyklofosfamid eller bare bendamustin. Begge disse kurene er spesielt lymfotoksiske og medfører lymfopeni, og kuren kalles derfor
lymfodeplesjon. Hensikten er å sette i gang en produksjon av cytokiner som kan stimulere til proliferasjon av lymfocytter igjen. Dette fungerer som en drahjelp til CAR T-cellene for videre proliferasjon når de kommer inn i kroppen.
Kymriah var det første CAR T-celle produktet som ble godkjent av FDA i 2017 til barn og unge under 25 år med tilbakefall av akutt lymfatisk leukemi av B-celletype. Godkjenningen var basert på den internasjonale ELIANA studien hvor også barneavdelingen på Rikshospitalet deltok. Denne indikasjonen er godkjent i Norge av Nye Metoder. Både Kymriah, Yescarta og to andre CAR T-celleprodukter til behandling av lymfomer og leukemier binder seg til «cluster of differentiation» (CD)19. Dette er et overflatemolekyl som vi finner på alle B-celler, fra pre-B stadiet i benmargen og frem til en moden, antigen-eksponert B-celle. Ved videre differensiering til plasmacelle taper B-cellen uttrykket av CD19. De fleste akutte B-celle lymfoblastiske leukemier og modne B-celle lymfomer uttrykker CD19 og kan dermed gjenkjennes og drepes av CAR T-celler med en anti-CD19 spesifikk CAR. I tillegg til fire CAR T-celle produkter som er rettet mot CD19, har FDA i USA godkjent to CAR T-celle produkter for myelomatose. Begge disse er rettet mot B-cell maturation antigen (BCMA), et overflatemolekyl som kjennetegner plasmaceller (tabell).
Den 28. august 2023 besluttet Nye Metoder at Yescarta også kunne tas i bruk til pasienter med DLBCL med tilbakefall innen 12 måneder etter
fullføring av, eller som er refraktære overfor, førstelinje kjemo-immunterapi. Bakgrunnen var denne gang den randomiserte ZUMA-7 studien som viste klart forbedret sykdomskontroll og bedre totaloverlevelse ved Yescarta sammenliknet med standard immunokjemoterapi etterfulgt av høydosebehandling med autolog stamcellestøtte (HMAS) for pasienter med respons. Denne gangen kom godkjenningen innen ett år etter første publikasjon og det ble ikke lagt føringer på at behandlingen skulle sentraliseres til OUS. Det vil likevel ta tid før denne behandlingen blir etablert i de andre regionene.
Per 31. desember 2023 har vi diskutert mer enn 35 potensielle kandidater for CAR T-celle terapi på det ukentlige, nasjonale MDT-møtet. Totalt 31 pasienter har fått høstet T-celler og 26 av disse har så langt mottatt Yescarta. Hos 22 av disse var indikasjonen residivert eller refraktær sykdom etter to eller flere linjer, mens hos 4 pasienter var indikasjonen tidlig residivert eller primært refraktær sykdom etter førstelinjebehandling. I gjennomsnitt har to pasienter fått behandling per måned dette første året, men vi fikk en markant økning etter 28. august. I forbindelse med økende pågang av pasienter, har tilgangen til leukaferese vært en begrensende faktor. Noen pasienter har måttet vente på leukaferese. DLBCL kan være en svært aggressiv kreftsykdom, og det har vært nødvendig å gi noen av pasientene kjemoterapi for å beholde sykdomskontroll i ventetiden. Dette er ugunstig både med tanke på kvaliteten på T-cellene som høstes og risikoen
for å utarme benmargsfunksjonen før CAR T-celle terapi.
Seleksjon av rett pasientgruppe til denne potentielt toksiske og resurskrevende behandlingen er en utfordring. Det har vært svært få pasienter hvor vi i siste liten har måttet avlyse planlagt leukaferese eller reinfusjon av CAR T-celler på grunn av rask progresjon og tap av sykdomskontroll. Det er et mål i seg selv å holde dette antallet lavest mulig. Pasientene med r/r DLBCL har ofte kort forventet levetid og få eller ingen andre kurative behandlingsmuligheter, og det kan være spesielt tungt for pasienter med lang reisevei å oppleve at en håpefull behandling må avlyses. Vi forsøker å unngå dette ved at behandlingsansvarlig team på henvisende sykehus monitorerer pasientene tett frem mot leukaferese og reinfusjon. God og fortløpende kommunikasjon mellom OUS og henvisende sykehus gjennom MDT-møtene og andre kanaler har vært viktig. Vi har forsøkt å gjøre en riktig seleksjon av pasienter til denne behandlingen ved god kartlegging av komorbiditet og aspekter ved lymfomsykdommen. Så langt har vi tenkt at pasientene bør oppfylle de samme helsemessige kravene som vi stiller før HMAS. Dette er i stor grad i tråd med inklusjonskriteriene i ZUMA-1 og ZUMA-7 studiene som vi baserer oss på, men man kan diskutere om det er litt for strengt. I løpet av 2023 er det publisert data fra klinisk rutinebehandling med bruk av Yescarta og Kymriah ved DLBCL. Disse dataene viser at CAR T-celle terapi er mindre toksisk og bedre tolerert enn HMAS, og at det for eksempel er egnet til selekterte pasienter i høyere alder enn
aldersgrensen for HMAS. Aspekter ved lymfomsykdommen kan være assosiert med redusert sjanse for effekt av CAR T-celle terapien, som raskt progressiv sykdom, affeksjon av lever og/eller flere ekstranodale lokalisasjoner, høyt tumorvolum og en systemisk høyinflammatorisk tilstand (med høy ferritin, høy LD, høy CRP målt i blod). Dette er pasienter hvor CAR T-celle terapi kan være mindre effektivt, men dette er på ingen måte absolutt og det er viktig at pasientseleksjonen til en potensielt kurativ behandling ikke blir for streng.
RESULTATER
Med ett års erfaring kan vi nå oppsummere tidlige resultater av de første pasientene og så vidt sammenlikne med andres erfaringer. Av de 26 pasientene som har vært behandlet frem til 31.12.23 har 25 vært til første responsevaluering en måned etter infusjon. Tretten var da i komplett remisjon og syv i partiell remisjon vurdert med CT. Det tilsvarer en total responsrate (overall response rate; ORR) på 80% og en komplett responsrate (complete response rate; CRR) på 52%. Av de 16 pasientene hvor effekten er evaluerbar tre måneder etter behandling er åtte i komplett metabolsk remisjon (CMR) vurdert med PET-CT og dette tilsvarer en komplett responsrate på 50%. Det er for tidlig å gjøre en nøyaktig evaluering av behandlingsresultatene, men inntrykket så langt er at vi oppnår responsrater som er på høyde med ZUMA-1 og ZUMA-7 studiene og sammenliknbare med data fra klinisk rutinebehandling publisert fra de største sentrene i USA og Europa (se for eksempel Nastoupil L et al. J Clin Oncol. 2020
Sep 20). Langtidsoppfølging fra ZUMA-1 studien viser en median total overlevelse på 26 måneder og en overlevelseskurve som flater ut på vel 40% etter fem år. I data fra klinisk rutinebehandling hvor både Yescarta og Kymriah er benyttet i tredje eller senere linje, rapporteres det om progresjonsfri overlevelse ved 12 måneder på 45% og total overlevelse på 64%. Dette er svært gode tall sammenliknet med medianoverlevelsen på 6 måneder etter tidligere standardbehandling for denne pasientgruppen. Vi er spente på om videre oppfølging av våre pasienter også vil ligge på dette nivået.
CAR T-celle terapi er forbundet med særegne og potensielt alvorlige bivirkninger. Pasienter må monitoreres nøye og komplikasjoner håndteres optimalt for å unngå behandlingsrelatert morbiditet og mortalitet.
• CRS: Den vanligste bivirkningen er cytokinfrigjøringssyndrom (cytokin release syndrom; CRS) som vi til dels kjenner i liknende form fra andre onkologiske immunterapier som for eksempel rituximab. CRS ved CAR T-celle terapi kan imidlertid bli mer alvorlig og mer langvarig enn ved standard immunterapi. CAR T-celler er levende behandling som aktiveres og prolifererer når de kommer inn i pasienten. Ved kontakt mellom CAR T-cellene og målcellene i pasienten (dette er både normale CD19 positive B-celler og lymfomcellene) frisettes store mengder cytokiner. Mekanismene
bak CRS er ikke fullstendig kartlagt, men innbefatter først frisetting av interferon-gamma (IFN-gamma) og tumor-nekrosefaktor-alfa (TNFalfa) fra aktiverte CAR T-celler og lyserte tumorceller, etter hvert også interleukin-6 (IL6) fra aktiverte makrofager, endotel- og T-celler. Som uttrykk for CRS får nesten alle pasientene feber i løpet av de første dagene etter CAR T-infusjonen. Som ved uønskede hendelser ved kreftbehandling ellers graderes alvorligheten av CRS som grad 1-4 basert på temperatur, blodtrykk, respirasjon og oksygenmetning. Ved grad 1 har pasienten kun feber. Ved grad 2 måles lett hypotensjon og/eller hypoksi, men pasienten har effekt av paracetamol, væsketilførsel og noen få liter oksygen på nesekateter. Vi starter da behandling med tocilizumab (Roactemra®), et antistoff mot reseptoren for IL6. For de fleste pasienter med CRS grad 2 er en til fire infusjoner med tocilizumab med 8 timers mellomrom nok til å stabilisere og reversere CRS. Ved grad 3-4 er det mer alvorlig hypotensjon og/eller hypoksi, og vi må flytte pasienten til mer spesialisert avdeling som postoperativ overvåkningspost eller intensivavdeling for pressor-behandling og mer avansert respirasjonsstøtte. I samme fase som CRS opptrer er pasientene oftest neutropene etter lymfodeplesjonskuren eller tidligere kreftbehandling. Det kan være vanskelig å skille symptomene på CRS og på sepsis. Vi har derfor også et fokus på infeksjonsutredning og starter antibiotikabehandling. Av de 26 pasientene som er behandlet
med Yescarta hos oss, utviklet 25 pasienter CRS. Fem fikk CRS grad 3 og måtte behandles fra ett til flere døgn ved postoperativ avdeling på Radiumhospitalet eller intensivavdelingen på Rikshospitalet. De øvrige 20 fikk CRS grad 1-2 som ble håndtert på sengeposten.
• ICANS: En annen særegen klassebivirkning ved CAR T-celle terapi er av nevrologisk karakter og kalles «immune effector cell associated neurotoxicity syndrome» (ICANS). Begrepet dekker en rekke forskjellige nevrologiske symptomer man kan observere de første dagene til ukene etter infusjonen av CAR T-celler og er uttrykk for en immunmediert encephalopati. Pasientene monitoreres for utvikling av ICANS flere ganger i døgnet. De første symptomene kan være subtile og viser seg som nedsatt konsentrasjon og orienteringsevne, mild ekspressiv afasi, apraksi eller tremor. Vi gjør en enkel og objektiv skåring av kognitiv funksjon og pasienten skriver en fast setning på et skjema. Å følge håndskriften ser ut til å være en sensitiv måte å oppdage ICANS på. Dysgrafi er et tidlig symptom og håndskriften kan gå fra å være normal til krøllete og helt uleselig på bare et par timer. ICANS graderes også etter en objektiv skala fra 1-4. Vi er raskt ute med å gi pasienten høydose deksametason ved utvikling av ICANS grad 2 eller høyere. ICANS kan ha en bi-fasisk utvikling og de første symptomene opptrer ofte kort tid etter at pasienten har fått symptomer på CRS. Disse kan som regel reverseres med tocilizumab. Senere i forløpet, etter 7-10 dager
(og hos noen enda senere) kan symptomene forverres igjen. Ved ICANS grad 3 eller høyere kan pasienten være desorientert og somnolent, ha total afasi, uttalt dyspraksi, ataksi og tremor og det er risiko for utvikling av krampeanfall og i verste fall status epilepticus og hjerneødem. Pasientene med grad 3 eller høyere må flyttes til nevrologisk overvåkningspost, for OUS er dette på Rikshospitalet. Alle pasientene som skal ha CAR T-celle terapi på Radiumhospitalet settes profylaktisk på levetiracetam (Keppra) før infusjonen av cellene og fortsetter med dette til og med dag 28 etter infusjon, eventuelt lengre hvis de har hatt alvorlig ICANS. Så langt har åtte av våre pasienter hatt ICANS grad 1-2 og fem har hatt ICANS grad 3. Denne komplekse bivirkningen kan være skremmende å oppleve, ikke minst for pårørende som observerer dette, og pasienten og pårørende informeres grundig på forhånd. Heldigvis er dette syndromet reversibelt når det håndteres riktig, og sekveler eller død som følge av ICANS ses svært sjelden.
• Hypogammaglobulinemi og cytopeni: Etter B-celle rettet CAR T-celle terapi får de fleste pasientene B-celle aplasi. Denne kan bli langvarig og ledsages ofte av hypogammaglobulinemi med økt infeksjonstendens. Det er lav terskel for å gi substitusjonsbehandling med intravenøst eller subcutant immunoglobulin til disse pasientene. Pasientene kan også få langvarig neutropeni og trombocytopeni.
Håndteringen av CRS, ICANS og infeksjonskomplikasjoner ved CAR T-celle terapi krever et godt, multidisiplinært samarbeid og kontinuerlig kommunikasjon mellom spesialistgruppene som håndterer pasientene. Gjennom dette første året med CAR T-celle terapi er det opparbeidet et tett og godt samarbeid med avdelingene for anestesi, nevrologi og infeksjonsmedisin, i tillegg til avdeling for blodsykdommer som bidrar med oppfølgning av pasientene som må flyttes til Rikshospitalet i forløpet.
Under CAR T-celle terapien er pasientene innlagt på Radiumhospitalet fra og med oppstart av kuren for lymfomdeplesjon, til og med 14 dager etter CAR T-infusjon. Deretter skal de oppholde seg innen 2 timers reisevei fra Radiumhospitalet til dag 28. Risikoen for sen utvikling av ICANS er en av årsakene til at pasienten må oppholde seg i nærheten av Radiumhospitalet såpass lenge, i tillegg til risikoen for langvarige cytopenier, hypogammaglobulinemi og ledsagende infeksjonskomplikasjoner.
For noen av pasientene våre har det blitt tydelig ganske tidlig i behandlingsforløpet at CAR T-celle terapien ikke har effekt. Det aggressive forløpet ved ukontrollert DLBCL gjør at en situasjon preget av håp og bedring under CAR T-celle terapi snur ganske fort. Det kan da være få eller ingen behandlingsmuligheter å spille på. Omsorgen for pasienter som ikke har effekt av CAR T-celle terapi er krevende. Særlig for de pasientene som kommer langveis fra,
fordrer dette et godt samarbeid med pasientens lokalsykehus.
Det forgår en svært høy og kompetitiv forskningsaktivitet på CAR T-celle terapi og annen T-celle engasjerende immunterapi internasjonalt. Vi er inne i et paradigmeskifte innen lymfom og leukemibehandling hvor helt nye behandlingsprinsipper kommer til å prege utviklingen de neste ti årene. Denne typen behandling er også på vei inn i behandlingen av andre krefttyper og Radiumhospitalet kommer til å delta i kliniske studier med T-celle engasjerende behandling inkludert CAR T-celle terapi innen flere diagnosegrupper i nærmeste fremtid. Det er fortsatt forbedringspotensial ved CAR T-celle terapien både med tanke på effekt og bivirkningsprofil. Rett før jul 2023 publiserte FDA en rapport om at noen ganske få pasienter har utviklet aggressiv T-celle leukemi/ lymfom som er CAR positiv flere år etter at de mottok CAR T-celle terapi. FDA har pålagt firmaene som prøver ut CAR T-celle terapi i kliniske studier å følge pasientene i minst 15 år nettopp med tanke på langtidseffekten av å tilføre genmanipulerte celler. Forbedring av sikkerheten ved bruken av genmanipulerte celler i pasientbehandling er en stor og viktig utfordring innen videreutviklingen av moderne celleterapi. På kortere sikt her i Norge, ser vi i 2024 frem mot etablering av CAR T-celle terapi ved flere av universitetssykehusene i Norge og en utvidelse av behandlingstilbudet til flere hematologiske maligniteter.
Godkjent i Beslutningsforum for 2 indikasjoner 1,2

Beslutning i Beslutningsforum for nye metoder (23.05.2022):
Lorlatinib (Lorviqua) innføres til behandling av voksne pasienter med ALK-positiv avansert ikke-småcellet lungekreft (NSCLC) som ikke tidligere har blitt behandlet med en ALK‑hemmer.1

Indikasjoner
Beslutning i Beslutningsforum for nye metoder (14.12.2020):
Lorlatinib (Lorviqua) innføres til behandling av ALK-positiv avansert ikke-småcellet lungekreft (NSCLC) i andre – eller senere behandlingslinjer. 2
For oppdatert informasjon om forventet effekt og sikkerhet for Lorviqua i de ulike behandlingslinjene, se Pfizer sine hjemmesider på https://www.pfizerpro.no/ legemiddel/lorviqua-lorlatinib.
Ved å scanne QR-koden til venstre med telefonen din, tas du også direkte til hjemmesiden.
Monoterapi til behandling av voksne med anaplastisk lymfomkinase (ALK) -positiv avansert ikke -småcellet lungekreft (NSCLC) som ikke tidligere har blitt behandlet med en ALK-hemmer.
Monoterapi til behandling av voksne med ALK-positiv avansert NSCLC der sykdommen har progrediert etter alektinib eller ceritinib som første behandling med ALK-tyrosinkinasehemmer (TKI) eller krizotinib og minst 1 annen ALK-TKI.
Viktig sikkerhetsinformasjon:
LORVIQUA® (lorlatinib): filmdrasjerte tabletter (25mg og 100mg).
Kontraindikasjoner: Samtidig bruk av sterke CYP3A4/5-induktorer. Advarsler/Forsiktighetsregler: Vær oppmerksom på følgende før og under behandling: Hyperlipidemi, CNS effekter, atrioventrikulær blokk, reduksjon i venstre ventrikkels ejeksjonsfraksjon, økning i lipase og amylase, interstitiell lungesykdom/ pneumonitt, hypertensjon og hyperglykemi. Forsiktighet ved bilkjøring og bruk av maskiner da CNS-påvirkning kan forekomme.
Dosering: Anbefalt dose er 100 mg 1 gang daglig. Behandlingen bør fortsette til sykdomsprogresjon eller uakseptabel toksisitet. Dosejusteringer kan være påkrevd basert på individuell sikkerhet og tolerabilitet. Se preparatomtale for informasjon om dosejusteringer
Bivirkninger: De hyppigst rapporterte bivirkningene er hyperkolesterolemi, hypertriglyseridemi, ødem, perifer nevropati, kognitive effekter, fatigue, vektøkning, artralgi, stemningseffekter og diaré.
Pakninger, priser og refusjon: 25 mg x 90 (blister) 70 161,30,- H-resept, Reseptgruppe C 100 mg x 30 (blister) 70 161,30,H-resept, Reseptgruppe C.
For fullstendig informasjon, se preparatomtale for LORVIQUA på legemiddelsok.no.
Referanser:
1. https://nyemetoder.no/metoder/lorlatinib-lorviqua-indikasjon-ii, sist lest 28.juni.2023
2. https://nyemetoder.no/metoder/lorlatinib-lorviqua, sist lest 28.juni.2023

Hematolog, overlege og førsteamanuensis Akershus universitetssykehus og Institutt for klinisk medisin, Universitetet i Oslo
Forekomsten av venøs trombose hos kreftpasienter varierer fra 2-20% per år (1). Til sammenlikning er forekomsten i den alminnelige norske befolkningen ca. 2/1000 per år. Det er derfor meningsfullt å vurdere tromboseprofylakse hos alle kreftpasienter.
TROMBOSEPROFYLAKSE
Padua skår er en skår for å bestemme hvilke indremedisinske pasienter som bør få tromboseprofylakse (2). Får man mer enn 4 poeng er det anbefalt å gi tromboseprofylakse. I denne skåren gir enhver kreftsykdom 3 poeng. Det betyr i praksis at nesten alle kreftpasienter som legges inn med akutt sykdom bør få tromboseprofylakse. (Tabell 1).
Blant polikliniske kreftpasienter bør de med høy risiko for venøs trombose få tromboseprofylakse. Det er vist at å gi tromboseprofylakse til en uselektert populasjon av polikliniske kreftpasienter vil gi et for høyt «Numbers needed to treat» (NNT) til at det regnes som effektivt (3, 4). Men hvis man bruker en risikoskår til å plukke ut pasienter med høy risiko gir det lavere NNT (5, 6). Den risikoskåren som er best dokumentert og som også er enkel å bruke er Khorana skår (7). Hos kreftpasienter som skal få kjemoterapi og som får 2 poeng i Khorana skår kan man da gi tromboseprofylakse. Dessverre er det kun lavmolekylært heparin som har
dette som godkjent indikasjon, DOAK kan derfor ikke brukes selv om det er vist at det virker. (Tabell 2).
BEHANDLING AV VENØS TROMBOSE HOS KREFTPASIENTER De fleste kreftpasienter som får venøs trombose kan behandles med en av de direktevirkende orale faktor Xa hemmerne edoksaban, rivaroksaban, eller apiksaban (8-10). Trombinhemmeren dabigatran er ikke testet ut hos kreftpasienter og anbefales derfor ikke. Alle kreftpasienter kan også behandles med lavmolekylært heparin for sin venøse trombose, mens warfarin regnes som dårligere siden det gir hyppigere residivtromboser. Dalteparin er det lavmolekylære heparinet som er best dokumentert hos kreftpasienter i Norge brukes dalteparin og enoksaparin om hverandre uten at vi kan si at det ene er bedre eller dårligere enn det andre.
Gastrointestinal og urologisk kreft
Både edoksaban og rivaroksaban gir flere store blødninger enn lavmolekyært heparin hos pasienter med gastrointestinal kreft. I studiene av apiksaban sees ikke denne forskjellen. Derimot så observerte man at pasienter med resesert gastrointestinal kreft ikke fikk noe særlig blødninger i det hele tatt (11, 12). Det har også vært antydet at pasienter med urologisk
Tabell 1: Padua skår
Poeng
3 Aktiv malign sykdom
3 Tidligere DVT eller lungeemboli
3 Immobilisering 3 dager eller lenger
3 Kjent trombofili
2 Nylig traume eller kirurgi (<1mnd)
1 Alder 70 år og høyere
1 Hjerte- eller respirasjonssvikt
1 Hjerteinfarkt eller iskemisk slag
1 Infeksjon eller reumatologisk sykdom
1 BMI 30 og høyere
1 Hormonbehandling
kreft har flere store blødninger på edoksaban enn lavmolekylært heparin, men det er små tall som underbygger dette og tilsvarende stor usikkerhet. I studiene av apiksaban så ser det ut til at pasienter med urologisk kreft blødde mye uansett om de fikk behandling med apiksaban eller lavmolekylært heparin.
Kreftpasienter med høy risiko for blødning Pasienter med høy risiko for blødning bør behandles med lavmolekylært heparin så lenge de er blødningsutsatt. Grunnen er at lavmolekylært heparin har kortere halveringstid enn DOAK, det finnes antidot (protaminsulfat) og det er lettere å redusere dosen siden det er flere dosetrinn. Hvilke pasienter som har høy risiko for blødning er en klinisk vurdering. Eksempler er pasienter med luminale svulster, trombocytopeni under 50, eller klinisk blødningstendens. Lav Hb uten forklaring før oppstart av antikoagulasjon kan være et tegn på en liten uoppdaget
Tabell 2: Khorana skår Risikofaktor
Pankreas/ventrikkel kreft
Poeng
2 Lunge, gynekologisk, lymfom, blære eller testikkelkreft
blødning, som kan bli forverret når man starter antikoagulasjon.
Behandlingslengde
Kreftpasienter skal som hovedregel behandles i 6 måneder for sin venøse trombose eller så lenge de har kreft.
Behandling i den palliative fasen må sees i lys av den eventuelle symptomlindring antikoagulasjon kan gi, f.eks. ved tungpustenhet som skyldes lungeemboli. Hvis ikke antikoagulasjon gir symptomlindring er det ikke hensiktsmessig å gi det i den palliative fasen. Brystkreftpasienter som har fått venøs trombose og som behandles langvarig med tamoksifen bør sannsynligvis bruke antikoagulasjon så lenge de bruker tamoksifen.
Dosereduksjon av antikoagulasjon
Lavmolekylært heparin dosereduseres rutinemessig til 150 E/kg x 1 etter 4 ukers behandling. Ved behandling med DOAK er det foreløpig kun én publisert studie som har testet ut
dosereduksjon (13). I denne enarmede intervensjonsstudien ble apiksaban doseredusert til 2.5 mg x 2 etter 6 måneder hos de som ikke allerede hadde fått residiv av venøs trombose eller alvorlig blødning. Det ble observert få residivtromboser og få alvorlige blødninger i de neste 30 månedene etter dosereduksjon, slik at dette regimet er trolig trygt å bruke i denne pasientgruppen.
Medikamentinteraksjoner Lavmolekylært heparin har i praksis ingen medikamentinteraksjoner utover andre medikamenter som også gir blødningstendens, f.eks. blodplatehemmere og NSAID. DOAK påvirkes av medikamenter som induserer eller hemmer CYP3A4 og P-glykoprotein. Rivaroksaban og apiksaban metaboliseres av begge disse enzymene, mens edoksaban kun er avhengig av P-glykoprotein. Imidlertid er det ofte slik at medikamenter som påvirker CYP3A4 også ofte påvirker P-glykoprotein, dermed er det de
samme medikamentene som interagerer med alle DOAK’ene. En sjelden gang i blant kan det være pasienter som ikke kan bruke rivaroksaban eller apiksaban grunnet medikamentinteraksjoner som likevel kan bruke edoksaban. Det er nesten ingen studier som har studert medikamentinteraksjoners effekt på kliniske endepunkter, slik at dette er hovedsakelig teoretiske overveininger. Eksempler på kreftmedisiner som interagerer med DOAK er dabrafenib, enzalutumid og idelalisib.
Svulst i hjernen
Det er veldig lite data på DOAK behandling av venøs trombose hos pasienter med primær eller metastatisk hjernesvulst. De få studiene som er gjort er utelukkende gjennom-
ganger av historiske data. Det er derfor vanskelig å si om DOAK kan brukes ved intracerebrale svulster. De fleste leger vil nok foretrekke lavmolekylært heparin fordi det har kortere halveringstid og det finnes antidot.
Nyresvikt
Nyresvikt påvirker utskillelse av både lavmolekylært heparin og DOAK. For lavmolekylært heparin kan det være nyttig å styre behandlingen etter antifaktor Xa aktivitet hos disse pasientene. Ved behandling med DOAK må man være forsiktig ved kreatinin-clearence under 30 og dosereduksjon kan være nødvendig, se preparatomtalene av medikamentene. Det vil også være nyttig å holde øye med klinisk blødningstendens hos disse pasientene.
De orale faktor Xa hemmerne kan brukes til de fleste kreftpasienter med venøs trombose, selv om det i perioder med biopsier, operasjoner og andre inngrep vil være nødvendig å bruke lavmolekylært heparin. Apiksaban gir ikke mer alvorlig blødning enn lavmolekylært heparin hos pasienter med gastrointestinal kreft, i hvert fall ikke når tumor er operert bort. Husk å vurdere alle inneliggende kreftpasienter for tromboseprofylakse med Padua skår og polikliniske pasienter med Khorana skår.
Referanser:
Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no
DOSEJUSTERINGER1:
For dosering ved febril nøytropeni, perifer nevropati og/eller nedsatt nyre- og leverfunksjon, se fullstendig produktomtale.
ADMINISTRASJONSMÅTE1:
Den anbefalte dosen med ADCETRIS infunderes i løpet av 30 minutter.
For instruksjoner om rekonstituering og fortynning av dette legemidlet før administrering se godkjent produktomtale. ADCETRIS må ikke administreres som en intravenøs direkte injeksjon eller bolus. ADCETRIS skal administreres via en separat intravenøs slange, og skal ikke blandes med andre legemidler
PRISER2:
50 mg, 1stk. hetteglass 37760,20. Reseptgruppe C. H-resept
REFUSJON2:
Er innført:
I kombinasjon med syklofosfamid, doksorubicin og prednison til førstelinjebehandling av voksne pasienter med systemisk anaplastisk storcellet lymfom (sALCL). Behandling av voksne pasienter med CD30+ Hodgkins lymfom med forhøyet risiko for tilbakefall eller progresjon etter autolog stamcelletransplantasjon.
Til behandling av tilbakefall av Hodgkins lymfom og storcellet anaplastisk non-Hodgkins lymfom.
Til metodevurdering for førstelinjebehandling av CD30+ HL
REFERANSER:
1. Adcetris SPC 12.10.23 Punkt 4.1 og 5.1, tilgjengelig på www.legemiddelsok.no
2. Adcetris FK-tekst, Tilgjengelig på felleskatalogen.no (Sist lest 04.01.24)
HOLD DEG OPPDATERT OM LYMFOMBEHANDLING.



ADCETRIS har nå også indikasjon for førstelinjebehandling av pasienter med Stadium III CD 30+ Hodgkin Lymfom****

Når HMAS eller kjemoterapi med flere legemidler ikke er et behandligsalternativ etter minst 2 tidligere

Som konsolidering ved forhøyet risiko for tilbakefall eller progresjon etter HMAS.

Pasienter med diagnostisert CTCL etter minst en tidligere systemisk behandling***

Tidligere ubehandlet sALCL i kombinasjon med CHP**

Ved residiverende eller refraktær sALCL.
Etter minst 1 tidligere behandling





Til rebehandling av pasienter som tidligere har fått behandling med Adcetris og nådd komplett eller partiell remisjon

INDIKASJONER1
ADCETRIS er indisert til voksne pasienter med tidligere ubehandlet CD30+ Hodgkin lymfom (HL) stadium III eller IV i kombinasjon med doksorubicin, vinblastin og dakarbazin (AVD)
ADCETRIS er indisert til behandling av voksne pasienter med CD30+ HL med forhøyet risiko for tilbakefall eller progresjon etter autolog stamcelletransplantasjon (ASCT)
ADCETRIS er indisert til behandling av voksne pasienter med residiverende eller refraktær CD30+ Hodgkin lymfom (HL):
1. etter ASCT eller
2. etter minst to tidligere behandlinger når ASCT eller kjemoterapi med flere legemidler ikke er et behandlingsalternativ.
ADCETRIS i kombinasjon med cyklofosfamid, doksorubicin og prednison (CHP) er indisert til voksne pasienter med tidligere ubehandlet systemisk anaplastisk storcellet lymfom (sALCL).
ADCETRIS er indisert til behandling av voksne pasienter med residiverende eller refraktær sALCL.
ADCETRIS er indisert til behandling av voksne pasienter med CD30+ kutant T-cellelymfom (CTCL) etter minst 1 tidligere systemisk behandling.
UTVALGT PRODUKTINFORMASJON FOR ADCETRIS® (Brentuksimabvedotin)1
DOSERING OG ADMINISTRASJON:
• Anbefalt dose når Adcetris kombineres med kjemoterapi (AVD) er 1,2 mg/kg dag 1 og 15 i hver 28-dagers i 6 sykluser.
• Anbefalt dose er 1,8 mg/kg hver 3.uke i kombinasjon med CHP ved sALCL i 6-8 sykluser.
• Anbefalt dose i monoterapi er 1,8 mg/kg administrert som en intravenøs infusjon i løpet av 30 minutter hver 3. uke.
• Samtidig administrasjon av bleomycin forårsaker pulmonal toksisitet.
Vanligste bivirkninger (≥1/10):
Infeksjon, kløe, øvre luftveisinfeksjon, nøytropeni, anemi, febril nøytropeni, nedsatt appetitt, perifer sensorisk nevropati, perifer motorisk nevropati, svimmelhet, hoste, dyspné, økt ALAT, kvalme, diaré, brekninger, forstoppelse, magesmerter, stomatitt, alopesi, utslett, pruritus, artralgi, myalgi, skjelettsmerter, ryggsmerter, fatigue, pyreksi, infusjonsrelaterte reaksjoner, vekttap, søvnløshet. VANLIGE (≥1/100 til <1/10): Trombocytopeni, hyperglykemi, herpes zoster, pneumoni, herpes simplex, oral candidiasis, sepsis/septisk sjokk, frysninger, ASAT.
*doksorubicin, vinblastine, dakarbazin HMAS=Høydosebehandling med autolog stamcellestøtte **cyklofosfamid, doksorubicin og prednison
**** Indikasjon er til metodevurdering
FOR DETALJERT INFORMASJON FØR FORSKRIVNING, SE FELLESKATALOGEN.NO

 ODD R. SCHIBSTED MONGE
Fana, Bergen, o.monge@online.no
ODD R. SCHIBSTED MONGE
Fana, Bergen, o.monge@online.no
Mitt forrige bidrag i jakten på røttene til norsk onkologi i Onkonytt 2-2023 dokumenterte at röntgenbehandling av leukemi i Bergen startet allerede i 19041. I denne artikkelen kommer analyse av internasjonale publikasjoner som kan ha vært av betydning for å bringe «röntgenbehandling» til Norge allerede 9 år etter oppdagelsen av röntgenstråling. Dette var mange år før utvikling av evidensbasert medisin som begrep4. Regelverk for gjennomføring av kliniske studier ble ikke etablert før 1996, gjennom The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH), og retningslinjer for Good Clinical Practice (GCP)5 Det var fortsatt mange år til begrepene clinical studies med fase I - IV ble formet4
RÖNTGENSTRÅLING OG WILHELM CONRAD RÖNTGEN (1845-1923) (FIGUR 1). Hans biografi er kjent av mange, her bare kortversjon7,24. WC Röntgen var født i Lennep i daværende Preussen, øst for Düsseldorf i Tyskland. Den lille byen ble senere innlemmet i Remscheid. Ikke overraskende er det tyske Röntgen-museum lokalisert i byen24. Faren hans var tysk forretningsmann, moren nederlandsk. WC forble enebarn. Familien flyttet til Nederland da han var 3 år. Han
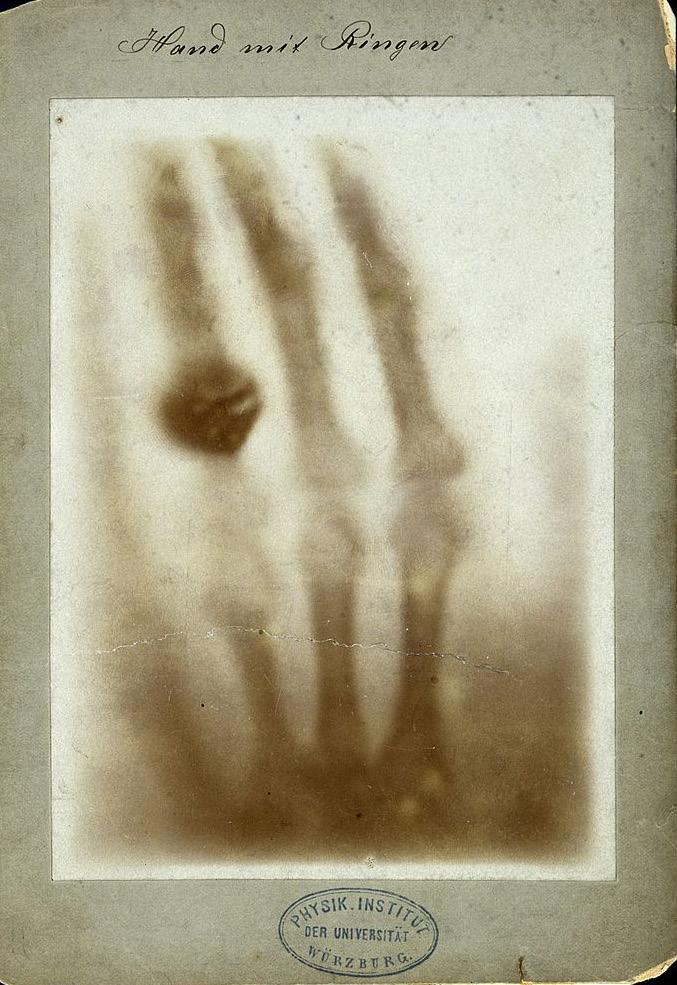
gikk på teknisk skole og studerte fysikk i Utrecht før han studerte ingeniørfag i Zürich, og ble Ph.D. i 1869. Han hadde akademiske stillinger flere steder før han i 1888 kom til Würzburg i Tyskland som professor i fysikk. Det var ved fysikklaboratoriet i Würzburg han om kvelden 8. november 1895 gjorde oppdagelsen av «Eine neue Art von Strahlen» –X-rays eller röntgenstråling3. Funnet ble publisert allerede i desember samme år som monografi på 10 sider, utgitt på et forlag i Würzburg som ledd i lokale «Verhandlungen der Physik.-Medizin.-Gesellschaft» 3,7,24 (Figur 2). Monografien hadde ingen illustrasjoner, verken av testoppsettet eller det senere ikoniske röntgenbildet av den ene hånden til fru Anna Bertha Röntgen f. Ludwig (her gjøres ikke forsøk på å oppsummere den


tekniske beskrivelsen, dette overlates til historie-interesserte fysikere). Publikasjonen gav raskt internasjonal berømmelse, og resulterte i tildeling av (første) Nobelpris i fysikk allerede 6 år senere, i 19017 (Figur 1).
WC giftet seg i 1872 i Apeldoorn, Nederland med Anna Bertha Ludwig fra Zürich. Paret adopterte en datter av broren til Anna. Det var hånden til Anna Bertha, (med ringer på ringfingeren), som ble gjenstand for første bevarte, og senere publiserte, röntgenbilde. i desember 189522. Det kan ha vært dette röntgenbildet som bidro til folkelig forståelse av dybdevirkning av ufiltrert röntgenstråling, «gjennomlysing» (Figur 3). Først flere tiår etter 1895 ble det mulig å framstille dybdedosekurver, jfr. Figur 9 side 74 i Onkonytt 2 20231,7
TIL ARMAUER HANSEN I SEPTEMBER 1896
I Onkonytt 2 2023 var det på side 74 nevnt dokumentasjon om en medieseanse ved Bergen tekniske skole med röntgenbilde av den ene hånden til Armauer Hansen1 i september 1897, og at eksponeringstiden var 1 time og 15 minutter. Ved digitalt søk ved Nasjonalbiblioteket i norske aviser fra 1890-tallet viste det seg at seansen var i 1896, ikke 1897. Dessverre ser det ikke ut til at röntgenbildet noen gang ble publisert. Det kan selvfølgelig være at seansen ikke var vellykket. Seansen var ikke nevnt i årsberetninger for Bergen tekniske skole.
ALLEREDE I 1896
Publikasjonen til WC Röntgen, «Eine neue Art von Strahlen»3, høsten 1895 var en ren fysikkstudie som dokumenterte eksistens av ioniserende stråling, variant antatt ufiltrert röntgenstråling, Det forelå ikke observasjon av fysisk dybdemåling av strålingsaktivitet før en gikk i gang med behandling av ulike sykdommer hos mennesker. Begrepet fase I-studier kom først mange år senere4. Det forelå heller ikke biologiske studier, eller murine studier med röntgenstråling, før en gikk i gang med behandling av sykdom hos mennesker. Fraksjonert röntgenbehandling mot en benign tilstand hos et barn i 18961 var en av de best dokumenterte tidlige kliniske serier som ble gjennomført1,2. Ellers finnes tidlige

publikasjoner om röntgenbehandling ved recidiv av overfladisk malign sykdom hos voksne. Det var tidlig bl.a. kjent at et par svenske publikasjoner i 1898 hevdet at helbredelse av hudkreft hos voksne med röntgenbehandling var mulig13. Rimeligvis var den økende forekomsten av multiple sykdommer med dårlig prognose drivkraft for tidlig bruk av röntgenbehandling20 Apparaturen var vel lett tilgjengelig, forholdsvis rimelig å anskaffe og trolig også rimelig i bruk. Tidlig bruk trengte (dessverre) heller ikke fysikerstøtte.
FRAKSJONERT RÖNTGENBEHANDLING AV BENIGN
TILSTAND HOS ET BARN I 1896 OG AKUTTREAKSJON
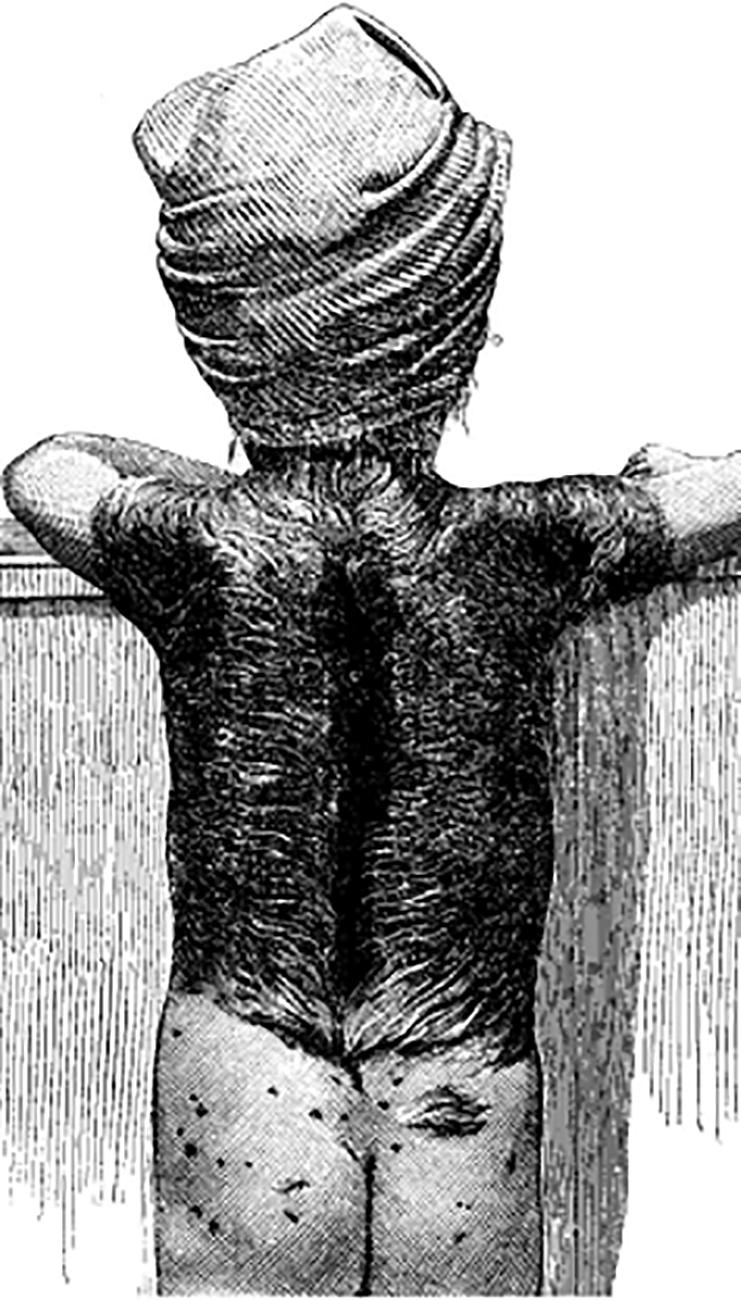
Monografien til medisineren Leopold Freund16 i Wien i 1897 redegjorde ikke for hvorfor han valgte röntgenbehandling av et barn med benign tilstand som første kandidat for den
nye behandlingsteknikken. Foreldrene samtykket neppe skriftlig til bruk av utprøvende behandling, men en fikk inntrykk i publikasjonen av at bekymring hos mor kan ha vært driver for start av behandling. Den første publikasjonen viste en strektegning av behandlingsområdet med utbredt medfødt hårnævus16 og omtale av oppsett ved behandling fra november 1896 (Figur 4A). Det faglige grunnlaget for behandlingen kan bare ha vært publikasjonen til WC Röntgen’s «Eine neue Art von Strahlen» nær nøyaktig ett år tidligere3. Ingen biologiske effekter av behandlingsteknikken kan ha vært kjent på den tiden. Den 5 år gamle jenten hadde en stor hårnævus som dekket hele ryggsiden, inkludert skuldre og lumbalregionen16. Etter redegjørelse for oppsett med jenten stående med ryggen vendt mot röntgenapparatet, ble det startet fraksjonert behandling i november
189616. Den akutte strålingsreaksjon ble omtalt i den neste publikasjonen17 Behandlingen ble avsluttet i desember samme år etter observert huderytem i nedre del av området (akuttreaksjon grad 1 i moderne terminologi) 17 Håravfallet var åpenbart mest omfattende i lumbalregionen, jfr. figur 4B. Neste monografi av Freund17 hevdet at det etter fullført behandling kom akuttreaksjon med fuktig deskvamasjon i et større område lumbalt. Men i nåtiden vil nok mange heller hevde det kom nekrose i epidermis i nærmest hele lumbosakralregionen (Figur 4B). Lokalisasjon av nekrose i sakralregionen til dels utenfor primære utbredelse av hudnævus kan være uttrykk for upresis og umoden behandlingsteknologi. Kollimering av behandlingsfelt ble tilgjengelig først over 20 år etter WC Röntgen3 sin publikasjon i 1895.


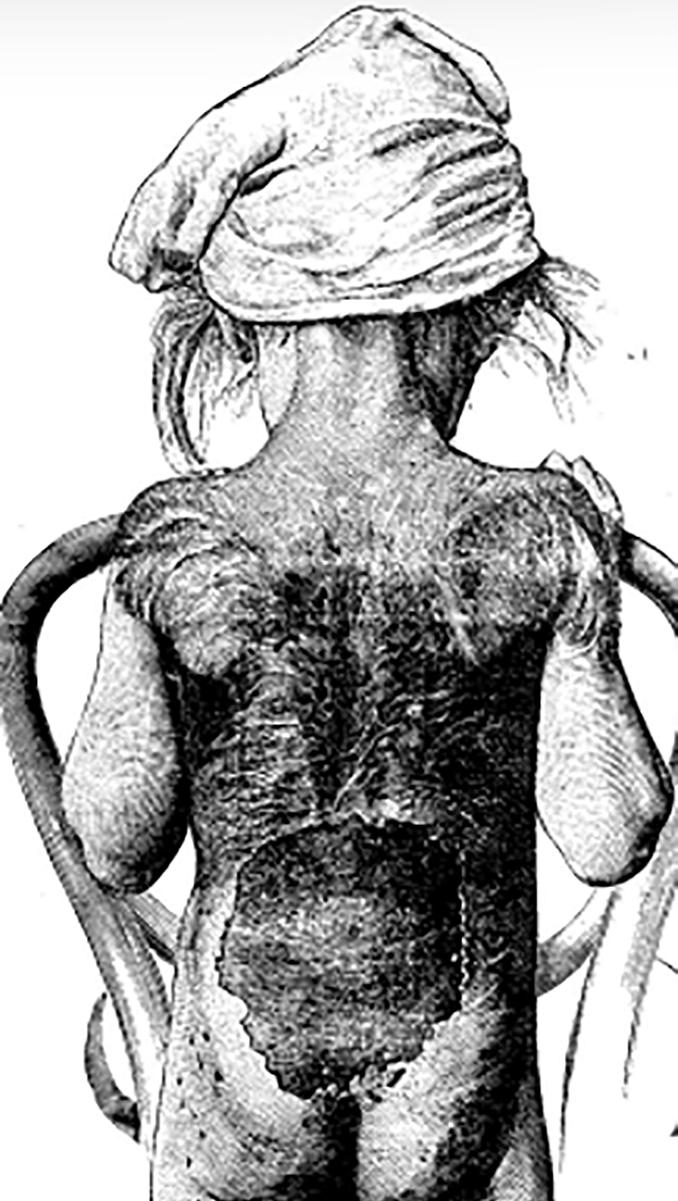
Fotodokumentasjon av seneffektene ble publisert 75 år etter, i forbindelse med 100-årsjubileet for röntgenstråling i 1995. Bildet som ble publisert av HD Kogelnik, bekrefter tilstand etter nekrose i epidermis med uttalt fibrose, inndragninger og skoliose18,19 (Figur 4C). og Muligens har pasienten også blitt rammet av sekundær osteoporose etter gonadesvikt som følge av behandlingen18. Kunnskap om seneffekter av alle former for strålebehandling er selvfølgelig viktig, særlig hos barn, og særlig mhp forebygging21. Av interesse at hårveksten i huden thorakalregionen så ut til å blitt borte uten åpenbare seneffekter. Betenkeligheter ved strålebehandling av barn kom for øvrig ikke tydelig fram ved feiring av 100-årsjubiléet19 i 1995. Den tidlige starten av röntgenbehandling i Wien i 1896
før röntgendiagnostikk ble utviklet, hadde også sin parallell i Bergen i 1904 da en startet röntgenbehandling av leukemi før röntgendiagnostikk ved behandlingsinstitusjonen var tydelig utviklet 1,18,19
TIDLIG ERFARING MED RÖNTGENBEHANDLING VED MALIGN TILSTAND, MULIG HODGKINS SYKDOM.
Kirurgen Nicholas Senn i Chicago hadde flere viktige illustrasjoner i første monografi om «röntgen ray treatment of pseudoleucæmia» i 19038, dvs. omkring tidspunktet da beslutning om å skaffe apparatur for «röntgenbehandling» i Bergen ble fattet (Figur 5A). Det finnes neppe bedre kliniske illustrasjoner enn Senn’s i tidlige publikasjoner om röntgenbehandling av kreft8,9.
Pasienten var en 43 år gammel mann, F.B.,”saloonkeeper and farmer by occupation”, fra navngitt by i Wisconsin med “strange disease known as pseudoleucaemia, or Hodgkin’s disease. That it is an infectious disease there can be no doubt, but the microbe which produces it has so far successfully eluded detection”8
Den ikke klart definerte tilstanden «pseudoleukemi» var også studert av Robert E. Kloster og patologen og lepramedisineren, prosektor Hans Peter Lie12. Deres kasuistikk publisert i 1906, med feberkurver, klarte tross obduksjonsfunn med mikroskopi av patologiske lymfeknuter, ikke å svare på om det forelå malign eller infeksiøs sykdom (’manglende funn av mikrober kan tale for malign sykdom med allmennsymptomer’).
Nicholas Senn gav ikke opplysninger


om allmennsymptomer, heller ikke detaljer om biopsifunn8. Siden Senn de facto hevdet at Hodgkins sykdom var en infeksjonssykdom, har han ikke forstått at han behandlet en malign tilstand8,9. Som tidligere rapportert postulerte også Armauer Hansen14 i 1900 at ulike kreftformer kunne være utviklet på grunnlag av «parasitter», men Armauer var neppe i tvil om at Hodgkins sykdom inngikk i kreftbegrepet han beskrev.
Heller ikke Senn gav opplysning om målvolum, kilde-hud-avstand, fraksjonering og dosering, eller omfang og varighet av akuttreaksjon av behandlingen8,9. Uten annen behandling enn röntgenbehandling var det selvfølgelig oppsiktsvekkende
med en såpass dramatisk lindring av alvorlige kliniske funn (Figur 5B og 5C). Dette var den første vellykkede utprøvende behandling mot antatt Hodgkins sykdom8. Har ikke funnet eldre oversiktspublikasjoner verken om varighet av klinisk effekt eller overlevelse ved slik röntgenbehandling av tumorbetinget lymfadenopati. Det er ikke uventet at slike tidlige behandlingseffekter ved röntgenbehandling ble forsøkt kopiert flere steder, slik som i Bergen, allerede året etter monografien til Senn1,2. Det var ved forrige århundreskifte selvfølgelig også mange andre alvorlige sykdommer, ikke bare kreft. Vi må ta til etterretning at röntgenbehandling ble utprøvd også ved andre sykdommer. Nåværende standarder for kliniske
studier var selvfølgelig ikke kjent i 1903.
I Robert E. Kloster sin monografi2 i 1906 var arbeidet til Senn i 1903 nevnt under Litteratur. Det er ukjent om Ivar A. Laastad bygde på Senn sin publikasjon som bakgrunn da han trolig var sentral for at Bergens (kommunale) sygehus kjøpte inn Walterapparatet for röntgenbehandling i 1903 eller 1904, før behandling av «leukemi» startet i 19042. Vi kan anta at Jørgen Sandberg, som både var kirurgisk overlege og direktør, samt overlege ved Medisinsk avdeling Klaus Hanssen, begge var aktive da bestillingen skjedde, men dokumentasjon om bakgrunnen for
anskaffelse av apparat for röntgenbehandling i 1904 mangler fortsatt. Selvfølgelig spekulasjon om Ivar A. Laastad ble kjent med publikasjonen til Senn fra 1903 under sin studietur, for egen kostnad, til Berlin i 19031
Ikke overraskende manglet regelverk for utprøvende behandling ved slutten av 1800-tallet da röntgenbehandling ble tatt i bruk. Helsearbeidere hadde kun medisinsk-faglige etiske retningslinjer å forholde seg til. Manglende regelverk for kliniske studier hindret heldigvis ikke den britiske skipslegen på seilskip, James Lind, allerede i 1747 å gjennomføre en klinisk studie der konklusjonen ble at sitrusfrukter (med C-vitamin) både hindret utvikling av, og effektivt reverserte skjørbuk hos sjøfolk6. Denne studien ble publisert i 1753 (Figur 6), og brukes i nåtiden for å markere Clinical Trials Day, 20. mai - www.clinicaltrialsday.org/ about. Dermed trenger vi ikke historie om fase I-IV av kliniske studier for detaljert argumentasjon om nytte av kliniske studier og evidensbasert medisin4
Særlig artiklene til Senn og Pusey fra tidlig 1900-tall kan ha vært viktige for å etablere at röntgenbehandling oppnådde objektiv klinisk respons i behandling av sykdommer som vokste i lymfeknuteområder8,9,13,15. Kan ha bidratt til tanken bak etablering av både kappefelt og omvendt Y-felt. Også kappefelt kom på banen før medikamentell behandling av malignt lymfom ble etablert. Etter 1990-tallet ble kappefelt og omvendt Y-felt gradvis faset ut22.
Utstrakt bruk av ioniserende stråling ble viktig både for diagnostikk og behandling av flere grupper kreft13
Fra starten av har det vært viktig å vise at helbredelse og livsforlengelse var mulig. Fortsatt gjenstår mye. Mange antar at nye behandlingsformer uten eller med ioniserende stråling kan bedre resultatene ytterligere i årene som kommer, og bidra til å «løse kreftens gåte(r)».
Sett tilbake var det gledelig at norske enheter med röntgenbehandling tilsynelatende prioriterte behandling av kreft i den tidlige perioden, framfor ulike benigne tilstander det kom publikasjoner om13. Selvfølgelig var det strålebehandling av benigne tilstander også i Norge, men lite publikasjoner13. Erindrer fra min tid som konstituert ved Terapiseksjonen ved Røntgenavdelingen, Rikshospitalet omkring 1990 at vi brukte hypofraksjonert kV-behandling mot tidligere skjeggområder i ansiktet til personer som hadde gjennomgått kjønnsskifte fra mann til kvinne. Ikke alle var fornøyde. Behandlingsformen gav neppe mest yrkesmessig klinikertilfredshet i min tid som onkolog.
Erratum: Ivar Amandus Laastad (1866-1921)1, grunnlegger av röntgenbehandling i Bergen i 1904, var født i Luster, ikke i Lindås.
Takk til Christine Tarlebø Mjøs, UBBmed..
Referanser:
Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no

Cabometyx «kabozantinib» filmdrasjerte tabletter. Reseptgruppe C. Indikasjoner: Voksne: Som monoterapi ved behandling av avansert nyrecellekarsinom (RCC) som førstelinjebehandling ved intermediær eller dårlig prognose, og/eller etter tidligere vaskulær endotelvekstfaktor (VEGF)-rettet behandling. I kombinasjon med nivolumab til førstelinjebehandling av avansert RCC. Som monoterapi ved behandling av hepatocellulært karsinom (HCC) etter tidligere sorafenibbehandling. Som monoterapi ved behandling av lokalt avansert eller metastatisk differensiert tyreoideakarsinom (DTC) hos voksne, som er refraktære eller ikke kvalifisert for behandling med radioaktivt jod og har progrediert under eller etter tidligere systemisk behandling. Dosering: Monoterapi: 60 mg 1 gang daglig. Bør fortsettes så lenge klinisk nytte sees eller til uakseptabel toksisitet. Kombinasjon med nivolumab: 40 mg 1 gang daglig i kombinasjon med nivolumab i.v. enten 240 mg hver 2. uke eller 480 mg hver 4. uke. Behandling fortsettes inntil sykdomsprogresjon eller uakseptabel toksisitet. Se SPC for dosering av nivolumab. Dosejustering: Midlertidig avbrudd og/eller dosereduksjon kan være påkrevd ved mistenkte bivirkninger. Ved monoterapi anbefales først reduksjon til 40 mg/dag, og deretter til 20 mg/dag. I kombinasjon med nivolumab anbefales først reduksjon til 20 mg/dag og deretter til 20 mg annenhver dag. Behandlingsavbrudd anbefales ved CTCAE grad ≥ 3 eller uakseptabel grad 2-toksisitet og ved ALAT/ASAT >3 x ULN, men ≤10 x ULN, uten samtidig total bilirubin ≥ 2 x ULN. Ved nedgang til grad ≤1 kan behandling gjenopptas med redusert dose. Spesielle pasientgrupper: Ikke anbefalt ved alvorlig nedsatt leverfunksjon (Child-Pugh C). Ikke anbefalt ved alvorlig nedsatt nyrefunksjon. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Forsiktighetsregler: Hepatotoksisitet: Unormale leverfunksjonstester er hyppig sett. Leverfunksjonstester anbefales før behandlingsstart, samt nøye regelmessig overvåkning under behandling. Ved forverrede leverfunksjonstester bør anbefalte doseendringer følges. Sjeldne tilfeller av vanishing bile ductsyndrom er sett. Immunologiske sjekkpunkthemmere ble gitt, enten før eller samtidig med kabozantinib i alle tilfeller. Leverencefalopati: Overvåkning anbefales for tegn/symptomer på leverencefalopati. Perforeringer og fistler: Alvorlige GIperforeringer og fistler, av og til fatale, er sett. Bør seponeres ved gastrointestinal perforasjon eller fistler som ikke lar seg behandle adekvat. Gastrointestinale sykdommer: Diaré, kvalme/oppkast, nedsatt appetitt og stomatitt/smerter i munnen er vanlige GIhendelser. Rask behandling, inkl. støttebehandling bør innføres. Behandlingsavbrudd, dosereduksjon eller permanent seponering bør vurderes ved vedvarende eller gjentatte signifikante GI-bivirkninger. Tromboemboliske hendelser: Venøs og arteriell tromboembolisme (inkl. fatal) er sett. Brukes med forsiktighet ved risiko for, eller tidligere tromboembolisme. Pasienter med tidligere infiltrasjon til portvene har høyere risiko for portvenetrombose. Bør seponeres ved utvikling av akutt myokardinfarkt eller klinisk signifikante tromboemboliske komplikasjoner. Blødning: Alvorlige blødninger (inkl. fatale) er sett. Ved tidligere alvorlige blødninger bør pasienten vurderes nøye før behandlingsstart. Bør ikke gis ved alvorlig blødning eller risiko for dette. Aneurismer og arteriedisseksjoner: Kan fremme dannelsen av aneurismer og/eller arteriedisseksjoner. Før oppstart bør risikoen vurderes nøye ved risikofaktorer som hypertensjon eller aneurisme i anamnesen. Trombocytopeni: Er sett. Blodplatenivå bør overvåkes under behandling, og dose endres iht. alvorlighetsgrad av trombocytopeni. Komplikasjoner med sårtilheling: Er sett. Behandling bør stoppes minst 28 dager før planlagt kirurgi hvis mulig. Beslutning om å gjenoppta behandlingen bør baseres på vurdering av sårtilheling. Bør seponeres ved sårtilhelingskomplikasjoner som krever medisinsk intervensjon. Hypertensjon (inkl. hypertensiv krise): Er sett. Blodtrykk bør være velkontrollert før oppstart. Blodtrykket skal overvåkes tidlig og regelmessig, og egnet antihypertensiv behandling gis etter behov. Ved vedvarende hypertensjon til tross for antihypertensiv behandling, bør kabozantinibdosen midlertidig seponeres til blodtrykket er under kontroll. Deretter kan kabozantinib gjenopptas med redusert dose. Bør seponeres ved alvorlig og vedvarende hypertensjon, til tross for antihypertensiv behandling og reduksjon i kabozantinibdosen, samt ved hypertensiv krise. Kjeveosteonekrose (ONJ): Er sett. Munnhuleundersøkelse bør utføres før og med jevne mellomrom under behandling. Behandling bør om mulig stoppes minst 28 dager før planlagt dentalkirurgi/invasiv tannbehandling. Forsiktighet utvises ved bruk av legemidler forbundet med ONJ, f.eks. bisfosfonater. Seponeres ved ONJ. Palmar plantar erytrodysestisyndrom (PPES): Er sett. Ved alvorlig PPES bør det vurderes å avbryte behandlingen. Kan gjenopptas med lavere dose når PPES er gått tilbake til grad 1. Proteinuri: Er sett. Urinprotein bør måles regelmessig under behandling. Bør seponeres ved utvikling av nefrotisk syndrom. Posterior reversibelt encefalopati-syndrom (PRES): Er sett. Behandlingen bør seponeres ved PRES. Forlenget QT-intervall: Brukes med forsiktighet ved tidligere QT-forlengelse, ved bruk av antiarytmika eller ved relevant eksisterende hjertesykdom, bradykardi eller elektrolyttforstyrrelser. Regelmessig EKG-overvåkning og elektrolyttmåling bør vurderes. Tyreoideadysfunksjon: Måling av tyreoideafunksjonen anbefales ved baseline, samt nøye overvåkning for tegn/symptomer under hele behanlingen. Behandling iht. vanlig medisinsk praksis. Unormale biokjemiske laboratorietester: Økt forekomst av elektrolyttforstyrrelser er sett og tilfeller av leverencefalopati ved HCC kan tilskrives dette. Hyppigere frekvens og/eller økt alvorlighetsgrad av hypokalsemi, inkl. grad 3 og 4, er sett hos pasienter med tyreoideakarsinom sammenlignet med pasienter med andre krefttyper. Overvåkning av biokjemiske parametre anbefales. Behandlingsavbrudd, dosereduksjon eller permanent seponering bør vurderes ved vedvarende eller gjentatte signifikante avvik. Graviditet, amming og fertilitet: Graviditet: Skal ikke brukes under graviditet, hvis ikke klinisk tilstand nødvendiggjør behandling. Amming: Skal opphøre under og i minst 4 måneder etter endt behandling. Fertilitet: Kan reduseres. Bivirkninger: Monoterapi: Svært vanlige: anemi, trombocytopeni, hypotyreoidisme, abdominalsmerter, diaré, dyspepsi, forstoppelse, kvalme, oppkast, stomatitt, asteni, fatigue, mukositt, perifert ødem, palmarplantar erytrodysestesisyndrom, utslett, blødning (inkl. epistakse), hypertensjon, dysfoni, dyspné, hoste, smerter i ekstremitet, dysgeusi, hodepine, svimmelhet, hypoalbuminemi, hypokalemi, hypomagnesemi, redusert appetitt, redusert vekt, økt ALAT, økt ASAT. Vanlige: lymfopeni, nøytropeni, dysfagi, fistel, gastrointestinal perforasjon, gastroøsofageal reflukssykdom, hemoroider, munnsmerter, munntørrhet, pankreatitt, akneiform dermatitt, alopesi, endret hårfarge, erytem, hyperkeratose, kløe, tørr hud, abscess, venetrombose (alle former, inkl. dyp venetrombose), hepatisk encefalopati, lungeembolisme, artralgi, muskelkramper, perifer nevropati (inkl. polynevropati; perifer nevropati er hovedsakelig sensorisk), proteinuri, dehydrering, hyperbilirubinemi, hyperglykemi, hyperkalemi, hypofosfatemi, hypoglykemi, hypokalsemi, hyponatremi, økt ALP, økt amylase, økt kolesterol, økt kreatinin, økt lipase, økte triglyserider, økt γ -GT, tinnitus. Mindre vanlige: Akutt hjerteinfarkt, arteriell trombose, arteriell embolisme, glossodyni, pneumothorax, posterior reversibelt encefalopatisyndrom, sårkomplikasjon (nedsatt sårheling, snittlinjekomplikasjoner og sår som åpner seg). Ukjent: Aneurisme, arteriedisseksjon, hudvaskulitt. Kombinasjon med nivolumab: Svært vanlige: hypertyreoidisme, hypotyreoidisme, abdominalsmerter, diaré, dyspepsi, forstoppelse, kvalme, oppkast, stomatitt, fatigue, feber, ødem, kløe, palmar-plantar erytrodysestesisyndrom, utslett, øvre luftveisinfeksjon, hypertensjon, dysfoni, dyspné, hoste, artralgi, muskel-skjelettsmerter, muskelkramper, dysgeusi, hodepine, svimmelhet, proteinuri, redusert appetitt, anemi, hyperglykemi, hyperkalemi, hyperkalsemi, hypermagnesemi, hypernatremi, hypofosfatemi, hypoglykemi, hypokalemi, hypokalsemi, hypomagnesemi, hyponatremi leukopeni, lymfopeni, nøytropeni, redusert vekt, trombocytopeni, økt ALAT, økt ALP, økt ASAT, økt amylase, økt kreatinin, økt lipase, økt totalbilirubin. Vanlige: eosinofili, binyreinsuffisiens, gastritt, hemoroider, kolitt, munnsmerter, munntørrhet, brystsmerte, smerte, atrieflimmer, takykardi, alopesi, endret hårfarge, erytem, tørr hud, overfølsomhet (inkl. anafylaktisk reaksjon), pneumoni, trombose, hepatitt, epistakse, lungeembolisme, pleuraeffusjon, pneumonitt, artritt, perifer nevropati, akutt nyreskade, nyresvikt, dehydrering, økt kolesterol, økte triglyserider, tinnitus, tørre øyne, tåkesyn. Mindre vanlige: Pneumothorax, arteriell embolisme. Ukjent: Hudvaskulitt, vanishing bile duct-syndrom. For mer informasjon, se Felleskatalogen eller preparatomtalen (SPC). Innehaver av markedsføringstillatelse: Ipsen Pharma, 65 quai Georges Gorse, 92100 BoulogneBillancourt, Frankrike. Tlf.: 00 46 8 451 60 00. E-post: info.se@ipsen.com. Basert på SPC godkjent av SLV: 19.06.2023. Pakninger og priser per 15.08.2023: 20 mg: 30 stk. (boks) kr 72522,60. 40 mg: 30 stk. (boks) kr 72522,60. 60 mg: 30 stk. (boks) kr 72522,60. (priser og ev. refusjon oppdateres hver 14. dag). Refusjon: H-resept: Refusjonsberettiget bruk: Rekvirering skal gjøres i tråd med nasjonale handlingsprogrammer for kreft og føringer fra RHF/LIS spesialistgruppe. Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist. Dato: 15.08.2023.


Superior efficacy (OS, PFS, ORR)* vs. sunitinib demonstrated in a population reflective of real-life practice.1-6
14 months mOS gain versus sunitinib and an early separation of the Kaplan-Meier curve, sustained over time. 6
* mOS: 49.5 vs 35.5 mo p<0.0001 mPFS: 16.6 vs 8.4 mo p<0.0001 ORR: 56
Indikasjoner

A well-understood tolerability profile and a low rate of AE-related discontinuations (7% both CABOMETYX® and nivolumab).1,2,5,6
Optimised CABOMETYX® dosing, easily adjusted to meet patients’ needs. 5
Voksne: CABOMETYX® er indisert som monoterapi ved avansert nyrecellekarsinom – som førstelinjebehandling av voksne pasienter med intermediær eller dårlig prognose, og/eller etter tidligere vaskulær endotelvekstfaktor (VEGF)-rettet behandling. I kombinasjon med nivolumab til førstelinjebehandling av avansert nyrecellekarsinom.
6. Burotto M, et al. Presented at CITIM Conference; TK, Hall JP, et al. Future Oncol. 2020; 16: 3045–3060. 5. April 24–27, 2023; Vilnius, Lithuania.
Institut Produits Synthèse (IPSEN) AB, Färögatan 33, SE-164 51 Kista, Sweden

POSITIVE-studien har hatt som mål å undersøke om det er trygt for pasienter å ta en pause fra adjuvant endokrin behandling for å prøve å bli gravide. Dette er en internasjonal studie (IBCSG 48-14/BIG 8-13/ Alliance A221405: POSITIVE Trial) som Norsk Bryst Cancer Gruppe (NBCG) har deltatt i, og studien har mottatt støtte fra Rosa Sløyfe og Brystkreftforeningen. De første resultatene av studien ble publisert i New England Journal of Medicine i mai 2023 (1). Hva har vi lært så langt fra denne viktige studien?
 ANNA SÆTERSDAL
ANNA SÆTERSDAL
Overlege
Avdeling for Kreftbehandling, Oslo Universitetssykehus
INNLEDNING
Brystkreft er den vanligste kreftformen for kvinner under 40 år. For disse pasientene er bevaring av fertilitet og mulighet til å få barn etter kreftbehandlingen meget viktig. Noen av kvinnene vil derfor foreta behandlingsvalg ut fra hvilken behandling som vil gi størst mulighet til å få barn. I de siste dekadene har mors alder ved fødsel av første barn steget i Norge og andre vestlige land. I Norge er nå gjennomsnittsalderen for første barn 30,2 år. Dette er en viktig grunn til at mange unge kvinner som får brystkreft ikke har startet å få barn eller fått alle barna de ønsker seg. Retrospektive studier har tidligere vist at det er trygt å gjennomgå graviditet etter brystkreftbehandling. Likevel kan resultatene fra de retrospektive studiene være farget av det vi kaller «healthy mother effect», der det bare er de friskeste brystkreftoverleverne som prøver å oppnå graviditet. Vi anbefaler nå 5-10 års adjuvant endokrin behandling for kvinner som har hormonreseptorpositiv brystkreft. I løpet av disse årene er graviditet kontraindisert. Ovarialreserven vil synke med økende alder slik at muligheten å få barn etter endokrin behandling ofte er liten.
POSITIVE (Pregnancy Outcome and Safety of Interrupting Therapy for Women with Endocrine Responsive Breast Cancer)-studien ble designet for å forsøke å besvare spørsmålet om det er trygt for
premenopausale kvinner med endokrinfølsom brystkreft å gjøre et avbrudd i den endokrine behandling for å prøve å bli gravide. Studien er en enarmet prospektiv studie. Studiepopulasjonen blir sammenlignet med kvinner som var inkludert i to andre, store studier om endokrin behandling; SOFT og TEXT. Disse studiene så på effekt av ovarial suppresjon som endokrin behandling i tillegg til medikasjon med antiøstrogen eller aromatasehemmer. Studiepopulasjonene i disse to studiene er lik som de kvinnene som ble inkludert i POSITIVE-studien og dermed matchet for analysen.
POSITIVE STUDIEPOPULASJONEN OG STUDIEDESIGN
Studien inkluderte 518 kvinner med brystkreft stadium I - III mellom 18 og 42 år, som hadde brukt adjuvant endokrin behandling i 18-30 måneder og som ønsket seg barn. I alt 116 sentra i 20 land verden over deltok. I Norge hadde vi et senter ved OUS, Radiumhospitalet som deltok. Kvinner fra hele landet ble rekruttert inn i studien.
Etter inklusjon i studien ble hormonbehandlingen stoppet. Etter det fulgte en utvaskingsperiode på 3 måneder før deltakeren kunne prøve å bli gravid. Avbruddet i hormonbehandlingen skulle vare i inntil 2 år. Om ikke graviditet ble oppnådd innen ett år ble pasienten henvist til en fertilitets-
vurdering. IVF behandling var tillatt. Amming var ønsket. Etter avbruddet ble den endokrine behandlingen gjenopptatt og fullført som planlagt.
I Norge inkluderte vi 25 pasienter. Radiumhospitalet er dermed det enkeltsenteret i studien som inkluderte flest deltakere.
Totalt ble det i studien, fra desember 2014 til desember 2019, inkludert 518 pasienter hvorav 516 var tilgjengelig for analyse. Ved tidspunkt for analysen var median oppfølgingstid 41 måneder (3,4 år). Median tid fra brystkreftdiagnosen til inklusjon i studien var 29 måneder. Median alder var 37 år (27-43), og 34,3 % av pasientene var under 35 år. De fleste pasientene hadde brystkreft stadium I eller II. I alt 29,3 % hadde spredning til 1-3 lymfeknuter i aksillen og 4,5 % hadde spredning til 4-9 lymfeknuter. Kjemoterapi hadde blitt gitt til 62% av pasientene.
Etter en oppfølgingstid på 3,4 år fikk 44 pasienter i studiepopulasjonen en brystkrefthendelse. Dette ligger under den pre-spesifiserte sikkerhetsterskelen som var beregnet til 46 hendelser. Treårs-insidensen av brystkrefthendelser var 8,9 % i Positive studiepopulasjonen mot 9,2% i den eksterne kontrollkohorten. Det var 22 kvinner (4,5%) i POSITIVE kohorten som fikk metastatisk sykdom sammenlignet med 5,8% i kontroll kohorten. I alt 41 av de 368 kvinnene (11,1%) som oppnådde minst en graviditet, rapporterte minst én svangerskapskomplikasjon. De vanligste komplikasjonene var hypertensjon eller preeklampsi (3,8%), diabetes mellitus (2,4%) og placenta abnormaliteter (1,6%).
Vi fikk opplysninger om graviditetsstatus fra 497 pasienter. Av disse ble 74% gravide minst én gang i løpet av studien. Alder var den eneste faktoren man fant som predikerte sannsynlighet for graviditet. Det var i alt 85,7 % av kvinner under 35 år som ble gravide. Av disse var 76 % mellom 35 og 39 år og 52,7% av kvinnene var mellom 40 og 42 år. Det var 43,3 % av kvinnene som mottok assistert befruktning. Ved analysetidspunktet hadde 317 kvinner født minst ett barn, dvs 63,8 %. Av 507 graviditeter, førte 350 fram til fødsel med i alt 365 fødte barn (dvs 335 enkeltfødsler og 25 tvillingpar). Amming ble gjort av 61% av kvinnene som hadde født.
Blant de 415 pasientene som var sykdomsfrie etter 2 år, hadde 73,3% gjenopptatt den endokrine behandling. Av de 111 kvinnene som ikke hadde gjenopptatt den endokrine behandling, var noen gravide. Andre forsøkte å bli gravide for andre gang eller var i gang med amming. I alt 15,4 % av de pasientene som skulle ha startet endokrin behandling hadde ikke gjort det etter 48 måneder.
POSITIVE-studien er den første prospektive studien som undersøker om det er trygt å ta et avbrudd i hormonbehandlingen for å forsøke å få barn blant unge kvinner som har gjennomgått hormonfølsom brystkreft. Antallet som fikk lokalt residiv eller metastastisk sykdom var likt som i den matchede kontrollgruppen. Bare 15,4 % av kvinnene unnlot å gjenoppta endokrin behandling. Det er omtrent samme andel som sluttet å ta endokrin
behandling i den eksterne kontrollgruppen (SOFT og TEXT kohortene).
Tidligere studier har vist at graviditet etter brystkreftbehandling kan gi økt risiko for keisersnitt, for tidlig fødsel og lavere fødselsvekt. Tidspunktet for graviditet synes avgjørende. Kvinner som blir gravide innen 1 år etter avsluttet kjemoterapi har høyere risiko for tidlig fødsel sammenlignet med dem som blir gravide mer enn 1 år etter avsluttet behandling. I POSITIVEstudien ble kvinner inkludert minst 18 måneder etter start av kjemoterapi. Dette er trolig én grunn til at forekomst av svangerskapskomplikasjoner i studien var like høy som blant kvinner i samme alder som ikke har hatt brystkreft.
Den viktigste begrensningen i studien er den korte oppfølgingstiden, som var på 3,4 år. Vi må vente på 10 års oppfølgingsdata for med større grad av sikkerhet kunne si at et avbrudd i hormonbehandlingen er trygt, særlig fordi hormonreseptorpositiv brystkreft har en vedvarende risiko for tilbakefall.
KONKLUSJON
Til tross for noen begrensninger er POSITIVE-studien den første prospektive studien som gir grunnlag for å si at et avbrudd i adjuvant endokrin behandling for å få barn synes trygt. Å få barn er viktig for unge kvinner. POSITIVE-studien hjelper oss kreftleger til bedre å veilede unge brystkreftpasienter med hormonreseptorpositiv sykdom som ønsker å få barn.
Referanser:
1. Interrupting Endocrine Therapy to Attempt Pregnancy after Breast Cancer. Partridge AH et al. N Engl J Med. 2023 May 4; 388(18):1645-1656.a
Hepatisk intraarteriell kjemoterapi ved kolorektale levermetastaser og intrahepatisk kolangiokarsinom

TOR MAGNUS SMEDMAN
Overlege
Seksjon for gastrointestinal onkologi
Avdeling for kreftbehandling
Oslo Universitetssykehus
ANNE M. LONGVA
Legespesialist
Seksjon for HPB kirurgi
Avdeling for gastro-og barnekirurgi
Oslo Universitetssykehus
KRISTOFFER LASSEN
Overlege/seksjonsleder
Seksjon for HPB kirurgi
Avdeling for gastro-og barnekirurgi
Oslo Universitetssykehus
Hepatisk intraarteriell kjemoterapi (Hepatic Arterial Infusion/HAI) har gjennom flere tiår vært et etablert behandlingstilbud ved sentre i USA for pasienter med kolorektale levermetastaser (CRLM). Flere studier har vist gunstig effekt, men publikasjonene stammer fra noen få miljøer og det mangler randomiserte data. Behandlingen har så langt ikke fått fotfeste i Europa. Imidlertid har det de siste årene vært økende interesse for intraarteriell kjemoterapi, både i USA og Europa. I 2021 ble det startet en randomisert kontrollert studie ved Rikshospitalet, Excalibur (EXtended CriteriA treatment for LIver metastases with heavy tumour BURden), som blant annet skal undersøke effekten av HAI hos pasienter med CRLM med høy tumorbyrde. I løpet av 2024 er det planlagt oppstart av en studie for pasienter med ikke-resektabelt intrahepatisk kolangiokarsinom (TOMCAT).
Leveren er det organet med hyppigst forekommende fjernspredning fra kolorektal kreft [1]. Rundt halvparten av pasienter med kolorektal kreft har levermetastaser på diagnosetidspunktet, eller vil i løpet av sykdomsforløpet utvikle dette. Leverreseksjon er ansett som den
eneste etablerte behandlingsmodaliteten med kurativt potensial. Ved diagnosetidspunkt er imidlertid 75-80% av pasientene ikke-resektable, enten på grunn av for omfattende tumorutbredelse i leveren eller på grunn av ekstrahepatisk sykdom.
Ved utbredt metastasering i leveren behandler man ofte med systemisk kjemoterapi med mål om å oppnå resektabilitet, noe som oppnås hos et begrenset antall (22-57 %) [2]. Det er imidlertid usikkerhet knyttet til disse tallene, da det er stor variasjon i hva som initialt vurderes som ikke-resektabel sykdom. 5-års totaloverlevelse (OS) etter leverreseksjon varierer fra 25-50 % og er avhengig av en rekke faktorer, som inkluderer CEA, KRAS/BRAF status, antall/størrelse på lesjoner og synkron/ metakron sykdom. Hos pasienter hvor man ikke oppnår resektabilitet vil behandlingen bestå av palliativ kjemoterapi, med en forventet 5-års OS på 10-15 % [3,4].
Hepatisk intraarteriell kjemoterapi er en behandling hvor kjemoterapi gis direkte inn i leverarterien via en subkutan pumpe. Det anatomiske rasjonale bak intraarteriell kjemoterapi i lever er at leversvulster nesten utelukkende får sin blodforsyning via leverarterien, og i svært liten grad via portvenen (vena portae). Floxuridin (FUDR) er det
best studerte og foretrukne kjemoterapeutiske middelet som brukes i HAI-behandling grunnet stoffets gunstige farmakokinetiske egenskaper. FUDR har ca. 95 % førstepassasjemetabolisme i leveren og rask utskillelse, noe som muliggjør opptil 400 ganger høyere dose til leveren sammenlignet med konvensjonell systemisk kjemoterapi. På grunn av høy grad av metabolisering i leveren når svært lite FUDR systemisk sirkulasjon, og gir derfor minimalt med systemiske bivirkninger.
Ved Rikshospitalet implanteres HAI-pumpe med en åpen operasjon (laparotomi). HAI-pumpen plasseres subkutant i nedre kvadrant av buken, fortrinnsvis på pasientens venstre side. Et kateter fra pumpen trekkes gjennom fascien og inn i bukhulen hvor kateteret plasseres i arteria gastroduodenalis ved innmunningen til leverarterien (Fig. 1). Kirurgisk implantasjon av HAI-pumpe innebærer lav risiko for komplikasjoner, hvor de vanligste komplikasjonene er sårinfeksjon og blødning. Pasienten er inneliggende på avdelingen i 3-6 dager for postoperativ behandling. Før utskrivelse blir pumpefunksjonen testet ved kontrastinjeksjon og angiografi som bekrefter arterieanatomi, bilobær distribusjon og fravær av kontrastovergang til nærliggende organ via mindre arterier. I tillegg utføres en scintigrafi for å utelukke ekstrahepatisk perfusjon. Implantasjon av HAI-pumpe krever at pasienten må ha opphold fra kjemoterapi-behandling i minimum 3 uker preoperativt og 2 uker postoperativt.
Hos pasienter med ikke-resektable
CRLM kan HAI-behandling kombineres med systemisk kjemoterapi med mål om å oppnå resektabel sykdom, og potensielt kurasjon. HAI-behandling
kan i tillegg øke totaloverlevelse hos pasienter som ikke oppnår resektabel sykdom. Memorial Sloan Kettering Cancer Center (MSKCC) i New York har utviklet metoden og har flere tiårs erfaring med HAI-behandling.
En studie fra 2006, som randomiserte 135 pasienter med ikke-resektable CRLM til systemisk kjemoterapi (FLV) versus HAI fant man signifikant økt OS i HAI-armen (24 versus 20 måneder), men tid til ekstrahepatisk progresjon var signifikant kortere i HAI-armen, noe som har ført til at man nå alltid gir systemisk kjemoterapi sammen med HAI [7]. En senere fase II-studie fra MSKCC undersøkte HAI sammen med mer moderne kjemoterapi-regimer hos 49 pasienter med ikke-resektable CRLM [8]. Majoriteten av pasientene i denne studien var tidligere behandlet
og hadde median 14 metastaser i leveren. Man fant i denne studien objektiv responsrate på 76 % og oppnådde reseksjon hos 47 % av pasientene median 6 måneder fra behandlingsstart.
Den samme gruppen fra MSKCC publiserte i 2023 en artikkel med retrospektive data som så på 58 kjemoterapi-naive pasienter med ikkeresektable CRLM [9]. Fire pasienter (7 %) oppnådde langvarig komplett respons og man oppnådde reseksjon hos 55 %. Samlet hadde disse pasientene en 5-års OS på 72 %, noe som er imponerende, også sammenliknet med primært resektable CRLM.
På tross av at flere observasjonelle studier har vist gunstig effekt, er det enighet om at det er behov for randomiserte data før man kan konkluderer
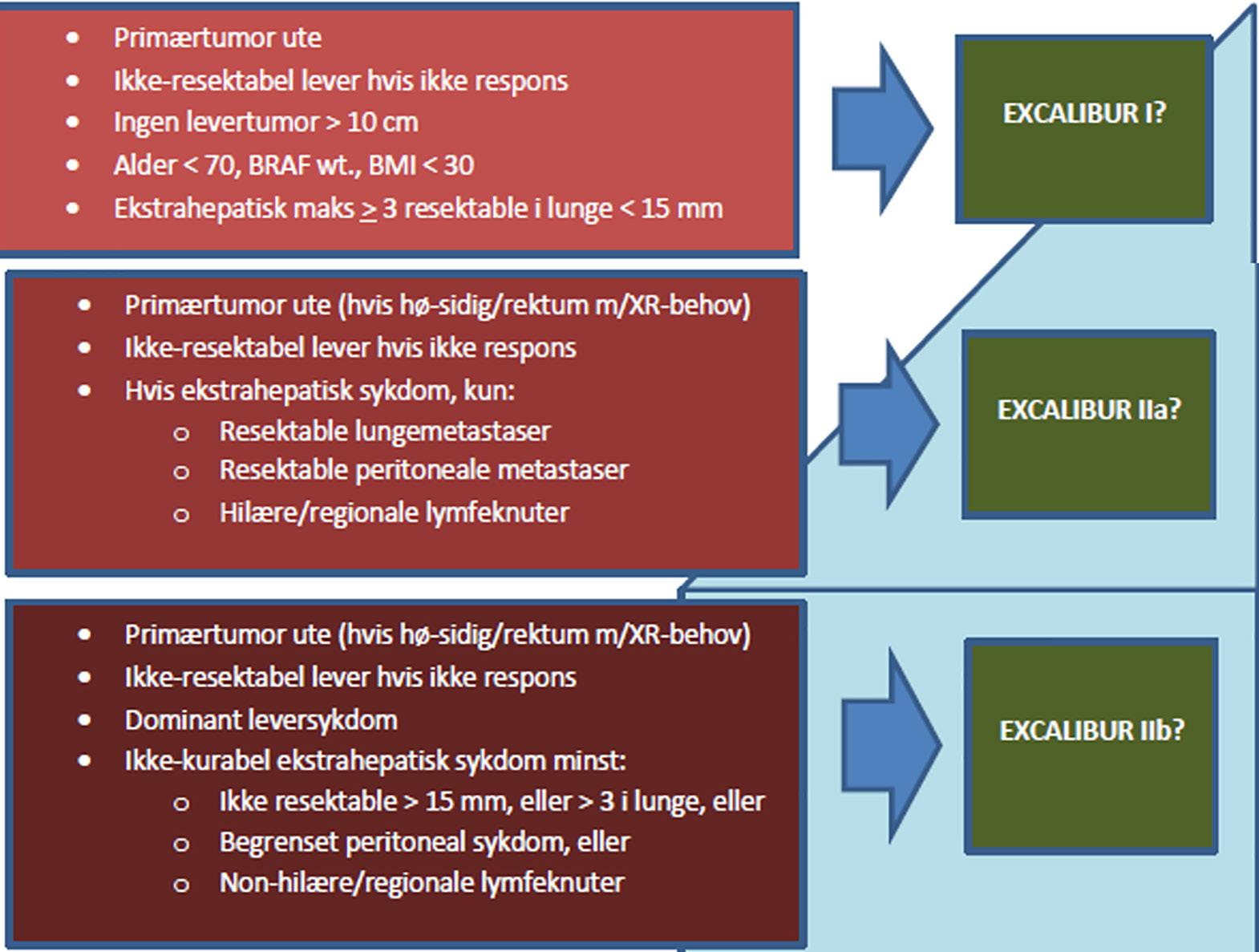
om nytten av HAI. Det er ikke utført randomiserte studier som undersøker HAI sammen med moderne systemisk kjemoterapi mot moderne systemisk kjemoterapi alene. Dette er bakgrunnen for oppstart av Excalibur studien i 2021. Det er i tillegg nylig startet en stor multisenter randomisert kontrollert studie i USA, som er tilsvarende Excalibur-II studien [10].
Den mest alvorlige langtidskomplikasjonen til behandling med intrarteriell hepatisk floxuridine er galleveistoksisitet. Biliær toksisitet kan resultere i alt fra lett forbigående stigning i lever/ galleprøver til irreversible skader i galleveier. I sin mest alvorlige form kan det medføre skleroserende kolangitt med typisk strikturdannelse i ekstrahepatiske galleveier. Ved alvorlig toksisitet seponeres behandling og det startes behandling med deksametason adminstrert i HAI-pumpen og peroral ursodeoksykolsyre (Ursofalk). I alvorlige tilfeller kan det være behov for ERCP med blokking og stenting for å sikre galledrenasjen. I internasjonale studier angis insidensen av biliær sklerose på ca. 5 % [11]. Det er derfor
essensielt at pasientens lever- og galleprøver følges tett under behandlingen og at det er stor grad av kompetanse og årvåkenhet blant behandlere.
Excalibur-studien utgår fra HPBavdelingen ved Rikshospitalet i Oslo og er en randomisert kontrollert studie inndelt i Excalibur 1 og 2 (Fig. 2). Studien inkluderer pasienter med ikke-resektable CRLM hvor det er behov for linjebytte grunnet progresjon eller toksisitet. I Excalibur 1 randomiseres pasientene mellom tre ulike armer: neste linje kjemoterapi og levertransplantasjon eller neste linjes kjemoterapi og HAI-pumpe eller neste linje kjemoterapi alene (standard behandling). Inklusjon i Excalibur 1 krever at primærtumor er fjernet og pasienten har begrenset ekstrahepatisk sykdom; det aksepteres maksimalt tre resektable lungemetastaser under 15 mm. I Excalibur 2 aksepteres pasienter med noe mer ekstrahepatisk sykdom. Pasienter med venstresidig koloncancer eller rectumcancer uten behov for preoperativ strålebehandling, kan inkluderes med primærtumor in situ. Excalibur-2-studien er nylig blitt
utvidet med en protokoll hvor det ikke er krav om indikasjon for linjebytte (Excalibur IIc). I denne protokollen inkluderes pasienter med CRLM med stor tumorbyrde med respons på inneværende kjemoterapi-linje, men hvor det vurderes lite sannsynlig at man oppnår resektabilitet.
Excalibur-studien har løpende inklusjon. Pasienter som ønskes vurdert for studien kan henvises til MDT (“levermøtet”) ved HBP avdelingen ved Rikshospitalet. Det er ønskelig at henvisende lege tar kontakt med studiepersonell direkte for raskere vurdering. Studien er pågående og forventes ferdig inkludert i løpet av 2024. Totalt skal studien inkludere 45 pasienter.
Mer informasjon om studien finnes på på https://excaliburstudy.com/
I løpet av første halvdel av 2024 planlegges oppstart av den kliniske studien TOMCAT (trans-arterial treatment modalities for intra-hepatic cholangiocarcinoma not amenable to resection) ved Rikshospitalet. Studien inkluderer pasienter med intrahepatisk kolangiokarsinom som er vurdert som ikke-resektable. TOMCAT er en ikke-randomisert, to-kohortstudie hvor pasienter blir fordelt mellom to ulike intervensjonsarmer i tillegg til systemisk (konvensjonell) kjemoterapi (GemOx): enten HAI eller SIRT (selektiv internal radiation therapy). Pasienter blir hovedsakelig selektert basert på tumor-karakteristika. Primært endepunkt er median overlevelsestid.
Referanser:
Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no


Nubeqa (darolutamid) er førstevalg ved behandling av menn med nmCRPC, som har høy risiko for å utvikle metastatisk sykdom.
Sykehusinnkjøp. Anbefalinger for onkologiske og kolonstimulerende legemidler. Juni 2021.
død med >30 %*1
NUBEQAs sikkerhetsprofil er sammenlignbar med ADT-behandling alene.1 Se felleskatalogteksten under for mer informasjon.
*mHSPC: Den primære analysen av total overlevelse i ARASENS ble utført etter at 533 pasienter var døde (229 (35,2 %) i darolutamidgruppen og 304 pasienter (46,5 %) i ADT-gruppen (placebogruppen)). HR 0,68; 95 % CI 0,57-0,80; P<0,001. nmCRPC: Det primære effektmålet I ARAMIS var metastasefri overlevelse (darolutamid 40,4 måneder vs placebo 18,4 måneder; HR:0,41; 95% CI: 0,34-0,50; P<0,001) og total overlevelse var et sekundært effektmål (HR: 0,69; 95 % Cl: 0,53-0,88; P<0,001). Sluttanalysen av overlevelsesdataene ble utført etter at 254 pasienter var døde (148 (15 %) i darolutamid + ADT-gruppen og 106 (19 %) i ADT-gruppen (placebogruppen).
1. NUBEQA SPC 02/2023.



Overfølsomhet for virkestoffet eller noen av hjelpestoffene (laktose). Kvinner som er eller kan bli gravide. Forsiktighetsregler: Pasienter med alvorlig nedsatt nyrefunksjon eller moderat/alvorlig nedsatt leverfunksjon skal overvåkes nøye mht. bivirkninger pga. forhøyet eksponering. Hjerte/kar: Sikkerhet er ikke fastslått ved kardiovaskulær sykdom de siste 6 månedene. Ved forskrivning skal
skal fortsette under behandling hos pasienter som ikke er kirurgisk kastrert. Kontraindikasjoner: Overfølsomhet for virkestoffet eller noen av hjelpestoffene (laktose). Kvinner som er eller kan bli gravide. Forsiktighetsregler: Pasienter med alvorlig nedsatt nyrefunksjon eller moderat/alvorlig nedsatt leverfunksjon skal overvåkes nøye mht. bivirkninger pga. forhøyet eksponering. Hjerte/kar: Sikkerhet er ikke fastslått ved kardiovaskulær sykdom de siste 6 månedene. Ved forskrivning skal
NUBEQA® (darolutamid) 300 mg filmdrasjerte tabletter. ATC-nr: L02B B06. Indikasjoner: NUBEQA er en androgenreseptorhemmer indisert til behandling av voksne menn med: 1. ikkemetastatisk, kastrasjonsresistent prostatakreft (nmCRPC), som har høy risiko for å utvikle metastatisk sykdom; 2. metastatisk hormonfølsom prostatakreft (mHSPC) i kombinasjon med docetaxel og androgen deprivasjonsbehandling. Dosering: Anbefalt dose er 600 mg (2 tabletter à 300 mg) 2 ganger daglig, tilsv. total daglig dose 1200 mg. Medisinsk kastrasjon med GnRH-analog skal fortsette under behandling hos pasienter som ikke er kirurgisk kastrert. Kontraindikasjoner: Overfølsomhet for virkestoffet eller noen av hjelpestoffene (laktose). Kvinner som er eller kan bli gravide. Forsiktighetsregler: Pasienter med alvorlig nedsatt nyrefunksjon eller moderat/alvorlig nedsatt leverfunksjon skal overvåkes nøye mht. bivirkninger pga. forhøyet eksponering. Hjerte/kar: Sikkerhet er ikke fastslått ved kardiovaskulær sykdom de siste 6 månedene. Ved forskrivning skal
2023.
pasienter med klinisk signifikant kardiovaskulær sykdom behandles for disse tilstandene iht. fastsatte retningslinjer. Ved risikofaktorer for QT-forlengelse i anamnesen og ved samtidig bruk av legemidler som kan forlenge QT-intervallet, skal nytte-/risikoforholdet vurderes, inkl. potensialet for torsades de pointes, før oppstart med darolutamid. Pasienter skal overvåkes med hensyn til bivirkninger av BCRP-, OATP1B1- og OATP1B3 substrater, fordi samtidig administrering av darolutamid kan øke plasmakonsentrasjonen av disse substratene. Samtidig administrering av rosuvastatin bør unngås, med mindre det ikke finnes andre behandlingsalternativer. I tilfelle forhøyede levertransaminaser som tyder på idiosynkratisk legemiddelindusert leverskade relatert til darolutamid, skal behandling med darolutamid seponeres permanent. Bivirkninger: 1. Hos pasienter med nmCRPC: Svært vanlige (≥ 1/10): Fatigue/astenitilstander, redusert antall nøytrofile, økt bilirubin og ASAT. Vanlige (≥ 1/100, < 1/10): Iskemisk hjertesykdom og hjertesvikt, utslett, smerter i ekstremiteter, smerter i muskler og skjelett samt frakturer. 2. I kombinasjon med docetaxel hos pasienter med mHSPC: Svært vanlige (≥ 1/10): Hypertensjon, utslett, redusert antall nøytrofile, økt bilirubin, ALAT og ASAT. Vanlige (≥ 1/100, < 1/10): Frakturer, gynekomasti. Basert på SPC godkjent av SLV/EMA: 02/2023. Konsulter preparatomtalen (SPC) for mer informasjon Pakninger og priser: 112 stk. (blister) AUP 46.636,30 NOK Varenr: 063426. R.gr. C, H-resept For oppdaterte priser se; www.felleskatalogen. no. Kontaktinformasjon: Bayer AS, Drammensveien 288, NO-0283 OSLO, Postboks 193, 1325 Lysaker. Tlf: +47 23 13 05 00, Faks: +47 23 13 05 01, www.bayer.no. MA-M_DAR-NO_0008, Mars 2023.
2023.
Dette legemiddelet
Dette legemiddelet er under spesiell overvåkning for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Du kan bidra ved å melde enhver mistenkt bivirkning via relis.no.
Dette legemiddelet er under spesiell overvåkning for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Du kan bidra ved å melde enhver mistenkt bivirkning via relis.no.
Kreditering: Aktiv mot kreft har finansiert studien
Overlevere etter testikkelkreft har økt risiko for tidlig død. Regelmessig fysisk aktivitet har vist å redusere total dødelighet etter brystkreft, prostatakreft og kolorektalkreft, men ingen har undersøkt sammenhengen mellom fysisk aktivitet og dødelighet etter testikkelkreft (2, 3). Vi fant at testikkelkreftoverlevere som var fysisk aktive 12 år (i gjennomsnitt) etter behandling i 1980-1994 hadde 50 % redusert total dødsrisiko (uavhengig av årsak) 30 år etter behandling, sammenlignet med fysisk inaktive. Resultatene ble publisert i International Journal of Cancer i oktober 2023 "Association of physical activity with overall mortality among long-term testicular cancer survivors: A longitudinal study" (uio.no) (1).Klinikere og overlevere etter testikkelkreft bør kjenne til at risikoen for tidlig død kan reduseres betydelig hvis man er regelmessig fysisk aktiv etter behandling.

LENE THORSEN
PhD
Avdeling for kreftbehandling Oslo universitetssykehus
HEGE S. HAUGNES
Prof. MD
Kreftavdelingen
Universitetssykehuset Nord-Norge
Institutt for klinisk medisin
Universitet i TromsøNorges arktiske universitet
HELENE F.S. NEGAARD
PhD MD
Avdeling for kreftbehandling Oslo universitetssykehus
SOPHIE D. FOSSÅ
Prof. em. MD
Avdeling for kreftbehandling Oslo universitetssykehus
Testikkelkreft er den vanligste kreftformen blant unge menn. Med en median alder på 36 år ved diagnose og en 15-års relativ overlevelsesrate > 98 % i Norge 2018-2022 (4), har testikkelkreftoverlevere lang forventet levetid. Nyere studier viser imidlertid at behandling av metastatisk testikkelkreft med cisplatin-basert cytostatika og/eller stråleterapi øker risikoen for alvorlige helseproblemer som kardiovaskulær sykdom og sekundær kreft, og tidlig død (5, 6).
Å være regelmessig fysisk aktiv har store helsefordeler. Studier blant voksne i den generelle befolkningen viser at regelmessig fysisk aktivitet reduserer risikoen for blant annet kardiovaskulære sykdommer, diabetes type 2, depresjon, flere kreftformer og tidlig død (7-9). Et økende antall studier viser at regelmessig fysisk aktivitet også er assosiert med redusert risiko for tilbakefall og dødelighet av bryst- prostata- og kolorektalkreft
(2, 3). Ingen studier har imidlertid undersøkt sammenhengen mellom fysisk aktivitet og dødelighet blant testikkelkreftoverlevere.
Det overordnede målet med denne studien var å undersøke sammenhengen mellom regelmessig fysisk aktivitet og dødelighet blant langtidsoverlevere etter testikkelkreft. Mer spesifikt ville vi undersøke om stigende nivåer av regelmessig fysisk aktivitet, målt ved to tidspunkter etter diagnosen, er assosiert med total dødelighetsrisiko.
MATERIAL OG METODE
Resultatene baserer seg på en nasjonal longitudinell studie som prof. Sophie D. Fosså startet i 1998 (10). Testikkelkreftoverlevere behandlet med kirurgi alene, strålebehandling alene eller kjemoterapi (eventuelt i kombinasjon med kirurgi eller strålebehandling) mellom 1980 – 1994, ble identifisert i Kreftregisteret. Mennene ble invitert til å fylle ut et spørreskjema
ved tre ulike tidspunkt. Analysene som inngår i denne studien inkluderer data fra de to første undersøkelsene. Den første undersøkelsen (U1) ble gjennomført mellom 1998-2002 (median 11 år etter diagnose), og den andre undersøkelsen (U2) mellom 2007-2009 (median 8 år etter U1).
Alle deltagerne ble observert til desember 2020, i gjennomsnitt 30 år etter diagnose (End of Study [EoS]) (Figur 1).
Mål på fysisk aktivitet
Respondenten ble spurt om hvor mange timer per uke (i gjennomsnitt det siste året) han har drevet med lett aktivitet (ikke svett/andpusten) og/eller hard fysisk aktivitet (svett/ andpusten)). Svarene ble omregnet til metabolske ekvivalent timer per uke (MET-timer/uke), et mål på ukentlig energiforbruk. Basert på anbefalinger fra Verdens helseorganisasjons (WHO)1 (11) ble deltagerne delt i fire aktivitetsgrupper:
• Inaktive (0 MET-timer/uke) som verken rapporterte lett eller hard aktivitet
• Lav-Aktive (2-6 MET-timer/uke) som rapporterte aktivitet tilsvarende mindre enn anbefalingene fra WHO
• Aktive (10-18 MET-timer/uke) som møtte anbefalingene fra WHO
• Høy-Aktive (> 20 MET-timer/uke) som rapporterte aktivitet høyere enn WHO’s minimumsanbefaling
Utfall og kovariater
Utfallet i studien var total dødelighet i perioden fra henholdsvis U1 og U2 til EoS. Informasjon om dato
Observasjonstid: Median 20 år (0.5-22 år)
Median 11 år (4-22) Median 8 år (6-10)
Observasjonstid: Median 13 år (0.1-14)
Testikkelkreft diagnose 1980-1994 Undersøkelse 1 (U1) 1998-2002 Undersøkelse 2 (U2) 2007-2009 Studieslutt (31.12.2020)
for død ble hentet fra Kreftregisteret. Relevante og tilgjengelige variabler inkludert i multivariable analyser var: Alder, utdanningsnivå, selvrapportert somatiske sykdommer (dvs. hjerteinfarkt, angina pectoris, slag, diabetes og/eller andre tidligere kreftdiagnoser enn testikkelkreft), daglig røyking, ugunstig alkoholforbruk og mottatt kreftbehandling.
Statistikk
Kaplan-Meier estimator og Log rank test ble brukt for å undersøke forskjeller i ujusterte mortalitetsrater mellom aktivitetsgruppene. Cox proportional hazard models ble brukt for å undersøke sammenhengen mellom fysisk aktivitet og total dødelighet, justert for kovariater.
RESULTATER
Av 1813 menn som ble invitert til U1, svarte 1392 (77 %) på spørreskjemaet. Av de som fortsatt var i live og som ble invitert til U2 (n=1331), svarte 1011 (76 %). Gjennomsnittsalder ved diagnose var 33 år og nesten 40 % hadde fått kjemoterapi som del av behandlingen. Ved U1 hadde nesten 10 % en eller flere andre alvorlige somatiske sykdommer, 35 % var daglig røykere og nesten 20 % hadde et ugunstig
alkoholforbruk. Seks prosent var Inaktive, 25 % Lav-Aktive, 33% Aktive og 36 % Høy-Aktive.
Fysisk aktivitet ved U1 og total dødelighet
Mellom U1 og EoS (median 20 år observasjonstid) døde 19 %2 totalt; 31 %, 26 %, 15 % og 17 % blant henholdsvis de Inaktive, Lav-Aktive, Aktive og Høy-Aktive. Kaplan-Meier plottet og Log Rank test viser at de ujusterte mortalitetsratene var signifikant lavere blant de Aktive og Høy-Aktive enn de Inaktive (Figur 2). Justert for kovariater, viste Cox analysen at de Aktive ved U1 hadde 51 % redusert total dødelighetsrisiko ved EoS sammenlignet med de Inaktive ved U1 (Hazard ratio [HR] 0.49, 95% Konfidensintervall [KI]: 0.29-0.84). Vi fant ingen ytterligere reduksjon i dødelighetsrisiko blant de Høy-Aktive (HR 0.71, 95% KI: 0.42-1.19).
Fysisk aktivitet ved U2 og total dødelighet Mellom U2 og EoS (median 13 år observasjonstid), døde 14 %3 totalt; nesten 40% blant de Inaktive, og <15% blant de tre aktive gruppene. Kaplan-Meier plottet og Log Rank
1 150-300 minutter i uken aktivitet med moderat intensitet eller 75-150 minutter i uken aktivitet med høy intensitet eller en kombinasjon av moderat og hard aktivitet.
2 Dødsårsak; Testikkelkreft (4 %), annen kreft (44 %), kardiovaskulær sykdom (17 %), andre sykdommer (29 %) og ukjent (6 %)
Ujustert mortalitetsrate
Ujustert mortalitetsrate
Lav-aktive
Høy-aktive
Lav-aktive
Høy-aktive
test viste at den ujusterte mortalitetsraten var signifikant høyere for de Inaktive enn de tre aktive gruppene (Figur 3). Justert for kovariater viste Cox analysen at de aktive gruppene reduserte total dødelighetsrisiko ved EoS med minst 60% sammenlignet med de Inaktive (Lav-Aktive: HR 0.37, 95% KI: 0.17-0.80, Aktive: HR 0.29, 95% KI: 0.14-0.60, Høy-Aktive HR 0.27, 95% KI: 0.13-0.55).
Studien viser at testikkelkreftoverlevere som oppfylte WHO’s anbefalinger for fysisk aktivitet 12 år etter diagnose, hadde halvert total dødelighetsrisiko 30 år etter diagnose, sammenlignet med fysisk inaktive. Disse resultatene er i samsvar med resultater fra andre studier som har undersøkt sammenhengen mellom regelmessig fysisk aktivitet og dødelighet blant kreftoverlevere etter andre diagnoser (2, 12). Vi var overrasket over at den mest aktive gruppen ikke reduserte dødelighetsrisikoen mer enn den nest mest aktive gruppen, men dette er også i overenstemmelse med studier blant brystkreftoverlevere (13, 14).
Lav-aktive
Høy-aktive
Nesten 20 år etter diagnose, viste alle tre aktivitetsgruppene, også de Lav-Aktive, en redusert dødelighetsrisiko på mer enn 60 %. Vi var overrasket over at de Lav-Aktive reduserte risikoen med samme ratio som de Aktive og Høy-Aktive, men dette kan forklares med at gevinster av lav aktivitet har vist seg å øke ved økende alder. Våre resultater samsvarer også med nyere studier som har vist redusert dødelig også etter lavintensiv aktivitet blant den aldrende generelle populasjonen (15, 16). En annen forklaring kan være at testikkelkreftoverlevere som lever lenger er en seleksjon av de friskeste, som betyr at de med dårligst helse har falt fra og at fysisk aktivitet ikke er av like stor betydning for overlevelse blant de med et friskere utgangspunkt.
KONKLUSJON:
Studien indikerer hvor viktig det er å være regelmessig fysisk aktiv etter behandling for testikkelkreft. Dette er viktig kunnskap for både testikkelkreftoverlevere og helsepersonell.
Stiftelsen Aktiv mot kreft (AMK) ble etablert av Helle Aanesen og Grete Waitz i 2007. Målet til stiftelsen er å inkludere fysisk aktivitet som en del av kreftbehandlingen. AMK har derfor etablert 21 Pusterom (treningssentre) på norske sykehus (Pusterommet - Aktiv mot kreft). På Pusterommene får pasienter tilrettelagt treningsveiledning av fag personer med kompetanse innen trening av kreftpasienter. Tilbudet består av både individuell treningsveiledning og gruppetimer med blant annet yoga, kondisjon- og styrketrening. Helsepersonell bør være klar over dette tilbudet og henvise testikkelkreftpasienter.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no

Kun for

BRYSTKREFT
Lynparza er indisert som monoterapi eller i kombinasjon med endokrin behandling til adjuvant behandling av voksne pasienter med kimbane BRCA1/2-mutasjoner som har HER2-negativ tidlig brystkreft med høy risiko for tilbakefall, og som tidligere har blitt behandlet med neoadjuvant eller adjuvant kjemoterapi 3
Signifikant forbedring i IDFS 3
42%
Redusert risiko for invasiv sykdom eller død sammenlignet med placebo
(HR, 0.58; 99.5% CI, 0.41-0.82; P=0.0000073)3
Patients invasive disease free at 3 years 86% (95% CI, 83-88) vs 77% (95% CI, 74-80)3
(LYNPARZA N = 921, placebo N = 915)3
UTVALGT SIKKERHETSINFORMASJON
Signifikant forbedring i OS 3
32%
Reduksjon av risikoen for død sammenlignet med placebo
(HR 0,68; 98,5 % CI, 0,47-0,97; P = 0,0091)3
Patients alive at 4 years 90% (95% CI, 87-92) vs 86% (95% CI, 84-89)3 (LYNPARZA N = 921, placebo N = 915)3
Før oppstart av behandling med Lynparza til adjuvant behandling av HER2-negativ tidlig brystkreft med høy risiko for tilbakefall, må pasientene få påvist skadelig eller mistenkt skadelig gBRCA1/2-mutasjon ved hjelp av en validert test 3
KONTRAINDIKASJONER: Amming under behandling og i 1 måned etter den siste dosen (se pkt. 4.6 i SPC). FORSIKTIGHET UTVISES VED: Hematologisk toksisitet: Blodtelling før behandlingsoppstart og deretter månedlig, er anbefalt de første 12 månedene av behandlingen og periodevis etter dette tidspunktet for å overvåke klinisk signifikante endringer av verdiene under behandling. Myelodysplastisk syndrom/akutt myelogen leukemi: Dersom MDS og/eller AML blir diagnostisert under behandling med Lynparza, skal Lynparza seponeres og pasienten skal få hensiktsmessig behandling. Venøse tromboemboliske hendelser: Pasientene skal overvåkes med tanke på kliniske tegn og symptomer på venetrombose og lungemboli og behandles på medisinsk hensiktsmessig måte. Pneumonitt: Hvis pasienten får nye, eller en forverring av respiratoriske symptomer som dyspné, hoste og feber, eller et unormalt radiologisk funn observeres i brystet, bør behandling med Lynparza avbrytes og utredning igangsettes raskt. Levertoksisitet: Dersom det utvikles kliniske symptomer eller tegn som tyder på levertoksisitet, må klinisk vurdering av pasienten og måling av leverfunksjonsprøver utføres raskt. Dersom det mistenkes legemiddelutløst leverskade (DILI), skal behandlingen avbrytes. Fertilitet, graviditet: Fertile kvinner må ikke bli gravide når Lynparza benyttes og må ikke være gravide ved oppstart av behandlingen. Graviditetstesting bør utføres før oppstart av behandling og deretter regelmessig under behandling på alle fertile kvinner. Effekten av noen hormonelle legemidler kan reduseres ved samtidig administrasjon med Lynparza. En ekstra ikke-hormonell prevensjonsmetode bør derfor vurderes under behandling. Fertile kvinner må bruke to former for sikker prevensjon før oppstart av behandling med Lynparza, under behandlingen og i 6 måneder etter siste dose med Lynparza. Se pkt. 4.4 i SPC for mer informasjon om advarsler og forsiktighetsregler. VIKTIGE INTERAKSJONER: Samtidig administrering av Lynparza med kraftige eller moderate CYP3A-hemmere eller CYP3A-induktorer anbefales ikke. Se pkt. 4.2 og 4.5 i SPC for mer informasjon dersom en kraftig eller moderat CYP3A-hemmer eller CYP3A-induktor likevel må administreres samtidig med Lynparza. Se pkt 4.5 i SPC for mer informasjon om andre former for interaksjoner. VIKTIGE BIVIRKNINGER: De hyppigste observerte bivirkningene på tvers av kliniske studier hos pasienter som fikk Lynparza som monoterapi (≥ 10 %) var kvalme, oppkast, diaré, dyspepsi, fatigue/ asteni, hodepine, dysgeusi, nedsatt appetitt, svimmelhet, hoste, dyspné, anemi, nøytropeni, og leukocytopeni.
LYNPARZA®(olaparib) VIKTIG INFORMASJON
INDIKASJONER:
Full indikasjonstekst finner du i Felleskatalogen.
DOSERING OG ADMINISTRASJONSMÅTE
Behandling med Lynparza bør initieres og overvåkes av lege med erfaring i bruk av legemidler til kreftbehandling. Anbefalt dose av Lynparza som monoterapi eller i kombinasjon med endokrin behandling er 300 mg (to tabletter à 150 mg) som skal tas to ganger daglig, tilsvarende en daglig dose på totalt 600 mg. Tablett à 100 mg er tilgjengelig for dosereduksjon. Ved bruk av Lynparza i kombinasjon med endokrin behandling, se den fullstendige produktinformasjonen for legemidler som brukes til endokrin behandling i kombinasjon med Lynparza (aromatasehemmer/antiøstrogen), for informasjon om anbefalt dosering.
PRIS, REFUSJON OG FORSKRIVNINGSREGLER
Pakninger og priser: Tabletter: 100 mg: 56 stk. kr 27754,60. 150 mg: 56 stk. kr 27754,60. Reseptgruppe C. Refusjon: H-resept.
gBRCAm= germline (kimbane) BReastCAncer mutation
Refusjonsberettiget bruk: Der det er utarbeidet nasjonale handlingsprogrammer/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/LIS spesialistgruppe skal rekvirering gjøres i tråd med disse. Vilkår: (216) Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist.
Beslutning i Beslutningsforum for nye metoder (28.08.2023): Olaparib (Lynparza) kan innføres som monoterapi eller i kombinasjon med endokrin behandling til adjuvant behandling av voksne pasienter med kimbane BRCA1/2-mutasjoner som har HER2-negativ tidlig brystkreft med høy risiko for tilbakefall, og som tidligere har blitt behandlet med neoadjuvant eller adjuvant kjemoterapi.
Lynparza inngår i Helseforetakenes anbefaling for HER2-negativ brystkreft (Onkologi 2307, gjeldende fra 01.10.2023): Adjuvant behandling, BRCA positiv (førstevalg)4
Før forskrivning av LYNPARZA, se FK-tekst eller SPC på www.felleskatalogen.no NO-11252-10-2023-ONC
IDFS = Invasive Disease Free Survival, invasiv sykdomsfri overlevelse OS = Overall Survival, total overlevelse Referanser: 1. Tutt ANJ, Garber JE, Kaufman B, et al. Adjuvant olaparib for patients with BRCA1 - or BRCA2- mutated breast cancer. N Engl J Med. 2021;384:2394-2405. 2. https://nyemetoder.no/metoder/olaparib-lynparza-indikasjon-viii 3. LYNPARZA (olaparib) SPC 4. https://www.sykehusinnkjop.no/4a771a/siteassets/avtaledokumenter/avtaler-legemidler/onkologi/anbefaling-onkologiske-og-kolonistimulerende-legemidler.pdf

MORTEN THRONÆS
Overlege
Kreftklinikken, St. Olavs hospital og Førsteamanuensis, Senter for krisepsykologi, Universitetet i Bergen Forsker
Institutt for Klinisk og molekylær medisin, Fakultet for medisin og helsevitenskap, NTNU
LINE MERETHE OLDERVOLL
Professor
Senter for krisepsykologi, Universitetet i Bergen og Nasjonalt kompetansemiljø om utviklingshemming (NAKU), Fakultet for medisin og helsevitenskap, NTNU
GURO BIRGITTE STENE
Førsteamanuensis
Senter for krisepsykologi, Universitetet i Bergen og Institutt for nevromedisin og bevegelsesvitenskap, Fakultet for medisin og helsevitenskap, NTNU
MAY HAUKEN
Professor Senter for krisepsykologi, Universitetet i Bergen
HILDE HJELMELAND AHMEDZAI
Forsker/Post doc
Senter for krisepsykologi, Universitetet i Bergen
ERIK TORBJØRN LØHRE
Overlege
Kreftklinikken, St. Olavs hospital Førsteamanuensis
Senter for krisepsykologi, Universitetet i Bergen og Forsker, Institutt for Klinisk og molekylær medisin, Fakultet for medisin og helsevitenskap, NTNU
Både insidens og prevalens av kreftsykdom er økende i den norske befolkningen (1). De siste årene har flere nye behandlingsmetoder blitt lansert, noe som har gitt lengre overlevelse for kreftpasienter i palliativ fase. Den overordnede målsetningen for behandling av palliative kreftpasienter er lengst mulig levetid og best mulig livskvalitet. Studier på integrasjon av palliasjon i onkologien har vist bedret livskvalitet og symptomkontroll (2). Et annet viktig aspekt hos palliative kreftpasienter er opprettholdelse og eventuelt bedring av funksjon, som potensielt vil kunne gi store gevinster både for den enkelte pasient, pårørende og samfunnet som helhet (3).
Ifølge Verdens helseorganisasjon (WHO) er både rehabilitering og palliativ omsorg viktig bidrag i kreftbehandlingen (4-6). Integrert palliativ rehabilitering defineres av WHO som et sett av tiltak for å optimalisere egenmestring av symptomer, selvstendighet i daglige gjøremål og sosial deltakelse (7). Internasjonale retningslinjer anbefaler fysisk aktivitet for pasienter både under og etter kreftbehandling for å opprettholde fysisk funksjon og dagligdagse aktiviteter (8). Fysisk aktivitet og treningsintervensjoner er testet ut med lovende resultater også for palliative pasienter (9), men det
rapporteres også om høyt frafall og lav etterlevelse (10, 11). Det kan derfor være behov for rehabiliteringstiltak som imøtekommer de unike behovene til personer som lever med ikkekurerbar kreftsykdom (12).
Innen palliativ rehabilitering står uttrykket «disability» sentralt (13) og kan på norsk forstås som funksjonstap. Funksjonstap reduserer livskvalitet og velvære, fører til mer behov for pleie og omsorg og øker både sykehusinnleggelser og dødelighet (14). Palliativ rehabilitering har derfor som mål å redusere symptomer og sørge for at kreftpasienter forblir selvstendige og sosialt aktive så lenge som mulig (14).
Flere studier har vist effekt av palliativ rehabilitering på livskvalitet, funksjon og symptombyrde (15-18). En nylig gjennomført randomisert, multisenterstudie viste at et kortvarig rehabiliteringsprogram med egenmestring av funksjonsbegrensende symptomer, optimalisering av fysisk funksjon og deltakelse i hverdagsaktiviteter var gjennomførbart og viste moderat bedring i livskvalitet blant palliative kreftpasienter sammenlignet med standard behandling (19).
INSPIRE PROSJEKTET
På bakgrunn av dette er det igangsatt et stort EU-finansiert prosjekt kalt
INSPIRE; Integrated Short-Term










Palliative Rehabilitation in Incurable Cancer (20). Målsetningen med prosjektet er å undersøke effekten av en palliativ rehabiliteringsintervensjon gitt over 8 uker til pasienter med ikke-kurabel kreftsykdom i forhold til livskvalitet og kostnader. Videre vil prosjektet evaluere hvorvidt det å adressere symptombyrde, funksjonsnedsettelse og sosial deltakelse, fører til bedre livskvalitet og reduserer belastningen for pårørende. Prosjektet har ambisjon om å identifisere en effektiv modell for rehabilitering som kan gis som en integrert del av rutinemessig kreft- og palliativ omsorg for personer
med uhelbredelig kreft i hele Europa. Forskere og klinikere innen palliasjon og palliativ rehabilitering fra syv land i Europa inngår i INSPIRE – konsortiet (Figur 1). Partner fra Norge er Senter for krisepsykologi ved Universitetet i Bergen og ledes av professor Line Merethe Oldervoll.
INSPIRE MODELLEN – HVA ER VIKTIG FOR DEG?
Tanken bak INSPIRE er at systematisk integrering av rehabilitering i palliativ omsorg kan gi personer som lever med uhelbredelig kreft mulighet til aktivt å håndtere funksjonsnedsettelse og å
leve fullt ut med best mulig livskvalitet. Teorier om sykdom og sykdomsforståelse, rehabiliteringsprosesser og atferdsendring er basis for modellen (21-23). Sentralt står en personsentrert tilnærming: hva er viktig for deg som pasient? Involvering av pårørende og omsorgspersoner vektlegges og intervensjonen vil vektlegge strategier for å ta gode valg, egenhåndtering av situasjonen, måloppnåelse og justering av mål. En tverrfaglig tilnærming med forsterket spesialisert rehabiliteringskompetanse vil bli benyttet. INPIRE modellen er illustrert i Figur 2.

HVOR OG HVORDAN SKAL PROSJEKTET GJENNOMFØRES?
INSPIRE prosjektet består av åtte arbeidspakker, der den mest sentrale er gjennomføring av en randomisert, singel blindet multisenter studie (20). Denne skal måle den kliniske effekten av palliativ rehabilitering, gitt i 8 uker, i forhold til livskvalitet, funksjonsnedsettelse, symptombyrde og måloppnåelse for pasienter med ikke-kurabel kreftsykdom. Studien
skal gjennomføres i Norge, Frankrike, Danmark, England, Skottland og Italia. Det skal til sammen rekrutteres 340 pasienter over to år. Deltakerne randomiseres 1:1 hvor kontrollgruppen får standard behandling og intervensjonsgruppen får standard behandling pluss systematisk integrert palliativ rehabilitering. Det primære endepunktet er forskjell i helserelatert livskvalitet, målt med Functional Assessment of Cancer Therapy (FACT) som måler fire domener av helserelatert livskvalitet.

Planlagt studiestart i Norge er i mars 2024 og inklusjon vil foregå ved Kreftklinikken, St. Olavs hospital.
Referanser:
Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no
Funded by the European Union. Views and opinions expressed are however those of the author(s) only and do not necessarily reflect those of the European Union or European Health and Digital Executive Agency. Neither the European Union nor the granting authority can be held responsible for them.
Subkutan behandling administrert på 5-8 minutter 1,2


Les
PHESGO er anbudsvinner fra 1. oktober 2023 3
I LIS anbud 2307 er PHESGO førstevalg ved HER2-positiv brystkreft i ulike stadier med eller uten spredning ved behandling med pertuzumab og trastuzumab.
INDIKASJONER
Brystkreft i tidlig stadium (EBC)
PHESGO er indisert til bruk i kombinasjon med kjemoterapi ved: neoadjuvant behandling av voksne pasienter med HER2-positiv, lokalavansert, inflammatorisk eller tidlig stadium brystkreft med høy risiko for tilbakefall adjuvant behandling av voksne pasienter med HER2-positiv brystkreft i tidlig stadium med høy risiko for tilbakefall
Metastatisk brystkreft (MBC)
PHESGO er indisert til bruk i kombinasjon med docetaksel hos voksne pasienter med HER2-positiv metastatisk eller lokal tilbakevendende inoperabel brystkreft, som tidligere ikke har fått HER2-rettet behandling eller kjemoterapi for metastatisk sykdom.
ANBEFALT DOSERING OG ADMINISTRERING
KONTRAINDIKASJONER
Overfølsomhet overfor virkestoffene eller overfor noen av hjelpestoffene.
BIVIRKNINGER
De vanligste bivirkningene (≥ 30%) rapportert hos pasienter behandlet med PHESGO eller intravenøs pertuzumab i kombinasjon med trastuzumab og kjemoterapi er alopesi, diaré, kvalme, anemi, asteni og artralgi. De vanligste rapporterte alvorlige bivirkningene (SAE) (≥ 1 %) hos pasienter behandlet med PHESGO eller intravenøs pertuzumab i kombinasjon med trastuzumab er febril nøytropeni, hjertesvikt, pyreksi, nøytropeni, nøytropen sepsis, redusert nøytrofiltall og pneumoni.
GRAVIDITET OG AMMING
Fertile kvinner må bruke sikker prevensjon under behandling med PHESGO og i 7 måneder etter den siste dosen. Amming skal unngås ved behandling med PHESGO og i minst 7 måneder etter siste dose.
FORSIKTIGHETSREGLER
Hjerterisiko skal vurderes nøye og balanseres mot det medisinske behovet til den enkelte pasienten før bruk av PHESGO med et antracyklin. Pasienter med hviledyspné på grunn av komplikasjoner ved langt fremskreden kreft og andre samtidige sykdommer, kan ha økt risiko for lungekomplikasjoner. Disse pasientene skal derfor ikke behandles med PHESGO. Pasienter bør overvåkes nøye for overfølsomhetsreaksjoner.
PAKNINGER OG PRISER
600 mg/600 mg: 10 ml (hettegl.) kr 52689,90. 1200 mg/600 mg: 15 ml (hettegl.) kr 91850,50.
REFUSJON
I LIS anbud 2307 er PHESGO førstevalg ved HER2-positiv brystkreft i ulike stadier med eller uten spredning: ved behandling med trastuzumab + pertuzumab.
PHESGO forskrives på H-resept av lege med erfaring innen kreftbehandling.
PHESGO er i reseptgruppe C.
For utfyllende informasjon om dosering, bivirkninger, interaksjoner og forsiktighetsregler, se fullstendig preparatomtale på Felleskatalogen.no
Referanser:
1. SPC PHESGO datert 13.01.2022 avsnitt 4.2
2. Tan AR, Im S-A, Mattar A et al. Fixed-dose combination of pertuzumab and trastuzumab for subcutaneous injection plus chemotherapy in HER2-positive early breast cancer (FeDeriCa): a randomised, open-label, multicentre, non-inferiority, phase 3 study. Lancet Oncol 2021; 22: 85–97
3. LIS anbud onkologi 2307 effektivt fra 1.10.2023 https://www.sykehusinnkjop.no/4a771a/siteassets/avtaledokumenter/avtaler-legemidler/onkologi/anbefaling-onkologiske-og-kolonistimulerende-legemidler.pdf. Sist lest 6. november 2023
4. SPC PHESGO datert 13.01.2022 avsnitt 4.1, 4.2, 4.3, 4.4, 4.6 og 4.8
Roche Norge AS, Brynsengfaret 6b, 0667 Oslo, Telefon: 22 78 90 00, Email: pharma.norge@roche.com
Stadig flere pasienter overlever lungekreft. Det skyldes ikke minst innsatsen til Åslaug Helland (56), årets mottaker av Kreftforeningens prestisjetunge forskningspris.
Åslaug Helland er den 32. vinneren av Kreftforeningens høythengende Kong Olav Vs kreftforskningspris.
I statuttene heter det at prisen skal hedre en fremragende forskers innsats både her hjemme og internasjonalt, og innstillingsutvalget har vurdert en rad sterke kandidater etter følgende kriterier:
• Kandidatens forskning skal ha klar kreftrelevans
• Hovedvekten av forskningen skal ha funnet sted ved en norsk forskningsinstitusjon og bidratt til styrking av det norske forskningsmiljøet
• Forskeren skal ha oppnådd internasjonal anerkjennelse for sitt arbeid, bidratt til ny innsikt og kunnskap innenfor forskningsfeltet, og til bred formidling av sine resultater.
Kong Olav Vs kreftforskningspris er på 1 million kroner og ble i år delt ut for 32. gang. Også helseminister Ingvild Kjerkol og ordfører Marianne Borgen var til stede under den høytidelige seremonien i Universitetets fullsatte aula i Oslo.
Der roste Kreftforeningens generalsekretær Ingrid Stenstadvold Ross prisvinnerens unike evne til å bygge sterke lag.
– At du har klart å få landets fremste forskere til å jobbe så godt sammen mot felles mål, er en viktig årsak til at overlevelsen blant lungekreftpasientene er doblet de siste 20 årene, sa hun.
I sin takketale mintes Helland hvordan det tidlig i hennes karriere gjaldt å oppdage lungekreft så sent som mulig, slik at pasientene kunne leve lengst mulig i lykkelig uvitenhet om sykdommen de uansett skulle dø av.
– Slik er det heldigvis ikke lenger, sa hun, og fortalte at nesten 40 prosent nå får kurativ behandling.
– Men fortsatt er dessverre lungekreft en diagnose med dårlig prognose. Det skal jeg jobbe hver eneste dag for å endre, lovet hun.
EN SANN PIONER
Ross forteller at det ikke var tvil om hvem som skulle få prisen i år. Hun beskriver Åslaug Helland som en usedvanlig dyktig onkolog og forsker, og i tillegg en lagbygger i særklasse.
De uavhengige internasjonale ekspertene som vurderte de nominerte til prisen, trakk særlig fram hvordan hun gjennom sine kliniske studier har bidratt til å utvikle en mer persontilpasset behandling for kreftsyke.
«Resultatet er at særlig lungekreftpasienter de siste årene har fått langt bedre behandling og prognoser. Det er en utvikling det er all grunn til å tro at bare vil fortsette», heter det i begrunnelsen.


Hellands drivkraft har alltid vært å hjelpe pasientene.
– De mest meningsfulle øyeblikkene kommer når de får tilgang til ny behandling som forlenger livet og øker livskvaliteten, sier Helland.
Slike øyeblikk er det blitt langt flere av. Rundt 40 prosent får nå kurativ behandling, der målet er at de skal bli helt friske.
LAGKAPTEIN
Helland er den første til å understreke at kreftforskning ikke er solospill, men lagarbeid.
– Det er helt avgjørende å bygge sterke miljøer, sier hun.
Det har hun klart. Og hun har aldri kviet seg for å ta rollen som lagkaptein.
Da Kreftforeningen for ti år siden etablerte en nasjonal ekspertgruppe for lungekreft, var Helland det selvskrevne valget som leder. Hun leder også IMPRESS-Norway, Norges største kliniske kreftstudie, og MATRIX, et nasjonalt forskningssenter for klinisk behandling.
Og, som om ikke det var nok, leder hun Nor Trials-Kreft, et samarbeid om kliniske studier mellom helseregionene og legemiddelindustrien om kliniske studier.
Underveis har hun mottatt over 100 millioner kroner i støtte fra Kreftforeningen. Hun har publisert mer enn 165 fagfellevurderte artikler i vitenskapelige tidsskrifter, og blitt sitert nærmere 10.000 ganger. Nylig ble hun også tatt opp som medlem av Det Norske Videnskaps-Akademi.
De mest meningsfulle øyeblikkene kommer når de får tilgang til ny behandling som forlenger livet og øker livskvaliteten
Lungekreft er den kreftformen som tar flest liv i Norge i dag. 1190 menn og 1053 kvinner døde av lungekreft i 2021.
3685 nye tilfeller av lungekreft ble registrert i 2021. Antallet innbyggere som lever med diagnosen, er tredoblet i løpet av de siste tjue årene.
Overlevelsen har nærmest doblet seg de siste 20 årene og er høyere for kvinner enn for menn.
Femårig relativ overlevelse i 2021 var for kvinner 32,8 prosent og 25,7 prosent for menn.

BAKGRUNN FOR PRISEN
Dreper-T-lymfocytter er immunceller som kan angripe kreftceller. Det gjør de ved å gjenkjenne proteiner som er endret av kreftsykdommen som følge av bl.a. mutasjoner, via sin T-cellereseptor (TCR). I de fleste pasienter som har kreft med spredning, vil imidlertid pasientens egne immunceller etter hvert miste evnen til å gjenkjenne og drepe kreftcellene. Immunterapi der pasientens dreperT-celler blir genetisk «programmert» med terapeutiske TCR i laboratoriet og gitt tilbake til pasienten, har derfor dukket opp som et lovende behandlings-alternativ. To store utfordringer er imidlertid: 1) identifikasjon av trygge behandlingsmål som finnes i høye nok nivåer i kreftcellene, og 2) identifikasjon av TCR som gjenkjenner målene effektivt. Begge utfordringene blir adressert i Giannakopoulos arbeider.
Giannakopoulou et al utviklet først en effektiv og følsom teknologi for å identifisere (in vitro) T-celler og T-cellereseptorer (TCR) fra friske
blodgivere som gjenkjenner potensielle behandlingsmål (artikkel 1). Dette er innovativt og viktig fordi feltet fram til nå i hovedsak har benyttet T celler fra pasienter for å identifisere slike TCR. Den nye metoden øker sannsynligheten for å identifisere TCR, og i tillegg sannsynligheten for å identifisere TCR som er effektive. I artikkel 2 utnyttet Giannakopoulou et al denne teknologien til å identifisere TCR som gjenkjenner et helt nytt behandlingsmål i celler fra pasienter med akutt lymfatisk leukemi (ALL), både ALL med utgangspunkt i T celler og B celler (T-ALL og B-ALL). Enzymet TdT er en DNA-polymerase som overuttrykkes hos de fleste pasienter med ALL. Det utrykkes derimot kun en kort periode under normal modning av lymfocytter. Forskerteamet identifiserte to TCR som gjenkjenner TdT. Begge medierte effektiv eliminasjon av leukemiceller fra pasienter transplantert til mus, mens normale celler ble spart.
Deretter benyttet Giannakopoulou et al teknologien til å identifisere
og karakterisere en TCR rettet mot et annet nytt behandlingsmål, som også tilhører en annen kategori av behandlingsmål - en punktmutasjon i FLT3 som er felles for en undergruppe av pasienter med blodkreft av typen akutt myelogen leukemi (AML). Denne TCR medierte effektivt drap av leukemiceller fra pasienter både i cellekultur og transplantert til mus, samtidig som normale celler ble spart (artikkel 3). T celler genetisk utstyrt med denne TCR medierte også eliminasjon av leukemi-stamceller i mus. Dette representerer en milepæl fordi stamcellene er lite følsomme for standard behandling, som kjemoterapi. Resultatene indikerer at T-celler modifisert til å uttrykke en terapeutisk TCR mot en enkelt felles mutasjon kan gi effektiv immunterapi hos en undergruppe av pasienter med AML.
Samlet tyder Giannakopoulous arbeid på at T-celler fra pasienter som er genetisk modifisert til å uttrykke TCR målrettet mot TdT eller FLT3 D835Y mutasjonen, kan utgjøre et lovende behandlings-alternativ for pasienter med ALL (artikkel 2) og AML (artikkel 3). Artikkel 2 baner vei for å benytte normale proteiner som er inne i kreftcellen men kun er forbigående uttrykt under normal celledifferensiering, som behandlingsmål, noe som er helt nytt. Studien i Nature Biotechnology fikk stor internasjonal oppmerksomhet og ble bl.a. omtalt av Reuters. Den har en Altmetric score for medieoppmerksomhet som er blant de 2% øverste av alle artikler
med tilsvarende alder, og blant de 29% øverste blant alle artikler med tilsvarende alder publisert i Nature Biotechnology. Studien i Nature Cancer ble publisert 2. oktober 2023. Nature Cancer publiserte i samme nummer en News and Views artikkel om funnene, og ACIR laget en illustrert oppsummering av artikkelen i sitt nyhetsbrev.
Det foreligger nå avanserte planer for en forskerinitiert klinisk studie med T-celleterapi der T cellene uttrykker TdT TCR, for behandling av barn og voksne med T-ALL og B-ALL, med overlege Jochen Büchner som principal investigator og OUS er sponsor. Büchner er trolig den lege i Norden med størst erfaring fra T-cellebasert terapi, og var leder i Norden for Novartis CAR19 T celleterapistudie som ble publisert i NEJM i 2018 og førte til godkjenning av behandlingen hos barn. Büchner fikk 20 mill NOK i 2022 fra Klinbeforsk programmet til å gjennomføre studien, som er beregnet å starte i 2025/2026.
Giannakopoulou har publisert tre artikler som alle holder eksepsjonelt høy kvalitet, som presenterer helt nye behandlingskonsepter som har fått stor internasjonal oppmerksomhet, og der resultatene i tillegg har potensiale for å danne grunnlag for ny klinisk behandling.

Artikler
1. Ali M*, Foldvari Z*, Giannakopoulou E*, Böschen ML, Strønen E, Yang W, Toebes M, Schubert B, Kohlbacher O, Schumacher TN, Olweus J. Induction of neoantigen-reactive T cells from healthy donors. Nat Protoc. 2019 Jun;14(6):19261943. *Equal contribution
2. Ali M*, Giannakopoulou E*, Li Y, Lehander M, Virding Culleton S, Yang W, Knetter C, Odabasi MC, Bollineni RC, Yang X, Foldvari Z, Böschen ML, Taraldsrud E, Strønen E, Toebes M, Hillen A, Mazzi S, de Ru AH, Janssen GMC, Kolstad A, Tjønnfjord GE, Lie BA, Griffioen M, Lehmann S, Osnes LT, Buechner J, Garcia KC, Schumacher TN, van Veelen PA, Leisegang M, Jacobsen SEW, Woll P, Olweus J. T cells targeted to TdT kill leukemic lymphoblasts while sparing normal lymphocytes. Nat Biotechnol. 2022 Apr;40(4):488-498. *Equal contribution
3. Giannakopoulou E, Lehander M, Culleton S V, Yang W, Li Y, Karpanen T, Nielsen M M, Bollineni R, Delic-Sarac M, Gjerdingen T J, Douvlataniotis K, Laos M, Ali M, Hillen A, Mazzi S, Wai D, Mehta A, Holm J S, Bentzen A K, Bill M, Griffioen M, Gedde-Dahl T, Lehmann S, Jacobsen S E W, Woll P, Olweus J. A T-cell receptor targeting a shared neoantigen mediates elimination of primary human acute myeloid leukemia in vivo. Nat Cancer 2023, Oct 2, DOI: 10.1038/s43018023-00642-8

Styret i Kolbjørn Brambani legat for kreftforskning har tildelt årets stipend på kr 200 000 til Liv Catherine Heggebø.

Liv Cathrine Heggebø er PhD stipendiat og arbeider med en randomisert studie i Norge og Sverige (PRO-GLIO trial) hvor det skal gis enten konvensjonell fotonstråling eller protonstråling for IDH muterte gliomer av grad 2 og 3 til 224 pasienter. Hun er førsteforfatter på en publikasjon som presenterer studien. I tillegg skal hun gjennomføre et sub studie med oppfølgende intervjuer av 10 norske pasienter i hver gruppe.
Midlene skal brukes til forskningsopphold ved institusjoner som har lang erfaring med protoner
for hjernesvulster, samt ESTRO kurs om protoner og en planlagt presentasjon av prosjektet på nevro-onkologi kongressen i Glasgow 2024.
Da vi i Norge planlegger å åpne protonsentre i 2024/2025 hvor barn er en prioritert gruppe, vil det være viktig å få objektive data om nytten av behandlingen.
PRO-GLIO-STUDIEN RULLER VIDERE
Forfattere:
Liv Cathrine Heggebø PhD stipendiat/konst. overlege ved Avdeling for kreftbehandling ved Radiumhospitalet, Oslo universitetssykehus
Ida Borgen Psykolog/postdoktor ved Avdeling for kreftbehandling ved Radiumhospitalet, Oslo universitetssykehus
Petter Brandal Fagansvarlig overlege ved Avdeling for kreftbehandling ved Radiumhospitalet, Oslo universitetssykehus
Screening- og baselineundersøkelse på studiesenter:
- Spørreskjema
- Nevropsykologisk test
- MR baseline - Klinisk undersøkelse
Randomisering
Protonstrålebehandling på protonsenter
Fotonstrålebehandling på lokal behandlingsinstitusjon
3-måneders kontroll på studiesenter: - Klinisk kontroll - Oppstart adjuvant kjemoterapi
Kjemoterapi kontinueres på lokalsykehus
5-måneders kontroll på studiesenter: - Spørreskjema - Nevropsykologisk test - MR 3 måneder postirradiært - Klinisk undersøkelse
MR 8 måneder etter baseline på lokalsykehus
12-måneders kontroll på studiesenter:
- Spørreskjema
- MR - Klinisk undersøkelse
Videre studiebesøk på studiesenter ved 2, 5, 10 og 15 år
Pasientene følges ellers ved sitt lokalsykehus

PRO-GLIO er en multisenter randomisert fase 3 studie hvor vi ønsker å sammenligne proton- og fotonstrålebehandling for pasienter med isositrat dehydrogenase (IDH)muterte diffuse gliomer grad 2 og 3, astrocytomer og oligodendrogliomer.
PRO-GLIO-studien er et samarbeid mellom totalt 11 studiesentre i Norge og Sverige og totalt skal det inkluderes 224 pasienter mellom 18 og 65 år. Pasientene randomiseres 1:1 mellom foton- og protonstrålebehandling, resten av behandlingen gis etter standard retningslinjer (1). Pasientene vil bli fulgt i 15 år etter inklusjon med MR-undersøkelser, spørreskjema, nevropsykologisk testing og kliniske konsultasjoner (Figur 1). PRO-GLIOstudien åpnet for inklusjon ved Radiumhospitalet i januar 2022 og de andre sentrene har åpnet i tur og orden etter det. Til nå er det inkludert 65 pasienter. Studien har tidligere vært beskrevet i Onkonytt nr2, 2022 (2).
Pasienter som blir diagnostisert med IDH-muterte diffuse gliomer grad 2 og 3 er ofte unge og har lang forventet levetid, til tross for at sykdommen i prinsippet er inkurabel (3-5). Håpet er at protonstrålebehandling kan spare risikoorganer, inkludert friskt hjernevev, i større grad enn konvensjonell fotonstrålebehandling og dermed gi mindre senvirkninger. Man vil også undersøke om den mer konforme dosefordelingen ved protonstrålebehandling ikke går på bekostning av tumorkontroll med tanke på det diffuse vekstmønsteret til gliomer. Det primære endepunktet i studien er intervensjonsfri overlevelse etter 2 år.
PRO-GLIO-studien vil i tillegg undersøke en rekke endepunkter relatert til svulstkontroll, livskvalitet, kognitiv funksjon, rehabiliteringsbehov og helseøkonomiske endepunkter. Man håper at den nye kunnskapen skal bidra til bedre behandling og en mer helhetlig tilnærming overfor disse pasientene. Før protonsentrene
åpner i Bergen og Oslo sendes de norske pasientene som randomiseres til protonstrålebehandling i PROGLIO-studien til Skandionkliniken i Sverige, mens fotonstrålebehandling gis ved pasientens den lokale behandlingsinstitusjon.
DELSTUDIER
Å bli diagnostisert med sykdom som IDH-muterte diffuse gliomer grad 2 og 3 er livsomveltende. For å få dybdekunnskap om pasientenes perspektiver er det også laget en kvalitativ delstudie. I denne har man inkludert 19 norske pasienter fordelt med henholdsvis 9 og 10 pasienter i hver behandlingsarm. Det gjennomføres individuelle dybdeintervjuer på fire tidspunkter (baseline og etter 5 måneder, 2 år og 5 år, Figur 2). I den kvalitative delstudien fokuserer vi på hvordan det er å få diagnosen, synet på fremtiden, livskvalitet, hvordan behandlingen oppleves og hvordan det er å være med i en randomisert studie.
Innsamlede data vil bli analysert med tematisk metode (6). Til nå er alle de 19 inkluderte pasientene intervjuet ved baseline og etter 5 måneder. Vi håper at denne delstudien skal bidra til bedret informasjonsflyt og pasientforløp både i og utenfor PRO-GLIO-studien.
Å få en alvorlig kreftsykdom påvirker ikke bare pasienten, men i høyeste grad også deres nærmeste. For å belyse dette aspektet er det i PRO-GLIO en delstudie for pårørende, i denne er det hittil inkludert 58 personer. I denne delstudien blir pårørende bedt om å fylle ut spørreskjema på en rekke tidspunkter gjennom studieforløpet.
I en multisenter strålestudie er kvalitetssikring av inntegning og planlegging sentralt for å sikre at pasientene mottar likest mulig behandling i henhold til protokoll og uavhengig av studiesenter (7). Variasjon i avlevert strålebehandling avhenger av både inntegning av målvolum og risikoorganer og hvordan stråleplanen utformes, her kan det være både inter- og intraindividuelle forskjeller (Figur 3). I PRO-GLIOstudien er en dummy-run prosedyre obligatorisk ved alle studiesentrene før inklusjonstart. Dummy-run prosedyren er todelt, først skal alle sentrene tegne inn målvolum og risikoorganer
på minst 1 kasus, deretter skal alle sentrene lage en stråleplan basert på en konsensusinntegning, dette for å sikre best mulig sammenligning av planene. De norske sentrene har laget fotonplaner (noen også protonplaner), mens de svenske sentrene har laget en foton- og en protonplan på hvert kasus (Figur 4). Det er planlagt to artikler basert på dummy-run prosedyren, en som omhandler inntegning og en med analyse av stråleplanene. Inntegning og planlegging er gjennomført ved alle 11 sentrene, og analyser av data er under arbeid.
I løpet av 2025 skal det åpnes to protonsentre i Norge og det er viktig å sørge for god seleksjon av pasienter som kan profitere på protonstrålebehandling. Det nevroonkologiske miljøet ved Radiumhospitalet har i den forbindelse et pågående prosjekt relatert til strålebehandling av hypofysesvulster. Også disse pasientene er ofte unge og med normal/lang forventet levetid, så minimering av strålebivirkninger er sentralt for å opprettholde god livskvalitet i lang tid. Formålet med prosjektet er å finne ut hva som er den beste strålebehandlingen for pasienter med hypofysesvulster. I denne stråleplanleggingsstudien lages det fire stråleplaner for 15 pasienter som tidligere har mottatt strålebehandling for hypofysesvulst. Vi ønsker å sammenligne ikke bare fotonog protonstrålebehandling, men
også ulike teknikker for protonstrålebehandling. For hver pasient vil det i tillegg til en fotonplan (VMAT) lages
3 ulike protonplaner hvor antall felt (3 versus 2) og feltvinkler varieres for å sammenligne stråledose til friskt hjernevev og risikoorganer. Arbeidet forventes å bidra til økt kunnskap om optimalisering av strålebehandling for pasientgruppen, og man regner med at det ofte vil være nødvendig med en individualisert behandling basert på lokalisasjon av svulst, størrelse og nærhet til risikoorganer. Stråleplanene er laget og dataanalyse pågår.
KREFTFORSKNINGSSTIPEND
Kolbjørn Brambani-stipendet som ble tildelt Liv Cathrine Heggebø i 2023 vil gi henne mulighet til kompetanseheving innen protonstrålebehandling. Dette inkluderer mulighet til å reise på kurs, hospitering og konferanser
– og selvsagt presentere PRO-GLIOstudien. Vi planlegger også at midlene kan bidra til å sette opp en database for MR-undersøkelser og stråleplaner fra PRO-GLIO-studien som vil gi et rikt datagrunnlag for videre forskningsarbeid.
PRO-GLIO-studien støttes av Helse Sør-Øst, Kreftforeningen, Hjernesvulstforeningen, Network in Radiation Oncology (NIRO), Svenska Läkaresällskapet, Göteborgs Läkaresällskap, Jubileumsklinikens Cancerfond og Lions Cancerfond Väst i Sverige.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no

Prisen, som skal deles ut av NOF ved hvert årsmøte, gis til en onkolog eller lege under spesialisering i onkologi, som på en eller annen måte har utmerket seg gjennom klinisk praksis og/eller god forskningsinnsats og/eller på en annen måte gitt et viktig bidrag til det onkologiske fagfeltet i Norge Det legges vekt på at kandidaten har bidratt til å skape et godt arbeidsmiljø Kandidaten må være medlem i NOF
Aktuelle kandidater med begrunnelse for forslaget meldes inn til NOF ved styreleder Daniel Heinrich
Prisen vil bli delt ut på Onkologisk Forum 2024 og består av kunst til en verdi av 10 000 kr pluss diplom
Fristen for innmelding er 01.10.2024
Innmelding sendes til NOF: Daniel.Heinrich@sykehuset-innlandet.no
Det var mange år siden jeg hadde vært på ESTRO og gledet meg som et barn. Kongressen svarte til forventningene med utrolig mange flotte foredrag, hyggelige møter med kollegaer fra inn- og utland, også avtaler og besøk i utstillingshallen ga utbytte. Tross regnvær var Wien en fantastisk by og et vell av kulturelle opplevelser.
 LIV ELLEN GISKE
LIV ELLEN GISKE
Overlege Kreftavdelingen, Sykehuset Innlandet, Gjøvik
Det lønner seg å vite hva en vil prioritere, da får en mest utav oppholdet.
Jeg valgte å fokusere på palliasjon, samtidig som jeg fikk med meg mye annet spennende også, spesielt aktuelle diskusjoner rundt brystkreftbehandling.
«Palliative care: Patient’s and physician’s journey in the era of new treatments and radiation techniques». Overskriften fenget; pasientens og legens reise… Ja, for det har vært en reise for oss som startet med simulator og direkteinnstilling på apparat, ett felt bakfra, kilde-hud-avstand og manuell konturtagging med «strikkepinner». Vi lærte mye av erfarne stråleterapeuter, ikke minst at vi måtte jobbe så fort og stille som mulig for at pasienten skulle bruke kortest mulig tid på simulator.
For pasientene har det også vært en reise med en enorm tilvekst av behandlingsmuligheter. Dette har ikke bare gitt økte kurasjonstall, men betydelige muligheter for ny behand-
ling når sykdommen residiverer og metastaserer.
I tillegg til mange nye systemiske behandlingsmuligheter, har vi hatt en enorm teknisk utvikling innen stråleterapi. Jeg forventa å bli skikkelig oppdatert på fraksjoneringsmønstre og foretrukne teknikker, godt begrunna i forskningsrapporter og erfaringer fra kloke kollegaer ute i den store verden. Som leger må vi være tilpasningsdyktige og oppdaterte på nyvinninger som kommer pasientene til gode, men vår kritiske sans er også viktig. Ikke alt nytt betyr en forbedring, og hva er forbedringen, har den egentlig klinisk konsekvens? Vi har hatt noen paradigmeskifter i faget vårt, men de fleste endringer baserer seg på langt mindre prosentuell forbedring.
Mine spørsmål før kongressen var bl.a.: Engangsfraksjoner når? Andre aktuelle fraksjonsmønstre? Stereotaksi og IMRT i palliasjon?? Når det enkle er godt nok, hvorfor da gjøre ting komplisert? Og komplisert for hvem? For meg? For doseplanleggerne? For

de på behandlingsapparat? Og hva med pasienten? Tre av foredragene omhandlet ikke stråleterapi i det hele tatt.
Med sitt åpningsforedrag: «Advance care planning: How early should palliative care start?», satt Yvette van der Linden fra Nederland både stemning og standard for dette 7 timers lange formøte-programmet. Pasienten og pasientens beste var i sentrum. Hun snakket om at vi tidlig nok måtte integrere samtalen om palliasjon. Van der Linden mente at vi har en tendens til å utsette å snakke om palliasjon, og at palliasjon starter mye tidligere og mer gradert i sykdomsforløpene nå enn slik vi tenkte før. Hun refererte bl.a. til Murray et al sin artikkel i BMJ 2005 (Figur 1).
Advance care planning er pro-aktiv planlegging for å definere mål og
«Blir jeg overrasket om denne pasienten lever om 1 år?»
Og motsatt: «Blir jeg overrasket om denne pasienten er død om 1 år?»
preferanser frem i tid sammen med pasient og pårørende, og med rom for endring underveis. Hun (van der Linden, red.anm.) snakket om at vi leger forholder oss til det fysiske (den nederste delen av Maslow’s pyramide fra 1943); sykdommen, symptomer og behandling – og det må vi selvsagt. Men at god palliativ omsorg ivaretar hele mennesket med også psyko-
logiske, sosiale og åndelige dimensjoner. Selv en pasient som kommer for strålebehandling av en skjelettmetastase har ofte mer eksistensielle bekymringer. Når vi greier å integrere dette i vår tilnærming til pasient og pårørende, vil de føle seg sett og ikke som et nummer i rekka.
Van der Linden oppfordret oss til «two track approach», hvor det kurative og palliative løpet snakkes om samtidig og tidlig nok. Utsetter en å snakke om døden, kommer den ofte brått og brutalt, sammenfallende med mange plagsomme symptomer og mindre rom for gode samtaler og planlegging. Resultater fra relativt like spørreundersøkelser i flere land har vist nytten av at vi spør oss selv: «Blir jeg overrasket om denne pasienten lever om 1 år?» Og motsatt: «Blir jeg overrasket om denne pasienten er død om 1 år?»

Dette gir økt bevissthet rundt behovet for palliativ omsorg.
Og mange studier viser at tidlig integrert palliativ omsorg gjør at den siste tiden blir mer slik en ønsker, både for pasient og pårørende, bl.a. med færre sykehusinnleggelser.
Hun viste eksempler på enkle spørsmål som raskt ivaretar både det fysiske, psykiske, sosiale og eksistensielle. Hun mente også at vi som leger hadde godt av å gå gjennom disse spørsmålene for oss selv.
Palliativ omsorg er teamarbeid, det kreves kunnskap, kreativitet, kommunikasjonsevner og empati. Kun en mindre andel av pasientene krever svært spesialisert palliasjon. Vi må spille på hverandres styrker og også kjenne på egne grenser. I Holland
jobbes det med kompetanseløft for palliasjon.
Joanna Kazmierska fra Polen fulgte senere på dagen opp med et foredrag om kommunikasjon med undertittelen: «Hva er sagt? Hva er hørt?», for det er det det handler om, mente hun. Og det gjelder også andre veien, det er ikke alltid vi har hørt hva pasienten har sagt.
Hvorfor er kommunikasjon så vanskelig? Kunnskap er ikke det samme som å forstå. Når vi snakker om bivirkninger for eksempel, ber vi egentlig pasienten om å forestille seg noe han ikke har noe forhold til. Det aller viktigste i god pasient-legekommunikasjon er relasjonen. Den bygger på tillitt, og gjør samtalen om de vanskelige tingene enklere, også for legen.
Kazmierska snakket om hva som er våre barrierer, hva hos oss som gjør det vanskelig både å gi dårlige beskjeder samt ta beslutninger om behandlingen mot slutten av livet. Frykt for egen dødelighet, for egne og andres følelser, skyldfølelse og skuffelse når vi ikke kan helbrede, slitenhet og stress er noen av svara. For pasient og pårørende er misforståelser, endringer i roller, sterke følelser og mangel på støtte bl.a. barrierer.
Hvordan kommunisere dårlige nyheter? Mange pasienter ønsker å være med å bestemme når og hvor og sammen med hvem, men det er viktig at det skjer tidlig nok. Det viser seg at de fleste pasienter kun husker omtrent 20% fra en slik samtale. Kazmierska mente også at legens følelser, mer enn pasientens livskvalitet, kan være
avgjørende for når legen avslutter tumorrettet behandling.
«Hvor lenge har jeg igjen å leve?»
Spørsmålet handler om prognose og håp. Det gir muligheter for en god siste tid og nye små håp i hverdagen, men er også svært utfordrende.
Spesielt i tilfeller der pasienten har urealistiske håp og dette støttes av legen, fordi han/hun også er lei seg grunnet egne følelser i saken.
I en oversikt fra tidlig 2000-tall visste bare 14 % av legene hvor pasienten ønsket å være når han døde. For pasientene er det viktig at de føler at legen er komfortabel med å snakke om døden.
Kazmierska refererte til SPIKESmodellen, beskrevet av Baile og Lenzi i The Oncologist fra 2000, hvor rammene for å gjøre dette på en god måte er satt opp. Hun inviterte – som van der Linden – til selvrefleksjon, og hun avsluttet med noen «To do and not to do». Si aldri «jeg forstår hvordan du har det», for det gjør vi ikke. Og vær ikke redd for stillhet, den er nødvendig!
Mot slutten av dagen snakket Caroline Hertler fra Sveits om spesielle utfordringer i terminalfasen, altså de siste dager til uke(r). Hun ba oss være var på hvordan vi ordlegger oss. Behandling slutter ikke når tumorrettet behandling opphører, den finner bare ny retning. Og at pasienten får riktig behandling i denne tiden er viktig, både for den døende og de som står nær og skal leve videre.
Hun gikk spesielt inn på smerte, dyspnø og blødning, og minnet oss på at alt vi tenker på i kurativ setting, må vi også tenke på i terminalfasen. Hvordan er smerten? Kan den skyldes noe annet enn den opplagte tumorsmerten? Hun snakket om den totale smerten som ikke minst påvirkes av det en skal dø fra. Smerte i terminalfasen er en spesiell smerte. Forventes akutt blødning i terminalfasen er det viktig at både pasient og pårørende er informert, og at en har en plan for hvordan dette skal håndteres. Diffus småblødning forutsier ofte større blødning.
Den gode død, er den mulig? Da er alle forberedt og godt informert med tid nok til å snakke om de viktige tinga. Hun minnet om at spesielt hos pasienter med primære hjernetumores er det viktig å være tidlig ute. 90% av dem har allerede på diagnosetidspunktet en viss grad av kognitiv svikt. Hertler påpekte også vårt ansvar for at det skal gå best mulig med de etterlatte. Vår jobb slutter ikke med døden, mente hun. Det er påvist økt dødelighet hos pårørende, spesielt kardiovaskulær død, det første halvåret. Dette minner oss om hvilket enormt stress også de etterlatte har vært utsatt for. 10-20% får forlenga sorgreaksjon med redusert funksjonsnivå og depresjon, for noen også med suicidale tanker.
Carsten Nieder fra Bodø og Norge holdt et interessant foredrag: «Prediction of survival – hype or useful tool for health care professionals». Allerede i 2014 var han medforfatter av boka «Decision Tools for Radiation Oncology». Han refererte
til flere studier, både eldre og yngre, om hvor vanskelig det er å forutsi forventet levetid. PS (performance status, red. anm.) viser seg å være den viktigste enkeltfaktoren. Han viste forskjellige verktøy for å predikere livslengde og at dette var nyttig i klinikken.
LabBM er et slikt verktøy, opprinnelig laget for å vurdere pasienter med hjernemetastaser. Nieder og kollegaene i Bodø fant at dette kunne brukes ved alle slags palliative pasienter, og de laget et tilsvarende verktøy som de kalte LabPS. Som i LabBM gjøres 5 blodanalyser; Hb, trombocytter, Albumin, LDH og CRP. Avvik gir en fastsatt score (0, 0.5 eller 1), ECOGstatus skåres også (ECOG 0-1=0p, 2=0,5p og ECOG 3-4=1p). De skåret og fulgte 375 pasienter som fikk strålebehandling med ulike regimer. Det var høy korrelasjon mellom høy totalskår og rask død. Alle pasientene med ECOG 3-4 og 5 unormale blodprøver døde innen 35 dager. På den annen side levde alle med normale blodprøver og ECOG 0-1 etter 6 mndr. Det finnes også et onlineverktøy laget av JC Farris, som kan brukes for prediksjon.
Alle verktøy har til hensikt å hjelpe oss å velge ut riktig behandling for riktig pasient. Et dilemma er de som havner i en dårlig prognosegruppe, men viser seg å være langtidsoverlevere. Også Nieder kom med overraskelsesspørsmålet: “Hvor overrasket blir jeg om denne pasienten lever om 3 mndr? I 1 år?» Vi må passe oss for å bruke opp tiden til en pasient med svært kort forventet levetid.
Nicolaus Andratschke fra Sveits snakket om «Standards and Innovation in palliative RT» og da spesielt fokus på rebestråling. Det er ulike scenarier: full overlapp, partiell overlapp og situasjoner hvor kumulativ dose gir utfordringer, enten til bestrålt organ eller OAR (organ at risk, red.anm.). Og en må skille mellom repetert strålebehandling til et organ, og når overlappen skyldes rebehandling i ulike organ. Det har vært et økende antall publikasjoner om rebestråling, med gode rapporterte kliniske parametre. Men utover fraksjoneringsmønstre har svært få registrert detaljerte stråledata, så som dosimetri, volumer, OAR-data m.m. Overføringsverdien blir da usikker, selv om konklusjonene kan være riktige. Han viste til en rekke systematiske reviews og nye konsensusguidelines, men mye er fortsatt uavklart.
Også Andratschke snakket mye om pasientseleksjon Han trakk fram en systematisk reviewartikkel av Drodge et al fra 2014, hvor de så på symptomkontroll ved palliativ mediastinal bestråling. Hemoptyse, dyspnø, obstruksjon og smerte var indikasjonene. 69% hadde respons og noen var, palliasjon og rebestråling til tross, langtidsoverlevere.
Hva kjennetegnet disse pasientene, altså hva predikterte god og langvarig effekt (>2 år)? Det så ut som totaldosen hadde noe å si, men ved ensidig å se på dose, kan en overse toksistetsbildet og gi for tøff behandling til pasienter som ikke bør ha det. En gikk derfor andre vegen og fant at
Hun poengterte også viktigheten av å forklare pasientene hva som skjer «når det ikke skjer noe»
KPS>=80, planned target volum <300c, fravær av metastaser og ekstratorakal sykdom, samt tid til residiv >1 år etter primærbehandling, skilte seg ut som prognostisk gunstige faktorer. Slik kan en ved å ta hensyn til hvordan pasienten har det og tumorkarakteristika, beslutte hvem som antas å ha nytte av en høyere dose. Og hvem som, for kortvarig symptomlindring, bør ha lavere totaldoser.
Ved beslutning om rebestråling er effekt av tidligere behandling, tidligere og evt. gjenværende toksisitet samt tid til residiv viktige parametre. Dette sammen med PS, vil da hjelpe oss i beslutningen om en ved rebestrålingen skal gå for høyere dose for bedre tumorkontroll. I tillegg kommer betraktninger for OAR. Hva er ansett som trygge doser? For medulla spriker det fra 56 til 65 Gy, men også andre forhold spiller inn, som tid siden forrige behandling. Ut ifra dagens viten er det kun CNS (hjerne og medulla) som har recovery.
Til mindre volum som blir bestrålt, til større er toleransen (volumeffekten). Hva er trygt for lungene? Pneumonittrisiko øker ikke ved rebehandling på samme sted, men (avhengig av lokali-
sasjon) kan risiko for costafraktur øke. Ved repetert lungebestråling (annet sted) øker sjansen for pneumonitt.
Andratschke viste eksempler på multiple lesjoner og repetert SBRT (stereotactic body radiotherapy, red.anm.). Overlevelsesdata brukes som surrogat for toksisitet. I SBRT-studier med svært høye doser til sentrale luftveier, kom mer fraksjonert behandling bedre ut med hensyn til toksisitet. Også dette var studier uten volumdata og tilstrekkelig informasjon om kumulative doser. Materiale fra eget hus viste vel tolererte svært høye kumulative doser i thoraks. I en rebestrålingssituasjon anbefalte han likevel mer forsiktig fraksjonering.
De fleste som gir rebestråling, gjør dette på individuell basis uten vedtatte retningslinjer. Det er derfor viktig å komme sammen og prøve å bli enige om noe. For ØNH-kreft og glioblastom finnes verktøy for rebestråling, som i det minste kan gi oss hint om veien videre. Lokoregional kontroll er god grunn til rebestråling, selv om overlevelsen ikke øker. Ved rebestråling av ØNH-kreft snakkes det om risikoen for carotis blow-out (letal veggruptur i a. carotis). Den ligger i størrelsesorden 2-12,5%, med økt risiko ved ung alder, carotisinvasjon på mer enn halve sirkumferensen, og bruk av SBRT. Likeledes doser over 120 Gy med konvensjonell fraksjonering og >100 Gy ved SBRT (EQD2) samt parametre som hudinvasjon, abscess og ulcera.
Det foregår et arbeid i regi av ESTRO under ledelse av fysikergruppa for å
prøve å standardisere rebestråling. Viktige spørsmål er α/β, antagelser for recovery, dosekalkuleringsmodeller m.m. E2-Radiate, en EORTCobservasjonsstudie hvor en ønsker at klinikere sender inn data. Det er 3 kohorter – Oligo-care, ParticleCare og ReCare. Her oppfordres vi alle til å delta.
Joanne van der Velden fra Utrecht gikk gjennom utviklingen av «Fast track clinic», fra begynnelsen i Toronto til nå, og fordelen dette har hatt spesielt for palliative pasienter. I Utrecht startet de i 2014, da med én pasient per dag, nå behandler de 4 lokalisasjoner per dag. Målet for de aktuelle pasientene er at de får behandling innen 48 timer etter at den er rekvirert og at totaltiden på sykehuset kun skal være 3 timer. Forutsetningene er dedikerte team, samt avsatte slots til både lege, CT og behandlingsapparat.
I Utrecht ble antall ø-hjelpspasienter i helger halvert. Med dette kan en også gir flere sårbare pasienter muligheten til behandling ved at det blir færre oppmøter, ideelt sett bare ett. Flere pasienter ble på denne måten behandlet med engangsfraksjon ved smertefulle metastaser, som anbefalt. Men det kan også være aktuelt for pasienter med lungecancer og blødninger, eller der hjernestereotaksi er aktuelt. Der engangsfraksjoner mot slutten av livet kan gi meningsfull symptomlindring, er dette et viktig tiltak. Utfordringer skjer dersom situasjonen er mer komplisert enn forutsett, samt oversett interaksjonsproblematikk med systemisk behandling grunnet
tidspress og forventninger fra pasienten.
Fra 2019 har de prøvd «same-day MR-linac guided RT» for smertefulle skjelettmetastaser, og fra 2020 introduserte de VMAT-planlegging for disse pasientene. Kan det gjøres enda raskere? I FAST-METS-studien i Amsterdam tegnet en inn MV på diagnostiske CT-bilder og brukte CBCT som kontroll, og også for replanlegging om nødvendig og mulig. Medgått tid gikk ned til 85 min, derav 30 min for pasienten i behandlingsrommet. Dagens innovasjon inkluderer strålebehandling uten forutgående doseplan-CT, og SBRT med MR-linac på samme dag, avsluttet van der Velden.
Stråleterapeut Madalyne Chamberlain fra Zürich gikk gjennom vårt felles ansvar for at pasienten skal ha nytte av og å orke og gjennomføre behandlingen, og hvordan de strukturert screenet pasientene før stereotaktisk behandling. Stikkord er PS, compliance, evne til å ligge stille lenge nok, god kommunikasjon og gjentatt informasjon. Hun poengterte også viktigheten av å forklare pasientene hva som skjer «når det ikke skjer noe». God informasjon reduserer angst og bekymringer før og under behandlingen. Pasientkomfort er nøkkelen, og hun presiserte nytten av å bruke gode monitoreringssystemer, også aktivt på palliative pasienter. Hun snakket om tid, robusthet og besparelse av OAR, hvor det kan være andre prioriteringer enn hos kurative pasienter.
Dette ble etterfulgt av et nytt foredrag av N.Andratschke, stråleonkolog i Zürich. «What to consider for stereotactic radiotherapy in palliative patients –Practical considerations». Stereotaksi er ideelt ved mindre volumer, men grensen for akseptert tumorstørrelse har økt. Dosedistribusjonen er annerledes enn ved konvensjonell behandling, og en utnytter inhomogeniteten for å komme opp i høye doser i tumor. Det har ikke vært en ensartet måte å foreskrive dosen på, så sammenligninger kan være vanskelig. Samme dose til PTV kan bety forskjellig dose til tumor. En har sett opp til 95% lokal kontroll. Med potensielt svært høy tumordose med bratt dosefall, sparing av risikoorganer, lav akutt toksisitet og kort behandlingstid, er dette godt egnet for palliative pasienter. Som oftest har en kun GTV og liten margin til PTV.
Stereotaksi egner seg godt som eneste behandling til eldre skjøre pasienter med NSCLC, det er bedre overlevelsesdata enn ved konvensjonell behandling. Forskjellige regimer kan velges ut ifra toksistetshensyn, 15 Gy x 3, 12 Gy x 4 og 7,5 Gy x 8. Stereotaksi har vist god lokal kontroll ved hepatocellulært carcinom hos skjøre pasienter som ikke tåler sedvanlig kurativ tilnærming,
Stereotaksi ved oligometastaser har vist økt PFS og OS for flere tumorgrupper. For første og eneste metastase, og også ny oligo, er prognosen bedre enn når det foreligger flere metastaser. Resultatene bør bekreftes i større kohorter. Andratschke anbefalte også SBRT hos noen pasienter med
disseminert sykdom. En kanadisk studie viste bedre symptomlindring ved 12 Gy x 2, enn 4 Gy x 5. Ved mer systemisk behandling lever mange av pasientene lenger, og en kan t.o.m. komme i situasjoner der primærtumor bør blir behandlet, stadium IV-sykdom til tross. Han er opptatt av at vi velger ut de riktige pasientene og at vi bruker moderne teknikker der pasienten har nytte av det, med færre oppmøter vil vi også kunne nå pasienter som ellers ikke får behandling. Han fortalte til slutt om deres egen BoneShot-studie, hvor pasienten med 65 min total liggetid på bordet, fikk MR-guidet engangsfraksjon mot smertefulle skjelettmetastaser.
To av foredragene omhandlet spesielle behandlingsmetoder. Først ut var Peter Hoskin fra UK, som snakket om brachyterapi i palliasjon. Det er få publikasjoner og de fleste med få pasienter. Best nytte er det ved vist øsofaguscancer, men også ved rektumog gyncancer, samt ved affeksjon i hud og underliggende vev, hvor anatomien er utfordrende. Brachyterapi er konform, har optimal dosedistribusjon og bratt dosegradient. Den kan redusere bulky tumor samt symptomer som dysfagi og blødning, og den kan brukes der rebestråling ellers ville være krevende.
Orit Kaidar-Person fra Israel snakket om «Lattice RT for store lesjoner». Ingen i salen hadde egenerfaring med denne type behandling. Hun refererte til en artikkel fra 1933. Dette er altså en gammel behandlingsmåte, hvor en før linacenes tid kunne behandle i dypet og samtidig hudbesparende ved
En pasient kan være ute av stand til å motta en behandling vi er i stand til å gi
å gi mange tynne felt med høy dose. Denne gitterbehandlingen har sin egen biologi, og mye er ukjent. Hun viste til egen erfaring og enkelte nyere publikasjoner, men det er få pasienter og vanskelig å komme med entydige råd. Hun mente, tross krevende planlegging, at dette kunne ha sin plass i spesielle situasjoner hvor palliative doser ikke vil ha effekt, og hvor høyere doser utfordres av OAR. Som ellers er det viktig å velge ut de riktige pasientene som kan ha nytte av dette.
Bianca Hoeben fra Utrecht holdt innlegg om utfordringene og mulighetene ved palliativ strålebehandling hos barn/unge voksne. Den største utfordringen er å vite når en virkelig kun snakker om symptomlindring. På den andre siden er nytten av behandlingen mindre om den gis i livets siste 30 dager. Hun snakket av egen erfaring og med referanse til litteraturen. Svært få barn/unge voksne tilbys strålebehandling, og hovedbarrieren er bekymringer for toksisitet. Indikasjoner, lokalisasjoner og teknikk er likt som for voksne, men histologien er annerledes. Generelt er disse svulstene svært radiosensitive, og ofte med effekt allerede etter 1 uke. Noen gikk i langvarig komplett respons. De fleste fikk fraksjonsdoser på 2,5 Gy eller mer, og Hoeben’s erfaring var
at akutt-toksisiteten var mindre hos barn enn hos voksne. Kun hos 10% er anestesi nødvendig. Hun la også frem resultatet av en studie med stereotaktisk strålebehandling til isoeffektive doser for barn med sarkom/neuroblastom. Her fant de (med unntak for lesjoner i orbita og vertebra) største besparelse til OAR ved å gi 3 eller 5 fraksjoner mot 20-30 fraksjoner med konvensjonell behandling. Ved diffust intrinsic pontin gliom, hvor det ikke finnes kurasjon, er hypofraksjonering å anbefale. Nye guidelines ble publisert i 2021.
Hoeben snakket også om spesielle utfordringer hos unge voksne, og våre utfordringer som helsepersonell i møte med disse pasientene, der (urealistiske) håp om effekt av behandling kunne føre til uthalende intensiv behandling og utsettelse av formidling av dårlige nyheter. Intensiv behandling er mer vanlig for barn og unge voksne (rundt 50%) og fører til dårlig kvalitet på den siste tiden. Opptil 85% ønsker å få dø hjemme. Også her er kommunikasjon nøkkelen, og viktigheten av å koble inn palliative team og lage gode planer ble understreket. Vi trenger bevissthet og følsomhet i møte med disse pasientene.
Icro Meattini fra Firenze holdt et innholdsmettet foredrag om «Interaksjoner mellom systemisk behandling og strålebehandling» Det har kommet mange nye kreftmedisiner de siste åra, der noen er kjente radiosensitizers, og det foreligger en del studier. Men generelt foreligger lite data om kombinasjon med stråleterapi for svært mange av
de virksomme nye medikamentene. Økt viten rundt interaksjoner kan kanskje være aktuelt tema for et senere OnkoNytt.
Yvette van der Linden og Joanne van der Velden, begge fra Nederland, holdt avslutningsforedraget om behandling av kompliserte beinmetastaser. De ukompliserte er de som gir smerter, men er uten truende eller påvist fraktur, og uten kompresjon av medulla eller cauda equina (uavhengig av metastasens størrelse). Her er anbefalingen 8 Gy x1 (level 1 evidens). Men hva med de kompliserte? En lesjon kan skåres med hensyn til kompleksitet på bakgrunn av lokalisasjon, smertegrad og lesjonens utseende og hvor mye den involverer av knokkelens
diameter. De viste hvordan det også i palliative situasjoner er nyttig med multidisiplinære beslutninger, hvor nevrologiske funn, lesjonens beliggenhet og pasientens allmenntilstand veies opp mot onkologiske behandlingsmuligheter og behov for stabiliserende tiltak (NOMS framework). Slik kan en metastase i Th11 ende opp med behandlingsmulighetene 8 Gy x 1, 3 Gy x 10, eller stereotaksi med 18 Gy x 1, alt etter totalsituasjon.
Alle onkologer, uansett subspesialitet, vil møte den palliative pasienten. Som ellers gjelder det å finne riktig tiltak til riktig tid. En pasient kan være ute av stand til å motta en behandling vi er i stand til å gi.
Denne dagen – og starten på mitt ESTRO 23 – ble en vakker påminnelse om hva som er viktig i møte med våre pasienter og deres nære og kjære. Omsorg for hele mennesket betyr at vi også anerkjenner det ikke rent fysiske, at vi er lyttende og seende, at vi utnytter våre tekniske behandlingsmuligheter på en klok måte. Vi fikk presentert prognostiske verktøy som kan bevisstgjøre oss med tanke på forventet levetid, og stereotaksi er allerede godt etablert i palliativ strålebehandling. Palliativ strålebehandling innebærer ofte rebestråling, og det gjøres og planlegges kartlegginger for tryggere estimering av kumulative doser. De mange foredragene inneholdt interessante referanser, som jeg gjerne deler.


ESMO World GI-konferansen som fant sted i Barcelona i 28/6-1/7 2023. Konferansen organiseres av det europeiske fagmiljøet innen GI-cancer, og er kjent for å tiltrekke seg deltakere fra både Asia, Afrika og USA. Som takknemlig mottaker av NOF-stipend har jeg skrevet følgende rapport fra møtet.
 HANNE HAMRE
HANNE HAMRE
Overlege
Felles for flere diagnoser, ikke bare kolorektal cancer, er at det foregår mye innen målrettet behandling, der KRAS- og HER2rettet terapi peker seg ut med noe mer konsistente data. Fase 3 studier er fortsatt fraværende, det er såkalte waterfall- plots som er standarden, og dette er vel noe vi må venne oss til da prevalensen for flere av diagnosene ofte er for lav til å rekruttere tilstrekkelig mange pasienter, særlig hvis det er konkurrerende agens på markedet. Det kan være lett å glemme at virkningen av «hemmere» sjeldent varer lenger enn noen få måneder, og så snart en «hemmer» har vist en viss grad av respons eller dårligere respons, kommer resistens- og ev. kombo-studiene på rekke og rad. Både for KRAS-mutasjoner og HER2-amplifikasjoner jobber flere konkurrenter parallelt, noe som holder farten på resultater oppe, men en skeptisk onkolog savner fase-3 data sterkt. Dersom man kan gi flere «hemmere» etter hverandre eller gi tilleggs-medikamenter, som forsterker effekt eller motvirker resistens, så kan man kanskje øyne håp om at vi om noen år kan skilte med meningsfulle livsforlengelser for i hvert fall noen av pasientene våre.
Men, dette krever testing av mange pasienter. Fremdeles kan de fleste forandringer detekteres på DNA- nivå,
der pris på analyser stadig går ned, men dessverre kreves det bredere testing ved for eksempel fusjoner (NTRK, FGFR), og der flytende biopsi virker klart underlegen vevsanalyse. I tillegg har vi biomarkører som fordrer andre teknikker (CPS-score, PDL1 score, eventuelt Claudin-18). Alt i alt synes veien framover som labyrintisk.
REFLEKSJONER OG NYTT FRA SPESIFIKKE DIAGNOSER Pankreascancer
Debatten for og mot neoadjuvant kjemoterapi ved pancreascancer ble i lys av NORPACT-1 studien drøftet. Det er åpenbar usikkerhet i hvorvidt direkte resektable svulster bør behandles med neoadjuvant kjemoterapi, en debatt som har pågått siden studien ble presentert. på ASCO i sommer. Håpet er at resultater fra de ikke ferdigstilte studiene PREOPANC 3 og ALLIANCE skal kunne avklare dette spørsmålet.
Gastroøsofageal cancer
Elizabeth Smyth presenterte resultater fra VESTIGE-studien (FLOT versus ipilimumab/nivolumab i postoperativ setting hos høyrisikopasienter). Noe overraskende så man at sykdomsfri overlevelse var betydelig bedre hos pasienter som fikk FLOT (23 måneder versus 12 måneder). Resultatene indikerer at immunterapi neppehar noen plass i postoperativ setting
etter neoadjuvant FLOT, og at FLOT postoperativt sannsynligvis har en beskyttende effekt i seg selv hos høyrisikopasienter.
Videre viste en gjennomgang av pasienter med MSI svulster (INFINTY og NEONPIGA studiene) at neoadjuvans med PD1-hemmer + CTLA4hemmer kan være veien å gå for MSI ventrikkelcancere, og at resultatene for denne pasientgruppen bør ut av studiene på hele pasientgruppen Resultater for HER2-positive svulster hva gjelder tillegg av PD1-hemmer neoadjuvant og i første linje palliativt ble ikke nevnt, men kommer forhåpentligvis på ESMO i Madrid til høsten. Videre foregår det mye utprøvning av andre linjes behandling for HER2-positive pasienter (trastuzumab-deruxtecan, tucatinib), men det spørs om suksessraten man har sett for disse medikamentene ved brystkreft lar seg overføre til pasienter med gastroøsofagale cancere.
Hepatocellulært carcinom
Langtidsdata (4 års oppfølging) fra HIMALAYA-studien ble presentert. Studien har prøvd ut tremelilumab/ durvalumab versus sorafenib i første linje, og i studien var 25% i live i utprøvende arm mot 15% i standard arm. Vi aner den gledelige konturen av «en hale» av langtidsoverlevere. Så blir det spennende å se om IMbrave 150-studien kan vise tilsvarende når denne studien oppnår samme oppfølgingstid (atezolizumab-bevacizumab).
Cholangiocarcinom
Ingen nye data ble presentert, men Dr. Lipika Goyal, en kjent guru innen
denne diagnosen bekreftet at det er mye som skjer på FGFR-hemmerfronten, blant annet blir det spennende å se om videre utprøvning av den selektive FGFR2-hemmeren RLY-4008 viser like gode resultater på større pasientgrupper enn det som ble presentert på ESMO Paris i fjor. Medikamenter som motvirker resistens mot FGFR-hemmere er også under utprøving. Immunterapi i tillegg til kjemoterapi, som første linje i palliativ setting, har i to fase-3 studier vist marginal men signifikant effekt (TOPAZ-1, Keynote 966), og durvalumab er godkjent både i USA og i Europa. Dessverre kan slike godkjenninger ta futten ut av utprøvninger på undergrupper med bedre effekt, da det ikke lenger finnes finansielt insentiv for å finne undergrupper av pasienter med bedre respons. Immunterapi ikke er godkjent i Norge for denne diagnosen.
Kolorektalcancer
Som nevnt kan debatter av behandlingsmodaliteter med stor uenighet øke kunnskap og gi perspektiv. Intet felt egner seg bedre for en slik seanse enn behandling av lokalavansert rektumcancer, der representanter fra alle relevante felt var representert (medisinske onkologer, stråleonkologer, kirurger). Ingen klare konklusjoner kom ut av denne sesjonen men jeg tror at det norske fagmiljøet plukket opp essensen i uenighetene og at det kan åpne for nyanseringen som kreves i prosessen fremover.
Debatten for og mot bruk av sirkulerende tumor-DNA avdekket mulige begrensinger ved bruk av testen med
Kunnskapen en GI-onkolog sitter igjen med etter ESMO er som avføringen fra en velfungerende magetarm-kanal: godt fordøyd og passe stor mengde. Konferansen preges av at ASCO og AAACR er avviklet tidligere på våren. Således kan noen av de amerikanske storhetene få slappe av litt sammen med sine europeiske kolleger og holde korte, velfordøyde innlegg om vårens resultater i fine omgivelser. Dessuten har denne konferansen flere bakgrunnsforelesninger («Meet the expert»), samt innsiktsgivende debatter («PRO and CON») som hever kunnskap innen felt det hersker uenighet på. Dette er en bra konferanse altså!
tanke på om man skal tilby adjuvant kjemoterapi eller ikke. Blant annet varierer sensitiviteten av testen hvilket organ man har metastaser til (høy ved levermetastaser, mye lavere ved lungemetastaser). Innen metastatisk kolorektalcancer snuses det fortsatt på hvordan man kan gjøre MSS-tumores tilgjengelig for immunterapi, mens BRAF/EGFR-hemmere finner plass stadig tidligere i behandlingsforløpet (selv om ingen resultater endrer dagens standard enda). Hva gjelder KRAS G12c-hemming, der lovende data finnes for blant annet lungekreftpasienter, er det mye som tyder på at KRAS G12c-hemmer alene ikke er effektiv nok.
Det var kun ett norsk abstrakt-bidrag i år. Overlege Geir Olav Hjortland fra Oslo Universitetssykehus viste resultater fra den spennende studien «Safety and feasibility of irradiation and nivolumab in esophageal cancera phase I/II study»,
I perioden fra 20. til 24. oktober 2023 ble den årlige ESMO-kongressen i Madrid besøkt av over 30 000 deltakere fra ulike spesialområder. Blant de mange feltene som ble representert, var øvregastrointestinale (GI) kreftformer spesielt interessante. Vi vil nå oppsummere de mest betydningsfulle funnene innen dette feltet, som kan komme til å påvirke vår daglige praksis.
 GHAZWAN AL-HAIDARI
GHAZWAN AL-HAIDARI
Overlege onkolog
Avdeling for kreftbehandling, OUS
Aktiv overvåkning etter neoadjuvant kjemoradioterapi gir sammenlignbar total overlevelse med kirurgi i visse tilfeller av spiserørskreft.
En nylig studie presentert på ESMO-kongressen 2023, kjent som SANO-studien, tilbyr et lovende alternativ til kirurgi for visse pasienter med spiserørskreft. Denne ikke-inferioritetsstudien sammenlignet pasienter som oppnådde klinisk fullstendig respons (CCR) etter neoadjuvant kjemioradioterapi (nCRT) og ble satt under aktiv overvåkning (198 pasienter) med de som gjennomgikk vanlig kirurgi (111 pasienter). Den primære utfallsmålingen, totaloverlevelse (OS) fra dagen for CCR, viste at aktiv overvåkning ikke var dårligere enn kirurgi ved toårsmerket (hazard ratio [HR] 1.14, 95% konfidensintervall [CI] 0.74–1.78; p=0.55). Videre rapporterte pasienter under aktiv overvåkning betydelig bedre helse-relatert livskvalitet (HRQoL) etter 6 og 9 måneder sammenlignet med de som gjennomgikk kirurgi.
Forskjellen mellom de to primære histologiske typene spiserørskreft,
plateepitelkarsinom (SCC) og adenokarsinom, forblir viktig. SCC ser ut til å respondere bedre på kjemioradioterapi (CRT) enn adenokarsinom, noe som gjør ikke-kirurgisk behandling mer gjennomførbar for SCC-pasienter. Studien ga ikke data stratifisert etter histologisk type, så ytterligere undersøkelser er nødvendig.
For pasienter som ikke oppnår CCR, antyder nylige data fra NeoRes II-studien at forsinkelse av kirurgi med 10–12 uker etter fullført nCRT kan føre til dårligere kliniske resultater sammenlignet med tidligere kirurgi. Det trengs en ny randomisert studie som sammenligner alle pasienter som følger SANO-algoritmen med gjeldende standardbehandling (kirurgi innen 6 uker) for å vurdere både livskvalitet (QoL) og totaloverlevelse (OS) som essensielle utfallsmål for bredere klinisk anvendelse.
Immunsjekkpunkthemmere i perioperativ terapi for gastroøsofageal adenokarsinom Interimanalyser fra to fase III-studier ble presentert på ESMO-kongressen 2023, med fokus på immunterapi kombinert med kjemoterapi
for pasienter med ubehandlede, resektable gastro-/gastro-øsofageale overgangs adenokarsinom (G/ GEJ). I KEYNOTE-585-studien førte tilsetningen av PD-1-hemmeren pembrolizumab til kjemoterapi til en signifikant forbedret rate av patologisk komplett respons (pCR): 13,0 % med pembrolizumab sammenlignet med 2,4 % med placebo. I hovedkohorten, der flertallet av pasientene ikke mottok FLOT-kjemoterapi, var pCR-ratene 12,9 % med pembrolizumab og 2,0 % med placebo. Imidlertid forlenget ikke denne kombinasjonsterapien betydelig hendelsesfri overlevelse (EFS).
MATTERHORN-studien avslørte en betydelig økning i pCR-rater for pasienter som fikk durvalumab pluss FLOT (19 %) sammenlignet med de som fikk placebo pluss FLOT (7 %). Studien viste heller ingen forskjell i andelen pasienter som fullførte kirurgi og i R0-reseksjonsraten mellom gruppene. Sikkerhetsprofilene var like, og studien pågår for å vurdere EFS.
Selv om disse funnene var ventet for å håndtere den høye tilbakefallshastigheten hos pasienter som gjennomgår kirurgisk reseksjon etter FLOT, støtter resultatene for øyeblikket ikke den rutinemessige bruken av immunterapi i perioperativ behandling for G/GEJ-kreft. Påvirkningen på klinisk praksis vil avhenge av kommende EFS-data. Resultatene understreker behovet for biomarkørvalgte studier og den potensielle rollen til spesifikke markører som PD-L1 og mikrosatellittinstabilitet-høy (MSI-H) for å forbedre resultater for visse pasientgrupper.
Førstelinjebehandling av pembrolizumab med kjemoterapi/trastuzumab forbedrer progresjonsfri overlevelse (PFS) hos pasienter med HER2positiv metastatisk G/GEJ adenokarsinom Pembrolizumab, i kombinasjon med standardbehandling (trastuzumab og kjemoterapi), har fått europeisk godkjenning for behandling av HER2-positiv metastatisk gastroeller gastroøsofageal junction (G/GEJ) adenokarsinom. Denne godkjennelsen er basert på positive resultater fra fase III KEYNOTE-811-studien.
En interimsanalyse på ESMOkongressen 2023 avslørte at førstelinjebehandling med pembrolizumab og standardbehandling signifikant forbedret progresjonsfri overlevelse (PFS) sammenlignet med placebo og standardbehandling. Hos alle pasienter nådde PFS 10,0 måneder sammenlignet med 8,1 måneder, med en hazard ratio (HR) på 0,72. Hos pasienter med en PD-L1 kombinert positiv score ≥1 var PFS enda mer markert, på 10,8 måneder sammenlignet med 7,2 måneder.
I den tredje intermisanalysen, med 606 PFS-hendelser og en median oppfølgingstid på 38,5 måneder, var 24-måneders PFS-rater henholdsvis 24 % og 15 % for gruppen som fikk pembrolizumab pluss standardbehandling og placebogruppen pluss standardbehandling. Den objektive responsraten forbedret seg også med pembrolizumab, med 73 % sammenlignet med 60 % for placebogruppen,
med sykdomskontrollrater på 92 % sammenlignet med 87 %.
Eksperter tror disse funnene vil ha betydelig innvirkning på behandlingslandskapet for pasienter med HER2positivt avansert G/GEJ-kreft. Studien antyder at PFS bør vurderes som en verdifull endepunkt for regulatorisk godkjenning uten behov for å vente på data for total overlevelse.
Den europeiske årskonferansen i onkologi i Madrid bød på realt «norsk» sommervær – tross 35 grader uka før var det styrtregn ankomstdagen og småkaldt de neste dagene. Enda verre var det for stakkarene som ikke fikk bagasjen ved ankomst og måtte gå i våte klær! Selv utenom turistsesongen myldret det av folk. Lettest var det å ta seg frem med Madrids metro, med avganger hvert 5. minutt og et av verdens største spornett under byen. Den forbløffet også med å kjøre i venstre spor, hvilket faktisk er mer forvirrende enn det kan høres ut når toget dundrer ut av tunnelen fra «feil» hold.
 ARNE WESTGAARD
ARNE WESTGAARD
Overlege
Seksjon for mage- og tarmkreft, Avdeling for kreftbehandling, Oslo universitetssykehus
Også i år var det mange godbiter om kreft i pankreas, galleveier eller lever. Nærmere bestemt var 171 av de totalt 2185 aksepterte vitenskapelige arbeidene kliniske studier innen «midtre GI-kreft», i tillegg til midtre GI-studier innen kategorien translasjonsforskning og tumoragnostiske studier m.m. (tabell 1).
Alle studier som ikke ble fremlagt som foredrag, ble gjort tilgjengelige som e-Posters – og fysiske plakater utstilt på konferansens tredje dag med de studieansvarlige parat til å diskutere med interesserte konferansedeltakere.

BUKSPYTTKJERTELKREFT
To kliniske studier innen pankreaskreft ble presentert som «Proffered Paper». Dette er nest høyeste trinn på ‘kvalitetsskalaen’. Praksisendrende nyheter blir presentert i «Presidential Symposium», men her var det dessverre intet nytt innen midtre GI i år.
GENERATE: Nab-paclitaxel plus gemcitabine versus modified FOLFIRINOX or S-IROX in metastatic or recurrent pancreatic cancer: A multicentred, randomized, open-label, three-arm, phase II/III trial (1). Denne japanske multisenterstudien ble hett diskusjonstema. Studien viste at gemcitabin+nabpaklitaksel (GnP) ga


bedre langtidsoverlevelse og mindre bivirkninger enn mFOLFIRINOX som førstelinjes behandling ved avansert pankreaskreft. Dette var vanskelig å svelge for Angela Lamarca, som var invitert til å diskutere resultatene. Ikke minst fordi NAPOLI-3-studien (en global fase 3-studie) nylig viste at NALIRIFOX ga bedre median totaloverlevelse og progresjonsfri overlevelse enn GnP, og lik forekomst av alvorlige bivirkninger (2). Og siden NALIRIFOX er nesten det samme som FOLFIRINOX, skulle en kanskje tro at FOLFIRINOX også er bedre enn GnP?
Den japanske multisenterstudien var en randomisert fase II/III-studie ved 45 sentre i Japan (2019-2023), og Lamarca stilte spørsmålet om det kunne være etniske forskjeller som forklarer disse overraskende funnene. Fra andre studier er det kjent at legemidler kan virke forskjellig ved ulik etnisitet. I denne japanske studien ble voksne pasienter med ECOG 0-1 og patologisk bekreftet metastatisk eller residiverende pankreaskreft randomisert (1:1:1) til å få enten (1) GnP, (2) mFOLFIRINOX eller (3) S-IROX (der 5FU er byttet ut med S-1). Primært endepunkt for fase III-delen av studien var totaloverlevelse. Denne første interimanalysen inkluderte 426 pasienter, og median totaloverlevelse (mOS) var henholdsvis 17,1, 14,0 og 13,6 måneder. Forskjellene var såpass store – i favør av GnP – at studien ble terminert fordi det neppe kunne blitt «superiority» for mFOLFIRINOX eller S-IROX om flere pasienter hadde blitt inkludert. Det mest påfallende var likevel at pasientene som fikk GnP levde så mye lenger enn man
Vitenskapelige arbeider presentert på ESMO 2023 Antall
Basalfag, biomarkører, nye
ville forvente utfra historiske data. Til sammenligning var mOS i nevnte studie med NALIRIFOX vs GnP 11,1 vs 9,2 måneder. Ikke-hematologiske bivirkninger grad 3-4 forekom også betydelig sjeldnere hos pasienter som fikk GnP i den japanske studien.
Den samme forskningsgruppen har tidligere publisert resultater fra en fase II-studie ved 29 japanske sykehus der 125 pasienter med lokalavansert pankreaskreft ble randomisert til enten mFOLFIRINOX eller GnP, og selv om totaloverlevelse da var lik for de to gruppene, fremstod GnP som noe mer effektivt også i den studien, fordi andelen med respons var høyere i GnP-armen (3). Responser er spesielt viktig hvis det kan gi mulighet for potensielt kurativ kirurgi, hvilket gjelder for omtrent 13 % av pasienter med lokalavansert pancre-
ascancer med nedgraderende preoperativ kjemoterapi i henhold til Norpact-2-studien, som vi selv har bidratt til (4).
Men vi trenger nok mer data både for metastatisk og lokalavansert pancreascancer før vi kan konkludere med hvilket av disse regimene, FOLFIRINOX eller GnP, som eventuelt er mest virksomt ved inoperabel pankreascancer. Per i dag foretrekker vi førstnevnte, hos spreke pasienter. Fordelen med dette regimet er ikke minst at vi får testet platinum-sensitivitet, og i tilfelle pasienten f.eks. har en BRCA-mutasjon, kan det også ha videre behandlingsmessig konsekvens senere (5).
PREOPANC-2: Neoadjuvant chemotherapy with FOLFIRINOX versus neoadjuvant gemcitabine-based

chemoradiotherapy for borderline resectable and resectable pancreatic cancer (PREOPANC-2): A multicenter randomized controlled trial (6). Til nå har vi i Norge sjelden gitt strålebehandling før operasjon ved pancreascancer. En nederlandsk gruppe har tidligere vist at preoperativ gemcitabin-basert radiokjemoterapi ga bedre langtidsoverlevelse sammenlignet med direkte kirurgi og adjuvant gemcitabin hos pasienter med resektabel eller borderline resektabel pankreaskreft (PREOPANC-studien) (7). Ved årets ESMO presenterte samme forskningsgruppe resultatene fra PREOPANC-2, gjennomført ved 19 nederlandske sentre i 20182021. Pasienter med resektabel og borderline resektabel pankreaskreft (n=368) ble randomisert (1:1) til enten (1) neoadjuvant kjemoterapi med FOLFIRINOX i 16 uker eller (2) neoadjuvant gemcitabin i 12 uker kombinert med strålebehandling til 36 Gy fordelt på 15 fraksjoner under andre behandlingssyklus (uke 4-6) (figur 1).
Like mange pasienter i begge armer (henholdsvis 77 % og 75 %; p=0,7) gjennomgikk reseksjon. Like mange oppnådde også R0-reseksjon (61 % vs 67 %, p=0,3), og forekomsten av alvorlige bivirkninger var temmelig lik. Når også mOS var temmelig identisk (21,9 måneder vs 21,3 måneder) var studien dermed negativ, dvs FOLFIRINOX ga verken økt totaloverlevelse (primært endepunkt) eller høyere reseksjonsrate (sekundært endepunkt).
En vesentlig innvending til studien er at man la opp til å gi neoadjuvant behandling i hele fire måneder uten mulighet for å skifte f.eks. fra FOLFIRINOX til GnP ved tegn til manglende effekt underveis. I vår Norpact-3-studie planlegger vi f.eks. også å gi neoadjuvant behandling i fire måneder, men skifte regime etter to måneder hvis mellomevaluering på det tidspunktet viser behandlingssvikt. Dessuten er det ikke nødvendigvis likegyldig om det foreligger resektabel eller borderline resektabel pancreascancer. Dermed er det heller
ikke med denne studien vist hvorvidt preoperativ radiokjemoterapi eller neoadjuvant kjemoterapi uten strålebehandling er best.
Basert på resultatene fra vår egen studie (NORPACT-1) innen resektabel pancreascancer, og støttet av resultatene i PREOPANC-2-studien, anser vi dermed at direkte reseksjon (pluss adjuvant kjemoterapi) fortsatt er standard behandling for resektabel pancreascancer (8), mens det ennå er uvisst hvilket regime som er best ved borderline resektabel sykdom (9).
PREOPANC-2-studien var annonsert som late-breaking abstract, men altså ikke praksisendrende. Hva kan vi så forvente neste år? Innen tidlig-fase studier var en studie spesielt verd å merke seg. Som kjent er pankreaskreft en av de dødeligste kreftsykdommene (10), og fordi svulstene sjelden (<1 %) er MSI og svært ofte (>90%) har drivermutasjoner i KRAS-genet, er det store forhåpninger til at multi-KRAShemmerne kan revolusjonere behand-
lingen for denne lumske kreftsykdommen. Men hvor effektive vil disse være, hvor trygge vil de være i bruk. Og kan de kombineres med annen behandling for oppnå synergistisk effekt?
RMC-6236: Preliminary clinical activity of RMC-6236, a first-in-class, RAS-selective, tri-complex RASMULTI(ON) inhibitor in patients with KRAS mutant pancreatic ductal adenocarcinoma (PDAC) and non-small cell lung cancer (NSCLC) (11). Flere KRAS G12C-hemmere har allerede vist effekt ved pancreascancer. Problemet er bare at denne mutasjonen sees hos et fåtall av pasientene. Som oftest foreligger det G12D, -R eller -V-mutasjon. RMC-6236 er en RAS-selektiv, multiRAS-hemmer (hemmer både mutert form og villtype) som i prekliniske studier har vist effekt ved bukspyttkjertelog lungekreft. En amerikansk studie presentert på årets ESMO hadde prøvd ut behandlingen på 46 pasienter med lungekreft og 65 pasienter med bykspyttkjertelkreft. Alle pasientene hadde KRAS G12X-mutasjon (som oftest G12D, -V eller -R, mens G12C var ekskludert fra studien). Pasientene fikk tablettbehandling i eskalerende doser for å teste sikkerhet og effekt. De tålte behandlingen svært godt, og responsratene var gode selv i lave doser. For pancreascancer så man objektiv respons hos 9/46 (20 %) og stabil sykdom hos 31/46 (67 %), altså totalt 40/46 (87 %) uten progresjon. Ingen oppnådde komplett remisjon, og mye forskning gjenstår før pasienter med ikke-resektabel pancreascancer blir kurert med medikamentell behandling. Det neste logiske skrittet blir å teste ut medikamentet i større kliniske studier, og i kombinasjon med
annen behandling, og kanskje blir det neste års nyhet på ESMO. En global fase III-studie med dette medikamentet er i anmarsj, men så vidt vites ikke i gang her til lands ennå.
Som den rake motsetning til bukspyttkjertelkreft har galleveiskreft ofte genforandringer egnet for målrettet behandling. Men galleveiskreft er en sjelden kreftsykdom, hvilket gjør veien lang til godkjent behandling i det offentlige norske helsevesenet.
Den vanligste målrettbare genforandringen (spesielt hyppig ved intrahepatisk kolangiokarsinom, iCCA) – er IDH1 R132-mutasjon. Ivosidenib fikk markedsføringstillatelse for andrelinjes systembehandling mot lokalavansert og metastatisk kolangiokarsinom med R132-mutasjon 4. mai 2023 (12). I et av industrisymposiene ble temaet grundig belyst under årets ESMO (13). Denne småmolekylære hemmeren av isositrat dehydrogenase-1 (IDH1) virker ved å redusere abnormal produksjon av onkometabolitten 2 hydroksyglutarat (2-HG) og hindrer derved kreftcellenes differensiering. Til grunn for EMA-godkjenningen var ClarIDHy-studien (14), en internasjonal, randomisert fase-3 multisenterstudie av 187 pasienter. Studien viste at pasienter med svikt på kjemoterapi og påvist IDH1-mutert kolangiokarsinom hadde median 1,3 måneders gevinst i progresjonsfri overlevelse med ivosidenib sammenlignet med placebo (mPFS 2,7 måneder for ivosidenib vs 1,4 måneder for placebo; p<0,0001). I løpet av 6
måneder fikk alle med placebo progresjon, mens 32 % av pasienter med ivosidenib da fortsatt var uten progresjon, og også etter ett år var det fortsatt 22 % uten progresjon i behandlingsarmen. Som forventet, pga den bremsende, non-cytotoksiske effekten av medikamentet, var det med ivosidenib få responser (2,4 %), mens 50,8 % hadde stabil sykdom vs 27,9 % stabil sykdom med placebo. Subgruppeanalyse viste ingen forskjell avhengig av antall linjers behandling, kjønn, sykdomsutbredelse, ECOG eller geografi. Behandlingen var godt tolerert, og OS var 10,3 måneder i ivosidenib-armen mot 5,1 måneder i placebo etter justering for overkrysning (p<0,0001).
Behandling rettet mot den nest vanligste målrettbare genforandringen ved kolangiokarsinom (i FGFR-genet) var temaet for et av to kliniske studier presentert i en «Mini Oral»-økt.
Tinengotinib (FGFR-hemmer): 95MO Tinengotinib in patients with advanced, fibroblast growth factor receptor (FGFR) inhibitor refractory/relapsed cholangiocarcinoma (15) (obs: konferansepresentasjonen supplerte med flere data enn det som står i abstraktet). Vi har allerede flere FDA-/EMA-/LMV-godkjente FGFR-hemmere, men ingen av disse foreløpig innført her til lands for pasienter med galleveiskreft. Optimismen knyttet til FGFRhemmere skyldes ikke bare at det ofte sees langvarige responser, men også fordi det selv etter progresjon på én FGFR-hemmer kan det være respons på neste FGFR-hemmer. Milind Javle fra MD Anderson Cancer Center i
Texas presenterte resultater fra klinisk utprøvning av tinengotinib, en slik ‘neste generasjons’ FGFR-hemmer, hos 89 pasienter med CCA (flertallet vestlige pasienter). 47 % hadde også fått behandling med minst én FGFR-hemmer tidligere (pemigatinib, RLY-4008, derazantinib, infigratinib, futibatinib, erdafitinib og/eller gunagratinib). Selv om bivirkningene ved slike FGFR-hemmere anses å være en klasseeffekt, var det færre behandlingsrelaterte bivirkninger med tinengotinib enn det tidligere er blitt rapportert for f.eks. pemigatinib i Fight-202-studien (16). Bivirkningene med tinengotinib var også som oftest reversible og håndterbare.
Blant 41 pasienter med FGFRgenforandringer som var blitt behandlet med tinengotini, var det objektiv respons hos 12 pasienter (29 %) og stabil sykdom hos 25 pasienter (61 %). Totalt altså sykdomskontroll hos 90 %. Median progresjonsfri overlevelse (mPFS) var 6,0 måneder.
Blant de 41 pasientene hadde 36 pasienter tidligere fått FGFR-hemmer. I denne undergruppen var det like gode responser (objektiv respons hos 11/36, 31 %; og mPFS 6,0 måneder). Førstegenerasjons FGFR-hemmere svikter i to av tre tilfeller fordi det erverves polyklonale kinasedomenemutasjoner. Blant de 16 pasientene som fikk påvist slike resistensmutasjoner, var det hele 7/16 (44 %) som hadde respons på tinengotinib (mPFS 6,9 måneder), hvorav en oppnådde komplett respons og deretter ble operert med kurativ intensjon september 2020 foreløpig uten påvist residiv.
Tinengotinib ser dermed ut til å overkomme resistens som erverves ved førstegenerasjons FGFR-hemming.
En global, randomisert fase III-studie (2:1) av tinengotinib vs standard systembehandling til pasienter som tidligere har fått kjemoterapi og én FGFR-hemmer, er nå på trappene (17).
Tre ganger har til nå Beslutningsforum vendt tommelen ned for innføring av pemigatinib i Norge (18).
Immunterapi
Spenningen knytter seg dermed for tiden mest til hvorvidt immunterapi vil bli innført som kombinasjonsbehandling med gemcitabin+cisplatin i første linje ved inoperabel galleveiskreft.
Immunterapi dreier seg her om durvalumab (D) (TOPAZ-1) (19) eller pembrolizumab (P) (KEYNOTE-966) (20). Begge regimene, både GemCisD og GemCisP, er til metodevurdering, og forslaget er at behandlingen gis i første linje uavhengig av molekylære eller andre karakteristika. Også på denne konferansen ble det presentert supplerende data fra TOPAZ-1 [Potentially prognostic factors of overall survival in advanced biliary tract cancer in the randomised phase III TOPAZ-1 study (21)] og KEYNOTE-966 [Hepatitis B virus (HBV)-related outcomes in patients (pts) with baseline HBV infection in the KEYNOTE-966 study of pembrolizumab (pembro) plus gemcitabine and cisplatin (gem/cis) for advanced biliary tract cancer (BTC) (22)], men igjen uten at man kunne peke ut noen subgruppe som skiller seg fra gruppen som helhet med tanke på nytte av immunterapi ved slik kombinasjonsbehandling.
Dermed er det fortsatt av interesse å vite hvem som egentlig har best nytte av GemCis uten immunterapi.
Ekstrahepatisk galleveiskreft
ABC01-03: Advanced extrahepatic cholangiocarcinoma: Post-hoc analysis of the ABC-01, -02 and -03 clinical trials (23). Denne studien var en etteranalyse av ABC-01, -02 og -03-studiene ved avansert galleveiskreft, der fokus nå var på undergruppen med ekstrahepatisk galleveiskreft (eCCA, 56 % av pasientene i nevnte kliniske studier). I denne post hoc-studien fant man at totaloverlevelse etter GemCis (i palliativ setting) var dårligere ved ekstrahepatisk enn ved intrahepatisk (iCCA) galleveiskreft. Det er kanskje ikke så overraskende. Multivariat analyse viste at funksjonsnivå (ECOG ‘performance’ status) og forhøyet initial CA125 (vurdert som kontinuerlig variabel) var uavhengige prediktorer for dårligere totaloverlevelse. CA19-9 og CEA nådde ikke statistisk signifikans, men skal nok ikke avskrives som tumormarkører likevel. Først og fremst var analysen en påminning om at også CA125 kan ha verdi som prognostisk faktor (som vist i denne analysen) og for å følge forløpet av behandlingen i tilfeller der CA19-9 eller CEA ikke er forhøyet.
LEVERKREFT
Primær leverkreft (hepatocellulært karsinom, HCC) er på verdensbasis en av de hyppigste årsakene til kreftrelatert død. På årets konferanse var det likevel bare én klinisk studie innen HCC som oppnådde å bli tildelt muntlig presentasjon (i «Mini oral session»).
AdvanTIG-206: AdvanTIG-206: Phase II randomized open-label study of ociperlimab + tislelizumab (TIS) + BAT1706 (bevacizumab biosimilar) versus TIS + BAT1706 in patients with advanced hepatocellular carcinoma (24). I denne multisenterstudien fra Kina og Taiwan ble pasienter med avansert HCC randomisert (2:1) til (arm A) ociperlimab (anti-TIGIT) i tillegg til standard behandling (PDL1-hemmer og bevacuzumab biosimilar), eller (arm B) standard behandling alene. Primært endepunkt objektiv responsrate var henholdsvis 35,5 % i arm A (eksperimentell arm) mot 37,5 % i arm B (standardbehandling), og studien var dermed negativ. Progresjonsfri overlevelse var lik for de to behandlingsarmene. Som et bifunn var det numerisk høyere responser av tilleggsbehandlingen med anti-TIGIT når PD-L1 ≥ 1 %.
Diagnostikken ved HCC kan være utfordrende. Verktøy basert på kunstig intelligens (KI) blir stadig oftere vist nyttig som supplement eller erstatning for menneskelige vurderinger.
Deap learning: Computer-aided HCC lesion detection based on deep learning and CT images (25). Diagnostikk av HCC på kontrastforsterket CT kan være en utfordring. En fransk forskergruppe trente en KI-modell mot et datasett med 620 HCC-lesjoner og benyttet deretter et testsett med 221 HCC-lesjoner for å vurdere nytten av slik dyplæring for diagnostikk av HCC. Modellen var god for påvisning av svulster ned til 30 mm og påviste da 175/176 (≈100 %) biopsiverifiserte lesjoner.

Sensitiviteten var bare 60 % (27/45) for svulster mellom 30 og 10 mm, men overordnet var dette likevel imponerende siden total sensitivitet på 92 % er langt bedre enn gjennomsnittlig sensitivitet hos radiologer (69 %) (26).
ESMO bød også på utallige industriutstillinger, lounger og kafeer, og sesjoner der du kunne «meet the experts». Og først og fremst byr slik konferansedeltakelse på mange muligheter for å utvide det faglige nettverket. Ikke minst på restaurant om kvelden med hjemlige kolleger.
Referanser:
Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no
Etter flere år med pandemi og digitale konferanser var gleden stor over å få delta på ESMO 2023 i Madrid. Jeg så fram til faglig påfyll, nye behandlingsmuligheter og interessante diskusjoner med gamle og nye kollegaer iblandet tapas og D-vitamin. Konferansen ble derimot innledet med overraskende store mengder regn, i overkant selv for en bergenser, da bagasjen måtte tørkes med hårføner etter en meget fuktig landing. Og selv om de store nyhetene for GI cancer lot vente på seg i år, så kom solen omsider tilbake, og det beste måltidet viste seg faktisk å være meksikansk.

KRISTINE AASEBØ
MD, PhD, overlege
Avdeling for kreftbehandling Haukeland universitetssykehus
KRASG12C MUTASJON
Den mest profilerte studien for kolorektalkreft (CRC) på årets ESMO vil ha betydning for kun en svært liten andel av våre pasienter. Codebreak 300: en randomisert fase III studie med sotorasib + panitumumab vs. standard 3. linjes behandling for pasienter med KRASG12C metastatisk CRC. KRASG12C mutasjon identifiseres kun hos rundt 3% av pasienter med metastatisk CRC. Det primære endepunktet for studien, progresjonsfri overlevelse (PFS), var signifikant høyere i sotorasib-armen 960 mg (5,6 md.) sammenlignet med standardbehandling (2,2 md.), med HR på 0,49 og responsrate (ORR) 26% vs. 0%. Det var ikke forskjell i total overlevelse (OS), men her er dataene fortsatt for umodne. Studien ble publisert i NEJM samme dag. Effekten på PFS og ORR må anses beskjeden med usikker klinisk nytte. Pasienter i kontrollarm mottok trifluridine-tiperacil (T/T) i monoterapi, ikke kombinert med
bevacizumab (bev) som anses som standard etter Sunlight studien med en tilleggseffekt på 3 md. økt PFS og OS. En stor retrospektiv studie nylig publisert i Nature Medicine viste imidlertid at pasienter med KRASG12 mutasjon ikke ser ut til å ha nytte av T/T, og dette kan tale for at sotorasib + panitumumab likevel bør vurderes som standard 3. linjes behandling for disse pasientene (van de Haar et al, Nature Medicine 2023). Flere KRASG12C hemmere er på trappene, og foreløpige fase II resultater fra Krystal studien med adagrasib + cetuximab har vist en betydelig høyere ORR enn i Codebreak300. Man lurer også på om effekten vil bli høyere ved å introdusere medikamentet tidligere, og flere 1. linje studier pågår.
VED LEVERMETASTASER
Jeg vil også nevne overlevelsesdata fra CAIRO 5 studien, en randomisert fase III studie som har undersøkt effekten av ulike neoadjuvante regimer til CRC pasienter med primært ikke-resektable
levermetastaser. Pasienter med
BRAF/RAS mutasjon og/eller høyresidig coloncancer ble randomisert mellom FOLFOX/FOLFIRI + bev og FOLFOXIRI + bev. Pasienter med BRAF/RAS villtype venstresidig CRC ble randomisert mellom FOLFOX/ FOLFIRI + bev og FOLFOX/FOLFIRI + panitumumab. For BRAF/RAS muterte og/eller høyresidig fant man ingen forskjell i OS mellom regimene, selv om studiens tidligere publiserte resultater har vist en beskjeden økning i PFS (9 vs. 10,6 md.) og ORR (54% vs. 33%) ved trippelregime + bev. Det var også flere pasienter som oppnådde
R0/R1 reseksjon (36% vs. 51%). For pasienter med venstresidig villtype CRC var det heller ingen forskjell i overlevelse mellom regimene, selv om tidligere demonstrerte resultater har vist signifikant økt ORR for pasienter som fikk panitumumab (53% vs. 80%) sammenlignet med pasienter som fikk bev. De som fikk panitumumab hadde imidlertid også signifikant mer bivirkninger. Det skal bemerkes at begge disse armene ble stengt prematurt grunnet manglende effekt hvilket kan påvirke statistisk styrke. Andre studier har vist trend til bedre overlevelse og responsrate ved bruk
av trippel kjemoterapi + bev, særlig ved BRAF muterte svulster, men vi vet også at pasienter med BRAF/RAS mutasjon har dårlig prognose etter leverkirurgi. Økt PFS, ORR og R0/R1 tyder på at trippelbehandling fortsatt kan vurderes, men da forbeholdt selekterte pasienter grunnet betydelig toksisitet. På bakgrunn av økt responsrate kan EGFR hemmer vurderes framfor bevacizumab til pasienter med venstresidig villtype CRC, men dette er nok mindre betydningsfullt og med dårligere bivirkningsprofil.

Norsk Onkologisk Forening gjentar suksessen fra i fjor og ønsker å invitere LiS til en fellesreise til ESMO i Barcelona, 13.-17.09.2024. Formålet er å skape fellesskap i miljøet og øke interessen for faget.
Det blir felles avgang fra Gardermoen. NOF dekker reisen fra Gardermoen, opphold og kongressavgift for èn LIS fra hvert sykehus i Norge som utdanner onkologer. NOF dekker også reisen fra hjembyen tur/retur Gardermoen.
Informasjon om reisen og invitasjonen sendes til samtlige onkologiske avdelinger i Norge ved avdelingsleder, -sjef, -direktør og utdanningsansvarlig overlege i løpet av februar 2024.
Avdelingene velger selv hvem de ønsker å tilby å reise. Deltakeren som sykehuset velger må være (eller bli) medlem i NOF og medlem i ESMO (25 Euro per år for LiS).
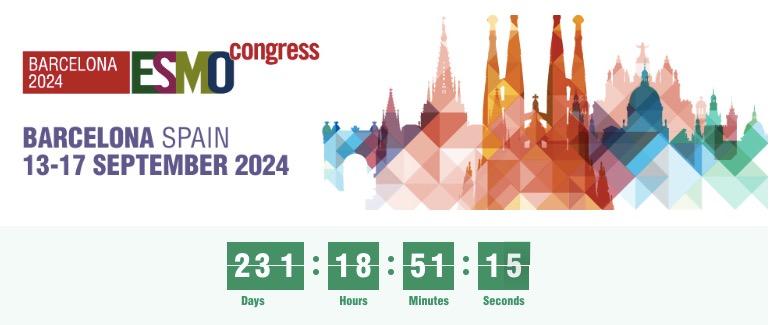
Nye studier på lungekreft ble viet stor plass på årets ESMO-kongress. Nesten 500 abstracts totalt hvorav 7 fant veien til den største scenen med den konsekvens at 46.7 % av presentasjonene på presidential-sesjonene omhandlet lungekreft. Søkelyset ble særlig rettet mot neoadjuvant immunterapi, antistoff-legemiddel-konjugater (ADCer) og forbedret målrettet terapi ved velkjente aktiverende mutasjoner.

Spesialist i onkologi
Avd for kreftbehandling, Oslo universitetssykehus, Ullevål
CheckMate 77T er en fase III-studie hvor 416 pasienter med resektabel ikke-småcellet lungekreft (NSCLC) stadium II-IIIB ble randomisert til a) neoadjuvant nivolumab + kjemoterapi med etterfølgende kirurgi og ett år adjuvant nivolumab eller b) neoadjuvant placebo + kjemoterapi med etterfølgende kirurgi og adjuvant placebo. Foreløpig resultater fra studien ble lagt frem og viste signifikant bedre hendelsesfri overlevelse blant pasientene som mottok immunterapi i tillegg til kjemoterapi med en hazard ratio (HR) på 0.58 [0.42-0.81]. Gevinsten ved perioperativ nivolumab var som ventet størst ved stadium III og ved PD-L1 positiv sykdom. Andelen pasienter med patologisk komplett respons var betydelig høyere i armen som fikk nivolumab (25.3% vs 4.7%).
Oppdaterte resultater fra Keynote671-studien ble også presentert i Madrid. Denne fase III-studien inkluderte pasienter med NSCLC stadium II-IIIB tilgjengelig for kirurgi. Pasientene mottok preoperativt 4 kurer pembrolizumab eller placebo
pluss cisplatin-basert kjemoterapi og postoperativt 13 kurer pembrolizumab eller placebo. Både totaloverlevelse (HR 0.72 [95% KI 0.56-0.93]) og hendelsesfri overlevelse (HR 0.59 [95% KI 0.48-0.72]) var signifikant høyere i gruppen som fikk pembrolizumab. Median hendelsesfri overlevelse med tillegg av pembrolizumab periadjuvant var 47.2 måneder mot 18.3 måneder med placebo.
Basert på de to nevnte og ytterligere pågående studier må man kunne si at evidensen for nytte av neoadjuvant (kjemo)immunterapi ved ikkesmåcellet lungekreft begynner å bli overveldende, særlig nå som data på totaloverlevelse også trekker i samme retning. Bivirkningsbyrden virker gjennomgående å være akseptabel Andelen pasienter som ikke når frem til operasjonsbordet ligger på rundt 20%. Mange spørsmål er imidlertid fortsatt ubesvarte. Spesielt er det viktig å avklare hvilke pasienter som «kun» trenger neoadjuvant immunterapi og hvilke som har nytte av postoperativ behandling, samt i hvor stor grad man kan man stole på patologisk komplett respons som en markør for å besvare dette spørsmålet.
ALINA-studien har undersøkt adjuvant alektinib ved ALK-positiv NSCLC i stadium IB-IIIA. 257 pasienter ble etter kirurgi randomisert til enten alektinib i to år eller dagens standard med fire kurer platinumbasert kjemoterapi. Etter en median oppfølgingstid på 27.8 måneder, ser man en markant høyere sykdomsfri overlevelse blant pasientene som mottok ALK-rettet behandling med HR 0.24 [95% KI 0.13-0.43]. Gevinsten ved adjuvant alektinib var tydelig i alle undergrupper og manifesterte seg også i form av signifikant lavere forekomst av hjernemetastaser som ellers er relativt hyppig ved ALK-positiv sykdom. Bivirkningene var tolerable og overveiende kjent fra tidligere bruk av alektinib i metastatisk setting. Totalt sett fremstod resultatene som svært overbevisende. Det må bemerkes at data på totaloverlevelse fortsatt gjenstår og at studien ikke er egnet for å vurdere om opererte pasienter med ALK-translokasjon bør starte direkte med ALK-hemmer eller gjennomgå adjuvant kjemoterapi først.
Hele tre studier som omhandler EGFR-mutert lungekreft ble beæret med fremlegg på en av presidentialsesjonene, alle tre med medikamentet amivantamab i ulike kombinasjoner. Amivantamab er et bispesifikt monoklonalt antistoff rettet mot EGFR og MET som tidligere har vært mest kjent for å ha noe effekt ved EGFR ekson 20-insersjoner (ikke godkjent av beslutningsforum). Fase III-studien Papillon undersøkte dette videre; behandlingsnaive pasi-
enter med avansert NSCLC og EGFR ekson-20 insersjon ble randomisert til enten amivantamab pluss kjemoterapi eller til kun kjemo. Etter en median oppfølgingstid på 15 måneder, var median progresjonsfri overlevelse (PFS) med amivantamab pluss kjemo 11.4 måneder mot 6.7 måneder med kjemoterapi alene. Objektiv responsrate (ORR) økte fra 47% til 73% ved å legge til amivantamab. Overlevelsesdata er fortsatt umodne, og den kombinerte behandlingen innebærer nokså mye bivirkninger, særlig i form av utslett, paronyki, nøytropeni, ødemer og infusjonsreaksjoner.
Siden insersjon i ekson-20 må betraktes som en nokså uvanlig EGFRmutasjon, er det nok vel så betydningsfullt å optimalisere behandlingen i første og andre linje ved de vanlige EGFR-mutasjonene. MARIPOSAstudien fokuserer på førstelinje; over 1000 behandlingsnaive pasienter med ikke resektabel og EGFR-positiv (delesjon ekson 19 og L858R) NSCLC ble inkludert. Den primære målsettingen til studien var å vurdere amivantamab
i kombinasjon med lazertinib (en tredjegenerasjons EGFR-TKI), opp mot osimertinib i monoterapi som er dagens standardbehandling for denne pasientpopulasjonen. Median PFS ved amivantamab + lazertinib var 23.7 måneder sammenliknet med 16.6 måneder ved osimertinib, noe som gir en HR på 0.70 i favør av førstnevnte. Bivirkninger grad 3 eller høyere og særlig venøs tromboembolisme forekom hyppigere i kombinasjonsarmen. I den påfølgende diskusjonen av studien ble det trukket frem at effektresultatene bør vurderes i kontekst av andre aktuelle førstelinjestudier ved EGFR-positiv sykdom. Dette inkluderer FLAURA 2-studien som ble presentert på verdenskonferansen tidligere i høst, hvor man fant 9 måneders lengre PFS ved kombinasjon av osimertinib og kjemoterapi sammenliknet med osimertinib alene.
MARIPOSA 2 følger opp med å undersøke behandlingsalternativer etter progresjon på osimertinib, igjen for pasienter med aktiverende EGFR-mutasjon og avansert sykdom. Deltakerne ble randomisert 2:2:1 til

enten a) amivantamab + lazertinib + kjemoterapi, b) kjemoterapi alene eller c) amivantamab + kjemoterapi. Kombinasjonsregimene ga lengre PFS (8.3 måneder ved amivantamab + lazertinib + kjemoterapi vs 6.3 måneder ved amivantamab + kjemoterapi vs 4.2 måneder ved kjemoterapi alene), høyere responsrater og bedre intrakraniell sykdomskontroll. Kostnaden utover dyre medikamenter er mer bivirkninger, inklusive mer hematologisk toksisitet. Det pågår for tiden en rekke studier som via ulike tilnærminger prøver å finne den beste behandlingen etter progresjon på EGFR-hemmer i førstelinje, og det eneste som synes klart er at løsningen ikke er ren kjemoterapi.
Interessen for ADCer har eksplodert i onkologien de siste fem årene. Disse medikamentene kombinerer monoklonale antistoffers spesifisitet med cytostatikas effektive celledrap og har gitt svært gode resultater ved ulike
solide tumortyper, deriblant ved brystkreft og urotelialkreft. Innen lungekreft er denne type medikamenter foreløpig på utprøvingsstadiet. Under årets ESMO-kongress ble resultater fra TROPION-Lung01-studien offentliggjort. Studien var rettet mot pasienter med metastatisk NSCLC og progresjon på platinumbasert kjemoterapi og PD-(L)1 hemmer, en gruppe pasienter man har lite effektiv behandling å tilby i dag. Deltakerne ble randomisert til datopotamab deruxtecan, et ADC rettet mot transmembranproteinet TROP-2, eller docetaxel. Median PFS var lenger med datopotamab deruxtecan enn med docetaxel (4.4 måneder vs 3.7 måneder, HR 0.75), men forskjellen må sies å være skuffende liten. Gevinsten ble kun sett hos pasienter med ikke-plateepitelcarcinom. Foreløpig analyse av totaloverlevelse viste en ikke signifikant trend i favør datopotamab deruxtecan. Det var noe lavere forekomst av bivirkninger grad 3 eller høyere ved ADC, men særlig stomatitt og kvalme rammet
mange av pasientene. Resultatene fra TROPION-Lung01 er neppe nok til å endre klinisk praksis, men legger noen steiner til kunnskapsvarden som kan vise seg å bli et viktig veimerke i fremtidens lungekreftbehandling.
NORSK REPRESENTASJON Åslaug Helland la frem resultater fra NIPU-studien som er initiert fra Oslomiljøet med Åslaug og Vilde Haakensen i spissen. Studien inkluderte 118 pasienter med malignt mesoteliom med progresjon på platinumbasert kjemoterapi i første linje. Pasientene fikk behandling med nivolumab + ipilimumab +/- UV1-vaksine. Studien nådde ikke det primære endepunktet ettersom progresjonsfri overlevelse i de to behandlingsgruppene var lik (HR 1.01) bedømt ved en uavhengig sentral komité (BICR), men umodne overlevelsesdata kan indikere noe lengre median overlevelse i gruppen som fikk UV1-vaksine. Stipendiat Solfrid Thunold presenterte en poster med mer eksplorative data fra studien hvor hun har sett på den prognostiske verdien av 18F-FDG-PET for mesoteliom-pasienter behandlet med dobbel immunterapi. Man ser særlig at lavt metabolsk tumorvolum (MTV) er signifikant assosiert med bedre kliniske utfall, inklusive OS og PFS. Mer translasjonsforskning knyttet til NIPU-studien er ventet de kommende årene.
Madrid levde opp til ryktet som en imøtekommende og severdig europeisk storby med høy trivselsfaktor. Gran Via, spansk omelette, El Retiro, argentinsk storfekjøtt og Museo del Prado, ble fortært i omtrent den rekkefølgen før vi satte kursen mot Barajas og den norske senhøsten.
Med ERLEADA® 240 mg, kan pasienten din fortsette å nyttigjøre seg ektiviteten og sikkerheten til ERLEADA®, men med kun én-tablettdaglig.1,2
Med ERLEADA® 240 mg, kan pasienten din å nyttigjøre seg ektiviteten og sikkerheten ERLEADA®, men med kun én-tablettdaglig.
DOSERING = FIRE 60 MG TABLETTER, EN GANG DAGLIG1


DOSERING = FIRE 60 MG TABLETTER, EN GANG DAGLIG1


DOSERING = EN 240 MG TABLETT, EN GANG DAGLIG1
OR =

DOSERING = EN 240 EN GANG DAGLIG
• En enkelt 240 mg ERLEADA® tablett gir samme effektivitet og trygghet som 4 x 60 mg ERLEADA® tabletter 1,2
• Forenkling av dosering har vist seg å ha den mest positive effekten på etterlevelse av orale prostatakreftbehandlinger, sammenlignet med andre tiltak 3,4
• En enkelt 240 mg ERLEADA® tablett gir samme effektivitet og trygghet som 4 x 60 mg ERLEADA® tabletter 1,2
ERLEADA® forblir tilgjenglig i sin opprinnelige 60 mg formulering.1
• Forenkling av dosering har vist seg å ha den mest positive effekten på etterlevelse av orale prostatakreftbehandlinger, sammenlignet med andre tiltak 3,4
ERLEADA® forblir tilgjenglig i sin opprinnelige 60 mg formulering.1
REFERANSER
1. ERLEADA® SPC 09/2023, chapter 1
2. Chi KN, Chowdhury S, Bjartell A, et al. Apalutamide in Patients With Metastatic Castration-Sensitive Prostate Cancer: Final Survival Analysis of the Randomized, Double-Blind, Phase III TITAN Study. J Clin Oncol. 2021 Jul 10;39(20):2294-2303.
3. Higano CS, Hafron J. Adherence With Oral Anticancer Therapies: Clinical Trial vs Real-world Experiences With a Focus on Prostate Cancer. J Urol. 2023 Mar;209(3):485-493.
4. Duerden M, Avery T, Payne. Polypharmacy and Medicines Optimisation. King's Fund Report, November 2013. https://www.kingsfund.org.uk/sites/default/files/field/field_publication_file/ polypharmacy-and-medicines-optimisation-kingsfund-nov13.pdf. Accessed: December 2023.
2 †Time to castration resistance was defined as time from random assignment progression, PSA progression per PCWG2, or symptomatic skeletal event, whichever occurred first.2
REFERANSER
1. ERLEADA® SPC 09/2023, chapter 1
2. Chi KN, Chowdhury S, Bjartell A, et al. Apalutamide in Patients With Metastatic Castration-Sensitive Prostate Cancer: Final Survival Analysis of the Randomized, Double-Blind, Phase III TITAN J Clin Oncol. 2021 Jul 10;39(20):2294-2303.
INDIKASJONER
3. Higano CS, Hafron J. Adherence With Oral Anticancer Therapies: Clinical Trial vs Real-world Experiences With a Focus on Prostate Cancer. J Urol. 2023 Mar;209(3):485-493.
• Fall og frakturer: Økt risiko for fall og frakturer. Pasienten skal evalueres for frakturer og fallrisiko før behandlingsstart, og videre overvåkes og behandles for frakturer iht. etablerte behandlingsretningslinjer, og bruk av skjelettspesifikke legemidler skal vurderes.
4. Duerden M, Avery T, Payne. Polypharmacy and Medicines Optimisation. King's Fund Report, November 2013. https://www.kingsfund.org.uk/sites/default/files/field/field_publication_file/ polypharmacy-and-medicines-optimisation-kingsfund-nov13.pdf. Accessed: December 2023.
Til voksne menn til behandling av ikke-metastaserende, kastrasjonsresistent prostatakreft (nmCRPC) som har høy risiko for å utvikle metastaserende sykdom.
• Til voksne menn til behandling av metastaserende, hormonsensitiv prostatakreft (mHSPC) i kombinasjon med androgendeprivasjonsterapi (ADT).
DOSERING
UTVALGT PRODUKT OG SIKKERHETSINFORMASJON FOR APALUTAMID, ERLEADA®
INDIKASJONER
Voksne (inkl. eldre) menn: Behandlingen skal innledes og overvåkes av legespesialist med erfaring innen medisinsk behandling av prostatakreft. Anbefalt dose er 240 mg (4 tabletter à 60 mg eller 1 tablett à 240 mg) 1 gang daglig. Medisinsk kastrasjon med gonadotropinfrisettende hormonanalog (GnRHa) skal fortsette under behandlingen hos pasienter som ikke er kirurgisk kastrert. Ved toksisitet grad ≥3 eller uakseptabel bivirkning skal doseringen utsettes fremfor å seponere behandlingen permanent, inntil symptomene bedres til grad ≤1 eller opprinnelig grad, og deretter gjenopptas med samme dose eller om nødvendig, redusert dose (180 mg eller 120 mg).
• Alvorlige kutane bivirkninger (SCARs): SCARs, inkl. DRESS og Stevens-Johnsons syndrom/ toksisk epidermal nekrolyse (SJS/TEN), som kan være livstruende eller dødelig, er rapportert. Pasienten skal informeres om tegn og symptomer på DRESS og SJS/TEN. Ved symptomer skal preparatet seponeres umiddelbart. Behandlingen skal ikke gjenopptas hos pasienter som har fått DRESS eller SJS/TEN under behandlingen.
INTERAKSJONER
Apalutamid er en induktor av enzymer og transportører som kan medføre til redusert plasmakonsentrasjon og dermed tapt eller redusert klinisk effekt av enkelte legemidler.
MONITORERING
• Til voksne menn til behandling av ikke-metastaserende, kastrasjonsresistent prostatakreft (nmCRPC) som har høy risiko for å utvikle metastaserende sykdom.
KONTRAINDIKASJONER
• Fall og frakturer: Økt risiko for fall og frakturer. Pasienten skal evalueres for fallrisiko før behandlingsstart, og videre overvåkes og behandles for frakturer behandlingsretningslinjer, og bruk av skjelettspesifikke legemidler skal vurderes.
Ingen laboratorieundersøkelser utover rutineundersøkelsene som følger diagnosen prostatakreft er nødvendig.
• Til voksne menn til behandling av metastaserende, hormonsensitiv prostatakreft (mHSPC) i kombinasjon med androgendeprivasjonsterapi (ADT).
Overfølsomhet for innholdsstoffene. Kvinner som er eller kan bli gravide.
DOSERING
BIVIRKNINGER
Svært vanlige bivirkninger (≥1/10) er fatigue, hudutslett, hypertensjon, hetetokter, artralgi, diaré, fall, vekttap og frakturer.
Vis forsiktighet ved behandling av pasienter med:
• Krampeanfall: Ikke anbefalt ved krampeanfall i anamnesen eller andre disponerende faktorer.
PAKNINGER, PRISER OG REFUSJON
Voksne (inkl. eldre) menn: Behandlingen skal innledes og overvåkes av legespesialist med erfaring innen medisinsk behandling av prostatakreft. Anbefalt dose er 240 mg (4 tabletter à 60 mg eller 1 tablett à 240 mg) 1 gang daglig. Medisinsk kastrasjon med gonadotropinfrisettende hormonanalog (GnRHa) skal fortsette under behandlingen hos pasienter som ikke er kirurgisk kastrert. Ved toksisitet grad ≥3 eller uakseptabel bivirkning skal doseringen utsettes fremfor å seponere behandlingen permanent, inntil symptomene bedres til grad ≤1 eller opprinnelig grad, og deretter gjenopptas med samme dose eller om nødvendig, redusert dose (180 mg eller 120 mg).
Pakninger og priser: Tabletter; filmdrasjerte 60 mg og 240 mg: Hver tablett inneholder: Apalutamid; 60 mg resp. 240 mg, hjelpestoffer. Fargestoff: 60 mg og 240 mg: Svart og gult jernoksid (E 172), titandioksid (E 171). 60 mg: 112 stk.1 (kalenderpakn.) 512560.; 37292,20 kr. 240 mg: 28 stk. (kalenderpakn.) 525400.; 37292,20 kr.
• Alvorlige kutane bivirkninger (SCARs): SCARs, inkl. DRESS og Stevens-Johnsons toksisk epidermal nekrolyse (SJS/TEN), som kan være livstruende eller dødelig, Pasienten skal informeres om tegn og symptomer på DRESS og SJS/TEN. Ved skal preparatet seponeres umiddelbart. Behandlingen skal ikke gjenopptas som har fått DRESS eller SJS/TEN under behandlingen.
INTERAKSJONER
Refusjon: H-resept: L02B B05_1 Apalutamid. Refusjonsberettiget bruk: Der det er utarbeidet nasjonale handlingsprogrammer/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/ LIS spesialistgruppe skal rekvirering gjøres i tråd med disse. Basert på SPC 09/2023. For utfyllende informasjon se felleskatalogen.
Apalutamid er en induktor av enzymer og transportører som kan medføre til plasmakonsentrasjon og dermed tapt eller redusert klinisk effekt av enkelte
MONITORERING
Ingen laboratorieundersøkelser utover rutineundersøkelsene som følger diagnosen prostatakreft er nødvendig.
PAKNINGER, PRISER OG REFUSJON
ADT, androgen deprivation therapy; AE, adverse event; CI, confidence interval; PCWG2, Prostate Cancer Clinical Trials Working Group; HR, hazard ratio; HRQoL, health-related quality of life; ITT, not reached; PSA, prostate-specific antigen; TEAEs, treatment-emergent AEs. *Median follow-up was 44.0 months. TABLET T DAGLIG
Avdelingsoverlege
Oslo Universitetssykehus, avdeling for kreftbehandling sesjon brystkreft, professor ved Universitetet i Oslo, institutt for klinisk medisin
IKKE PRAKSISENDRENDE, MEN EN STYRKNING AV DAGENS BEHANDLING
Oppsummert vil neppe studiene som ble lagt frem på årets ESMO-kongress være praksisendrende, men data som ble lagt frem styrker det vi i dag mener er god behandling, og som allerede er i klinisk bruk. Ett unntak er resultatene lagt frem fra MonarchE studien, som vi må håpe at medfører snarlig godkjennelse av medikamentet.
TROPION-BREAST01
Denne studien har undersøkt effekten av det nye legemiddel Dato-DXd (et TROP2-rettet antistoff-cellegiftkonjugat, ADC) for pasienter med inoperabel eller metastatisk hormonreseptor positiv (HR+), Her2 negativ sykdom som har progrediert på endokrin terapi og 1 eller 2 linjer kjemoterapi. Pasientene, totalt 732, ble randomisert til enten å motta Dato-DXd eller konvensjonell kjemoterapi ut fra legens valg (inkludert eribulin, vinorelbin, capecitabin eller gemcitabin) inntil sykdomsprogresjon eller uakseptabel toksisitet. Ved data cut-off i juli 2023 var 93 pasienter i Dato-DXd-arm og 39 i konvensjonell kjemoterapiarm fortsatt under behandling. Resultatene viste at pasientene som fikk Dato-DXd hadde en forbedring i progresjonsfri overlevelse (PFS) på 2 måneder sammen-
lignet med de som fikk konvensjonell kjemoterapi (6,9 måneder versus 4,9 måneder (hazard ratio 0.63, 95% KI fra 0,52 til 0,76). PFS-fordelen var konsistent på tvers av undergruppene som ble studert. Resultater for total overlevelse er umodne foreløpig, men det ble rapportert en trend i favør av Dato-DXd-armen (HR 0,84, 95 % KI 0,62–1,14). Videre hadde pasientene som mottok Dato-DXd lavere forekomst av mer betydelige behandlingsrelaterte bivirkninger (grad ≥3 TRAE) og dosereduksjoner sammenlignet med pasienter som mottok konvensjonell kjemoterapi. Progresjonsfri overlevelse på to måneder er ikke dramatisk, men en forbedring sammenlignet med det vi har av tilgjengelig behandling i dag. Dato-DXd synes å ha mindre kraftige bivirkninger, som også er interessant, fordi dette da er en behandling som potensielt kan forbedre livskvaliteten for pasientene våre.
Det ble presentert flere immunterapistudier under årets kongress som konsoliderer dagens kunnskap. Vi vet et sjekkpunkthemmere gir effekt både som del av neoadjuvant behandling og for metastatisk trippel negativ brystkreft, og det ble presentert data som bekreftet denne kunnskapen. Man ser at effektene holder seg med lengre observasjonstid, noe som gjør det
tryggere å bruke, blant annet demonstrert for KEYNOTE 522-studien
Det ble også lagt frem resultater fra studier som har undersøkt effekten av å gi immunterapi i kombinasjon med cellegift i neoadjuvant setting til pasienter med tidlig brystkreft som er HR+ og HER2-. Så langt har det vært uklart om immunterapi kan være til nytte for denne pasientgruppen. CheckMate-7FL studien og KEYNOTE-756- studien viste en klar økning i sannsynlighet for patologisk komplett respons ved å legge til sjekkpunkthemmere, spesielt for pasienter som uttrykker PDL1. Vi vet ingenting om effekt på overlevelse ennå men resultatene gir håp om at denne kombinasjonen også vil gi utslag på overlevelse. I Begonia studien, der man blant annet testet Dato-DXd i kombinasjon med en sjekkpunkthemmer i en av behandlingsarmene hos brystkreftpasienter med trippelnegativ sykdom, så man en responsrate på 79%, som er frapperende godt, og veldig lovende, selv om man ikke har en sammenlignende arm i denne Fase 1/2 studien. Det blir spennende å følge med på fremtidige resultater fra randomiserte studier med denne behandlingskombinasjonen.
MONARCE-STUDIEN:
BEKREFTENDE DATA
Denne studien som vi nå kjenner godt til, har sett på effekten av å legge til abemaciclib (CDK4/6-hemmer) til endokrin terapi (ET) hos pasienter med HR+, HER2- tidlig brystkreft med spredning til lymfeknuter med høy risiko for tilbakefall. Resultatene
som ble lagt frem på ESMO 2023 var en oppdatering av hva som tidligere er presentert, nå etter fem års oppfølgingstid. I denne studien ble pasientene randomisert mellom ET i minst 5 år i kombinasjon med abemaciclib i to år, og kun ET. Inkluderte pasienter hadde enten påvist spredning til ≥4 lymfeknuter i aksillen eller til 1-3 lymfeknuter med samtidig histologisk grad 3 tumor i brystet og/ eller en tumor med størrelse ≥ 5 cm (Kohort 1; 5120 pasienter). En mindre gruppe av pasienter ble inkludert i Kohort 2 (517 pasienter) hvis de hadde 1-3 positive lymfeknuter og høyere Ki67-ekspresjon, men ikke tilfredsstilte inklusjonskriteriene i Kohort 1. Resultatene etter fem års observasjonstid viser at abemaciclib i tillegg til ET ytterligere reduserte risikoen for sykdomsresidiv i forhold til hva som er presentert fra studien tidligere (med kortere observasjonstid); nå har forskjellen i risiko for tilbakefall økt til 7.6%, og forskjellen i overlevelse uten fjernspredning økt til 6.7%. Disse oppdaterte resultater støtter bruken av abemaciclib hos pasienter med høyrisiko tidlig brystkreft. Foreløpig er det for tidlig å kunne vurdere effekt på totaloverlevelse, selv om det numerisk er færre døde i abemaciclib-armen enn i kontrollarmen (154 vs 187). Forskjellene i overlevelse blir altså stadig høyere innen denne selekterte høyrisikogruppen. Tidligere i år fikk medikamentet avslag i Nye Metoder. Vi håper at de oppdaterte resultater vil medføre ny vurdering og godkjennelse, slik at abemaciclib også vil bli tilgjengelig for norske pasienter snart.
 MARIA NYRE VIGMOSTAD
MARIA NYRE VIGMOSTAD
Spesialist i onkologi
Avdeling for blod- og kreftsjukdommar, Stavanger Universitetssjukehus
INTRODUKSJON:
ESMO 2023 var konferansen då me fekk oppleve plystring, ståande applaus og tårer på hovudsesjon for ein urologisk cancer. Dei fantastiske blærekreftresultata fekk sindige onkologar til å reagere med glade tilrop og optimisme på vegne av ei ofte underbehandla gruppe pasientar med dårleg prognose. Det var sjølvsagt nyheiter innan andre urologiske kreftformer også, og under kjem eit samandrag av det viktigaste frå konferansen sett frå ein uroonkolog sin ståstad.
BLÆREKREFT:
Behandling av metastatisk blærekreft var uforandra i fleire tiår fram til 2020; Kjemoterapi med gemcitabin og cisplatin (eventuelt carboplatin). Median overlevelse låg på omlag 14 månader. Data frå Javelin-bladder 100 studien blei lagt fram på virtuell ASCO i 2020(1). I denne studien fekk pasientar som ikkje progredierte på standard kjemoterapi, vedlikehaldsbehandling i etterkant med immunterapi (avelumab). Median overlevelse steig då til i overkant av 21 månader. Karismatiske Thomas Powles som også presenterte i 2020, fekk i år lov til å legge fram banebrytande resultat framfor 8000 tilhøyrarar på fellessesjon på ESMO. Det var to blærekreftstudiar som blei presentert i same fellessesjon.
EV 302 (LBA6)
I fase 3-studien EV 302 blei pasientar med tidlegare ubehandla metastatisk blærekreft randomisert 1:1 til enten platinumbasert kjemoterapi med gemcitabin og cisplatin (eller carboplatin) i seks syklusar, eller enfortumab vedotin (EV) dag 1 og 8 og pembrolizumab dag 1. EV blei gitt til progresjon og pembrolizumab i maksimalt 2 år. Hovudendepunkt var progresjonsfri overlevelse (PFS) og total overlevelse (OS).
Knapt 900 pasientar blei randomisert. Det var ei nesten dobling av OS med median i EV+ pembrolizumab arm på 31.5 månader mot 16.1 månader i kjemoterapiarmen (HR 0.47, p<0.00001). Ein såg effekt av EV + pembrolizumab over alle subgrupper og fordelen var uavhengig av PDL1 status, viscerale metastasar eller ikkje, og av om pasienten var cisplatinkandidat eller ei.
Responsraten var høg; 68% mot 44% i kjemoterapiarmen. I tillegg såg ein 29% komplette responsar mot 12% i standardarmen. Det ser ut som den høge delen komplette responsar saman med lang varigheit på respons (median ikkje nådd mot 7 månader) er det som driv overlevelsesgevinsten.
Enfortumab vedotin er eit antistoff medikament konjugat (ADC) som
bind seg til nectin4 som er uttrykt på urotel celler. Nectin 4 er også overuttrykt mellom anna i hud og forklarer at 67% av pasientane hadde hudbiverknader- grad III i 15% av tilfella. 63% av pasientane fekk nevropati mot 30% i kontrollarmen (grad III 7 mot 0%). Totalt var det likevel færre grad III biverknader hos pasientar som fekk EV + pembrolizumab versus kjemoterapi (56 mot 69%).
Checkmate 901 (LBA7)
To negative fase 3-studiar har allereie undersøkt om immunterapi i tillegg til platinumbasert kjemoterapi har effekt på overlevelse i fyrstelinjebehandling av metastatisk blærekreft(2, 3). Desse studiane inkluderte også pasientar som ikkje kunne få cisplatin. Fase 3-studien Checkmate 901 blei også presentert i fellessesjon. Denne studien inkluderte berre pasientar som var aktuelle for cisplatinbehandling i fyrstelinjebehandling av metastatisk blærekreft. Pasientane fekk enten gemcitabin og cisplatin (GC) opp mot 6 syklusar, eller GC opp mot 6 syklusar + nivolumab opp mot 2 år. Hovudendepunkt var PFS og OS.
Det var omtrent 300 pasientar i kvar arm. Det var signifikant betre OS med median på knapt 22 månader mot 19 månader (HR 0.78, p=0.0171) og dette såg ein for alle subgrupper.
Objektiv responsrate var 58% i den eksperimentelle armen mot 43% i GC armen. Median responslengde var også forbetra; 37 mot 12 månader. Ein såg 22% komplette responsar i den eksperimentelle armen mot 11% i GC armen.

Konklusjon blærekreft: EV+ pembrolizumab er ny fyrstelinjebehandling for metastatisk blærekreft, med ein auke i median OS til over 31 månader. EV + pembrolizumab har best responsrate og er betre tolerert. Per i dag er behandlinga ikkje godkjent verken i EMA eller i Norge. Eit samla miljø ser fram til den dagen me kan tilby dette til våre pasientar!
Frå Checkmate 901 kan ein konkludere at for pasientar som er kandidatar for cisplatin, så har både sekvensiell immunterapi (etter Javelin bladder-100) og kombinasjonsbehandling (Checkmate 901)
overlevelsesgevinst. Også her ventar me på norsk godkjenning.
Enza-p (LBA84)
Dette er ein fase 2-studie som undersøkte tillegg av LuPSMA til nyare hormonbehandling (NHA) med enzalutamid for metastatisk kastrasjonsresistent prostatakreft (mCRPC). Pasientane skulle ikkje tidlegare ha fått kjemoterapi eller hormonbehandling for mCRPC, og skulle ha minst to risikofaktorar som gav auka risiko for at enzalutamid aleine skulle feile (t.d.: >LD, >ALP, <albumin mm). Pasientane fekk enten

enzalutamid aleine eller enzalutamid med tillegg av LuPSMA 2-4 behandlingar avhengig av opptak på interim PET. Primære endepunkt var PSA-PFS.
Det var om lag 80 pasientar i kvar arm og PSA-PFS var lengre med enzalutamid-LuPSMA versus enzalutamid aleine, med median på 13 mot 8 mnd (HR 0.43, p=0.00001). Ein såg ingen auke i rapporterte biverknader i den eksperimentelle armen, og kanskje det skuldast den adaptive doseringa. Meir kan sjå ut til å vera betre for enkelte, og i såfall er pasientseleksjon nøkkelen. Godkjente behandlingar for mCRPC er uansett basert på gevinst i total overlevelse. Ein venter overlevelsesdata frå denne studien medio 2024.
PSMA fore (LBA13)
Fase 3-studien PSMA-fore inkluderte pasientar med mCRPC som skulle ha progrediert på ei linje med NHA. Primære endepunkt var PFS og OS.
Knapt 500 pasientar blei randomisert til enten endring av NHA eller behandling med LuPSMA kvar 6. veke i totalt seks syklusar. 85% av pasientane kryssa over til LuPSMAarmen. Det var signifikant betring i PFS med median i eksperimentell arm på 12 månader mot knapt 6 månader i NHA-arm (HR 0.43). Median OS i analyse justert for overkrysning var lik (19.25 mot 19.55), og i den ikkjejusterte var median OS 19.25 mot 19.71 med HR på 1.16.
Kontrollarmen er problematisk og ein veit frå andre studiar at å endre NHA kan samanliknast med placebo(4, 5). Studien gir data på bruk før docetaxel, men fortel lite om når LuPSMA skal brukast og basert på denne studien erstattar ikkje LuPSMA eksisterande val. Andre studiar har allereie vist at LuPSMA er ei effektiv behandling som gir betring i overlevelse(6).
ProBio (LBA86)
Fleire sjukehus i Norge inkluderer i ProBio studien. ProBio er ein biomarkørdriven, randomisert, adaptiv plattformstudie for pasientar med metastatisk prostatakreft. Ein samanliknar biomarkørdriven seleksjon av behandling mot legen sitt val av standard behandling. På ESMO blei det presentert data for fyrstelinjebehandling av mCRPC med PFS og OS som primære endepunkt.
219 pasientar blei randomisert og det var ei klar forbetring av median OS for biomarkørdriven NHA (11 månader) versus taksaner (7 månader) og legen sitt val av standardbehandling (7.5 månader). Effekten er stort sett driven av androgenreseptor og tp53 villtype.
Studien støttar praksis siste åra; NHA er føretrekke framfor taksaner i fyrstelinjebehandling av mCRPC.
Hif2-α er ein hovuddrivar i Von Hippel Lindau og klarcella nyrekreft, og det var fleire studiar på hif2-α hemmaren belzutifan som blei presentert på årets ESMO.
I fase 3-studien Litespark 005 (LBA88) samanlikna ein behandling med belzutifan mot everolimus i seinare linjer av metastatisk, klarcella nyrecellekreft. I overkant av 700 pasientar ble inkludert og primære endepunkt var PFS og OS.
Pasientane skulle ha fått 1-3 tidlegare behandlingslinjer inkludert immunterapi, og for >85% så var dette 3. eller 4. linjes behandling. Studien var positiv for PFS (HR 0.75, p<0.01), men utan signifikant betring i total overlevelse. Responsraten i denne tungt behandla gruppa var 23% for belzutifan mot 3.5% for everolimus. Det var 62% grad III biverknader i begge armane, og >80% av pasientane som
fekk belzutifan hadde anemi (grad III hos 32%).
Utan betring i overlevelse så er det vanskeleg å seie at dette er praksisendrande resultat. Men det manglar fase 3-studiar med OS gevinst etter immunterapi i så seine behandlingslinjer, og utifrå det perspektivet så er dette velkomne data.
Hif2-α hemmar er nok på veg inn, men kanskje fortrinnsvis i tidlegare linjer. Data blei også presentert på konferansen frå fase 2-studien Litespark 003 (LBA87); her var responsraten på nesten 70% for kombinasjonen av belzutifan og cabozantinib hos tidlegare behandlingsnaive pasientar med metastatisk, klarcella nyrecellekreft.
Øivind Kvammen, overlege PhD frå Ålesund, presenterte poster på pasientar med testikkelkreft. Posteren
var basert på journalgjennomgang av 558 avdøde pasientar med testikkelkreftdiagnose frå 1980-2009. Hovudfokus var å karakterisere pasientar som døyde av testikkelkreft eller av behandlinga. Ein såg behandlingsrelaterte dødsfall hos 41/588 pasientar. Over 90% av desse fekk kjemoterapi og døyde som komplikasjon til dette. Dødsfall av testikkelkreft var svært sjeldan ved klinisk stadium 1 eller ved IGCCCG god prognosegruppe, og hyppigast for dei med non-seminom, viscerale metastasar eller dersom det var behov for ytterlegare kjemoterapi i etterkant av kirurgi. Dette er del av eit stort arbeid ein gjer for å identifisere risikofaktorar som ytterlegare kan redusere dødelegheit av testikkelkreft eller behandling.
Referanser:
Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no

KATARINA PUCO
Overlege i onkologi
Institutt for kreftforskning, Oslo Universitetssykehus, på vegne av NPCG
Foto er tatt av
ÅSMUND FLOBAK
PRESISJONSMEDISIN
Behandling av pasienter har alltid vært persontilpasset. Vi bruker tilgjengelig informasjon om alder, kjønn, komorbiditet, preferanser osv. til å tilpasse diagnostikk og behandling til den enkelte pasienten. Persontilpasset medisin tar utgangspunkt i at hver enkelt pasient får et unikt tilbud om behandling. Begrepet presisjonsmedisin er tatt i bruk de siste tiårene, og spesielt etter at det ble definert av National Research Council i USA i 2011 (1,2). Presisjonsmedisin kan ses som en forlengelse av stratifisert medisin, hvor karakteristika for pasientgrupper blir stadig mer presist definert, og hvor to ulike behandlinger kan testes og sammenlignes for effektivitet. I onkologisk praksis er presisjonsmedisin i dag knyttet til gendiagnostikk, hvor målet er å bruke ny diagnostikk til å identifisere stadig mindre og mer veldefinerte undergrupper av pasienter som har mest effekt av en type behandling, og dermed redusere bivirkninger og kostnader av ineffektiv behandling. Begrepene presisjonsmedisin, persontilpasset medisin eller stratifisert medisin brukes ofte som synonymer.
NASJONAL STRATEGI FOR IMPLEMENTERING OG ØKT KUNNSKAPSBEHOV HOS HELSEPERSONELL
Den norske Nasjonal strategi for persontilpasset medisin ble først lansert i 2016, med målet å bygge opp infrastruktur for presisjonsdiagnostikk. Den nye strategien for 2023-2030 bygger videre på denne og handler i større grad om implementering av presisjonsmedisin i forskjellige områder av helsetjenesten (3,4). Implementering stiller krav til kontinuerlig utvikling av kunnskap og kompetanse hos helsepersonell og til tverrfaglig samarbeid på tvers av tradisjonelle samarbeidslinjer, samt samarbeid mellom helsefagarbeidere og personell som ikke har helsefaglig bakgrunn, som innen molekylærbiologi, bioinformatikk, og biostatistikk.
I takt med implementering av presisjonsdiagnostikk i det offentlige og økt bruk av gendiagnostikk i privat sektor, har det onkologiske miljøet utrykt behov for å ha en felles arena for å diskutere analysene og funnene, og implikasjoner for den enkelte pasients
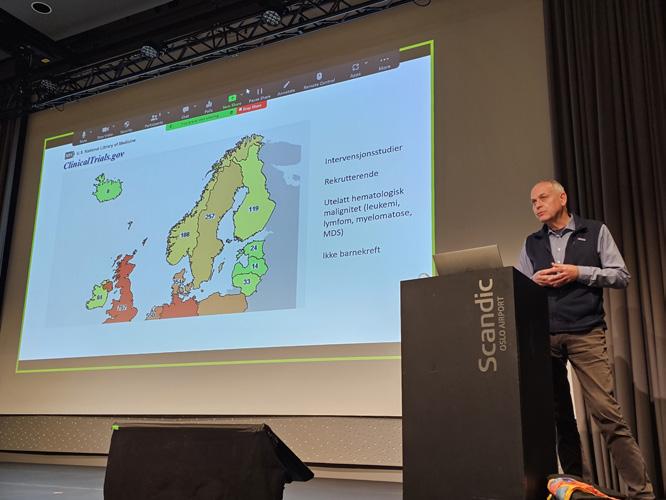

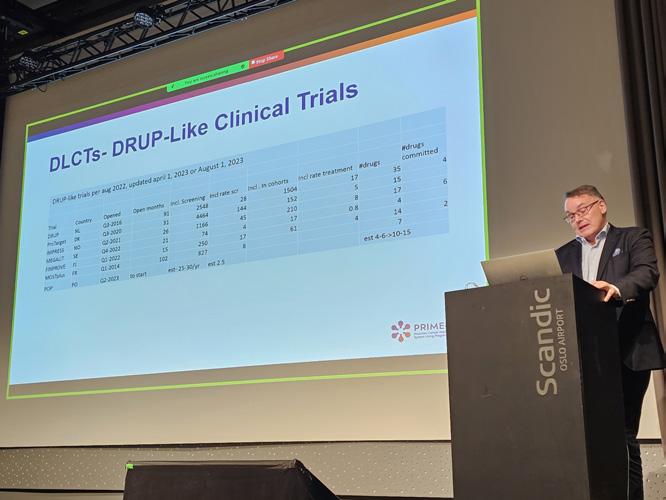
oppfølging og behandling. Andre faggrupper som gynekologi, hematologi, pediatri og diagnostiske miljøer har utrykt det samme behovet.
I tråd med nasjonal strategi og økende behov, ble «grunnsteinen» for etablering av egen faggruppe for presjonsmedisin lagt allerede i 2021, og under Onkologisk Forum 2023 hadde Norsk Presisjonsmedisinsk Cancer Gruppe sitt konstitueringsmøte.
NPCG skal være et møtested for leger og annet personell som er interessert i presisjonsmedisin, og diskusjonsarena for behandlere og diagnostikere innen presisjonsmedisin for kreft. Dette inkluderer diagnostikk, utredning, behandling, og oppfølging. Den nye faggruppen er relevant for leger innen kliniske fag som onkologi, hematologi, lungemedisin, gynekologi, kirurgi og pediatri, og for diagnostiske fag som patologi, genetikk og molekylærbiologi. I tillegg til å være diskusjonsarena, skal NPCG bistå med metodevarsler når nye medikamenter
skal evalueres. Dette gjelder medikamenter som er meldt til Nye metoder med tumoragnostisk indikasjon.
NPCG kan også foreslå overfor Helsedirektoratet at det utarbeides handlingsprogram på områder de finner aktuelle og forslå egnede arbeidsgrupper til disse.
NPCG ledes av et styre som ideelt sett har representanter fra diagnostiske spesialiteter (patologi, genetikk) samt kliniske spesialiteter (onkologi, lungemedisin, gynekologi, pediatri). En kan bli medlem av faggruppen ved å sende en skriftlig søknad om medlemskap til styret, epost adresse: asmund.flobak@ ntnu.no eller katpuc@ous-hf.no.
Første møte hadde 24 engasjerte deltagere og vi diskuterte erfaringer fra implementering av presisjonsdiagnostikk i Norge som har skjedd under infrastruktur for presisjonsdiagnostikk InPreD. Det ble presentert oversikt over molekylært styrte kliniske studier i Norge, Norden og Europa. Faglig del av møte ble avsluttet med diskusjon om behov for internasjonalt samarbeid for utveksling av kompetanse og erfaringer, samt planlegging av forskningssamarbeid.
Videre ble det valgt et midlertidig styre som skal utarbeide vedtektene. Det midlertidige styret består av 5 onkologer, 2 lungemedisiner, og 2 patologer, og ledes av Åsmund Flobak fra St. Olavs hospital. Endelig styre og vedtekter vedtas på årsmøtet i 2024. NPCG har for tiden 24 medlemmer.
Vi ønsker å invitere alle kollegaer med interesse i presjonsmedisin til å bli medlemmer og sende en skriftlig søknad til styret, samt ønsker velkommen til neste årsmøte under Onkologisk Forum 2024. Det planlegges for fysisk og virtuell deltagelse.
Referanser:
1. Committee on a Framework for Development of a New Taxonomy of Disease, National Research Council. Toward Precision Medicine:Building a Knowledge Network for Biomedical Research and a New Taxonomy of Disease. Washington, DC; National Academies Press; 2011.
2. Ashley EA. The Precision Medicine Initiative: A New National Effort. JAMA. 2015;313(21):2119–2120.
3. Nasjonal strategi for persontilpasset medisin i helsetjenesten 2017–2021. IS-2446. Oslo: Helsedirektoratet, 2016
4. Strategi for persontilpassa medisin i helsetenesta 2023-2030. Oslo: Helsedirektoratet; https://www.helsedirektoratet. no/tema/persontilpasset-medisin/strategi-forpersontilpassa-medisin-2023-2030
Kreftenheten ved Hamar Sykehus håndterer onkologiske tilstander for et omfattende geografisk område, som strekker seg fra Røros i nord til Espa i sør, med om lag 150 000 innbyggere. Denne avdelingen er organisert som en selvstendig seksjon under indremedisinsk avdeling, med egen seksjonsoverlege, fagansvarlig overlege, avdelingssykepleier og fagansvarlig sykepleier. Siden avdelingen åpnet i 1991 med kun en lege og to sykepleiere, har den vokst betydelig og teller nå seks overleger, ni kreftsykepleiere, og to leger i spesialisering. Aktiviteten har økt jevnt og trutt: i 2023 mottok over 5300 pasienter behandling og det ble utført omtrent 12 000 polikliniske konsultasjoner.
Seksjonsoverlege
Avdelingen har hovedfokus på poliklinisk behandling av et bredt spekter onkologiske tilstander hos voksne pasienter. Vi håndterer nesten alle tumorgrupper, med seksjonering mellom overlegene. Det legges betydelig vekt på kontinuitet i behandlingsforløpet, der behandlingsansvarlige overleger følger pasientene fra det første oppmøtet til de er ferdige med systemisk tumorrettet behandling. Denne tilnærmingen øker kvalitet, effektivitet og viktigst av alt, pasientenes tilfredshet.
Økt fokus på klinisk forskning preger avdelingen, der pasienter fra alle tumorgrupper inkluderes i pågående studier. Med tilføyelsen av en dedikert forskningssykepleier det siste året og en overlege i 20% forskningsstilling, planlegger avdelingen å etablere en egen forskningsgruppe innen kreftbehandling i løpet av 2024, ledet av to overleger med PhD-kompetanse.
Hamar Sykehus har en betydelig kreftkirurgisk aktivitet, hvor nesten 90% av all kreftkirurgi i Innlandet utføres her. Vi har ikke egen sengepost og våre pasienter legges inn på sine «moderavdelinger», dvs kirurgiske
og indremedisinske sengeposter. Dette medfører et nært samarbeid mellom onkologene og de ulike subspesialiteten vi har på sykehuset. Vi går imidlertid på tilsyn på sengepostene og håndterer daglige henvendelser fra sengeposter eller kollegaer angående inneliggende pasienter eller pasienter under utredning. Vi har ukentlige MDT-møter for de store tumorgruppene. Vi er i tillegg meget heldige med den fantastiske støtten vi får fra radiologene med daglig demonstrasjon av CT/MR undersøkelser. Dette hektiske, men engasjerende arbeidsmiljøet gir oss privilegiet til å støtte pasienter gjennom det utfordrende forløpet som kreftbehandling innebærer.
Palliativ enhet på Hamar Sykehus spiller en sentral rolle i helhetlig omsorg. Den består av to sykepleiere, fysioterapeut, prest, ernæringsfysiolog og en overlege, og har et nært samarbeid med kreftavdelingen. Palliativ enhet spiller en nøkkelrolle i å gi omsorg og støtte og bidrar til at pasienter får en god og profesjonell oppfølging.

Den onkologiske avdelingen i gamle Hedmark er ansvarlig for behandlingsløpet til alle pasientene i området, med unntak av lungekreft som håndteres primært av Elverum sykehus. Dette involverer også ukentlig tilstedeværelse av en av avdelingens overleger på Krefteneheten Elverum.
Kreftenheten Hamar har også det overordnede ansvaret for behandlingsløpet til pasientene fra Tynset, noe som betyr at pasientene kommer til Hamar Sykehus for første vurdering og alle påfølgende polikliniske kontroller. Behandlingene utføres hovedsakelig på Tynset for pasienter tilknyttet dette området.
Til tross for at dagene er travle trives vi spesielt godt fordi vi er et sammensveiset lag. Lunsj er et viktig knute-
punkt for dagen med samtaler om alt fra det reneste tøys og fjas til forsøk på innsiktsfull utenrikspolitikk. Alle som starter på avdelingen får raskt opplæring i Norges viktigste politiske skandaler og uoppklarte forbrytelser.
Med tanke på fremtiden for kreftbehandling i Innlandet, har vi fokus på det kommende sykehuset i Moelv. Allerede i dag har vi et nært samarbeid med kreftenheten på Gjøvik, særlig innen strålebehandling, og det jobbes mot enda tettere integrasjon. LIS ved avdelingen har regelmessig undervisning med LIS på Gjøvik, og det er etablert en rotasjonsavtale med stråleenheten på Gjøvik for å få gjennomført obligatorisk stråletjeneste.
Sykehuset Innlandets opptaksområde er svært stort (tilsvarende
hele Danmark), så avdelingen retter også fokuset mot å levere effektiv og trygg behandling over dette store området i fremtiden. Dette krever tett samarbeid og koordinasjon med andre enheter og sykehus i regionen for sikre at pasientene fortsetter å få god oppfølging gjennom hele behandlingsforløpet.
I tillegg til den kliniske behandlingen legger avdelingen også stor vekt på å opprettholde et godt arbeidsmiljø. Dette blir spesielt viktig når det nye sykehuset på Moelv står ferdig. Den nåværende tette samarbeidskulturen og støtten mellom kollegaer som vi trives godt med i dag skal viderebringes til det nye sykehuset, og avdelingen har allerede innført strategier for å sikre en så sømløs overgang som mulig.
Avdeling for Kreftbehandling ved Oslo Universitetssykehus er en stor avdeling med om lag 120 spesialister og 39 leger i spesialisering (LIS). Per i dag er det nærmere 1200 ansatte i avdelingen og rundt 150 senger og 18 Linacer fordelt på Radiumhospitalet og Ullevål. Hos oss er det mange leger som går i ulike typer forskningsstillinger iblandet klinikk, og med fagets rivende utvikling er det behov for å holde seg kontinuerlig oppdatert både innen ens egen, men også andre tumorgrupper.
EIVIND STORAAS
Overlege
Avdeling for Kreftbehandling OUS
STEIN KAASA
Avdelingsleder og overlege
Avdeling for Kreftbehandling OUS
JON RIISE
Overlege
Avdeling for Kreftbehandling OUS
MARIANNE GUREN
Overlege
Avdeling for Kreftbehandling OUS
Lymfomseksjonen er en av 9 ulike seksjoner hos oss og har det siste året vært preget av oppstarten av CAR-T-behandling (Yescarta) for diffust storcellet B-cellelymfom (DLBCL). Dette er en helt ny behandlingsmodalitet som vi i mange år har ønsket å få etablert hos oss. I oktober 2022 åpnet Nye Metoder for bruk av CAR-T i 3. linje og i slutten av august 2023 ble det også åpnet for CAR-T-behandling i 2. linje for samme entitet. Vi har i 2023 vurdert over 35 pasienter til denne behandlingen og 26 pasienter har fått infusjon av CAR-T. Av de 16 pasientene vi til nå har hatt til 3-mnd kontroll ser vi komplette remisjoner hos ca 50%, hos en gruppe pasienter som tidligere hadde svært dårlig prognose. Dette er svært spennende å få være med på, men skaper også nye krav og utfordringer til oss. Forhåpentligvis kan behandlingen også tilbys i Trondheim og Bergen om ikke så lenge.
Det gjennomføres flere prosjekter i avdelingen. Ved starten av 2023 begynte man å planlegge en gjennom-
gang av LIS-utdanningen hos oss og arbeidet kom i gang med bred involvering etter sommeren på mandat fra Klinikksjef Sigbjørn Smeland og under ledelse av avdelingsleder Stein Kaasa. Hensikten med gjennomgangen har vært å heve både spesialistutdanningen vi tilbyr LISene og arbeidsmiljøet i avdelingen som helhet. Det er funnet flere forbedringspunkter med tilhørende tiltak og avdelingen ser frem til neste besøk av spesialistkomiteen i juni 2024. Et inntrykk er at den nye spesialistordningen ble svært ambisiøs hva gjelder kompetansenivå som skal oppnås, hvor nesten halvparten av onkologiens læringsmål er satt til høyeste nivå, og at de foreslåtte læringsaktivitetene ikke nødvendigvis er ensbetydende med oppnådd kompetanse. Leder for regionalt utdanningssenter i Helse-Sør Øst har latt seg sitere på at ambisjonsnivået til kompetanse i den nye ordningen som helhet, for hver av de 44 sykehusspesialitetene, tilsvarer det man kanskje har oppnådd dagen før man skal pensjonere seg. Dette blir til ettertanke all den tid vårt virke fordrer livslang

læring også etter endt spesialisering. En uformell spørrerunde hos medisinstudentene i Oslo viste at kun halvparten så for seg klinisk arbeid i fremtiden. Det er viktig at onkologien gjør seg attraktiv for fremtidige kolleger og en revisjon av ordningen for onkologiens del kan være indisert i løpet av de kommende årene.
Overordnet er vår avdeling inne i omstilling både i lys av nytt Radiumhospital og at det fremover blir nye strålesentra i regionen, i første omgang i Drammen, og så etter hvert i Skien, med påfølgende nedtrekk av behandlingen hos oss. Klinikere har vært involvert tidlig i prosessen med nytt Radiumhospital og dette bærer også nybygget preg av. Nytt Radiumhospital gir nye muligheter og er tenkt ferdig innflyttet i løpet av
høsten 2024. Det blir en ny nasjonal behandlingstjeneste for protonbehandling i Oslo og Bergen, og det bygges kompetanse i fagmiljøene i samarbeid med alle helseregioner. Avdeling for Kreftbehandling vil skifte navn til Onkologisk avdeling og være en del av Kreftklinikken ved sykehuset som får stedlig ledelse ved Radiumhospitalet. Klinikken er sertifisert som «Comprehensive Cancer Center» og har et tydelig fokus på internasjonalt samarbeid.
Kunstig intelligens har gjort sitt inntog i planleggingen av stråleterapi. En studie gjort ved brystseksjonen i vår avdeling viste tidsbesparing ved inntegning av risikoorganer. Det blir spennende å se hvordan dette vil påvirke det daglige arbeidet, utdannelsen, og behandlingen for øvrig i årene fremover.
Inntrykket i den kliniske driften er at flere pasienter er mer kompliserte, blant annet påvirket av at befolkningen blir eldre. Dette gjenspeiles nødvendigvis ikke alltid i måten tjenesten er finansiert på. Avdelingen vår mottar en god del forespørsler om second opinion av pasienter fra andre sykehus i Norge, og prøver å svare ut hvert tilfelle best mulig så raskt det lar seg gjøre. Mange pasienter søker seg til oss på fritt behandlingsvalg, selv om behandlingen lokalt som regel ikke står tilbake for den vi kan tilby her. Vi arbeider aktivt for å motvirke unødvendig sentralisering av behandlingen.
Parallelt med mer komplekse sykdomsbilder, så er også behandlingsmulighetene stadig ekspanderende og vår seksjon for
utprøvende behandling har høy aktivitet innen både forsker- og industri initierte studier. Flere av våre klinikere er involvert i ImPress-Norway studien og det er et privilegium for miljøet som er på Radiumhospitalet å få være fysisk tett på både Forskningsbygget og Oslo Cancer Cluster. Disse økende behandlingsmulighetene utfordrer legerollen i valget om å skulle avslutte tumorrettet behandling, som i tråd med de kloke ord «Sjelden kurere, ofte lindre, alltid trøste», fordrer reflekterende dialog og informerte samvalg med pasientene våre.
Avdelingen gjør nå en gjennomgang av det palliative tilbudet som helhet hvor man blant annet ønsker mer bruk av hjemmebehandling i tråd med sykehusets ambisjoner om dette for øvrig. I tillegg går vi gjennom en del av de andre sentraliserte behandlingsforløpene i vår region. Prinsippet om at det som kan gjøres lokalt skal gjøres der er en viktig del av ivaretakelsen tror vi, og vi ser frem til den videre oppbyggingen av behandlingstilbudet ved andre virksomheter i vår region.
Det EU-finansierte forskning- og implementeringsprosjektet «MyPath»
vil starte opp ved utvalgte poliklinikker hos oss i løpet av året som kommer, i samarbeid med flere sentra i Norge og ni sentra i Europa. Målet er å tilby pasientsentrerte forløp integrert med nye innovative IKT- og organisatoriske løsninger i klinikken for best mulig behandling, basert på den enkelte pasienten sine behov.
Vi er heldige som får arbeide med verdens mest meningsfulle fag og gleder oss til å ta fatt på et nytt år i samarbeid med kolleger landet rundt!

Norsk Onkologisk Forening utlyser for medlemmene inntil 15 fagstipender som kan brukes til faglige formål som konferanser, kurs, hospitering o.l.
Mottakere vil få refundert inntil 20.000 kr av dokumenterte utgifter innenfor kalenderåret 2024 til kursavgift, reise og opphold. Kost dekkes ikke.
Tildeling av stipend forutsetter innlegg i Onkonytt etter nærmere avtale med redaksjonen ved René van Helvoirt (rene.helvoirt@sshf.no).
Søknad sendes til styremedlem Dalia Dietzel (jada@sthf.no) og fristen for 2024 er 1. mai. Søknaden skal inneholde navn, stilling, arbeidssted og opplysninger om formålet. Beslutning om tildeling fattes av styret. Søkere som ikke har mottatt fagstipend de siste 2 årene prioriteres, deretter ved loddtrekning.
Stipendet utbetales innen 3 måneder etter innsendt reise- / kursregning med kvitteringer.
Nå har flere pasienter med mBC mulighet til forlenget
Første og eneste godkjente trop-2 rettede ADC, fra 2L behandling hos pasienter med mTNBC* og fra 3L behandling hos pasienter med HR+/HER2- mBC.**
mTNBCmTNBC HR+/ HER2- mBC HR+/HER2− mBC
NY INDIKASJON


* Monoterapi hos voksne med inoperabel eller metastatisk trippelnegativ brystkreft (mTNBC) som har fått 2 eller flere tidligere systemiske behandlinger, hvorav minst 1 for avansert sykdom.1
** Monoterapi hos voksne med inoperabel eller metastatisk hormonreseptor (HR)-positiv, HER2-negativ brystkreft som har fått endokrinbasert behandling og minst 2 ytterligere systemiske behandlinger i avansert setting.1
a) ASCENT-studie (mTNBC), OS: Medianverdi 11,8 måneder (95% KI, 20,5-13,9) med Trodelvy vs 6,9 måneder (KI 95%, 5,9-7,7) med behandling valgt av legen (eribulin, kapecitabin, gemcitabin eller vinorelbin). HR 0,51 (95% KI, 0,41-0,62; p<0,0001), for hele studiepopulasjon (primært endepunkt pluss pasienter med hjernemetastaser).1
b) TROPiCS-02 studie (HR+/HER2- mBC), OS: Medianverdi 14,4 måneder (95% KI, 13,0-15,7) med Trodelvy vs 11,2 måneder (95% KI, 10,1-12,7) med behandling valgt av legen (eribulin, kapecitabin, gemcitabin eller vinorelbin). HR 0,789 (95% KI, 0,646-0,964; p = 0,02)1
Dosering
1. Trodelvy SmPC 07/2023.
2L = andre linje; ADC = antistoff legmiddelkonjugat; mBC = inoperabel eller metastatisk brystkreft; HR+/HER2- mBC = hormon-reseptor positiv, human epidermal vekstfaktor reseptor 2-negativ inoperabel eller metastatisk brystkreft; mTNBC = inoperabel eller metastatisk trippelnegativ brystkreft; Trop-2 = trofoblast celleoverflate antigen 2).
10 mg/kg/uke gitt som i.v. infusjon på dag 1 og dag 8 i behandlingssykluser på 21 dager, til sykdomsprogresjon eller uakseptabel toksisitet. Forebyggende behandling mot infusjonsrelaterte reaksjoner og CINV anbefales. Infusjonshastighet reduseres eller infusjonen avbrytes dersom infusjonsrelatert reaksjon oppstår. Seponeres permanent dersom livstruende, infusjonsrelaterte reaksjoner oppstår. Kontraindikasjoner Overfølsomhet for innholdsstoffene.
Utvalgt sikkerhetsinformasjon
Utvalgte bivirkninger
Svært Vanlige
Nøytropeni: Alvorlig/ livstruende nøytropeni kan opptre, inkl. dødelige infeksjoner. Skal ikke gis hvis absolutt nøytrofiltall er <1500/ mm3 på dag 1 eller < 1000mm3 på dag 8 i en syklus. Blodverdier skal overvåkes. Gis ikke ved nøytropen feber. Pga. alvorlig nøytropeni kan behandling med G-CSF og doseendringer være påkrevd. Diaré: Kan forårsake kraftig diaré, ev. dehydrering og akutt nyreskade. Loperamidbehandling og ytterligere støttetiltak kan benyttes. Ved for sterk kolinerg respons på behandling kan egnet behandling gis ved etterfølgende behandlinger. Overfølsomhet: Anafylaktiske reaksjoner er sett. Premedisinering før infusjon anbefales. Kvalme/oppkast: Antiemetisk forebyggende behandling anbefales. Pasienter skal gis legemidler de kan ta med hjem.
Hematologiske Anemi, leukopeni, lymfopeni, nøytropeni Gastrointestinale Abdominalsmerter, diaré, forstoppelse, kvalme, oppkast Andre Fatigue, alopesi, overfølsomhet, urinveisinfeksjon, øvre luftveisinfeksjon, dyspné, hoste, artralgi, ryggsmerter, hodepine, svimmelhet, insomni, hypokalemi, hypomagnesemi, redusert appetitt
▼ Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig.
Trodelvy «sacituzumabgovitekan» pulver til konsentrat til infusjonsvæske, oppløsning
Reseptgruppe C
Indikasjon: - Monoterapi hos voksne med inoperabel eller metastatisk trippelnegativ brystkreft (mTNBC) som har fått 2 eller flere tidligere systemiske behandlinger, hvorav minst 1 for avansert sykdom. - Monoterapi hos voksne med inoperabel eller metastatisk hormonreseptor (HR)-positiv, HER2-negativ brystkreft som har fått endokrinbasert behandling og minst 2 ytterligere systemiske behandlinger i avansert setting.
Dosering: Administreres av helsepersonell med erfaring i bruk av kreftlegemidler. Komplett utstyr for gjenopplivning skal være tilgjengelig. Voksne: 10 mg/kg/uke gitt som i.v. infusjon på dag 1 og dag 8 i behandlingssykluser på 21 dager, til sykdomsprogresjon eller uakseptabel toksisitet. Forebyggende behandling mot infusjonsrelaterte reaksjoner og CINV anbefales. Infusjonshastighet reduseres eller infusjonen avbrytes dersom infusjonsrelatert reaksjon oppstår. Seponeres permanent dersom livstruende, infusjonsrelaterte reaksjoner oppstår. Anbefalte doseendringer ved bivirkninger: Se SPC for doseringsveiledning. Spesielle pasientgrupper: Nedsatt leverfunksjon: Sikkerhet ikke fastslått ved moderat/ alvorlig nedsatt leverfunksjon. Nedsatt nyrefunksjon: Ikke undersøkt ved alvorlig nedsatt nyrefunksjon eller terminal nyresvikt. Eldre: Begrensede data hos eldre ≥75 år. Tilberedning/Håndtering: Skal tilberedes av helsepersonell med erfaring i håndtering av kreftbehandling. Se pakningsvedlegget for instruksjoner. Administrering: Gis som i.v. infusjon. Se SPC. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Forsiktighetsregler: Nøytropeni: Alvorlig/livstruende nøytropeni kan opptre, inkl. dødelige infeksjoner. Skal ikke gis hvis absolutt nøytrofiltall er <1500/mm3 på dag 1 eller <1000mm3 på dag 8 i en syklus.
Blodverdier skal overvåkes. Gis ikke ved nøytropen feber. Pga. alvorlig nøytropeni kan behandling med
G-CSF og doseendringer være påkrevd. Diaré: Kan forårsake kraftig diaré, ev. dehydrering og akutt nyreskade. Loperamidbehandling og ytterligere støttetiltak kan benyttes. Ved for sterk kolinerg respons på behandling kan egnet behandling gis ved etterfølgende behandlinger. Overfølsomhet: Anafylaktiske reaksjoner er sett. Premedisinering før infusjon anbefales. Kvalme/oppkast: Antiemetisk forebyggende behandling anbefales. Pasienter skal gis legemidler de kan ta med hjem. Redusert UGT1A1-aktivitet: SN-38 metaboliseres via UGT1A1. Pasienter med kjent nedsatt UGT1A1-aktivitet skal overvåkes nøye for bivirkninger. Natrium: Daglig totalt natriuminntak fra alle kilder skal vurderes. Interaksjoner: UGT1A1-hemmere eller -induktorer kan potensielt hhv. øke eller redusere SN-38-eksponering. Forsiktighet utvises ved samtidig bruk. Graviditet og amming: Graviditet: Teratogenisitet og/eller embryoføtal dødelighet kan oppstå. Skal ikke brukes under graviditet hvis ikke klinisk tilstand gjør det nødvendig. Kvinner i fertil alder må bruke sikker prevensjon under og i 6 måneder etter avsluttet behandling. Mannlige pasienter med fertile kvinnelige partnere må bruke sikker prevensjon under og i 3 måneder etter avsluttet behandling. Amming: Amming skal opphøre under og i 1 måned etter behandling. Bivirkninger: Svært vanlige: Anemi, leukopeni, lymfopeni, nøytropeni, abdominalsmerter, diaré, forstoppelse, kvalme, oppkast, fatigue, alopesi, overfølsomhet, urinveisinfeksjon, øvre luftveisinfeksjon, dyspné, hoste, artralgi, ryggsmerter, hodepine, svimmelhet, insomni, hypokalemi, hypomagnesemi, redusert appetitt. Vanlige: Febril nøytropeni, trombocytopeni, abdominal distensjon, dyspepsi, gastroøsofageal reflukssykdom, kolitt, nøytropen kolitt, stomatitt, øvre abdominalsmerter, frysninger, smerter, bronkitt, influensa, nasofaryngitt, oral herpes, pneumoni, sepsis, sinusitt, hypotensjon, epistakse, muskelkramper, muskel-skjelettsmerter i brystet, dysgeusi, angst, dehydrering, hyperglykemi, hypofosfatemi, hypokalsemi, hyponatremi, redusert vekt. Mindre vanlige: Enteritt, infusjonsrelatert reaksjon. For mer informasjon, se felleskatalogen eller preparatomtalen (SPC) Basert på SPC godkjent av SLV/ EMA: 07/2023. Innehaver av markedsføringstillatelsen: Gilead Sciences Ireland UC, Irland. For informasjon, kontakt lokal representant: Gilead Sciences Nordic, Sverige: Telefon: + 46 8 505 71 800. E-post: nordics. medinfo@gilead.com Pakninger og priser per 15.02.2022: 1 stk. (hettegl.) kr. 12311,20 (priser og ev. refusjon oppdateres hver 14. dag). Refusjon: - Dato: 10.08.2023
Kreftklinikken på St. Olavs hospital har regionalt ansvar for kreftbehandling i Midt-Norge, og dekker totalt et innbyggertall på omtrent 720.000. Vi har i tillegg lokalsykehusansvar for Trondheim og 14 omliggende kommuner. Det meste av vår aktivitet foregår i Trondheim, med poliklinikk og dagenhet, 36 sengeplasser for inneliggende pasienter og stråleterapiavdeling. I tillegg er kreftpoliklinkken på Orkdal sjukehus, Kompetansetjeneste for lindrende behandling Midt-Norge samt Vardesenteret og Pusterommet organisert som en del av Kreftklinikken. Klinikken har siden juni 2023 blitt ledet av klinikksjef Turid Lund.
TURID LUND Klinikksjef
HEIDI KNOBEL Avdelingssjef
Ide siste årene har Kreftklinikken hatt en betydelig aktivitetsøkning, blant annet på grunn av godkjenninger av nye medikamenter og indikasjoner som fører til at store pasientgrupper skal ha ny behandling. Vi forventer at aktiviteten vil fortsette å øke i årene som kommer, noe som utfordrer oss både med tanke på personell og areal.
ORGANISERING FOR FREMTIDEN
Vi jobber stadig med å organisere tjenestene våre for å være godt rustet for fremtiden. På Øya i Trondheim disponerer vi i dag fem etasjer klinisk areal som består av stråleavdeling, poliklinikk, dagenhet, sengepost og en seksjon for lindrende behandling med poliklinikk og sengepost. I tillegg har vi «satellitter» i form av en kreftpoliklinikk på Orkdal sjukehus som tilbyr både kurativ og palliativ behandling, og en sengepost som befinner seg på St. Olav sitt pasienthotell. Sistnevnte er en fellespost for hele sykehuset, men ble i 2023 formelt underlagt Kreftklinikken med bakgrunn i at vi er en av klinikkene som benytter oss mest av dette tilbudet. Fellesposten er
aktuell for pasienter med medisinsk avklart situasjon, og som har en dokumentert behandlingsplan.
Legetjenesten ved klinikken er organisert i seks team med overleger og LIS-leger, og hvert team har fagansvarlige overleger for de ulike tumorgruppene. Sengeposten, poliklinikken og seksjon lindrende behandling har egne seksjonsoverleger som inngår i den kliniske driften. Vi ønsker en faglig sterk legegruppe, og flere av våre ansatte er aktive forskere, samt deltar i fagutviklingsarbeid nasjonalt og internasjonalt.
I 2023 hadde Kreftklinikken 26 498 polikliniske konsultasjoner og 1795 innleggelser. I tillegg gjennomførte vi 24 390 strålebehandlinger og administrerte 8 548 intravenøse kreftbehandlinger. En aktivitetsøkning som følge av at kreftpasienter blir flere, er krevende, og vi har behov for å omstille driften for å møte denne økningen. Viktige tiltak er digitalisering, både av konsultasjoner og avstandsoppfølging av definerte pasientgrupper, men også i form av automatisering av arbeidsprosesser.


Dette innebærer betydelige endringsprosesser som påvirker hele klinikken.
Pasienter med komplekse og sammensatte seneffekter kan nå få hjelp på en egen poliklinikk for seneffekter ved St. Olavs hospital. Den ble åpnet 2. september 2022, og skal i tillegg til poliklinisk drift være en rådgiver og kompetansebygger for øvrige deler av helsetjenesten.
Vi har hatt høy aktivitet også innen andre områder. De siste årene har klinikken bygget mye kompetanse innenfor protonbehandling. Vi har et godt samarbeid med Haukeland universitetssjukehus, hvor pasienter fra Midt-Norge skal få sin protonbehandling. Høsten 2023 startet vi, i samarbeid med Laboratoriemedisinsk klinikk, med å utrede mulighetene for å kunne tilby CAR-T-behandling ved St. Olavs hospital, og vi har startet prosessen med søknad om akkreditering som Comprehensive Cancer Center.
I samarbeid med Fakultet for medisin og helsevitenskap, NTNU, har klinikken stort fokus på gjennomføring og utvikling av undervisning og forskning som en del av det integrerte universitetssykehuset.
Forskningsaktivitet ved Kreftklinikken organiseres i tett samarbeid med Forskningsgruppe kreft og palliasjon ved NTNU, og vi har høy aktivitet både når det gjelder initiering av og deltakelse i kliniske studier nasjonalt og internasjonalt.
Klinikken har en ambisjon om at flest mulig overleger skal ha forskningserfaring, vi har derfor flere leger i delte stillinger. Kreftklinikken er til enhver tid involvert i et stort antall kliniske studier, både oppdrag og bidrag, og de aller fleste legene på klinikken er involvert i studier selv om de ikke har forskerstilling. Vi jobber målrettet for å nå målet i handlingsplanen for kliniske studier i Norge, og har i samarbeid med forskningsgruppen på NTNU etablert en robust infrastruktur for forskning som bistår aktivt i dette arbeidet.
De siste årene har Kreftklinikken satt i gang en større satsning på innovasjon, blant annet ved ansettelse av en dedikert innovasjonssykepleier som følger opp en rekke små og store innovasjonsprosjekter. En del av prosjektene handler om digitalisering og avstandsoppfølging, men satsningen har også åpnet for å raskt kunne iverksette mindre prosjekter som letter arbeidshverdagen i klinikken.
Ved Avdeling stråleterapi er onkologene tungt involvert i ulike prosjekter for å øke kvalitet og effektivitet gjennom å automatisere manuelle operasjoner i planlegging av strålebehandling. I samarbeid med leverandør og Ålesund sjukehus ha vi utviklet egne segmenteringsmodeller basert på kunstig intelligens for inntegning av både målvolum og risikoorganer. Et godt tverrfaglig samarbeid med medisinske fysikere og stråleterapeuter har også gjort at bortimot alle doseplaner nå blir laget ved hjelp av et automatisert dataskript som sikrer doseplaner av høy kvalitet generert på kort tid.
Denne talen ble holdt av leder for Norske Onkologisk Forening, Daniel Heinrich, under festaften på Onkologisk Forum i november 2023 i forbindelse med utnevnelse av Hans Petter Eikesdal som Æresmedlem i NOF.
Prof. Herman Høst
Prof. Sophie Dorothea Fosså
Prof. Olav Dahl
Prof. Olbjørn Klepp
Prof. Stein Olav Kvaløy
Prof. Erik Wist
Prof. Øyvind Bruland
Prof. Steinar Aamdal
Prof. Terje Risberg
Prof. Stein Sundstrøm
Dr. Kirsten Sundby Hall
Dr. Harald Holte
Prof. Marit Slaaen
Prof. Olav Mella
Prof. Hans Petter Eikesdal (†2023)
Onkologisk Forum er den viktigste årlige møtearena for alle som jobber med kreft i Norge! Her møter vi kollegaer som vi ser hver dag og andre som vi bare ser en gang i året. Mange er blitt gode bekjente og venner. Jeg møter mange gode venner på Onkologisk Forum hvert år.
Men en av dem er ikke her i dag. Dere hadde vanligvis sett oss i baren som de første onsdag kveld og trolig som noen av de siste i kveld etter festaften.
Hans Petter er ikke her i kveld, jeg har mistet min beste venn, og hva mye verre er, Inger Marie og ungene har mistet mann og far!
Men dette skal ikke bli en lang trist minnetale, Hans hadde ikke ønsket det, «det er en festaften, da skal det feires!» hadde han sagt.
«Hans Petter var min beste venn» har mange sagt i dagene og ukene etter den tragiske kvelden, jeg også, han var det. Han var best på å være beste venn. Med hans genuine interesse i folk, med hans medfødte evne til å se
noe spennende og interessant i hvert menneske og alltid med en historie fra barndomstiden i Haugesund på lur, så var han en naturlig «bestevenn»!
Han var best også på å velge gode viner og restauranter og å dele denne gleden med oss, det var viktig å dele gleden.
Også ble han avdelingsdirektør i Bergen og har i den funksjonen lanserte han strategi for avdelingen for de neste årene. Ikke overraskende var målet å bli best, best i verden, det gir ikke noe mening å ha som mål å være nest best.
Jeg har lyst til å bringe ut en skål (med denne vinen som trolig ikke hadde funnet veien inn i Hans sin vinkjeller). En skål på at vi alle skal jobbe for dette store målet (ikke bare for kreftavdelingen i Bergen men for alle norske kreftpasienter) at vi skal bli best i verden til ære for Hans Petter.
For å ære Hans Petter Eikesdal har styret og årsmøte i Norsk Onkologisk Forening utnevnt Hans Petter posthum til æresmedlem i Norsk Onkologisk Forening.»
På diplomet som følger med utnevnelsen står det:
«Hans Petter har vært til inspirasjon og en motivator for oss alle og en uerstattelig del av felleskapet. Han var en hjørnestein i det onkologiske fagmiljøet i Norge og har gjennom sin innsats for hver enkel pasient og sin forskningsinnsats for store pasientgrupper forbedret, forlenget og reddet livet til utallige mennesker.
Med sjarm, humor og Haugesunds dialekt var han overalt elsket og midtpunktet på hvert møte og hver fest. Vi har alle mistet en god kollega, støttespiller, pådriver og ikke minst venn.
Med utnevnelsen til æresmedlem blir du, kjære Hans Petter, for alltid en del av Norsk Onkologisk Forenings historie og vil alltid være blant oss!»

2022
Kari Dolven-Jacobsen Oslo Universitetssykehus, Radiumhospitalet, Oslo
2021
Odd Terje Brustugun Drammen sykehus, Vestre Viken
2020
Ikke utdelt pga Covid-19
2019
Kirsten Marienhagen UNN, Tromsø
2018
Andreas Stensvold Sykehuset Østfold, Kalnes
2017
Stephanie Geisler Akershus Universitetssykehus
2016
Ingvil Mjaaland Stavanger Universitetssykehus
2015
Tor Jensen Sykehuset Telemark, avd. Skien
2014
René van Helvoirt Sykehuset Sørlandet Kristiansand
2013
Jan Folkvard Evensen Oslo Universitetssykehus, Radiumhospitalet, Oslo
2012
Knut Fjæstad Sykehuset Innlandet, Hamar
2011
Arne Solberg St. Olavs Hospital, Trondheim
Vår alles kjære Alina er en positiv sjel! Alt hun engasjerer seg i - og det er mye- blir bra!!
Alina har en enorm arbeidskapasitet, og beholder roen selv om det koker rundt.
Hun har særskilt god evne til å samarbeide med andre, er svært godt likt av alle og har gode diplomatiske evner som bidrar sterkt til det gode arbeidsmiljøet i avdelingen.
Hun er svært godt likt av LiSene, tar seg alltid tid til og vare på dem, forklarer og deler sin kunnskap med humør og forståelse for hverdagen til LiSene, som uansett kan spørre henne til råds om både stort og smått.
Hun har vært Norge Rundt som medlem i Spesialitetskomiteen, har god oversikt over ny ordning og læringsmål, gir god innføring og støtte til nyansatte LiS, og ikke minst inspirerer og engasjerer LiS til å arbeide med kliniske studier.
Hun er faglig sterk, fagansvarlig for malignt melanom og brystkreft ved Drammen sykehus, og tok raskt ansvar også nasjonalt som medlem i NBCG. Men foruten hjertebarna malignt melanom og cancer mammae behandler hun ALLE diagnoser og gyver løs på nye oppgaver. Hun

innførte immunterapi ved Drammen sykehus og har vært opptatt av å informere kollegaene om håndtering av bivirkningene med foredrag på de ulike avdelingene.
Alina ble nominert til Årets onkolog av kollegaene ved Onkologisk Poliklinikk, Drammen Sykehus
Styret i Norsk Onkologisk forening er stolt og beæret av å kunne tildele prisen for Årets Onkolog til henne.

VECTIBIX ER INDISERT til behandling av voksne pasienter med metastatisk kolorektalkreft (mCRC) med villtypeRAS i førstelinjebehandling i kombinasjon med FOLFOX eller FOLFIRI. I andrelinjebehandling i kombinasjon med FOLFIRI for pasienter som har fått førstelinjebehandling med fluoropyrimidin-basert kjemoterapi (ekskludert irinotekan). Som monoterapi når kjemoterapiregimer med fluoropyrimidin, oksaliplatin og irinotekan har sviktet.1
RAS VILLTYPE (KRAS og NRAS) må være bestemt før initiering av behandlingen. Mutasjonsstatus bør fastslås av et erfarent laboratorium, som benytter validert testmetode for påvisning av KRAS-(ekson 2, 3 og 4) og NRAS-mutasjoner (ekson 2, 3 og 4).
ANBUD: Fra oktober 2023 er Vectibix® (panitumumab) rabattert og rangert som 1. valg i anbud 2307 onkologi (Gastrointestinalkreft).2
Lær mer om behandling med Vectibix® og bestill materiale:

Hold telefonens kamera over qr-koden for å komme til landingssiden eller besøk cloud.amgeninfo.com/bestill_kreft
Anbefalt dose: 6 mg/kg kroppsvekt gitt hver 14. dag (q2w). Anbefalt infusjonstid er ca. 60 minutter. Dersom den første infusjonen tolereres, kan påfølgende infusjoner administreres i løpet av 30-60 minutter. Doser >1000 mg skal administreres i løpet av ca. 90 minutter. Utvalgte bivirkninger og viktige forsiktighetsregler:
• Dermatologiske reaksjoner og bløtvevstoksisitet
• Elektrolyttforstyrrelser/hypomagnesemi
• Det er sett forkortet progresjonsfri overlevelsestid og økt dødelighet hos pasienter som fikk panitumumab i kombinasjon med bevacizumab og kjemoterapi.
Kontraindikasjoner: Tidligere alvorlig eller livstruende overfølsomhet for innholdsstoffene. Interstitiell pneumonitt eller pulmonal fibrose. Kombinasjon med kjemoterapi som inneholder oksaliplatin, er kontraindisert hos pasienter med mutert RAS mCRC eller med en ukjent RAS mCRC-status.
Pakninger, priser og refusjon: Konsentrat til infusjonsvæske, oppløsning R.Gr.C
Styrke Pakning Pris (kr)*
20 mg/ml 5 ml (hettegl.) 119031 4734,60
20 ml (hettegl.) 119053 18829,70
Se Felleskatalogen for mer informasjon.
*Maksimal utsalgspris apotek
Returadresse:
Den Norske Legeforening
Pb 1152 Sentrum
0107 Oslo

INDIKASJON
Enhertu som monoterapi er indisert til behandling av voksne pasienter med inoperabel eller metastaserende HER2-lav brystkreft som har fått tidligere kjemoterapi ved metastaserende sykdom eller fått sykdomstilbakefall under eller innen 6 måneder etter fullført adjuvant kjemoterapi.1
ENHERTU gav signifikant lengre progresjonsfri overlevelse og økt total overlevelse hos pasienter med HER2-lav mBC2,3
måneder mPFS
mPFS var 10,1 måneder (N=331, 95 % KI 9,5–11,5) med ENHERTU vs. 5,4 måneder (N=163, 95 % KI 4,4–7,1) med kjemoterapi*2,3
49% risikoreduksjon
ENHERTU reduserte risikoen for sykdomsprogresjon eller død vs. kjemoterapi* med 49 %
(N=494, HR 0,51; 95 % KI 0,40–0,64; P<0,001)2,3
Dosering: Anbefalt dose brystkreft: 5,4 mg/kg. Gis som iv. infusjon (ikke som støtdose eller bolus) 1 gang hver 3. uke (21-dagerssyklus) frem til sykdomsprogresjon eller uakseptabel toksisitet. Før hver dose bør pasientene premedisineres med et kombinasjonsregime av 2 eller 3 legemidler for å forebygge kvalme og oppkast.
Bivirkninger: De vanligste bivirkningene var kvalme (76,8 %), fatigue (56,1 %) og oppkast (44,6%). Behandling av bivirkninger kan kreve midlertidig avbrudd, dosereduksjon eller seponering av behandling.
Utvalgt sikkerhetsinformasjon: Skal forskrives av lege og administreres under tilsyn av helsepersonell med erfaring innen bruk av kreftlegemidler. For å forebygge feilmedisinering skal hetteglassene sjekkes for å sikre at legemidlet som tilberedes og administreres er Enhertu (trastuzumabderukstekan) og ikke trastuzumab eller trastuzumabemtansin.
Interstitiell lungesykdom (ILD)/pneumonitt: Pasienter skal monitoreres for tegn og symptomer på ILD/pneumonitt og umiddelbart utredes ved mistanke om dette.
Nøytropeni: Komplett blodtelling skal foretas før oppstart av behandling og før hver dose, og som klinisk indisert.
Reduksjon i venstre ventrikkels ejeksjonsfraksjon (LVEF): Standard hjertefunksjonsundersøkelse (EKG eller MUGA skanning) skal foretas for å vurdere LVEF før oppstart av behandling og regelmessig under behandling som klinisk indisert.
Graviditet: Kan forårsake fosterskade.
Vi anbefaler at du leser preparatomtalen før oppstart av behandling. Det er utarbeidet risikohåndteringsmateriell og pasientinformasjon for Enhertu. Dette finner du på www.felleskatalogen.no eller ved å kontakte oss.
Se preparatomtalen (SPC) for utfyllende informasjon om Enhertu. Det anbefales at du leser denne før oppstart av behandling.
Reseptgruppe: C.
Pakninger, priser og refusjon: 100mg: 1 stk. (hetteglass) 22341,00 NOK. Besluttet innført ved HER2+ metastatisk brystkreft i 2. linje eller senere og ved HER2-lav inoperabel eller metastasert brystkreft.
*Brukt kjemoterapi var kapecitabin, eribulin, gemcitabin, paklitaksel eller nab-paklitaksel i henhold til legens valg, mBC = metastatic Breast Cancer, mPFS=medium Progression Free Survival
Referanser: 1. Enhertu® (trastuzumabderukstekan) preparatomtale EMA/SLV pkt. 4.1. 2. Enhertu® (trastuzumabderukstekan) preparatomtale EMA/SLV pkt. 5.1. 3. Modi S, Jacot W, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med. 2022;387(1):9-20. 4. https://nyemetoder.no Enhertu markedsføres i Norge av Daiichi Sankyo Nordics Aps og AstraZeneca AS. NO.ENH/23/0381 25.05.2023, NO-11072-09-23-EN