

Mục lục
Phần 1..............................................................................................................8 Khu vực châu Á ................................................................................................8
Olympiad Khoa Học Úc ........................................................................................ 9
Olympiad Hóa học Ấn Độ ...................................................................................20
Câu 1: Hành trình đến nhựa epoxy 20
Câu 2: Hợp chất ăn được và chất tạo màu 28
Câu 3: Sản sinh oxygen hóa học và an toàn oxygen 34
Câu 4: Polyoxometallate 42
Olympiad Hóa học Trung Quốc 49
Câu 1: Viết phương trình phản ứng 49
Câu 2: Các dạng thù hình của oxygen 51
Câu 3: Hợp chất boron ..................................................................................54
Câu 4: Băng khô.............................................................................................56 Câu 5: Xác định hợp chất ..............................................................................60 Câu 6: Cấu trúc perovskite ............................................................................62
Câu 7: Phức chất ...........................................................................................65 Câu 8: Cấu trúc - Hoạt tính hợp chất hữu cơ................................................67
Câu 9: Chuyển hóa hữu cơ 71 Câu 10: Kiến thức tổng hợp 74 Phần 2............................................................................................................79 Khu vực châu Âu ............................................................................................79
Olympiad Hóa học Anh 2022 80 Câu 1: Xăng E10 80 Câu 2: Nitrous oxide 85 Câu 3: Cubane................................................................................................88 Câu 4: Xét nghiệm virus corona....................................................................97 Câu 5: Nút thắt Trung Hoa ..........................................................................103 Câu 6: Câu hỏi về phương pháp lưu trữ vaccine........................................111
Olympiad Hóa học Estonia...............................................................................116 Câu 1: Năng lượng mạng tinh thể...............................................................116 Câu 2: Sự chuyển phase của khoáng chất olivine .....................................121 Câu 3: Các hợp chất thú vị của phosphorus ..............................................127 Câu 4: Hydrogen hóa xúc tác 129 Câu 5: Tổng hợp thuốc 135 Câu 6: Phân giải động học các đối quang 137
Olympiad Hóa học Romania 141
Câu 1: Trắc nghiệm 141
Câu 2: Dung dịch. Điện hóa học 146 Câu 3: Azobenzene 151 Câu 4: Hóa Lí................................................................................................156
Olympiad Hóa học Áo.......................................................................................169
Câu 1: Các phân tử chứa liên kết bội..........................................................169
Câu 2: Hóa học hữu cơ ở thời La Mã cổ đại...............................................178
Câu 3: Nhiệt động học của quá trình Solvay ..............................................188
2 | Olympiad Hóa học các quốc gia trên thế giới
Câu 4: Hóa lập thể của lysergic acid 192
Câu 5: Cs và Co 196
Câu 6: Sự tạo thành và phân hủy hydrogen iodide 204
Câu 7: Các cân bằng thủy ngân ..................................................................208
Olympiad Hóa học Czech.................................................................................213
Phần 1: Hóa Vô cơ .......................................................................................213
Câu 1: Spinel ................................................................................................213 Câu 2: Các silicate và aluminosilicate........................................................218 Phần 2: Hóa Hữu cơ ....................................................................................223
Câu 1: Phản ứng olefin hóa Julia 223
Câu 2: Điều chế các hợp chất cơ lưu huỳnh 225
Câu 3: Sản xuất công nghiệp 2-naphthol 228
Phần 3: Hóa Lí 232
Câu 1: Khả năng hòa tan thuốc 232 Câu 2: Phép màu ở đất Marah 237
Câu 3: Sắc kí anion 243
Olympiad Hóa học Slovakia .............................................................................246 Hóa học Vô cơ – Hóa phân tích..................................................................246 Câu 1: Vật liệu sắt từ ...................................................................................246
Hóa Lí ...........................................................................................................253 Câu 1: Các cân bằng phase ........................................................................253 Câu 2: Pin điện.............................................................................................256 Câu 3: Động hóa học 260 Hóa Hữu cơ 263 Câu 1: Thuốc clopidogrel 263 Câu 2: Vòng cỡ trung 267 Câu 3: Xúc tác bất đối 270 Câu 4: Corylon 272 Olympiad Hóa học Serbia 274 Câu 1: Chuẩn độ. Nitro hóa.........................................................................274 Câu 2: Cây cam thảo ...................................................................................278 Câu 3: Ethanol..............................................................................................285 Câu 4: Hợp chất boron ................................................................................289 Câu 5: Các đường biên phase.....................................................................295 Câu 6: Mục tiêu ............................................................................................301 Câu 7: Nhổ cỏ, tiêu diệt mầm bệnh và thưởng hương hoa nhài................305 Câu 8: Penicillin V ........................................................................................315 Olympiad Hóa học Nga ....................................................................................318 Lớp 10 318
Câu 1: Chuyển hóa vô cơ 318 Câu 2: Xác định hợp chất 321 Câu 3: Các hỗn hợp khí 324 Câu 4: Một quy trình mới 329 Câu 5: Nitrogen dioxide 333 Lớp 11 ...............................................................................................................338 Câu 1: Sơ đồ chuyển hóa.............................................................................338 Câu 2: Bảng màu .........................................................................................343
3 | Olympiad Hóa học các quốc gia trên thế giới
Câu 3: Phản ứng ghép cặp chéo 349
Câu 4: Aldehyde dâu tây 354
Câu 5: Các phương pháp hấp thụ carbon dioxide 362
Olympiad Hóa học vùng Baltic.........................................................................367
Câu 1: Tính chất hóa học của nguyên tố X.................................................367
Câu 2: Nhiệt động lực học của quá trình bắt giữ CO2 điện hóa ................374
Câu 3: Dung dịch không lỏng ......................................................................382
Câu 4: Động học ..........................................................................................395
Câu 5: Tổng hợp toàn phần (–)-Colombiasin A .........................................403
Tranh tài Hóa học Cambridge 415
Câu 1: Câu hỏi về giá trị tương đương liên kết đôi 415
Câu 2: Câu hỏi về nhôm, chất ức chế tiết mồ hôi và đá mật ong 425
Olympiad Hóa học các Đại đô thị 436
Câu 1: Bí ẩn về chiếc vòng tay vàng 436 Câu 2: Bắt carbon dioxide – Nhân tạo và tự nhiên 439
Câu 3: Phản ứng đóng vòng Nazarov và ứng dụng trong tổng hợp hữu cơ
......................................................................................................................446
Câu 4: Phổ học và Nghệ thuật ....................................................................451 Câu 5: Pin kim loại .......................................................................................458 Câu 6: Các keto acid bảo vệ quá trình trao đổi chất..................................465
Olympiad Hóa học Hữu cơ Nga .......................................................................470
Câu 1: Trifluoromethylsulfone ....................................................................470 Câu 2: Dị vòng furan 472 Câu 3: Một phương pháp tổng hợp hữu hiệu 474
Câu 4: Tổng hợp một pheromone 476 Câu 5: Chuỗi chuyển hóa 478 Câu 6: Các hydrocarbon thú vị 480 Câu 7: Tổng hợp toàn phần phytotoxin 485 Câu 8: Spiroketone 488 Câu 9: Samarium diiodide ...........................................................................491 Câu 10: Sự sinh động của màu sắc............................................................495 Phần 3..........................................................................................................497
Olympiad
4 | Olympiad Hóa học các quốc gia trên thế giới
Câu 12: Xác định nhanh Vitamin C bằng hệ keo vàng 549
Câu 13: Allene 553
Câu 14: Cyclopropane 563
Câu 15: Xúc tác base Lewis ........................................................................571
Câu 16: Isosorbitol.......................................................................................579
Câu 17: Tổng hợp toàn phần Hopeanol .....................................................582
Câu 18: Tổng hợp toàn phần Lithospermic acid........................................589
Câu 19: Phản ứng của peptide....................................................................595
Câu 20: Tổng hợp toàn phần các hợp chất thiên nhiên có cấu trúc khung Hapalindole 601
Câu 21: Tổng hợp toàn phần Schindilactone A 607
Câu 22: Nhựa tái chế - biến rác thái thành vàng 612
Câu 23: Quá trình đốt khí than ướt 621
Câu 24: Nhiệt động học của phản ứng phân hủy 624
Câu 25: Ngưng tụ hơi 1-butanol 627
Câu 26: Động hóa học 629 Câu 27: Điện hóa..........................................................................................633 Câu 28 Hệ ��-liên hợp...................................................................................636 Olympiad Hóa học Quốc tế ..............................................................................640
Câu 1: Phương pháp xét nghiệm nucleic acid nhanh và trực quan cho COVID-19......................................................................................................640 Câu 2: Chromium trong thời cổ đại và hiện đại .........................................645
Câu 3: Bắt và Chuyển Hóa Carbon Dioxide 651
Câu 4: Hành Trình Mới cho Lưu Huỳnh Cổ Đại 660 Câu 5: Sự chuyển hóa giữa các Nitrogen Oxid 671 Câu 6: Kích hoạt Phosphine 679 Câu 7: Các phân tử hữu cơ trong sự sống 686 Câu 8: Xúc tác Spiro Thủ Tính Thú Vị 691 Câu 9: Tổng hợp Toàn Phần Capitulactone 697 Phần 4
5 | Olympiad Hóa học các quốc gia trên thế giới
6
Câu 4: Các tính toán về động học và năng lượng 749
Câu 5: Ba hợp chất 753
Câu 6: Phức chất 755
Câu 7: Một số vấn đề về nhiệt động học....................................................760
Câu 8: Tổng hợp (–)-Muscone....................................................................763
Câu 9: Nhỏ mà có võ ...................................................................................768
Câu 10: Các hợp chất carbonyl ở dạng chất phản ứng và sản phẩm.......773
Olympiad Hóa học Hà Lan ...............................................................................776
Câu 1: Các alkane nitrile..............................................................................776
Câu 2: Copper(I) oxide 778
Câu 3: Chất mài mòn rắn 781
Câu 4: Tổng hợp haloperidol 786
Olympiad Hóa học Ba Lan 790
Câu 1: Cảm biến sinh học enzyme 790
Câu 2: Hợp chất của boron 794
Câu 3: Sự chọn lọc của phản ứng chuỗi gốc 799 Câu 4: Các enol và enolate trong hóa hữu cơ ............................................804 Câu 5: Các peptide và peptidomimetic ......................................................808 Một số đề thi Olympiad cấp khu vực ở Nga....................................................813
Đề thi số 1 .........................................................................................................813
Câu 1: Thuốc nhuộm ...................................................................................813 Câu 2: Acid và muối tương ứng ..................................................................818 Câu 3: Các hỗn hợp khí 823 Câu 4: Lớp ozone 827 Câu 5: Phản ứng Kolbe-Schmidt 832 Đề thi số 2 835
Câu 1: Nhiệt phân tinh thể 835 Câu 2: Kim loại chưa biết 839 Câu 3: Sơ đồ chuyển hóa các hợp chất hữu cơ 843 Câu 4: Quy tắc Wagner ................................................................................846 Câu 5: Sự phụ thuộc của tốc độ phản ứng hóa học vào nhiệt độ. Mối liên hệ giữa các phương trình Van’t Hoff và Arrhenius. ...................................850 Đề thi số 3 .........................................................................................................854 Câu 1: Các hợp chất rắn ..............................................................................854 Câu 2: Nhận biết hợp chất...........................................................................857 Câu 3: Quy tắc Zaitsev – Khống chế động học hay nhiệt động học? .......861 Câu 4: Hợp chất
| Olympiad Hóa học các quốc gia trên thế giới
Phần 3: Hóa Lí 905
Câu 1: Phản ứng thế nucleophile 905
Câu 2: Xúc tác từ nickel 911
Câu 3: Cesium..............................................................................................916
Phần 2: Hóa Vô cơ .......................................................................................920
Câu 1: Xác định kim loại..............................................................................920
Câu 2: Sơ đồ chuyển hóa.............................................................................926
Câu 3: Phức chất .........................................................................................931
7 | Olympiad Hóa học các quốc gia trên thế giới
Phần 1 Khu vực châu Á
Olympiad Khoa Học Úc
1. Dãy các tiểu phân nào sau đây được sắp xếp theo thứ tự tăng dần bán kính ion?
A. Cs+, Rb+, Na+
B. S2−, Cl , K+ C. O2−, Na+, Ba2+ D. I , Cl , Br
E. Sr2+, Rb+, Br
2. Cặp chất nào dưới đây sẽ tạo kết tủa khi trộn 0.1 mol L 1 dung dịch của chúng với nhau?
A. AgNO3 và Ba(NO3)2
B. K2SO4 and Cu(NO3)2
C. Ca(NO3)2 and KBr D. NaOH and CuCl2
E. CuCl2 and NH4NO3
3. Hydrocarbon C12H24 là thành phần của nhiên liệu diesel, có tỷ trọng 0.790 g mL 1. Hãy cho biết thể tích CO2 được tạo thành (tại 25 oC và 100 kPa) khi đốt hoàn toàn 2.00 L C12H24 trong oxygen dư?
A. 2.79 L B. 3.53 L C. 1400 L D. 2790 L E. 3530 L
4. Hợp chất nào sau đây có dạng hình chóp đáy tam giác?
A. NCl3
B. CH2Cl2 C. COCl2 D. CH4 E. BCl3
9 | Olympiad Hóa học các quốc gia trên thế giới
5. Khi trộn các tác nhân sau lượng cho sẵn như dưới đây, hỗn hợp nào sinh ra nhiều CO2 nhất (về khối lượng)?
A. 0.3 mol CuCO3 và 0.1 mol H2SO4
B. 0.2 mol CuCO3 và 0.3 mol HCl
C. 0.2 mol CuCO3 và 0.2 mol H2SO4
D. 0.3 mol CuCO3 và 0.3 mol HCl
E. 0.1 mol CuCO3 và 0.3 mol H2SO4
F. 0.1 mol CuCO3 và 0.2 mol HCl
6. Các mẫu mô sinh học thường được nhuộm bằng phẩm nhuộm là các muối hữu cơ có màu.
- Phẩm nhuộm có tính kiềm chứa một cation mang màu và một anion không màu.
- Phẩm nhuộm có tính acid chứa một anion mang màu và một cation không màu.
Trong các đáp án dưới đây, đâu là phẩm nhuộm có tính acid? Chọn tất cả đáp án đúng.
A. C21H22N3Cl B. C25H33N2O2Cl C. C16H17N2ClS D. C19H17N2NaO5S E. C33H43N3Na2O8S2
7. Tổng số điện tử hóa trị trong ion PO23−
A. 15 B. 17 C. 20 D. 30 E. 34
10 | Olympiad Hóa học các quốc gia trên thế giới
8. Phân tử nào sau đây có 29.67% khối lượng là lưu huỳnh?
A. SF4
B. SO2Cl2
C. SOCl2
D. SF6
E. S2F10
9. Dãy chất nào sau đây được sắp xếp theo thứ tự tăng dần nhiệt độ sôi?
A. CO2, PCl3, CaO
B. PCl3, CaO, CO2
C. CaO, CO2, PCl3
D. CaO, PCl3, CO2
E. CO2, CaO, PCl3
F. PCl3, CO2, CaO
10. Năng lượng ion thứ nhất tiên được định nghĩa là năng lượng cần dùng để tách một mol điện tử ra khởi một mol ion khí. Dãy nguyên tố nào sau đây được xếp theo thứ tự tăng dần năng lượng ion hóa thứ nhất?
A. C, F, N, Li B. C, N, Li, F C. Li, C, N, F
D. Li, N, F, C E. F, N, C, Li F. F, Li, N, C
11. Có bao nhiêu nguyên tử hiện diện trong 1.0 kg mẫu C2H4O?
A. 1.4 ∙ 1022
B. 9.6 ∙ 1022
C. 1.4 ∙ 1025
D. 9.6 ∙ 1025
E. 9.6 1028
11 | Olympiad Hóa học các quốc gia trên thế giới
12. Acrylonitrile (C3H3N) có thể được tổng hợp ở quy mô công nghiệp dựa trên phương trình phản ứng sau: ++→+ 3632332 2 CH(k)2NH(k)3O(k)2CHN(k)6HO(k) Khi trộn 100 kg C3H6 với 50 kg NH3 và 125 kg O2, hãy cho biết tác chất được được sử dụng với lượng dư? Chọn tất cả câu trả lời đúng. A. C3H6 B. NH3 C. O2 13. Công thức nào sau đây vừa là công thức thực nghiệm vừa là công thức phân tử? A. C3F6 B. C3F8 C. C4F6 D. C4F8 E. C4F10 14. 1.620 g XF6 có thể được tạo ra từ 1.000 g nguyên tố X X có thể là nguyên tố nào trong các đáp án sau đây? A. W B. Se C. Mo D. Rh E. U 15. Trong các nguyên tố sau, đâu là nguyên tố có năng lượng ion hóa thứ ba cao nhất? A. Ar B. Si C. Mg D. Al E. Cl
12 | Olympiad Hóa học các quốc gia trên thế giới
16. Phương pháp phân tích nhiệt trọng lượng liên quan đến việc đo khối lượng mẫu khi gia nhiệt nó. Hợp chất A phân hủy khi gia nhiệt, tạo thành chuỗi các hợp chất B, C và D. Tất cả các chất sản phẩm đều chứa calcium. Tại mỗi giai đoạn, một phân tử nhỏ được loại ra khỏi hệ (kí hiệu lần lượt là phân tử 1, 2 và 3), khiến cho khối lượng của mỗi hợp chất tiếp theo trở nên nhỏ hơn.

Khối lượng của mỗi hợp chất, được biểu diễn dưới dạng phần trăm theo khối lượng ban đầu của A, được ghi lại trong bảng dưới đây. Hợp chất Phần trăm theo khối lượng ban đầu của A còn lại A 100.0 B 87.67 C 68.50 D 38.38
13 | Olympiad Hóa học các quốc gia trên thế giới
Hòa tan 1.946 g oxalic acid dihydrate (H2C2O4·2H2O, phân tử lượng 126.068 g mol 1) vào nước, sau đó định mức dung dịch lên 250.0 mL bằng bình định mức.
(f) Tính nồng độ dung dịch oxalic acid (theo mol L 1). Oxalic acid phản ứng với sodium hydroxide tạo ra sodium oxalate và nước theo phương trình hóa học sau: +→+ 2242242HCO(dd)2 NaOH(dd)NaCO(dd)2 HO(l)
Để phản ứng hoàn toàn (hết) 20.00 mL dung dịch oxalic acid trên cần 18.57 mL dung dịch sodium hydroxide. (g) Tính nồng độ dung dịch sodium hydroxide (theo mol L 1).
Thành phần ion ammonium của một muối có thể được xác định bằng quy trình sau. Cho 1.988 g một mẫu muối ammonium vào bình phản ứng với 50.00 mL dung dịch potassium hydroxide 0.5493 mol L 1 (lượng dư) rồi đun lên. Ion ammonium và hydroxide phản ứng với nhau sinh ra nước và ammonia, bay hơi ra khỏi bình phản ứng: +−+→+ 423 NH(dd)OH(dd)HO(l)NH(k)
Lượng potassium hydroxide còn dư trong bình phản ứng sau khi tất cả ammonia đã bay hơi ra khỏi hệ được xác định bằng hydrochloric acid 0.1032 mol L 1. Để phản ứng hết potassium hydroxide dư cần 23.89 mL hydrochloric acid 0.1032 mol L 1 . (h) Tính lượng (theo mol hoặc mmol) hydrochloric acid đã thêm vào.
(i) Tính lượng (theo mol hoặc mmol) potassium hydroxide đã sử dụng trong mẫu 50.00 mL potassium hydroxide ban đầu.
(j) Tính lượng (theo mol hoặc mmol) ion ammonium trong 1.988 g mẫu muối ammonium.
14 | Olympiad Hóa học các quốc gia trên thế giới
(k) Tính phần trăm khối lượng ion ammonium trong 1.988 g mẫu muối ammonium.
Khi không có dụng cụ thủy tinh để xác định thể tích, ta hoàn toàn có thể chỉ sử dụng các phép đo khối lượng để xác định thành phần của dung dịch.
KHP (KC8H5O4) là một acid thường được sử dụng trong trường hợp này.
(l) Tính phân tử lượng KHP (theo g mol 1).
Hòa tan 20.58 g KHP vào nước tạo thành một dung dịch có khối lượng 118.48 g.
(m) Tính khối lượng nước (theo g) cần phải thêm vào để tạo thành 118.48 g dung dịch.
Pha một dung dịch sodium hydroxide. 4.471 g dung dịch sodium hydroxide này phản ứng hoàn tàn (hết) với 5.979 g dung dịch KHP trên. Sodium hydroxide phản ứng với KHP theo tỷ lệ mol 1:1.
Trong một phản ứng tương tự, 4.359 g dung dịch sodium hydroxide phản ứng hoàn toàn với 5.925 g một mẫu giấm (chứa acetic acid, CH3COOH). Sodium hydroxide phản ứng với acetic acid theo tỷ lệ mol 1:1. (n) Tính khối lượng (theo g) dung dịch KHP cần để phản ứng hoàn toàn với 4.359 g dung dịch sodium hydroxide.
(o) Tính lượng KHP tinh khiết (theo mol hoặc mmol) cần dùng để phản ứng hoàn toàn với 4.359 g dung dịch sodium hydroxide. (p) Tính phần trăm khối lượng acetic acid có trong mẫu giấm. (q) Giả sử tỷ khối của dung dịch sodium hydroxide là 1.045 g mL 1 , hãy tính nồng độ dung dịch sodium hydroxide (theo mol L 1).
15 | Olympiad Hóa học các quốc gia trên thế giới
17. Câu hỏi sau sẽ tìm hiểu vai trò của tính đối xứng trong hóa học, và sự ảnh hưởng của nó đến tính chất vật lý và hóa học của phân tử.
Ta sẽ bắt đầu bằng cách ôn lại nền tảng cấu trúc Lewis.
(a) Vẽ một cấu trúc Lewis đúng của F2.
(b) Vẽ một cấu trúc đúng của H2S.
(c) Vẽ một cấu trúc đúng của HCN.
(d) Vẽ một cấu túc đúng của NO2 + .
16 | Olympiad Hóa học các quốc gia trên thế giới
19 | Olympiad Hóa học các quốc gia trên thế giới




Olympiad Hóa học Ấn Độ
Câu 1: Hành trình đến nhựa epoxy Nhựa epoxy là một hợp chất rất đa dụng, được sử dụng nhiều trong công nghiệp. Nhờ vào tính bám dính mạnh, bền bỉ trong nhiều điều kiện như nhiệt độ cao, độ ẩm cao và trong môi trường có tính ăn mòn. Hình 1. Mô hình một vật liệu nhựa điển hình. Một số vật liệu từ nhựa hiện đang được sử dụng có cấu trúc cấp độ phân tử được biểu diễn như hình 1 bên dưới. Nó (vật liệu nhựa hình 1) có các phân tử với phân tử lượng lớn (đại diện bởi các đường đậm). Các phân tử này có thể là các sản phẩm ngưng tụ dạng monomer, polymer hoặc hỗn hợp của nhiều dạng đến từ hai hay nhiều hợp chất. Các phân tử được giữ lại với nhau bằng các tương tác khâu mạch hay “liên kết chéo” (đường liền màu xanh) và/hoặc các tương tác vật lý như tương tác tĩnh điện, lực van-der Waals (những đường dọc nét đứt). Tùy thuộc vào quá trình nén các phân
| Olympiad Hóa học các quốc gia trên thế giới

tử nhựa mà có thể tồn tại những vùng lỗ trống giữa các phân tử. Hơn thế nữa, có thể có các phân tử hoặc ion phụ gia bị giữ lại trong cấu trúc trong quá trình sản xuất vật liệu. Những đặc tính của vật liệu nhựa phụ thuộc vào bản chất của các tương tác giữa các phân tử nhựa (các liên kết chéo và các tương tác vật lý), và các tương tác giữa chúng và những phân tử bị giữ lại. Đôi khi tương tác xung quanh các phân tử bị giữ lại cũng có thể ảnh hưởng quan trọng đến tính chất của vật liệu.
Một ví dụ thường được biết đến về một loại nhựa epoxy thương mại được cấp vào một ống tiêm/ống chứa một piston và có hai ngăn như hình 2. Khi các chất lỏng có mặt trong ống này được trộn lại, chúng ngưng tụ với nhau để tạo thành nhựa.

Thông thường, một bên ngăn của ống tiêm chứa epichlorohydrin (2 đương lượng mol) và ngăn còn lại chứa bisphenol A (1 đương lượng mol) và NaOH (ít hơn 2 đương lượng mol).

Hình 2. Ống thương mại điển hình của một loại nhựa epoxy.
21 | Olympiad Hóa học các quốc gia trên thế giới
1.1. Epichlorohydrin được tổng hợp thông qua phản ứng của allyl chloride và hypochlorous acid được cho dưới đây. Vẽ cấu trúc của hợp chất M và N trong hướng tổng hợp này.
1.2. Bisphenol A thường được tạo từ phản ứng giữa acetone và hợp chất P với sự có mặt của một acid vô cơ. Phản ứng này tạo ra hỗn hợp sản phẩm gồm 3 đồng phần S, T, U của bisphenol A.
i) Vẽ cấu trúc của hợp chất P và U trong chuỗi phản ứng trên. Trong quy trình này, một trong những đồng phân kết tủa dễ dàng dưới dạng tinh thể, trong khi hai đồng phân còn lại vẫn nằm trong dung dịch và được tách bằng các phương pháp khác. Đồng phân này cũng có nhiệt độ nóng chảy cao nhất, cho thấy có liên kết nội phân tử rất mạnh, và là đồng phân duy nhất không có tính quang hoạt.
ii) Xác định cấu trúc của những đồng phân S, T, U. Trong những câu tiếp theo, khi vẽ polymer, thí sinh phải vẽ tất cả các nhóm ở hai đầu để nhận toàn bộ số điểm. Để đơn giản hóa về kí hiệu, nhóm phenyl có thể được biểu diễn bằng “Ph” và đơn vị lõi bisphenol A nếu không thay đổi trong phản ứng có thể biểu diễn bằng: Khi hai chất lỏng trong hai ống (Hình 2) trộn lẫn với nhau, chúng phản ứng với tốc độ phụ thuốc vào nồng độ của cả epochlorohydrin và bisphenol A nhưng lại không phụ thuộc vào nồng độ NaOH. Với
22 | Olympiad Hóa học các quốc gia trên thế giới
các hệ số tỉ lượng khác nhau của epichlorohydrin và bisphenol A, ta thu được các phân tử khác nhau.
1.3. i) Vẽ cấu trúc của sản phẩm chiếm ưu thế V, thu được khi cho 2 đương lượng epichlorohydrin phản ứng với 1 đương lượng bisphenol A.
ii) Vẽ cấu trúc của W, thu được khi cho bisphenol A phản ứng với ít hơn 2 đương lượng epichlorohydrin. iii) Xác định loại tương tác có thể có giữa hai phân tử W.
a) liên kết ion
b) tương tác van der Waals c) liên kết Hydrogen d) tương tác lưỡng cực – lưỡng cực
iv) Nhằm nghiên cứu cơ chế của phản ứng trong câu 1.3 i) và ii), ta có thể sử dụng phương pháp đánh dấu đồng vị một trong số các nguyên tử carbon, mà ở đó nguyên tử carbon được chọn sẽ được thay thế bằng một nguyên tử 13C (ví dụ 13CH3CH2Cl hoặc CH313CH2Cl đối với chloroethane). Trong phản ứng trên, hãy vẽ cấu trúc của các phân tử được đánh dấu bằng 13C mà có thể thích hợp để nghiên cứu cơ chế phản ứng. Vị trí của carbon đánh đấu trong một phân tử có thể được xác định bằng phổ nghiệm. Những tính chất cơ học của vật liệu nhựa như độ bền kéo phụ thuộc đáng kể vào độ bền liên kết và mật độ của chúng bên trong vật liệu. Tính dẻo phụ thuộc vào sự dễ dàng mà nhựa và các phân tử bị giữ lại có thể trượt qua nhau hoặc thay đổi hình dạng phân tử mà không thay đổi cấu trúc và các liên kết nội phân tử bên trong vật liệu. v) Hãy cho biết sản phẩm phụ tạo ra từ phản ứng trong 1.3 i) và ii) là gì? Nếu không thể tách ra, nó sẽ làm tăng hay làm giảm độ bền kéo của nền nhựa?
| Olympiad Hóa học các quốc gia trên thế giới
Nhựa epoxy đôi khi được cho phản ứng với các tác chất như amine, acid, alcohol, thiol,… để cải biến những tính chất về cấu trúc của nhựa. Ethylene diamine là một trong số các tác chất kể trên.
1.4. Vẽ cấu trúc của những sản phẩm được tạo thành trong các phản ứng được thực hiện trong dung môi phân cực phi proton sau đây.
i) V được cho phản ứng với ethylene diamine dư (nhiều hơn 4 đương lượng) ở độ pha loãng cao (1g trong 1000 mL)
ii) Cho V dư (nhiều hơn 4 đương lượng) phản ứng với ethylene diamine ở độ pha loãng thấp (1g trong 25 mL). Phản ứng cho sản phẩm với cấu trúc hóa học có các nhóm chức mang điện tích.
iii) Với quy trình phản ứng được mô tả trong câu 1.4 ii) tạo ra một nhựa
a) dẻo hơn b) dẫn diện hơn c) có độ bền kéo hơn 1.5. Nhựa epoxy có vai trò là chất kết dính đối với bề mặt nào sau đây
i) Bề mặt được làm từ polyethene, polystyrene. ii) Bề mặt có các nhóm chức thio (-SH). iii) bề mặt cellulose trên gỗ. iv) vải polyester.
24 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn 1.1 1.2 i) ii) T (đồng phân có hai nhóm -OH ở vị trí para của vòng benzene)
25 | Olympiad Hóa học các quốc gia trên thế giới
1.3 i) ii) iii) b, c, d. iv)
26 | Olympiad Hóa học các quốc gia trên thế giới
v) NaCl. Làm tăng độ bền kéo.
1.4 i) ii) iii) c) 1.5. ii, iii, iv.
27 | Olympiad Hóa học các quốc gia trên thế giới
Câu 2: Hợp chất ăn được và chất tạo màu
Việc khảo sát hợp chất Z được tìm thấy trong một vài loài thực vật có thể ăn được trong tự nhiên là một lĩnh vực thú vị đối với các nhà nghiên cứu trong hàng thế kỉ. Nó lần đầu được phân lập từ một loài thực vật vào năm 1815 ở Đức. Một trăm năm sau, hợp chất này đã được tổng hợp lần đầu trong phòng thí nghiệm và được xác định có cấu trúc như sau.
Nhưng các nhà khoa học phải mất thêm một vài thập kỉ nữa để hiểu dạng cấu trúc 3D của nó tồn tại trong dung dịch và chất rắn. Vào năm 1953, nhà khoa học Srinivas tại Chennai đã thử trích lại hợp chất Z từ cùng một nguồn thực vật bằng dung môi benzene. Nhằm kiểm tra hỗn hợp trích được chỉ chứa Z hay chứa đồng thời những hợp chất khác, ông cho hỗn hợp này vào một cột sắc ký. Một cột sắc ký là một ống hình trụ, được nhồi bằng pha tĩnh là chất rắn như bột silica. Hỗn hợp cần tách được cho vào cột từ phía trên theo sau là một dung môi, đóng vai trò là pha động. (Trước khi cho hỗn hợp cần tách vào, cột sắc ký đã được nhồi bột silica và được rót sẵn dung môi vào). Khi pha động chảy xuống qua silica trong ống, nó kéo theo các hợp chất có trong hỗn hợp cần tách theo. Nhờ vào ái lực khác nhau của các hợp chất với pha tĩnh và pha động, chúng được tách ra thành nhiều dải.
28 | Olympiad Hóa học các quốc gia trên thế giới
Hình 1. Sắc ký đồ của hỗn hợp cần tách, dùng dung môi benzene và pha tĩnh là silica.

Khi dùng benzene làm pha động, Srinivas thấy có 6 dải được tách ra như Hình 1, trong đó dải 1, 2 và 4 chiếm phần lớn độ dài cột. Một trong ba dải đó là Z, trong khi hai dải còn lại là của hợp chất Y và X có phân tử lượng lần lượt là 338 và 308. Hai hợp chất này có cùng khung phân tử với Z Khi phản ứng với FeCl3(dd) có tính acid, cả ba hợp chất này đều cho màu đỏ rất đậm, mà theo Srinivas là đậm hơn so với ông dự đoán vốn dĩ được tạo thành bởi các nhóm phenol trong cấu trúc đã cho phía trên. Ông cho rằng sẽ các nhóm chức khác trong phân tử X, Y, và Z cũng đồng thời liên kết với ion Fe3+. Với dự đoán này, có một vài đồng phân hình học phù hợp cho X, Y và Z. Srinivas dự đoán chỉ có một đồng phân được quan sát thực nghiệm chiếm ưu thế đối với mỗi hợp chất X, Y và Z (đồng phân này cũng được bền hóa bởi một số tương tác nội phân tử). Tất cả dự đoán của ông đã được chứng minh chính xác bằng những thí nghiệm sau này.
2.1. Từ những suy luận của Srinivas, vẽ đồng phân bền nhất của X, Y và Z. Tại mỗi cấu trúc, chỉ ra tất cả tương tác nội phân tử nếu có.
2.2. Xác định dải nào của 1, 2 và 4 là X, Y và Z.
2.3. Độ tan của Z trong dung dịch (dung môi nước) tăng khi pH tăng, kèm theo đó là sự thay đổi màu sắc của dung dịch. Vẽ dạng cấu trúc của Z tồn tại trong dung dịch kiềm mạnh (pH ~ 14).
Trong câu này, nếu cấu trúc cần tìm là các hợp chất ion, cần phải vẽ cả tất cả ion.
Mãi cho đến thế kỉ 20, boron không hề được biết là một phần của các mô thực vật vì các phương pháp phân tích hiện thời để xác định nó dưới mức miligram vẫn chưa được phát triển. Vào đầu thế kỉ 20, phản ứng của boric acid với Z tạo ra các hợp chất có màu đã mở đường cho việc phân tích chi tiết boron trong các mẫu thực vật.
Một trong những thử thách khi sử dụng phản ứng giữa boric acid và Z để phân tích định lượng là rút ngắn thời gian cần để phản ứng
29 | Olympiad Hóa học các quốc gia trên thế giới
hoàn tất. Một số thí nghiệm cho thấy khi thêm oxalic acid vào từ lúc bắt đầu phản ứng của hỗn hợp boric acid và Z giúp quá trình lên màu diễn ra trong nhanh hơn (chưa đầy một giờ). Những nghiên cứu về cơ chế đã chỉ ra boric acid đã phản ứng với oxalic acid đủ để tạo ra hợp chất P, có pKa cao hơn oxalic acid. P phản ứng với Z cho ra màu sắc rõ rệt do tạo thành Q trong dung dịch kể cả khi nồng độ boron thấp đến mức ~1 µM. 2.4. Vẽ cấu trúc của P và Q. Dù Z được tổng hợp trong phòng thí nghiệm vào những năm 1910, nhưng hiệu suất của quá trình khá thấp do tạo thành nhiều sản phẩm phụ. Một phương pháp tổng hợp hiệu quả và cải tiến hơn đã được phát triển vào năm 1960 bởi Pabon và nhóm của ông tại Hà Lan. Trong phương pháp này, 0.2 mol acetylacetone (petan-2,4dione) được khuấy với 10 g (dư) boric anhydride (B2O3). Một lớp bột dày được tạo thành chứa hợp chất ion R. Chất này sau đó được trộn với butylamine để phản ứng với hợp chất S (được sử dụng làm gia vị thực phẩm) với sự có mặt của N,N-dimethylformamide (dung môi phân cực, phi proton) và trimethyl borate (tác nhân dehyrate) để tạo ra một hợp chất ion T khác, có phân tử lượng lớn hơn Q. Thủy giải môi trường acid hợp chất T bằng HCl loãng cho hợp “Z” và một acid vô cơ.
2.5. Vẽ cấu trúc của R, S và T.
2.6. Cho biết các sản phẩm phụ khác thu được từ phản ứng này là gì?
Boric anhydride được thêm vào để ngăn chặn sự hình thành của một số hợp chất không mong muốn.
2.7. Vẽ cấu trúc của hai sản phẩm phụ sẽ tạo thành nếu không thêm boric anhydride vào phản ứng trên (được quan sát trong quy trình tổng hợp vào những năm 1910).
30 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn 2.1 2.2. 1 – Z 2 – Y 4 – X 2.3. Z tại pH 14
31 | Olympiad Hóa học các quốc gia trên thế giới
2.4. 2.5. Với A là OH , BO2
2.6. Methanol, boric acid, butyl ammonium borate
32 | Olympiad Hóa học các quốc gia trên thế giới
33 | Olympiad Hóa học các quốc gia trên thế giới
Câu 3: Sản sinh oxygen hóa học và an toàn oxygen
Tạo ra khí O2 từ nguyên liệu thông qua phản ứng hóa học được gọi là sự sản sinh oxygen hóa học. Những nguyên liệu của quá trình này được gọi là chất sản sinh oxygen hóa học (COG), là một nguồn lưu trữ O2 hữu ích và có thể vận chuyển đi khắp nơi, khắc phục được vấn đề nguy hiểm khi vận chuyển những thùng trữ khí oxygen nén. Câu hỏi trong bài này sẽ về các COG như chlorate, peroxide và superoxide, được sử dụng để lấy O2 dùng cho hô hấp hay những nhu cầu riêng biệt. Nến oxygen Nến oxygen chứa các muối chlorate được sử dụng để tạo ra khí oxygen trong trường hợp khẩn cấp trên máy bay, trạm không gian, … Một cây nến oxygen thường chứa NaClO3, BaO2 và bột sắt. Sự cháy dẫn đến quá trình oxid hóa bột sắt, từ đó tạo ra nhiệt. Ở nhiệt độ cao (~500oC), NaClO3 tự phân hủy sinh ra oxygen có thể dùng để thở.
Trong máy bay, có những chỉ dẫn kéo mặt nạ oxygen xuống trước khi đeo nó trong trường hợp cấp bách. Hành động kéo này sẽ mở chốt kích lửa và tạo ra sự cháy. Khi phản ứng bắt đầu, nó tiếp tục tỏa nhiệt. 3.1. Phản ứng sinh ra oxgyen dùng để thở phải đồng thời tạo ra các sản phẩm phụ không độc hại. Xác định (các) sản phẩm còn thiếu trong phương trình sau đây và cân bằng phương trình. →+ 32 NaClO...........O
Thông thường, phản ứng phân hủy chlorate sẽ đi chung với một phản ứng phụ, tạo ra khí độc A. Việc tách A khỏi hỗn hợp khí là bắt buộc. Một trong những vai trò của BaO2 trong nến oxygen là để loại khí A. Phản ứng thành công giữa BaO2 và A tạo thành muối barium B, và một khí C khác.
34 | Olympiad Hóa học các quốc gia trên thế giới
3.2. Xác định A, B và C và cân bằng phương trình hóa học dưới đây. +→+ 2BaO ABC
Superoxide
Superoxide kim loại (chứa ion O2 ) thường được sử dụng làm COG hiệu quả trong công nghiệp khai mỏ. Dung dịch màu vàng của superoxide kim loại D, sinh ra khí oxygen (33.8% về khối lượng) và hợp chất E, được cho trong sơ đồ bên dưới. Thú vị thay, CO2 được thở ra trong lúc hít thở có thể phản ứng với E để tạo ra F, từ đó không gây cản trở quá trình sản sinh O2. 3.3. Xác định D, E và F. ⎯⎯⎯⎯⎯→+⎯⎯⎯→ 2trongCO dung dich 2O DEF
Peroxide
H2O2 là một COG rất tốt, tuy nhiên khả năng lưu trữ và vận chuẩn của nó lại khá khó khăn do bản chất không bền của chất này. Một sản phẩm cộng dạng rắn của H2O2 với sodium carbonate là sodium percarbonate có công thức là xNa2CO3 •yH2O2 (x và y ứng với các hệ số tỉ lượng), giải phóng H2O2 khi gặp nước. ⎯⎯→+ 2 HO 23222322 xNaCOyHOxNaCOyHO Ô mạng cơ sở của cấu trúc tinh thể sản phẩm cộng này được cho ở trang bên. Trong sự sắp xếp của ô mạng này, mỗi oxgyen carbonate tạo một liên kết hydrogen với một nhóm OH của peroxide cạnh đó. (Lưu ý: hai phân tử CO32― chồng lên nhau được quay ngược lại đối với nhau, từ đó hình ảnh 2 chiều tạo ra một góc nhìn không chính xác về một hợp chất có dạng lục giác.)
3.4. Tìm giá trị của x và y. Đưa ra các phép tính/bước đi đến kết quả này. Một nguyên liệu peroxide rắn khác là G•H2O2. Khi tiếp xúc với nước, hợp chất này tạo ra O2 chiếm 17% về khối lượng của nó.
35 | Olympiad Hóa học các quốc gia trên thế giới
3.5. Tìm phân tử lượng của G. Đưa ra các bước tính toán.
Trong phòng thí nghiệm nghiên cứu của một công ty mỹ phẩm, một thực tập sinh mới vào được hướng dẫn điều chế sản phẩm cộng này. Khi anh (thực tập sinh) mang chất rắn màu trắng G về bàn làm việc, chất này vô tình bị đổ vào một dung dịch sodium hydroxide nóng. Ngay lập tức, những bóng khí bắt đầu bay lên từ dung dịch. Khi dùng giấy quỳ tím để tiếp xúc với bóng khí đang bốc lên thì giấy quỳ tím chuyển sang màu xanh. Để xác nhận đó là khí gì, anh (thực tập sinh) lấy một muối màu xanh da trời, H, và hòa tan nó vào nước. Khi giữ giấy lọc ướt thấm chứa dung dịch màu xanh da trời này phía trên các bóng khí, giấy lọc chuyển sang màu xanh lam đậm. 3.6. Xác định hợp chất G và H. Viết các phương trình hóa học cho những phản ứng đổi màu xảy ra trên giấy lọc.
Rủi ro khi sử dụng O2 Bản chất khí oxygen không dễ cháy nhưng nó hỗ trợ cho sự cháy. Alcohol là hợp chất dễ bay hơi và dễ cháy trong không khí – có mặt
| Olympiad Hóa học các quốc gia trên thế giới

21% (về thể tích) khí O2, hợp chất này có thể bắt lửa ở nhiệt độ phòng nếu có tia lửa, lửa hoặc nguồn nhiệt ở gần đó. Tại nồng độ O2 cao hơn, hợp chất có thể bắt lửa thậm chí ở nhiệt độ thấp hơn. Vì thế, trong những không gian (đặc biệt là phòng kín) có nồng độ oxy cao hơn (~23%), những rủi ro cháy nổ sẽ cao hơn rất nhiều. Phòng Chăm Sóc Đặc Biệt (ICU) ở các bệnh viện là nơi những rủi ro trên cần được để tâm cẩn thận. Giả sử một phòng ICU có kích thước 12 m x 7 m x 2.6 m với 12 giường bệnh. Trong một ngày, phòng ICU có 11 bệnh nhân cần được hỗ trợ máy thở. Không may thay, không ai nhận ra hệ thống rút khí của ICU đã bị hỏng; do đó không khí trong phòng được thay trong chu kỳ tận 6 giờ (thay vì mỗi 30 phút). Lỗ rò từ các ống máy thở đã làm tăng nồng độ oxygen trong không khí căn phòng lên 23.4% (phần mol).
Thêm vào đó, một loại nước rửa tay chứa 70% w/v ethanol đang được sử dụng trong phòng ICU này. Mỗi ngày, thường có khoảng 60 mL nước rửa tay được sử dụng với mỗi bệnh nhân, và 200 mL nước rửa tay được sử dụng bốn lần để sát khuẩn sàn nhà sau khi lau dọn, tất cả lượng trên sau cùng đều bay hơi và là một phần trong không khí của phòng. Giả sử không khí trong phòng ICU:
i) tất cả các khí đều là khí lý tưởng.
ii) tỉ khối = 1225 g m―3, nhiệt dung riêng ~ 1.01 J g―1 K―1
iii) nhiệt độ trung bình = 298 K.
iv) nhiệt dung riêng trên đơn vị khối lượng của các khí trong bài được xem như bằng của không khí. 3.7. Nếu hơi ethanol trong phòng tại bất kì thời điểm nào xảy ra sự cháy tức thời, hãy xác định nhiệt độ tối đa không khí trong phòng có thể lên đến. [Gợi ý: Nồng độ ethanol trong phòng tại mọi thời điểm sẽ ở khoảng 6/24 tổng ethanol bay hơi trong phòng trong cả ngày.]
37 | Olympiad Hóa học các quốc gia trên thế giới
Tuy nhiên, ở nồng độ hơi ethanol trong không khí thấp, nó sẽ không bắt lửa. Tại nhiệt độ 25oC, giới hạn dễ cháy dưới (LFL) của ethanol là 3.0%. [LFL: nồng độ tối thiểu về thể tích (v/v) mà tại đó hơi có thể bắt lửa trong không khí].
Không may, 500 mL nước rửa tay từ bình vô tình bị đổ xuống sàn. Trong suốt quá trình bay hơi, áp suất riêng phần của ethanol gần bề mặt chất lỏng sấp xỉ áp suất hơi cân bằng của nó và giảm dần khi khoảng cách tới bề mặt tăng lên (như hình bên dưới). Trong vòng 15 phút, hơi lan ra, và tạo thành một vùng có thể tích 1.5 m3 chứa lượng ethanol với nồng độ vượt trên mức LFL của nó.
3.8. Xác định phần mol trung bình của oxygen trong vùng 1.5 m3 , giả sử: i) nồng độ hơi ethanol trong vùng này là giá trị trung bình của giá trị cực đại và cực tiểu trong vùng; và ii) áp suất trung bình trong vùng không gian này vẫn giữ nguyên 1 atm, và các khí khác trong không khí (oxygen, nitrogen) là một hỗn hợp đồng thể sẽ bị khuếch tán đồng nhất ra khỏi vùng này khi ethanol tiếp tục được thêm vào. Nếu trong vùng này có bất kì tia lửa điện nào từ các thiết bị điện tử, ethanol có thể bắt lửa và cháy trong một phần giây.

3.9. Giả sử vùng này là một hệ kín đoạn nhiệt, giãn nở hai lần về thể tích sau khi cháy 0.5 giây. Hãy tính các đại lượng sau đây tại thời điểm 0.5 giây. [Lưu ý rằng áp suất tăng vì nhiệt tỏa ra cũng như các phân tử trong hệ tăng.] i) nhiệt độ trung bình của hỗn hợp khí
38 | Olympiad Hóa học các quốc gia trên thế giới
ii) phần mol trung bình của oxygen còn lại trong vùng này (để hỗ trợ sự cháy của các vật liệu khác và duy trì ngọn lửa)
3.10 Nếu tăng lượng oxygen trong phòng thì sẽ tăng nguy cơ cháy bởi vì (Đưa ra nhận định Đúng/Sai)
i) làm tăng tốc độ phản ứng đốt cháy.
ii) làm tăng nhiệt độ tối đa của không khí (vì làm mát do khuếch tán hoặc sự tuần hoàn khí chậm hơn).
iii) làm tăng nhiệt tỏa ra trên mỗi đơn vị khối lượng của ethanol.
iv) làm tăng áp suất tối đa trong hỗn hợp không khí trong quá trình đốt cháy (khiến nó dễ nổ hơn).
v) cho sự cháy kéo dài hơn vì vẫn còn nguyên liệu.
3.11 Sự tuần hòa khí tốt hơn trong phòng kín giúp giảm các mối nguy cháy nổ bằng việc tránh (chọn các đáp án đúng).
i) sự tích tụ hơi chất cháy nổ trong không gian.
ii) để mức oxygen giảm xuống dưới một mức nhất định.
iii) để mức oxygen tăng lên một mức nhất định.
iv) để nhiệt độ tăng nhanh trong bất kì không gian nhỏ nào.
39 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
3.1. →+ 33 2NaClO2NaCl3O
3.2. +→+ 2222 BaOClBaClO ABC Hoặc +→+ 222 BaO2OClBaCl2O A B C
3.3. D – KO2 E – KOH F – K2CO3
3.4. x = 2 y = 3
3.5. 1 mol peroxide tạo ra 0.5 mol oxygen Khối lượng mol của G là 60.1 g mol―1
3.6. G : Urea H : Copper sulfate ++
CO(NH)NHHCNO Cu4NH[Cu(NH)]
→+ +→ 223 22 334
3.7. Lượng hơi ethanol trong cả phòng là 255.5 g Nhiệt độ tăng lên 28.1 K
3.8. Phần mol trong bình của ethanol trong không khí = 0.043 Độ giảm phần mol oxygen = 0.009
Do đó, phần mol trung bình của oxygen = 0.201
3.9. i) Số mol của ethanol trong 1.5 m3 không khí = 2.64 mol Khối lượng không khí tham gia phản ứng đốt cháy = 1884 g
40 | Olympiad Hóa học các quốc gia trên thế giới
Độ tăng số mol các khí trong phản ứng đốt cháy = 1 mol trên mỗi mol ethanol.
Độ tăng nhiệt độ trước khi giãn nở = 1902 K
Nhiệt độ sau giãn nở = 1349 oC
ii) Số mol oxygen ban đâu = 12.3 mol
Số mol oxygen phản ứng = 7.92 mol
Phần mol trung bình của oxygen còn lại = 4.38/64.14 = 6.82%
3.10. i, ii, iv, v 3.11. i, iii, iv
41 | Olympiad Hóa học các quốc gia trên thế giới
Câu 4: Polyoxometallate
Một trong những khía cạnh thú vị của hóa học là các phản ứng giữa hợp chất không màu lại tạo ra hợp chất có màu. Một phản ứng như kể trên xảy ra khi trộn những hợp chất không màu là muối phosphate, muối molybdate, acid vô cơ và tác nhân khử (như ascorbic acid) ở tỉ lệ phù hợp. Hỗn hợp này tạo ra một hợp chất màu xanh dương đậm hay còn được gọi là màu xanh molybdenum (MB). Phản ứng này được biết đến từ thế kỉ 18 và được sử dụng để đánh giá phosphate có trong các mẫu nước. Tuy nhiên, hiểu biết ở mức độ phân tử của nó chỉ mới được mở rộng trong thế kỉ này.
Câu hỏi của bài này sẽ khám phá hai khía cạnh của phản ứng MB: cấu trúc hóa học của hợp chất có màu, và các phản ứng có thể can thiệp vào phản ứng này trong mẫu nước tự nhiên. Phần A – Cấu trúc Hợp chất có màu trong phản ứng MB phía trên là một nhóm (cluster) polymer duy nhất của molybdenum oxide, với những tính chất được khám phá sau đây. Oxide của kim loại chuyển tiếp nhóm VI ở trạng thái oxid hóa cao nhất (thường có công thức MO3, với M là Cr/Mo/W) có tính adic, và hòa tan được trong dung dịch kiềm mạnh để tạo thành ion [MO4]2― .
4.1. Ion [MO4]2― của Mo và W lại không dễ dàng bị khử nhưng hợp chất của Cr lại khá dễ dàng. (Các) lý do cho điều này là (Chọn (các) đáp án đúng)
i) Do độ âm điện cao hơn, oxygen có thể oxid hóa kim loại đến trạng thái oxid hóa cao nhất.
ii) Do trạng thái oxid hóa cao hơn của các nguyên tố phía dưới trong nhóm trong khu vực kim loại chuyển tiếp thì bền hơn.
iii) Do Mo và W có hiệu ứng co lanthanide.
42 | Olympiad Hóa học các quốc gia trên thế giới
iv) Do ảnh hưởng của điện tích hạt nhân trên orbital d giảm dần từ trên xuống (trong nhóm), khiến chúng dễ dàng hình thành liên kết hơn. Trong điều diện acid, ion [MO4]2― bị proton hóa, phụ thuộc vào pH mà sau đó chúng có thể polymer hóa hoặc kết tủa trở lại thành MO3. Các ion CrO42― hiếm khi polymer hóa xa hơn dạng dichromate. Tuy nhiên, sự proton hóa [MO4]2― tạo ra sự mở rộng của khối cầu phối trí thành dạng bát diện như [MoO3(OH2)3] thường polymer hóa để tạo thành các nhóm (cluster).

Hai ô mạng bát diện có thể kết hợp lại theo ba cách khác nhau được cho sau đây, với O ở mỗi đỉnh và ion kim loại ở trung tâm của mỗi bát diện.
4.2. Giả sử độ dài liên kết kim loại – oxgyen là bằng nhau đối với toàn bộ ba khối đa bát diện trên, hãy chọn mệnh đề đúng trong các mệnh đề sau đây.
i) Điện tích âm hiệu dụng xung quanh mỗi ion molybdenum trên cạnh chung của khối đa bát diện sẽ bé hơn so với ở vị trí góc chung của khối đa bát diện.
ii) Khoảng cách giữa hai ion molybdenum ở cạnh chung của khối đa bát diện sẽ ngắn hơn so với ở vị trí góc chung của khối đa bát diện.
43 | Olympiad Hóa học các quốc gia trên thế giới
iii) Các nguyên tử O tại vị trí đỉnh (*) trong mặt chung của khối đa bát diện đang ở vị trí xa nhất giữa chúng, điều này giúp cấu trúc trở nên bền nhất. iv) Góc chung của khối đa bát diện sẽ giúp cấu trúc bền hơn so với cạnh chung.
Trong điều kiện hơi acid (pH = 5 – 6), các ion molybdate dễ dàng ngưng tụ lại để tạo thành heptamolybdate chứa bảy ô mạng bát diện, với mỗi bát diện có ba cạnh chung với ô mạng kề cận. 4.3. Viết và cân bằng phương trình hóa học của chuyển hóa sau. −++→+ 2 4 7MoO...H....................
Khi có mặt PO43― (và trong môi trường acid), molybdate có thể tạo thành các cụm (cluster) có công thức tổng quát là [PMoqOr]n―. Cấu trúc đầu tiên của cụm (cluster) như vậy (Z, cho trong hình 1) được tìm ra bởi James Keggin thông qua phương pháp tinh thể học tia X, và vì thế chúng được gọi là cấu trúc Keggin.
4.4. Hãy cùng thử dựng cấu trúc Keggin Z ([PMoqOr]n―) từng bước từ việc dựng các ô mạng phụ của nó (có diện tích chưa được biết trước) trong các câu hỏi sau đây.
i) Xét ba bát diện ngưng tụ để tạo thành một khối đa bát diện [Mo3Ox], với mỗi ô mạng MoO6 có một cạnh chung với hai ô mạng khác. Tìm x trong công thức đã cho.
ii) Xét bốn khối đa bát diện [Mo3Ox] kết hợp với nhau thông qua các nguyên tử oxygen nằm ở góc chung tạo thành một khối đa bát diện ngưng tự mới [Mo12Oy]. Tìm y trong công thức này.
Trong cấu trúc Z (cho bên dưới), khung [Mo12Oy] đã được tạo thành xung quanh một ô mạng phosphate, với P liên kết với bốn nguyên tử O, mỗi nguyên tử này nằm trong ô mạng phụ [Mo3Ox].
44 | Olympiad Hóa học các quốc gia trên thế giới
Hình 1: Cấu trúc Keggin của Z theo mô hình: a) bát diện; b) bóng-và-que.
Z chứa bốn loại nguyên tử oxygen như sau:
▪
Oa – là oxgyen nằm ở cạnh chung của hai bát diện MoO6 (bắt cầu với Mo lân cận trong các ô mạng [Mo3Ox])
▪
Ob – là oxgyen nằm ở góc chung của hai bát diện MoO6 (của các ô mạng [Mo3Ox] khác nhau)
▪ Op – là oxygen dùng chung của ô mạng bát diện MoO6 và PO4
▪ Ot – là oxygen nằm ở ngoài cùng (không dùng chung với các bát diện khác)

iii) Hãy xác định số nguyên tử Oa, Ob, Op trong cấu trúc trên.
4.5. Hợp chất Z cho ở trên có màu vàng rơm (màu của mọi Mo nằm ở trạng thái oxid hóa +6). Hoàn thành phương trình phản ứng hóa sau dẫn đến sự tạo thành Z.
Thêm một tác nhân khử vào hỗn hợp phản ứng trong câu 4.5 dẫn đến quá trình khử 4e của hợp chất Z, tạo thành một hợp chất màu xanh dương đậm, Zred. Quá trình khử diễn ra dễ dàng bởi sau khi đã proton hóa một vài nguyên tử oxygen trên Z. Các điện tử liên quan đến quá trình khử không được thêm vào bất kì nguyên tử Mo cụ thể nào mà bất định xứ trên nhiều nguyên tử Mo. Màu của Zred bắt nguồn
45 | Olympiad Hóa học các quốc gia trên thế giới
từ sự chuyển dịch điện tử giữa một ion Mo (V) và ion Mo (VI) kề cận nó và không phải do bước chuyển d-d trong Mo. 4.6. Trong số 4 loại oxygen, sự proton hóa một loại trong đó được ưu tiên, điều này cũng cho phép quá trình chuyển dịch diện tử nhanh xảy ra giữa các ion Mo lân cận; do đó dễ dàng thúc đẩy quá trình khử hợp chất Z. Loại oxygen này là (chọn đáp án đúng)
i) Oa ii) Ob iii)Ot iv) Op
Phần B – xác định phosphate
Lượng phosphate thông thường trong nước bị ô nhiêm là khoảng 0.1 – 1 mM. Trong xét nghiệm MB, mẫu nước được trộn với các tác nhân (Na2MoO4, acid và chất khử) và cường độ màu của hợp chất màu xanh Zred tạo thành được đem đi đo (tỉ lệ với lượng phosphate có mặt trong mẫu). 4.7. Để xác định hàm lượng phosphate trong 100 mL mẫu nước ô nhiễm, ta nên thêm vào bao nhiêu mL Na2MoO4 10 mM?
i) 10 mL ii) 100 mL iii) 200 mL iv) 25 mL v) 75 mL Các mẫu nước tự nhiên thường có một số hợp chất như silicate, fluoride và các acid hữu cơ như oxalic acid, những chất này có thể phản ứng với một số tác nhân sử dụng trong xét nghiệm MB, và do đó ảnh hưởng đến việc xác đinh hàm lượng phosphate bằng nhiều cách. Silicate (Si(OH)4) có mặt trong nước có thể phản ứng với molybdate ở môi trường trung tính hoặc kiềm để tạo ra ion có màu Keggin R (tương tự như Z). Do đó, silicate có thể gây sai số trong quy trình
46 | Olympiad Hóa học các quốc gia trên thế giới
xác định phosphate nếu muối molybdate được thêm vào trước khi thêm acid.
4.8. Viết và cân bằng phương trình hóa học của phản ứng tạo thành R từ silicate trong điều kiện trên. Flouride (F ) sẽ phản ứng với silicate trong điều kiện acid nếu có mặt trong mẫu.
4.9. Viết và cân bằng (các) phương trình hóa học có thể xảy ra giữa silicate và fluoride trong mẫu nước khi sau khi thêm acid vào.
Tuy nhiên, bản thân F cũng ảnh hưởng đến xét nghiệm MB bởi nó sẽ gắn vào Mo(VI) (liên kết phối trí). H3BO3 là tác nhân hiệu quả dùng để loại ảnh hưởng của F đến kết quả xét nghiệm MB.
4.10. Viết và cân bằng phương trình phản ứng giữa F và H3BO3 trong điều kiện acid.
Oxalic acid ảnh hưởng đến quy trình xác định phosphate do phản ứng của nó và molybdate. Tuy nhiên formic acid thì không gây ra điều này.
4.11. Vẽ cấu trúc của các hợp chất tạo thành từ phản ứng giữa oxalic acid và molybdate.
4.12. Dùng dư Na2MoO4 trong xét nghiệm MB ở môi trường acid có thể giảm thiểu sai số bởi (chọn các đáp án đúng)
i) silicate ii) fluoride iii) oxalate
47 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn 4.1. ii, iv 4.2. i, ii, iv 4.3. −+− +→+26 47242 7[MoO]8H[MoO]4HO 4.4. i) x = 13 ii) y = 40 iii) Oa, = 12 Ob = 12 Op = 4 4.5. −−+ ++→+32 44331042 PO12[MoO]27HH[P(MoO)]12HO 4.6. ii 4.7. iii 4.8. ++→+ 24 4412402 Si(OH)12MoO2OH[Si(MoO)]12HO R 4.9. +→+ +→+ 242 2262
SiO4HFSiFHO SiO6HFH[SiF]2HO 4.10. +→+ 3342 HBO4HFHBF3HO 4.11. Hoặc [Mo(C2O4)2(H2O)2]2+ hoặc [Mo(C2O4)(H2O)4]4+ 4.12. ii, iii
48 | Olympiad Hóa học các quốc gia trên thế giới
Olympiad Hóa học Trung Quốc
Câu 1: Viết phương trình phản ứng
Viết phương trình các phản ứng diễn ra theo các điều kiện được cho dưới đây (cân bằng phương trình với các hệ số nguyên tối giản):
1. Gallium arsenide là vật liệu bán dẫn quan trọng, có thể được điều chế bằng kĩ thuật làm bay hơi bốc nhiệt. Trong quá trình điều chế, Ga và AsCl3 được sử dụng làm nguyên liệu phản ứng trong khí quyển hydrogen.
2. Dichlorodimethylsilane bị thủy phân tạo thành polymer mạch không phân nhánh.
3. Các nghiên cứu chỉ ra rằng ion Fe3+ đóng vai trò quan trọng trong quá trình hòa tan nhiều khoáng sulfide khác nhau trong môi trường acid. Hai ví dụ được dẫn ra dưới đây.
a) Fe3+ oxid hóa lưu huỳnh trong quặng acanthite (Ag2S) tạo thành lưu huỳnh đơn chất và chuyển các ion bạc vào dung dịch.
b) Fe3+ oxid hóa trực tiếp pyrrhotite (Fe7S8) thành ion sulfate.
4. “Mài bóng” [“thụ động hóa”] là một phương pháp xử lí bề mặt thép: nhúng các phần thép sạch vào dung dịch NaOH và NaNO2 với nồng độ nhất định (có thể thêm các chất phụ gia, nếu cần), rồi đun nóng ở nhiệt độ phù hợp và giữ trong một khoảng thời gian. Bề mặt của các phần thép tạo thành một lớp màng Fe3O4 đồng nhất, bền và có khả năng chống oxid hóa, thể hiện qua ánh nâu đen hoặc xanh thẫm. Quá trình xử lí giải phóng chất khí không màu có mùi khó chịu.
49 |
Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
1. 2Ga + 2AsCl3 + 3H2 → 2GaAs + 6HCl 2. nSi(CH3)2Cl2 + (n+1)H2O → [-SiO(CH3)2-]n + 2nHCl
3. a) 2Fe3+ + Ag2S → 2Fe2+ + S + 2Ag+ b) 62Fe3+ + Fe7S8 + 32H2O → 69Fe2+ + 8SO42- + 64H+ 4. 9Fe + 8H2O + 4NaNO2 → 3Fe3O4 + 8NH3 + 4NaOH
50 | Olympiad Hóa học các quốc gia trên thế giới
Câu 2: Các dạng thù hình của oxygen Các dạng thù hình phổ biến của oxygen là O2 và O3 Oxygen có thể tham gia vào sự tạo thành các oxide, peroxide, superoxide, ozonide, … 1. Sự tạo thành và phân hủy potassium ozone. Cho các phản ứng sau và biến thiên enthalpy mol chuẩn tương ứng: ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( )
1 Ks OgKOs H 285kJ·mol 2 KOs OgKOs Og H 119kJ·mol 3 Og2Og H 498kJ·mol 4 ( ) ( ) ( ) →+=−o1 32242KOs2KOs Og H 46kJ·mol a) Tính biến thiên enthalpy mol chuẩn o 5H của phản ứng: ( ) ( ) ( ) ( ) +→33 5 Ks OgKOs b) Tính biến thiên enthalpy mol chuẩn o 6H của phản ứng: ( ) ( ) ( ) ( ) →+32 6 OgOg Og 2. Dưới điều kiện cao áp (~ 50 GPa), diễn ra chuyển hóa: ( ) ( ) ( ) +→23 CaOs OsCaOs calcium trong CaO3 vẫn giữ số oxid hóa +2. a) Chỉ ra động lực chính [chọn 1 phương án] của phản ứng trên: ▪ CaO3 có năng lượng mạng lưới lớn hơn của CaO. ▪ Hiệu ứng tỏa nhiệt của phản ứng lớn.
+→=− +→+=− →=
o1 221 o1 23322 o1 23
Entropy của phản ứng tăng. ▪ Thể tích giảm trong quá trình phản ứng.
b) Biểu diễn cấu tạo Lewis của anion trong CaO3.
51 | Olympiad Hóa học các quốc gia trên thế giới
c) Trong CaO3, Ca2+ nằm ở các hốc tứ diện tạo thành bởi các nguyên tử oxygen, hãy chỉ ra sự phối trí của nguyên tử oxygen đầu mạch trong anion.
52 | Olympiad Hóa học các quốc gia trên thế giới

Câu 3: Hợp chất boron
B(OH)3 là hợp chất vô cơ rất quan trọng. Trong quá trình thử tổng hợp thioboronic acid, đã nhận được một hợp chất với công thức đơn giản nhất là HBS2. Các nghiên cứu cấu trúc chỉ ra rằng kiểu hợp chất này chủ yếu tồn tại ở dạng dimer (HBS2)2 (A) hoặc trimer (HBS2)3 (B), trong đó tất cả các nguyên tử boron đều có số phối trí 3.
1. Hãy biểu diễn cấu trúc của A và B
2. A và BCl3 phản ứng theo tỉ lệ hệ số hợp thức 1:1, tạo thành H2S với cùng hệ số hợp thức và sản phẩm C (phản ứng 1). C bị phân hủy tạo thành D và BCl3 (phản ứng 2) khi đun nóng. Ở điều kiện nhiệt độ thấp, D có thể tồn tại ở dạng đơn phân tử và cấu trúc chỉ có một trục quay bậc hai và hai mặt phẳng gương đi qua trục bậc hai.
a) Viết phương trình các phản ứng tạo thành (phản ứng 1) và phân hủy (phản ứng 2) của C
b) C dễ bị thủy phân. Viết phương trình phản ứng thủy phân chất này.
c) Vẽ cấu tạo của C và D
3. D phản ứng với đơn chất lưu huỳnh ở 300 oC tạo thành chất rắn màu trắng E, phân tử này có cấu trúc vòng lớn, phẳng, tương tự như khung porphine (xem hình bên, mỗi hình tròn đại diện cho một nguyên tử).
a) Biểu diễn công thức phân tử của E, chỉ rõ số oxid hóa của nguyên tử các nguyên tố thành phần.
b) Biểu diễn cấu tạo Lewis của E.
c) Sử dụng quy tắc Hückel để dự đoán liệu cấu tạo này có thể hiện tính thơm không?
54 | Olympiad Hóa học các quốc gia trên thế giới
Câu 4: Băng khô
1. Trong những điều kiện nhất định, các phân tử CO2 có thể tạo thành tinh thể và thường được gọi là “băng khô”. Trong ô mạng đơn vị lập phương của băng khô, các nguyên tử carbon nằm ở các vị trí đỉnh và tâm mặt, và các trục phân tử nằm song song với đường chéo khối của hình lập phương như trong hình minh họa. Độ dài liên kết C O là 116 pm.
a) Xác định số đơn vị phân tử trong ô mạng băng khô.
b) Mô tả kiểu cấu trúc tinh thể của băng khô.
c) Biết rằng khối lượng riêng của băng khô là 1.64 g·cm-3, hãy tính hằng số ô mạng đơn vị a của băng khô.
d) Xác định hệ số tọa độ của nguyên tử oxygen được đánh dấu trong hình.
2. Các tiểu phân thú vị chứa carbon và oxygen tạo thành một nhóm anion vòng với công thức tổng quát (CnOn)2- (n = 3, 4, 5, 6); chúng có cấu trúc phẳng, và những tiểu phân này đóng vai trò quan trọng trong lĩnh vực tổng hợp hữu cơ.

a) Biểu diễn cấu tạo của H2C4O4 (squaric acid).
b) Biểu diễn cấu tạo của anion squarate (vẽ tất cả các dạng cộng hưởng bền).
3. Cyclo[18]carbon (vòng 18 cạnh tạo thành bởi các nguyên tử carbon, kí hiệu là O) là một dạng thù hình tương đối mới của carbon. Cấu trúc của hợp chất này đã được đề xuất vào thập niên 1960, và vào năm 2019, nhóm nghiên cứu hợp tác giữa tập đoàn IBM và Đại học Oxford đã xác thực cấu trúc bởi thao tác quy mô nguyên tử với carbon oxide C24O6 (kí hiệu là P) nhờ sự trợ giúp
56 | Olympiad Hóa học các quốc gia trên thế giới
của kính hiển vi lực điện tử (AFM, atomic force microscopy). Trong quá trình khám phá cấu trúc của cyclo[18]carbon, sử dụng dẫn xuất của squarate (CH3)C4O4 và Li-C≡C-SiR3 (R = iPr, Me) cùng các tác nhân khác, các nhà khoa học đã khéo léo thiết kế lộ trình điều chế phân tử vòng P. Trong phân tử P, có trục quay bậc ba, và có bốn cách chuyển hóa P thành O, liên quan đến hai trung gian X và Y – trong đó X có khối lượng nhỏ hơn 14.6% so với P, còn Y thì nhỏ hơn 29.2%. Hãy biểu diễn cấu tạo của O, P, X, Y.
57 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
1. a) 4 phân tử CO2. b) Mạng lập phương đơn giản. c) a = 563 pm. d) Độ dài đường chéo khối a3975pm.Tọa độ của nguyên tử được đánh dấu là (0.119, 0.119, 0.119).
2. a) b)
58 | Olympiad Hóa học các quốc gia trên thế giới
59 | Olympiad Hóa học các quốc gia trên thế giới
Câu 5: Xác định hợp chất
Đun nóng 4.38 g đơn chất A trong HNO3, sau khi phản ứng kết thúc, thu được 6.16 g chất rắn B (oxide của A) và có chất khí màu nâu đỏ được giải phóng (phản ứng 1). A cũng phản ứng được với sodium hydroxide và bị dị phân (tự oxid hóa-khử), tạo thành hai muối C và D (phản ứng 2). Số oxid hóa của nguyên tố A trong C cũng giống như trong B. B phản ứng với o-phenylenediamine tạo thành E có chứa nguyên tố A và có phổ huỳnh quang đặc trưng, theo đó, có thể phân tích được hàm lượng của o-phenylenediamine cùng tồn tại với các đồng phân phenylenediamine khác.
1. Tính toán để xác định nguyên tố A.
2. Viết phương trình các phản ứng của A trong acid và trong base.
3. Biểu diễn cấu tạo của hợp chất E.
60 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn 1. Đặt công thức phân tử của B là x 2 OA
M4.38M19.69 M8x6.16 (Mr là khối lượng mol đương lượng của A). Sau khi thử các giá trị hóa trị (x) thì tìm được cặp giá trị khả dĩ là x = 4 và Mr = 78.74, nguyên tố A là selenium (Se). 2. Phương trình phản ứng: Se + 4HNO3 → SeO2 + 4NO2 + 2H2O Se + 6NaOH → Na2SeO3 + 2Na2Se + 3H2O 3.
+ r r r
61 | Olympiad Hóa học các quốc gia trên thế giới
Câu 6: Cấu trúc perovskite
Perovskite là một trong những kiểu cấu trúc phổ biến nhất. Hình (a) và (b) trình bày các cách biểu diễn khác nhau của cấu trúc này: (a) là ô mạng đơn vị của perovskite, trong đó bán kính cation tâm A lớn hơn, thường là các ion kim loại kiềm thổ hoặc đất hiếm; các cation tâm B với bán kính nhỏ hơn, thường là ion kim loại chuyển tiếp; các hình cầu màu xám nhạt đại diện cho các ion oxygen (O2-); (b) Các đa diện phối trí thể hiện đặc trưng cấu tạo của perovskite, ion B ở tâm của bát diện. Cấu trúc perovskite có thể tạo thành các cấu trúc dẫn xuất khác nhau. Ví dụ, cấu trúc pervoskite có thể được chia dọc theo mặt phẳng vuông góc với trục quay bậc bốn, và hình chiếu của lớp tạo thành dọc theo hướng trục quay bậc bốn giống như trong hình (b). Các lớp xen kẽ được dịch chuyển ½ chu kì dọc theo các trục a và b, sao cho các ion dương và âm đối diện với nhau và liên kết để tạo thành một dãy hợp chất gọi là “phase Ruddlesden-Popper” (kí hiệu là phase RP); (c) là một đơn lớp chứa perovskite (n = 1) RP.

Perovskite và cấu trúc dẫn xuất của nó.
1. Viết công thức hóa học của cấu trúc được biểu diễn trong hình (c).
2. Nếu số oxid hóa của ion tâm A không thay đổi thì khi thay đổi cấu trúc từ (a) thành (c) thì số oxid hóa của ion tâm B thay đổi như thế nào?
62 | Olympiad Hóa học các quốc gia trên thế giới
3. Trong hình (a), thông số ô mạng lập phương là a = 387.3 pm, hãy xác định thông số ô mạng đơn vị của cấu trúc biểu diễn ở hình (c). Biết rằng trong cấu trúc (c), khoảng cách A O giữa các lớp liền kề dọc theo trục c bằng 95.0% so với trong cấu trúc (a).
4. Trong cấu trúc phase RP, lớp perovskite cũng có thể là lưỡng lớp (n = 2), tam lớp (n = 3) hoặc đa lớp (n), hãy viết công thức tổng quát của dãy hợp chất này.
63 | Olympiad Hóa học các quốc gia trên thế giới
64 | Olympiad Hóa học các quốc gia trên thế giới
Câu 7: Phức chất
Trong một ống nghiệm thạch anh, cho iodine phản ứng với các mảnh đơn chất kim loại chuyển tiếp M ở 280 oC để tạo thành chất rắn X màu nâu đỏ X trên bề mặt kim loại. Đun nóng X trong bình chân không ở 300 oC để phân hủy, tạo thành chất rắn Y màu đỏ và chất khí màu tím, quá trình đi kèm với sự giảm khối lượng 29.4%. Y được chuyển hóa thành chất màu đỏ thẫm Z khi tiếp xúc với không khí khô (khối lượng tăng 5.25% và Z có nhiều hơn Y 1 nguyên tử oxygen).
Cho sulfate của M phản ứng hoàn toàn với phối tử hữu cơ hai càng 2,2'-bipyrimidine (kí hiệu là bipy, khối lượng phân tử 156.2), sau khi phản ứng diễn ra hoàn toàn thì thêm một lượng vừa đủ KI trong methanol vào bình phản ứng để nhận được các tinh thể màu xanh lục A. A phản ứng với Mg tạo thành chất màu xanh lam B, chất này bị khử tiếp bởi LiAlH4 trong THF, tạo thành chất rắn màu đỏ C. Nếu cho B phản ứng với đơn chất iodine thì trước tiên tạo thành chất rắn màu đỏ khác là D, sau đó D phản ứng tiếp với đơn chất iodine và chuyển trở lại thành tinh thể màu xanh lục A. Kết quả phân tích nguyên tố cho thấy rằng A có thể được xem là phức của Y với kết hợp bipy. So với Y, A có khối lượng lớn hơn 157% và không chứa các phân tử dung môi. Các phép đo độ cảm từ cho thấy moment từ hiệu dụng của A là B 3.75, còn C nghịch từ
65 | Olympiad Hóa học các quốc gia trên thế giới
Phức chất của M.
Hướng dẫn Đặt công thức X là MIx, Y là MIy, thì Z là MOIy. Đây là khối lượng đương lượng mol của Y là ( ) == r 16 M304.8 0.0525 Y - sau khi thử các giá trị hóa trị (y) thì y = 2, tương ứng Mr(M) = 51 là phù hợp nhất. Vậy M là vanadium (V), Y là VI2, Z là VOI2. Sau khi thử các giá trị x thì trường hợp x = 3 phù hợp, tương ứng với X là VI3.
66 | Olympiad Hóa học các quốc gia trên thế giới
Câu 8: Cấu trúc - Hoạt tính hợp chất hữu cơ
1. Biểu diễn cấu trúc của trung gian vòng A và sản phẩm chuyển vị mở rộng vòng B của phản ứng này
2. Trong số các chất dưới đây (benzoic acid và dẫn xuất của nó), dung dịch chất nào có tính acid mạnh nhất?
3. Hợp chất nào sau đây có nguyên tử hydrogen alpha (so với nhóm carbonyl) có tính acid mạnh nhất?
4. Chất nào sau đây có tốc độ dung môi phân trong sodium acetate /acetic acid nhanh nhất?
5. Dẫn xuất chlorohydrin nào sau đây có tốc độ phản ứng tạo thành dẫn xuất ethylen oxide trong môi trường base nhanh nhất?
67 | Olympiad Hóa học các quốc gia trên thế giới
68 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn 1. 2. 3. 4.
69 | Olympiad Hóa học các quốc gia trên thế giới
70 | Olympiad Hóa học các quốc gia trên thế giới
Câu 9: Chuyển hóa hữu cơ
1. Diaryltrifluoromethylphosphine rất hiệu quả trong quá trình đưa nhóm trifluoromethyl vào vị trí C4 của pyridine. Các kết quả thực nghiệm chỉ ra rằng phản ứng có thể diễn ra êm dịu chỉ khi vị trí C4 của nhóm phenyl trong diaryltrifluoromethylphosphine bị thế bởi nhóm nhường electron hiệu quả, và sự chọn lọc vị trí hiệu quả diễn ra ở vị trí C4 của pyridine. Vẽ cấu trúc đơn giản hóa của A và B (với Ar đại diện cho nhóm aryl trên P, cả hai sản phẩm đều là muối.)
2. Trong chuyển hóa sau, hai sản phẩm cuối được tạo thành với tỉ lệ 1:1. Vẽ cấu trúc lập thể của trung gian A trong chuyển hóa này và các trạng thái chuyển tiếp B và C mà qua đó, A chuyển hóa thành các sản phẩm cuối.
71 | Olympiad Hóa học các quốc gia trên thế giới
3. Khi xử lí với silver nitrate, hợp chất sau đây chỉ tạo thành 5% nitrate nhưng không tạo thành dẫn xuất allyl alcohol.
Khi tính nucleophile của tác nhân tăng lên, hiệu suất phản ứng thế sẽ tăng dần; nhưng khi nucleophile là MeLi thì phản ứng giống như chuyển hóa trên sẽ không diễn ra, thay vào đó tạo thành sản phẩm có công thức phân tử C9H12. Phổ 1H NMR của sản phẩm này cho thấy có 6 hydrogen với độ chuyển dịch hóa học 0.89 ppm Hãy vẽ cấu trúc đơn giản hóa của sản phẩm này.
72 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn 1. 2. 3.
73 | Olympiad Hóa học các quốc gia trên thế giới
Câu 10: Kiến thức tổng hợp
1. Vẽ công thức cộng hưởng của amide A:
2. Khi nguyên tử nitrogen của amide B gắn vào hai dị tố thì cặp electron chưa liên kết trên dị tố sẽ gây ra hiệu ứng hướng phân (anomeric), do đó phản ứng thế nucleophile có thể diễn ra trên nguyên tử nitrogen của amide.
a) Khi Y là nhóm ethoxy, Z là nhóm chức lần lượt chứa N, O hoặc một nguyên tử F thì amide được thế bởi dị tố nào (N, O, F) sẽ có hiệu ứng hướng phân mạnh nhất? b) Hiệu ứng hướng phân được tăng cường hay làm suy giảm khi amide chuyển hóa thành sulfonamide? Giải thích ngắn gọn.
3. Kĩ thuật “chỉnh sửa phân tử” có tiềm năng vô cùng to lớn trong lĩnh vực tổng hợp hữu cơ. Gần đây, các nhà khoa học đã sử dụng các amide với hiệu ứng hướng phân để chỉnh sửa khung sườn của amine bậc hai, trực tiếp “xóa bỏ” các nguyên tử nitrogen, giải phóng khí nitrogen và tạo thành các liên kết C-C. Đây là đột phá so với kĩ thuật hồi tổng hợp [tổng hợp ngược] truyền thống.
Các kết quả chỉ ra rằng sự tạo thành liên kết C-C diễn ra qua một cơ chế cặp-gốc tự do chặt chẽ, theo đó, trong quá trình “xóa bỏ” nguyên tử nitrogen, hai gốc được tạo thành và sau đó chúng kết hợp để tạo thành sản phẩm. Hãy vẽ cấu tạo của hai trung gian quan trọng trong quá trình chuyển hóa này.
4. Phản ứng chuyển vị kép (chuyển vị Dyotropic) đề cập đến sự chuyển vị đồng thời của hai liên kết σ trên hai nguyên tử kề nhau,
| Olympiad Hóa học các quốc gia trên thế giới
và vị trí của các nhóm thế trên khung sườn cũng thay đổi tương ứng. Mô tả tổng quát cho chuyển vị được cho trong hình dưới:
Phản ứng này có đặc trưng lập thể cao và được sử dụng rộng rãi trong tổng hợp các phân tử phức tạp. Dựa vào thông tin đã cho ở trên, hãy hoàn thành các chuyển hóa sau (phải biểu diễn cấu trúc ba chiều của phân tử và chỉ ra cấu hình lập thể của tâm thủ tính). a) b) c)
d) Vẽ cấu tạo hợp chất trung gian trong quá trình chuyển hóa sau và xác định cấu hình lập thể của các nguyên tử carbon bất đối trong cấu tạo sản phẩm mà hóa lập thể chưa được chỉ rõ:
75 | Olympiad Hóa học các quốc gia trên thế giới
Các từ viết tắt: Ar: aryl; Bn: benzyl; tBu: tert-butyl; 0.5 eq: 0.5 đương lượng [chất phản ứng]; Et: ethyl; Me: methyl; Ph: phenyl; THF: tetrahydrofuran; TMS: trimethylsilyl; Ts: p-toluenesulfonyl.
76 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
1. 2. a) Nguyên tử F. b) Suy giảm. Các sulfonamide có tính acid mạnh hơn amide và không thuận lợi để tham gia phản ứng thế SN1.
3.
77 | Olympiad Hóa học các quốc gia trên thế giới
78 | Olympiad Hóa học các quốc gia trên thế giới
Phần 2 Khu vực châu Âu
| Olympiad Hóa học các quốc gia trên thế giới
Olympiad Hóa học Anh 2022
Câu 1: Xăng E10
Nhằm hạn chế các tác nhân gây biến đổi khí hậu, tháng 9 năm 2021 chính phủ Vương Quốc Anh đã thay đổi loại xăng tiêu chuẩn ở cây xăng từ xăng E5 thành xăng E10. Giá trị E này là phần trăm ethanol trong hỗn hợp nhiên liệu ethanol-hydrocarbon. Đã có nhiều tranh cãi về việc thay đổi xăng E5 thành E10 này chính là một yếu tố góp phần vào tình trạng thiếu hút xăng dầu vào tháng 10 cùng năm, vì các đại lý đã cố cắt nguồn cung xăng E5. Giá trị E và số octane đều được hiển thị trên các cây xăng. Chỉ có một phần nhỏ đồng phân mạch thẳng của octane trong xăng có xu hướng cháy kích nổ trong động cơ. Hiện tượng cháy kích nổ diễn ra khi nhiên liệu cháy sớm và làm giảm hiệu năng của động cơ. Các đồng phân mạch nhánh của octane ít cháy kích nổ hơn và phần lớn đồng phân này có trong xăng. Một trong số đó là 2,2,4trimethylpentane.
a) Vẽ công thức cấu tạo của 2,2,4-trimethylpentane. Hòa trộn ethanol vào các hỗn hợp xăng như E5 và E10 cũng giúp giảm hiện tượng cháy kích nổ. Ethanol là một nhiên liệu sinh học và thường được tạo ra thông qua quá trình lên men đường từ thực vật. Thực vật nhận carbon dioxide từ không khí và chuyển hóa thành các đường như glucose, C6H12O6, qua quá trình quang hợp.
b) Viết phương trình tạo thành glucose trong quá trình quang hợp từ carbon dioxide.
| Olympiad Hóa học các quốc gia trên thế giới

Sự lên men kỵ khí của glucose tạo ra ethanol và carbon dioxide. c) Hãy viết phương trình của quá trình này. Một trong những đặc điểm của một nhiên liệu hiệu quả là tổng năng lượng nó tạo ra, hay enthalpy quá trình đốt cháy của nó. Một phương pháp dùng để xác định giá trị này là sử dụng các giá trị enthalpy liên kết trung bình. Các giá trị enthalpy liên kết trung bình được cho trong bảng dưới đây.
Liên kết
Enthalpy liên kết trung bình / kJ mol-1
C-C 347 C-H 413 O=O 498 C-O 358 C=O 805 O-H 464
Khi tính toán bằng phương pháp này, mọi đồng phân khác nhau của octane đều có cùng một giá trị d) Tính enthalpy của quá trình đốt cháy một đồng phân của octane. Giả sử 1 lít xăng E10 chứa 100 mL ethanol và 900 mL các đồng phân của octane, và 1 lít xăng E5 chứa 50 mL ethanol và 950 mL các đồng phân của octane. Tỉ khối của ethanol nguyên chất là 0.789 g cm-3 và tỉ khối của đồng phân octane nguyên chất là 0.703 g cm-3. Giả sử không có sự thay đổi thể tích trong quá trình hòa trộn. Enthalpy của quá trình đốt cháy ethanol tính bằng phương pháp sử dụng các enthalpy liên kết trung bình là -1276 kJ mol-1 .
81 | Olympiad Hóa học các quốc gia trên thế giới
e) Tính năng lượng tỏa ra (kJ) khi đốt cháy 1 lít xăng E5 và 1 lít xăng E10.
Nếu không có đáp án cho câu d), thí sinh có thể lấy giá trị enthalpy đốt cháy đồng phân octane là -6666 kJ mol-1
f) Xem năng lượng tỏa ra từ quá trình đốt cháy 1 lít xăng E5 là 100%, hãy tính phần trăm năng lượng tỏa ra từ quá trình đốt cháy 1 lít xăng E10.
Toàn bộ carbon dioxide thải ra từ phản ứng đốt cháy ethanol được bù lại bằng lượng khí carbon dioxide cây hấp thu trong quá trình phát triển. Vì thế, ethanol không đóng góp vào vết carbon của xăng E5 và E10.
g) Xem khí CO2 được sinh ra từ quá trình đốt cháy 1 lít xăng E5 là 100%, hãy tính phần trăm khí CO2 được sinh ra từ quá trình đốt cháy 1 lít xăng E10. Chỉ xét khí CO2 được tạo thành từ quá trình đốt cháy các đồng phân của octane.
82 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
a)
b) 6CO2 + 6H2O → C6H12O6 + 6O2
c) C6H12O6 → 2C2H5OH + 2CO2
d) C8H18 + 12.5O2 → 8CO2 + 9H2O
Tổng enthalpy liên kết của các chất phản ứng [(7 × 347) + (18 × 413) + (12.5 × 498)] kJ mol 1 = 16088 kJ mol 1
Tổng enthalpy liên kết của các sản phẩm [(16 × 805) + (18 × 464)] kJ mol 1 = 21232 kJ mol 1
Enthalpy đốt cháy = [16088 − 21232] kJ mol 1 = −5144 kJ mol 1
e) Ethanol: −1276 kJ mol 1 / 46.07 g mol 1 = −27.70 kJ g 1 27.70 kJ g 1 × 0.789 g cm 3 = −21.86 kJ cm 3 Octane: −5144 kJ mol 1 / 114.22 g mol 1 = −45.04 kJ g 1 −45.04 kJ g 1 × 0.703 g cm 3 = −31.66 kJ cm 3
Năng lượng giải phóng từ 1 L (1000 cm3) của nhiên liệu E5 = (950 cm3 × 31.66 kJ cm 3) + (50 cm3 × 21.86 kJ cm 3) = 31170 kJ
Năng lượng giải phóng từ 1 L (1000 cm3) nhiên liệu E10 = (900 cm3 × 31.66 kJ cm 3) + (100 cm3 × 21.86 kJ cm 3) = 30680 kJ
Cách giải khác: Trong 1 L nhiên liệu E5
Số mol ethanol = 50 cm3 × 0.789 g cm 3 / 46.07 g mol 1 = 0.8563 mol
83 | Olympiad Hóa học các quốc gia trên thế giới
Số mol octane = 950 cm3 × 0.703 g cm 3 / 114.22 g mol 1 = 5.847 mol Năng lượng giải phóng = (0.8563 mol × 1276 kJ mol 1) + (5.847 mol × 5144 kJ mol 1) = 31170 kJ
Trong 1 L nhiên liệu E10
Số mol ethanol = 100 cm3 × 0.789 g cm 3 / 46.07 g mol 1 = 1.713 mol
Số mol octane = 900 cm3 × 0.703 g cm 3 / 114.22 g mol 1 = 5.539 mol
Năng lượng giải phóng = (1.713 mol × 1276 kJ mol 1) + (5.539 mol × 5144 kJ mol 1) = 30680 kJ f) 30680 kJ / 31170 kJ × 100 = 98.4% g) 90/95 × 100 = 94.7%
84 | Olympiad Hóa học các quốc gia trên thế giới
Câu 2: Nitrous oxide

Nitrous oxide, N2O, là một hợp chất có khá nhiều công dụng. Nó được sử dụng làm chất đẩy trong kem sữa tươi, làm phụ gia nhiên liệu để cải thiện quá trình đốt trong động cơ xe hơi, và làm chất gây mê trong y khoa và nha khoa. Khi hít phải, nitrous oxide có thể tạo ra cảm giác hưng phấn, dẫn đến biệt danh “khí cười” của chất này. Hiện nay người ta đã biết được những rủi ro về sức khỏe nghiêm trọng liên quan đến vấn đề sử dụng nitrous oxide để giải trí.
Nitrous oxide có thể được tạo thành từ nitrous acid, HNO2, một acid yếu được sử dụng trong quá trình sản xuất các phẩm nhuộm. a) Vẽ sơ đồ dấu chấm và dấu chéo của HNO2. Sơ đồ mô tả electron hóa trị của các nguyên tử, những electron đến từ nguyên tử khác nhau được biểu diễn bằng các kí hiệu khác nhau (thường là dấu chấm và dấu chéo) nhằm cho thấy rõ electron đến từ nguyên tử nào. Nitrous acid có thể được chuyển hóa thành nitrous oxide bằng hai phương pháp. Phương pháp đầu tiên được cho dưới đây. Đầu tiên nitrous acid phản ứng với O2 để tạo thành phân tử A. Sau đó A được cho phản ứng với ammonia tạo thành muối [B+][C-], muối này phân hủy nhiệt tạo thành nitrous oxide và nước.
85 | Olympiad Hóa học các quốc gia trên thế giới
Phân tích nguyên tố cho thấy A chứa 1.60% hydrogen và 22.23% nitrogen về khối lượng.
b) Cho biết công thức của A. c) Vẽ ion B+ và C- cho thấy rõ hình dạng của chúng. Phương pháp thứ hai là phân hủy nhiệt nitrous acid. Với mỗi hai phân tử nitrous acid phân hủy nhiệt tạo thành một phân tử D, E và nước. Chất E là một khí màu nâu đỏ nằm trong cân bằng với một khí X không màu.
D và E phản ứng với nhau tạo thành phân tử F. Phân tử này sau đó phân hủy nhiệt tạo thành nitrous oxide và oxygen. d) Viết công thức của D, E, F và X. Nitrous oxide là một phân tử có dạng đường thẳng với một nguyên tử nitrogen nằm giữa. e) Vẽ cấu trúc N2O.
86 | Olympiad Hóa học các quốc gia trên thế giới




Câu 3: Cubane

Khối Platon là các hình khối ba chiều với mọi mặt, cạnh và góc đều tương đẳng (đồng nhất). Chỉ có năm hình khối có được tính chất như vậy. Platon đã đưa ra giả thuyết rằng các nguyên tố cổ điển – không khí, đất, lửa, và nước – mỗi nguyên tố tương ứng với một trong các hình khối.
Với những tiến bộ về hóa học trong 2360 năm qua, chúng ta không còn nghĩ rằng tạo hóa có bốn nguyên tố hay chúng được tạo ra từ khối Platon nữa. Tuy nhiên, ta có thể tạo ra một hình khối Platon từ các nguyên tố.
Một trong những phân tử như vậy chính là cubane. Chất này được quan tâm và có tiềm năng sử dụng nhờ vào cấu trúc khác thường của nó.
Cấu trúc khung cubane
a) Cho biết công thức phân tử của cubane.
Một quy trình tổng hợp cubane xuất phát từ cubane-1,4-dicarboxylic acid. Cấu trúc của cubane carboxylic acid và ba đồng phân của hợp chất này được cho dưới đây.

88
| Olympiad Hóa học các quốc gia trên thế giới
b) Hoàn thành bảng sau với số peak trong phổ đồ cộng hưởng từ hạt nhân 13C của các phân tử:
Phân tử Số peak trong phổ đồ NMR 13C
Cubane
Cubane-carboxylic acid

Cubane-1,2-dicarboxylic acid

Cubane-1,3-dicarboxylic acid
Cubane-1,4-dicarboxylic acid Phần đầu của chuỗi tổng hợp cubane được cho dưới đây.
89 | Olympiad Hóa học các quốc gia trên thế giới
Chất A được cho phản ứng với ba đương lượng Br2 để tạo thành hợp chất B. B có công thức phân tử là C7H9O2Br3, với mỗi nguyên tử bromine cách xa hai nguyên tử oxygen chính xác ba liên kết.
Chất B sau đó được cho phản ứng với sodium hydroxide dư. Phản ứng này được đề nghị cơ chế đi qua chất trung gian C, chất này sau đó tự phản ứng với các phân tử khác của chính nó để tạo thành hợp chất D

c) Vẽ cấu trúc của chất A và B.
Phản ứng từ chất trung gian C tạo thành D là một phản ứng cộng đóng vòng Diels-Alder. Ví dụ đơn giản nhất của một phản ứng cộng đóng vòng Diels-Alder là phản ứng giữa butadiene và ethane, được cho dưới đây: Ba ví dụ khác của phản ứng cộng đóng vòng Diels-Alder được cho như sau: d) Vẽ cấu trúc của các sản phẩm W và X. Hợp chất Y dimer hóa thông qua phản ứng Diels-Alder để tạo thành sản phẩm như trên.
90 | Olympiad Hóa học các quốc gia trên thế giới

e) Vẽ cấu trúc của chất Y. f) Dựa vào kiến thức về phản ứng Diels-Alder, hãy vẽ cấu trúc của chất trung gian C.
Hợp chất D phản ứng dung dịch acid tạo thành E. Hợp chất này sau đó tiếp xúc với ánh sáng UV, phản ứng nội phân tử tạo thành hợp chất F. Cấu trúc F có chứa hai vòng bốn.
Sau cùng, chất F được cho phản ứng với sodium hydroxide sau đó là hydrochloric acid. Điều kiện này dẫn đến phản ứng chuyển vị Favorskii. Phản ứng tổng quát cho chuyển vị Favorskii được cho sau đây:



g) Hãy khoanh tròn (các) nguyên tử carbon có tính thân điện tử của cấu trúc sau.
h) Từ hai khung sau đây, hãy vẽ cấu trúc của hợp chất E và F.
91 | Olympiad Hóa học các quốc gia trên thế giới
Acid dicarboxylic dưới đây có thể được chuyển hóa thành cubane. i) Từ khung sau đây hãy vẽ cấu trúc của chất G và H.

Một đồng phân của cubane, barrelene, cũng có thể tổng hợp được bằng cách sử dụng phản ứng Diels-Alder.



Hai tiền chất diễn ra phản ứng Diels-Alder tạo thành hợp chất Q Chất này tiếp tục phản ứng tạo thêm một vòng nữa hiện diện trong chất R. Sau đó, R phản ứng cho ra ba sản phẩm, một trong số đó
92 | Olympiad Hóa học các quốc gia trên thế giới
được cho trong chuỗi. Hợp chất S là một khí, và hợp chất T phản ứng với NaOH cho ra barrelene-1,2-dicarboxylic acid.

j) Hãy cho biết cấu trúc của các chất Q, R, S và T. Dùng khung dưới đây để vẽ cấu trúc của Q, R và T
93 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
a) C8H8 b)
Phân tử Số peak trong phổ đồ NMR 13C
Cubane 1
Cubane-carboxylic acid 5
Cubane-1,2-dicarboxylic acid 4
Cubane-1,3-dicarboxylic acid 5
Cubane-1,4-dicarboxylic acid 3 c-f) A B W X Y C





94 | Olympiad Hóa học các quốc gia trên thế giới

95 | Olympiad Hóa học các quốc gia trên thế giới





96 | Olympiad Hóa học các quốc gia trên thế giới



Câu 4: Xét nghiệm virus corona
Bộ xét nghiệm dòng chảy ngang điển hình hoạt động thông qua một mẫu chất lỏng chảy trong một môi trường giấy (từ trái sáng phải theo hình dưới đây). Các bộ xét nghiệm dòng chảy ngang (bộ test nhanh) COVID-19 ứng dụng sự liên kết mạnh giữa các protein gai trên bề mặt của hạt virus và kháng thể để phát hiện virus corora. Màu đỏ/hồng trong các bộ xét nghiệm dòng chảy ngang là từ các hạt nano vàng được phủ bằng kháng thể. Để xét nghiệm bằng bộ xét nghiệm nhanh, một que được dùng để lấy mẫu và nhúng vào 1.0 cm3 dung dịch chiết chứa 7.3 mmol dm-3 Na2HPO4 và 4.6 mmol dm-3 KH2PO4 ở pH 7.4 tại 25 oC.
a) Hãy cho biết mục đích của những hóa chất trong dung dịch chiết? Chọn đáp án đúng.

A. Tạo một dung dịch rất acid
B. Tạo một dung dịch trung tính
C. Tạo một dung dịch rất kiềm
D. Tạo một dung dịch đệm
b) Nếu 1.0 cm3 HCl 0.1 mol dm-3 sau đó được thêm vào dung dịch chiết, hãy cho biết pH của dung dịch thay đổi ra sao? Chọn đáp án đúng.
A. Rất acid
B. Trung tính
C. pH 7.4
D. Rất kiềm
Trong quá trình xét nghiệm người ta lấy mẫu từ mũi/cổ họng và nhúng nó vào dung dịch chiết. Dung dịch này, sau đó, được gọi là
97 | Olympiad Hóa học các quốc gia trên thế giới
dung dịch xét nghiệm. Mẫu xét nghiệm sau khi được chiết thành dung dịch xét nghiệm, được nhỏ một vài giọt (0.10 cm3) lên bệ mẫu.
Nếu người được xét nghiệm mắc COVID-19, mẫu xét nghiệm điển hình sẽ chứa 67.110 hạt virus trên cm3. Mỗi hạt virus có khoảng 20 protein gai trên bề mặt. c) Hãy cho biết nồng độ protein gai [SP] (mol dm-3) trong mẫu xét nghiệm nằm trên bệ. Nếu không tìm được đáp án, hãy sử dụng giá trị = 113[SP]1.010moldm trong các phép tính phía sau. Khi mẫu vượt qua bệ liên hợp, nó trở nên bão hòa với kháng thể màu đỏ được phủ lên các hạt nano (NP), với nồng độ 121.610 NP trên cm3 . Một cân bằng được thiết lập ở vị trí NP trói bất kỳ protein gai SP nào. Giả sử mọi sự trói buộc diễn ra giữa protein gai và hạt nano vàng là 1:1 == 1013 [SPNP] K1.210moldm [NP][SP]
d) Vì bộ xét nghiệm chứa một lượng dư hạt nano vàng, thí sinh có thể giả sử nồng độ hạt nano vàng tại cân bằng vẫn là 121.610 NP trên cm3 . Hãy xác định [SPNP] (mol dm-3) tại cân bằng. Nếu không tìm được đáp án, hãy sử dụng giá trị = 113[SPNP]1.010moldm trong các phép tính phía sau.
98 | Olympiad Hóa học các quốc gia trên thế giới
Hỗn hợp tạo thành chảy qua dải xét nghiệm có chứa kháng thể được cố định trên bề mặt (AB). Khi xét đến lượng chất trên bề mặt, ta sử dụng đại lượng mật độ bề mặt A thay cho nồng độ. Dải xét nghiệm dài 3.0 mm, rộng 1.0 mm và sâu 0.10 mm với mật độ bề mặt của kháng thể = 92 AB 1.210mm .
e)
i) Hãy tính có bao nhiêu kháng thể được cố định trên bề mặt, AB, có trên bề mặt dải xét nghiệm. ii) Hãy tính có bao nhiêu protein gai tự do, SP, và có bao nhiêu protein gai bị trói vào hạt nano, SPNP, có mặt trong thể tích dung dịch bằng với kích thước của dải xét nghiệm trước khi có bất kì tương tác nào với dải xét nghiệm. Kháng thể được cố định trên bề mặt, AB, trói bất kì protein gai nào hiện diện trong hệ (SP tự do và SPNP hạt nano đã trói) thông qua cân bằng sau đây: AB(bề mặt) + SP(aq) ABSP(bề mặt) AB(bề mặt) + SPNP(bề mặt) ABSPNP(bề mặt)
f) Xác định số hạt nano được cố định trên dải xét nghiệm ABSPNP khi toàn bộ 0.10 cm3 mẫu xét nghiệm đã chảy qua. Khả năng hiển thị của đường xét nghiệm phụ thuộc vào số hạt nano trở nên cố định trên nó. Các hạt nano khả kiến trong mẫu xét nghiệm sẽ cho ra kết quả dương tính.

g) Xác định số hạt virus cực tiểu có trong mẫu xét nghiệm để có thể cho kết quả dương tính.
99 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
a) D. Tạo một dung dịch đệm b) A. Rất acid c) 7.1 × 106 hạt virus / cm3 × (1000 cm3 / dm3 ) = 7.1 × 109 hạt virus / dm3 [Hạt virus] = Số hạt virus / NA = 7.1 × 109 hạt virus / dm3 / 6.02 × 1023 mol 1 = 1.18 × 10 14 mol dm 3 [SP] = 20 × [hạt virus] = 20 × 1.18 × 10 14 mol dm 3 = 2.36 × 10 13 mol dm 3 d) [NP]0 = 1.6 × 1012 cm 3 × (1000 cm3 / dm3 ) / NA = 2.66 × 10 9 mol dm 3 Tiểu phân Nồng độ ban đầu Nồng độ sau khi cân bằng SP 2.36 × 10-13 mol dm-3 2.36 × 10-13 mol dm-3 – x NP 2.66 × 10-9 mol dm-3 2.66 × 10-9 mol dm-3 – x SPNP 0 x x ≪ [SP]0, nên bất kì biến đổi nào của [NP] cũng đều nhỏ và [NP] xấp xỉ bằng [NP]0 = 2.66 × 10-9 mol dm-3
100 | Olympiad Hóa học các quốc gia trên thế giới
e) (i) Diện tích dải A = 3 mm2 . Số lượng AB = 3 mm2 × 1.2 × 109 mm 2 = 3.6 × 109 (ii) Thể tích dải V = 0.3 mm3 = 3 × 10 7 dm3 Số mol SPNP = 2.29 × 10 13 mol dm 3 × 3 × 10 7 dm3 = 6.86 × 10 20 mol
Số mol SPNP = 6.86 × 10 20 mol × 6.02 × 1023 mol 1 = 4.13 × 104 . [SP] = [SP]0 – [SPNP] = 7.2 × 10 15 mol dm 3 Số mol SP = 7.2 × 10 15 mol dm 3 × 3 × 10 7 dm3 = 2.1 × 10 21 mol Số lượng SP = 2.1 × 10 21 mol × 6.02 × 1023 mol 1 = 1.3 × 103 f) Nếu y SPNP gắn với AB tạo thành y ABSPNP thì ta có [SPNP]= [SPNP]0 – y / V và σABSPNP = ��/A Viết lại hằng số cân bằng
101 | Olympiad Hóa học các quốc gia trên thế giới
Chú ý rằng 1 ≪ KAσAB/V vậy 0 ySPNPV
Ta có thể sử dụng V = 0.10 cm3 g) Xét nghiệm này cho 1.38 × 107 ABSPNP trong 3 mm2 vậy mật độ là 4.59 × 106 mm-2. Xét nghiệm này có 7.1 × 105 hạt virus trong mẫu xét nghiệm. Do số ABSPNP tỉ lệ thuận với số hạt virus nên số lượng quan sát được tối thiểu là (3 × 106 / 4.59 × 106 ) × (7.1 × 105 ) = 4.64 × 105 hạt virus
102 | Olympiad Hóa học các quốc gia trên thế giới

Câu 5: Nút thắt Trung Hoa
Kì thi Olympiad Hóa học Quốc tế 2022 sắp được tổ chức bởi Đại học Thiên Tân tại Trung Hoa. Văn hóa truyền thống của Trung Hoa thường có các nút thắt trang trí được buộc từ các sợi dây hoặc vải. Vào năm 2021, các nhà nghiên cứu đã có thể buộc một phân tử thành nút thắt Trung Hoa nhỏ nhất từ trước đến nay. Hình bên là một nút thắt Trung Hoa được thắt từ dây thừng. Đầu tiên, họ tổng hợp một phối tử hữu cơ với vai trò như những sợi chỉ. Sự phối trí của các nguyên tử trên các phối tử hữu cơ này với các ion kim loại tạo thành một lưới đan xen (3x3) như hình bên dưới. Mười hai đầu sợi dây được tham gia vào một phản ứng hóa học và các ion kim loại được loại bỏ sau đó để tạo thành nút thắt Trung Hoa hoàn toàn hữu cơ.
Lưới (3x3)


Quy trình tổng hợp một trong số những dây hữu cơ có thể bắt đầu từ hai tiền chất khác nhau: A hoặc B đều có thể được chuyển hóa thành 3-fluoro-4-nitrophenol.
103 | Olympiad Hóa học các quốc gia trên thế giới

a)
i) Vẽ cấu trúc của A
ii) Vẽ cấu trúc của tác nhân electrophile hoạt tính được sinh ra khi A phản ứng để tạo thành 3-fluoro-4-nitrophenol. Tiến hành phân tích nguyên tố của B cho thấy: C 51.81%; H 3.62%; N 10.07%.
b) Vẽ cấu trúc của B. 3-fluoro-4-nitrophenol được chuyển hóa thành hợp chất D. Để chuyển hóa C thành D, các nhà nghiên cứu đã sử dụng một amine bậc 1 (RNH2) với R là một nhóm alkyl. c) i) Vẽ cấu trúc của C ii) Vẽ cấu trúc của D. Sử dụng chữ viết tắt R để kí hiệu cho nhóm alkyl của amine bậc 1. Hợp chất D được chuyển hóa thành dây hữu cơ qua ba bước. Hai bước cuối sử dụng cùng một hỗn hợp xúc tác palladium. Cho hợp chất E và thiazolothiazole phản ứng với hỗn hợp này tạo thành hợp chất F. Tiếp tục cho hợp chất F và tác nhân G phản ứng với hỗn hợp này cho ra một dây hữu cơ.
104 | Olympiad Hóa học các quốc gia trên thế giới
d) Vẽ cấu trúc của hợp chất E và tác nhân G. Trong phổ đồ NMR 1H của hợp chất D, các tín hiệu từ nhóm alkyl R như sau: 3.26 ppm (2H, doublet of triplets); 1.77 ppm (1H, multiplet); 1.63 ppm (2H, doublet of triplets) 0.98 ppm (6H, doublet).

e) Vẽ cấu trúc của amine bậc một (RNH2) được dùng để tổng hợp D.

Các nguyên tử ở mỗi dây phối trí vào các ion kim loại để tạo thành lưới (3x3).
f) Với cấu trúc dưới đây, hãy vẽ tại các ion kim loại và cho thấy các nguyên tử nào phối trí vào ion kim loại nào.
105 | Olympiad Hóa học các quốc gia trên thế giới
Thí sinh hãy sử dụng cách vẽ của hình dưới đây cho câu f). Với ion kim loại được biểu diễn bằng chữ M trong vòng tròn, và các nguyên tử phối trí có một mũi tên cho thấy chúng đang phối trí vào kim loại nào.
g) Hình học phối trí tổng quát quanh mỗi ion kim loại trong lưới 3x3 này là? Chọn đáp án đúng.

A. tứ diện
B. tam giác phẳng C. vuông phẳng D. bát diện
E. chóp đáy tam giác
F. lục giác phẳng Công thức của muối kim loại được thêm vào để tạo thành lưới có thể được viết là 22 MX6HO , với M2+ là một cation hóa trị hai ở hàng kim loại chuyển tiếp đầu tiên, X- là một anion tứ diện mang điện tích -1, và có 6 phân tử nước kết tinh trong muối. Khi khuấy muối trong dung dịch sodium hydroxide, dung dịch xuất hiện một kết tủa màu xanh lục, khi dừng khuấy kết tủa chuyển màu sang nâu. Khi đun nóng nhẹ, muối sẽ giảm 32.0% khối lượng. Anion X- chứa hai nguyên tố khác nhau, đều không phải oxygen. h) Xác định M2+ và vẽ cấu trúc của anion X. Lưới 3x3 sau đó được cho thực hiện phản ứng hoán vị alkene, gắn hai alkene đầu mạch thành một alkene hai nhóm thế và tạo ra sản phẩm phụ ethene. Do cấu trúc cố định của lưới nên chỉ có các dây gần nhau mới có thể tham gia vào phản ứng này.
106 | Olympiad Hóa học các quốc gia trên thế giới
Dù phản ứng này chỉ nối các đầu dây gần nhau, vẫn có nhiều khả năng các đầu dây khác cũng có thể được nối lại. Điều này phụ thuộc vào đầu dây nào được nối trước, đôi khi một số đầu dây lại ở quá xa so với các đầu dây khác để có thể nối được. Một khi phản ứng hoán vị alkene hoàn tất, EDTA được thêm vào để loại các ion kim loại. Sau khi các ion kim loại đã được loại khỏi lưới, ta còn lại bốn loại cấu trúc hữu cơ khác nhau, phụ thuộc vào các đầu dây nào đã nối lại: (i) nút thắt Trung Hoa; (ii) hai vòng đan xen nhau; (iii) vòng riêng lẻ; (iv) phân tử hữu cơ mạch thẳng.
i) Các cặp đầu dây sau đây được kết nối và sau đó loại bỏ ion kim loại. Hãy cho biết cấu trúc nào ứng với
i) (1,2) (3,4) (5,6) (7,8) (9,10) (11,12) ii) (1,2) (4,5) (6,7) (8,9) (10,11) (3 và 12 không được nối) iii) (1,2) (3,4) (5,6) (8,9) (10,11) (7 và 12 không được nối) iv) (2,3 (4,5) (6,7) (8,9) (10,11) (12,1)

107 | Olympiad Hóa học các quốc gia trên thế giới

Hướng dẫn a) (i) (ii) b) c) (i)



108 | Olympiad Hóa học các quốc gia trên thế giới

(ii) d) e) f) g) D. Bát diện h) M2+ = Fe2+ và X– = BF4 –




109 | Olympiad Hóa học các quốc gia trên thế giới

Iron(II) có thể được xác định từ phép thử ion đặc trưng. Từ khối lượng giảm khi đun nóng, có thể xác định khối lượng phân tử. 6 × 18.106 = 32.0% do đó khối lượng tổng của phức là 337.8 g mol–1. Khối lượng mol của hai anion là 337.8 – (6 × 18.106 + 55.85) g mol–1 = 173.314 g mol–1 . Khối lượng mol của một anion là 86.657 g mol–1 (xấp xỉ với BF4, 86.81 g mol-1)
i) (i) nút thắt Trung Hoa; (ii) hai vòng riêng lẻ và phân tử hữu cơ mạch thẳng. (iii) vòng đan xen nhau và phân tử hữu cơ mạch thẳng. (iv) nút thắt Trung Hoa;
110 | Olympiad Hóa học các quốc gia trên thế giới
Câu 6: Câu hỏi về phương pháp lưu trữ vaccine
Vì nguy cơ suy biến các thành phần bên trong, vaccine luôn cần phải được làm lạnh. Điều này gây tăng giá thành và khiến việc phân bố vận chuyển trở vaccine nên khó khăn. Một quy trình được phát triển gần đây có tên gọi là bọc silica hóa (ensilication) có thể cải tiến mạnh mẽ độ ổn định của vaccine. Thành phần của vaccine đã được bọc silica hóa có thể lưu trữ ở nhiệt độ phòng và chịu được (chưa bị suy biến) khi gia tăng nhiệt độ lên đến 100 oC. Quá trình bọc silica hóa bắt đầu bằng phản ứng thủy giải ethyl orthosilicate, Si(OCH2CH3)4 để tạo thành orthosilicic acid, Si(OH)4, (quá trình 1). Hợp chất này sau đó được thêm vào một dung dịch protein/kháng thể, dung dịch xúc tác quá trình phân hủy acid diễn ra tạo thành silica, SiO2 (quá trình 2).
a) Viết phương trình hóa học của quá trình 1 và 2. Ở cuối quá trình 2, hỗn hợp huyền phù của các hạt nano silica mang protein được hình thành. Protein có thể được gỡ ra khi dùng dung dịch NaF và HCl để phá vỡ hạt nano silica (quá trình 3).

b) Hãy tính biến thiên enthalpy chuẩn của phản ứng trên dựa vào dữ kiện sau đây:
111 | Olympiad Hóa học các quốc gia trên thế giới
+→+=− +→+=− +→+=−
NaOHHClNaClHOH56.7 kJ mol SiO6 HFHSiF2 HOH100.3 kJ mol NaOHHFHONaFH61.5 kJ mol Quá trình 2 thuận lợi về mặt nhiệt động học nhưng diễn ra chậm, vì thế nên đòi hỏi chất xúc tác. Hằng số cân bằng cho phản ứng này là = eq4 K1/[Si(OH)] và =−− 4 1680 ln[Si(OH)]0.605 T với [Si(OH)4] là nồng độ cân bằng (mol dm-3), và T là nhiệt độ (K). c) Hãy tính biến thiên enthalpy mol, oH , và biến thiên entropy mol, oS của quá trình 2. Kỹ thuật tán xạ ánh sáng động có thể được sử dụng để xác định kích thước của các hạt nano. Giả sử dung dịch đang xét chỉ chứa hai loại hạt hình cầu: protein đã được bọc silica hóa với bán kính r1 và protein tự do với bán kính r2. Cường độ của ánh sáng bị tán xạ bởi những hạt này có thể được chuyển thành một hàm tự tương quan, c.
o1 2 o1 2262 o1 2
112 | Olympiad Hóa học các quốc gia trên thế giới
Nếu không tìm được đáp án, hãy sử dụng = A0.50000 cho các phép tính phía sau. Phương trình cho c có thể được xếp lại về dạng , với ==+=+ o2211 1212 t
cc1 f,a(rA r),brA 2r.
e) Hãy tính giá trị của độ dốc a và hệ số chặn b, biết rằng = c1.54289 tại = t1μsvà = c1.51937 tại = t2 μs
Nếu không tìm được đáp án, hãy sử dụng = 11 a0.00250 nm μs và = 1 b0.12500 nm cho các phép tính phía sau. f) Từ đó hãy tìm bán kính r1 và r2 . Cân nhắc bước giải đầu tiên với việc đặt = 1 11xr và = 1 22xr .
113 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
1 lnKlnlnSiOH
SiOH So sánh v
114 | Olympiad Hóa học các quốc gia trên thế giới
f) Đặt == 11 1122 rx vàrx.Biến đổi lại biểu thức cho b, ta có = 1 2 bx x A Thế vào biểu thức cho a, ta có:
Nghiệm thứ nhất là: x1 = 0.00526 nm-1 từ đây tìm được == 11 2 bx x0.249 nm A - tương ứng với r1 = 190 nm và r2 = 4.01 nm.
Nghiệm thứ hai là x1 = 0.182 nm-1 và do đó ==− 11 2 bx x0.0621nm A - không hợp lí.
115 | Olympiad Hóa học các quốc gia trên thế giới
Olympiad Hóa học Estonia
Câu 1: Năng lượng mạng tinh thể
Năng lượng mạng tinh thể tương ứng với năng lượng giải phóng từ các ion khí trong quá trình tạo thành tinh thể. Không thể đo trực tiếp năng lượng mạng tinh thể, nhưng có thể tính được nhờ chu trình

Born-Haber, cho phép nó được biểu thị như mắt xích trong một chuỗi quá trình tuần hoàn. Hình dưới đây biểu diễn chu trình BornHaber của NaCl.
a) Gán các quá trình được biểu diễn trong hình (1 - 6) với dạng năng lượng được cho trong bảng dưới đây. Chú ý rằng tên các dạng năng lượng có thể không tương ứng với quá trình thuận trong chu trình Born-Haber!
116 | Olympiad Hóa học các quốc gia trên thế giới
Dạng enthalpy
Kí hiệu Giá trị (kJ·mol-1) Ái lực electron của Cl Eaq(Cl) -356 Phân li Cl2 D0(Cl2) 242 Thăng hoa Na sub HNa 109
Ion hóa Na ( )IENa 494 Enthalpy tạo thành NaCl ( ) f HNaCl -411 Năng lượng mạng tinh thể NaCl ( ) UNaCl

b) Sử dụng chu trình Born-Haber, hãy tính năng lượng mạng lưới của NaCl. Ô mạng đơn vị của tinh thể NaCl có dạng hình lập phương (như minh họa ở hình bên). Khối lượng riêng của NaCl là ��NaCl = 2.17 g cm-3 . c) Tính khoảng cách giữa các ion Na+ và Cl- (dNaCl) trong tinh thể NaCl. Trong trường hợp mạng tinh thể ion, thành phần đóng góp quan trọng nhất vào năng lượng mạng tinh thể là tương tác tĩnh điện ( ) giữa các ion với điện tích cụ thể. Giá trị này có thể được tính theo biểu thức:
elU
2 A e
l 0
UANzze 4 Với A là hằng số Madelung, NA là số Avogadro (6.022·1023 mol-1), z+ và z- lần lượt là trị số điện tích của cation và anion, e là điện tích
117 | Olympiad Hóa học các quốc gia trên thế giới
nguyên tố (1.602·10-19 C), là hằng số điện môi chân không (8.854·10 12 C2 J-1 m-1) và d là khoảng cách giữa các ion.
d) Tính giá trị thành phần tĩnh điện đóng góp vào năng lượng mạng tinh thể của NaCl. Sử dụng A = 1.748 và dNaCl ở ý c để tính toán. Nếu bạn không tính được giá trị ở ý d thì sử dụng dNaCl = 2.80 Å.
e) Giả sử dNaCl = dBaO, hãy lí giải xem NaCl hay BaO có nhiệt độ nóng chảy cao hơn.
Cho biết năng lượng mạng tinh thể của một số sodium halide như sau: ( ) ( ) ( ) ===111UNaF923kJmol; UNaBr747kJmol; UNaI704kJmol
f) Hãy giải thích ngắn gọn về sự biến đổi đều đặn các giá trị năng lượng mạng tinh thể của các sodium halide.
118 | Olympiad Hóa học các quốc gia trên thế giới
1 E2E3E4E5E6E1 2 411109494121356779 kJmol c) Hãy tính khối lượng của một ô mạng đơn vị. Dễ xác định được mỗi ô mạng đơn vị có chứa 4 đơn vị NaCl, mà khối lượng mol của NaCl là 58.5 g·mol-1 nên khối lượng 1 mol ô mạng đơn vị là
=
1 58.54234 gmol . Vậy khối lượng mỗi ô mạng đơn vị là: m(ô mạng) = M(ô mạng)/NA Tính độ dài cạnh của ô mạng đơn vị:
tinh
e) Các trị số điện tích của Ba2+ và O2- đều bằng 2, do đó tích z+ztrong biểu thức bằng 4 (với NaCl là 1). Vậy năng lượng mạng tinh thể của BaO cao hơn năng lượng mạng tinh thể của NaCl, nên có thể dự đoán rằng nhiệt độ nóng chảy của BaO cao hơn (cần nhiều năng lượng hơn để phá vỡ mạng tinh thể). [Thực tế thì = BaO d2.87Å nên sự đơn giản hóa như trong đề bài đã cho là chấp nhận được!] f) Năng lượng mạng tinh thể của các sodium halide giảm khi khoảng cách giữa các ion Na+ và halide tăng lên, bởi trong biểu thức thì khoảng cách ion nằm ở phần mẫu số.
elU elU
120 | Olympiad Hóa học các quốc gia trên thế giới
Câu 2: Sự chuyển phase của khoáng chất olivine
Lớp phủ địa chất của Trái Đất chủ yếu được cấu thành bởi các khoáng chất silicate. Đóng góp lớn nhất là các silicate của Mg-Fe, đại diện tiêu biểu là khoáng chất olivine có công thức tổng quát là ( ) x1x4 2 MgFeSiO . Tỉ lệ của Mg và Fe trong olivine biến đổi từ dạng giàu-magnesium (Mg2SiO4, forsterite) đến giàu-sắt (Fe2SiO4, fayalite), tạo thành một dãy đẳng cấu trong đó các cation magnesium và sắt có thể thay thế lẫn nhau trong cấu trúc tinh thể của olivine. Tỉ lệ Mg/Fe gây ảnh hưởng đáng kể đến các tính chất lí hóa của olivine, bao gồm cả nhiệt độ nóng chảy. Hình 1 là giản đồ phase biểu diễn sự thay đổi nhiệt độ nóng chảy của olivine. Hình 1: Giản đồ phase thành phần-nhiệt độ của olivine. Sự chuyển phase trong các khoáng chất đẳng cấu là quá trình nhiều giai đoạn mà thành phần của các phần lỏng và rắn có thể đổi khác trong quá trình. a) Sử dụng giản đồ phase, hãy ước tính nhiệt độ tại đó bắt đầu
(i) sự nóng chảy của olivine với 35% forsterite. (ii) sự hóa rắn của olivine với 65% forsterite.
121 | Olympiad Hóa học các quốc gia trên thế giới

Đun nóng olivine rắn chứa 35% forsterite trong một hệ kín (nghĩa là không có phần nào của olivine rời khỏi hệ) cho đến khi nó bắt đầu nóng chảy, và tiếp tục đun nóng cho đến khi olivine ở trạng thái lỏng.
b)
(i) Ước tính nhiệt độ tại đó tỉ lệ olivine lỏng/rắn là 1:1. (ii) Ước tính thành phần phase rắn của olivine được xác định ở ý (i)b
Nhiệt độ và áp suất trong lòng Trái Đất tăng theo độ sâu, do đó các silicate Mg-Fe khác nhau thì bền ở các độ sâu khác nhau. Hệ quả là olivine tồn tại ở một số dạng khác nhau trong lớp phủ địa chất –chúng có cùng thành phần hóa học nhưng khác về cấu trúc tinh thể. c) Sử dụng các tính toán cần thiết, hãy thiết lập công thức của dạng olivine phổ biến nhất trong lớp phủ địa chất, biết nó chiếm 29.76% Mg về khối lượng. Ở áp suất cực kì cao, olivine có công thức tổng quát M2SiO4 không còn bền và bị chuyển thành perovskite (silicate Mg-Fe) và oxide. Hình 2 biểu diễn cấu trúc ô mạng đơn vị của perovskite. Các quả cầu lớn đại diện cho các cation kim loại (Fe, Mg), các quả cầu nhỏ hơn đại diện cho các nguyên tử Si, còn những quả cầu nhỏ nhất là các nguyên tử oxygen.
122 | Olympiad Hóa học các quốc gia trên thế giới
Hình 2: Ô mạng đơn vị perovskite. d)
(i) Xác định công thức tối giản của perovskite.
(ii) Viết phương trình phản ứng có cân bằng cho chuyển hóa M2SiO4 → perovskite + oxide, sử dụng kí hiệu tổng quát M cho tất cả các cation kim loại.

Hình 3 biểu diễn giản đồ phase của các khoáng olivine trong khoảng nhiệt độ và áp suất trong lớp phủ địa chất. Khối lượng riêng của các phase khác nhau của (Mg, Fe)2SiO4 được cho trong bảng dưới đây.
Phase olivine Khối lượng riêng (g·cm3) -olivine 3.25 -olivine 3.84 -olivine 3.90
123 | Olympiad Hóa học các quốc gia trên thế giới
e) Sử dụng thông tin đã cho ở trên, hãy điền vào các vùng tương
ứng trong giản đồ phase dưới đây tên của phase olivine phù hợp ( ) + perovskiteoxide -olivine;-olivine; -olivine; Hình 3: Giản đồ phase nhiệt độ-áp suất của olivine. Tốc độ sóng địa chấn trong các trận động đất phụ thuộc vào cấu trúc của các loại khoáng chất mà sóng đi qua. Các đo lường địa chấn chỉ ra rằng lớp phủ địa chất có độ sâu thăng giáng vận tốc –tại đó tốc độ sóng thay đổi đột ngột. Đó là các độ sâu z1 = 410 km và z2 = 660 km.

f)
(i) Biết rằng sự gia tăng áp suất 1 Gpa thì tương ứng với trung bình 29 km, hãy ước lượng những quá trình chuyển phase tương ứng với mỗi độ sâu thăng giáng vận tốc.
(ii) Tính gradient nhiệt độ của lớp phủ địa chất (biến thiên nhiệt độ khi độ sâu gia tăng) và vẽ vào giản đồ phase.
124 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
a) (i) Olivine có 35% forsterite bắt đầu nóng chảy ở 1355 (± 15) °C. (i) Olivine lỏng có 65% forsterite bắt đầu đóng rắn ở 1740 (± 15) °C. b) (i) Xem hình. Ở nhiệt độ có tỉ lệ 1:1 giữa phase lỏng và rắn, đường đại diện cho 35% forsterite phải cách đều các phase lỏng và rắn. Tỉ lệ chất lỏng và rắn là 1:1 ở 1430 (± 15) °C. (ii) Thành phần của phần rắn ở 1430 oC là 50 (± 5)% forsterite, nghĩa là trong công thức tổng quát thì x = 0.5.
125 | Olympiad Hóa học các quốc gia trên thế giới

f) (i) z1 = 410 km tương ứng với 14.1 GPa, z2 = 660 km tương ứng với 22.8 GPa. Những quá trình chuyển phase tương ứng là →-olivine-olivine (410 km) và + → perovskiteoxide -olivine (660 km). (ii) == 1 dT1960 K1590K1.481.5 Kkm dz660 km410 km
126 | Olympiad Hóa học các quốc gia trên thế giới

Câu 3: Các hợp chất thú vị của phosphorus
Hóa học phosphorus vô cùng đa dạng. Ngoài vai trò quan trọng trong hóa sinh, phosphorus cũng là nguồn nguyên liệu để sản xuất nhiều hợp chất vô cơ và hữu cơ. Sơ đồ dưới đây cho thấy khả năng tổng hợp nhiều hợp chất thú vị có chứa phosphorus. Toàn bộ các phản ứng được dẫn ra trong sơ đồ đều đã được cân bằng và không có sản phẩm phụ nào khác được tạo thành. Đơn chất B còn được gọi là phosphorus trắng. D được tạo thành bởi phản ứng thế nucleophile. Công thức phân tử của E là C6H18Si2O. F là chất tương tự nitrile của nguyên tố thuộc chu kì 3. Hợp chất G có ba mặt phẳng đối xứng. Hợp chất H và I chỉ chứa các liên kết đôi, trong khi đó H không chứa liên kết phosphorus-phosphorus. Phân tử của hợp chất I có hình dạng tương tự đơn chất B. Alkene J không có carbon bậc hai. Khi O, là đại diện đơn giản nhất cho nhóm hợp
127 | Olympiad Hóa học các quốc gia trên thế giới
chất của nó, được tạo thành ở dạng sản phẩm phụ trong quy trình điều chế K bởi phản ứng của N với điện cực carbon ở điện áp cao.
M là acid hai nấc.

a) Xác định các hợp chất A – P
b) Cho biết phản ứng tương ứng với mô tả sau đây: Dị phân (tự oxid hóa khử), nhiệt phân trong chân không, tách nước, chuyển dịch [1,3]-silyl. Hướng dẫn
a)
b) Dị phân: 4M → N + 3H3PO4
Nhiệt phân chân không: F → K + J Tách nước: 3P → 1.5E + 1.5H2O chuyển dịch [1,3]: D → D', nhưng D → F cũng được chấp nhận.
128 | Olympiad Hóa học các quốc gia trên thế giới
Câu 4: Hydrogen hóa xúc tác
Sir Geoffrey Wilkinson (1921–1996) là nhà hóa học người Anh nổi tiếng bởi những thành tựu trong lĩnh vực nghiên cứu về các hợp chất cơ kim trên cơ sở các kim loại chuyển tiếp, nhờ vậy ông cũng giành được giải thưởng Nobel Hóa học năm 1973. Một phần quan trọng trong nghiên cứu của ông là việc khám phá ra xúc tác Wilkinson (xem hình) – hoạt tính của chất này đã góp phần đặt nền móng cho xúc tác đồng thể hiện đại. Phức chất này có thể được tổng hợp, ví dụ, bằng cách khử tinh thể ngậm nước của kim loại thuộc chu kì 5 MCl3·3H2O bởi lượng dư triphenylphosphine (PPh3, trong đó Ph = C6H5).
Các electron hóa trị của phức chất có thể được đếm theo quy tắc như sau:
1. Nguyên tử trung tâm đóng góp cho lớp vỏ hóa trị của phức chất tất cả các electron hóa trị (bằng số nhóm trong bảng tuần hoàn).
2. Các phối tử tạo một liên kết cộng hóa trị với nguyên tử kim loại (ví dụ H, halogen, …) đóng góp một electron cho lớp vỏ hóa trị.
3. Các phối tử liên kết với nguyên tử kim loại qua một cặp electron tự do (ví dụ CO, NH3, …) thì đóng góp hai electron cho lớp vỏ hóa trị.
4. Các hợp chất carbon chưa bão hòa (không no, ví dụ như alkene) liên kết với kim loại qua [các] liên kết bội, với các orbital phân tử được tạo thành bởi các orbital p của các nguyên tử liên kết, và đóng góp cho lớp vỏ hóa trị x electron, trong đó x là số carbon tạo phối trí với nguyên tử kim loại. Các phối tử như vậy được kí hiệu bởi chữ cái Hi Lạp �� và kí tự trên x.
129 | Olympiad Hóa học các quốc gia trên thế giới
Hình sau đây minh họa một vài ví dụ về việc đếm electron hóa trị. a)
(i) Xác định kim loại M, biết rằng có 16 electron trong lớp vỏ hóa trị của xúc tác Wilkinson.
(ii) Viết phương trình phản ứng điều chế xúc tác Wilkinson. Giản đồ dưới đây biểu diễn chu trình xúc tác của phản ứng hydrogen hóa trong trường hợp 3-phenylpropene. Phản ứng xúc tác diễn ra qua các trung gian A – D.
130 | Olympiad Hóa học các quốc gia trên thế giới
b) Đếm số electron hóa trị trong các trung gian A – D. Trong dung dịch, trung gian A có thể chuyển hóa thuận nghịch tạo thành dạng nhị hợp [dimer] có cấu tạo dạng tứ giác phẳng nhờ sự tồn tại của các tâm phối trí tự do. c)

(i) Biểu diễn cấu tạo dạng nhị hợp của trung gian A (ii) Đếm số electron hóa trị theo mỗi nguyên tử M trong dimer. Hiệu quả xúc tác được đặc trưng bởi tỉ lệ TON (turnover number, hay “số luân chuyển”) – mô tả có bao nhiêu phân tử sản phẩm được tạo thành trên mỗi phân tử xúc tác. Andreas, một sinh viên ngành hóa, muốn ước tính giá trị TON của phản ứng được mô tả trong sơ đồ ở trên và đã thực hiện một thí nghiệm. Trước tiên, cậu điều chế một dung dịch chứa 0.480 g 3-phenylpropene trong 10 mL methanol đựng trong bình đáy tròn. Sau đó, cậu nối bình này với một xi-lanh khí và thay thế không khí bởi hydrogen sao cho áp suất trong bình
131 | Olympiad Hóa học các quốc gia trên thế giới
được duy trì ở p = 1.00 atm trong suốt phản ứng. Cuối cùng, cậu thêm 1.600 mL dung dịch xúc tác Wilkinson 0.010 M rồi tiến hành phản ứng ở T = 20.0 oC cho đến khi ngừng tiêu thụ hydrogen. Phản ứng tiêu thụ tổng cộng = 3 V0.043 dm khí hydrogen. Cho biết phương trình trạng thái khí lí tưởng: = pVnRT (trong đó R = 8.314 J·K-1·mol-1).
d) Sử dụng phương trình trạng thái khí lí tưởng, hãy tính: (i) Hiệu suất (%) (ii) Giá trị TON của xúc tác đối với phản ứng trên. e) Giải thích ngắn gọn tại sao chỉ các liên kết đôi ngoài vòng bị khử trong hệ phản ứng này. Mặc dù trong giai đoạn CDthì về mặt lí thuyết, một liên kết M-C có thể được tạo thành ở cả nguyên tử carbon bậc một và bậc hai của alkene, tuy nhiên sự tạo liên kết với tâm kim loại qua carbon đầu mạch lại chiếm ưu thế do sự án ngữ không gian.
f) Xét đến tính thuận nghịch của giai đoạn CD - hãy chỉ ra những sản phẩm phụ chưa bão hòa nào có thể được tạo thành trong phản ứng hydrogen hóa.
132 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
a) (i) Tổng cộng có 16 electron. Trong đó 3 nhóm PPh3 tương ứng với 3·2e-= 6e- và 1 nguyên tử Cl là 1e-. Vậy, 16 – 6 – 1 = 9 electron hóa trị còn lại có nguồn gốc từ nguyên tử kim loại. Đề bài cho biết đó là kim loại chuyển tiếp thuộc chu kì 5, vậy M là Rh. (ii) RhCl3 ·3H2O + 4PPh3 → Rh[Cl(PPh3)3] + Ph3PO + 2HCl + 2H2O b) A: 14e-; B: 16e-; C: 18e-; D: 16e. c)
2·9e- = 18e- (2 Rh) 4·2e = 8e- (4 PPh3) 2·1e- = 2e- (2 Cl) 2·2e- = 4e- (các cặp electron Cl đóng vai trò phối tử cầu nối) Tổng: 32e- tương ứng với 16e- cho mỗi nguyên tử
133 | Olympiad Hóa học các quốc gia trên thế giới

Vậy: ( ) ( ) === nsp 1.79mmol TON112 nxúctác0.016mmol
e) Liên kết đôi ngoài vòng dễ bị khử hơn hệ thơm bởi ngay cả trong trường hợp khử hóa một phần thì hệ thơm cũng sẽ mất nhiều năng lượng bền hóa (kết quả của sự liên hợp vòng). Do đó, sự khử hóa vòng thơm không thuận lợi về mặt nhiệt động như sự khử hóa alkene.
f)
134 | Olympiad Hóa học các quốc gia trên thế giới
Câu 5: Tổng hợp thuốc
Các benzodiazepine những loại thuốc thần kinh được sử dụng để làm giảm lo âu và rối loạn giấc ngủ. Trong số đó bao gồm cả clonazepam, loại thuốc theo toa được kê nhiều thứ 201 ở Mỹ trong năm 2019. Clonazepam có thể được tổng hợp từ 2nitrobenzaldehyde qua các giai đoạn sau:
a) Những nhóm chức nào sau đây có trong clonazepam: amino, keto, aldehyde, enamine, imino, oxime, nitro, alcohol, carboxyl, cyano, ester, azido, epoxy, halo?
b) Xác định cấu tạo của các hợp chất A – E.
c) Tại sao chuyển hóa D từ C được tiến hành qua hai bước theo trình tự như trong sơ đồ trên?
Thay vì sử dụng hỗn hợp cổ điển HNO3 và H2SO4 đặc, thì các điều kiện êm dịu hơn (KNO3/H2SO4) được sử dụng cho phản ứng nitro hóa E.
d) Giải thích ngắn gọn cơ sở cho việc lựa chọn tác nhân như trên.
e) Cho biết các chuyển hóa i) D → E và ii) E → clonazepam thuộc loại phản ứng hữu cơ nào?
135 | Olympiad Hóa học các quốc gia trên thế giới

Hướng dẫn
a) Clonazepam có nhóm nitro, imino, amide và halo. b)

c) Bromoacetyl bromide (BrCH2COBr) và ammonia phải được cộng hợp vào hợp chất C theo hai bước để tránh cho ammonia khỏi phản ứng với bromoacetyl bromide tạo thành BrCH2CONH2 hoặc hỗn hợp BrCH2CONH2 và H2NCH2CONH2 (tùy thuộc vào lượng ammonia phản ứng). d) Sự nitro hóa hợp chất E trong điều kiện êm dịu giúp giảm bớt sự tạo thành những sản phẩm phụ không mong muốn và đảm bảo nitro hóa diễn ra ở nguyên tử carbon mong muốn. e) (i) Phản ứng ngưng tụ và (ii) phản ứng thế electrophile nhân thơm.
136 | Olympiad Hóa học các quốc gia trên thế giới
Câu 6: Phân giải động học các đối quang
Phân giải động học là phương pháp dựa vào các tính chất hóa học để tách các đối quang từ hỗn hợp của chúng. Phương pháp này có thể được sử dụng khi một trong các đối quang của nguyên liệu đầu phản ứng với tác nhân hoặc xúc tác thủ tính nhanh hơn đồng phân lập thể còn lại. Trong thực tế, rất khó để thực hiện sự phân giải lí tưởng, trong đó chỉ có duy nhất một đối quang có thể phản ứng, và do đó có một lượng nhỏ đồng phân không mong muốn của sản phẩm sẽ được tạo thành. Tiếp theo, ta nghiên cứu về quá trình acyl hóa của hỗn hợp tiêu triền racemic alcohol qua ví dụ của 1phenylethanol, trong đó đồng phân R của chất đầu phản ứng với dạng hoạt tính (kat*) của xúc tác – được tạo thành từ xúc tác thủ tính (kat) và acetic anhydride - nhanh hơn nhiều so với đồng phân S
Các kí hiệu: Et = C2H5, Me = CH3, Ph = C6H5.

a)
(i) Biểu diễn cấu tạo của đối quang của xúc tác (kat).
(ii) Chỉ ra kiểu tính thủ tính hiện diện trong phân tử này: tâm, trục, phẳng, xoắn. b) Biểu diễn cấu tạo dạng hoạt tính (kat*) của xúc tác và cả hai đồng phân lập thể của sản phẩm (R)-P và (S)-P.
Kí hiệu đồng phân 1-phenylethanol phản ứng chậm hơn là A và đồng phân phản ứng nhanh hơn là K. Độ chọn lọc của xúc tác thủ tính
137 | Olympiad Hóa học các quốc gia trên thế giới
k s k , trong đó kK và kA là kí hiệu cho các hằng số tốc độ bậc một của các đồng phân tương ứng. Độ chọn lọc có thể được đánh giá khi biết mức độ chuyển hóa của phản ứng (X) ở thời điểm t và dư lượng đối quang (ee) của nguyên liệu đầu ở cùng thời điểm:
AKAK
AKAK
d) Tại sao racemic 1-phenylethanol không thể được phân giải thành các đối quang bằng các phương pháp như chiết, chưng cất hoặc kết tinh lại?


140 | Olympiad Hóa học các quốc gia trên thế giới
Olympiad Hóa học Romania
Câu 1: Trắc nghiệm
1) Cho pin điện: ( ) ( )−+ 232PtHO,H NO,NO,HO Pt. Phát biểu nào sau đây là đúng:
A. Ở anode diễn ra quá trình: +→++ 232NO HO NO HO 2e.
B. Ở cathode diễn ra quá trình: +→+ 22 2HO2e2HOH C. Ở anode diễn ra quá trình: +→+ 22 2HOH2HO3e
D. Phương trình phản ứng tạo thành dòng điện là: +→+ 2322 HNONOHO
E. Phương trình phản ứng tạo thành dòng điện là: +→+ 2232 HNONOHO
2) Thalidomide, một loại thuốc an thần, bán ra lần đầu tiên ở Châu Âu vào thập niên 1950, được kê đơn đặc biệt cho phụ nữ mang thai. Tuy nhiên, thảm kịch đã xảy ra ở thập niên tiếp theo. Cụ thể là từ năm 1961, đã có báo cáo về việc một số sản phụ sử dụng thalidomide sinh ra những đứa trẻ bị dị tật bẩm sinh. Một quy trình tổng hợp đơn giản hóa của thalidomide được đưa ra dưới đây:
Chất A trong sơ đồ trên là
A. 2-aminoglutaric acid. B. aminosuccinic acid.
C. 3-aminoglutaric acid. D. 2,4-diaminopentanoic acid.
141 | Olympiad Hóa học các quốc gia trên thế giới
E. 2,3-diaminoglutaric acid.
3) Dãy nào sau đây biểu diễn các tác nhân theo trình tự giảm dần hoạt tính trong phản ứng cộng nucleophile:
A. Formaldehyde > chloral > acetone > benzenecarbaldehyde > acetophenone.
B. Formaldehyde > benzenecarbaldehyde > chloral > acetone > acetophenone.
C. Chloral > formaldehyde > benzenecarbaldehyde > acetophenone > acetone.
D. Chloral > formaldehyde> benzenecarbaldehyde> acetone> acetophenone.
E. Formaldehyde > chloral > benzenecarbaldehyde > acetophenone > acetone.
4) Cho các hợp chất: 1) p-chloroaniline, 2) p-methoxyaniline, 3) pfluoroaniline, 4) aniline, 5) p-toluidine. Dãy các chất theo trình tự giảm dần tính base là
A. 2> 5> 4> 1> 3.
B. 2> 5> 3> 4> 1. C. 5> 2> 4> 1> 3. D. 5> 2> 3> 4> 1. E. 2> 5> 4> 3> 1.
5) Hòa tan 30 g ammonium nitrate vào 250 g nước ở 15.0 oC, nhận được một dung dịch có nhiệt độ cuối là 5.37 oC. Nhiệt dung riêng của dung dịch tạo thành là 0.90 cal/(g·K). Enthalpy mol của dung dịch ammonium nitrate là
A. +27.07 kJ/mol. B. +6.47 kJ/mol. C. +27.07 kcal/mol. D. -6.47 kcal/mol. E. -6.47 kJ/mol.
6) Số oxid hóa của lưu huỳnh trong K2S2O8 là
A. -2 và +6. B. +4 và +6. C. +7.
142 | Olympiad Hóa học các quốc gia trên thế giới
D. +6. E. +4. 7) Xét cân bằng phân li của chất A, là chất duy nhất có mặt ban đầu trong phase khí đồng thể: + 23ABC Áp suất của hỗn hợp khí khi cân bằng là P. Hằng số cân bằng Kp, được biểu diễn theo độ phân li của hợp chất A là A. =
3 p 2 K P B.
=
2 2 p 1 K P C. ( ) = −
4 2 p2 2
27 KP 161 D. = − 3 p3 KP 1 E. = 3 p KP 3 8) Một phản ứng bậc nhất có năng lượng hoạt hóa Ea = 25 kcal/mol. Biết rằng hệ số trước số mũ A = 2·1013 min-1. Nhiệt độ tại đó chu kì bán hủy bằng 1 phút là A. 387.54 K. B. 568.12 K. C. 324.60 K. D. 406.12 K. E. 479.20 K.
9) Công dân X (Citizen X) đã quay trở lại! Lần này, ông ta muốn thực hiện một thí nghiệm khí tượng hoc độc đáo: Ông cho 2.6888·1025 phân tử khí vào một quá bóng (Tính được luôn! Làm cách nào
143 | Olympiad Hóa học các quốc gia trên thế giới
vậy?!). Sau đó, ông cầm lấy quá bóng và nhận thấy nó đạt thể tích đúng bằng 1 m3. Cho biết thí nghiệm diễn ra vào mùa nào trong năm và khí được bơm vào bóng như thế nào?
A. Mùa đông (0 oC), ông ta đã thổi vào quả bóng và đưa vào những gì ông ta có: hỗn hợp của N2, O2, CO2, Ar; khi không tự thổi thêm bằng phổi được, ông ta thậm chí còn làm một việc rất nguy hiểm, bơm khí từ ống dẫn khí (CH4, C2H6, C3H8).
B. Mùa hè (25 oC), bơm khí từ ống oxygen hàn xì.
C. Mùa đông (0 oC), bơm khí từ ống oxygen hàn xì.
D. Mùa hè (25 oC), ông ta đã thổi vào quả bóng và đưa vào những gì ông ta có: hỗn hợp của N2, O2, CO2, Ar; khi không tự thổi thêm bằng phổi được, ông ta thậm chí còn làm một việc rất nguy hiểm, bơm khí từ ống dẫn khí (CH4, C2H6, C3H8).
E. Mùa hè ở Sahara (58 oC), bơm khí vào bằng bơm xe đạp. 10)Cho các giá trị enthalpy tạo thành: ( ) ( ) ( ) ( ) ( ) ( )
144 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
1D, 2A, 3D, 4B, 5A, 6D, 7C, 8D, 9A, 10B.
145 | Olympiad Hóa học các quốc gia trên thế giới
Câu 2: Dung dịch. Điện hóa học
1) Silver oxalate là muối tan ít trong nước (ở 25 oC, pH = 7.4, độ tan S = 2.06·10-4 mol/L). Một trong các yếu tố ảnh hưởng đến độ tan của muối là pH, bởi anion oxalate phản ứng với các ion hydronium. Tính độ tan của silver oxalate ở 25 oC trong nước được acid hóa với pH = 5. Cho biết: - Các hằng số acid của oxalic acid là == 25 a12K5.610 vàK6.210. - Khi kết tủa XmYn xuất hiện trong dung dịch, một cân bằng được thiết lập giữa phase rắn và dung dịch như minh họa bởi phương trình dưới: ( ) ( ) ( ) +− + nm mnaqaq XYsmXnY . Cân bằng được đặc trưng bởi tích số tan, Ks, của hợp chất XmYn. Nếu S là độ tan của hợp chất XmYn thì ( ) ( ) ( ) +− + === mnmn nms mn smnmn K KXYXYmSnSS mn
2) Ở 25 oC, thêm 50 mL dung dịch AgNO3 0.04 M vào 200 dung dịch HBr chưa rõ nồng độ. Sau một thời gian, nhúng một thanh bạc và điện cực hydrogen H2 ( ) ( ) = 2 Hg P1 atm vào cốc chứa dung dịch. Suất điện động của pin điện hóa nhận được là 0.1843 V. a) Viết phương trình các quá trình diễn ra ở các điện cực của pin điện hóa. b) Tính nồng độ mol của dung dịch HBr ban đầu.
146 | Olympiad Hóa học các quốc gia trên thế giới
147 | Olympiad Hóa học các quốc gia trên thế giới
Câu 3: Azobenzene
Azobenzene (AB), có cấu tạo như trong hình, là phân tử với những đặc tính thú vị nhờ khả năng biến đổi thuận nghịch khi được chiếu sáng ở các bước sóng λ = 340 nm và λ = 450 nm.

Hình 1: Cấu tạo azobenzene và phổ hấp thụ UV-Vis (độ hấp thụ bước sóng) của các tiểu phân azobenzene. a) Viết phương trình phản ứng diễn ra, gọi tên các tiểu phân và gán bước sóng phù hợp với sự chuyển hóa của mỗi tiểu phân. Đặc tính chuyển đổi thuận nghịch của một hệ hóa học ổn định kép, dưới tác động của một kích thích vật lí như ánh sáng, đã dẫn đến sự xuất hiện của nhóm hợp chất gọi chung là “máy tính quang phân tử”. Mối quan tâm đến các phân tử như vậy bắt nguồn từ ý tưởng về khả năng ứng dụng kết hợp với các loại thuốc, một lĩnh vực được gọi là quang dược học, ví dụ như hoạt hóa hoặc ức chế hoạt tính theo hướng có kiểm soát, giảm thiểu hoặc loại bỏ các tác dụng phụ. Vậy nên, để ứng dụng được, các phân tử như vậy phải có khả năng chuyển hoàn toàn từ dạng này sang dạng khác - thông số này được đo bởi phần trăm phân bố của hai dạng ở cân bằng (trạng thái quang tĩnh, PSS). Ngoài ra, chu kì bán hủy của dạng kém bền hơn phải có một giá trị nhất định, tùy thuộc vào mục đích ứng dụng, theo mức độ giờ hoặc ngày.
151 | Olympiad Hóa học các quốc gia trên thế giới
Bảng 1: Hợp chất (dạng bền) (dạng kém bền)
PSS (dạng kém bền,%)
PSS (dạng bền, %)
t1/2 (giờ) AB 444 430 14 - - 0.04 1 456 414 42 86 91 92 2 469 419 50 90 97 15 Tuy nhiên Azobenzene vẫn tồn tại một vài nhược điểm để có thể sử dụng trong những ứng dụng như vậy, đó là lí do vì sau bộ khung cấu trúc đã được biến đổi nhằm loại bỏ các nhược điểm này. b) Sử dụng phổ hấp thụ của các tiểu phân azobenzene trong Hình 1 và dữ kiện trong Bảng 1 về cực đại hấp thụ tương ứng với các bước chuyển − n* - hãy chỉ ra các nhược điểm chính của azobenzene trong vai trò động cơ quang phân tử.
Các cấu tạo D và E đều là dẫn xuất azobenzene, có chứa các nhóm hút electron và đã loại bỏ được các nhược điểm chính của azobenzene, trong khi đó làm tăng đáng kể chu kì bán hủy của dạng kém bền hơn. Hợp chất D và E được tạo thành bởi phản ứng oxid hóa ghép cặp các amine X và Y tương ứng, khi có mặt hỗn hợp KMnO4/FeSO4. D có khối lượng phân tử 254 và là dẫn xuất orthohalogen hóa.
152 | Olympiad Hóa học các quốc gia trên thế giới
c) Xác định cấu tạo X, Y, D, E, M, N, O. d) Gán các dữ kiện trong Bảng 1 cho các hợp chất D và E. Giải thích. Sự thay thế một trong các gốc aryl bởi dị-aryl (aryl chứa dị tố) thì tạo thành các hợp chất với những đặc tính được cải thiện đáng kể so với các dẫn xuất arylazobenzene. Hợp chất T được tạo thành từ amine X bởi chuỗi phản ứng sau: e) Xác định cấu tạo các chất U, V, T. f) Tính chu kì bán hủy (theo ngày) của hợp chất T, biết rằng kết quả đo phổ 1H NMR trong chuyển hóa nhiệt của dạng kém bền thành dạng bền hơn xác định được tốc độ phản ứng bằng 7.86·10-8 giây-1
g) Mô tả cơ chế của chuyển hóa V thành T.
(Tham khảo từ bài báo: Beilstein J. Org. Chem. 2019, 15, 2753–2764; Chem. Eur. J. 2014, 20, 16492–16501)
153 | Olympiad Hóa học các quốc gia trên thế giới
Hướng dẫn
a)
b) Sự xen phủ của các dải hấp thụ tương ứng với các bước chuyển − n* của hai đồng phân hình học chỉ ra rằng không có sự chuyển hóa hoàn toàn giữa đồng phân này thành đồng phân kia. Chu kì bán hủy cực kì ngắn. c)
d) 1-D, 2-E. E chứa nhiều nhóm hút electron hơn, dẫn đến sự phân tách các dải hấp thụ tốt hơn và có khả năng nhận được PSS cao hơn.
e)
154 | Olympiad Hóa học các quốc gia trên thế giới
f)
155 | Olympiad Hóa học các quốc gia trên thế giới

Câu 4: Hóa Lí
A. A. Wexler (J. Res. Natl. Bur. Stand. A Phys. Chem., 1976, 80A, 775785) đã thực hiện các phép đo áp suất hơi nước ở các nhiệt độ khác nhau và các dữ kiện được cho trong giản đồ dưới đây. Trong một bình dung tích 100 L, có một chất khí bền được bão hòa hơi nước ở nhiệt độ 40 oC và áp suất tổng bằng 1000 mmHg. Xác định khối lượng nước được ngưng tụ trong điều kiện đẳng áp nếu nhiệt độ của hỗn hợp khí giảm đi 15 oC. Giản đồ áp suất hơi nước.

B) Đốt cháy 1 mol alkane trong khí quyển oxygen dẫn đến sự tạo thành hỗn hợp sản phẩm chỉ chứa các chất khí. Các tính chất nhiệt động học của các chất phản ứng và sản phẩm phản ứng được cho trong Bảng 1a. Enthalpy phản ứng ở 25 oC và 327 oC được cho trong Bảng 1b. Xác định công thức phân tử của alkane.
156 | Olympiad Hóa học các quốc gia trên thế giới
Bảng 1a
Hợp chất ( ) = 11 P
CdHcalKmol dT CO2(g) 8.87 H2O(g) 8.03 O2(g) 7.02 Alkane(g) 12.58 Bảng 1b Nhiệt độ ( ) 1 rHkJmol 25 -1560.0 327 -1554.2 C) Tiến hành nghiên cứu động học của phản ứng nhiệt phân trong phase khí của hai đồng phân không vòng, không chứa liên kết O-H, có công thức phân tử C4H6O4. Cho biết các thông tin sau đây: - Mỗi đồng phân đều bị phân cắt đồng li thành hai mảnh với cấu tạo giống hệt nhau, đây là giai đoạn tốc định (quyết định tốc độ phản ứng); - Cả hai đồng phân đều tạo thành cùng sản phẩm nhiệt phân: một vô cơ và một alkane theo tỉ lệ mol 2:1.
Loại bỏ hoàn toàn không khí khỏi một bình phản ứng với dung tích 1 L không đổi ở nhiệt độ thường (khoảng 20 oC) bằng khí trơ (argon) cho đến khi đạt tới áp suất cuối 5943.2 Pa. Đun nóng bình phản ứng đến 220 oC, sau đó đưa vào 288 mg của một trong hai đồng phân (bay hơi ngay lập tức) và bắt đầu đếm thời gian. Sau 3831 giây, áp suất bình phản ứng đạt 30000 Pa. Đun nóng (tức thì) lò phản ứng
157 | Olympiad Hóa học các quốc gia trên thế giới
lên 234 oC và bắt đầu đếm thời gian. Sau 1218 giây nữa thì áp suất bình phản ứng đạt giá trị 35852 Pa.
Trong thí nghiệm tương tự với đồng phân còn lại, các nhà nghiên cứu quan sát thấy rằng ở 90 oC, một nửa chất phản ứng đã bị tiêu hao sau 3820 giây, trong khi đó ở 100 oC chỉ cần 1260 giây để tiêu thụ lượng chất như vậy.

1) Xác định cấu tạo của hai đồng phân.
2) Đề xuất và viết cơ chế gốc ba-giai đoạn cho phản ứng nhiệt phân của mỗi đồng phân.
3) Tính giá trị các hằng số tốc độ tương ứng và giá trị năng lượng hoạt hóa của phản ứng nhiệt phân của mỗi đồng phân.
4) Gán cho mỗi đồng phân giá trị năng lượng tạo thành mol trong giản đồ dưới đây và vẽ giản đồ năng lượng của phản ứng tương ứng với mỗi đồng phân.
5) Ước tính, bằng các tính toán đơn giản, năng lượng tạo thành mol các mảnh phân tử cho mỗi đồng phân (được đề cập đến ở phần đề bài trên).
158 | Olympiad Hóa học các quốc gia trên thế giới
Đối với bài C:
- Đơn giản hóa bằng cách xem rằng H ≅ U (lưu ý là chỉ áp dụng cho bài tập này!)
- Các giá trị năng lượng liên kết trung bình cho các liên kết đơn giản được cho dưới đây:
146kJmol
Thông tin chung:
- Đơn giản hóa: Xem rằng các chất khí là khí lí tưởng. - Làm tròn: 0 oC = 273 K R = 0.082 L·atm·mol-1·K-1 = 8.31 J·mol-1·K-1 1 atm = 760 mm Hg = 101325 Pa 1 cal = 4.18 J
159 | Olympiad Hóa học các quốc gia trên thế giới
pp n Pp
HO(1)HO(2) khi tong HO(2)
HO(1)
HO(2)
160 | Olympiad Hóa học các quốc gia trên thế giới
Đây là áp suất riêng phần (t = 0) của C4H6O4 ở 493 K, ( ) == 464CHO t0,T493 K P .
Áp suất bình phản ứng tổng khi bắt đầu đếm giờ ở 220 oC: ( ) ( ) ( ) = == == =+ =+= 464tongArCHO T493 t0,T493KKt0,T493 K
PPP 10000 Pa10000 Pa20000 Pa
Khi quá trình nhiệt phân diễn ra, áp suất sẽ tăng theo hệ số tỉ lượng: C4H6O4 ⎯⎯→ C2H6 + 2CO2
Ban đầu (t = 0) ( ) = 464 CHO0 t P 0 0
ện tại (t) ( ) (
164 | Olympiad Hóa học các quốc gia trên thế giới
Liên kết C-C
Liên kết C-O
Liên kết O-O Năng lượng liên kết trung bình dimethyl oxalate 1 4 0 + =+= ccco 4 34743581779 diacetyl peroxide 2 2 1 ++ =++= cccooo22 234723581461556 Các kết quả số nhận được chỉ ra rằng trong trường hợp dimethyl oxalate có năng lượng được giải phóng để tạo thành các liên kết lớn hơn nên phân tử bền hơn. Chênh lệch về năng lượng tạo thành giữa các đồng phân chỉ ra rằng dimethyl oxalate bền hơn với giá trị −= 1 17791556223 kJmol - rất gần với chênh lệch của các giá trị trong giản đồ ( ) −−−= 1 553756221kJmol.
167 | Olympiad Hóa học các quốc gia trên thế giới
5) H3C-O-C•=O: −+
168 | Olympiad Hóa học các quốc gia trên thế giới

Olympiad Hóa học Áo
Câu 1: Các phân tử chứa liên kết bội
A. Ba phân tử nhỏ
Ba phân tử lưỡng nguyên tử có thể được cấu thành từ các nguyên tử O và N – thông qua đó, chúng ta có thể học được nhiều điều về các mô hình liên kết và sự mô hình hóa nói chung. Có lẽ, cách thức đơn giản nhất để giải thích về các liên kết dựa vào các electron là công thức liên kết cộng hóa trị Lewis. Đáng tiếc, cách làm đơn giản nhất không phải lúc nào cũng là cách làm đúng. Bởi công thức Lewis chỉ có thể dự đoán có một electron chưa liên kết cho một trong ba phân tử - và chỉ vậy thôi, bởi không làm khác được. 1) Hãy biểu diễn công thức Lewis cho các phân tử N2, O2 và NO –chỉ ra phân tử duy nhất nên có một electron chưa liên kết. Số lượng các electron chưa ghép đôi quyết định liệu một phân tử có tính nghịch hay thuận từ. Do thực nghiệm chỉ ra rằng hai trong số các phân tử đã đề cập ở trên có tính thuận từ, bạn cần “sang số” và xem xét các orbital phân tử.
2) Hình trên biểu diễn các giản đồ MO chưa bị chiếm. Hãy bổ sung các kí hiệu nguyên tố, điền các electron vào MO thích hợp, chỉ ra
169 | Olympiad Hóa học các quốc gia trên thế giới

bậc liên kết cho mỗi phân tử và xác định liệu chúng có tính nghịch hay thuận từ.
B. Ion phân tử có kích thước trung bình
Anion dichromate Cr2O72- rất phổ biến trong Hóa học Phân tích. Bộ khung hóa trị có tính đối xứng nên trong phần sau, chúng tôi chỉ muốn xét đến phần bên trái (với điện tích âm) và viết tắt phần bên phải là X.

3) Dự đoán cấu hình (dạng hình học phân tử) theo thuyết VSEPR cho
a) nguyên tử Cr. b) nguyên tử O số 4.
4) Biểu diễn ba công thức cộng hưởng giới hạn của phần bên trái để chứng minh rằng ba liên kết Cr-O tương đương (bằng nhau). Sử dụng kí hiệu viết tắt X. Biểu diễn sự “nhảy” của các cặp electron bởi các mũi tên phù hợp.
5) Trong dichromate có hai loại liên kết C-O với độ dài khác nhau, cụ thể là 179 pm và 163 pm. Dự đoán đâu là độ dài của a) liên kết Cr-O4 . b) liên kết Cr-O3 .
6) Dẫn ra cấu hình electron hoàn chỉnh của
a) chromium (6 spin chưa liên kết). b) chromium(III).
170 | Olympiad Hóa học các quốc gia trên thế giới
C. Phân tử lớn và mảnh cấu trúc của nó
Retinal là chất mang màu trong các protein nhạy quang, đặc biệt là trong rhodopsin, sắc tố nhạy cảm với ánh sáng ở võng mạc mắt. Hãy nhìn vào cấu trúc, bạn sẽ thấy một hệ electron π mở rộng.

Hình 1 Hình 2
Trước tiên, hãy nhìn vào phần được vẽ lại ở Hình 2.
7) Xác định tên gọi (hình 2) theo danh pháp IUPAC, bao gồm cả các kí hiệu mô tả lập thể cần thiết.
Dưới đây là 6 orbital phân tử tính toán được của phân tử được cắt ra trên.
Hình 3. Orbital phân tử.
8) Phân tử được quan sát theo góc nhìn (1, 2, 3, 4) nào như trong hình 2?
9) Sắp xếp các orbital phân tử trong hình 3 theo trình tự tăng dần năng lượng.
171 | Olympiad Hóa học các quốc gia trên thế giới
10)Xác định liệu (A) và (F) là các orbital phân tử σ hay π?
11)Một trong các orbital phân tử đã cho là HOMO, một là LUMO. Hãy chỉ ra đó là các orbital phân tử nào?
Khi nhìn vào hình minh họa của all-trans retinal, một ý tưởng có thể xuất hiện là “xem rằng tất cả các electron π như những vi hạt trong hộp thế”. Tính toán theo mô hình phân tử sẽ cung cấp độ dài của hộp thế được xét đến như dưới đây:
12)Xác định số electron π trong hộp thế này.

13)Tính bước sóng (nm) tương ứng với bước chuyển HOMO-LUMO theo mô hình vi hạt trong hộp thế
14)Thực tế, all-trans retinal khi hòa tan trong hexane sẽ thể hiện cực đại hấp thụ ở 380 nm. Theo đó, có thể đánh giá rằng hộp thế được xét đến ở đây là: (a) quá ngắn; hay (b) quá dài?
Khi khử hóa nhóm carbonyl sẽ tạo thành all-trans retinol, dẫn đến sự thay đổi trong hệ electron π. Cực đại hấp thụ của nó dịch chuyển theo một hướng khoảng 55 nm so với của all-trans retinal (λmax = 380 nm). Một trong các đường cong dưới đây là của retinal, còn một đường là của retinol.
172 | Olympiad Hóa học các quốc gia trên thế giới
15)Xác định đường cong nào tương ứng với all-trans retinol.
16)Bước sóng tương ứng với khoảng cách giữa hai vạch kề nhau trên trục hoành (trục x) là
1) 5 nm. 2) 10 nm. 3) 15 nm 4) 20 nm. 5) 25 nm.
17)Xác định các giá trị ở x và y theo nm. Xác định được hệ số hấp phụ mol của all-trans retinol ở cực đại hấp phụ là ε = 52700 L mol 1cm 1
18)Hãy tính nồng độ mẫu có độ hấp thụ trong cuvette 1 cm là A = 0.445.

D. Tính thơm?
Như đã biết, benzene tuân theo quy tắc Hückel. Theo quy tắc này, các phân tử, ion dạng vòng khác cũng có thể thể hiện tính bền hóa thơm. Dưới đây là 9 cấu trúc thơm với số electron π hoặc điện tích được chỉ rõ.
19)Hoàn thành công thức bằng cách viết số electron π vào hình tròn trống hoặc điện tích vào hình chữ nhật trống.
173 | Olympiad Hóa học các quốc gia trên thế giới
Đôi khi, borazine B3N3H6 được gọi là “benzene vô cơ” do nó cũng có hình dạng lục giác (dù rằng chỉ có một trục quay bậc ba). 20)Hãy vẽ ba công thức cộng hưởng giới hạn của borazine (chỉ rõ các điện tích hình thức và các cặp electron chưa liên kết) để chứng minh rằng ba liên kết B-N tương đương (bằng nhau).
174 | Olympiad Hóa học các quốc gia trên thế giới



177 | Olympiad Hóa học các quốc gia trên thế giới
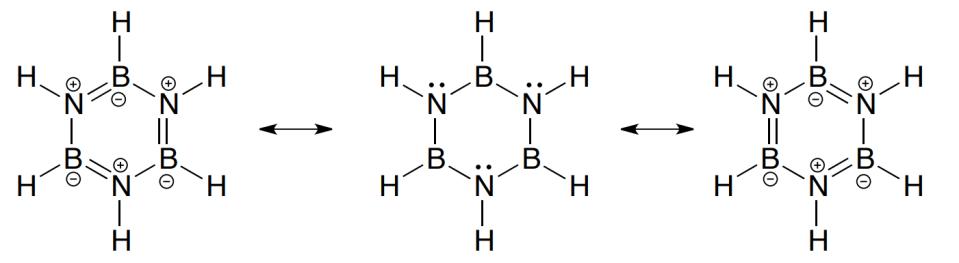

Câu 2: Hóa học hữu cơ ở thời La Mã cổ đại
A. Một số phản ứng hữu cơ
- Phổ 1H NMR (đo trong CDCl3) của B, I, G được cho dưới đây.

- Trong phản ứng 1, nước tạo thành ở dạng sản phẩm phụ.
- Chất E là đồng phân E
- Phổ 1H NMR của chất B:
178 | Olympiad Hóa học các quốc gia trên thế giới
- Dữ kiện 1H NMR của chất I: 1.53 ppm (mũi đơn, rộng, 1H); 1.49 ppm (mũi bội, 4H); 1.13 ppm (mũi đơn, 3H); 0.90 ppm (mũi ba, 6H).
- Dữ kiện 1H NMR của chất G chỉ có duy nhất một mũi đơn với cường độ tích phân bằng 6 ở 2.34 ppm.
1) Xác định tên gọi theo danh pháp IUPAC của chất đầu.
2) Biểu diễn cấu tạo của các chất A – I và cấu trúc của E.
3) Với phản ứng 1, hãy viết ra hai bước đầu của cơ chế phản ứng (không có bất kì quá trình xúc tác nào). Sử dụng các mũi tên để biểu diễn sự “chuyển dời” các cặp electron. Chỉ rõ tất cả các cặp electron chưa liên kết trong các cấu tạo. Cho biết phản ứng diễn ra theo kiểu cơ chế nào.
B. Molnupiravir
Molnupiravir là loại thuốc kháng virus, sử dụng qua đường miệng, được dùng trong điều trị COVID-19. Từ 4 tháng 11 năm 2021, loại thuốc này đã được chính quyền Vương quốc Anh phê duyệt có điều kiện để điều trị cho những bệnh nhân có nguy cơ cao và người cao tuổi. Cho đến tháng Tư, 2022, molnupiravir vẫn không được phê duyệt ở châu Âu. Cơ quan Y tế châu Âu (EMA) đã hỗ trợ sử dụng trong các tình huống khẩn cấp, tức là với những bệnh nhân COVID19 có tình trạng bệnh nghiêm trọng hơn, không tự thở được. 4) Biểu diễn cấu tạo và gọi tên theo danh pháp IUPAC của acid có thể dùng để điều chế loại thuốc này bởi phản ứng ester hóa.
179 | Olympiad Hóa học các quốc gia trên thế giới
C. Tổng hợp cantharidin
Cantharidin là terpenoid trong dịch tiết của bọ cánh cứng ở dạng chất phòng vệ hoặc pheromone giới tính, tùy vào loài. Ngày nay, chúng ta biết rằng đây là độc chất rất mạnh, ngay cả khi nó được cho là có tác dụng kích thích khả năng tình dục. Theo các ghi chép chiến tranh, chất này được xem là một trong những nguyên nhân làm suy tàn đội quân của Napoleon trong chiến dịch ở Ai Cập. Những con ếch đã ăn các loài bọ cánh cứng rồi chúng lại trở thành thức ăn của những người lính Pháp, và trong chuỗi thức ăn này đã có sự tích tụ sinh học của độc chất.
Trong bài này, chúng ta xem xét chi tiết hơn quy trình tổng hợp cantharidin do nhà hóa học Bỉ Gilbert Stork công bố vào năm 1951:
- Kí hiệu viết tắt: Me = methyl, Ph = phenyl.
180 | Olympiad Hóa học các quốc gia trên thế giới
- Phản ứng 1 và bước thứ hai trong phản ứng 2 đều là phản ứng Diels-Alder (cộng đóng vòng 4+2).
- Phản ứng hydrogen hóa xúc tác trong phản ứng 2 chỉ diễn ra ở liên kết đôi “dễ tiếp cận hơn”.
- I phản ứng với DNPH (2,4-dinitrophenylhydrazine) tạo thành kết tủa.
5) Cho biết tên gọi của các nhóm chức trong:
- chất đầu B
- sản phẩm N, được tạo thành từ bước 12.
6) Xác định cấu hình hóa lập thể của các hợp chất C, D, E, F, G, X, I, J, K và M Không biểu diễn các vòng phẳng, nhưng có thể dựa vào các cấu trúc đã cho trong sơ đồ phản ứng làm chỉ dẫn.
7) Cho biết các phản ứng 4, 8, 9 diễn ra theo cơ chế nào.
8) Cho biết tác nhân “NaSC2H5” trong phản ứng 5 là nucleophile, gốc hay electrophile và xác định tâm hoạt tính.
9) Sắp xếp các nhóm thế CF3SO3-, HO-, CH3SO3- theo trình tự nhóm rời đi kém nhất đến tốt nhất.
10)Biểu diễn tiểu phân hoạt động đầu tiên được tạo thành từ I trong phản ứng 8. Sử dụng các mũi tên trong cấu trúc này để chỉ ra sự diễn tiến tiếp theo của cơ chế phản ứng.
181 | Olympiad Hóa học các quốc gia trên thế giới
D. Tổng hợp (Z)-Jasmon
Jasmone là nguyên nhân tạo ra mùi thơm của hoa nhài, được người
La Mãn cổ đại dùng làm nước hoa. Theo quan điểm hóa học, jasmone có thể được xem là thuộc loại cyclopentenone
- G là trung gian trước khi tạo thành vòng.
- Hãy nhó rằng các β-carbonyl carboxylic acid dễ bị decarboxyl hóa trong môi trường base lẫn acid.
- Trong bước C → D, C bị deproton hóa.
- Trong bước cuối của sơ đồ tổng hợp, diễn ra phản ứng cộng aldol tạo thành vòng cyclopentenone.
- Phổ 1H NMR của H có nhiều tín hiệu, nhưng chỉ hai trong đó có cường độ tích phân bằng ba, cụ thể là một mũi đơn (2.2 ppm) và một mũi ba (1.1 ppm).
11)Biểu diễn chất phản ứng A và khoanh tròn proton có giá trị pKaa nhỏ nhất.
12)Biểu diễn cấu tạo của các chất B, C, D, E và H ((Z)-Jasmone). Chỉ rõ hóa lập thể khi cần thiết (và có thể).
182
|
Olympiad Hóa học các quốc gia trên thế giới
E. Sự tự ghép nối trong các protein
Liệu rằng để tồn tại được đến ngày nay, có phải loài người đã mắc nợ những loại đậu giàu-protein – thứ đã giúp cho tổ tiên chúng ta ở châu Âu không bị chết đói? Đối với người La Mã, các loại đậu có vai trò lớn đến nhường nào được thể hiện qua sự thật rằng bốn dòng họ La Mã quan trọng nhất được đặt tên theo họ đậu: Fabius (đặt theo tên đậu fava, hay đậu tằm, đậu răng ngựa), Lentulus (đặt theo tên đậu lentil, hay đậu lăng), Piso (đặt theo tên đậu pea, hay đậu Hà Lan) và Cicero (đặt theo tên đậu chickpea, hay đậu gà). Đáng tiếc rằng, cùng với sự suy tàn của Đế quốc La Mã, những kiến thức và tầm quan trọng của các họ đậu này cũng biến mất. Mãi sau này, đậu mới lại đóng vai trò quan trọng và đảm bảo chất dinh dưỡng cho chúng ta.
Sự tự ghép nối protein được khám phá lần đầu tiên vào năm 1990. Theo đó, có sự tạo thành các trung gian thioester A. Ngày nay, nó cũng được ứng dụng trong tổng hợp peptide.
13)Xác định cấu trúc của A. Vẽ các mũi tên trong cấu trúc chất đầu để biểu diễn sự diễn tiến của cơ chế.
14)Cho biết tên gọi của nhóm chức được khoanh tròn ở trên.
183 | Olympiad Hóa học các quốc gia trên thế giới

8) Nucleophile NaSC2H5 9) HO– < CH3SO3– < CF3SO3–10) 11) 12)
186 | Olympiad Hóa học các quốc gia trên thế giới

14) Carboxylic acid amide.
187 | Olympiad Hóa học các quốc gia trên thế giới

Câu 3: Nhiệt động học của quá trình Solvay
Quá trình Solvay Các nguyên liệu đầu để tổng hợp soda (sodium carbonate) là sodium chloride và calcium carbonate. Đáng tiếc là phản ứng trong dung dịch nước diễn theo hướng không mong muốn, cụ thể là: ++ 2323NaCOCaCl2 NaClCaC1 OR Một giải pháp cho vấn đề này là sử dụng phản ứng nhiều bước, được trình bày như trong sơ đồ dưới đây. Phương pháp này do Ernest Solvay phát triển. Các hình tròn đại diện cho các phản ứng.

1) Viết phương trình các phản ứng 1, 2, 3, 4 và bằng các kết hợp phù hợp các phản ứng trên, hãy chứng minh rằng phản ứng tổng của quá trình Solvay tương ứng với phản ứng mong đợi (ngược với R1).
Bạn có th
188 | Olympiad Hóa học các quốc gia trên thế giới
3) Dẫn ra biểu thức hằng số cân bằng Kp.
4) Tính o rG ở 298 K.
5) Xác định hai đại lượng (A) và (B) còn thiếu trong bảng. o rH kJ·mol-1
o rG kJ·mol-1
oS J·mol-1·K-1 pC J·mol-1·K-1 H2(g) 0.0 130.7 28.80 H2O(g) -241.8 (A) 188.8 33.60 O2(g) 0.0 205.2 29.40 CHNaO3(s) -950.8 (B) 101.7 87.60 CNa2O3 -1131 -1045 138.9 112.3 CO2(g) -393.5 -394.4 213.8 37.10 Dữ liệu nhiệt động học từ sổ tay CRC Trong quá trình công nghiệp, phản ứng được tiến hành ở 180 oC (khoảng 453 K). Ở nhiệt độ này, áp suất hơi nước bão hòa đã là khoảng 1001.9 kPa, có nghĩa rằng sự ngưng tụ sẽ bắt đầu ngay khi áp suất hơi riêng phần của nước vượt giá trị này.
6) Tính giá trị Kp ở 453 K, giả sử rằng o rH là hằng số.
7) Tính áp suất riêng phần khi cân bằng trên hỗn hợp phản ứng vẫn khô ở nhiệt độ này, nghĩa là khi hơi nước đã đạt tới áp suất bão hòa của nó. Hãy cống hiến hết mình cho những nỗ lực của nhân loại trong tương lai trên các hành tinh khác! Ví dụ như một nhà máy Solvay trên Sao Kim thì sao? Các điều kiện vận hành sẽ rất thú vị: Áp suất khí quyển chỉ chứa 20 ppm H2O nhưng đến 96.5% (V/V) CO2 và toàn bộ đều ở áp suất pges = 92 bar. Ngoài ra, nhiệt độ trung bình là 737 K.
Hãy tính oo rr H và S của phản ứng R2 trên Sao Kim, xem rằng Cp không phụ thuộc vào nhiệt độ.
Xác định xem liệu NaHCO3 có phân hủy tự diễn trên Sao Kim theo phương trình R2 hay không.
189 | Olympiad Hóa học các quốc gia trên thế giới
Câu 4: Hóa lập thể của lysergic acid
A. Hóa lập thể của lysergic acid
Lysergic acid A là tiền chất của nhiều ergoline alkaloid và từng được sử dụng làm thuốc kích thích chuyển dạ. Dẫn xuất nổi tiếng nhất là lysergic acid diethylamide, hay thường viết tắt là LSD.
1) Chỉ ra các tâm lập thể của lysergic acid trong công thức cấu tạo trên và cho biết lysergic acid có thể tồn tại bao nhiêu đồng phân lập thể?
2) Tất cả các tâm lập thể của lysergic acid đều có cấu hình R. Hãy biểu diễn cấu trúc của lysergic acid với hóa lập thể chính xác.
B. Tổng hợp lysergic acid
Woodward đã thực hiện được quy trình tổng hợp toàn phần đầu tiên của lysergic acid (racemic) từ năm 1956. Năm 2011, Fujii và Ohno đã công bố một quy trình tổng hợp chọn lọc đối quang với giai đoạn then chốt là phản ứng vòng hóa domino xúc tác bởi palladium. Chất đầu cho giai đoạn then chốt này là allene thủ tính G. Allene G có thể được điều chế từ propargylic alcohol sử dụng phương pháp do Myers phát triển năm 1996. Sau đây là nguyên lí của phương pháp này.
192 | Olympiad Hóa học các quốc gia trên thế giới
Phương pháp Myers:
3) Dẫn ra kí hiệu mô tả lập thể phù hợp cho D.
Quy trình tổng hợp allene thủ tính G
(X = halogen, TsOH = Me-Ph-SO3H, DEAD = diethylazodicarboxylate (EtOCO)2N2)

4) Biểu diễn cấu trúc trung gian F với hóa lập thể phù hợp.
5) Biêu diễn cấu trúc allene thủ tính G với hóa lập thể phù hợp. Trong phổ khối lượng sau, bạn có thể thấy sự phân bố đồng vị phân của propargylic alcohol E. Khoảng cách giữa các tín hiệu riêng biệt trong mỗi trường hợp là 1.
193 | Olympiad Hóa học các quốc gia trên thế giới
6) Dựa vào phân bố đồng vị phân, hãy xác định halogen X trong E. Hướng dẫn
1) 2 tâm lập thể, tương ứng với 4 đồng phân lập thể khả dĩ. 2) 3) aR 4)
194 | Olympiad Hóa học các quốc gia trên thế giới
7) Bromine.
195 | Olympiad Hóa học các quốc gia trên thế giới
Câu 5: Cs và Co
A. Cesium Chloride
Phản ứng của cesium với khí chlorine tỏa nhiệt mạnh. Enthalpy tạo thành chuẩn của cesium chloride là –443 kJ·mol-1. Dưới đây là các dữ kiện vật lí khác liên quan đến cesium và chlorine: ▪
Enthalpy thăng hoa của Cs: +78.0 kJ·mol-1 .
Năng lượng ion hóa thứ nhất của Cs: 3.89 eV ▪
Năng lượng ion hóa thứ hai của Cs: 23.16 eV ▪
Năng lượng phân li của Cl2: 243 kJ·mol-1 ▪ Ái lực electron của Cl: 3.62 eV
1) Tính năng lượng mạng lưới của CsCl. (Gợi ý: hãy vẽ chu trình Born-Haber).
2) Cần nhân giá trị năng lượng mạng lưới của CsCl với hệ số bao nhiêu để ước tính năng lượng mạng lưới của BaO?
Trong kĩ thuật phổ hấp thụ nguyên tử (AAS), cesium chloride được sử dụng làm dung dịch đệm ion hóa để chống lại sự ion hóa các kim loại dễ nhường electron. Trong trường hợp này, cesium chloride phù hợp hơn potassium chloride.
3) Phát biểu nào sau đây không đúng:
A. Bán kính ion của K+ nhỏ hơn của Cs+ .
B. Bán kính của Cs+ được hydrate hóa nhỏ hơn của K+ được hydrate hóa.
C. Ion Cs+ làm tăng pH của dung dịch.
D. Do đặc trưng cộng hóa trị của liên kết giữa các ion Cs+ và Clnên CsCl phù hợp làm dung dịch đệm ion hóa cho kĩ thuật AAS hơn potassium chloride.
Một sinh viên tên L. rất hứng thú với những phản ứng tỏa nhiệt mạnh. Để điều chế cesium chloride (dĩ nhiên là phải tuân thủ toàn bộ các biện pháp phòng ngừa an toàn), cậu đã cho một lượng nhỏ đơn chất cesium vào cốc nước (1). Một tiếng nổ nhỏ xuất hiện (2). Sau đó., cậu trung hòa dung dịch tạo thành bởi acid phù hợp (3).
196 | Olympiad Hóa học các quốc gia trên thế giới
4) Viết phương trình các phản ứng (1) – (3), chỉ rõ trạng thái tập hợp của các chất phản ứng và sản phẩm (s, l, g, aq). Sau khi làm bay hơi dung dịch, chất rắn tạo thành kết tinh theo cấu trúc lập phương với một ion Cl- ở mỗi đỉnh và ion Cs+ ở trung tâm ô mạng đơn vị. Các bán kính ion r+ = 169 pm; r–= 181 pm.
5) Ô mạng đơn vị này thuộc kiểu mạng Bravais nào:
A. Lập phương đơn giản.
B. Lập phương tâm khối.
C. Lập phương tâm diện.
6) Tính hằng số mạng a.
Tiến hành nhiễu xạ tia X với một đơn tinh thể cesium chloride bởi nguồn nhiễu xạ có bước sóng 71.0 pm, đo được góc phản xạ 2 của mặt (1 0 0) là 10.00o
7) Sử dụng định luật Bragg để tính toán và kiểm chứng lại giá trị hằng số mạng tính được ở ý 6. Mỏ Tanco là mỏ khoáng chất cesium-lithium-tantalum nằm ở Hồ Bernic, Manitoba, Canada. Mỏ quặng chứa nhiều thân quặng granitic pegmatite. Tại đây, người ta khai thác spodumene (quặng lithium), wodginite (quặng tantalum) và từ năm 1992 là cả pollucite (quặng cesium). Pollucite là khoáng chất thuộc họ aluminosilicate. Nó kết tinh theo hệ tinh thể lập phương, với công thức ( )224122 Cs,NaAlSiO·HO. Cấu trúc của các họ khoáng silicate phổ biến được đưa ra trong hình dưới đây:
197 | Olympiad Hóa học các quốc gia trên thế giới

8) Xác định tỉ lệ Si-O và tên gọi mỗi họ khoáng silicate a – f.
9) Pollucite thuộc họ khoáng silicate nào kể trên?
Lepidolite là một khoáng chất aluminosilicate hiếm khác, cũng chứa cesium, có công thức ( ) 0...60...2210 4 KCsAlF|Si,AlO . Nó tồn tại chủ yếu ở dạng các khối khoáng màu trắng, xám-tím, cho đến màu hồng. Màu hồng tạo nên bởi một lượng Mn2+ thấp.



10)Lepidolite thuộc họ khoáng silicate nào kể trên? 11)Dẫn ra tất cả các công thức có thể có về mặt lí thuyết của lepidolite với điều kiện như sau: Phải có ít nhất 3 Si và ít nhất 1 Cs trong công thức. Silicate 1 Silicate 2 12)Cho biết hình ảnh nào ở trên là của khoáng pollucite và của khoáng lepidolite.
198 | Olympiad Hóa học các quốc gia trên thế giới
B. Các phức chất của cobalt
Khi thêm dung dịch ammonia vào dung dịch hexaaquacobalt(II) chloride, ban đầu xuất hiện kết tủa cobalt(II) hydroxide (1) – chất này bị hòa tan và tạo thành các phức chất ammine cobalt(III) trong ammonia dư và ammonium chloride trong khí quyển oxygen (đóng vai trò chất oxid hóa). Cụ thể, có hexaamminecobalt(III) chloride (2) màu vàng-cam được tạo thành, ngoài ra còn có tetraammine dichloridocobalt(III) chloride.
13)Viết phương trình ion của các phản ứng 1 và 2
14)Biểu diễn hai xuyên lập thể phân (đồng phân dia) của tetraamminedichloridocobalt(III).
15)Xác định trạng thái lai hóa của ion Co trung tâm trong tetraamminedichloridocobalt(III).
16)Hãy vẽ hai giản đồ orbital d bị chiếm theo thuyết trường phối tử cho các trường hợp phức chất spin-cao và spin-thấp.
17)Tính moment từ theo Bohr magneton cho các trường hợp spincao và spin-thấp của phức tetraammine dichloridocobalt(III).
Năm 1963, Junnosuke Fujita và Yoichi Shimura đã công bố các phố hấp thụ của cis-[Co(CN)2en2]+ (A), [Co(CN)6]3- (B), [Coen3]3+ (C) và [Co(CN)5SO3]4-(D):
199 | Olympiad Hóa học các quốc gia trên thế giới
18)Xác định phổ đồ (1 – 4) tương ứng với mỗi phức chất A – D.
200 | Olympiad Hóa học các quốc gia trên thế giới

Spin thấp: = B 0 μ
18) Phổ đồ 1: B Phổ đồ 2: A
Phổ đồ 3: C Phổ đồ 4: D
203 | Olympiad Hóa học các quốc gia trên thế giới
Câu 6: Sự tạo thành và phân hủy hydrogen iodide
Vào cuối thế kỉ 19, Bodenstein đã thực hiện các phép đo động học với hydrogen iodide. Ông đã kết luận rằng cả quá trình tạo thành và phân hủy đều là phản ứng lưỡng phân tử và có thể xác định được năng lượng hoạt hóa của các quá trình tạo thành A,fE và phân hủy A,dE của hydrogen iodide: ( ) + == 22 11 A,fA,d
1HI2HI E167 kJmol; E184 kJmol
1) Sự phân hủy hydrogen iodide tuân theo quy luật động học A. bậc 0. B. bậc 1. C. bậc 2. 2) Các dữ kiện sau được đo ở 556 K: t/h 0 1 2 5 [HI]/mol·mL-1 1.000 0.441 0.283 0.136 ln[HI] 0.000 -0.817 -1.261 -1.991 1 HI 1.000 2.265 3.531 7.328 3) Xây dựng đồ thị để chứng minh rằng giả định về phản ứng lưỡng phân tử không mâu thuẫn với các kết quả đo được. 4) Xác định (chỉ rõ dấu) dung dịch ban đầu cần thay đổi bao nhiêu phần trăm để tốc độ phản ứng tăng lên gấp đôi?
5) Xác định hằng số tốc độ phản ứng, chỉ rõ đơn vị.
6) Tính hằng số tốc độ cho quá trình phân hủy ở 720 K. Các nghiên cứu về sau đã cho thấy rằng sự tạo thành hydrogen iodide không hoàn toàn đơn giản như suy nghĩ ban đầu. Có thể chỉ ra rằng các phản ứng sơ cấp sau đây đóng vai trò quan trọng trong sự tạo thành hydrogen iodide:
204 | Olympiad Hóa học các quốc gia trên thế giới
Xác định biểu thức tốc độ dạng vi phân cho [HI] và [H2]. Các phản ứng (2) và (3) bao gồm các cân bằng thuận nghịch cực kì nhanh, do đó có thể xem rằng 423kk,k và các nồng độ các trung gian trong cân bằng có thể được xác định bởi các hằng số cân bằng tương ứng.
7) Biểu diễn [IH2] theo các hằng số cân bằng K2, K3 và các nồng độ [H2], [I2]. Dưới điều kiện cân bằng thuận nghịch, hằng số tốc độ của phản ứng tạo thành hydrogen iodide (1) có thể được mô tả như sau:
ges22 dHI 1 vkHI 2dt
8) Xác định các bậc phản ứng a, b và thiết lập mối liên hệ giữa kges và hằng số tốc độ của các bước sơ cấp.
205 | Olympiad Hóa học các quốc gia trên thế giới

Câu 7: Các cân bằng thủy ngân
Hòa tan hoàn toàn 0.0500 g mercury(II) oxide vào 1.00 L nước.
1) Viết phương trình phản ứng giữa mercury(II) oxide và tính pH của dung dịch tạo thành. Trong các hợp chất, thủy ngân thường có hóa trị II (như trong ion Hg2+) và hóa trị I. Thủy phân hóa trị I thường hiện diện ở dạng cụm lưỡng nguyên tử, nên ion được viết ở dạng Hg22+. Theo đó, các muối sẽ có công thức kiểu như Hg2Cl2 và Hg2I2. Cho biết các giá trị thế khử sau ở pH = 0: ++ +
22o 2 2o 2
+= +=
1 HgeHgE0.911 2V 1HgeHgE0.796 2V
2) Tính thế khử chuẩn: + + 2 Hg2eHg. Ion mercury(I) cũng có thể tự oxid hóa-khử: ++ + 22 2 HgHgHg.
3) Tính hằng số cân bằng phản ứng tự oxid hóa-khử dựa vào các giá trị thế khử đã cho.
Cho dung dịch mercury(II) nitrate (0.0100 mol/L) phản ứng với lượng dư đơn chất thủy ngân.
4) Sử dụng kết quả cho ở ý trước, hãy tính nồng độ các ion Hg2+ và Hg22+ trong dung dịch. Nếu bạn không xác định được hằng số cân bằng, hãy sử dụng giá trị K = 0.012.
Cho biết tích số tan của Hg2F2 là 3.10·10-6
5) Tính thế chuẩn của phản ứng: ++ 22HgF 2e2Hg 2F
208 | Olympiad Hóa học các quốc gia trên thế giới
Cho 1.00 g NaOH rắn vào 1.00 L dung dịch mercury(II) nitrate (0.0100 mol/L) thì có hai phức chất khác nhau được tạo thành, với các hằng số tạo thành phức chất được cho như sau: ( ) ( )
+ = =
HgOH 2.0010 HgOH 5.0110
10 1 21 22
Với các tính toán tiếp theo, hãy giả định rằng không có kết tủa tạo thành và số oxid hóa của thủy ngân không thay đổi.
6) Tính pH của dung dịch tạo thành và nồng độ của tất cả các tiểu phân thủy ngân hiện diện trong dung dịch.
209 | Olympiad Hóa học các quốc gia trên thế giới

