12 minute read
A HPV szerepe az orális daganatokban
Dr. Várnai Gusztáv és Várnai Renáta
A HPV SZEREPE AZ ORÁLIS DAGANATOKBAN
Advertisement
Bevezetés
Az 1970-es évekig a humán papillomavírusok nem keltettek különösebb érdeklődést, csupán a közönséges szemölcsök, e jóindulatú bőrdaganatok okaként tartották őket számon. Az 1980-as évektől ismerték fel szerepüket a méhnyakrák és egyéb, nemi szerv környéki daganatok, a fej-nyak, valamint számos egyéb bőr-, nyálkahártya-eredetű rosszindulatú tumorok kiváltásában (Rozgonyi Ferenc, Kónya József: Orális mikrobiológia, immunitástan, diagnosztika és infekciókontroll. Medicina, 2007).
A humán papillomavírusok (HPV) a Papillomaviridae víruscsalád tagjai, számos fajuk ismert. Az elnevezésük gazdaspecificitáson alapszik, így az emberi típusokat humán papillomavírusoknak nevezzük. A filogenetikai osztályozás, fajbesorolás, valamint típusmeghatározás az L1 génszekvenciák összehasonlításán alapszik, s mind a specieseket, mind a típusokat számmal jelöljük. A klinikai virológiában azonban csak a típusok használatosak. A virion 55 nm átmérőjű, kubikális szimmetriával rendelkezik, peplon nem veszi körül. A genom kettős szálú cirkuláris DNS. Több mint 150 genotípusát ismerjük, amelyek a többrétegű laphámot fertőzik meg, elszarusodással járó kórképet hoznak létre.
A HPV patomechanizmusa
A vírusok a többrétegű hámok bazális sejtjeit fertőzik, s a sejtmagban zajló replikáció a hámsejtek differenciálódásához kötött, azok stratum granulosumában történik, ahol fiziológiásan már nem lenne DNS-szintézis. A képződött vírusrészecskék végül a legfelső hámréteg leváló sejtjeivel együtt ürülnek. A vírusnak tehát a megsokszorozódásához a sejtet olyan állapotba kell juttatnia, amelyben a DNS-szintézis lehetséges. Ezt különböző géntermékeivel (E6, E7 fehérjék) sikerül megtenni, s a sejtciklus G0-1 fázisában tartózkodó sejtet az S fázisba irányítja. Az eltérő típusú HPV E6 és E7 géntermékei mind szekvenciájukban, mind biológiai tulajdonságaikban különböznek, így a sejtciklusra sem gyakorolnak azonos erősségű hatást. Ezen különbségekből eredően, valamint nőgyógyászati kórképek alapján eltérő onkogén kockázatú csoportokba soroljuk. Aszerint, hogy milyen mértékben társíthatók rosszindulatú daganatok kialakulásával, alacsony vagy magas rizikójú HPV-nak nevezzük őket. Magas kockázatú típusok például a HPV 16, 18, 31, 33, 35, míg alacsony kockázatúak a HPV 6, 11, 40, 42 (Kónya, 2011).
Egyik fő csoportjuk a bőrt, míg másik csoportjuk a nyálkahártyát fertőzi meg. A kután HPV-k közül az 5-ös és a 8-as magas onkogenitású vírusok, amelyek kimondottan az epidermoplasia verruciformis nevű ritka betegséghez társulnak. Ha ezt a léziót napfénynek tesszük ki, akkor rosszindulatú bőrtumorrá alakul (Pass és mtsai, 1977). Ez a képesség az immunvédekezésükben meggyengült betegekben kifejezettebb (Schmanin és mtsai, 1996). Elgondolkodtató az az adat, hogy a rák szempontjából alacsony kockázatú HPV 6-os, 11-es típusok a szexuálisan aktív népesség magas százalékában kimutathatók. Immunszuppresszió következtében (AIDS, transzplantáció, gyógyszeres kezelés, veleszületett immunhiány) azonban akár malignus daganatot, rákot is okozhatnak ezen alacsony rizikójú HPV-típusok.
Ismert tény, hogy a kután HPV-vel fertőzött sejtek UV sugárzás hatására már kevéssé képesek apoptotikus sejtelhalásra (Jackson és mtsai, 2000). Ezért vezetnek a további sejtosztódások a sérült DNS-sel rendelkező sejtek felszaporodásához. A folyamat elindításához szükség van a vírusokra, a fenntartásához már nem.
A mukozális HPV-ket szintén alacsony és magas rizikójú csoportokba osztották be. Az alacsony rizikójúak (6, 11) hiperkeratózissal járó elváltozásokat hoznak létre, köztük a genitalis szemölcsöt (condyloma acuminatum). A magas rizikójúak (16, 18) okozta nyálkahártya-elváltozások a hiperkeratózis kiváltása után invazív laphámkarcinómába alakulhatnak át. Jelen tudásunk szerint az anogenitális régió rosszindulatú daganatai igazolt összefüggést mutatnak ezekkel a vírusokkal. Ezek közül a legerősebb asszociáció a cervix daganataival (90%) összefüggésben észlelhető (Alult, 2006).
Terjedésük közvetlen kontaktussal történik, s a hám mikrosérülésein keresztül jutnak be a bazális sejtekhez. Elsősorban szexuális kontaktussal terjed, a vírust tartalmazó váladék a genitális régión kívül az anális, orális és felső légúti nyálkahártyák területén vagy a bőrön is okozhat fertőzést. Az átfertőzöttség mértéke erősen korrelál a szexuális promiszkuitással, anogenitális infekción a populáció több mint 40%-a átesik. Az anyáról intrapartum módon az újszülött légútjaiba kerülhet (Kónya, 2011).
Az immunválasz lassan alakul ki, hatékonysága esetén a fertőzés tranziens. Ez a HPV esetében egy évet jelent. Ha az elimináció a szervezetből nem túl sikeres, perzisztens infekció jöhet létre a vírus többéves jelenlétével (Kónya, 2011).
A fertőzések nagy része tünetmentes vagy klinikailag nem vehető észre. Az eltérő rizikójú csoportok eltérő betegségeket okozhatnak. Az alacsony rizikójú HPV-k jóindulatú hámburjánzás és papilloma, condyloma acuminatum, enyhe fokú laphámsejtes intraepithelialis lézió, laryngealis papillomatosis, orális benignus leukoplákia formájában jelenhetnek meg, valamint a bőrön szemölcsök formájában. A magas kockázatú HPV-csoportok kialakíthatnak számos premalignus, malignus elváltozást, így súlyos laphámsejtes intraepithelialis léziót, planocelluláris karcinómát. A malignus daganatok megjelenhetnek a méhnyakon, vulván, péniszen, nyelvgyökön, tonsillán és a gégében is (Kónya, 2011).
HPV a szájüregben
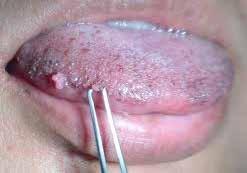
A szájüreg nyálkahártyája a humán papillomavírusok gyakori előfordulási helye. A benignus elváltozások közül az egyik leggyakoribb a papilloma.
A szájüreg papillomája bármely életkorban előfordulhat, elsősorban a nyelven, az ajkon, a pofanyálkahártyán, az ínyen és a szájpadláson található. Körülírt, szemölcsös felszínű, gyakran nyeles képlet, átmérője általában néhány mm. Színe halványvörös vagy szürkésfehér lehet, attól függően, hogy a felszínes szaruréteg mennyire vaskos. Szövettanilag a papilloma hosszú, vékony, kesztyűujjszerű nyúlványokból épül fel, melyek váza elágazó kötőszövetnyaláb. A nyúlványok felszínén hiperpláziás többrétegű laphám burjánzik, fokozottan kiszélesedett a spinocelluláris réteg. Hiperkeratózis látható. Nagyobb papillomákban a hámsejtek mérsékelt polimorfiája, fokozott sejtosztódási aktivitása fedezhető fel. Ennek ellenére a malignus elfajulás igen ritka. A papilloma nyelében és kötőszöveti vázban kapillárisok, valamint kereksejtes beszűrődések találhatók. Sebészi kimetszés során a papilloma nyelével együtt a bazális nyálkahártyát is el kell távolítani. Megfelelő műtéti eljárás után a kiújulás rendkívül ritka.
A verruca vulgaris szintén jóindulatú elváltozás, szájüregben az előfordulása ritka, inkább az ajkakon található, valamint az ujjakon, kézháton. Gyermekeken és fiatal felnőtteken gyakori elváltozás. Bőrfelszínből kiemelkedő lencsényi képlet, amely a hiperkeratózis miatt egyenetlen, kemény tapintatú. Színe szürkésfehér. Szövettanilag a felszínen tüskeszerű nyúlványokat képez. A fokozott hiperkeratózis miatt a szemölcsöt vaskos, lemezes szerkezetű, eozinofil keratinmassza borítja. A szemcséssejtes rétegben a hámsejtek magja zsugorodott (piknózis), továbbá perinuclearisan világos udvar alakul ki (koilocitózis). A sejtmagvakban vírusfertőzésre utaló zárványtestek is előfordulnak. A szemölcs spontán gyógyulásra hajlamos. A gyógyszeres kezelés és sebészi kimetszés szintén alkalmazható terápia.
A condyloma acuminatum főleg a meleg, nedves hámfelszíneken jelentkezik. Gyakori az anogenitális, valamint orális nyálkahártyákon. Immunhiányos állapotokban különösen gyakori.
A lézió több apró halványvörös, lapos papulával kezdődik, amelyek később összeolvadnak, széles alapú lágy, papilláris jellegű növedéket alkotnak. A felszínen az elszarusodás változó mértékű. Szövettanilag a papillomához hasonló nyúlványokat képez, vékony centrális kötőszöveti vázzal és hiperpláziás hámfelszínnel. A szaruréteg nem túl vastag, időnként piknotikus sejtmagvakat tartalmaz (parakeratózis). Sebészi kimetszés után gyakoriak a recidívák, ami a környező, morfológiailag épnek tűnő hám fertőzöttségével magyarázható. A korszerű inter-feronkezelés biztató eredményeket mutat (Suba, 2011).
A magas kockázatú típusok (HPV 16, 18, 31, 33, 35 stb.) malignus kórképeket alakítanak ki.
A HPV-fertőzés a szájüregben enyhe nyálkahártya-elváltozásokkal kezdődik, fájdalmatlan fehéres színű folt formájában jelentkezik, kezelés nélkül idővel kifekélyesedik.
A HPV-fertőzés hatására kialakuló szájüregi rákokra jellemző, hogy gyakrabban jelennek meg 50 éves kor alatt, gyakoribbak nőkben, valamint gyakoribbak nem dohányzókban és nem alkoholizálókban.
A szájnyálkahártya fertőzése legtöbbször orális szex útján következik be. A szájnyálkahártya különlegessége, hogy benne mind a genitális, mind a bőrinfekciókat okozó típusok megtelepedhetnek.
A szájüregi elváltozásokból komplikáltabb kimutatni a HPV-t, mint a nőgyógyászati vagy urológiai esetekben, s vagy az eltávolított kóros szövetből, előzetes szövettani vizsgálat után vagy PCR módszerrel lehet kimutatni.
A különböző vizsgálatok gyakran igen eltérő gyakoriságot igazolnak. A normál mukózában előforduló prevalenciaadatok nagyban függnek a kimutatásukra alkalmazott módszerektől. Több tanulmány adatain metaanalízist végezve megállapították, a normális orális mukóza sejtjei átlagosan 13,5%-ban bizonyultak pozitívnak, korcsoportra való tekintet nélkül (az egyes vizsgálatok 0–60% közötti értékeket tartalmaztak). 25,4%-ra emelkedett az átlag akkor, ha csak a PCR-rel igazolt eseteket számították. A nők aránya jellemzően magasabb volt. Összességében az egészséges személyek szájüregi nyálkahártyájában leggyakrabban a HPV 16, 18 magas kockázatú
Forrás: http://oralmaxillo-facialsurgery.blogspot. hu/2010/05/viral-infections-of-mouth-cont-2.html
típusok fordultak elő (együtt 53%-ban), míg az alacsony kockázatúak közül a HPV 6, 11 volt a legnagyobb gyakoriságú (együtt 42%). A HPV-k átlagos előfordulása a különböző szájüregi elváltozásokban emelkedett volt. Benignus leukoplákiában 14,8%, intraepithelialis neopláziában 18,5%, laphámkarcinómában 26,2%, verrucosus karcinómában 27% (Miller és White, 1996). Nagyon érzékeny PCR-t alkalmazva, a szájüreg nyálkahártyájának epithel sejtjeiben a minták 81,1%-ban mutatták ki a HPV DNSét (30 esetben a 37-ből), s az esetek 56,7%-ában több HPV-típus is jelen volt. A kópiaszám 10-1 és 10-4 kópia/sejt közötti értékeket mutatott, az átlag 10-3 kópia/sejt (Terai és mtsai, 1999). Házastársakat vizsgálva megállapították, hogy az egyik fél perzisztens orális HPV-fertőzése 10-szeresére emeli a kockázatát annak, hogy a másik társban is ugyanez kialakul. Ezek az adatok a humán papillomavírusok orális úton történő terjedését támasztják alá (Rintala és mtsai, 2006).
Egyes vizsgálatok szerint a HPV 16-os típusa a garatrákos betegek daganatainak 72%-ában volt jelen, azoknál pedig, akiknél a vérben ki lehetett mutatni a HPV ellen termelt antitestek jelenlétét, 58-szorosára nőtt a daganatok kialakulásának esélye.
A fertőzés a legtöbbször tünetmentes, több év is eltelhet, mire a kóros sejtburjánzás következtében daganatos elváltozás alakul ki.
Többszöri azonos típussal történő fertőzés a betegség, daganat kialakulásának esélyét növeli. A magas kockázatú HPV-ket a legnagyobb mértékben a tonsilla, illetve a nyelvgyök rosszindulatú daganataiban mutatták ki.
Klinikai tapasztalatok azt igazolták, hogy a HPV-pozitív daganatok érzékenyebbek a sugárkezelésre, és később adnak metasztázist (www.ncbi.nem.gov/ pmc/articles/pmc 2815356).
A karcinogenezis folyamatára jellemző, hogy a HPV genomja integrálódik a gazdasejt genomjába. Ezt az E6/E7 fehérjék expressziójának szabályozási zavara kíséri (Jeon és mtsai, 1995). A magas rizikójú HPV-k E6/E7 fehérjéinek megjelenése a gazdasejt apoptózisképtelenségét okozza, aminek a következménye lesz a humán keratinociták szövettani megjelenésének megváltozása: a magas rizikójú prekancerózus léziók képére jellemző tulajdonságokat veszik fel. Általában a folyamat nem progrediál egészen addig, míg más tumorkeltő faktorok meg nem jelennek, s hatásukat ki nem fejtik ezekre a sejtekre. A cervikális prekancerózisok esetében kimutatták, hogy kis dózisú ösztrogén hatására karcinóma alakul ki belőlük (Arbeit és mtsai, 1996).
A HPV daganatkeltő hatása tehát az E6/E7 onkoproteineknek azzal a képességével magyarázható, hogy képesek beavatkozni a sejt regulációs mechanizmusait szabályozó fehérjék működésébe. A p53 és a pRb (retinoblasztoma tumorszuppresszor protein) tumorszuppresszor fehérjék, melyek a normális sejtműködés részeként szabályozzák a sejtproliferációt, a differenciációt, valamint az apoptózist. Az E6 a p53, az E7 pedig a pRb működését gátolja, így okozza a sejtek korlátlan növekedését. Emellett a sejt DNS-stabilitása is csökkent. Az E7 onkoprotein a mitózis mechanizmusainak zavarát idézi elő (Sang és Barbarosa, 1992). Anafázisban a megkettőződött kromoszómák nem válnak szét, illetve időnként akár multipoláris mitózis is előfordulhat, ami a magas rizikójú laphámrákok egyik specifikus jellemzője.
A HPV kóroki szerepének bizonyítása kiemelt fontossággal bír, amennyiben preventív stratégiák kidolgozását teszi lehetővé. A HPV elleni vakcináció alkalmazható lehet a HPV-pozitív orális lichen karcinómák kialakulásának megelőzésére. Ennek egyre nagyobb a jelentősége, mivel epidemiológiai vizsgálatok alapján állítható, hogy a HPV-pozitív orális tumorok prevalenciája emelkedik (Ramquist és mtsai, 2011).
A vakcináció hatásának fokozására az IgA-termelés lehetséges útjait figyelembe kell venni. Az a tény, hogy a szelektív IgA-s betegek fele semmilyen, a megbetegedésre típusos tünetet nem mutat, rámutat arra a tényre, hogy a védekezés nem kizárólag az IgA segítségével történik. Ezeknek az alternatív utaknak a feltárása a vakcináció hatásfokának javításához vezethet. Az eddig alkalmazott vakcinák hátránya az, hogy a mukozális védekezést nem fokozzák, vagyis a kórokozók kolonizációját nem képesek befolyásolni. Mint több más kórokozó esetében, a HPV esetében is a kolonizáció gátlása lenne a legfontosabb.
A HPV elleni immunválasz kialakulásának szempontjából több tényező is akadályt jelent. Ezek közül kiemelten fontosak a HPV sajátosságaiból eredő alábbi tényezők: 1. A HPV-fertőzésnek nincs vér által közvetített szakasza. 2. A késői virális kapszid proteinek (L1, L2) expreszsziója limitált és késleltetett. 3. A HPV nem okozza a keratinociták lízisét. 4. Az E6 és E7 elnyomja a sejtmediálta immunválaszhoz szükséges interferonszignált. 5. Az antigénprezentáló sejtek (APC) nem aktiválódnak.
A cervikális HPV-fertőzés ellen ugyan kialakulhat immunválasz, a fertőzés után 6–12 hónappal, ennek létrejötte azonban lassú és gyenge, antitestválasz pedig nem minden nőben jön létre.
Az, hogy egy adott HPV-típus elleni antitestek védenek-e azonos vagy közeli típussal történő reinfekció ellen, nem bizonyultak egyértelműnek (Schaff, 2011).
A HPV okozta megbetegedésre speciális gyógyszer nincs. Nagyon fontos a megelőzés.
A HPV 6, 11, 16, 18 típusok ellen védőoltás létezik.
A rekombináns, kvadrivalens vakcina a 6, 11, 16, 18-as HPV-típusok L1-es kapszidjának nagy tisztaságú, vírusszerű részecskéiből készül. A vírusrészecskék nem tartalmaznak vírus-DNS-t, így nem képesek a sejteket megfertőzni, reprodukálódni, illetve be-
tegséget okozni. Kétféle védőoltás létezik, az egyik a HPV 16, 18, a másik pedig a HPV 6, 11, 16, 18 ellen nyújt védelmet.
A védettséghez három védőoltásra van szükség. (A második védőoltást az első után 2 hónappal kell beadni, a harmadikat pedig az első injekciótól számított 6 hónap múlva.)
Az USA-ban 23 millió vakcinát használtak fel. Százezer páciensből 54 tapasztalt mellékhatásként ájulást, émelygést, szédülést. A mellékhatások 6,2%-a volt komoly, összesen 32 haláleset történt. Több mint 40 esetben történt súlyos nem kívánt hatás, amikor fiatal lánygyermekeket közel egy időben oltottak HPV és meningitis ellen, ezekben az esetekben a védőoltásban részesülteknél Guillan–Barré-szindróma alakult ki (ez egy súlyos immunrendellenesség, fülzúgással, zsibbadásérzettel, valamint izombénulással társul).
A HPV elleni védőoltásokról összességében elmondható, hogy megfelelően alkalmazva súlyos mellékhatások rendkívül ritkán alakulnak ki. A vakcinát a szexuális élet megkezdése előtt ajánlott beadni, hogy megfelelő, hatékony védettséget nyújtson a különböző HPV-típusokkal szemben.

Összefoglalás
A humán papillomavírusok számos típusa ismert, rákkockázat szempontjából alacsony és magas onkogén kockázatú csoportokat különböztethetünk meg.
Az alacsony rizikójú csoportba tartozó típusok többnyire jóindulatú elváltozásokat képesek kialakítani a bőrön, valamint a nyálkahártyán. A nagyobb veszélyt a magas onkogén kockázatú típusok jelentik, melyek malignus elváltozások kialakulásához vezetnek, leggyakrabban a méhnyakon, de egyre többször fordulnak elő különböző szájüregi daganatokban.
Sajnos a vírus okozta megbetegedésre speciális gyógyszer nincs, ebből következően nagyon fontos a megelőzés, vagyis a prevenció.
A HPV egyes típusai (6, 11, 16, 18) ellen védőoltás létezik.
Rendkívül nagy jelentőségű volna, ha ezek a védőoltások – mint a primer prevenció eszközei – minden érintett személy számára hozzáférhetők lennének, s nem lenne financiális akadálya annak, hogy ki jut vakcinához, és ki nem.
Remélhetőleg a közeljövőben hazánkban is nagyobb hangsúlyt fog kapni a HPV okozta megbetegedések primer prevenciója, vagyis a védőoltások szélesebb körben lesznek alkalmazhatók. n
Forrás: http://divany.hu

PRÉMIUM FÉNYESÍTÔ ÉS FOGFEHÉRÍTÔ FOGKRÉMEK
A egyszerû és gyengéd fogfehérítés a mindennapokban, otthoni felhasználásra




OSSZIFIKÁLÓDÓ MEMBRÁN, AMELY MÁS HASONLÓ TERMÉKEKKEL SZEMBEN NEM FELSZÍVÓDIK, HANEM ÁTCSONTOSODIK OSSZIFIKÁLÓDÓ KOLLAGÉN VÁZ


OSSZIFIKÁLÓDÓ KOLLAGÉNBLOKK












