
OUTROS TÍTULOS DE INTERESSE
Avaliação, Diagnóstico, Monitoramento e Aferição em Nutrição – Adulto e Pediátrico
Cristina Martins
Dietoterapia nas Doenças do Adulto
Aline Marcadenti de Oliveira
Flávia Moraes Silva
Fisiopatologia da Nutrição e Dietoterapia
Carla de Oliveira Barbosa Rosa
Helen Hermana Miranda Hermsdorff
Interpretação de Exames Laboratoriais
Aplicados à Nutrição Clínica
Larissa Calixto-Lima
Nelzir Trindade Reis
Protocolos para Pesquisas em Nutrição
Clínica: Avaliação Antropométrica, Dietética e Metabolismo Energético
Eliane Lopes Rosado
Maisa Cruz Martins
Nefrologia no Dia a Dia
Daniel Rinaldi dos Santos
Nutrição Clínica – Bases para Prescrição
Nelzir Trindade Reis
Larissa Calixto-Lima
Nutrição Clínica no Dia a Dia, 2a ed.
Larissa Calixto-Lima
Maria Cristina Gonzalez
Nutrição e Metabolismo em Cirurgia Metabólica e Bariátrica, 2a ed.
Luciana Zuolo Coppini
Nutrição Oncológica no Dia a Dia
Aline Pereira Pedrosa
Taiara Scopel Poltronieri
Emanuelly Varea Maria Wiegert
Larissa Calixto-Lima
Terapia Nutricional em UTI, 2a ed.
Diogo Toledo
Melina Castro
Saiba mais sobre estes e outros títulos em nosso site: www.rubio.com.br

A editora e os autores deste livro não mediram esforços para assegurar dados corretos e informações precisas. Entretanto, por ser a Medicina uma ciência em permanente evolução, recomendamos aos nossos leitores recorrer à bula dos medicamentos e a outras fontes fidedignas – inclusive documentos oficiais –, bem como avaliar cuidadosamente as recomendações contidas neste livro em relação às condições clínicas de cada paciente.
Organizadoras
Denise Mafra
Graduada em Nutrição pela Universidade Federal de Santa Catarina (UFSC).
Mestre e Doutora em Ciências dos Alimentos pela Universidade de São Paulo (USP).
Pós-doutorado pela Université Claude Bernard, Lyon, França.
Estágio Sênior no Karolinska Institutet, Estocolmo, Suécia.
Professora Visitante na University of Glasgow, Escócia.
Professora Titular na Universidade Federal Fluminense (UFF), Niterói, RJ, e dos Programas de Pós-graduação (PPG) em Ciências Médicas (UFF), PPG em Ciências da Nutrição (UFF) e do PPG em Ciências Biológicas da Universidade Federal do Rio de Janeiro (UFRJ).
Membro da International Society of Renal Nutrition and Metabolism e do Comitê de Nutrição da Sociedade Brasileira de Nefrologia (SBN).
Editora da Seção de Nutrição do Nephrology Dialysis Transplantation e da BioMed Central (BMC) Nephrology.
Editorial Board da International Urology Nephrology e da Nutrition Research
Coordenadora do Ambulatório de Nutrição Renal da UFF e Líder do Grupo de Pesquisa em Nutrição e Nefrologia da UFF.
Viviane de Oliveira Leal
Graduada em Nutrição pela Universidade Federal Fluminense (UFF).
Mestre em Clínica Médica pela Universidade Federal do Rio de Janeiro (UFRJ).
Doutora em Ciências Médicas pela UFF.
Pós-doutorado pela UFF.
Nutricionista do Centro de Nefrologia Mageense (Cenefro) e do Hospital Universitário Pedro Ernesto/ Universidade do Estado do Rio de Janeiro (Hupe/Uerj).
Nutrição em Nefrologia no Dia a Dia
Copyright © 2024 Editora Rubio Ltda.
ISBN 978-65-88340-68-4
Todos os direitos reservados. É expressamente proibida a reprodução desta obra, no todo ou em parte, sem autorização por escrito da Editora.
Produção
Equipe Rubio
Capa
Bruno Sales
Imagens de capa
iStock.com/Liudmila Chernetska
Diagramação
Estúdio Castellani
CIP-BRASIL. CATALOGAÇÃO NA PUBLICAÇÃO
SINDICATO NACIONAL DOS EDITORES DE LIVROS, RJ
N97
Nutrição em nefrologia no dia a dia / organização Denise Mafra, Viviane de Oliveira Leal. – 1. ed. - Rio de Janeiro : Rubio, 2024. 452 p. ; 24 cm.
Inclui bibliografia
ISBN 978-65-88340-68-4
1. Nefrologia - Nutrição. 2. Rins - Doenças. I. Mafra, Denise. II. Leal, Viviane de Oliveira.
24-88997
CDD: 616.61
CDU: 616.61
Gabriela Faray Ferreira Lopes - Bibliotecária - CRB-7/6643
Editora Rubio Ltda.
Av. Franklin Roosevelt, 194, s/l 204 – Centro 20021-120 – Rio de Janeiro – RJ
Telefone: +55(21) 2262-3779
E-mail: rubio@rubio.com.br www.rubio.com.br
Impresso no Brasil
Printed in Brazil
Colaboradores
Aline de Araujo Antunes
Graduada em Nutrição pela Universidade Estadual Paulista
Júlio de Mesquita Filho (Unesp).
Doutora em Ciências da Saúde (área de Nefrologia) pela Faculdade de Medicina de Botucatu (FMB)/Unesp.
Membro do Comitê de Nutrição da Sociedade Brasileira de Nefrologia (SBN).
Nutricionista Clínica na DaVita Tratamento Renal, Taubaté, SP.
Beatriz Germer Baptista
Graduada em Nutrição pela Fundação Universidade Regional de Blumenau (Furb).
Mestre em Ciências Médicas pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Pós-graduada em Nutrição e Nefrologia pelo Instituto
Nacional de Ensino Superior (Inades).
Nutricionista Clínica na Associação Renal Vida, Blumenau – SC.
Beatriz Oliveira da Cruz
Graduada em Nutrição pela Universidade Federal Fluminense (UFF).
Mestre em Ciências Cardiovasculares pela UFF.
Doutoranda em Ciências Cardiovasculares pela UFF com Período Sanduíche na Université Claude Bernard Lyon 1, França, no Laboratório Metabolism, Enzymes and Molecular Mechanisms (MEM) pelo Programa Capes/PDSE.
Integrante do Grupo de Pesquisa em Nutrigenética e Nutrigenômica (GPeNN/UFF).
Cristiane Ferreira Moraes
Graduada em Nutrição pela Universidade Católica Dom Bosco (UCDB), MS.
Especialista em Fisiologia do Exercício pela Universidade Gama Filho (UGF), RJ.
Especialista em Nutrição Esportiva pelo Centro Universitário de São José do Rio Preto (Unirp).
Mestre em Saúde Coletiva pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Doutora em Ciências Cardiovasculares pela UFF.
Pós-doutorado em Ciências Cardiovasculares pela UFF.
Vice-coordenadora do Comitê de Nutrição da Sociedade Brasileira de Nefrologia (SBN).
Daniela Amaral Rizzo
Graduada em Nutrição pela Universidade Veiga de Almeida (UVA), RJ.
Pós-graduada em Nutrição Funcional Aplicada à Clínica na Universidade Federal do Rio de Janeiro (UFRJ).
Mestranda no Programa de Pós-graduação em Ciências Médicas pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Danielle de Souza do Nascimento
Graduada em Nutrição pela Universidade Federal do Rio de Janeiro (UFRJ).
Pós-graduada em Nutrição Esportiva Funcional pela Valéria Paschoal – Centro de Nutrição Funcional.
Mestre em Ciências Médicas pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Doutoranda no Programa de Pós-graduação em Ciências Biológicas – Fisiologia pela UFRJ.
Danielle Regine Francisco Bastos
Graduada em Nutrição pela Faculdade Anhanguera, Niterói – RJ.
Pós-graduanda em Nutrição Renal pelo Instituto Nacional de Ensino Superior (Inades).
Denis Fouque
Médico Nefrologista com Doutorado em Nefrologia e Nutrição na University of California.
Chefe do Departamento de Nefrologia-Nutrição-Diálise do Centre Hospitalier Lyon Sud, França.
Foi Editor-chefe da Nephrology Dialysis Transplantation e Vice-presidente do Centro de Pesquisa em Saúde na University Claude Bernard Lyon 1, França.
Drielly Cristhiny Mendes de Vargas Reis
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Pós-graduada em Nutrição nas Doenças Crônicas não Transmissíveis pelo Instituto Israelita de Ensino e Pesquisa Albert Einstein (Iiep).
Mestre em Ciências Médicas pela UFF.
Doutoranda pelo Programa de Pós-graduação em Clínica Médica da Universidade Federal do Rio de Janeiro (UFRJ).
Membro do Comitê de Nutrição da Sociedade Brasileira de Nefrologia (SBN).
Elizabete Goes da Silva
Graduada em Nutrição pela Universidade do Estado do Rio de Janeiro (Uerj).
Residência em Nutrição Clínica com Ênfase em Clínica Médica pela Uerj.
Pós-graduada em Terapia Nutricional pela Uerj.
Mestre em Fisiopatologia Clínica e Experimental (Fisclinex) pela Uerj.
Especialista em Nutrição Clínica pela Associação Brasileira de Nutrição (Asbran).
Pós-graduada em Nutrição Renal pelo Instituto Nacional de Ensino Superior (Inades).
Pós-graduada em Preceptoria Multiprofissional na Área da Saúde pela Faculdade de Ciências da Saúde Moinhos de Vento/Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (Proadi-SUS).
Nutricionista da Atenção Especializada da Secretaria Municipal de Saúde de Maricá, RJ.
Chefe da Seção de Nutrição Clínica do Serviço de Nutrição e Dietética do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (HUCFF/UFRJ).
Fabiana Baggio Nerbass
Graduada em Nutrição pela Universidade Federal de Santa Catarina (UFSC).
Mestre em Nutrição pela Universidade Federal de São Paulo (Unifesp).
Doutora e Pós-doutora em Ciências da Saúde pela Pontifícia Universidade Católica do Paraná (PUC-PR).
Membro do Comitê de Nutrição e do Comitê de Registros e Projetos Nacionais e Internacionais da Sociedade Brasileira de Nefrologia (SBN).
Pesquisadora na Fundação Pró-rim, Joinville – SC.
Fabiane Rossi dos Santos
Graduada em Psicologia pelo Centro de Ensino Superior de Juiz de Fora, MG.
Mestra e Doutora em Saúde pela Universidade Federal de Juiz de Fora (UFJF).
Professora do Departamento de Psicologia e do Programa de Pós-graduação em Psicologia da UFJF.
Tutora das Residências Multiprofissionais do Hospital Universitário da UFJF.
Coordenadora do Núcleo Interdisciplinar de Investigação em Psicossomática, Saúde e Organizações (Nuipso) da UFJF.
Fabíola Martin Del Campo
Graduada em Nutrição pela Universidad de Guadalajara, Guadalajara, México.
Mestre em Nutrição Humana na Universidad de Guadalajara, Guadalajara, México.
Doutora em Ciências Médicas pela Universidad de Colima, Colima, México.
Pesquisadora Associada na Unidad de Investigación Biomédica e no Hospital de Especialidades, Instituto Mexicano del Seguro Social.
Professora de Nutrição na Universidad de Guadalajara, Guadalajara, México.
Felipe Rizzetto Santos
Graduado em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Mestre e Doutor em Clínica Médica pela Universidade Federal do Rio de Janeiro (UFRJ).
Pós-doutor em Imunotoxicologia e Inflamação pela Faculdade de Ciências Farmacêuticas da Universidade de São Paulo (USP).
Nutricionista do Ambulatório de Nutrição Renal do Hospital Federal da Lagoa, RJ.
Isabela de Souza da Costa Brum
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Pós-graduada em Nutrição Clínica Funcional pela Universidade Cruzeiro do Sul/Valéria Paschoal.
Nutricionista do Ambulatório de Nutrição Renal da UFF. Mestre em Ciências Cardiovasculares pela UFF.
Doutoranda no Programa Pós-graduação em Ciências Médicas pela UFF.
Isadora Kopke Britto Graduada em Nutrição pela Universidade Federal do Estado do Rio de Janeiro (Unirio).
Especialização em Nutrição Oncológica e Aperfeiçoamento em Pesquisa Oncológica pelo Programa de Residência
Multiprofissional do Instituto Nacional de Câncer José Alencar Gomes da Silva (Inca).
Mestre em Ciências Médicas pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Doutoranda no Programa de Pós-graduação em Ciências Biológicas – Fisiologia na Universidade Federal do Rio de Janeiro (UFRJ).
Nutricionista do Ambulatório de Nutrição Renal da UFF.
Jean Christ Cedras Capo-Chichi Graduado em Medicina pela Escuela Latinoamericana de Medicina (Elam), Cuba.
Especialista em Medicina da Família pela Faculdade de Medicina de Sancti-Spíritus, Havana, Cuba.
Mestre em Ciências Médicas pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Pós-graduado em Nefrologia pela Faculdade Israelita de Ciências da Saúde Albert Einstein (Ficsae).
Médico Assistente das Clínicas de Hemodiálise Prodoctor, CDR e DaVita.
Jessyca Sousa de Brito
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Mestre em Ciências Cardiovasculares pela UFF.
Doutora em Ciências Médicas pela UFF.
Pós-doutoranda no Programa de Pós-graduação em Ciências Biológicas – Fisiologia da Universidade Federal do Rio de Janeiro (UFRJ).
José Carlos Carraro Eduardo
Graduado em Medicina pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Mestre em Medicina/Nefrologia pela Universidade Federal do Rio de Janeiro (UFRJ).
Doutor em Patologia pela UFF.
Professor Titular de Nefrologia da Faculdade de Medicina da UFF.
Juliana Furtado Saldanha
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Mestre e Doutora em Ciências Médicas pela UFF, com Período Sanduíche na Université Claude Bernard, Lyon 1 – França.
Especialista em Nutrição Clínica pela Universidade Gama Filho do Rio de Janeiro (UGF), RJ.
Membro da Associação Brasileira para o Estudo da Obesidade e Síndrome Metabólica (Abeso).
Julie Ann Kemp
Graduada em Nutrição pela Universidade Federal do Rio de Janeiro (UFRJ).
Mestre em Ciências Médicas pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Doutora em Ciências Cardiovasculares pela UFF.
Pós-doutoranda do Programa de Pós-graduação em Ciências da Nutrição pela UFF.
Professora colaboradora do Programa de Pós-graduação em Ciência da Nutrição pela UFF.
Julie Calixto Lobo
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Pós-graduada em Nutrição Clínica Funcional pela VP –
Centro de Nutrição Funcional.
Mestre em Ciências dos Alimentos pela Universidade de São Paulo (USP).
Doutora em Ciências Biológicas – Biofísica pela Universidade Federal do Rio de Janeiro (UFRJ).
Pós-doutora pelo Programa de Pós-graduação (PPG) em Ciências Cardiovasculares da UFF e pelo PPG em Odontologia da UFF.
Karla Thaís Resende Teixeira
Graduada em Nutrição pela Universidade Federal do Estado do Rio de Janeiro (Unirio).
Pós-graduada em Nutrição Clínica pela Universidade Federal do Rio de Janeiro (UFRJ).
Residência Multiprofissional em Saúde (área de Oncologia) pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Mestre em Ciências da Nutrição pela UFF.
Doutoranda pelo Programa de Pós-graduação em Ciências Médicas da UFF.
Nutricionista do Ambulatório de Nutrição Renal da UFF.
Laís de Souza Gouveia Moreira
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Pós-graduada em Nutrição Clínica Ortomolecular, Biofuncional e Fitoterapia pelo Centro Universitário Redentor (UniRedentor), Itaperuna – RJ.
Pós-graduada em Nutrição Esportiva Aplicada à Saúde e Desempenho Físico pela UniRedentor.
Especialista em Residência Multiprofissional em Saúde (área de Oncologia) pela UFF.
Mestre em Ciências da Nutrição pela UFF.
Doutoranda pelo Programa de Pós-graduação em Ciências Médicas pela UFF.
Nutricionista do Ambulatório de Nutrição Renal da UFF.
Larissa dos Santos Fonseca
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Pós-graduada em Nutrição em Nefrologia e Nefrologia Multiprofissional pela Faculdade Unyleya, SP.
Mestre em Ciências Médicas pela UFF.
Doutoranda pelo Programa de Pós-graduação em Ciências Médicas da UFF.
Nutricionista do Ambulatório de Nutrição Renal da UFF.
Ligia Soares Lima
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Pós-graduanda em Nutrição, Metabolismo e Fisiologia no Esporte pela Faculdade de Empreendedorismo e Ciências
Humanas (Inades).
Mestranda no Programa de Pós-graduação (PPG) em Ciências Biológicas – Fisiologia na Universidade Federal do Rio de Janeiro (UFRJ).
Nutricionista do Ambulatório de Nutrição Renal da UFF.
Livia de Almeida Alvarenga
Graduada em Nutrição pela Universidade Federal de Juiz de Fora (UFJF).
Mestre em Saúde e Nutrição pela Universidade Federal de Ouro Preto (Ufop).
Doutora em Ciências Médicas pela Universidade Federal Fluminense (UFF), Niterói – RJ, com Período Sanduíche na Wayne State University, EUA.
Pós-doutoranda do Programa de Pós-graduação (PPG) em Ciências Biológicas – Fisiologia da Universidade Federal do Rio de Janeiro (UFRJ).
Professora Colaboradora do PPG em Ciência da Nutrição pela UFF.
Ludmila Ferreira Medeiros de França Cardozo
Graduada em Nutrição pela Universidade Federal do Estado do Rio de Janeiro (Unirio).
Especialização em Nutrição Clínica pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Mestre em Saúde da Criança e do Adolescente pela UFF.
Doutora em Ciências Médicas pela UFF.
Pós-doutora com Ênfase em Nefrologia no Programa de Pós-graduação em Ciências Cardiovasculares pela UFF.
Professora Adjunta da Faculdade de Nutrição e dos Programas de Pós-gradução em Ciências Cardiovasculares e Ciências da Nutrição da UFF.
Membro do Comitê de Nutrição da Sociedade Brasileira de Nefrologia (SBN).
Ludmilla Dias de Santana e Santana
Graduada em Nutrição pela Universidade do Estado da Bahia (Uneb).
Pós-graduada em Nutrição Clínica na Obesidade e Estética pela Uneb e Especialização na Modalidade Residência em Nutrição Clínica com Ênfase em Clínica Cirúrgica e Oncologia pela Universidade do Estado do Rio de Janeiro (Uerj).
Mestre do Programa de Pós-graduação em Alimentação, Nutrição e Saúde pela Uerj.
Mara Rosana Nazaré Souza dos Santos
Graduada em Nutrição pela Universidade Federal do Pará (UFPA).
Pós-graduação em Nutrição Clínica e Terapia Nutricional
Enteral e Parenteral (Ganep).
Pós-graduação em Saúde do Trabalhador e Ecologia
Humana pela Fundação Oswaldo Cruz (Fiocruz), RJ. Mestre em Ciência da Motricidade Humana pela Universidade Castelo Branco (UCB).
Responsável Técnica do Serviço de Nutrição e Dietética do Hospital de Clínicas Alberto Lima, Macapá – AP.
Marcia Maria Ferreira Ribeiro
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Pós-graduada em Nutrição em Nefrologia e Nefrologia Multiprofissional pela Faculdade Unyleya, SP.
Mestre em Ciências da Nutrição pela UFF.
Doutoranda no Programa de Pós-graduação em Ciências
Biológicas – Fisiologia na Universidade Federal do Rio de Janeiro (UFRJ).
Nutricionista do Ambulatório de Nutrição Renal da UFF.
Maria Helena Lima Gusmão
Graduação em Nutrição pela Universidade Federal da Bahia (UFBA).
Pós-graduada em Nutrição Clínica pelo Instituto de Pesquisa Capacitação e Ensino (IPCE), Bahia.
Capacitada em Nutrição e Nefrologia pela Pontifícia Universidade Católica do Paraná (PUC-PR).
Mestre em Alimentos, Nutrição e Saúde pela UFBA.
Doutora em Medicina e Saúde pela UFBA.
Nutricionista do Hospital Universitário Professor Edgard Santos (Hupes) da UFBA.
Professora Adjunta da Escola de Nutrição da UFBA.
Preceptora da Residência Médica em Nefrologia do Hupes da UFBA.
Coordenadora do Comitê de Nutrição da Sociedade Brasileira de Nefrologia (SBN).
Marina Nogueira Berbel Bufarah
Graduada em Nutrição pela Universidade Estadual Paulista Júlio de Mesquita Filho (Unesp).
Mestre e Doutora em Fisiopatologia em Clínica Médica pela Faculdade de Medicina de Botucatu (FMB)/Unesp.
Nutricionista Responsável pela Gerência Técnica de Nutrição e Dietética do Hospital das Clínicas da Faculdade de Medicina de Botucatu (HC-FMB).
Michele Ribeiro Sgambato
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Mestre em Saúde Coletiva/Epidemiologia pela UFF.
Doutora em Saúde Coletiva/Epidemiologia pelo Instituto de Medicina Social, Universidade do Estado do Rio de Janeiro (Uerj).
Pós-doutorado em Nutrição pelo Programa de Pós-graduação em Nutrição da Universidade Federal do Rio de Janeiro (UFRJ).
Milena Barcza Stockler-Pinto
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Mestre em Ciências dos Alimentos pela Faculdade de Ciências Farmacêuticas da Universidade de São Paulo (USP).
Doutora em Ciências Biológicas (Biofísica) pela Universidade Federal do Rio de Janeiro (UFRJ).
Pós-doutorado na Université Claude Bernard Lyon 1, França. Professora Adjunta da Faculdade de Nutrição e dos Programas de Pós-graduação (PPG) em Ciências Cardiovasculares, PPG em Patologia e do PPG Ciências da Nutrição da UFF.
Miriam Ghedini Garcia Lopes
Graduada em Nutrição pela Universidade do Oeste Paulista (Unoeste).
Mestre em Nutrição pela Universidade Federal de São Paulo (Unifesp).
Doutora em Ciências pela Unifesp.
Professora Adjunta do Departamento de Nutrição e Medicina do Centro Universitário de Adamantina (UniFai), SP.
Najla Elias Farage
Graduada em Nutrição pela Universidade do Rio de Janeiro (Unirio).
Mestre em Clínica Médica pela Universidade Federal do Rio de Janeiro (UFRJ).
Doutora em Ciências Médicas pela Universidade Federal Fluminense (UFF), Niterói – RJ. Especialista em Nutrição Clínica pela Associação Brasileira de Nutrição (Asbran).
Professora da Universidade Veiga de Almeida (UVA), RJ.
Nara Xavier Moreira
Graduação em Nutrição pela Universidade Estadual do Ceará (Uece).
Mestre e Doutora em Ciências dos Alimentos pela Universidade de São Paulo (USP).
Professora Associada IV da Universidade Federal Fluminense (UFF), Niterói – RJ.
Coordenadora do Laboratório de Alimentos e Dietética (Labdi-UFF) e membro do Comitê Gestor do Centro Integrado de Alimentos e Nutrição (Cian-UFF).
Pós-doutorado no Centro de Investigação em Tecnologias e Serviços de Saúde (Cintesis), na Faculdade de Medicina da Universidade do Porto (FMUP), no Departamento de Biomedicina na Unidade de Bioquímica do Centro de Investigação Médica (CIM).
Colaboradora do Projeto Global Congestive Heart Failure Registry (G-CHF) no Centro Hospitalar Universitário de São João/FMUP em parceria com Hamilton Health Sciences Corporation/McMaster University, Canadá.
Natália Alvarenga Borges
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Mestre e Doutora em Ciências Médicas pela UFF.
Residência Multiprofissional em Saúde na Área de Terapia Intensiva no Hospital Universitário Antônio Pedro (Huap/UFF).
Pós-doutorado em Ciências Cardiovasculares na UFF.
Professora Adjunta da Universidade do Estado do Rio de Janeiro (Uerj).
Professora do Programa de Pós-graduação em Alimentação
Nutrição e Saúde (PPG-ANS) da Uerj.
Membro do Comitê de Nutrição da Sociedade Brasileira de Nefrologia (SBN).
Nina Cid Loureiro Pombo
Graduada em Nutrição pela Universidade Federal do Estado do Rio de Janeiro (Unirio).
Residência em Saúde Perinatal (Maternidade Escola) da Universidade Federal do Rio de Janeiro (UFRJ).
Mestre em Ciências pela Escola Nacional de Saúde
Pública/Fundação Oswaldo Cruz (Fiocruz), RJ.
Doutoranda do Programa de Saúde Pública e Meio
Ambiente da Escola Nacional de Saúde Pública/Fiocruz.
Nutricionista do Núcleo Perinatal do Hospital Universitário
Pedro Ernesto (Hupe) da Universidade do Estado do Rio de Janeiro (Uerj).
Preceptora da Residência em Nutrição Clínica do Programa de Saúde Perinatal.
Pricilla de Castro Trigueira
Graduada em Nutrição pela Universidade Federal Fluminense (UFF), Niterói – RJ.
Pós-graduada em Nutrição Clínica, Funcional e Fitoterápicos pela Faculdade São Camilo, SP.
Mestre em Ciências da Nutrição pela UFF.
Doutoranda no Programa de Pós-graduação em Patologia na UFF.
Priscila Mansur Leal
Graduada em Nutrição pela Universidade Federal do Estado do Rio de Janeiro (Unirio).
Pós-graduada em Nutrição Clínica pela Universidade Federal do Rio de Janeiro (UFRJ).
Residência em Nutrição Clínica com Ênfase em Nefrologia pela Universidade do Estado do Rio de Janeiro (Uerj).
Mestre em Fisiopatologia Clínica e Experimental (Fisclinex) pela Uerj.
Nutricionista Clínica do Hospital Universitário Pedro Ernesto (Hupe/Uerj) e Preceptora da Residência em Nutrição Clínica do Setor de Nefrologia.
Renata Cristina Bezerra Rodrigues
Graduada em Letras pela Universidade Estadual do Pará (Uepa) e em Nutrição pela Escola Superior da Amazônia (Esamaz).
Pós-graduada em Nutrição nas Enfermidades Renais pelo Instituto Cristina Martins e em Fitoterapia Aplicada a Nutrição pela Faculdade Dom Alberto (Faveni)
Mestre em Neurociências e Comportamento pela Universidade Federal do Pará (UFPA).
Renata Rodrigues Teixeira
Graduada em Nutrição pelas Faculdades Metropolitanas Unidas (FMU).
Especializada em Nutrição Aplicada às Doenças Renais e Mestre em Ciências, ambos pela Universidade Federal de São Paulo (Unifesp).
Professora do Curso de Especialização em Nutrição e Nefrologia do Instituto Nacional de Ensino Superior (Inades).
Tatiana Pereira de Paula Graduada em Nutrição pela Universidade Federal do Rio de Janeiro (UFRJ).
Mestre e Doutora em Ciências pelo Programa de Pós-graduação (PPG) em Clínica Médica do Hospital Universitário Clementino Fraga Filho (HUCFF/UFRJ).
Docente Colaboradora do Programa de Pós-graduação em Nutrição Clínica do Instituto de Nutrição Josué de Castro (INJC-UFRJ).
Pós-graduada em Terapia Nutricional em Cuidados Intensivos – Ciências Médicas-MG/Ganep Educação.
Pós-graduada em Preceptoria Multiprofissional na Área da Saúde pela Faculdade de Ciências da Saúde Moinhos de Vento/Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (Proadi/SUS).
Tutora de Campo da Residência Multiprofissional Integrada em Saúde do HUCFF/UFRJ – Ênfase em Nutrição.
Vice-coordenadora do Curso de Especialização em Terapia Nutricional do Adulto (INJC-UFRJ).
Chefe da Seção de Ensino e Pesquisa do Serviço de Nutrição e Dietética (HUCFF/UFRJ).
Thais Vitorino Neves do Nascimento
Graduada em Nutrição pela Universidade Federal da Bahia (UFBA).
Especialização em Nutrição Clínica sob a forma de Residência pela UFBA.
Pós-graduada em Nutrição Esportiva Funcional pela Valéria Paschoal – Centro de Nutrição Funcional – Universidade Cruzeiro do Sul.
Mestre em Alimentos, Nutrição e Saúde pela UFBA. Nutricionista do Setor de Diálise do Hospital Ana Nery – Salvador/BA.
Professora do curso de Especialização em Nutrição e Nefrologia do Instituto Nacional de Ensino Superior (Inades).
Thalita Lima Melo
Graduada em Nutrição pela Universidade Presbiteriana Mackenzie, SP.
Especializada em Nutrição Aplicada às Doenças Renais e Doutora em Ciências com Ênfase em Nefrologia pela Universidade Federal de São Paulo (Unifesp)/Escola Paulista de Medicina (EPM).
Aprimorada em Transtornos Alimentares pelo Programa de Transtornos Alimentares (Ambulim) do Instituto de Psiquiatria (IPq) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP).
Professora do Curso de Especialização em Nutrição e Nefrologia do Instituto Nacional de Ensino Superior (Inades).
Dedicatória
A todos os pacientes que com suas dores e angústias nos fazem ressignificar diariamente nossas próprias vidas e contribuem para nosso desejo de contínua evolução.
A todos os profissionais que prezam pela excelência em seu trabalho e buscam nortear suas condutas com base em evidências científicas, com fontes atualizadas e confiáveis.
Agradecimentos
Meu primeiro agradecimento vai para essa nutri e ex-aluna inteligente, eficiente, detalhista (quase chatinha) e dedicada, que, mesmo com um bebezinho, topou essa aventura de escrever o livro comigo! Viviane Leal é, de fato, Leal, Amiga e Filha do meu coração!
Agradeço ao meu lindo Grupo de Pesquisa em Nutrição e Nefrologia da Universidade Federal Fluminense (UFF) e a Fabio Rubio, que me incentivaram (diria, empurraram) a construir este livro!
Agradeço a todos os autores desta obra, que dedicaram seu tempo para contribuir com brilhantes atualizações científicas para os estudantes e profissionais da saúde, principalmente para os nutricionistas que cuidam dos pacientes com doenças renais.
Denise Mafra
Agradeço a Deus por me direcionar com amor em caminhos que eu nunca imaginei trilhar.
Obrigada à minha família que, com paciência, me acolheu nos intensos meses de elaboração deste livro. Paulo Vitor, Clara e Murilo: obrigada!
À minha amiga e eterna orientadora, Denise, agradeço por confiar no meu potencial e sempre me proporcionar a oportunidade de aprender e ensinar.
Agradeço a todos os pacientes, colegas nutricionistas, médicos (em especial ao Dr. Paulo Tinoco), enfermeiros e equipe de saúde que, nesses muitos anos de experiência com doença renal crônica, me ensinam diariamente não só sobre doença e seu tratamento, mas também sobre vida, resiliência e superação.
Viviane de Oliveira Leal
Apresentação
Costumamos brincar que os rins são os órgãos mais importantes do corpo, tamanha é a repercussão orgânica quando acometidos por alguma condição patológica, aguda ou crônica.
Neste contexto, a Nutrição desempenha papel fundamental na prevenção e no controle das condições clínicas e comorbidades que predispõem a doenças renais, bem como propicia melhores desfechos em saúde, sobretudo no que tange às complicações da doença renal crônica.
Assim, em razão dos inúmeros avanços na área de Nutrição e Nefrologia, com consolidação de condutas para o manejo nos diferentes espectros das doenças renais, esta obra reúne informações atualizadas para nortear a prática clínica de forma didática e assertiva.
Além dos aspectos tradicionais do cuidado nutricional das diferentes doenças renais, as possibilidades inovadoras de prevenção e tratamento, baseadas no conceito de food as medicine, também são incluídas neste livro.
Entretanto, o que mais nos orgulha é ampliar nossa perspectiva para além do conteúdo técnico, com a inclusão de temas relacionados aos aspectos psicológicos do acompanhamento de pacientes com doença renal crônica, bem como o próprio olhar de uma paciente que se tornou nutricionista por entender a importância da Nutrição no contexto da Nefrologia.
Dessa forma, pretendemos estimular os novos e antigos profissionais que atuam nesta área tão difícil, mas também tão apaixonante, a se atualizarem e ampliarem as possibilidades de cuidado nutricional. Boa leitura!
As Organizadoras
Preface
In their new book, Dra. Denise Mafra and Dra. Viviane Leal comprehensively review common nutritional issues relevant to patients with kidney disease. The book starts by explaining the basic principles of kidney physiology and its relation to the pathophysiological conditions that affect the kidney. A similar description is also provided for the nutritional assessment of patients with kidney disease, followed by a detailed explanation of the most recent nutritional recommendations for patients with chronic kidney disease (CKD). The book’s subsequent sections are very intriguing since they explore more practical and creative aspects of the nutritional care of patients with CKD. The practical chapters describe the most recent nutrition guidelines for macronutrients, micronutrients, minerals, and electrolytes. They further provide much-needed practical suggestions for the keto diets and low-protein diets for patients with kidney disease. Drs. Mafra and Leal also dive into nutritional management in less commonly seen conditions in patients with kidney disease, such as pregnancy, glomerular and polycystic kidney disease, and hepato- and cardio-renal syndromes. The book is completed with a detailed discussion on emerging scientific areas such as intestinal microbiota, “fad diets,”
and “food as medicine.” This innovative approach is complemented by a final chapter focused on the patient and the psychological aspects of nutritional care in the setting of kidney disease.
This new book is an outstanding compilation of highly relevant nutritional topics for patients with kidney disease. The authors are to be commended for attempting to provide information for commonly observed conditions in patients with kidney disease and to provide updates on settings that are more rarely observed and emerging scientific topics. Overall, this book will be an immense resource for individuals interested in caring for patients with kidney disease.
Talat Alp Ikizler Organizer of KDOQI Clinical Practice Guideline for Nutrition in CKD: 2020 update Division of Nephrology and Hypertension. Professor of Medicine. Vice Chair for Clinical Research. Director, Division of Nephrology and Hypertension. Vanderbilt University Medical Center –Nashville, Tennessee, USA.
Prefácio
Em seu novo livro, a Dra. Denise Mafra e a Dra. Viviane Leal fornecem uma revisão abrangente de questões nutricionais comuns que são relevantes para pacientes com doença renal. O livro começa com a explicação dos princípios básicos da fisiologia renal e sua relação com as condições fisiopatológicas que afetam os rins. Uma descrição semelhante também é fornecida para a avaliação nutricional de pacientes com doença renal, seguida de uma explicação detalhada das recomendações nutricionais mais recentes em pacientes com doença renal crônica (DRC). As seções subsequentes do livro são muito intrigantes, pois exploram aspectos mais práticos e criativos do cuidado nutricional de pacientes com DRC. Os capítulos práticos incluem a descrição das diretrizes nutricionais mais recentes para macronutrientes, micronutrientes, minerais e eletrólitos. Ainda foram elaborados capítulos sobre cetodieta e dieta hipoproteica para pacientes com DRC. As professoras Mafra e Leal se aprofundam, ainda, no manejo nutricional em condições menos comumente observadas em pacientes com doença renal, como gravidez, glomerulopatias, doença renal policística autossômica dominante e síndromes hepato- e cardiorrenais. O livro também traz uma discussão detalhada sobre áreas científicas emergentes, como microbiota intestinal, “dietas da moda” e food as medicine. Essa abordagem
inovadora é complementada por um capítulo final centrado no paciente e nos aspectos psicológicos do cuidado nutricional no contexto da doença renal.
Este novo livro é uma excelente compilação de tópicos nutricionais altamente relevantes para o tratamento de pacientes com doença renal. Os autores devem ser elogiados por tentarem fornecer informações, não apenas sobre condições comumente observadas em pacientes com doença renal, mas também por fornecerem atualizações sobre condições pouco discutidas na literatura, além de tópicos científicos emergentes. No geral, esta obra fornece informações relevantes para profissionais da saúde interessados no tratamento de pacientes com doença renal.
Talat Alp Ikizler Organizador do Guias de Nutrição Renal – KDOQI Clinical Practice Guideline for Nutrition in CKD: 2020 update. Divisão de Nefrologia e Hipertensão. Professor de Medicina. Vice-presidente de Pesquisa Clínica. Diretor, Divisão de Nefrologia e Hipertensão. Vanderbilt University Medical Center, Nashville, Tennessee, EUA.
Lista de Siglas e Abreviaturas
%GC Percentual de gordura corporal
β-HMB beta-hidroxibetametilbutirato
1,25(OH)2D 1,25 di-hidroxivitamina D
25(OH)D 25-hidroxivitamina D
AACR Aminoácidos de cadeira ramificada
Abeso Associação Brasileira para o Estudo da Obesidade e Síndrome Metabólica
ADH Hormônio antidiurético
AGB Área de gordura do braço
AGCC Ácidos graxos de cadeia curta
AINE Anti-inflamatórios não esteroides
AMB Área muscular do braço
AMBc Área muscular do braço corrigida
AMP Adenosina monofosfato
AMPc Adenosina 3′,5′-monofosfato cíclico
ASG Avaliação subjetiva global
ATP Trifosfato de adenosina
ATPase Cotransportador sódio-potássio
AVE Acidente vascular encefálico
BCAA Aminoácidos de cadeira ramificada
BIA Bioimpedância elétrica
BN Balanço nitrogenado
CB Circunferência do braço
CBD Censo Brasileiro de Diálise
CC Circunferência da cintura
ClCr Clearance da creatinina
CMB Circunferência muscular do braço
COX-2 Ciclo-oxigenase-2
CP Circunferência da panturrilha
CTE Cadeia de transporte de elétrons
CTLF Contagem total de linfócitos
Da Daltons
DAC Doença arterial coronariana
Dc Densidade corporal
DCAb Dobra cutânea abdominal
DCB Dobra cutânea bicipital
DCE Doador de critério expandido
DCNT Doenças crônicas não transmissíveis
DCSE Dobra cutânea subescapular
DCSI Dobra cutânea suprailíaca
DCT Dobra cutânea tricipital
DM1 Diabetes melito tipo 1
DM2 Diabetes melito tipo 2
DMO Distúrbio mineral e ósseo
DNA Ácido desoxirribonucleico
DP Diálise peritoneal
DPA Diálise peritoneal automatizada
DPAC Diálise peritoneal ambulatorial contínua
DPAV Diálise peritoneal de alto volume
DPCC Diálise peritoneal cíclica contínua
DRC Doença renal crônica
DRD Doença renal diabética
DRPAD Doença renal policística autossômica dominante
DVP Doença vascular periférica
EAS Elementos anormais e sedimentoscopia
ECA Enzima conversora de angiotensina
EPO Eritropoetina
ERO Espécies reativas de oxigênio
Espen European Society for Clinical Nutrition and Metabolism
eTFG Taxa de filtração glomerular estimada
EUTOX European Uremic Toxins Work Group
FGF-23 Fator de crescimento de fibroblastos 23
FID Federação Internacional de Diabetes
FMP Força de preensão manual
FRR Função renal residual
GESF Glomerulosclerose segmentar e focal
GH Hormônio do crescimento
GIG Grandes para a idade gestacional
GLUT-2 Transportador de glicose tipo 2
GPG Ganho de peso gestacional
GPID Ganho de peso interdialítico
HAS Hipertensão arterial sistêmica
HD Hemodiálise
HDL Lipoproteína de alta densidade
HO-1 Hemeoxigenase-1
HVE Hipertrofia ventricular esquerda
IAM Infarto agudo do miocárdio
IC Índice de conicidade
ICC Insuficiência cardíaca congestiva
IECA Inibidores da enzima conversora de angiotensina
IgA Imunoglobulina
IGF-1 Fator de crescimento semelhante à insulina tipo 1
IL Interleucina
IMC Índice de massa corporal
INS Identificação internacional numérica
IRA Injúria renal aguda
iSGLT2 Inibidores do cotransportador de sódio/glicose 2
KDIGO Kidney Disease Improving Global Outcome
KDOQI Kidney Disease Improving Global Outcome
LDL Lipoproteína de baixa densidade
LES Lúpus eritematoso sistêmico
LPS Lipopolissacarídeos
MCP-1 proteína quimiotática de monócitos-1
MLG Massa livre de gordura
MME Massa muscular esquelética
MNA-SF BMI Miniavaliação nutricional – versão curta (do inglês, mini nutritional assessment short form – body mass index)
MST Instrumento de triagem de desnutrição (do inglês, malnutrition screening tool)
mTFG Taxa de filtração glomerular medida
mTOR Proteína-alvo da rapamicina em mamíferos (do inglês, mammalian target of rapamycin)
MUST Instrumento de triagem universal de desnutrição (do inglês, malnutrition universal screening tool)
NADPH Fosfato de dinucleotídio de nicotinamida e adenina (do inglês, nicotinamide adenine dinucleotide phosphate)
NE Nutrição enteral
NF-κB
Fator nuclear kappa B (do inglês, nuclear factor-kappa B)
NIgA Nefropatia por imunoglobulina A
NKF National Kidney Foundation
NP Nutrição parenteral
NPID Nutrição parenteral intradialítica
Nrf2 Fator nuclear eritroide 2 relacionado ao fator 2 (do inglês, nuclear factor erythroid 2-related factor 2)
NRS-2002
Triagem de risco nutricional-2002 (do inglês, nutritional risk screening 2002)
NUS Nitrogênio ureico sérico
NUSa Nitrogênio ureico sérico ajustado
NUU Nitrogênio ureico na urina
OMS Organização Mundial da Saúde
OPAS Organização Pan-americana de Saúde
PCN
PC-R
Processo de cuidado em nutrição
Proteína C-reativa
p-CS p-cresil sulfato
PDVK Proteínas dependentes de vitamina K
PFOA Ácido perfluoro-octanoico
PIG Pequeno para a idade gestacional
PM Peso molecular
PNA Peptídio natriurético atrial
PTH Paratormônio
QFA Questionário de frequência alimentar
RNA Ácido ribonucleico
SARS-CoV-2 Severe acute respiratorysyndrome coronavirus 2
SBN Sociedade Brasileira de Nefrologia
SHR Síndrome hepatorrenal
SN Síndrome nefrótica
SNO Suplementação nutricional oral
SOD Superóxido dismutase
SRA Sistema renina-angiotensina
SRAA Sistema renina-angiotensinaaldosterona
TC Tomografia computadorizada
TCA Tratamento conservador abrangente
TCC Terapias cognitivas e comportamentais
TFG Taxa de filtração glomerular
TNF-β Fator transformador de crescimento beta
TGI Trato gastrintestinal
TNF-α Fator de necrose tumoral alfa
TR Transplante renal
TRS Terapia renal substitutiva
UNA Aparecimento de nitrogênio ureico (do inglês, urea nitrogen appearance)
UTI Unidades de terapia intensiva
VET Valor energético total
VLDL Lipoproteínas de muito baixa densidade
Sumário 1 Fisiologia Renal 3 Jean Christ Cedras Capo-Chichi 2 Fisiopatologia da Doença Renal Crônica 8 Denise Mafra 3 Marcadores Bioquímicos 13 José Carlos Carraro Eduardo Parte I Fisiologia e Fisiopatologia Renal 4 Triagem Nutricional 21 Cristiane Ferreira Moraes 5 Avaliação Antropométrica 27 Maria Helena Lima Gusmão Thais Vitorino Neves do Nascimento 6 Avaliação da Ingestão Alimentar 36 Michele Ribeiro Sgambato Viviane de Oliveira Leal 7 Marcadores Bioquímicos 40 Najla Elias Farage Livia de Almeida Alvarenga Parte II Avaliação Nutricional 8 Tratamento Conservador 47 Isabela de Souza da Costa Brum Isadora Kopke Britto 9 Hemodiálise e Hemodiafiltração 58 Fabiana Baggio Nerbass Miriam Ghedini Garcia Lopes Viviane de Oliveira Leal 10 Diálise Peritoneal 68 Priscila Mansur Leal 11 Transplante Renal 75 Natália Alvarenga Borges Ludmilla Dias de Santana e Santana 12 Diabetes 85 Daniela Amaral Rizzo Denise Mafra 13 Obesidade 93 Juliana Furtado Saldanha 14 Desnutrição 99 Denise Mafra Denis Fouque 15 Doenças Cardiovasculares 107 Livia de Almeida Alvarenga Denise Mafra Viviane de Oliveira Leal Ludmila Ferreira Medeiros de França Cardozo Parte III Recomendações Nutricionais na Doença Renal Crônica
16 Pediatria 121 Karla Thaís Resende Teixeira 17 Gestação e Lactação 134 Nina Cid Loureiro Pombo 18 Geriatria 145 Tatiana Pereira de Paula Elizabete Goes da Silva Parte IV Nutrição em Nefrologia nos Ciclos de Vida 19 Glomerulopatias 163 Danielle de Souza do Nascimento 20 Litíase 169 Thalita Lima Melo 21 Doença Renal Policística Autossômica Dominante 177 Viviane de Oliveira Leal 22 Injúria Renal Aguda 181 Marina Nogueira Berbel Bufarah 23 Síndrome Hepatorrenal 189 Najla Elias Farage Viviane de Oliveira Leal Denise Mafra 24 Síndrome Cardiorrenal 196 Ludmila Ferreira Medeiros de França Cardozo 25 Onconefrologia 201 Isadora Kopke Britto Maria Helena Lima Gusmão Denise Mafra Parte V Nutrição em Outras Doenças Renais 26 Potássio 211 Drielly Cristhiny Mendes de Vargas Reis 27 Fósforo 222 Aline de Araujo Antunes 28 Outros Minerais (Ferro, Cálcio, Zinco e Selênio) 230 Milena Barcza Stockler-Pinto Pricilla de Castro Trigueira 29 Acidose Metabólica 238 Felipe Rizzetto Santos 30 Vitaminas 244 Marcia Maria Ferreira Ribeiro Ligia Soares Lima 31 Sódio e Líquidos 255 Fabiana Baggio Nerbass Fabíola Martin Del Campo Parte VI Orientações Nutricionais Específicas 32 Suplementação de Energia 263 Julie Calixto Lobo 33 Suplementação de Proteínas 270 Laís de Souza Gouveia Moreira 34 Cetodieta 281 Renata Rodrigues Teixeira 35 A Vida na Cozinha com Dieta Hipoproteica 289 Nara Xavier Moreira Ligia Soares Lima Parte VII Aspectos Práticos na Doença Renal Crônica
36 Microbiota Intestinal nos Pacientes com Doenças Renais 319 Julie Ann Kemp Natália Alvarenga Borges 37 Estresse Oxidativo, Inflamação e Senescência 329 Denise Mafra Ludmila Ferreira Medeiros de França Cardozo 38 “Dietas da Moda” para Pacientes com Doença Renal Crônica 334 Isabela de Souza da Costa Brum Ludmila Ferreira Medeiros de França Cardozo 39 Suplementação de Proteínas e Creatina em Indivíduos Saudáveis e seu Impacto na Função Renal 338 Natália Alvarenga Borges Ludmilla Dias de Santana e Santana 40 Discussão sobre Proteínas de Origem Animal e Vegetal 344 Cristiane Ferreira Moraes Mara Rosana Nazaré Souza dos Santos 41 Massa Muscular: Importância e Perspectivas 350 Cristiane Ferreira Moraes Denise Mafra Viviane de Oliveira Leal Parte VIII Atualidades Científicas 42 Vegetais 361 Ludmila Ferreira Medeiros de França Cardozo Marcia Maria Ferreira Ribeiro Laís de Souza Gouveia Moreira 43 Frutas 367 Ligia Soares Lima Laís de Souza Gouveia Moreira 44 Leguminosas 374 Jessyca Sousa de Brito Renata Cristina Bezerra Rodrigues 45 Oleaginosas 380 Milena Barcza Stockler-Pinto Beatriz Oliveira da Cruz 46 Café, Canela e Chocolate 385 Livia de Almeida Alvarenga Marcia Maria Ferreira Ribeiro 47 Temperos Naturais 390 Jessyca Sousa de Brito Livia de Almeida Alvarenga 48 Própolis e Geleia Real 397 Beatriz Germer Baptista Larissa dos Santos Fonseca 49 Bebidas e Alimentos Fermentados 401 Marcia Maria Ferreira Ribeiro 50 Adoçantes 405 Beatriz Germer Baptista Marcia Maria Ferreira Ribeiro Parte IX Food as Medicine para Pacientes com Doença Renal Crônica 51 Aspectos Psicológicos de Pacientes com Doença Renal Crônica 413 Fabiane Rossi dos Santos 52 O Paciente 417 Danielle Regine Francisco Bastos 53 Resumos das Recomendações Nutricionais para Pacientes com Doenças Renais 420 Parte X Doença Renal Crônica Além do Ângulo Tradicional
Parte
Fisiologia e Fisiopatologia Renal
CAPÍTULOS
1 Fisiologia Renal, 3
2 Fisiopatologia da Doença Renal Crônica, 8
3 Marcadores Bioquímicos, 13
I
Fisiologia e Fisiopatologia Renal
1 Fisiologia Renal
Jean Christ Cedras Capo-Chichi
Introdução
Considera-se o rim um órgão fundamental para a manutenção da homeostase corporal, não somente pela filtração sanguínea, que possibilita a eliminação de toxinas, resíduos metabólicos e excesso de íons, mas também por promover o equilíbrio hidreletrolítico e ácido-básico.
Além dessas funções vitais, os rins cumprem outras funções relevantes, como a metabolização da vitamina D e a síntese de diversos agentes importantes ao organismo como a eritropoetina, que estimula a produção de hemácias, e a renina, fundamental para a regulação da pressão arterial. Tais funções são realizadas pelo néfron, considerado a unidade funcional dos rins.1-3
Néfrons
Os néfrons são as unidades estruturais e funcionais dos rins. Cada rim humano contém cerca de 1.200.000 néfrons. Esse quantitativo não aumenta após o nascimento; portanto, quando se fala em hipertrofia dos néfrons, isto está relacionado ao seu aumento de tamanho, mas não de número.
Os principais componentes do néfron são (Figura 1.1):
Glomérulo.
Cápsula de Bowman.
Túbulo contorcido proximal.
Alça de Henle.
Túbulo contorcido distal.
Túbulo coletor.
O glomérulo e a cápsula de Bowman juntos são chamados de corpúsculo renal, e o restante do néfron é denominado túbulo renal. Cada porção do néfron desempenha funções específicas relacionadas à filtração glomerular, formação da urina, fluxo sanguíneo, reabsorção e secreção tubular.
Fluxo Sanguíneo Renal
A árvore vascular renal tem pressão hidrostática de 75mmHg, aproximadamente 70% da existente na aorta, sendo maior quando comparada com outros capilares do organismo. Ao ingressar no hilo renal, a artéria renal
divide-se em anterior e posterior, as quais se ramificam em artérias interlobares, que, ao chegarem à base das pirâmides, dão origem às artérias arqueadas. As artérias arqueadas darão origem às artérias interlobulares, que se ramificam em arteríolas aferentes. Cada néfron é irrigado por uma arteríola aferente que, por sua vez, se ramifica em uma rede espiral de tubos de capilares (tufo glomerular) chamada de glomérulo. Os capilares glomerulares unificam-se posteriormente, formando a arteríola eferente. Eles são os únicos a localizar-se entre duas arteríolas em vez de estarem localizados entre uma arteríola e uma vênula. A arteríola eferente desemboca em uma rede de capilares peritubulares e vasos retos através do córtex e medula renal na proximidade dos túbulos.1,4
Os capilares peritubulares rodeiam os túbulos contorcidos tanto proximais quanto distais, o que facilita a reabsorção das substâncias essenciais previamente filtradas. Já os vasos retos favorecem as trocas de água e íons entre o sangue e o interstício medular, em razão de sua localização, uma vez que estão adjacentes às alças de Henle ascendente e descendente.
Constituindo menos de 0,5% da massa corporal, os rins recebem, através da artéria renal direita e esquerda, em torno de 25% do débito cardíaco no indivíduo em repouso,
Túbulo contorcido proximal
Cápsula de Bowman
Glomérulo
Alça de Henle

Túbulo contorcido distal
Túbulo coletor
Ca P ítul O
Figura
1.1 Estrutura do néfron
grande volume urinário (ou seja, urina mais diluída) ou pouco volume urinário (urina mais concentrada), de acordo com a necessidade do organismo.
Como mencionado, o filtrado glomerular sai do túbulo contorcido proximal isotônico ao plasma. À medida que há passagem pelos diferentes segmentos dos túbulos e pela alça de Henle, a água vai sendo absorvida (ou não) e os solutos são reabsorvidos ou secretados. O produto final (urina) é, então, drenado até a pelve renal, sendo finalmente excretado pela uretra.1,2,3,10
Regulação Hormonal da Reabsorção e Secreção de Eletrólitos e Água
De forma genérica, o sistema renina-angiotensina-aldosterona (SRAA) responde pela regulação de sódio, cloro, água e potássio, enquanto o ADH é o principal responsável pela regulação da absorção de água. Apesar de ter papel menor, o peptídio natriurético atrial (PNA) participa na inibição da reabsorção de eletrólitos e água.2,3,7,10
Sistema Renina-Angiotensina-Aldosterona
O SRAA é constituído por uma sequência de processos fisiológicos que auxiliam na regulação da volemia, da pressão arterial e da absorção e da secreção de eletrólitos.

Quando há um quadro de hipovolemia e/ou hipotensão, a redução da distensão da parede da arteríola aferente estimula a secreção de renina pelas células justaglomerulares. A secreção de renina também pode ser diretamente estimulada pelo sistema autônomo simpático.
A renina, uma vez secretada, estimula a conversão do angiotensinogênio formado pelas células hepáticas em angiotensina I, um peptídio de menor tamanho composto por 10 aminoácidos. Na penúltima etapa da cascata fisiológica do SRAA, a angiotensina I é metabolizada em sua forma ativa, a angiotensina II mediante a enzima conversora de angiotensina (ECA), alvo farmacológico de inúmeros medicamentos utilizados para o controle da hipertensão arterial (Figura 1.2).1-4
A angiotensina II cumpre três funções fisiológicas com o intuito de manter a volemia e a pressão arterial:
1. Estímulo à vasoconstrição da arteríola aferente acarretando redução da filtração glomerular.
2. Estímulo à produção de aldosterona pelo córtex adrenal, que, por sua vez, estimula a reabsorção de sódio, cloro e água e excreção de potássio nos túbulos coletores.
3. Aumento da reabsorção de sódio, cloro e água ao nível do túbulo contorcido proximal.

Angiotensinogênio
Angiotensina I
Angiotensina II


Enzima conversora de angiotensina



adrenalRins
Nutrição em Nefrologia no Dia a Dia 6
↓ Pressão sanguínea
Renina ↓ Pressão arterial
vascular Hipófise posterior Córtex
Vasoconstrição Hormônio antidiurético Aldosterona Reabsorção
sódio Figura 1.2 Sistema renina-angiotensina-aldosterona (SRAA)
Músculo liso
de água e
Avaliação Nutricional
4 Triagem Nutricional, 21
5 Avaliação Antropométrica, 27
6 Avaliação da Ingestão Alimentar, 36
7 Marcadores Bioquímicos, 40
CAPÍTULOS
Parte II
Avaliação Nutricional
4 Triagem Nutricional
Cristiane Ferreira Moraes
Introdução
O estado nutricional adequado é fundamental para a manutenção da saúde e, por isso, exerce influência nos desfechos clínicos de pacientes com doença renal crônica (DRC). A desnutrição, comumente observada nesses pacientes, está intimamente associada às altas taxas de hospitalização, complicações e mortalidade.1 Por ser uma condição grave com consequente impacto negativo na qualidade de vida e evolução clínica dos pacientes, a identificação precoce do risco nutricional mostra-se essencial para implementar ações necessárias à prevenção ou à reversão da desnutrição.2
Triagem de Risco Nutricional e Processo de Cuidado em Nutrição
Por definição, triagem é o “processo de identificação de pacientes, clientes ou grupos que poderiam ter um diagnóstico em nutrição e se beneficiariam da avaliação e
intervenção de um nutricionista”.3 A triagem nutricional é reconhecidamente importante, mas não obrigatória, para todos os indivíduos atendidos por um nutricionista.
Na prática, a triagem é uma etapa inicial, rápida e fácil que pode ser aplicada em toda e qualquer população, permitindo identificar precocemente pacientes em risco nutricional, sobretudo de desnutrição. Em uma escala de risco, os pacientes hospitalizados são os mais suscetíveis aos distúrbios nutricionais. Considerando a faixa etária, idosos e crianças são os mais passíveis de risco nutricional.4
Na DRC, inúmeros fatores predispõem à desnutrição, como acidose metabólica, perda de nutrientes durante os procedimentos dialíticos e resistência aos hormônios anabólicos.5,6 A prevalência de desnutrição aumenta conforme a progressão da doença, alcançando de 28% a 54% dos pacientes em hemodiálise (HD).7 Portanto, quando se trata de pacientes com DRC, sabe-se que também se refere a uma população de maior risco nutricional.
Uma vez identificado o risco nutricional, o processo de cuidado em nutrição (Figura 4.1) deve ser iniciado o
Ca P ítul O
Sistema de Triagem e Referência
PCN Avaliação e reavaliação Diagnóstico Monitoramento e aferição Intervenção Figura 4.1 Processo de cuidado em nutrição (PCN) Fonte: adaptada de Skipper et al., 2020.3
Sistema de Gestão de Resultados
Passo 1
Pontuação do IMC
IMC kg/m2
>20 (>30 obesidade)
18,5 a 20
Pontuação
<18,5 =0 =1 =2
Passo 2
Pontuação da perda de peso
Perda de peso involuntário nos últimos 3 a 6 meses
Pontuação =0 =1 =2 % <5 5 a 10 >10
Se não for possível obter a altura e o peso, consulte o texto para maiores informações
Passo 4
Risco geral de malnutrição
Somar todas as pontuações para calcular o risco geral de malnutrição
Pontuação 0 1 2 ou >
Risco
Baixo risco
Risco médio
Alto risco
Passo 5
Linhas de orientação de controle
0
Baixo risco
Cuidados de saúde de rotina
Repetir o rastreio:
Hospital: semanalmente
Instituições de cuidado: mensalmente
Comunidade: anualmente para os grupos especiais, por exemplo os indivíduos >75 anos de idade
1 Risco médio
Observar
Registrar a ingestão nutricional durante 3 dias:
Se for adequada: preocupação ligeira e repetir o rastreio
Hospital: semanalmente
Instituição de cuidados: pelo menos mensalmente
Comunidade: pelo Pelo menos de 2 a 3 meses
Se for inadequada: preocupação clínica– seguir os políticos locais, definir objetivos, melhorar e aumentar a ingestão nutricioal geral, monitorar e rever plano de cuidados regularmente
Passo 3
Pontuação da consequência da doença grave
Se o indivíduo está gravemente doente e reduziu drasticamente a ingestão nutricional ou se prevê não conseguir alimentar-se durante >5 dias
Pontuação 2
É impossível qua a consequência de doença grave seja aplicada fora do hospital
Todas as categorias de risco:
Tratar as condições subjacentes e prestar ajuda e aconselhamento nas opções alimentares, nos alimentos e nas bebidas quando necessário
Registrar a categoria de risco de malnutrição
Registrar a necessidade de dados especiais e seguir a política local
Obesidade:
2 ou + Alto risco
Tratar*
Remeter ao nutricionista, à equipe de suporte nutricional ou implementar a política local
Definir objetivos, melhorar e aumentar a ingestão nutricional geral
Monitorar e rever o plano de:
Cuidados hospital: semanalmente
Instituição de cuidados: mensalmente
Comunidade: mensalmente
*A menos que se suspeite poder prejudicar ou não beneficiar como o suporte nutricional, por exemplo morte iminente
Registrar a presença de obesidade. Para os doentes com codições subjacentes, estas são geralmente controladas antes do tratamento da obesidade
Reavaliar os indivíduos identficados como estando em risco à medida que vão passando pelas instituições de cuidado
Consulte o folheto explicativo de “MUST” para obter informações mais detalhadas e o relatório “MUST” para obter informações sobre as provas corroborantes
Figura 4.2 Instrumento de triagem universal de desnutrição (MUST)
Fonte: adaptada de Bapen, 2023.10
Nutrição em Nefrologia no Dia a Dia 24
Parte
Recomendações Nutricionais na Doença Renal Crônica
8 Tratamento Conservador, 47
9 Hemodiálise e Hemodiafiltração, 58
10 Diálise Peritoneal, 68
11 Transplante Renal, 75
12 Diabetes, 85
13 Obesidade, 93
14 Desnutrição, 99
15 Doenças Cardiovasculares, 107
CAPÍTULOS
III
Recomendações Nutricionais na DRC
Hemodiálise e Hemodiafiltração
Fabiana Baggio Nerbass Miriam Ghedini Garcia Lopes Viviane de Oliveira Leal
Introdução
A prevalência de pacientes em diálise no Brasil aumenta a cada ano. Em 2013, havia pouco mais de 100 mil pessoas em diálise no país e, em menos de 10 anos, esse número se elevou praticamente 50%. Segundo os dados do último Censo Brasileiro de Diálise (CBD), em 2022, 153.831 pacientes estavam em diálise no Brasil.1
A hemodiálise (HD) e a hemodiafiltração (HDF) são modalidades de diálise que consistem na filtração do sangue realizada por um dialisador externo. A HD é mais prevalente no país, sendo utilizada como tratamento por mais de 90% dos pacientes. A prevalência de terapia renal substitutiva (TRS) por HDF foi investigada apenas nos dois últimos anos do CBD, tendo sua prevalência mais que dobrado no período, alcançando quase 5% dos pacientes em diálise.1
Desde os estágios iniciais da doença renal crônica (DRC), intervenções nutricionais devem fazer parte do tratamento com o objetivo de contribuir para o manejo da DRC e suas comorbidades, bem como melhorar o perfil metabólico desses pacientes. No tratamento conservador, as principais metas nutricionais são preservar a função renal, protelar o início da TRS e promover melhor saúde cardiometabólica. Na fase dialítica, o objetivo do tratamento nutricional consiste em reduzir os sintomas urêmicos, prevenir o desequilíbrio hidreletrolítico, garantir estado nutricional adequado, auxiliar no controle da resistência à insulina, da hipertensão, da dislipidemia, da inflamação e do estresse oxidativo, assim como mitigar o risco de doenças cardiovasculares (DCV).
Características da Hemodiálise e da Hemodiafiltração
O processo de HD ou HDF ocorre por difusão de moléculas em solução por meio de uma membrana semipermeável artificial que proporciona remoção do excesso de líquidos, manutenção do estado ácido-básico e da homeostase eletrolítica e depuração de solutos (como ureia, creatinina e eletrólitos), dependendo de seu peso molecular.
Os princípios básicos da remoção de solutos por diálise são difusão e convecção. A difusão é o movimento
de solutos de uma área de alta para outra área de baixa concentração até que o equilíbrio seja alcançado. No caso de convecção, o solvente (água) transporta os solutos através da membrana e o fluido é removido em um processo conhecido como ultrafiltração.2 Assim, tanto a HD quanto a HDF propiciam a filtração do plasma urêmico por meio do dialisador externo, mas, enquanto a HD utiliza o transporte de moléculas por difusão, na HDF tal processo ocorre também por convecção, propiciando a eliminação de moléculas com maior peso molecular.2 O acesso vascular costuma ser feito pela fístula arteriovenosa (FAV), que une uma veia e uma artéria superficiais no antebraço. Assim, o sangue é impulsionado por uma bomba até o filtro mecânico de diálise, contido na máquina de diálise. Nesse filtro, o sangue entra em contato com a solução de diálise, constituída por sódio, potássio, bicarbonato, cálcio, cloro, acetato e magnésio, ocorrendo as trocas de substâncias entre os dois líquidos (sangue e dialisato). Após ser filtrado, o sangue é retornado ao paciente pelo mesmo acesso vascular. Quando há impossibilidade de confecção ou aguardo da maturação da FAV, bem como por preferência do paciente, outros tipos de acessos vasculares podem ser utilizados por meio da instalação venosa de cateteres temporários (cateter de duplo lúmen) ou de longa permanência (permcath) (Figura 9.1).
Ambos os tratamentos (HD e HDF) são geralmente realizados por 4h, 3×/semana. Contudo, há variações em relação ao tempo de duração e/ou frequência do procedimento. A diálise diária consiste em sessões de menos de 3h, 6×/semana, enquanto a diálise noturna acontece durante a noite, também 3×/semana, mas por período estendido (>5h/sessão). Já a HD de alto fluxo tem características de duração e frequência semelhantes à terapia convencional, porém são usados dialisadores específicos capazes de remover toxinas de alto peso molecular. Avalia-se a adequação da diálise por meio do cálculo do Kt/V que considera em sua fórmula o clearance de ureia do dialisador, o tempo de tratamento e o volume de distribuição de ureia do paciente. Quando se realiza o procedimento 3×/semana, o valor de Kt/V mínimo para que a diálise seja considerada eficaz é de 1,2. Para esquemas de tratamento com frequência de sessões diferentes, o Kt/V semanal superior a 2,1 é o mínimo
Ca P ítul O
9




Figura 9.1 (A a C) Para a realização da hemodiálise (HD) e da hemodiafiltração, o sangue sai e é filtrado pela membrana de diálise, que fica acoplada à máquina de HD (A ). O acesso vascular costuma ser por acesso permanente (fístula arteriovenosa) (B) ou temporário (cateter de duplo lúmen) (C )
C APÍTULO 9 Hemodiálise e Hemodiafiltração 59
C
A B
14
Desnutrição
Denise Mafra Denis Fouque
Introdução
De acordo com a definição da Organização Mundial da Saúde (OMS), a desnutrição ocorre quando a ingestão de nutrientes e energia é insuficiente para atender às necessidades energéticas do indivíduo. Isso resulta em baixo peso, comumente avaliado pelo índice de massa corporal (IMC), calculado com a seguinte equação:1
IMC = peso (kg)/(Altura (m2))
A European Society for Clinical Nutrition and Metabolism (Espen) define desnutrição como alterações na composição corporal com consequentes comprometimentos físico e mental que causem efeitos adversos decorrentes do fornecimento insuficiente ou da absorção incorreta de nutrientes essenciais.2 No entanto, o termo “desnutrição” tem gerado muita confusão na área de nutrição renal, e diferentes nomenclaturas têm sido utilizadas para descrever a deterioração do estado nutricional nos pacientes com essa condição, como caquexia urêmica, desnutrição urêmica, desnutrição proteico-energética e síndrome do complexo desnutrição-inflamação, entre outros.
Inicialmente, “desnutrição” foi usado para descrever fome e consequente redução da reserva de gordura e músculo. Contudo, muitas vezes, este não é o caso dos pacientes com doença renal crônica (DRC). Assim, propôs-se o termo desnutrição proteico-energética, que tratava da deficiência de energia com aumento do catabolismo de proteínas. Em 2008, a International Society of Renal Nutrition and Metabolism (ISRNM)3 sugeriu o termo protein wasting energy, que, apesar de não ter tradução adequada para o português, sugere distúrbios nutricionais no paciente com DRC em razão da diminuição dos estoques de proteínas e gordura associadas às condições características da DRC, descritas com mais detalhes a seguir, como inflamação e acidose metabólica, e não necessariamente em consequência da reduzida ingestão de energia e nutrientes.
À luz dos estudos epidemiológicos, os critérios para diagnóstico de desnutrição precisam ser atualizados. Todavia, as consequências e o tratamento dos distúrbios nutricionais dos pacientes com DRC são mais importantes para serem discutidos do que a nomenclatura que
será utilizada, pois a presença de desnutrição é um dos mais fortes preditores de morbidade e mortalidade em pacientes com DRC.
Ferramentas Usadas para o Diagnóstico de Desnutrição
Por não existir um indicador amplo e único para o diagnóstico nutricional dos pacientes com DRC, os métodos compostos de avaliação do estado nutricional têm sido muito empregados. Assim, muitos estudos têm utilizado a avaliação subjetiva global (ASG) de 7 pontos4 (Figura 14.1) e o malnutrition inflammation score (MIS)5 (Figura 14.2) (para pacientes em hemodialise [HD] e transplantados), como ferramentas para o diagnóstico de desnutrição, por terem sido validados como preditores de mortalidade em pacientes com DRC.6
Além disso, existem inúmeras classificações específicas e ferramentas criadas por diferentes sociedades, que podem ser utilizadas para diagnosticar a desnutrição nos pacientes com DRC (Figura 14.3). Contudo, vários questionamentos devem ser feitos quanto à utilização dessas ferramentas, já que, por exemplo, pacientes com DRC apresentam comumente baixos valores de hemoglobina, em razão da redução da produção de eritropoetina (ERO) pelos rins. Portanto, a hemoglobina não poderia ser usada como critério para desnutrição, como propõe a sarcopenia, cachexia and wasting disorders (SCWD).
O termo sarcopenia ganhou destaque nos estudos envolvendo estado nutricional de pacientes com DRC. A sarcopenia caracteriza-se pela redução progressiva e generalizada de massa muscular somada à redução de força muscular e/ou ao desempenho físico inerente ao envelhecimento. No entanto, pode também estar presente na vigência de doenças crônicas, como a DRC, mesmo em indivíduos jovens.3,7,8 Os critérios diagnósticos para sarcopenia são abordados em mais detalhes no Capítulo 41, Massa Muscular: Importância e Perspectivas
Considerando as inúmeras demandas dos serviços de diálise e da rotina hospitalar, o comprometimento do estado nutricional pode ser avaliado de forma mais simples pela coexistência de redução da ingestão alimentar e perda de peso não intencional ou retenção hídrica (que pode mascarar a perda de peso).9 O IMC isoladamente
Ca P ítul O
Bioquímica
Albumina<3,8g/dL
PEW (ISRNM)
Pré-albumina<30mg/dL (válidoapenasparadiálise)
Colesterol <100mg/dL
Massacorporal
IMC<23kg/m2
↓ Peso nãointencionalde5%em3 mesesou 10% em 6 meses
Percentual de gordura corporal <10%
Massamuscular
↓ Massamuscularem5%em3 mesesou 10% em 6 meses
↓ Circunferência muscular do braço>10% em relação ao percentil50da população de referência
Dieta
Redução não intencional da ingestão de proteína (diálise: <0,8g/kg/dia por >2 meses; estágios 2 a 5: <0,6g/kg/dia)
Redução não intencional da ingestão de energia: <25kcal/kg/dia por >2 meses
PEW= 1 critério em três das quatro categorias propostas
GLIM
Critérios fenotípicos – antropometria:
IMC<20kg/m2 para <70 anos ou IMC<22kg/m2 para >70 anos de idade
↓ Peso não intencional de 5% nos últimos 6 meses ou >10% em mais de 6 meses
↓ Massa muscular validada por métodos de composição corporal
Critérios etiológicos
Dieta: <50% da recomendação de energia por >1 semana ou qualquer redução em 2 semanas ou presença de sintomas gastrintestinais crônicos que afete a digestão ou absorção de alimentos
Inflamação: doença aguda ou crônica
GLIM= pelo menos 1 critério fenotípico e 1 critério diagnóstico
ESPEN
IMC <18,5 kg/m ou perda de peso não intencional 2 combinada com idade relacionada ao IMC (<20kg/m para <70 anos ou <22kg/mpara >70 22 anos)
Índice de massa livre de gordura <17kg/mpara 2 homens e 15kg/m para mulheres 2
Bioquímica
Albumina <3,2g/dL
Hemoglobina <12g/dL
PC-R >5mg/L e IL-6 >4pg/mL
Antropometria
IMC >20kg/m2
↓ Peso não intencional de 5% em 12 meses
↓ Circunferência muscular braço < percentil 10 segundo idade e sexo Índice de massa magra apendicular <5,45kg/m2 para mulheres e <7,5kg/m para homens 2
Fadiga
Dieta: <20kcal/dia ou <70% da ingestão habitual
↓ Apetite
Caquexia= erda de peso >5% em p 12 meses ou IMC <20kg/m2 + três dos demais critérios
Figura 14.3 Sugestão de alguns critérios para o diagnóstico clínico da desnutrição
PeW: protein energy wsting; Glin: global leadership initiative on malnutrition; IMC: índice de massa corporal; ISRNM: International Society of Renal Nutrition and Metabolism; Espen: European Society for Clinical Nutrition and Metabolism; SCWD: sarcopenia, cachexia and wasting disorders
o balanço de nitrogênio em pacientes com DRC clinicamente estáveis que recebem dietas hipoproteicas e que, por conseguinte, o risco de desnutrição é mínimo. Inclusive, um estudo mostrou que há mudança na dinâmica do músculo esquelético com a dieta hipoproteica: isso ocasiona diminuição na degradação proteica e melhora na eficiência do metabolismo proteico. Tais alterações permitem minimizar as perdas de nitrogênio muscular e podem contribuir para a preservação do equilíbrio de nitrogênio e da massa muscular quando ocorre diminuição na ingestão proteica.6,11,12 Vale lembrar que, para isso, a ingestão energética deve ser superior a 30kcal/kg/dia para promover o balanço de nitrogênio neutro ou positivo.11,12
A desnutrição (levando em consideração o que foi discutido para o diagnóstico) em pacientes com DRC é multifatorial. Entre os fatores associados à desnutrição na DRC, estão:13
Redução no apetite, incluindo a redução de ingestão calórica que ocorre nos dias de diálise.
Acidose metabólica.
Deficiência de vitamina D.
Resistência à insulina e outras alterações hormonais.
Inflamação.
Disbiose intestinal.
Acúmulo de toxinas urêmicas.
Baixo nível de exercício físico.
Senescência.
Desbalanço redox.
Presença de depressão que muitas vezes acomete o paciente com DRC.
Fatores Relacionados à Diálise
O clearance das toxinas urêmicas depende da adequação da diálise. A medida de adequação mais utilizada é
Nutrição em Nefrologia no Dia a Dia 102
Caquexia (SCWD)
Parte IV
Nutrição
em
Nefrologia nos Ciclos de Vida
16 Pediatria, 121
17 Gestação e Lactação, 134
18 Geriatria, 145
CAPÍTULOS
Nutrição em Nefrologia nos Ciclos de Vida
16 Pediatria
Karla Thaís Resende Teixeira
Introdução
A doença renal crônica (DRC) é reconhecida como um problema de saúde global em razão do aumento de sua prevalência. Estimativas recentes apontam que aproximadamente 10% da população são acometidos com algum comprometimento da função renal. Em pediatria (até 19 anos de idade), o cenário não se mostra diferente, e projeções semelhantes têm se tornado cada vez mais disponíveis. No entanto, dados de prevalência da DRC na população pediátrica ainda são escassos. Uma hipótese para essa limitação é que muitos dos estudos na população pediátrica são feitos com pacientes hospitalizados ou em clínicas de diálise, subestimando a prevalência dos estágios iniciais da doença, que, por sua vez, são comumente encontrados de forma assintomática, dificultando o diagnóstico.1
No Brasil, um estudo com pacientes menores de 19 anos de idade, que participavam de programa de diálise em diversas regiões do país, evidenciou prevalência de 20 pacientes por milhão da população com idade compatível (PMPIC) e incidência de 6,6 PMPIC no ano de 2012.2 Na região Sudeste, a prevalência estimada foi de 23 PMPIC.3 Apesar do aumento da sobrevida em crianças com DRC, a mortalidade continua 30 vezes mais elevada do que na população pediátrica em geral.4
São inúmeras as consequências da DRC em crianças e adolescentes, como:
Distúrbio mineral e ósseo (DMO).
Anemia.
Desnutrição.
Complicações cardiovasculares.
Esta última é a principal causa de morte em crianças com DRC em diálise. No entanto, o impacto da disfunção renal sobre o crescimento, o desenvolvimento e a qualidade de vida consta como o principal aspecto a ser considerado nesta população.5
Etiologia
As principais causas de DRC em crianças envolvem:
Anomalias congênitas dos rins e do trato urinário (ureteres, uretra e/ou bexiga), frequentemente encontradas em menores de 5 anos de idade, como uropatia obstrutiva, displasia e hipoplasia renal.
Nefropatias hereditárias, como cistinose, doença renal policística, nefronoftise e síndrome de Alport.
Glomerulopatias, sendo estas as principais causas de DRC após os 12 anos de idade.
Porém, no Brasil as causas indeterminadas representam um terço da etiologia para DRC nas crianças em diálise.5,6 Muito se discute sobre a influência da gestação no desenvolvimento das doenças renais. Sabe-se que fatores genéticos contribuem para anomalias congênitas dos rins e do trato urinário. Em contrapartida, fatores epigenéticos têm importante atuação na determinação do número de néfrons. Grande parte dos néfrons é formada durante o terceiro trimestre de gravidez e, por isso, a prematuridade e o baixo peso ao nascer podem aumentar o risco do desenvolvimento de DRC por estarem associados à redução do número de néfrons. Assim, o nascimento antes da 36a semana gestacional pode comprometer o desenvolvimento renal em bebês pela suspensão da nefrogênese.7
Mostra-se indiscutível o aumento da prevalência de obesidade na população pediátrica nas últimas décadas. Apesar de ainda não se conhecer exatamente os mecanismos de lesão renal vinculados, é possível que haja comprometimento renal em crianças obesas antes mesmo do surgimento de complicações, como hipertensão e diabetes. Isso porque crianças obesas apresentam rins aumentados e com maior fluxo sanguíneo quando comparadas às crianças de peso normal, havendo também aumento da inflamação, hiperfiltração glomerular e albuminúria nesses pacientes.8
Classificação da Doença Renal Crônica
Antes de falar sobre a classificação da DRC, é preciso mencionar a avaliação da função renal em pediatria. Assim como para adultos, a taxa de filtração glomerular (TFG) mostra-se um importante marcador da massa renal funcionante. Na prática clínica, as diretrizes atuais recomendam o uso de fórmulas para estimar a TFG utilizando marcadores endógenos, como a creatinina e a cistatina C.9
A cistatina C tem se mostrado um marcador preciso para estimar a TFG por sua estabilidade (produzida
P ítul O
Ca
Nutrição
Tabela 16.4 Classificação do estado nutricional de crianças entre 0 e 10 anos de idade
Crianças de 5 a 10 anos de idade
E/I
Muito baixa estatura para a idade
Magreza acentuada
Muito baixo peso para a idade
Índices antropométricos
Crianças de 0 a 5 anos de idade
Muito baixa estatura para a idade
Magreza acentuada
Magreza acentuada
Muito baixo peso para a idade
Magreza Baixa estatura para a idade
Baixo peso para a idade
Eutrofia
Peso adequado para a idade
Magreza Baixa estatura para a idade
Magreza
Baixo peso para a idade.
escore Z –2
Escore Z –3
–2 < escore Z –1
Escore
percentil
Valores críticos
Percentil
Percentil
percentil
Percentil
Eutrofia
Eutrofia
Peso adequado para a idade
Estatura adequada para a idade
Estatura adequada para a idade ≥ Percentil 15 e ≤ percentil 85 > Escore Z –1 e ≤ escore Z +1 > Percentil 85 e ≤ percentil 97 > Escore Z +1 e ≤ escore Z +2 r isco de sobrepeso r isco de sobrepeso
Obesidade
Obesidade grave
Peso elevado para a idade
Sobrepeso
Sobrepeso
Sobrepeso > Percentil 97 e ≤ percentil 99,9 > Escore Z +2 e ≤ escore Z +3
Peso elevado para a idade
Obesidade Obesidade
> Percentil 99,9 > Escore Z +3
P/I: peso para idade; P/E: peso para estatura; IMC/I: índice de massa corporal para idade; E/I: estatura para idade.
Fonte : adaptada de SBP, 2021. 18
no Dia a Dia 124
em Nefrologia
P/I P/E IMC/I
P/I IMC/I
E/I
<
0,1 <
≥
0,1 e <
3 ≥
Z
<
Escore
–3
≥
3 e <
15 ≥
Z
Parte V
Nutrição em Outras Doenças Renais
19 Glomerulopatias, 163
20 Litíase, 169
21 Doença Renal Policística Autossômica Dominante, 177
22 Injúria Renal Aguda, 181
23 Síndrome Hepatorrenal, 189
24 Síndrome Cardiorrenal, 196
25 Onconefrologia, 201
CAPÍTULOS
Nutrição em Outras Doenças Renais
19 Glomerulopatias
Danielle de Souza do Nascimento
Introdução
Os glomérulos são estruturas presentes na porção inicial dos néfrons, responsáveis sobretudo pela ultrafiltração do plasma sanguíneo. As glomerulopatias, geralmente conhecidas como “glomerulonefrites (GN)”, constituem um grupo de doenças que acomete os glomérulos em virtude de alterações genéticas, inflamatórias, sistêmicas ou imunológicas.1-3
A apresentação clínica e laboratorial das GN é variada, com diferentes padrões de progressão e desfechos, sendo a síndrome nefrótica (SN) uma de suas manifestações mais características e de maior necessidade de acompanhamento nutricional. Em determinados casos, as GN culminam em acelerada perda de função renal,1,4 configurando, inclusive, a quinta causa de doença renal crônica (DRC) em diálise no Brasil.5 Desse modo, o diagnóstico precoce das GN e o tratamento clínico e nutricional adequado são imprescindíveis para o curso favorável da doença.
Glomerulonefrites Primárias e Secundárias
As GN podem ser classificadas em primárias e secundárias, de acordo com o acometimento renal e de outros órgãos:
GN primárias: quando se originam nos rins e acometem apenas estes órgãos, sendo os principais padrões histológicos a nefropatia por imunoglobulina A (NIgA), a glomerulopatia de lesões mínimas, a glomerulosclerose segmentar e focal (GESF), a nefropatia membranosa e a glomerulonefrite membranoproliferativa.
GN secundárias: quando o dano renal é gerado por consequência de outra doença sistêmica, como doença renal diabética (DRD), nefrite lúpica, amiloidose renal e glomerulopatias crescênticas.
Manifestações Clínicas das Glomerulonefrites
O glomérulo renal (tufo de capilares) localiza-se dentro do corpúsculo renal do néfron, que é formado pelos glomérulos e pela cápsula de Bowman (Figura 19.1). Os


Corpúsculo renal (com glomérulo e cápsula de Bowman)
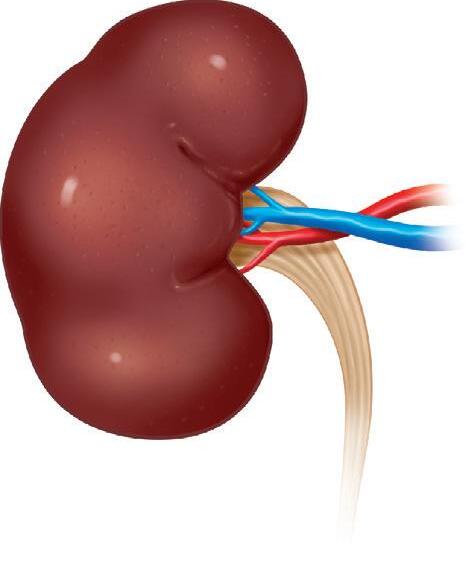
Ca P ítul O
Rim
Figura 19.1 Estrutura do glomérulo
Néfron
na matriz extracelular que, no caso do diabetes, se caracteriza por proliferação da membrana basal e expansão mesangial, que culmina em última análise com redução da superfície de filtração glomerular e redução da seletividade de proteínas (mais detalhes no Capítulo 12, Diabetes). Já na amiloidose renal, há deposição extracelular de amiloide, material fibrilar que pode ser derivado de diferentes tipos de proteínas precursoras que adquirem conformação errônea. Componentes genéticos têm participação importante em diversas formas de amiloidose.15
Há, ainda, GN que cursam com qualquer síndrome clínica, como a NIgA e a nefrite lúpica. A NIgA, também conhecida por doença de Berger, é uma doença autoimune na qual ocorre deposição de complexos imunes circulantes, constituídos principalmente por IgA (apresentam maior probabilidade de acúmulo nos glomérulos por conta de a filtração renal depender do tamanho e da carga da molécula). Embora sua fisiopatologia ainda não esteja completamente esclarecida, o depósito de IgA desencadeia inflamação e o consequente estímulo do sistema imunológico, tanto por mecanismos celulares quanto pela produção de anticorpos. Sua apresentação varia desde um quadro assintomático, apenas com hematúria microscópica, até disfunção renal rapidamente progressiva com GN crescêntica.16,17
Já a nefrite lúpica acomete 60% dos pacientes com lúpus eritematoso sistêmico (LES). No LES, os anticorpos marcam os próprios tecidos e deflagram resposta inflamatória contra articulações, rins e sistema nervoso central. Anticorpos IgG contra o ácido desoxirribonucleico (DNA), o ácido ribonucleico (RNA), as proteínas e os fosfolipídios são responsáveis pela disfunção renal, a qual decorre da deposição de imunocomplexos, de vasculites ou da formação de trombos intracapilares. Entre as manifestações clínicas da nefrite lúpica, estão: edema de membros inferiores, de face ou generalizado, ganho de peso, espuma na urina, HAS, distúrbios da coagulação, maior propensão a infecções, hematúria e injúria renal aguda (IRA). Se não for tratada de forma adequada, pode haver evolução para DRC com necessidade de diálise.18 A Tabela 19.1 apresenta as principais GN e suas características clínicas.
Diagnóstico e Tratamento Clínico
As GN são quase sempre diagnosticadas por biopsia. Embora a análise de urina, a TFG estimada e as características individuais do paciente possam apontar para o possível diagnóstico, na maior parte dos casos apenas a avaliação anatomopatológica do material obtido por biopsia renal consegue determinar o diagnóstico preciso. 3,8
Entretanto, muitas complicações decorrentes das GN estão mais relacionadas à apresentação clínica do que ao padrão histopatológico. Desse modo, o manejo não medicamentoso adequado de complicações ligadas às GN é importante para melhor prognóstico. Destaca-se o controle de edema, HAS e proteinúria, além de outras alterações metabólicas decorrentes da SN, como dislipidemia. No entanto, a terapia não medicamentosa pode ser desnecessária em caso de GN apenas com hematúria microscópica, TFG preservada, ausência de proteinúria ou hipertensão ou em caso de doenças com alterações mínimas e rápida remissão.8
Quanto ao tratamento medicamentoso, como algumas GN resultam da invasão renal por imunocomplexos ou células do sistema imunológico inato e adaptativo, o tratamento costuma ser fundamentado principalmente no uso de imunossupressores e corticosteroides. Além disso, medicamentos com potencial renoprotetor, como os inibidores da enzima conversora de angiotensina (IECA) e os bloqueadores do receptor de angiotensina II (BRA), podem ser utilizados.4,8 Os pacientes que têm sensibilidade ao tratamento com corticosteroides e manifestam recidivas frequentes podem utilizar ciclofosfamida e micofenolato mofetil, entre outros medicamentos.11
O uso de corticosteroides de forma crônica está relacionado ao aparecimento de muitos efeitos colaterais, como osteoporose. A terapia medicamentosa provoca diminuição da absorção de cálcio no túbulo renal, o que favorece o surgimento de distúrbio metabólico e ósseo (DMO). A ciclofosfamida pode acarretar, ainda, disfunção gonadal, alopecia e cistite hemorrágica. Já a ciclosporina está relacionada ao surgimento de hipertricose (crescimento excessivo de pelos) e hipertrofia gengival. Apesar
Tabela 19.1 Glomerulonefrites (GN) e suas manifestações clínicas
Manifestações clínicas
GN associadas à síndrome nefrótica
GN associadas à síndrome nefrítica
GN rapidamente progressiva
Lesões de matriz extracelular
GN com qualquer síndrome clínica
IgA: imunoglobulina A.
Glomerulonefrites
GN por lesões mínimas
Glomerulosclerose segmentar e focal
Nefropatia membranosa
GN pós-estreptocócica
GN membranoproliferativa
GN crescêntica
Nefropatia diabética
Amiloidose renal
Nefropatia por IgA
Nefrite lúpica
Nutrição em Nefrologia no Dia a Dia 166
Parte VI
Orientações Nutricionais Específicas
CAPÍTULOS
26 Potássio, 211
27 Fósforo, 222
28 Outros Minerais (Ferro, Cálcio, Zinco e Selênio), 230
29 Acidose Metabólica, 238
30 Vitaminas, 244
31 Sódio e Líquidos, 255
Orientações Nutricionais Específicas
Outros Minerais (Ferro, Cálcio, Zinco e Selênio)
Milena Barcza Stockler-Pinto Pricilla de Castro Trigueira
Introdução
Os minerais são oligoelementos que estão presentes em pequenas quantidades no organismo, sendo considerados essenciais aqueles que apresentam importante função fisiológica ou que fazem parte de estruturas metabólicas fundamentais, como o ferro, o cálcio, o zinco e o selênio. Portanto, a adequada ingestão desses minerais é imprescindível para a manutenção da saúde. 1-3
Os pacientes com doença renal crônica (DRC) têm risco de desenvolver deficiências de ferro, selênio e zinco, o que, em última análise, pode afetar seu estado clínico. No caso do cálcio, podem ocorrer redução ou aumento de seus níveis séricos, conforme, principalmente, a presença e o tipo de distúrbio mineral e ósseo (DMO). As deficiências de minerais estão relacionadas à ingestão alimentar insuficiente, em decorrência de falta de apetite ou restrição de alimentosfonte, absorção intestinal alterada, disbiose intestinal e, em casos de pacientes em diálise, perda de micronutrientes durante o processo dialítico. 4-8
Ferro (Fe)
Considera-se o ferro (Fe) um elemento essencial para o funcionamento de processos metabólicos por ser cofator de hemoproteínas e enzimas que atuam no transporte de oxigênio para os tecidos e no metabolismo de energia (hemoglobinas, catalases, peroxidases); no controle do crescimento e da diferenciação celular e da síntese de ácido desoxirribonucleico (DNA) –; e na respiração celular (citocromos).9,10
O ferro apresenta dois estados químicos estáveis, o estado férrico (Fe3+) e o ferroso (Fe2+). Caso não esteja em seu estado ferroso ou ligado à proteína heme, o ferro precisa ser convertido de Fe3+ para Fe2+ pela enzima redutase férrica citocromo B duodenal (Dcytb), que atua na presença de pH ácido, para que ocorra sua absorção no duodeno e no jejuno.9,11 Após sua absorção pelos enterócitos, o ferro é transportado pela transferrina para os hepatócitos e as células da medula óssea e armazenado como ferritina para, então, compor a hemoglobina e a mioglobina.12
Por não ter mecanismos excretores como os demais minerais e por participar de reações de redução-oxidação, quando em excesso, o ferro tem capacidade de toxicidade em consequência da produção de radicais livres. Logo, seu metabolismo apresenta mecanismos para controlar e gerir seus níveis pela absorção de acordo com a demanda. Em situações em que há elevada concentração de ferro, o hormônio peptídico hepcidina liga-se à proteína exportadora de ferro, ferroportina 1, presente em enterócitos, hepatócitos e macrófagos reticuloendoteliais e promove a redução da absorção intestinal de ferro, a inibição da liberação de ferro das reservas orgânicas e o favorecimento do estoque de ferro por meio da ferritina. Já em situações de baixa concentração de ferro ou hipoxia tecidual, a expressão da hepcidina é reduzida para que a absorção e a disponibilidade de ferro sejam otimizadas.10,11
Na DRC, a deficiência de ferro é uma das deficiências nutricionais mais comuns, sendo a anemia uma complicação muito prevalente em razão da própria fisiopatologia da DRC. A alterada absorção intestinal de ferro ocasionada pela uremia, além da redução da meia-vida eritrocitária, da perda de sangue durante a diálise e da presença de inflamação crônica, características comuns na DRC, predispõe à deficiência de ferro e, consequentemente, à anemia. Contudo, a deficiência de eritropoetina (EPO), hormônio produzido pelos rins e que regula a proliferação e a diferenciação de eritrócitos, é a principal causa de anemia nos pacientes com DRC, sendo comum a indicação do tratamento com EPO recombinante humana. 13,14
Segundo o Kidney Disease Improving Global Outcomes (KDIGO) em seu documento Clinical Practice Guideline for Anemia in Chronic Kidney Disease, para que se tenha o diagnóstico de anemia, é necessário que o paciente apresente:14
Níveis de hemoglobina <13,0g/dL para homens e <12,0g/dL para mulheres.
Saturação de transferrina ≤30%.
Ferritina sérica ≤500ng/mL.
A anemia nos pacientes com DRC pode contribuir para fadiga, fraqueza, dispneia e alterada função cognitiva, sendo, então, importante a adequada suplementação de ferro e/ou EPO, conforme o caso.13,14
Ca P ítul O 28
Recomendação Dietética
De acordo com o Institute of Medicine (IOM) da National Academy of Sciences,2 a ingestão dietética recomendada (RDA; do inglês, recommended dietary allowance) de ferro para homens adultos e mulheres na menopausa é de 8mg/dia e, para mulheres pré-menopausa, de 18mg/dia, sendo o limite máximo de ingestão tolerado (UL; do inglês, tolerable upper intake level) de 45mg/dia.
Em razão das alterações na absorção intestinal decorrentes da uremia, nos pacientes em diálise a administração endovenosa de ferro é a via preferencial. Ademais, em casos de anemia grave, ineficiência da suplementação oral de ferro por, pelo menos, três meses ou se houver intolerância gastrintestinal, também é apropriado considerar a suplementação de ferro por via endovenosa, na tentativa de evitar a transfusão de sangue. 14,15
No caso dos pacientes em tratamento conservador, em que há indicação de dieta hipoproteica, a suplementação oral de ferro pode ser necessária, pois as carnes são as melhores fontes alimentares de ferro. Normalmente, a suplementação é prescrita pela equipe médica, de modo a fornecer aproximadamente 200mg de ferro elementar diariamente; para alguns pacientes, doses menores podem ser eficazes (no Brasil, a dose máxima de ferro a ser prescrita pelo nutricionista pode ser de até 45mg/dia). 16 Segundo o KDIGO, a suplementação por sulfato ferroso é a comumente utilizada por apresentar maior acessibilidade, mas não há evidências significativas que sugiram que outras formulações orais de ferro, como o ferro quelado, sejam mais eficazes ou apresentem menos efeitos colaterais. 14
Para os pacientes com DRC é fundamental monitorar os valores de hemoglobina, ferritina e ferro, além do uso da EPO, para estabelecer a necessidade e a dose de suplementação, já que a suplementação de ferro deve



ser feita com cautela por favorecer o estresse oxidativo e distúrbios gastrintestinais.13,14
Alimentos-Fonte
O ferro derivado da alimentação pode ser do tipo heme ou não heme. O ferro heme, derivado principalmente da hemoglobina e da mioglobina de fontes animais, como carne e frutos do mar, é a fonte mais biodisponível de ferro, correspondendo a 15% a 35% de ferro absorvido. Já o ferro não heme, encontrado sobretudo em derivados de plantas, como vegetais, leguminosas e cereais, apresenta absorção inferior a 10%, sendo esta dependente de fatores que podem influenciar sua biodisponibilidade.10,12
No momento da alimentação, é importante estar atento aos compostos alimentares que podem intensificar ou dificultar a absorção do ferro. Os alimentos que têm em sua composição o ácido ascórbico (frutas e vegetais) podem aumentar a disponibilidade do ferro não heme presente normalmente em vegetais. Já os alimentos que possuem fitato (leguminosas, cereais e oleaginosas), polifenóis (chá preto, café, vinho, legumes, cereais, frutas e vegetais), cálcio e ácido oxálico (espinafre, acelga, feijão e nozes) podem reduzir a absorção do ferro11 e, por isso, não devem ser ingeridos com refeições ricas em ferro quando o objetivo é aumentar o suprimento de ferro no organismo (Figura 28.1).
Cálcio
O cálcio (Ca) é elemento essencial para inúmeras funções biológicas, como manutenção da saúde óssea, funcionamento cardíaco, contração muscular, transmissão de impulsos nervosos, coagulação sanguínea, divisão celular e permeabilidade de membranas plasmáticas. Cerca de 99% do cálcio presente no organismo é encontrado














8mg/dia para homens e mulheres na menopausa








C APÍTULO 28 Outros Minerais (Ferro, Cálcio, Zinco e Selênio) 231
Ferro heme
18mg/dia
Ferro não heme
RDA:
para mulheres na pré-menopausa
Laranja Couve
Acerola
Brócolis
Café Oleaginosas Leguminosas Carne bovina 2,6mg/100g Atum 1,46mg/100g Fígado bovino 5,6mg/100g Ostra 26,7mg/100g Ovo 1,33mg/100g Feijão 1,5mg/100g Taioba 1,62mg/100g Couve 0,45mg/100g Ervilha em vagem 1,44mg/100g Grão-de-bico 2,43mg/100g
Fonte
Chá preto
Figura 28.1 Alimentos-fonte de ferro e ingestão dietética recomendada (RDA)
: adaptada de Brasil, 2011.17
Parte VII
Aspectos Práticos na Doença Renal Crônica
CAPÍTULOS
32 Suplementação de Energia, 263
33 Suplementação de Proteínas, 270
34 Cetodieta, 281
35 A Vida na Cozinha com Dieta Hipoproteica, 289
Aspectos
Práticos na DRC
32
Suplementação de Energia
Julie Calixto Lobo
Introdução
Na doença renal crônica (DRC), o manejo dietético adequado é crucial, pois as necessidades nutricionais mudam ao longo do curso da doença, desde seus estágios iniciais até o período pós-transplante.1 Além disso, inúmeras alterações metabólicas e nutricionais comuns nos pacientes com DRC, como hipercatabolismo, anorexia e acidose metabólica, predispõem à desnutrição (previamente discutidos no Capítulo 14, Desnutrição), o que, em última análise, está associado ao maior risco de morbidade e mortalidade.2-4 Assim, intervenções nutricionais apropriadas são fundamentais para garantir a ingestão energética adequada, manter o balanço nitrogenado (BN) neutro ou positivo e melhorar a composição corporal de tais pacientes.3,5
Recomendação de Energia para Pacientes com Doença Renal Crônica
As diretrizes atuais para a recomendação de energia e proteínas na DRC estão dispostas na Tabela 32.1. Segundo a National Kidney Foundation (NKF) em sua diretriz Clinical Practice Guideline for Nutrition in Chronic Kidney Disease, a recomendação de energia para manter o estado nutricional adequado é de 25 a 35kcal/kg/dia para pacientes em qualquer estágio da DRC (tratamento
conservador, diálise e pós-transplante).6 Uma ressalva deve ser feita para pacientes em diálise peritoneal (DP), que obtêm energia extra proveniente da glicose na solução de diálise (cerca de 300g de glicose/dia) e que deve ser levada em consideração na estimativa da ingestão energética dietética recomendada (para mais detalhes, consultar Capítulo 10, Diálise Peritoneal).7
Como a faixa de recomendação é grande (10kcal/kg, o que para um indivíduo de 70kg representaria uma diferença de 700kcal/dia), convém individualizar a oferta energética segundo idade, gênero, nível de atividade física, composição corporal, comorbidades (como hiperpartireoidismo e diabetes descompensado), presença de inflamação e metas de ganho/perda de peso, a fim de evitar o BN negativo, o catabolismo proteico, a depleção de massa magra e a desnutrição.3,6
Em situações em que a oferta energética individualizada não é possível de ser alcançada, como na desnutrição ou na presença de anorexia grave, mostra-se importante indicar a suplementação oral, iniciando com a oferta de alimentos de alta densidade calórica e/ou uso de suplementos orais, se necessário. Nas situações em que a ingestão oral não for suficiente para atender às demandas nutricionais, a nutrição enteral (NE) pode ser considerada. Caso a NE também não seja tolerada e/ou suficiente para atender às necessidades nutricionais, a nutrição parenteral (NP), ou mesmo a NP intradialítica, pode ser prescrita (Figura 32.1).
Tabela 32.1 Recomendações de energia (kcal/kg/dia) e proteína (g/kg/dia) para pacientes com doença renal crônica (DRC)
*Incluindo as calorias do dialisato. NKF/KDOQI: National Kidney
Ca P ítul O
Tratamento conservador Hemodiálise Diálise peritoneal Energia Proteínas Energia Proteínas Energia Proteínas NKF/KDOQI 25
35
0,28
Diabéticos:
25 a 35 1 a 1,2 25 a 35 1 a 1,2 Espen 35 0,55 a 0,60 ou 0,28 + cetoanálogos 35 1 a 1,2 35 1 a 1,2 EBPG – – 30 a 40 >1,1 35 >1,1 ISRNM 30 a 35 0,6 a 0,8 30 a 35 >1,2 30 a 35* >1,2g Peritonite: >1,5
a
0,55 a 0,60 ou
a 0,43 + cetoanálogos
0,6 a 0,8
Disease Outcomes Quality Initiative; Espen: European Society for Clinical Nutrition and Metabolism; EBPG: European Best Practice Guidelines; ISRNM: International Society of Renal Nutrition and Metabolism.
Foundation/Kidney
Intervenção 1
Alimentos de alta densidade calórica

2
Suplementos orais hipercalóricos
Intervenção 3
Intervenção 4
Nutrição enteral Nutrição parenteral



Figura 32.1 Intervenções possíveis para a recuperação do estado nutricional de pacientes com doença renal crônica
Planejamento Dietético
O planejamento dietético individualizado e adaptado à rotina laborativa e/ou de tratamento é a primeira estratégia para alcançar as metas nutricionais e prevenir/ tratar a desnutrição. No caso específico dos pacientes em hemodiálise (HD), a frequência e o turno de tratamento também devem ser considerados, já que os que realizam as sessões no turno intermediário geralmente estão na unidade de diálise no horário de uma grande refeição (almoço).
Inicialmente, o maior fracionamento e/ou porcionamento alimentar, além da inclusão de alimentos de alta densidade energética é interessante, sobretudo nos pacientes com limitações econômicas para adquirir suplementos orais industrializados. Sob tal perspectiva, são exemplos de alimentos a serem incluídos azeite, farinha/ farofa, mel, tubérculos, biscoitos e pães. Além disso, preparações em que possa haver adição de farinhas, leite em pó, creme de leite e frutas também são interessantes, como iogurtes, mingaus, vitaminas, bolos, muffins, suflês e omeletes.
Nos pacientes em diálise, a recomendação é de dieta hiperproteica (Tabela 32.1), portanto, a maior ingestão energética pode e/ou deve ser acompanhada de aumento proporcional da ingestão de proteínas. Entretanto, para os pacientes nos estágios anteriores à diálise, em que se preconiza a dieta hipoproteica, a inclusão de alimentos com elevada densidade energética, mas de reduzida quantidade de proteínas, é interessante para alcançar as necessidades calóricas sem comprometer a meta proteica (Tabela 32.2).
Por questões de praticidade ou nos casos em que não é possível alcançar as necessidades energéticas por meio da ingestão alimentar, considera-se a suplementação nutricional oral (SNO) a primeira estratégia de intervenção.
Suplementação Nutricional Oral
A SNO é considerada uma estratégia eficaz de suporte nutricional em casos em que o aconselhamento dietético, por si só, não se mostra suficiente para preencher a lacuna entre a ingestão real e as necessidades-alvo. 8,9 Além do déficit energético, diversos parâmetros podem ser utilizados para indicar o uso de SNO (Tabela 32.3).
O tempo preconizado para uso de SNO é de três meses, com administração de duas a três vezes ao dia, preferencialmente 1h após as principais refeições (para não comprometer a ingestão alimentar habitual) ou como última refeição do dia (ceia) ou, no caso dos pacientes em diálise, durante o procedimento de diálise como estratégia para amenizar/reverter o catabolismo. 2,10
No caso do uso da SNO durante a sessão de HD, intercorrências e inconvenientes (como sintomas gastrintestinais, diálise insuficiente, hipotensão pós-prandial, risco de aspiração e de contaminação) não são comumente relatados e podem ser contornados com monitoramento rigoroso.2,11,12
Além destes, outros cuidados devem ser tomados durante a SNO para que a estratégia de suplementação seja eficaz:3,11-13
A prescrição deve considerar a individualidade das metas nutricionais, tolerâncias e preferências do paciente.
A aceitabilidade da SNO quanto aos aspectos de aparência, sabor, cheiro, textura e preparo (nas formas de milk-shake, iogurte, suco, sobremesa, pó fortificante ou barra nutricional) deve ser avaliada.
A opção preferida deve ser de um suplemento rico em energia (pacientes em tratamento conservador) e proteínas (para pacientes em diálise), com fósforo e potássio em quantidades adequadas.
Nutrição em Nefrologia no Dia a Dia 264
Intervenção
Parte
Atualidades Científicas
CAPÍTULOS
36 Microbiota Intestinal nos Pacientes com Doenças Renais, 319
37 Estresse Oxidativo, Inflamação e Senescência, 329
38 “Dietas da Moda” para Pacientes com Doença Renal Crônica, 334
39 Suplementação de Proteínas e Creatina em Indivíduos Saudáveis e seu Impacto na Função Renal, 338
40 Discussão sobre Proteínas de Origem Animal e Vegetal, 344
41 Massa Muscular: Importância e Perspectivas, 350
VIII
Atualidades Científicas
Introdução
Microbiota Intestinal nos Pacientes com Doenças Renais
Julie Ann Kemp Natália Alvarenga Borges
O tema “microbiota” é de grande interesse tanto na área da pesquisa quanto na prática clínica, mas os termos microbiota e microbioma são muitas vezes empregados de maneira equivocada. Define-se microbiota como a presença de diferentes microrganismos (bactérias, arqueas, vírus, fungos e outros) que coexistem em determinado meio ambiente. Já o microbioma é a junção desses microrganismos aos seus metabólitos, elementos estruturais (ácido nucleico, proteínas e lipídios) e moléculas produzidas a partir da interação com o organismo do hospedeiro.1 Vale destacar, ainda, que o termo “flora” é obsoleto e inadequado.
A microbiota intestinal mostra-se essencial para as atividades bioquímicas do corpo humano, como produção de vitaminas, regulação do sistema imune inato e produção de ácidos graxos de cadeia curta (AGCC). No entanto, em pacientes com doença renal crônica (DRC), a existência de disbiose intestinal desencadeia produção de toxinas relacionadas aos inúmeros desfechos negativos que, em razão da renal reduzida, não são excretadas do organismo. Dessa forma, o desequilíbrio da microbiota intestinal vem ganhando notoriedade como novo fator relacionado à inflamação, estresse oxidativo, desenvolvimento e progressão da DRC e doenças cardiovasculares (DCV). Neste capítulo, serão abordadas as consequências da disbiose intestinal para pacientes com DRC e alguns resultados de estudos que envolvem a modulação da microbiota pela dieta.
Microbiota Intestinal
Entre os microrganismos formadores da microbiota, as bactérias são as mais abundantes e mais estudadas.1 A classificação taxonômica é responsável pela identificação e pela nomenclatura dos organismos vivos, incluindo as bactérias. Assim, a classificação taxonômica agrupa as bactérias com características semelhantes em sete categorias hierárquicas (reino, filo, classe, ordem, família, gênero e espécie), como: reino Bacteria, filo Actinomycetota, classe Actinomycetes, ordem Bifidobacteriales, família Bifidobacteriaceae, gênero Bifidobacterium e espécie Bifidobacterium bifidum Ca P
A microbiota intestinal apresenta dominância de seis filos:
1. Bacillota (antigo Firmicutes).
2. Bacteroidota (antigo Bacteroidetes).
3. Pseudomonadota (antigo Proteobacteria).
4. Actinomycetota (antigo Actinobacteria).
5. Fusobacteria.
6. Verrucomicrobia.
Entre estes filos, 90% são representados por Bacillota e Bacteroidota. O filo Bacillota é o mais abundante na microbiota intestinal humana, bem como diverso em sua composição. É composto majoritariamente por bactérias Gram-positivas anaeróbias.2 Por outro lado, o filo Bacteroidota é formado por bactérias Gram-negativas estritamente anaeróbias e sensíveis ao pH abaixo de 6,5.3 O corpo humano apresenta diferentes microbiotas, como a de pele, boca, respiratória, intestinal e vaginal. Essa variação de microbiota ocorre em consequência de cada um desses locais apresentar diferentes características, como pH, oxigênio, camada de muco e agentes antimicrobianos, capazes de causar modificações na composição e na abundância dos microrganismos. Na Figura 36.1 estão representados os principais filos de diferentes partes do corpo humano, sendo a microbiota intestinal a mais populosa, com aproximadamente 1014 unidades formadora de colônias (UFC)/mL.4,5
Cada indivíduo apresenta sua própria composição de microbiota intestinal, sendo esta variável ao longo do tempo e conhecida como variação intraindividual. Além disso, existe a variação interindividual, que é a variação da composição da microbiota intestinal entre pessoas diferentes. Essas variações, tanto intraindividual quanto interindividual, ocorrem em razão de diversos fatores internos e externos do hospedeiro (Figura 36.2). Um estudo observou que 126 fatores intrínsecos e extrínsecos podem atuar na alteração da microbiota intestinal. Entre esses fatores, 12 eram relacionados às doenças, 19 aos medicamentos, 60 aos alimentos e 4 ao hábito de fumar.6
Funções da Microbiota no Organismo
A microbiota intestinal tem importante atuação na saúde e na doença do hospedeiro. Atualmente, sabe-se que a
36
ítul O

Microbiotas presentes em diferentes partes do corpo humano


Actinobactéria, firmicutes, proteobactérias, bacteroidetes e fusobactéria
Actinobactéria, firmicutes, proteobactérias, bacteroidetes e cianobactéria

Actinobactéria, firmicutes, proteobactérias e bacteroidetes


Lactobacilli Actinobactéria, firmicutes, bacteroidetes, lactobacillae, proteobactéria e outros
Figura 36.1 Composição da microbiota em diferentes partes do corpo humano







36.2






















Nutrição em Nefrologia no Dia a Dia 320
Exercícios físicos Viade partoe amamentação Doenças Medicamentos Idade Exer amentação as Med d
Dieta
Figura
Fatores internos e externos que influenciam a composição da microbiota intestinal
Parte IX
Food as Medicine para Pacientes com Doença Renal Crônica
42 Vegetais, 361
43 Frutas, 367
44 Leguminosas, 374
45 Oleaginosas, 380
46 Café, Canela e Chocolate, 385
47 Temperos Naturais, 390
48 Própolis e Geleia Real, 397
49 Bebidas e Alimentos Fermentados, 401
50 Adoçantes, 405
CAPÍTULOS
Food as Medicine Pacientes com DRC
Frutas
Ligia Soares Lima Laís de Souza Gouveia Moreira
Introdução
As frutas são parte essencial de hábitos alimentares saudáveis. Uma dieta com variedade de alimentos de origem vegetal é importante para manter a saúde e o bem-estar,1 sendo seu consumo reduzido associado à maior ocorrência de doenças crônicas não transmissíveis (DCNT), como a doença renal crônica (DRC).2
A Organização Mundial da Saúde (OMS) recomenda a ingestão de, no mínimo, 400g de frutas e hortaliças (cerca de 5 porções) diariamente.3 No Brasil, os dados da Vigilância de fatores de risco e proteção para doenças crônicas por inquérito telefônico (Vigitel) revelaram que nem a metade da população alcança o consumo de frutas e hortaliças recomendado pela OMS.4
As frutas destacam-se por serem ricas em compostos bioativos5,6 capazes de desempenhar efeitos positivos em complicações comuns à DRC, como estresse oxidativo, inflamação, alteração da composição da microbiota intestinal e disfunção mitocondrial. Dessa forma, as frutas constituem alimentos que podem se enquadrar no conceito de food as medicine, tão importante para a modulação de complicações clínicas adversas inerentes à DRC.7-9
Ingestão de Frutas no Contexto da Doença
Renal Crônica e Complicações Associadas
O consumo de frutas por pacientes com DRC naturalmente nos remete ao seu conteúdo de potássio. A presença de hipercalemia é comum nos estágios mais avançados da DRC em razão da redução da função renal. Como as frutas são fontes relevantes de potássio, há tendência à restrição habitual de frutas por pacientes com DRC. As diretrizes internacionais recomendam o controle da ingestão de potássio para que suas concentrações séricas fiquem dentro dos valores normais. Entretanto, na ocorrência de hipercalemia, é interessante recomendar a restrição de frutas ricas em potássio, orientando o paciente a preferir aquelas com menor teor de potássio, em vez de restringir sua ingestão por completo (para mais detalhes, consultar Capítulo 26, Potássio).10-15
A restrição desnecessária de frutas limita a ingestão de nutrientes essenciais na dieta, como fibras, vitaminas
e minerais, além de reduzir o potencial alcalinizante da dieta.12,16 Portanto, quando os níveis séricos de potássio estiverem normais, o paciente deve ingerir frutas, visto que seu consumo, de maneira adequada e variada, está associado à:12
Redução da incidência do estágio final da DRC.
Prevenção e controle da hipertensão e diabetes, as duas principais causas de DRC.
Redução da incidência de doenças cardiovasculares (DCV), principal causa de mortalidade na DRC.17-20
Principais
Compostos Bioativos das Frutas e Mecanismos de Ação
Os efeitos salutares das frutas se dão particularmente pela presença de compostos bioativos e nutrientes, sendo os mais frequentes: carotenoides, flavonoides, antocianinas e ácidos fenólicos, que apresentam propriedades antioxidantes, anti-inflamatórias, anti-hipertensivas, antidiabéticas, além de serem cardio- e nefroprotetores.21
Por ser um país de rica diversidade botânica, existe grande diversidade de frutas típicas em cada região do Brasil, sobretudo na região Norte. Aliás, há crescente interesse por frutas, como acerola, juçara, pitanga, araçá, jabuticaba e açaí, em especial pela sua variedade de compostos bioativos.22
Muitos compostos presentes nas plantas, conhecidos por fitoquímicos, estão associados aos efeitos benéficos para a saúde (Figura 43.1). Entre estes, estão os terpenoides (como carotenoides), os alcaloides, os polifenóis, os compostos organossulfurados (como o sulforafano) e os compostos contendo nitrogênio.
Os polifenóis são os fitoquímicos mais comuns e fornecem grande quantidade de compostos bioativos. A Figura 43.2 mostra algumas frutas ricas em flavonoides, carotenoides e ácidos fenólicos, bem como suas ações no organismo, as quais serão brevemente discutidas.
Carotenoides
Os carotenoides, pigmentos lipossolúveis sintetizados por plantas e microrganismos, são responsáveis pelas colorações vermelha, laranja, rosa e amarela das frutas. Os vegetais verde-escuros também têm alto conteúdo de carotenoides, mas seu elevado teor de clorofila mascara
Ca P ítul O 43
Fitoquímicos
Terpenoides
Ácido gálico Ácido vanílico
Ácido siríngico Protocatecuico
p-cumárico
Ácido cafeico
Ácido ferúlico
Ácido cinâmico
Ácido sináptico
Figura 43.1 Classificação dos fitoquímicos
Morina
Cianidina Delfinidina Peonidina Petunidina Malvidina
Taxifolina Engeletina
Daidzeína Gliciteína Daidzina Formononetina

Carotenoides
Antioxidante
Anti-inflamatório
Flavonoides
Antidiabético
Antioxidante
Anti-inflamatório
Anti-hipertensivo
Nefroprotetor
Cardioprotetor
Ácidos fenólicos
Anti-inflamatório
Antioxidante
Antifibrótico
Antidiabético
Hipolipemiante
Nefroprotetor
Figura 43.2 Frutas ricas em carotenoides (A) flavonoides (B), e ácidos fenólicos (C)
a coloração característica deles. Os carotenoides são amplamente distribuídos na natureza, especialmente em frutas, como laranja, mamão, manga, melancia, melão, pêssego, tangerina e uvas.23
Os carotenoides apresentam diversas funções benéficas para a saúde e, na DRC, os efeitos anti-inflamatórios e antioxidantes são os mais bem elucidados. O consumo elevado de carotenoides totais foi inversamente associado à mortalidade de pacientes com DRC e, embora
o mecanismo não esteja completamente esclarecido, tal efeito pode estar relacionado às propriedades antioxidantes desses pigmentos.23-25
Os mecanismos de ação exercidos pelos carotenoides para promover efeitos antioxidantes são, principalmente, a capacidade de remoção de radicais livres, além da regulação positiva da expressão e ativação do nuclear factor erythroid 2-related factor 2 (Nrf2), fator nuclear responsável pela síntese de mais de 250 enzimas
Nutrição em Nefrologia no Dia a Dia 368
Alcaloides Polifenóis Compostos organossulfurados Compostos contendo nitrogênio
Não carotenoides Ácidos fenólicos Cumarinas Flavonoides Resveratrol
Taninos
Curcumina
Ácido hidroxicinâmico Flavonóis Flavonas FlavanóisFlavanonas Antocianinas Flavanonóis Isoflavonas
Kaempferol Miricetina Galangina
Rutina Apigenina Crisina Luteolina Catequina Epicatequina Epicatequina galato Naringenina Eriodictiol Hesperetina
Pelargonidina
Carotenoides
Piceatanol Estilbenos
Lignanas
Ácido hidroxibenzoico
Quercetina
Fisetin
Astibina
Genesteína
C B A
Parte X
Doença Renal Crônica Além do Ângulo Tradicional
CAPÍTULOS
51 Aspectos Psicológicos de Pacientes com Doença Renal Crônica, 413
52 O Paciente, 417
53 Resumos das Recomendações Nutricionais para Pacientes com Doenças Renais, 420
DRC Além do Ângulo Tradicional
Aspectos Psicológicos de Pacientes com Doença Renal Crônica
Fabiane Rossi dos Santos
Introdução
A doença renal crônica (DRC) caracteriza-se como uma doença complexa, que vai além da perda da função renal. As inúmeras mudanças acarretadas por diagnóstico e tratamentos constituem importantes estressores que podem impactar significativamente na qualidade de vida. Entre estes, destacam-se as mudanças nos hábitos de vida, como as recomendações de restrições alimentares e hídricas (abordadas inúmeras vezes em capítulos deste livro), o convívio com a cronicidade e a impossibilidade de cura, o medo da morte, as alterações corporais e consequentes impactos na autoimagem, a necessidade de tratamento continuado, as mudanças da vida profissional e as alterações nos papéis familiares, entre outros fatores que podem dificultar a adesão dos pacientes ao tratamento.
Nos estágios iniciais da DRC, a ausência de sintomas e de manifestações mais expressivas no corpo pode fazer com os pacientes não percebam a gravidade da doença e apresentem mais dificuldades no envolvimento com o tratamento. Já na hemodiálise (HD) e na diálise peritoneal (DP), as dificuldades encontram-se na adaptação à nova condição de vida, pautada nas restrições nas esferas física, social e emocional. No transplante, sua idealização como cura também pode fazer com que haja prejuízos importantes na adesão ao tratamento.
Dessa forma, este capítulo destina-se a discutir, com base em evidências científicas, a relação entre DRC e saúde mental, apresentar os transtornos mentais mais prevalentes nos pacientes e seus impactos na adesão ao tratamento, bem como as possibilidades de intervenção psicológica com enfoque na prevenção e no tratamento dos transtornos e na promoção da saúde mental nessas pessoas.
Doença Renal Crônica e Saúde Mental
A vivência da DRC e seus tratamentos fazem com que os pacientes enfrentem problemas físicos, sociais e psicológicos, entre os quais se destacam a flutuação emocional, a ansiedade, a depressão, o medo e o estresse, especialmente na fase inicial do tratamento. As terapias renais substitutivas (TRS) também causam mudanças
significativas na vida diária, interrupção no horário de trabalho, moradia e casamento, além da mudança no papel social que impõe problemas financeiros e laborais. Ajustamento social e adaptação psicológica são, assim, desafios a serem vencidos pelos pacientes.1
Dessa maneira, a DRC caracteriza-se por uma condição que acarreta impactos significativos na saúde mental, sendo fator de risco para o desenvolvimento de transtornos mentais, como depressão e ansiedade. A depressão constitui-se uma comorbidade presente em aproximadamente 30% a 40% dos pacientes com DRC e está associada ao aumento do risco de mortalidade e a outros desfechos desfavoráveis. Impactos à imagem corporal, bem como danos físicos, funcionais, metabólicos e sociais e fragilidade mental, podem afetar a qualidade de vida dessa população.2,3 Além disso, em pessoas submetidas ao transplante renal (TR), a depressão está associada à perda do enxerto e à mortalidade.4
Sabe-se que prevalência de depressão em pacientes com DRC é maior em comparação à população geral. A coexistência de DRC e depressão pode ser explicada pela depressão ser um fator de risco para o desenvolvimento da DRC ou como consequência da perda da função renal, ou as duas condições podem ter uma fisiopatologia comum e se manifestarem juntas; no entanto, sua relação causal permanece controversa, ou seja, as associações bidirecionais entre DRC e depressão permanecem incertas.5
Apesar disso, tem sido observado que indivíduos com sintomas depressivos graves tendem a apresentar maior risco de declínio da função renal, início precoce de DRC e hospitalização. Paralelamente a tal realidade, os pacientes com DRC manifestam prevalência de depressão maior do que a relatada para pacientes com outras doenças crônicas, e tanto as evidências epidemiológicas quanto os mecanismos fisiopatológicos compartilhados sugerem a potencial relação bidirecional entre depressão e DRC.3 O enfrentamento desse processo de contato com o adoecimento dependerá de diversos fatores de ordem pessoal, rede de apoio social e conduta da equipe de saúde. A forma como o paciente com DRC perceberá tal experiência é muito singular, podendo acarretar ressignificações relevantes de vida ou ocasionar surgimento de transtornos mentais importantes. Em função dos diversos
O 51
Ca P ítul
estressores relacionados à doença e ao tratamento, como o ambiente hospitalar, os procedimentos médicos realizados e o medo do desconhecido, o estresse consiste em um quadro comum nos pacientes.6
Observa-se também correlação positiva entre o avanço da doença e o sofrimento psicológico e estresse, especialmente em função da necessidade de adaptação à rotina alimentar, marcada pela restrição hídrica e de alguns alimentos. Prevalências de 64% de sintomas de ansiedade em pacientes em HD, 60% de depressão e 52% de estresse têm sido descritas na literatura. Ademais, a prevalência de hospitalização psiquiátrica entre pacientes em HD é de 1,5 a 3 vezes maior do que em outras doenças crônicas.2
A fadiga, ou seja, sentir-se incapaz de prosseguir, sentir-se cansado para realizar as atividades diárias, menor presença de sentimentos de felicidade e humor deprimido, é um quadro sintomático central durante a transição para o diagnóstico de DRC. Isso denota a importância da identificação precoce e a gestão desses sintomas para a redução do risco de ativação de outros sintomas depressivos.7 Constructos, como autoeficácia e estratégias de coping (enfrentamento), podem influenciar a percepção da doença e a qualidade de vida dos pacientes, sendo as intervenções psicológicas um recurso relevante para o auxílio diante do sofrimento emocional acarretado pelos tratamentos.8
A falta de conhecimento sobre os transtornos mentais comuns na DRC, entre os profissionais que compõem as equipes de saúde, faz com que muitas vezes esses problemas psicológicos sejam ignorados ou subestimados e, por conseguinte, não tratados adequadamente. Destaca-se, assim, a importância da discussão acerca dos aspectos emocionais envolvidos na DRC não somente por profissionais de saúde mental, mas por todos os profissionais que compõem as equipes interdisciplinares em nefrologia.1
Saúde Mental e Adesão ao Tratamento
A adesão ao tratamento caracteriza-se pelo comportamento de uma pessoa – tomar medicamentos, seguir uma dieta ou executar mudanças no estilo de vida – diante das recomendações acordadas por um profissional de saúde. A adesão aos tratamentos de longo prazo para doenças crônicas é estimada em 50% em países de alta renda, mas, em países de baixa e média renda, as taxas são estimadas como inferiores. As consequências da baixa adesão aos tratamentos de longo prazo estão associadas aos desfechos desfavoráveis e ao aumento dos custos de saúde. A adesão é influenciada, simultaneamente, por múltiplos fatores, como aspectos sociais e econômicos, equipe/sistema de saúde, características da doença, tratamentos da doença e fatores relacionados ao paciente.9
Entre os principais impactos da presença de sintomas de transtornos mentais em indivíduos com DRC, estão
as dificuldades associadas à adesão ao tratamento. Especialmente durante o tratamento conservador, adotar um estilo de vida saudável é crucial para se evitar a perda da função renal e complicações cardiovasculares. Os principais comportamentos de estilo de vida na DRC envolvem em atividades regulares, como atividade física, abster-se de fumar, manter o peso saudável e aderir às prescrições dietéticas e medicamentosas. No entanto, comprometer-se com hábitos de vida saudáveis é difícil para a maioria dos pacientes.10
No que diz respeito à adesão medicamentosa, as prescrições médicas são apenas um aspecto do manejo farmacológico, e existem outros fatores que podem limitar a eficácia das terapias. Isso inclui o paciente ter acesso às prescrições, tomar o medicamento de acordo com a prescrição (adesão) e obter um novo suprimento do medicamento, ou seja, reabastecer as prescrições (persistência).11 Contudo, a adesão ao tratamento vai além da tomada das medicações e inclui mudanças nos hábitos de vida, como os hábitos alimentares.
As percepções dos pacientes sobre a doença podem ser os fatores-chave para a adesão ao tratamento. Portanto, é de extrema importância compreender melhor essa relação para aperfeiçoar ainda mais a eficácia dos programas de tratamento conservador e TRS. Associações entre percepções sobre a doença e adesão ao tratamento têm sido descritas na literatura. Uma revisão realizada por Oliveira et al. (2023)12 apontou que a adesão às restrições alimentares foi o tipo de adesão com associações mais significativas à percepção de doença, seguida do controle de líquidos e da ingestão de medicamentos. Por essa razão, as intervenções realizadas devem reconhecer a importância da modificação de tais percepções desadaptativas da doença para melhorar a adesão ao tratamento na DRC. Existem evidências de que a baixa adesão ao tratamento em países de baixa e média renda é influenciada pela falta de conhecimento por parte do paciente acerca do tratamento, atitudes e crenças negativas, o que acarreta redução da qualidade de vida.9
Entre os principais facilitadores e barreiras psicossociais percebidos pelos pacientes para o envolvimento em um estilo de vida saudável, destacam-se o conhecimento e a motivação intrínseca, o bem-estar emocional, o sofrimento psicológico, o otimismo e a aceitação da doença. Isso nos indica a necessidade de intervenções comportamentais personalizadas no estilo de vida para apoiar a autogestão da doença, especialmente orientadas para o desenvolvimento de estratégias adequadas para identificar e direcionar as barreiras e os facilitadores psicossociais.10
Ao se avaliar os principais desfechos na DRC, o atendimento multidisciplinar pode estar associado ao início oportuno da TRS e a menor mortalidade.13 Dessa maneira, a abordagem psicológica dentro das equipes interprofissionais pode ser um recurso importante para que se possa facilitar, de modo significativo, a adesão ao tratamento e, consequentemente, se obter melhores resultados.
Nutrição em Nefrologia no Dia a Dia 414












































































