
14 minute read
Dobór optymalnej techniki wykrywania alergenów (Dorota Merlak, Bogusław Wiera, Argenta
Dobór optymalnej techniki wykrywania alergenów
Regulacje prawne dotyczące znakowania żywności informacją o substancjach i produktach powodujących alergie lub reakcje nietolerancji funkcjonują już od kilkunastu lat. Obecnie obowiązującym dokumentem jest Rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 1169/2011 z dnia 25 października 2011 r., które jest stosowane w polskim porządku prawnym od 13.12.2014 r. Substancje powodujące alergie lub reakcje nietolerancji oraz ich pochodne objęte są obowiązkiem odpowiedniego znakowania dla wszystkich produktów spożywczych, w tym również sprzedawanych luzem. Stąd też konieczność sprawowania nadzoru nad alergenami w zakładzie produkującym żywność, a co za tym idzie prowadzenia badań wykrywających pozostałości substancji alergennych w surowcach, środowisku produkcji i produkcie gotowym. Kontrola alergenów jest jednak wciąż sporym problemem dla producentów żywności, a brak powszechnie uzgodnionych dopuszczalnych poziomów prowadzi czasem do nadużywania na etykietach informacji ostrzegawczych o możliwej obecności substancji alergizujących. Ten brak limitów powoduje szereg nieporozumień co do najlepszego podejścia do kontroli ryzyka występowania alergenów. Chcąc profesjonalnie podejść do problemu, producenci żywności wykonują sami lub zlecają badania wykwalifikowanym laboratoriom zewnętrznym. Wykonując badania, możemy ,,
Advertisement
skorzystać z kilku typów dostępnych na rynku diagnostycznym testów, opartych na różnych zasadach:
• testy immunologiczne w technice ELISA lub przepływu bocznego (LFD); • testy pośrednie wykorzystujące metodę • PCR; testy skriningowe niespecyficzne, wykorzystujące pomiar luminometryczny „ lub tzw. biuretowe; Nie wszystkie rodzaje • testy zautomatyzowane oparte o detekcję białek za pomocą Spektrometrii testów nadają się do
Mas (MS), LC-MS/MS, cytometrii każdego alergenu i przepływowej lub powierzchniowego rodzaju badanej próbki. rezonansu plazmonowego (SPR). Ograniczać może nas Na marginesie należy wspomnieć o jeszcze jednej, osobnej grupie, którą stanowią metody do oznaczana siarczynów: jodometryczna, enzymatyczna lub metoda Monier-Williamsa. Tradycyjnie stosowane rozwiązania oznaczania SO2 w winach gronowych i owocowych zastępowane są obecnie w analizie przemysłowej metodami potencjometrycznymi lub opartymi na pomiarach z wykorzystaniem sensorów optycznych, chemicznych oraz piezoelektrycznych umożliwiającymi analizę in situ, z niską granicą detekcji SO2 oraz krótkim całkowitym czasem analizy. posiadane wyposażenie lub środki na jego zakup, a planowana liczba badań nie zawsze uzasadnia wydatki na nowy sprzęt; chociaż czym więcej badań, tym inwestycje oczywiście szybciej się nam zwrócą. „
Nie wszystkie rodzaje testów nadają się do każdego alergenu i rodzaju badanej próbki. Ograniczać może nas posiadane wyposażenie lub środki na jego zakup, a planowana liczba badań nie zawsze uzasadnia wydatki na nowy sprzęt; chociaż czym więcej badań, tym inwestycje oczywiście szybciej się nam zwrócą.
Jak w takim razie, przy mnogości dostępnych rodzajów testów, dobrać taki, który będzie zakładu i produktu? Czyli jak dobrać rodzaj testów, żeby były one wiarygodne i jednocześnie efektywne kosztowo? ,,
Najlepiej przed rozpoczęciem badań odpowiedzieć sobie na kilka podstawowych pytań: 1.
Jakie substancje alergenne chcemy wykryć /oznaczyć?
Jaki rodzaj próbek będziemy badać?
Jakie ilości próbek i jak często będziemy badać?
Jakich wyników oczekujemy: ilościowych czy jakościowych?
Jakie parametry pracy testu (czułość, granice oznaczalności, czas uzyskania wyniku) są dla nas zadawalające?
Jakim wyposażeniem laboratoryjnym dysponujemy?
Jakie kwalifikacje posiada personel laboratorium?
Jaki jest koszt uzyskania jednego wiarygodnego wyniku?
Poniżej zamieszczamy charakterystykę poszczególnych metod badawczych pod kątem odpowiedzi na te pytania.
Testy immunologiczne ELISA
Testy immunologiczne oparte na reakcji antygen-przeciwciało od dawna stosowane były w badaniach klinicznych materiału pochodzącego od ludzi i zwierząt. Obecnie technika ta jest również używana w badaniach zapewniających bezpieczeństwo żywności np. do określania obecności alergenów czy mikotoksyn. Najbardziej popularną jej odmianą jest technika immunoenzymatyczna ELISA (Enzyme-Linked Immuno Sorbent Assay). W zasadzie możemy stwierdzić, że dla większości substancji powodujących alergie
najlepiej pasował do specyfiki naszego lub reakcje nietolerancji istnieją odpowiednie testy immunoenzymatyczne ELISA. Technika ELISA, w wielu odmianach, dostępna jest dla każdego białka alergenu z wyjątkiem selera, dla którego dostępny jest tylko test PCR. ELISA jest uznawana jako metoda referencyjna i pierwszego wyboru do oznaczania glutenu w żywności bezglutenowej (posiadającej licencję Europejskiego Systemu Licencyjnego i oznakowanej znakiem przekreślonego kłosa). Używana jest powszechnie do próbek surowców, produktów i jako referencyjna do kontroli środowiska produkcji, w tym do walidacji metod czyszczenia linii produkcyjnych. Za jej pomocą wykrywa się określone białka w badanym materiale z użyciem przeciwciał poliklonalnych lub monoklonalnych skoniugowanych z odpowiednim enzymem. Szukane białko z próbki wiąże się z przeciwciałami unieruchomionymi na powierzchni studzienek reakcyjnych oraz z dodawanymi przeciwciałami znakowanymi enzymem tworząc kompleks immunologiczny. Jest to tzw. reakcja kanapkowa: przeciwciałoantygen (białko)-przeciwciało skoniugowane z enzymem. Należy pamiętać, że niektóre składniki zawarte w próbce mogą również reagować z użytymi w teście przeciwciałami wywołując reakcję krzyżową, która może dać fałszywie dodatnie wyniki oznaczenia. Także próbki o silnym zabarwieniu utrudniają właściwe odczytanie wyniku końcowego w spektrofotometrze. Podczas przetwarzania żywności istnieje prawdopodobieństwo utraty właściwości immunologicznych alergenów. Czynności takie jak ogrzewanie, fermentacja, hydroliza mogą spowodować zmianę w strukturze białka, co uniemożliwia właściwe związanie przeciwciała i fałszywie ujemny wynik. Dlatego dobierając test ELISA do rodzaju badanych próbek, „ ... dobierając test ELISA do rodzaju badanych próbek, trzeba dobrze prześledzić deklarowane przez producenta w instrukcji użycia rodzaje sprawdzonych matryc oraz ewentualne ograniczenia pracy testu. „

Rys. 1. Zestaw do wykonywania oznaczeń techniką ELISA: czytnik płytek Thermo Scientific Multiscan Sky i automatyczna płuczka Thermo Scientific Wellwash
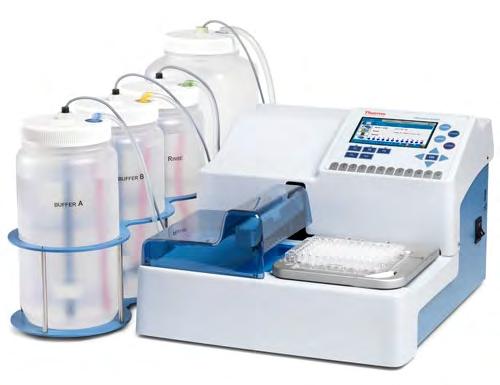
trzeba dobrze prześledzić deklarowane przez producenta w instrukcji użycia rodzaje sprawdzonych matryc oraz ewentualne ograniczenia pracy testu. Ze względu na wysoką czułość testów ELISA, podczas postępowania z próbkami laboratoryjnymi i odczynnikami należy stosować bardzo wysokie standardy czystości na wszystkich etapach procesu i po jego zakończeniu. Kluczem do otrzymania właściwych wyników jest również zachowanie zgodności pomiędzy próbkami i studzienkami oraz utrzymywanie wymaganych tolerancji co do zmienności masy, czasu i temperatury przy wykonywaniu oznaczenia. Najlepiej, aby badania wykonywał dobrze przeszkolony personel w przeznaczonej do tych zadań osobnej części laboratorium, oddzielonej oraz wyposażonej w odpowiedni sprzęt. Minimum specjalnego wyposażenia to jednorazowe pojemniczki na próbki, często wirówka o odpowiednim przyspieszeniu, pipety wielokanałowe, cieplarki oraz spektrofotometr lub najlepiej spektrofotometryczny czytnik płytek ELISA. Schemat postępowania jest modyfikowany w zależności od odmiany testu, ale zawsze między poszczególnymi etapami analizy następuje wielokrotne przepłukanie środowiska reakcji usuwające niezwiązane odczynniki. Etap płukania jest najbardziej krytycznym punktem w procedurze testów ELISA. Niedostateczne wypłukanie odczynników między etapami prowadzi do niewłaściwych wyników dla stosowanych standardów, a więc do nieprawidłowej krzywej wzorcowej, na podstawie której uzyskuje się wyniki próbek badanych. Może to powodować wyniki zawyżone, jak i zaniżone. Brak standaryzacji etapu płukania wykonywanego przez różnych operatorów może również powodować niską powtarzalność wyników. Pozostawione w studzienkach pęcherzyki powietrza, np. w wyniku stosowania do płukania tryskawki lub nieodpowiedniego pipetowania (płyn płuczący ma tendencję do pienienia), mogą powodować obniżenie efektywności reakcji enzymatycznej, co skutkuje wynikami fałszywie ujemnymi. Dlatego też najlepszym rozwiązaniem przy wykonywaniu dużej liczby analiz jest zastosowanie automatycznego systemu do płukania płytek ELISA. Ta tzw. płuczka automatyczna nie tylko znacząco skraca czas trwania tego etapu analizy, ale przede wszystkim eliminuje błędy mogące powstać w czasie jego wykonywania. Za pomocą techniki ELISA możemy uzyskiwać zarówno wyniki jakościowe, jak i ilościowe. Wartości LOQ (najmniejsza ilość białka alergenu, dla której test daje wynik ilościowy) zależą od kierunku badania i mogą wynosić nawet 0,1 ppm białka. Należy zwrócić uwagę, że różni producenci kalibrują testy w różny sposób, np. dla alergenu (np. Tropomiozyna, dla białka alergizującego (np. białko migdałów) lub dla produktu (np. proszku mlecznego). Dlatego też należy być ostrożnym porównując wyniki z testów różnych producentów i zawsze uważnie czytać instrukcję dotyczącą testu. Jeden test to jeden rodzaj alergenu na raz, więc każdy kolejny rodzaj alergenu potrzebuje nowego oznaczenia. Konieczność wykonywania krzywej wzorcowej, za pomocą dostawianych standardów, do każdej serii próbek powoduje, że koszt uzyskania wyniku pojedynczej próbki jest mocno uzależniony od liczby wykonywanych jednocześnie analiz, a zatem jest tym mniejszy, im więcej próbek wykonamy w jednej serii. Warto tutaj wspomnieć, że oprócz standardowych testów, dla których wykonuje się krzywą wzorcową z 5–6 wzorców, dostępną są testy ELISA o uproszczonym sposobie wyznaczania krzywej wzorcowej, np. tylko dwoma standardami, albo o krzywej podanej przez producenta. Jednak wyniki uzyskane takimi testami uznajemy tylko jako skriningowe.
Testy immunologiczne przepływu bocznego
Drugim powszechnie stosowanym rodzajem testów immunologicznych jest immunochromatograficzny test przepływu bocznego LFD (Lateral Flow Device). Zasada testów LFD jest podobna do tej wykorzystywanej w testach ELISA. Różnica polega na tym, że reakcja immunologiczna przebiega tu na membranie z wykorzystaniem zjawisk kapilarnych, a nie w studzience płytki mikrotitracyjnej. Zwykle stosowane są dwie formy specyficznego przeciwciała skierowanego przeciwko alergenowi, przy czym jedno z nich jest unieruchamiane na membranie, a drugie jest znakowane koloidalnym złotem i przenika na powierzchnię testową. Po dodaniu kropli uprzednio przygotowanej badanej substancji formuje się immunokompleks antygenu obecnego w próbce ze znakowanym przeciwciałem. Kompleks „porusza się” wraz z płynną próbką i migruje do pola z immobilizowanymi na membranie przeciwciałami. W konsekwencji szeregu reakcji na teście uwidacznia się kolorowa linia lub punkt. Dodatkowo zachodzi jeszcze reakcja kontroli wewnętrznej pracy testu, która pozwala nam ocenić, czy test nie został „zablokowany” i próbka prawidłowo doszła do strefy odczytu.
Rys. 2. Łatwy i szybki odczyt wyniku w teście LFD (Hygiena Gluten Tox Pro)
Testy mogą mieć postać kasetek lub prostych pasków. Testy LFD obejmują coraz więcej ,, rodzajów alergenów. Najbardziej znane są te przeznaczone dla najpowszechniej występujących białek: glutenu, białek mleka, jaj czy orzechów. Oferta kierunków oznaczeń jest jednak znacznie szersza i zależy od producenta. Często też występuje podział na testy dedykowane konkretnym matrycom: jedne dla wymazów z powierzchni, inne dla produktów, a jeszcze inne specjalnie dla trudnych matryc. Badanie dostarcza wyników jakościowych lub półilościowych odczytywanych w specjalnych czytnikach płytek testowych. Czytnik jest połączeniem optycznego detektora o wysokiej czułości oraz elektronicznego systemu do przetwarzania danych. Wybierając czytnik należy zwrócić uwagę, czy dany model nadaje się do stosowanych przez nas testów, gdyż nie wszystkie współpracują ze wszystkimi płytkami
LFD.
Generalnie czułość testów LFD jest niższa niż ich odpowiedników w technice ELISA, szczególnie w badaniu produktów, a wartości LOD znacząco zależą od sposobu przygotowania próbki oraz od samego zaprojektowania testu. Dobrze sprawdza się tu zasada: im bardziej napracujesz się na etapie przygotowania próbki, tym pewniejszy i prostszy do interpretacji będzie wynik na pasku/kasetce. Dlatego dla niektórych testów na etapie ekstrakcji próbki przed wykonaniem badania wymagane jest wirowanie albo dodanie izopropanolu. Co za tym idzie, przygotowanie próbek niektórych wysoko przetworzonych produktów (np. pieczywa o bardzo niskiej zawartości glutenu, herbatników, makaronu) do wykonania testu LFD jest utrudnione, a najmniejsza ilość alergenu możliwa do wykrycia w takich próbkach, może być niewystarczająca (np. dla glutenu często 10–20 ppm, co przy dopuszczalnej wartości 20 ppm i dodatkowej niepewności wyniku 5–10 ppm niekoniecznie da nam informację, czy produkt spełnia wymagania dla żywności bezglutenowej).
W testach LFD przy dużym zanieczyszczeniu (tzw. przeładowaniu) istnieje jeszcze ryzyko uzyskania wyników fałszywie ujemnych.
Natomiast to ryzyko może być wyeliminowane przez zastosowanie testów o bardziej zaawansowanej technice, z trzema liniami odczytu.
Podsumowując – chociaż wykonanie testu LFD jest dużo szybsze i prostsze, niż testu techniką ELISA, i nie wymaga tak dobrze wyposażonego laboratorium, to jednak potrzebne jest staranne dobranie testu pod kątem badanej matrycy. Na pewno jest to dobre narzędzie do monitorowania powierzchni produkcyjnych oraz sprawdzania efektywności czyszczenia linii produkcyjnych.
Testy PCR
Do lat dziewięćdziesiątych ubiegłego stulecia komercyjnie dostępne testy do badania alergenów opierały się wyłącznie na zasadzie immunologicznej. W ostatnich latach technika PCR, podobnie jak w badaniach mikrobiologicznych żywności, weszła do użycia również w obszar badania alergenów. Może być stosowana np. do wykrywania obecności orzeszków ziemnych, gorczycy, sezamu, pistacji, migdałów, orzechów makadamia, łubinu oraz selera. Jej zasada polega na wykrywaniu alergenów na podstawie identyfikacji fragmentów DNA kodujących syntezę alergennych białek. Jest więc metodą pośrednią. Znajduje zastosowanie szczególnie w przypadku wykrywania alergenów, dla których nie można użyć techniki immunologicznej, np. dla selera. Metoda nadaje się również do żywności wysoko przetworzonej, ponieważ w przeciwieństwie do białek DNA jest mniej podatne na skrajne warunki procesów przetwórczych. Zaletą metody PCR jest także wysoka czułość i specyficzność w stosunku do szukanego fragmentu DNA. Może być używana zarówno do oznaczeń jakościowych, jak i ilościowych w technice Real Time PCR. Ograniczenia stosowania tej metody to wyższe koszty sprzętu i odczynników, konieczność dysponowania odpowiednio wykwalifikowanym personelem oraz możliwość uzyskania wyniku dodatniego mimo rozłożenia białka alergennego w procesie produkcji, co jest pochodną wyższej stabilności „


Rys. 3. Termocykler Quant Studio 5 do oznaczania alergenów techniką PCR (Thermo Scientific)
termicznej DNA od białek alergennych. Jednakże dla laboratoriów wykonujących bardzo dużo analiz na trudnych matrycach, i dla których czas uzyskania wyniku i zautomatyzowanie procesu jest ważne, jest to doskonałe rozwiązanie. Na rynku dostępne są już komercyjne zestawy testów zawierające gotowe odczynniki do przeprowadzenia reakcji amplifikacji i detekcji szukanego fragmentu DNA.
Przy zakupie termocyklera, który może przecież służyć również do przeprowadzania reakcji PCR dla innych celów badawczych, należy zwrócić uwagę, aby było to urządzenie uniwersalne, pracujące w systemie otwartym, obsługujące najszerszą gamę testów do Real Time PCR.
To kolejna grupa metod, które mogą być wykorzystane do detekcji alergenów na liniach produkcyjnych i powierzchniach roboczych. Metody te są szybkie, tanie, łatwe do wykonania oraz nie wymagają posiadania laboratorium, ponieważ mogą być wykonane bezpośrednio na linii produkcyjnej. Mają charakter jakościowy oraz nie rozróżniają konkretnych białek alergenów, więc mogą być używane raczej tylko do pomiaru efektywności procesów sanitarnych, ale ich szerokie spektrum działania można przy takim zastosowaniu traktować jako zaletę. Do tych niespecyficznych technik kontroli obecności białek alergennych na powierzchniach zaliczamy technikę pomiaru ATP oraz wykrywanie białek za pomocą testów biuretowych. Technika ATP z wykorzystaniem odpowiednio czułego luminometru i odczynników (wymazówek ATP o zwiększonej czułości) może być użyta do sprawdzenia efektywności procedur mycia usuwających pozostałości produktu, w którym może znajdować się potencjalnie alergizujący materiał. Bardzo czułe testy pozwalają wykryć pozostałości produktu w ilości od 1–1000 ppm w zależności od matrycy, co jest porównywalne z możliwościami wykrywania alergenów przez specyficzne testy LFD. Przykładowe poziomy detekcji konkretnych alergenów wykrywanych techniką bioluminometryczną przedstawia tabela 1. Dane pochodzą z walidacji wykonanej z użyciem luminometru Hygiena Ensure i wymazówek SuperSnap. Należy tutaj zwrócić uwagę, że metoda nadaje się tylko do kontroli alergenów, które mają charakter białkowy.
Tab. 1. Poziomy detekcji określonych białek przy użyciu luminometru Hygiena Ensure i wymazówek UtraSnap
Alergen
Krewetki Pszenica Masło rzechowe Białko jaja kurzego Mleko w proszku Soja Migdały Sezam
LOD
1 ppm 100 ppm 100 ppm 1000 ppm 100 ppm 100 ppm 1000 ppm 100 ppm
System działa na zasadzie pomiaru stężenia ATP. Pozostałości produktów pochodzenia organicznego znajdujące się na powierzchni zawierają ATP. Po odpowiednim umyciu wszystkie źródła ATP powinny być istotnie zredukowane. Gdy próbka jest pobierana i ATP kontaktuje się z stabilnym płynnym odczynnikiem (kompleks lucyferynalucyferaza), emitowane jest światło wprost proporcjonalnie do ilości ATP obecnej w próbce. Luminometr mierzy wytworzone światło, dostarczając w kilkanaście sekund informację o poziomie zanieczyszczenia. Im więcej wykrytego ATP w próbce, tym bardziej brudna powierzchnia i tym więcej mogących na niej występować białkowych substancji alergizujących.

Rys. 4. Testy biuretowe Hygiena AllerSnap (wymazówka). Im bardziej fioletowa barwa, tym większe stężenie białek na badanej powierzchni
Jeśli wynik będzie poniżej walidowanych przez producenta limitów, można uznać, że na powierzchni nie ma białka alergennego lub jest poniżej znanego poziomu wykrywalności.
Testy biuretowe wykorzystują obecność wiązań peptydowych w związkach organicznych, takich jak białka. Warunkiem koniecznym jest występowanie co najmniej dwóch wiązań peptydowych bezpośrednio obok siebie lub przedzielonych nie więcej niż jednym atomem węgla. Test biuretowy polega na dodaniu do analizowanej mieszaniny roztworu silnej zasady oraz siarczanu miedzi (II). Jeżeli w roztworze obecne są związki zawierające bliskie wiązania peptydowe, to roztwór zmienia barwę z niebieskiej na fioletową, co jest spowodowane powstawaniem anionowych związków kompleksowych, w których jon Cu2+ jest kompleksowany przez minimum dwie grupy peptydowe. W przypadku występowania dimerów aminokwasów, w których występuje tylko jedno wiązanie peptydowe, układ zabarwia się na różowo. Natomiast wolne aminokwasy nie zmieniają barwy roztworu. Liniowa zależność zmiany barwy od stężenia protein, a dokładnie od liczby podwójnych wiązań peptydowych, pozwala na stosowanie metody zarówno jako jakościowej, jak i ilościowej.
Metoda jest szybka, ale posiada kilka cech, o których należy pamiętać. Jak wymieniona wcześniej metoda detekcji ATP, jest to technika niespecyficzna, którą nie rozróżnimy rodzaju obecnego alergenu. Dodatkowo, testy te mogą wykrywać również pozostałości innych substancji redukujących, takich jak proste cukry, tanina i kwas askorbinowy. Jednak jako wskaźnik czystości linii produkcyjnych, na których mogą występować alergeny, sprawdzą się bardzo dobrze.
Jakie rozwiązania będą komercyjnie dostępne w najbliższej przyszłości?
Rozwój technik analitycznych, takich jak LC-MS/MS umożliwia wykrywanie związków występujących w bardzo niskich stężeniach oraz jednoczesną analizę coraz większej liczby badanych substancji. LC-MS/MS umożliwia bezpośrednie wykrycie białka alergennego, niezależnie od jego przestrzennego ułożenia łańcucha polipeptydowego, za pomocą chromatografii cieczowej (LC) połączonej z tandemową spektrometrią mas (MS/MS). LC-MS/MS, umożliwia pomiar stężenia wielu alergenów jednocześnie np. na jednoczesną detekcję alergenów owoalbuminy oraz α-kazeiny i β-laktoglobuliny w produktach piekarskich, w ramach jednego czułego, specyficznego i precyzyjnego badania. Używanie metod MS w rutynowych testach jest ograniczone ze względu na bardzo zaawansowany sprzęt, wysokie koszty pojedynczych oznaczeń oraz pracochłonność/ czasochłonność. Wydaje się, że przyszłością mogą być też biosensorowe testy immunologiczne wykorzystujące powierzchniowy rezonans plazmonowy (SPR). Zalety tego rozwiązania to bardzo krótki czas uzyskania wyniku, wysokie zautomatyzowanie i możliwość jednoczesnego wykrywania kilku analitów. Niestety, stosunkowo wysoka cena, zarówno maszyn, jak i odczynników, może być poważnym ograniczeniem dla zastosowania tego rozwiązania w zakładach produkujących żywność. Raczej będzie to metoda wykorzystywana w dużych laboratoriach np. agencji kontroli żywności.

Przegląd powstał na podstawie doświadczeń ze współpracy firmy Argenta z laboratoriami badającymi alergeny oraz na podstawie danych uzyskanych od producentów testów do wykrywania alergenów.
www.argenta.com.pl mgr inż. Dorota Merlak
Absolwentka SGGW, wydziału Technologii Żywności oraz Studium Podyplomowego „Mikrobiologia, higiena i jakość w przemyśle” w PŁ. Przez 12 lat pracownik naukowy Instytutu Przemysłu Mleczarskiego. Współautorka patentów w zakresie drobnoustrojów probiotycznych. Przez wiele lat związana z firmą Argenta. Obecnie pełni funkcję doradczą z zakresu bezpieczeństwa żywności i diagnostyki mikrobiologicznej kosmetyków. Członek Komitetu Technicznego nr 3 PKN – Mikrobiologia łańcucha żywnościowego.
mgr Bogusław Wiera
Absolwent UŚ, Wydziału BiOŚ oraz Studium Podyplomowego „Mikrobiologia, higiena i jakość w przemyśle” w PŁ. Były wieloletni kierownik lab. mikrobiologicznego. Obecnie Kierownik Produktu w firmie Argenta.










