9 minute read
A importância da microbiota e integridade intestinal frente aos desafios
Liliana Borges e Melina Bonato (P&D, ICC Brazil)
Para que o intestino apresente uma boa funcionalidade, além da integridade intesti nal, é necessária uma microbiota em equilíbrio, que é formada por micro-organismos não patogêni cos e de fundamental importância para o metabolismo e absorção de nutrientes e outros compostos consu midos pelos animais. Uma microbiota saudável apresenta alta diversidade de gêneros microbianos em perfeito equilíbrio, permitindo um aumento da capacidade metabólica do intesti no.
A microbiota benéfica auxilia a digestão e absorção dos nutrientes, produz vitaminas que são utilizadas pelo hospedeiro e diminui, por com petição exclusiva e/ou liberação de substâncias, a proliferação de agentes patogênicos. Esta microbiota nativa produz ácidos graxos de cadeia curta e ácido lático. Esse ácidos orgânicos diminuem o pH da excreta, favore cendo a inibição das bactérias patogênicas e estimulando a proliferação dos enterócitos. Com isso pode ocor rer uma melhoria nas estruturas e integridade das células, aumentando a capacidade de absorção dos nutrien tes e consequente melhora no desempenho. Já as bactérias patogênicas causam inflamação na mucosa intes tinal, geram metabólitos tóxicos, e propiciam o aparecimento de enfer midades, como é o caso da Salmonella, E. coli, Clostridium, Staphylococcus, Pseudomonas.
A dinâmica populacional do mi crobiota intestinal pode ser alterada de acordo com a idade, nutrição, es tresse, doenças infecciosas bacterianas, higiene e pela exposição a antimicrobianos.
Quando ocorre disbiose, ou seja, desequilíbrio da microbiota com au mento das bactérias patogênicas, pode ocorrer uma redução da absorção dos nutrientes, aumento da espessura da mucosa e velocidade de passagem da digesta, além de aumentar a pro dução de aminas biogênicas (cadaverina, histamina, putrescina etc), amônia e gases que são altamente prejudiciais à integridade da mucosa e saúde intestinal.
A microbiota intestinal dos ani mais tem ainda um importante papel na regulação da resposta do sistema imune, pois, além de modular vários processos fisiológicos, nutrição, me tabolismo e exclusão de patógenos, pode alterar a fisiopatologia de doen ças conferindo resistência ou promover infecções parasitárias entéricas. As bactérias naturais do intestino atuam como adjuvantes moleculares que fornecem imunoestimulação in direta ajudando o organismo a se defender contra infecções.
Diversos aditivos tem a capacida de de modular positivamente ou negativamente a funcionalidade intestinal e, em consequência, influenciar a saúde e desempenho animal. Alguns atuam como moduladores da microbiota, do sistema imunológico e da integridade intestinal, sendo chamados compostos nutracêuticos, que incluem prebióticos, probióti cos, ácidos orgânicos, simbióticos, enzimas exógenas, ácidos graxos poli-insaturados e fitobióticos (Huyghebaert et al., 2011). Dentre eles estaca-se a levedura que através de seus compostos altera a constitui ção da microbiota por diversos mecanismos, modula a resposta imune, a produção de enzimas, vitaminas e outros metabólitos que afetam as bactérias intestinais quando usados como prebióticos.
A parede celular de levedura Saccharomyces cerevisiae (ImmunoWall ® , ICC Brazil) oriunda do processo de fermentação da cana-de-açúcar para produção de etanol, contém em torno de 35% de β-glucanas (1,3 e 1,6), e 20% de mananoligossacaríde os (MOS). As β-glucanas são reconhecidas pelas células fagocíticas (Petravić-Tominac et al., 2010), esti mulando-as a produzir citocinas que iniciarão uma reação em cadeia para induzir uma imunomodulação e me lhorar a capacidade de resposta do sistema imunológico inato. Já o MOS, possui uma capacidade de aglutina ção de patógenos que possuem fímbrias, tais como diversas cepas de Salmonella e Escherichia coli.
Um recente estudo de Beirão et al. (2020, no prelo) onde frangos de cor te foram alimentados com dietas suplementadas com ImmunoWall ® (0,5 kg/ton) e infectados aos dois dias de idade com Salmonella Enteritidis [SE] (via oral na dosagem de 10 8 UFC/ ave), mostrou alterações na micro biota e histopatologia do íleo e ceco. Os tratamentos utilizados no estudo foram: controle (sem aditivos e sem desafio); desafio com Salmonella (10 8 UFC/ave); ImmunoWall ® 0,5 kg/ton (sem desafio) e desafio com Salmo nella suplementado com ImmunoWall ® 0,5 kg/ton.
Os resultados mostraram uma forte influência do ImmunoWall ®
sobre a população microbiana dos frangos, tais como os gêneros Sub doligranulum e Lactobacillus, e filos Proteobacteria e Tenericutes, assim como o desafio influenciou no gê nero Ruminococcus.
Gêneros marcantes aos 14 e 21 dias de idade:
Ruminococccus torques: Possui uma função mucolítica e é de espe cial interesse, pois está correlacionado com melhor produtividade em frangos (Torok et al., 2011). Sua pre sença foi menor no grupo desafiado com Salmonella do que no grupo con trole. Embora não tenha sido avaliado, é interessante observar que o desafio pode ter afetado produtividade através da microbiota, e que o trata mento preveniu esta alteração.
Subdoligranulum: Neste gêne ro foi detectada a expressão de butirato quinase, uma enzima envolvida no último passo de uma das quatro potenciais vias de produção de buti rato (Polansky et al., 2016). O butirato é um ácido graxo de cadeia curta e desempenha um papel importante na fisiologia intestinal, servindo co mo fonte de energia para as células epiteliais do ceco e íleo, além de con trolar bactérias patogênicas ao alterar o pH interno dos patógenos (Roto et al., 2015). A partir dessas característi cas descritas, assume-se um papel positivo à bactéria Subdoligranulum, mas esse agente foi associado com pior conversão alimentar em aves (Singh et al., 2012). Assim sendo, a redução deste gênero pode ter sido um efeito positivo do tratamento, pois os resultados mostraram que
A dinâmica populacional da microbiota intestinal pode ser alterada de acordo com a idade, nutrição, estresse, doenças infecciosas bacterianas, higiene e pela exposição a antimicrobianos
Quando ocorre disbiose, ou seja, desequilíbrio da microbiota com aumento das bactérias patogênicas, pode ocorrer uma redução da absorção dos nutrientes, aumento da espessura da mucosa e velocidade de passagem da digesta, além de aumentar a produção de aminas biogênicas (cadaverina, histamina, putrescina etc), amônia e gases que são altamente prejudiciais à integridade da mucosa e saúde intestinal

ambos os tratamentos com ImmunoWall ® reduziram a quantidade dessas bactérias.
Lactobacillus: Produz ácidos graxos de cadeia curta e produz bac teriocinas que impedem o crescimento de patógenos. Seus efeitos benéficos na saúde intestinal do hospedeiro já foram bem relatados, incluindo-se melhores respostas vacinais de anti corpos, melhor defesa contra Salmonella e maior produtividade (ganho de peso e eficiência alimentar) (Lo man and Tappenden, 2016; Torok et al., 2011; Yan et al., 2017). Sabe-se que MOS e nucleotídeos de leveduras induzem o aumento de bactérias re conhecidamente benéficas, como Lactobacillus (Mesa et al., 2017). Con firmando a literatura, aos 14 dias ambos os tratamentos com ImmunoWall ® aumentaram a proliferação de Lactobacillus.
Filos aos 21 dias de idade:
Proteobacteria: O tratamento com ImmunoWall ® reduziu a quantidade deste filo em relação ao grupo controle.
Tenericutes: Ambos os trata mentos com ImmunoWall ® aumentaram a proliferação do filo Tenericutes aos 21 dias. Esse achado inédito pode ser de grande relevância visto que o gênero Tenericutes aparece em maior proporção no intestino de aves com melhor taxa de conversão alimentar (Singh et al., 2012).
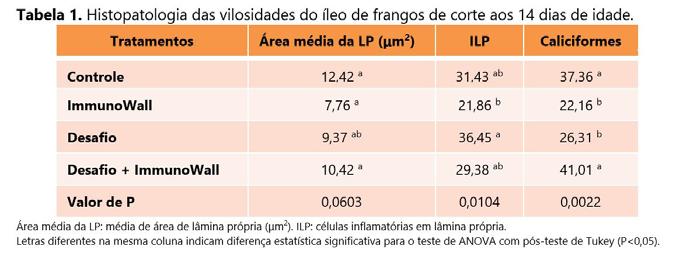
A alteração benéfica encontra das na microbiota como o aumento de Lactobacillus e Tenericutes, pode responder pelas melhoras encontra das em outros sistemas. Essas bactérias podem potencializar as respostas imunes e melhorar a integridade intestinal. No mesmo estudo de Bei rão et al. (2020, no prelo) foram avaliadas a área média da lâmina própria, células inflamatórias em lâmina própria e células calicifor mes do íleo e ceco que permitem avaliar o tipo de resposta celular predominante frente ao agente pa togênico (Tabelas 1 e 2).
O ImmunoWall ® melhorou a condição do intestino desafiado com SE, como podemos observar pela área da lâmina própria, onde se en contram grande parte das células imunes. A quantidade de células in flamatórias (ILP) foi reduzida com a suplementação de ImmunoWall ® (Desafio vs. Desafio +ImmunoWall ® ; Controle vs. ImmunoWall ® ).
As células caliciformes consti tuem uma das primeiras barreiras de defesa inespecífica do intestino e de acordo com os resultados verifica mos que ImmunoWall ® proporcionou maior produção nos animais desafiados.
A suplementação de Immuno Wall ® reduziu a quantidade de células inflamatórias (ILP) (Desafio vs. Desafio + ImmunoWall ® ; Controle vs. ImmunoWall ® ). Verificamos ainda que ImmunoWall ® proporcionou
maior produção de células caliciformes nos animais desafiados.
Os efeitos das leveduras sobre a microbiota não induzem sempre as mesmas alterações descritas, indi cando que há variações importantes na condução dos testes, ambientes e produtos. Desta forma, esse efeito benéfico pode ser uma característica importante do ImmunoWall ® .
Um correto programa de medi das incluindo nutrição balanceada, vacinação, redução dos fatores de estresse, boas práticas de manejo e bem-estar animal podem diminuir consideravelmente a incidência de imunossupressão. A adição de adi tivos dietéticos na alimentação, que atuam na modulação da micro biota e integridade intestinal, melhora a resposta de defesa frente aos desafios.
Referências
Beirão B. C. B. et al. Yeast cell wall immunomodulatory and intestinal integrity effects on broilers challen ged with Salmonella Enteritidis. Journal of Applied Poultry Research, 2020 (no prelo).
Duda-Chodak, A., Tarko, T., Sato ra, P., Sroka, P., 2015. Interaction of dietary compounds, especially polyphenols, with the intestinal mi crobiota: a review. European Journal of Nutrition. 54, 325–341. doi:10.1007/ s00394-015-0852-y
Flemming, J. S. Utilização de leve duras, probióticos e mananoligossaca

rídeos na alimentação de frangos de corte. 2005. 109 f. Tese (Doutorado em Tecnologia dos Alimentos) Uni versidade federal do Paraná, Curitiba, 2005.
Gomes, M. O. S. Efeito da adição da parede celular de levedura sobre a digestibilidade, microbiota, ácidos graxos de cadeia curta e aminas fecais e parâmetros hematológicos e imuno lógicos de cães. 2009. 79f. Dissertação (Mestrado em Clinica Médica Veteri nária). Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista, Jaboticabal, 2009.
Huyghebaert, G., Ducatelle, R., Immerseel, F. Van, 2011. An update on alternatives to antimicrobial gro wth promoters for broilers. Veterinary Journal. 187, 182–188. doi:10.1016/j. tvjl.2010.03.003
Loman, B.R., Tappenden, K.A., 2016. Prebiotic Short-Chain Fructoo ligosaccharides (scFOS) Increases Abundance of the Butyrate Producing Microbial Community Differentially When Administered With or Without Probiotic Lactobacillus rhamnosus GG (LGG) in Piglets With Short-Bowel Syndrome (SBS). FASEB Journal. 30, 683–685.
Mesa, D., Lammel, D.R., Balsa nelli, E., Sena, C., Noseda, M.D., Caron, L.F., Cruz, L.M., Pedrosa, F.O., Souza, E.M., 2017. Cecal Microbiota in Broilers Fed with Prebiotics. Fron tiers in Genetics. 8, 153.
Petravić-Tominac, V. et al. Biological effects of yeast -glucans. Agriculturae Conspectus Scientificus, n. 75, v. 4, 2010.
Polansky, O., Sekelova, Z., Faldy nova, M., Sebkova, A., Sisak, F., Rychlik, I., 2016. Important metabolic pathways and biological processes ex pressed by chicken cecal microbiota. Applied and Environmental Micro biology. 82, 1569–1576.
Roto, S.M., Rubinelli, P.M., Ricke, S.C., 2015. An introduction to the avian gut microbiota and the effects of yeast-based prebiotic-type com pounds as potential feed additives. Frontiers in Veerinary Science. 2, 28.
Singh, K.M., Shah, T., Deshpande, S., Jakhesara, S.J., Koringa, P.G., Rank, D.N., Joshi, C.G., 2012. High through put 16S rRNA gene-based pyrosequen cing analysis of the fecal microbiota of high FCR and low FCR broiler gro wers. Molecular Biology Reports. 39, 10595–10602.
Torok, V.A., Hughes, R.J., Mikkel sen, L.L., Perez-Maldonado, R., Balding, K., MacAlpine, R., Percy, N.J., Ophel-Keller, K., 2011. Identification and Characterization of Potential Per formance-Related Gut Microbiotas in Broiler Chickens across Various Fee ding Trials. Applied and Environmental Microbiology. 77, 5868–5878. doi:10.1128/AEM.00165-11
Yan, W., Sun, C., Yuan, J., Yang, N., 2017. Gut metagenomic analy sis reveals prominent roles of Lactobacillus and cecal microbiota in chicken feed efficiency. Scientific Reports. 7, 45308.