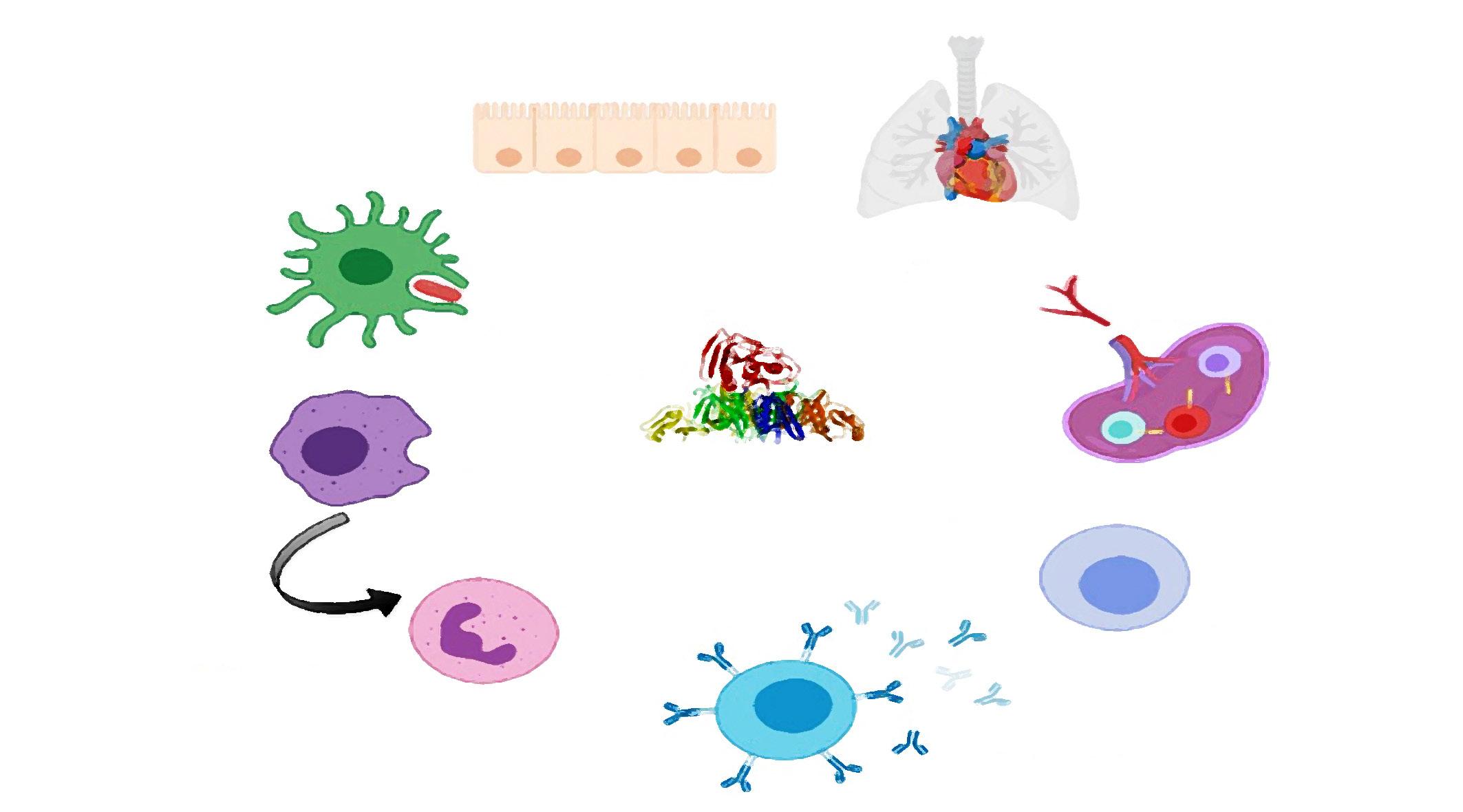
Lactante febril: evaluación del riesgo
Celulitis periorbitaria y orbitaria en pediatría
Tosferina maligna, una entidad milenaria y mortal
Manejo de las infecciones por Staphylococcus aureus en pediatría
Abordaje del paciente pediátrico en contacto con tuberculosis
Curso continuo de actualización en Pediatría CCAP
Volumen 22 Número 1
Enero - Marzo 2023
ISSN 2145-4590
Curso continuo de actualización en Pediatría CCAP
Volumen 22 Número 1
Enero - Marzo 2023
Sociedad Colombiana de Pediatría
Junta Directiva Nacional 2022 - 2024
Presidente Vicepresidente
Secretario
Vocal
Vocal
Vocal
Vocal
Vocal
Vocal
Vocal
Fiscal
Vocal Representante de Capítulos
Expresidente
Dr. Mauricio Javier Guerrero Román
Dra. Eliana Zemanate Zúñiga
Dr. Alberto José Esmeral Ojeda
Dra. Claudia Patricia Beltrán Arroyave
Dr. Jerónimo Zuluaga Vargas
Dra. Ángela María Giraldo Mejía
Dr. Víctor Manuel Mora Bautista
Dra. Liliam María Macías Lara
Dr. Mauricio Hernández Cadena
Dra. Iliana Francineth Curiel Arizmendi
Dr. Iván Alejandro Villalobos Cano
Dra. Nury Isabel Mancilla Gómez
Dra. Marcela María Fama Pereira
Comité Editorial
Dra. Nelly Lecompte Beltrán Pediatra (Editora)
Dra. Eliana Zemanate Zúñiga Pediatra Intensivista
Dr. León Jairo Londoño Velásquez Pediatra (Editor Ejecutivo)
Dr. Jürg Niederbacher Velásquez Pediatra Neumólogo
Sociedad Colombiana de Pediatría www.scp.com.co
precop
Subdirección de Programas Dirigidos al Pediatra
Calle 83 n.o 16A-44, Oficina 701
Edificio Cima. Bogotá, D.C.
Teléfonos: (601) 6495352 - 7464706/07
precop@scp.com.co
Producción editorial Grupo Distribuna
Carrera 9 B # 117 A-05
Barrio Santa Bárbara Central
Bogotá, D.C., Colombia
Teléfonos: (571) 6202294 - 2158335
(571) 2132379
www.libreriamedica.com
Lactante febril: evaluación del riesgo
María Andrea García Chaves
Daniela María Patiño Galarza
Kelly Márquez Herrera
Celulitis periorbitaria y orbitaria en pediatría
Laura Barrios
Iván Felipe Gutiérrez
Tosferina maligna, una entidad milenaria y mortal
Diana Marcela Muñoz Manquillo
Jennifer Tatiana Henao Pabón
Yessica Adriana Bravo Enríquez
Juan Pablo Rojas Hernández
Manejo de las infecciones por Staphylococcus aureus en pediatría
Sebastián Camilo Medina Rivera
Freddi Giovanni Soto
Abordaje del paciente pediátrico en contacto con tuberculosis
Juan Pablo Londoño Ruiz
Juan José Nofal Ladino
Volumen 22 Número 1 Precop SCP 3
Al final de los artículos encontrarán las preguntas del examen consultado sin sus respectivas respuestas, las cuales serán publicadas en el siguiente número.
4 13 22 35 45 Contenido
Cada fascículo PRECOP está disponible de manera online y sus evaluaciones podrán ser resueltas por todos los profesionales de la salud a través de este medio, ingresando por: www.scp.com.co/precop.
Lactante febril: evaluación del riesgo
Kelly Márquez Herrera3
INTRODUCCIÓN
La fiebre constituye la primera causa de consulta pediátrica en urgencias y una de las principales causas en consulta ambulatoria, con series que le atribuyen hasta el 65 % de los motivos de consulta en pediatría. Los niños menores de 2 años pueden presentar entre 4 y 8 episodios de fiebre al año, la mayoría de estos asociados a procesos virales benignos y autolimitados, que no precisan la realización de pruebas complementarias ni el inicio de tratamiento antibiótico.
Hasta el 20 % de los pacientes no presentan un foco evidente después de una anamnesis y exploración física minuciosas, mientras que en 7 %-11 % la fiebre puede ser secundaria a una infección bacteriana grave (IBG) como otitis media aguda, neumonía, infección del tracto urinario (ITU), meningitis o infecciones osteoarticulares, las cuales pueden complicarse e incluso producir la muerte, y en el 1 % de los casos puede estar asociada a bacteriemia oculta. Nuestra responsabilidad como médicos
y pediatras es detectar oportunamente a los pacientes que se encuentran dentro de estos dos últimos grupos.
Aunque las infecciones son la causa más frecuente de la fiebre, otros procesos no infecciosos, como las enfermedades autoinflamatorias, incluidas la enfermedad de Kawasaki y las enfermedades autoinmunes, metabólicas y neoplásicas, también pueden manifestarse con fiebre. En las últimas dos décadas, se ha intentado definir cuál es el mejor conjunto de criterios para realizar un enfoque adecuado de los lactantes febriles, con base en factores de riesgo de tener una IBG. Se han estudiado criterios clásicos como los de Rochester, Filadelfia y Boston, y más recientemente el Lab-score y el Step by Step para el manejo de los menores de 3 meses con fiebre sin foco, que tienen en cuenta datos etiológicos y biomarcadores, lo que permite un enfoque individualizado con disminución de días de estancia hospitalaria y de procedimientos invasivos como la punción lumbar, y favorece el uso racional de antibióticos.
1. Residente de segundo año de pediatría, Universidad del Cauca.
2. Pediatra, Universidad del Cauca.
Volumen 22 Número 1 Precop SCP 4
3. Infectóloga pediatra, Clínica Infantil Santa María del Lago, Bogotá. Hospital Susana López de Valencia, Popayán.
María Andrea García Chaves1
Daniela María Patiño Galarza2
DEFINICIÓN Y FISIOPATOLOGÍA
La fiebre es el aumento de la temperatura corporal interna por encima de 38 ºC. Corresponde a una respuesta compleja, coordinada, neuroendocrina y adaptativa como parte de la reacción de fase aguda a un cambio inmunológico. Es un síntoma y no una enfermedad.
La fiebre constituye parte importante de la respuesta inflamatoria del cuerpo, que favorece la actividad fagocítica y bactericida de los neutrófilos, y esto contribuye a la disminución de la morbimortalidad de muchas infecciones. En términos generales, mejora la función inmunológica, permite la estimulación de este sistema contra el microorganismo invasor y retrasa el crecimiento de virus, bacterias y hongos.

Los microorganismos, complejos inmunitarios, exposición a medicamentos, hormonas y otras causas de inflamación constituyen disparadores que llevan a la activación del sistema mononuclear fagocítico, con la consecuente liberación de mediadores inflamatorios como las interleucinas 1 y 6 (IL-1, IL-6) y el factor de necrosis tumoral (FNT), los cuales estimulan el centro termorregulador del hipotálamo y
aumentan la liberación de pirógenos endógenos como la prostaglandina E2 (PGE2), que a su vez aumenta la producción y disminuye la pérdida de calor a través de contracciones musculares (escalofríos), del aumento del metabolismo celular y la vasoconstricción, lo que finalmente genera fiebre como consecuencia de una pérdida de regulación del núcleo preóptico hipotalámico responsable del control de la temperatura del individuo. Los mecanismos contrarreguladores, como la vasodilatación y la sudoración, aparecen posteriormente para favorecer la pérdida del calor y volver a la homotermia (Figura 1).
Cuando la temperatura corporal asciende a niveles superiores a los normales y el sistema de termorregulación no funciona correctamente (es decir, no hay un cambio consecuente), se habla de hipertermia; en estos casos, el nivel del termostato no varía, únicamente la temperatura corporal, llegando incluso a superar los 41 °C (Figura 2). Es por esto que, desde el punto de vista terapéutico, la fiebre responde a fármacos antipiréticos, que tienden a bajar el termostato hipotalámico y a disminuir la síntesis de prostaglandinas, mientras que en la hipertermia no, ya que el termostato está normal, por lo que
Adaptado de: Ares Álvarez J, et al. En: AEPap (editor). Congreso de Actualización Pediatría 2020. Madrid: Lúa Ediciones 3.0; 2020. p. 397-408.
Volumen 22 Número 1 Precop SCP 5
María Andrea García Chaves, Daniela María Patiño Galarza, Kelly Márquez Herrera
Figura 1. Proceso fisiopatológico de la fiebre. FNT-α: factor de necrosis tumoral alfa.
endógenos Aumento de calor Disminución de la pérdida de calor Fiebre Hormonas Virus Hongos Medicamento Bacterias Complejos inmunitarios IL-1 FNT IL-6 Receptores IL-1 Receptores FNT-α Hipotálamo PGE2
Pirógenos
en este caso se deben emplear medidas que permitan enfriar al paciente.
CLASIFICACIÓN Y TÉRMINOS CLAVE
• Fiebre sin foco (FSF): fiebre que dura menos de 5 días, cuya etiología no aparece luego de una adecuada historia clínica y una exploración física exhaustiva y minuciosa.
• Fiebre de origen desconocido (FOD): proceso febril de 2 a 3 semanas de duración, con ausencia de diagnóstico luego de una semana de estudio ambulatorio u hospitalario.
• Bacteriemia oculta (BO): identificación en sangre de un patógeno bacteriano en un paciente con fiebre sin foco y un triángulo de evaluación pediátrico normal. El paciente luce un buen aspecto general, sin otros signos ni síntomas más que la fiebre.
• Infección bacteriana potencialmente grave (IBPG): infección con compromiso focal y sistémico importante en un paciente con aislamiento de una bacteria patógena en un líquido estéril (sangre, líquido cefalorraquídeo [LCR], pleural, líquido articular). Es más frecuente en los lactantes menores de 3 meses de vida con fiebre, se asocia a un peor
pronóstico y tiene una etiología diferente con respecto a niños mayores de esta edad.
ETIOLOGÍA EN RELACIÓN CON LA EDAD
Los virus continúan siendo uno de los principales agentes causales de la fiebre en la infancia, dentro de ellos los más frecuentes son los virus respiratorios, como el virus sincitial respiratorio, la influenza, el rinovirus y el adenovirus.
Las entidades clínicas que pueden manifestarse como fiebre sin foco son, por orden de frecuencia, la ITU, causada generalmente por Escherichia coli con o sin bacteriemia asociada, la bacteriemia y la neumonía ocultas. Los síndromes infecciosos bacterianos graves que se presentan en niños de 3 a 36 meses de edad incluyen meningitis, sepsis, neumonía, artritis séptica y celulitis.
Debido al estado de inmadurez de su sistema inmunológico, los recién nacidos tienen una presentación clínica y una etiología diferentes de las infecciones bacterianas y virales, que alcanzan un riesgo de hasta el 30 % de IBPG, razón por la que no serán abordados en esta revisión.
Adaptado de: Ares Álvarez J, et al. En: AEPap (editor). Congreso de Actualización Pediatría 2020. Madrid: Lúa Ediciones 3.0; 2020. p. 397-408.
Lactante febril: evaluación del riesgo Volumen 22 Número 1 Precop SCP 6
39° 38° 37° Normal Fiebre Hipertermia Termostato interno T° corporal
Figura 2. Diferenciación entre fiebre e hipertermia.
Los lactantes de 1 a 3 meses tienen una prevalencia de IBPG del 9 %-14 %. La ITU es la IBG más frecuente, producida principalmente por E. coli, seguida de la bacteriemia oculta. Con respecto a los virus, cabe mencionar que la ITU sigue siendo una infección concurrente significativa en bebés con bronquiolitis.
Los lactantes y niños de 3 a 36 meses tienen una incidencia de bacteriemia oculta < 1 %, como resultado de la introducción de las vacunas contra Streptococcus pneumoniae y Haemophilus influenzae en el esquema de vacunación. Las bacterias más frecuentemente aisladas en este grupo son neumococo y Staphylococcus aureus.
Los niños que superan los 36 meses de edad presentan generalmente síntomas de focalización asociados a la fiebre, por lo que las manifestaciones con fiebre sin foco e IBPG son aún menores. Teniendo en cuenta esto,
nos centraremos en el grupo etario de mayor riesgo fuera de los neonatos; es decir, en el lactante menor de 3 meses.
En la Tabla 1 se resumen la frecuencia de IBPG según el grupo etario, los tipos de infección y los microorganismos bacterianos más frecuentes.
EVALUACIÓN
La evaluación del lactante febril sin foco debe realizarse con base en la historia clínica, el examen físico y la toma de laboratorios complementarios. El riesgo de bacteriemia es directamente proporcional al grado de fiebre ( Tabla 2); cabe resaltar que solo el 5 % tiene fiebre mayor de 40,5 ºC.
Una historia clínica completa debe incluir no solo la historia prenatal, perinatal y neonatal,
Klebsiella
Streptococcus
S.
S.
Meningococo: 4,5
Kingella kingae: 1,5 %
Moraxella catarrhalis
E. coli
S. pyogenes Salmonella spp
IBPG: infección bacteriana potencialmente grave; ITU: infección del tracto urinario; SGB: Streptococcus del grupo B; IPTB: infección de piel y tejidos blandos; IOA infección osteoarticular.
Adaptada de: Rose E. Pediatric Fever. Emerg Med Clin North Am. 2021;39(3):627-39.
Volumen 22 Número 1 Precop SCP 7
María Andrea García Chaves, Daniela María Patiño Galarza, Kelly Márquez Herrera
Edad Prevalencia de IBPG Tipo de infección Microorganismo causal Recién nacidos 30 % Sepsis neonatal Neumonía ITU Meningitis Bacteriemia E. coli
Tabla 1. Frecuencia de IBPG según el grupo etario y microorganismos causales
pneumoniae SGB
monocytogenes 1-3 meses 9 %-14 % ITU 75 %-84 % Bacteriemia oculta: 6 %-13 % E. coli E. coli: 42 %
%
Listeria
SGB: 23
pneumoniae
% Listeria monocytogenes
meses
1 % Neumonía Meningitis Bacteriemia IPTB IOA
: 6
3-36
<
pneumoniae:
%
79,1
aureus
%
: 7,5
%
sino también la presencia de enfermedades previas, el estado de inmunización, antecedentes de hospitalizaciones, uso reciente de antibióticos y, muy importante, la exposición a contactos enfermos en el hogar o la guardería.
El paciente con mal estado general o aspecto tóxico debe ser enviado urgentemente a un centro hospitalario con un inicio temprano de antibióticos. Por el contrario, un paciente con buen o incluso “aceptable” estado general puede manejarse en cualquier nivel de atención de acuerdo con el riesgo.
Dentro de los laboratorios complementarios se describen hemograma, reactantes de fase aguda como la proteína C-reactiva (PCR) y la procalcitonina (PCT), uroanálisis, urocultivo, hemocultivos, radiografía de tórax y punción lumbar. A continuación, se describen las indicaciones y la utilidad de cada uno de ellos.
• Hemograma: no se recomienda de forma inicial ni de rutina para todos los pacientes, salvo en:
Adaptada de: Rose E. Pediatric Fever. Emerg Med Clin North Am. 2021;39(3):627-39.
La exploración física completa ayudará a confirmar o descartar la presencia de foco; sin embargo, en la mayoría de los casos los pacientes se van a presentar con síntomas inespecíficos como letargia, rechazo a la alimentación, vómitos, llanto inconsolable o irritabilidad.
El triángulo de evaluación pediátrico (TEP) es una herramienta útil en el servicio de urgencias, puesto que valora la apariencia general, el nivel de actividad, el color, el tono, la actitud y el estado de alerta. La irritabilidad, el llanto inconsolable, la mala perfusión, el tono deficiente, la disminución de la actividad o el letargo pueden ser signos de una infección grave, que se pueden deducir a partir de su aplicación.
La toma de signos vitales es fundamental y complementa el TEP. Una frecuencia cardíaca de más de 160 latidos por minuto (lpm) y una frecuencia respiratoria de más de 60 respiraciones por minuto (rpm) en los lactantes indican a menudo el desarrollo de sepsis y se asocian con un mayor riesgo de mortalidad.
- menores de 3 meses;
- niños vacunados con afectación moderadagrave del estado general;
- fiebre ≥ 40,5 °C;
- niños no vacunados o inmunocomprometidos.
La presencia de leucocitos ≥ 15 000/mm3 y neutrófilos ≥ 10 000/mm3 orienta hacia una infección neumocócica. Sin embargo, estos valores pueden estar normales o mínimamente elevados en casos de bacteriemia oculta por meningococo o Salmonella spp. Es importante recordar que la presencia de leucopenia en un paciente previamente sano con TEP normal no se relaciona con mayor riesgo, pero sí es factor de mal pronóstico en pacientes con sospecha clínica de sepsis.
• Reactantes de fase aguda: la sensibilidad de la PCT es ligeramente superior a la de la PCR para predecir IBG, pero su utilidad radica principalmente en que se eleva más rápidamente; sin embargo, puede elevarse también en estados de hipoperfusión (diarrea, hipovolemia). Ambas tienen más especificidad que la leucocitosis para detectar IBG, pero carecen de suficiente sensibilidad por
Lactante febril: evaluación del riesgo Volumen 22 Número 1 Precop SCP 8
Temperatura Riesgo de bacteriemia 38-40 °C 4 % 40-40,5 °C 7 % 40,6-41 °C 13 % > 41 °C 26 %
Tabla 2. Riesgo de bacteriemia según el grado de fiebre
sí mismas o incluso combinadas para descartarla, por lo que es necesario analizar el valor de acuerdo con el contexto clínico del paciente. Los puntos de corte propuestos para infección bacteriana invasiva (IBI) en lactantes menores de 3 meses son ≥ 0,5 ng/ mL para la procalcitonina y de ≥ 20 mg/L para la PCR.
• Uroanálisis y urocultivo: permite descartar ITU como la causa bacteriana más frecuente de fiebre sin foco. Se recomienda en niñas menores de 2 años y niños menores de 1 año con fiebre, aquellos con uropatía o nefropatía previas y en caso de fiebre sin foco > 48 horas.
• Radiografía de tórax: recomendada ante la sospecha de neumonía oculta (fiebre > 39-40 °C y leucocitosis > 20 000/mm3).
• Hemocultivos: su obtención debe restringirse a lactantes menores de 3 meses, sospecha de bacteriemia oculta y antes de iniciar tratamiento antibiótico empírico. Aunque el tiempo de crecimiento impide tomar decisiones rápidas, su toma permite racionalizar el uso de antibióticos.
• Punción lumbar: no debe realizarse de rutina, excepto si existe algún dato que indique un TEP alterado, con clínica o exploración sugestiva de meningitis o encefalitis, o cualquier lactante menor de 3 meses que no cumpla los criterios de bajo riesgo (en este grupo se incluiría a los niños menores de 21 días).
ENFOQUE DEL LACTANTE MENOR DE 3 MESES CON FIEBRE SIN FOCO
Es importante reconocer al lactante menor de 3 meses como paciente con riesgo incrementado de presentar una infección bacteriana seria (ITU, neumonía, bacteriemia oculta, osteomielitis, celulitis, meningitis). Existen factores independientes que los clasifican como grupo de riesgo, incluidos:
• menores de 1 mes;
• enfermedades de base (anemia de células falciformes, cardiopatías);
• inmunodeficiencias o estado de inmunosupresión (esteroides, neoplasias);
• antibioticoterapia previa (1 semana);
• vacunación incompleta;
• dispositivos médicos (derivación ventriculoperitoneal [DVP], catéter implantable).
El objetivo de clasificar a los niños dentro de un grupo de riesgo es poder detectar una infección bacteriana seria que ponga en peligro al niño sin someterlo a exámenes innecesarios o uso inadecuado de antibióticos. Los criterios de riesgo de IBI-IBPG pueden agruparse en la escala clínica Young Infant Observation Scale (YIOS), la cual pierde utilidad en las ITU febriles que en muchas ocasiones no provocan afectación del estado general y tiene escaso valor predictivo (VP) en pacientes con buena apariencia ( Tabla 3).
En 2016 Gómez y colaboradores realizaron un estudio prospectivo multicéntrico en el cual validaron y compararon la reciente escala Step by Step frente a las escalas Rochester y Lab-score (Tabla 4), que evalúan los criterios de bajo riesgo para infección bacteriana seria. En este estudio se encontró que la escala Step by Step es la herramienta más precisa, de mayor sensibilidad (92 %) y valor predictivo negativo (VPN; 99,3 %), con mayor número de LCR negativos, que identifica mejor a los pacientes de bajo riesgo.
De acuerdo con su clasificación en lactante menor de riesgo alto, intermedio o bajo de IBG, se determinará la conducta más apropiada a seguir. Así, el paciente de alto riesgo requerirá ingreso hospitalario, monitorización, realización de laboratorios e inicio de cubrimiento antibiótico empírico y punción lumbar luego de la estabilización. Por el contrario, el paciente de bajo riesgo podrá observarse de 12 a 24 horas desde el inicio de la fiebre, con una posterior alta sin antibiótico y control ambulatorio en 24 horas. El paciente que no cumple con criterios de alto ni de bajo riesgo cursa con un riesgo intermedio y requerirá observación hospitalaria hasta 12 a 24 horas desde el inicio de la fiebre,
Volumen 22 Número 1 Precop SCP 9
María Andrea García Chaves, Daniela María Patiño Galarza, Kelly Márquez Herrera
Tabla
Parámetro clínico Normal (1 punto)
Perfusión periférica Sonrosado, extremidades calientes
Afectación moderada (3 puntos)
Afectación grave (5 puntos)
Moteado, extremidades frías Pálido, choque
Respuesta social Sonríe o no irritable Irritable, consolable Irritable, inconsolable
Nivel de actividad Activo, espontáneamente vigoroso Actividad espontánea disminuida Sin actividad espontánea o activo solo con estimulación dolorosa
Nivel de alerta Completamente despierto o dormido, despierta rápido
Letárgico, se despierta con dificultad, alerta brevemente No se despierta
Estado/esfuerzo respiratorio No deterioro/vigoroso Compromiso respiratorio levemoderado (taquipnea > 60 rpm, retracciones o quejido)
Dificultad respiratoria con esfuerzo inadecuado (apnea, insuficiencia respiratoria)
Tono muscular Fuerte Disminuido Débil
Patrón de alimentación Succión vigorosa, ansioso por comer Come brevemente, succión débil Incapaz de comer
≤ 7 puntos probabilidad del 4 %. Sensibilidad: 76 %, especificidad: 75 %, VP negativo: 96 % para IBPG.
Tomado de: Gómez B, Mintegi S. Fiebre sin foco. Pediatría integral. 2018;22(5):211-8.
cubrimiento antibiótico, realización de laboratorios y punción lumbar solo si corresponde, con una posterior alta incluso sin antibiótico en función de su evolución.
TRATAMIENTO
El tratamiento del paciente febril está enfocado en el manejo integral, con el fin de mejorar su estado general y disminuir la sensación de malestar que genera la fiebre, más allá del tratamiento de la causa de la fiebre únicamente. Se cuenta con medidas generales, farmacológicas y no farmacológicas.
Como estrategias generales para la reducción de la temperatura están la hidratación adecuada
y los medios físicos que consisten en no abrigar demasiado y no desvestir; medidas que involucren baños o paños de agua tibia/fría no son recomendadas teniendo en cuenta el proceso fisiopatológico de la fiebre. Las medidas farmacológicas incluyen el acetaminofén en dosis de 10-15 mg/kg/dosis en intervalos de 4 a 6 horas (máximo 60-90 mg/kg/día) o ibuprofeno de 5-10 mg/kg/dosis en intervalos de 6 a 8 horas (máximo 40 mg/kg/día).
El manejo antibiótico se debe individualizar de acuerdo con la evaluación inicial, la clasificación del riesgo y el resultado de exploraciones complementarias en busca de cubrir los agentes etiológicos más probables, por lo que la ceftriaxona en dosis de 100 mg/kg/día por vía intravenosa en pacientes con alto riesgo
Lactante febril: evaluación del riesgo Volumen 22 Número 1 Precop SCP 10
3. Escala YIOS. Riesgo de IBI-IBPG en el lactante febril menor de 3 meses
Tabla 4. Comparación de escalas que evalúan los criterios de bajo riesgo de IBI-IBPG en el menor de 3 meses
Escala Rochester Lab-Score Step by Step
Criterios clínicos Buen aspecto general Previamente sano* Ausencia de signos de infección de piel, de tejidos blandos, articulación u oído
Criterios laboratorio
Leucocitos en sangre 500015 000/mm3
Cayados < 1500/mm3
< 10 leucocitos por campo en el uroanálisis
< 5 leucocitos por campo en materia fecal en caso de diarrea
Ninguno
Mala apariencia
Menor de 21 días
Procalcitonina: 0,5 → 0 puntos 0,5 a 2 → 2 puntos
≥ 2 → 4 puntos
PCR:
< 40 → 0 puntos 40 a 99 → 2 puntos
≥ 100 → 4 puntos
Tira reactiva de orina (esterasa o nitritos): Negativa → 0 puntos Positiva → 1 punto
Neutrófilos > 10 000/mm3
Procalcitonina > 0,5 μg/mL
PCR > 20 mg/L
Leucocituria
Puntaje Todos los criterios = probabilidad muy baja de IBG > 3 puntos: riesgo de IBG Riesgo alto: todos los criterios
Riesgo intermedio: criterio de neutrófilos o PCR
Riesgo bajo: ningún criterio
*Nacido a término, sin antibióticos perinatales, sin tratamiento por hiperbilirrubinemia inexplicada, no recibió ni estaba recibiendo antibióticos, sin hospitalización previa ni enfermedad crónica de base, no requirió estar más tiempo hospitalizado que su madre. VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Adaptada de: Rose E. Pediatric Fever. Emerg Med Clin North Am. 2021;39(3):627-39.
de IBG sin identificación de foco infeccioso constituye una muy buena opción empírica y terapéutica. Se debe dirigir la terapia una vez se cuente con el resultado de hemocultivos, urocultivo y cultivo de LCR en los casos en que se realice este último. Si los cultivos son negativos y la evolución clínica del paciente
es favorable, debe evaluarse la posibilidad de suspender el antibiótico de forma temprana.
Si no se asegura un manejo domiciliario adecuado, es preferible la observación hospitalaria durante unas horas sin tratamiento antibiótico que instaurar antibioterapia domiciliaria “por si acaso”.
Volumen 22 Número 1 Precop SCP 11
María Andrea García Chaves, Daniela María Patiño Galarza, Kelly Márquez Herrera
Sensibilidad 81,6 % 59,8 % 92 % Especificidad 44,5 % 84 % 46,9 % VPP 5,7 % 13,4 % 6,7 % VPN 98,3 % 98,1 % 99,3 %
CONCLUSIONES
• La fiebre constituye el motivo de consulta más frecuente en pediatría, tanto en urgencias como en consulta externa.
• Los niños menores de 3 meses tienen mayor riesgo de IBPG, por lo que requieren la valoración del riesgo.
• Ninguna escala de determinación de riesgo reemplaza el juicio clínico.
LECTURAS RECOMENDADAS
1. Ares Álvarez J, Morillo Gutiérrez B. Manejo del paciente pediátrico con fiebre sin foco. En: AEPap (editor). Congreso de Actualización Pediatría 2020. Madrid: Lúa Ediciones 3.0; 2020. p. 397-408.
2. Gómez B, Mintegi S, Bressan S, Da Dalt L, Gervaix A, Lacroix L; et al. Validation of the “Step-by-Step” Approach in the Management of Young Febrile Infants. Pediatrics. 2016;138(2):e20154381. doi: 10.1542/ peds.2015-4381.
3. Gómez B, Mintegi S. Fiebre sin foco. Pediatría integral. 2018;22(5):211-8.
4. Klarenbeek NN, Keuning M, Hol J, Pajkrt D, Plötz FB. Fever Without an Apparent Source in Young Infants: A Multicenter Retrospective Evaluation of Adherence to the Dutch Guidelines. Pediatr Infect Dis J. 2020;39(12):1075-1080. doi: 10.1097/ INF.0000000000002878.
• Es necesario realizar un abordaje integral e individualizado enfocado en el paciente, no en la cifra que marca el termómetro o en los laboratorios, lo que contribuye al uso racional de antibióticos y a la disminución de costos para el sistema de salud.
• Es mejor observar al paciente sin tratamiento antibiótico en un ambiente hospitalario, a instaurar antibioterapia domiciliaria “por si acaso” en pacientes que no lo necesitan.
5. Moraga M, Horwitz Z, Romero S. Fiebrefobia: conocimiento y actitud de los padres respecto de la fiebre. Rev Chil Pediatr. 2007;78(2):160-164.
6. Paul SP, Kini PK, Tibrewal SR, Heaton PA. NICE guideline review: fever in under 5s: assessment and initial management (NG143). Arch Dis Child Educ Pract Ed. 2022;107(3):212-216. doi: 10.1136/ archdischild-2021-321718.
7. Razón Behar Roberto. Fiebrefobia. Rev Cubana Pediatr. 2011;83(4):431-41.
8. Rose E. Pediatric Fever. Emerg Med Clin North Am. 2021;39(3):627-639. doi: 10.1016/j.emc.2021.04.011.
9. Sanz F, Ramos J, Pelayo F. Síndrome febril sin foco en pediatría. An Pediatr Contin. 2009;7(4)196-204.
Lactante
Volumen 22 Número 1 Precop SCP 12
febril: evaluación del riesgo
Celulitis periorbitaria y orbitaria en pediatría
Laura Barrios1 Iván Felipe Gutiérrez2
INTRODUCCIÓN
Las celulitis periorbitaria y orbitaria son infecciones de la piel y los tejidos blandos de la órbita, cuya delimitación está dada por un límite anatómico que es el tabique o septum orbitario. Este es una capa delgada de fascia que se extiende verticalmente desde el periostio del borde orbitario hasta la placa tarsal dentro de los párpados.Aunque es penetrado por nervios y estructuras vasculares, no existe drenaje venoso o linfático a este nivel, por lo que el tabique proporciona una barrera que es capaz de detener la propagación de agentes infecciosos hacia estructuras orbitarias y retroorbitarias más profundas.
La celulitis preseptal (o celulitis periorbitaria) compromete la porción anterior del párpado, que no afecta la órbita ni otras estructuras oculares; mientras que la celulitis orbitaria compromete el contenido de la órbita (grasa y músculos oculares), sin comprometer el globo ocular.
Por lo general, la celulitis periorbitaria puede deberse a infecciones originadas en la piel y tejidos
blandos periorbitarios, y en ocasiones tiene su origen en infecciones del tracto respiratorio (sinusitis); mientras que la celulitis orbitaria es debida a una infección complicada de los senos paranasales en la mayoría de los casos (generalmente sinusitis del etmoides). Es de destacar que los niños son más susceptibles a la celulitis orbitaria en comparación con los adultos, posiblemente por su sistema inmunológico inmaduro y el subdesarrollo de los senos paranasales. Debido a su presentación frecuente en pediatría, es de vital importancia conocerlas e identificarlas tempranamente para evitar complicaciones.
EPIDEMIOLOGÍA
La celulitis preseptal es mucho más común que la celulitis orbitaria, con una frecuencia de presentación del 83 % y 13 %, respectivamente. La celulitis orbitaria puede afectar a todos los grupos de edad, y compromete con mayor frecuencia a la población pediátrica, con una incidencia de 1,6/100 000 en niños comparada con 0,1/100 000 en adultos. En Colombia no hay datos epidemiológicos al respecto.
Volumen 22 Número 1 Precop SCP 13
1. Residente de Pediatría, Fundación Universitaria Sanitas.
2. Pediatra infectólogo, Clínica Infantil Santa María del Lago, Clínica Infantil Colsubsidio.
La edad de presentación varía de 6,1 años hasta 8 años (rango de 0,5 a 17 años), y se han encontrado algunas diferencias por edad y tipo de presentación, con una media de edad de la celulitis preseptal menor (33 meses) en comparación con la celulitis orbitaria (7,4 años).Afecta a ambos sexos por igual. La morbimortalidad en celulitis orbitaria ha disminuido debido al diagnóstico y tratamiento oportunos.
FACTORES DE RIESGO
El factor predisponente más frecuente es la sinusitis; aunque la celulitis orbitaria es una complicación poco frecuente de la sinusitis bacteriana, la sinusitis es el origen de la mayoría de los casos de celulitis orbitaria. La coexistencia de sinusitis está presente en el 86 % al 98 % de los casos de celulitis orbitaria. Se ha estimado que 1,3 %-5,6 % de los casos de sinusitis pueden complicarse con celulitis orbitaria y 0,3 %5,1 % pueden desarrollar absceso orbitario o subperióstico.
La sinusitis etmoidal y la pansinusitis son las formas de rinosinusitis con mayor probabilidad de dar origen a una celulitis orbitaria. La infección de los senos etmoidales se asocia a celulitis orbitaria hasta en el 43 % a 94,7 % de los casos. Otros estudios reportan que los senos afectados en orden de frecuencia son los senos maxilares, seguidos de los etmoidales, frontales y, por último, esfenoidales.
La diseminación hematógena por infecciones de la vía respiratoria superior hacia la órbita es otro factor predisponente de gran importancia, que se asocia a picos estacionales, y es más frecuente en invierno o principios de primavera en regiones con estaciones. Algunos reportes describen las infecciones de vías respiratorias superiores (68 %) y el trauma en párpados (20 %), como los principales factores predisponentes para celulitis periorbitaria.
En países en vía de desarrollo, el trauma representa un factor de riesgo importante
para desarrollar celulitis orbitaria debido a inoculación directa, lesión penetrante o fractura orbitaria que da cabida a la comunicación hacia los senos paranasales. También se ha informado de las lesiones faciales y del globo ocular como factores predisponentes, y la picadura de insectos, el orzuelo y el molusco contagioso del párpado coinfectado son las principales en edad pediátrica.
FISIOPATOLOGÍA
Celulitis preseptal o periorbitaria
Es una infección de los tejidos blandos anteriores al tabique orbitario, que no compromete la órbita ni otras estructuras oculares. La celulitis periorbitaria, a diferencia de la orbitaria, tiene un curso menos grave y menor frecuencia de complicaciones.
Generalmente es posible identificar el origen de la infección, dependiendo del mecanismo de la misma:
• Piel y tejidos blandos:
- inoculación directa por trauma en la piel: secundarias a picaduras de insectos o laceraciones;
- diseminación de infecciones cercanas: orzuelo, conjuntivitis, blefaroconjuntivitis, entre otras.
• Origen respiratorio:
- diseminación secundaria a un foco en senos paranasales.
• Otros:
- diseminación hematógena: por focos más distantes, incluidas otitis media aguda y neumonía.
Celulitis orbitaria
La celulitis orbitaria, o también llamada postseptal, corresponde a una extensión de la inflamación de los tejidos superficiales a los profundos a través del tabique orbitario.
Celulitis periorbitaria y orbitaria en pediatría Volumen 22 Número 1 Precop SCP 14
Los mecanismos de infección más frecuentes son la diseminación hematógena o por continuidad con infecciones cercanas como la sinusitis, más comúnmente la sinusitis etmoidal y, según la edad, la sinusitis maxilar o frontal. Lo anterior, teniendo en cuenta la anatomía de los senos paranasales en los niños, ya que solo el seno etmoidal se desarrolla al nacer, el seno maxilar no se desarrolla por completo hasta los 6 años y los senos frontales comienzan a desarrollarse a partir del sexto año de vida. A pesar de que la sinusitis es la causa más frecuente, también se han descrito como causas la infección del conducto lagrimal, dacriocistitis o tumores (retinoblastoma).
Su presentación es menos frecuente, pero más grave con respecto a la celulitis preseptal, puede asociarse incluso a muerte en porcentajes bajos. En la actualidad, la morbimortalidad asociada a celulitis orbitaria ha disminuido debido al diagnóstico y tratamiento tempranos y efectivos.
MANIFESTACIONES CLÍNICAS
La celulitis preseptal se presenta por lo general con dolor palpebral, edema y eritema palpebral, sin presentar alteración de los movimientos oculares o de la agudeza visual.
La celulitis orbitaria suele presentar las mismas características de la celulitis preseptal; sin embargo, se suele asociar con cifras variables a proptosis (47 %-100 % de los casos), disminución de la agudeza visual (12 %-37 %), defecto pupilar aferente (5 %-17 %) y movilidad ocular limitada (39 %-85 %). Adicionalmente, suele cursar con fiebre, cefalea y mayor compromiso sistémico ( Tabla 1).
ETIOLOGÍA
La etiología estará determinada de acuerdo con el origen primario de la infección. En caso de
Tabla 1. Características clínicas y diferencias entre celulitis pre- y postseptal
Características clínicas Celulitis preseptal Celulitis postseptal
Edema de párpados con o sin eritema Si
Dolor ocular No
Dolor con movilización ocular No
Proptosis No Usualmente, puede ser sutil
Oftalmoplejía o diplopía No
Alteración de la agudeza visual No
Puede estar presente
Puede estar presente
Quemosis Infrecuente Puede estar presente
Respuesta inflamatoria sistémica Puede estar presente Suele estar presente (fiebre)
Adaptada de: Bhatt A. En: Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. 8.a edición. Elsevier; 2018. p. 578-97.
Laura
Volumen 22 Número 1 Precop SCP 15
Barrios, Iván Felipe Gutiérrez
Sí
Sí
Sí
origen en la piel y tejidos blandos (picaduras, lesiones, heridas, impétigo, celulitis, entre otros), los patógenos más frecuentes serán Staphylococcus aureus y Streptococcus pyogenes La frecuencia de susceptibilidad a oxacilina en S. aureus varía de acuerdo con la epidemiología local. En Colombia, algunos estudios describen S. aureus sensible a la meticilina (SAMS) hasta en el 61,5 % de las infecciones de piel y tejidos blandos. Otras series en Estados Unidos describen la presencia de S. aureus resistente a la meticilina (SAMR) en un 73 %. Estudios en neonatos con abscesos periorbitarios describen la presencia de SAMR en un 33 % de los casos.
Cuando el origen es secundario a infección en senos paranasales, se debe considerar la posibilidad de Streptococcus pneumoniae , Moraxella catarrhalis y, menos frecuentemente, Haemophilus influenzae (no tipificable). En enfermedad complicada de senos paranasales (como celulitis orbitaria) se describe otro tipo de patógenos como Streptococcus anginosus (Streptococcus del grupo viridans).
Aunque es muy poco frecuente, se debe sospechar etiología fúngica en pacientes con alto riesgo (inmunocomprometidos, diabetes mellitus o en tratamiento crónico con esteroides o antibióticos), teniendo en cuenta patologías como la mucormicosis orbitaria y la aspergilosis, ya que son graves y potencialmente mortales. En infecciones secundarias a focos odontogénicos, los aislamientos más frecuentes incluyen Peptostreptococcus , Fusobacterium spp., Prevotella spp. y Cutibacterium acnes, entre otros.
COMPLICACIONES
Las complicaciones serias debidas a celulitis preseptal son infrecuentes, mientras que la celulitis orbitaria puede cursar con diferentes complicaciones, las cuales se describen a continuación.
• Orbitarias: dentro de las complicaciones orbitarias de la celulitis orbitaria se incluyen los abscesos subperiósticos o abscesos orbitarios. La prevalencia del absceso subperióstico orbitario se ha descrito entre 9 % y 23 % de los casos de celulitis orbitaria. Los abscesos subperiósticos suelen tener una localización medial en la órbita y ser más susceptibles de manejo antibiótico de acuerdo con el tamaño y la evolución; sin embargo, en algunos casos, la localización puede ser más superior, y presenta mayor riesgo de diseminación intracerebral. El absceso orbitario se presenta en cerca de un 2 % de pacientes con celulitis orbitaria. Aunque no todos los pacientes con absceso orbitario presentan proptosis, oftalmoplejía y dolor con los movimientos oculares, estos hallazgos suelen ser más frecuentes y graves en pacientes con esta complicación. En general, se estima que la celulitis orbitaria puede asociarse a pérdida de visión en 3 % a 11 % y a muerte en 1 % a 2 % de los casos.
• Intracerebrales: aunque las complicaciones intracraneales son poco frecuentes, debido a que las venas orbitarias superior e inferior realizan su drenaje sanguíneo directamente al seno cavernoso, y dado que las venas orbitarias inferiores no cuentan con válvulas, esta comunicación puede contribuir a que la infección pase de la órbita a estructuras intracraneales. Las complicaciones intracraneales suelen presentarse en pacientes de mayor edad, y son muy poco frecuentes en pacientes menores de 7 a 11 años.
Se debe sospechar la presencia de complicaciones intracraneales ante el aumento de la cefalea, emesis y alteración del estado de conciencia. En pacientes con trombosis del seno cavernoso, se puede observar parálisis de los nervios craneales, que puede ser bilateral. La presencia de cualquiera de estas manifestaciones hace necesaria la realización de TAC con contraste de las órbitas y de senos paranasales. Una revisión de 16 estudios,
Celulitis periorbitaria y orbitaria en pediatría Volumen 22 Número 1 Precop SCP 16
que incluyó 180 casos con complicaciones intracraneales, reportó que la frecuencia de complicaciones fueron empiema subdural (49 %), absceso epidural (36 %), absceso cerebral (21 %) y meningitis (19 %).
Históricamente, se ha usado la clasificación de Chandler para clasificar la celulitis orbitaria y sus complicaciones ( Tabla 2).
Por otro lado, se ha descrito una clasificación reciente simplificada, creada por Jain y Rubín:
• celulitis preseptal;
• celulitis orbitaria (con o sin complicaciones intracraneales);
• absceso periorbitario (con o sin complicaciones intracraneales):
- absceso intraorbitario, colección de material purulento en una celulitis orbitaria;
- absceso subperióstico, que puede llevar a una verdadera infección de los tejidos blandos orbitarios.
La fascitis necrosante es una infección bacteriana poco común, se debe sospechar como complicación de celulitis preseptal en caso de diseminación rápida del eritema y el edema, mala respuesta a antibióticos, sensibilidad
local aumentada seguida de anestesia, hipertensión y enfisema subcutáneo. De ocurrir, los microorganismos asociados son Pseudomonas spp, H. influenzae , Streptococcus spp, Diphteria y Proteus spp
DIAGNÓSTICO
Una anamnesis completa en búsqueda de signos clínicos que ayuden a diferenciar una celulitis preseptal de una postseptal, como la proptosis, quemosis, oftalmoplejía o disminución de la agudeza visual, suelen ser suficientes para establecer el diagnóstico; sin embargo, en ocasiones y según la edad del paciente, el edema palpebral es tan importante que hay limitaciones para la evaluación completa ocular, por lo que, ante la sospecha de compromiso orbitario y ante la incapacidad para realizar una evaluación clínica completa, est á indicada la tomografía axial computarizada (TAC) o la resonancia magnética para descartar celulitis orbitaria.
La TAC contrastada de senos paranasales es la imagen más útil en el diagnóstico de sinusitis en el contexto de una infección orbitaria (o para descartarla); así mismo, permite identificar complicaciones como el absceso orbitario y
Grupo Nombre
Características
1 Celulitis preseptal El proceso inflamatorio se limita a tejidos anteriores del tabique orbitario.
2 Celulitis orbitaria Afecta los tejidos orbitarios.
3 Absceso subperióstico Colección de material purulento periorbitario, entre las paredes óseas de la órbita y la periórbita.
4 Absceso intraorbitario Colección purulenta dentro de la órbita.
5 Trombosis del seno cavernoso Extensión de la inflamación orbitaria hacia el seno cavernoso, que llega a afectar el tercer, quinto y sexto par craneal.
Laura
Volumen 22 Número 1 Precop SCP 17
Barrios, Iván Felipe Gutiérrez
Tabla 2. Clasificación de Chandler
Adaptado de: Tsirouki T, et al. Surv Ophthalmol. 2018;63(4):534-53.
absceso subperióstico. Se recomienda la realización de TAC de órbita ante la incapacidad para evaluar la visión, presencia de proptosis, oftalmoplejia, edema bilateral o deterioro de la agudeza visual, falta de mejoría después de 24 horas de la administración de antibióticos intravenosos, o signos o síntomas de afectación del sistema nervioso central (SNC) (convulsiones, deterioro del estado de conciencia o signos de focalización neurológica). La TAC tiene una precisión diagnóstica para celulitis periorbitaria y absceso subperióstico del 91 %-100 %.
La resonancia magnética es el método de elección para detectar la trombosis de seno cavernoso, resulta ser más sensible para evaluar complicaciones orbitarias e intracraneales en pacientes con sinusitis; sin embargo, se recomienda su uso ante sospecha clínica o por complicaciones intracraneales manifestadas en la TAC.
Los laboratorios, incluidos hemograma y proteína C-reactiva (PCR), suelen ser inespecíficos, con un ligero aumento de los mismos, especialmente en casos de celulitis orbitaria o ante la presencia de complicaciones. No se recomienda su realización de rutina en casos de celulitis preseptal. Los laboratorios pueden orientar la sospecha clínica, pero no deben reemplazar la anamnesis ni un examen físico completo. Por otra parte, se deben tomar hemocultivos en niños con mal estado general, febriles, de aspecto tóxico, menores de 2 meses o con datos importantes de respuesta inflamatoria sistémica.
Con respecto al aislamiento microbiológico, en ocasiones es difícil identificar el agente causal, debido a la presencia de flora normal de la vía aérea y al uso de tratamiento antibiótico previo en algunos casos, por lo cual los cultivos pocas veces son positivos en pacientes con celulitis orbitaria. Si hay un sitio de infección claro en la piel, se debe intentar realizar cultivos. Los cultivos de frotis nasales o de garganta o
secreciones oculares suelen ser más efectivos; sin embargo, los cultivos posteriores a drenajes quirúrgicos son más confiables, aunque estos procedimientos invasivos no se recomiendan de rutina. En caso de realización de procedimiento quirúrgico para drenaje de colección, o ante la necesidad de manejo quirúrgico de la sinusitis, siempre se debe cultivar la muestra para aumentar la posibilidad de recuperación microbiológica.
TRATAMIENTO
Ante la sospecha o confirmación diagnóstica, debe iniciarse inmediatamente el cubrimiento antibiótico orientado hacia el agente causal más probable según la clínica del paciente y la epidemiología local, y siempre se debe enfocar el tratamiento a la sospecha del origen de la infección (p. ej., origen en la piel y tejidos blandos frente al origen respiratorio) ( Tabla 3).
La mayoría de casos de celulitis preseptal pueden tratarse de forma ambulatoria con antibióticos por vía oral durante 7 días; sin embargo, en menores de 1 año, pacientes con compromiso sistémico o con inadecuada respuesta en las primeras 24 a 48 horas, se debe considerar el manejo intrahospitalario. Siempre que se considere el manejo ambulatorio, se debe garantizar la posibilidad de seguimiento o de consulta temprana en caso de presencia de signos de alarma.
Ante el diagnóstico de celulitis orbitaria, el objetivo principal es minimizar el riesgo de complicaciones, por lo cual la mayoría de pacientes deben ser hospitalizados. El manejo médico se enfoca principalmente en una terapia antibiótica endovenosa y terapia concurrente de factores predisponentes subyacentes como la sinusitis. La duración del tratamiento varía entre 1 y 2 semanas por vía endovenosa, seguida de tratamiento oral para completar entre 2 y 4 semanas según la evolución.
Celulitis periorbitaria y orbitaria en pediatría Volumen 22 Número 1 Precop SCP 18
Origen y espectro del antibiótico
Antibiótico
A partir del segundo o tercer día, si hay resolución de la fiebre y disminución de eritema y edema
Piel y tejidos blandos: S. aureus y S. pyogenes
Oxacilina 200 mg/kg/día cada 4 h
O en casos leves, cefalexina
5-10 días Cefalexina 100 mg/kg/ día cada 6 horas
De acuerdo con la epidemiología local o si la respuesta es inadecuada, considerar cubrir SAMR con clindamicina.
Respiratorio (sinusitis):
S. pneumoniae, H. influenzae no tipificable, Streptococcus del grupo A y Moraxella.
Ampicilina sulbactam 200 a 300 mg/kg/día cada 6 horas o
En casos leves: Amoxicilina-ácido clavulánico o sultamicilina por vía oral
B. Celulitis orbitaria o postseptal
La mayoría secundarias a origen respiratorio**
S. pneumoniae, H. influenzae no tipificable, Streptococcus del grupo A, Moraxella y Streptococcus del grupo viridans
También descrito S. aureus.
Ampicilina sulbactam 200 a 300 mg/kg/día cada 6 horas
En casos graves, considerar ceftriaxona 100 mg/kg/día + clindamicina 40 mg/kg/ día
14 a 21 días
Sultamicilina 50 mg/kg/ día cada 12 horas
O amoxicilina-ácido clavulánico a 90 mg/ kg/día cada 12 horas
En infecciones graves o con respuesta inadecuada, considerar ajustar a ceftriaxona 100 mg/kg/día cada 12 o 24 horas
Asegurar 3 a 4 días endovenosos Realizar cambio a vía oral con mejoría de la fiebre, eritema y dolor Si los síntomas persisten, continuar el tratamiento
Considere vancomicina si hay sospecha de neuroinfección o en compromiso grave del estado general con sospecha de compromiso de SNC Adicionalmente, agregue metronidazol en este escenario
**Si hay una alta sospecha de origen en la piel y tejidos blandos, siga las mismas recomendaciones que para celulitis periorbitaria en cuanto a esquema antibiótico.
Adaptada de: Bhatt A. En: Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. 8.a edición. Elsevier; 2018. p. 578-97.
En términos generales, se considera incluir esquemas antibióticos con actividad frente a los patógenos respiratorios más frecuentemente asociados a sinusitis, sumado a S. aureus y
Streptococcus del grupo viridans , entre otros ( Tabla 3). Ante la sospecha de origen secundario a foco respiratorio (sinusitis), y según la condición del paciente (sin sospecha de
Laura Barrios, Iván Felipe Gutiérrez Volumen 22 Número 1 Precop SCP 19
Tabla 3. Celulitis periorbitaria o preseptal y celulitis orbitaria o postseptal
y dosis Tiempo Cambio a VO: Alternativa
A. Celulitis periorbitaria o preseptal
compromiso de SNC), se puede considerar el uso de ampicilina-sulbactam. En caso de compromiso grave, o respuesta clínica inadecuada (después de 24 a 48 horas de tratamiento), se deberá considerar el uso de ceftriaxona y clindamicina. Ante la posibilidad de compromiso del SNC, se cambia la clindamicina por vancomicina y se recomienda agregar metronidazol al tratamiento ( Tabla 3).
MANEJO QUIRÚRGICO
La mayoría de casos de celulitis preseptal se resuelven con antibiótico y rara vez requieren intervención quirúrgica (0 %-11 %). Estas cirugías consisten en orbitotomí as externas, drenaje de colecciones preseptales o cirugía endoscópica sinusal funcional. La literatura actual también sugiere que la celulitis orbitaria se puede tratar sin cirugía, con altas tasas de éxito de manejo no quirúrgico en la población pediátrica , que varían entre el 77 % y el 100 %. Se ha descrito un adecuado éxito clínico con el manejo del absceso subperióstico exclusivamente con antibióticos, a diferencia del absceso orbitario y la trombosis del seno cavernoso, que sí deben ser manejados quirúrgicamente, sumado al manejo antibiótico intravenoso. Otras indicaciones de manejo quirúrgico incluyen la presencia de sinusitis frontal, absceso subperióstico grande, sospecha de infección
LECTURAS RECOMENDADAS
1. Bhatt A. Ocular Infectious Diseases. En: Cherry J, Kaplan S, Steinbach W, Hotez PJ (editores). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. 8. a edición. Elsevier; 2018. p. 578-97.
2. Bradley J, Cantey J. Oropharyngeal Infections. En: Bradley JS, Nelson JD, Barnett E, Cantey J, Kimberlin DW, Palumbo PE, et al (editores). Nelson’s Pediatric Antimicrobial Therapy. 28.a edición. American Academy of Pediatrics; 2022. p. 22-5.
subperióstica anaeróbica, sinusitis crónica, compromiso agudo del nervio óptico o de la retina, o inadecuada respuesta al tratamiento antibiótico adecuado en 24 a 48 horas.
En relación con el uso de esteroides, la evidencia es contradictoria y en la actualidad se considera que no existe suficiente evidencia para recomendar su uso en la población pediátrica.
CONCLUSIÓN
Las celulitis orbitaria y periorbitaria son patologías frecuentes en la edad pediátrica. Ambas pueden presentar síntomas similares; sin embargo, existen signos que permiten identificar la presencia de celulitis orbitaria. En general, el diagnóstico es clínico, con indicación para la realización de imágenes diagnósticas en celulitis orbitaria y ante la sospecha de complicaciones o respuesta inadecuada. El tratamiento debe enfocarse con base en la sospecha del origen de la infección (piel y tejidos blandos frente a origen respiratorio) y deben tenerse en cuenta datos de la epidemiología local. Por lo general el tratamiento es médico, con indicación de manejo quirúrgico en casos particulares. La sospecha clínica, el diagnóstico y tratamiento adecuados y oportunos, son fundamentales para disminuir la frecuencia de complicaciones asociadas a estas patologías infecciosas de la órbita.
3. Bülbül L, Özkul Saglam N, Kara Elitok G, Mine Yazici Z, Hatipoglu N, Hatipoglu S, et al. Preseptal and Orbital Cellulitis: Analysis of Clinical, Laboratory and Imaging Findings of 123 Pediatric Cases From Turkey. Pediatr Infect Dis J. 2022;41(2):97-101. doi: 10.1097/ INF.0000000000003382.
4. Camacho-Cruz J, Gutiérrez IF, Brand-López K, SosaRodríguez YA, Vásquez-Hoyos P, Gómez-Cortés LC, et al. Differences Between Methicillin-susceptible Versus
Celulitis periorbitaria y
en
Volumen 22 Número 1 Precop SCP 20
orbitaria
pediatría
Methicillin-resistant Staphylococcus aureus Infections in Pediatrics: Multicenter Cohort Study Conducted in Bogotá, Colombia, 2014-2018. Pediatr Infect Dis J. 2022;41(1):12-9. doi: 10.1097/INF.0000000000003349.
5. Erickson BP, Lee WW. Orbital Cellulitis and Subperiosteal Abscess: A 5-year Outcomes Analysis. Orbit. 2015;34(3):115-20. doi: 10.3109/01676830.2014.950286.
6. Gappy C. Preseptal cellulitis [Internet]. UpToDate; 2020. Disponible en: https://es.scribd.com/ document/526569971/Preseptal-Cellulitis-UpToDate
7. Herrmann BW, Forsen JW Jr. Simultaneous intracranial and orbital complications of acute rhinosinusitis in children. Int J Pediatr Otorhinolaryngol. 2004;68(5):619-25. doi: 10.1016/j.ijporl.2003.12.010.
8. Howe L, Jones NS. Guidelines for the management of periorbital cellulitis/abscess. Clin Otolaryngol Allied Sci. 2004;29(6):725-8. doi: 10.1111/j.1365-2273.2004.00889.x.
9. Kornelsen E, Mahant S, Parkin P, Ren LY, Reginald YA, Shah SS, et al. Corticosteroids for periorbital and orbital cellulitis. Cochrane Database Syst Rev. 2021;4(4):CD013535. doi: 10.1002/14651858.CD013535. pub2.
10. Miranda-Barrios J, Bravo-Queipo-de-Llano B, Baquero-Artigao F, Granados-Fernandez M, Noval S, Rabanal I, et al. Preseptal Versus Orbital Cellulitis in Children: An Observational Study. Pediatr Infect Dis J. 2021;40(11):969-74. doi: 10.1097/ INF.0000000000003226.
11. Patel NA, Garber D, Hu S, Kamat A. Systematic review and case report: Intracranial complications of pediatric sinusitis. Int J Pediatr Otorhinolaryngol. 2016;86:20012. doi: 10.1016/j.ijporl.2016.05.009.
12. Rodríguez Ferran L, Puigarnau Vallhonrat R, Fasheh Youssef W, Ribó Aristazábal J, Luaces Cubells C, Pou Fernández J. Celulitis orbitaria y periorbitaria. Revisión de 107casos. An Esp Pediatr. 2000;53(6):567-72.
13. Rudloe TF, Harper MB, Prabhu SP, Rahbar R, Vanderveen D, Kimia AA. Acute periorbital infections: who needs
emergent imaging? Pediatrics. 2010;125(4):e719-26. doi: 10.1542/peds.2009-1709.
14. Saltagi MZ, Rabbani CC, Patel KS, Wannemuehler TJ, Chundury RV, Illing EA, et al. Orbital Complications of Acute Sinusitis in Pediatric Patients: Management of Chandler III Patients. Allergy Rhinol (Providence). 2022;13:21526575221097311. doi: 10.1177/21526575221097311.
15. Seltz LB, Smith J, Durairaj VD, Enzenauer R, Todd J. Microbiology and antibiotic management of orbital cellulitis. Pediatrics. 2011;127(3):e566-72. doi: 10.1542/ peds.2010-2117.
16. Shifman NT, Krause I, Dotan G, Gilony D, Bilavsky E. Orbital Cellulitis in a Pediatric Population - Experience From a Tertiary Center. Indian Pediatr. 2022;59(1):35-7.
17. Sobol SE, Marchand J, Tewfik TL, Manoukian JJ, Schloss MD. Orbital complications of sinusitis in children. J Otolaryngol. 2002;31(3):131-6. doi: 10.2310/7070.2002.10979.
18. Tongbram A, Alam S, Agarkar S, Mukherjee B. Infantile orbital abscess: clinical presentation, microbiological profile, and management outcomes. Orbit. 2022;41(4):422-8. doi: 10.1080/01676830.2021.1920040.
19. Tsirouki T, Dastiridou AI, Ibánez Flores N, Cerpa JC, Moschos MM, Brazitikos P, et al. Orbital cellulitis. Surv Ophthalmol. 2018;63(4):534-53. doi: 10.1016/j. survophthal.2017.12.001.
20. Williams KJ, Allen RC. Paediatric orbital and periorbital infections. Curr Opin Ophthalmol. 2019;30(5):349-55. doi: 10.1097/ICU.0000000000000589.
21. Wong SJ, Levi J. Management of pediatric orbital cellulitis: A systematic review. Int J Pediatr Otorhinolaryngol. 2018;110:123-9. doi: 10.1016/j.ijporl.2018.05.006.
22. Zhang J, Stringer MD. Ophthalmic and facial veins are not valveless. Clin Exp Ophthalmol. 2010;38(5):502-10. doi: 10.1111/j.1442-9071.2010.02325.x.
Laura Barrios, Iván
Gutiérrez Volumen 22 Número 1 Precop SCP 21
Felipe
Tosferina maligna, una entidad milenaria y mortal
Diana Marcela Muñoz Manquillo1
Jennifer Tatiana Henao Pabón2
Yessica Adriana Bravo Enríquez3
Juan Pablo Rojas Hernández4
INTRODUCCIÓN
La tosferina es una enfermedad infecciosa causada principalmente por Bordetella pertussis, la cual se transmite a través de gotas respiratorias de una persona infectada. A pesar del importante descenso en la mortalidad infantil con la introducción de la vacunación, esta sigue siendo una enfermedad endémica que afecta a todos los países, con picos epidémicos cada 3 a 4 años. Esta enfermedad es transmitida principalmente por adolescentes o adultos que no han recibido refuerzos posteriores al esquema de vacunación de la infancia, por lo que las estrategias de prevención están enfocadas en las madres gestantes y las personas que conviven con neonatos y lactantes pequeños. El objetivo es evitar la enfermedad en esta población infantil, en la cual puede presentarse con cuadros clínicos graves, que incluso pueden llevar a la muerte.
Según el reporte del Instituto Nacional de Salud, para el quinto período epidemiológico del 2022 se han reportado 1003 casos probables en el país, de los cuales se han confirmado 82, y el grupo más afectado es los menores de 5 años (62 %) y 23 casos tenían coinfección con enfermedad por coronavirus de 2019 (COVID-19). Los casos aumentaron 124,4 % en comparación con el mismo período epidemiológico del año anterior, con una tasa de letalidad de 1,3 por cada 100 000 habitantes. La hiperleucocitosis está fuertemente asociada con casos fatales de tosferina en lactantes; su reconocimiento temprano y su manejo es fundamental para prevenir la mortalidad. Como pediatras, es importante sospechar la enfermedad, notificarla, tomar las muestras pertinentes para la confirmación del caso y dar un tratamiento oportuno, así como estar preparados para afrontar pacientes con complicaciones y cuadros críticos que deben recibir manejo en unidades de cuidado intensivo (UCI).
Volumen 22 Número 1 Precop SCP 22
1. Pediatra, Universidad del Cauca
2. Pediatra, Hospital Universitario San José, Popayán
3. Pediatra intensivista, Hospital Universitario San José, Popayán
4. Infectólogo pediatra, magíster en Epidemiología, Fundación Clínica Infantil Club Noel, Universidad Libre, Cali, Colombia. Grupo de Investigación en Pediatría, GRINPED.
ETIOLOGÍA
En 1906 Bordet y Gengou aislaron por primera vez un cocobacilo gramnegativo no conocido en una muestra de secreción respiratoria de un lactante con tos que posteriormente fue denominado Bordetella pertussis. Actualmente se conocen nueve especies descritas del género Bordetella, dentro de las cuales sobresalen cuatro: B. pertussis (principal causante de la tosferina, que infecta exclusivamente a los seres humanos); B. parapertussis (responsable de un 10 % a 15 % de los casos); B. bronchiseptica (afecta a varios mamíferos, ha sido aislada en cuadros similares a la tosferina) y B. holmessi (responsable de cuadros de bacteriemia en pacientes inmunodeprimidos).
Se han descrito dos grupos de antígenos relevantes de B. pertussis. El primero relacionado con los procesos de adhesión y colonización, en los que se destacan la pertactina, la hemaglutinina filamentosa, las fimbrias 2 y 3, Vag8, BrkA, SphB1 y el factor de colonización traqueal. El segundo grupo está conformado por las toxinas, como el lipopolisacárido con propiedades tipo adhesina, la toxina pertúsica (TP) que actúa adicionalmente como adhesina a través de la subunidad B, la toxina tipo adenilato ciclasa con factores antifagocíticos, la toxina dermonecrótica y la citotoxina traqueal.
La principal toxina producida por B. pertussis es la TP compuesta por dos subunidades: la subunidad A, que es enzimáticamente activa, y la subunidad B, una estructura con forma anular que se une a la membrana de las células eucariotas y que facilita el ingreso de la subunidad A al citoplasma. Esta última inhibe la señalización a través del subconjunto de receptores acoplados a proteínas G (GPCR) que controlan gran parte de la migración celular y contribuyen a la leucocitosis. Se ha descrito que la TP retrasa el reclutamiento temprano de neutrófilos, inhibe la producción de anticuerpos séricos, lo que reduce la capacidad de estos para controlar la infección, y además suprime
la respuesta inmunitaria adaptativa por efecto sobre diferentes células como los monocitos y las células dendríticas (Figura 1).
La TP es la responsable de la leucocitosis a expensas de linfocitos, relacionada con una mayor migración desde sitios extravasculares, que aumenta su número absoluto en circulación. Esta toxina inhibe la señalización del receptor de quimiocinas reduciendo la retención de leucocitos en la médula ósea y el bazo, de modo que los linfocitos pierdan su capacidad de extravasación a los ganglios linfáticos y conserven su unión a las células endoteliales altas poscapilares (Figura 2). Existen dos marcadores de adhesión molecular importantes dentro del proceso patológico: CD62L y LFA-1, que median la unión inicial y el rodamiento de los linfocitos en los ganglios linfáticos, lo que favorece la extravasación de estas células. Con la acción producida por TP en los linfocitos, ocurre una inhibición de las cascadas de señalización de adherencia antes de lograr la extravasación en las vénulas endoteliales altas, con lo que se agudiza la hiperleucocitosis ya instaurada.
FISIOPATOLOGÍA
La transmisión se realiza a través de gotas o del contacto con las secreciones respiratorias de una persona infectada, con una tasa de contagiosidad de 10 a 14 (es decir, que una persona contamina entre 10 y 14 personas). La tasa de transmisión observada en las personas susceptibles que viven bajo el mismo techo es del 90 % y aquellos que comparten el medio escolar de un paciente alcanzan el 50 %-80 %. Una vez colonizada la nasofaringe, la bacteria se ancla al epitelio respiratorio gracias a la TP, la hemaglutinina filamentosa, la pertactina y el aglutinógeno. La TP dificulta la migración de linfocitos y macrófagos con el bloqueo de las defensinas locales, de este modo evade las defensas del hospedero y facilita su multiplicación. La toxina dermonecrótica, la adenilatociclasa y la citotoxina traqueal producen el daño
Volumen 22 Número 1 Precop SCP 23
Diana Marcela Muñoz Manquillo, Jennifer Tatiana Henao Pabón, Yessica Adriana Bravo Enríquez, Juan Pablo Rojas Hernández
Figura 1. Efectos de TP sobre las células de la inmunidad, su respuesta y otros aspectos de la patogénesis de pertussis.
Interrumpe uniones estrechas
Inhibe GPCR para promover la hipertensión pulmonar
Inhibe la fagocitosis Induce quimiocinas y citosinas
Toxina pertussis
Inhibe los linfocitos dirigidos a los ganglios linfáticos y la extravasación
Inhibe
local del epitelio causante de las manifestaciones respiratorias.
Varios estudios han propuesto una correlación entre niveles altos de leucocitosis y desenlace fatal en tosferina, debido a la producción de microtrombos y a la hiperviscosidad sanguínea que afecta arterias y arteriolas pulmonares, lo que aumenta la resistencia vascular pulmonar y culmina en hipertensión pulmonar, colapso hemodinámico, choque refractario y muerte por hipoxemia.
Entre los efectos sistémicos mediados por la TP se encuentra la sensibilización de las células B del páncreas, que causa un hiperinsulinismo que se manifiesta clínicamente como hipoglicemia persistente en los infantes pequeños; adicionalmente, se ha descrito un efecto de
Reduce el número y la función de Tregs
Suprime la respuesta de anticuerpos
bloqueo sobre los receptores α -2 adrenérgicos y dopaminérgicos que se relacionan con la resistencia a catecolaminas observada en los casos graves. Las complicaciones a nivel del sistema nervioso central son secundarias a la hipoxemia inducida por los accesos de tos y a la apnea asociada, más que a un efecto directo de la TP. Esta afectación neurológica también puede desarrollar un síndrome de secreción inadecuada de hormona antidiurética, que se manifiesta con hiponatremia y oliguria.
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas van a depender de la edad de la primoinfección, el antecedente de inmunización previa o infección pasada, la presencia de anticuerpos transmitidos de
Tosferina maligna, una entidad milenaria y mortal Volumen 22 Número 1 Precop SCP 24
Adaptada de: Scanlon K, et al. Toxins (Basel). 2019;11(7):373.
CXCL1 CXCL2 CXCL5 IL-17A
el reclutamiento temprano de neutrófilos
Figura 2. Posibles mecanismos de la leucocitosis mediada por TP en la tosferina.
B. pertussis infecta las vías respiratorias Las bacterias se multiplican en las células ciliadas y liberan TP, algunas de las cuales llegan al torrente sanguíneo
TP inhibe la señalización del receptor de quimiocinas, lo que reduce la retención de leucocitos en la médula ósea y el bazo

Adaptada de: Carbonetti NH. Pathog Dis. 2016;74(7):ftw087.
TP inhibe la detención mediada por LFA-1 en las vénulas de los ganglios linfáticos y la expresión de CD62L se reduce en los leucocitos circulantes, inhibiendo su extravasación
forma pasiva a través de la madre, el grado de exposición y el tamaño del inóculo, los factores propios del hospedero y el genotipo del microorganismo.
El cuadro clínico clásico conocido como síndrome pertúsico tiene tres fases:
• Fase catarral: dura en promedio 1 a 2 semanas, es la más contagiosa, pero generalmente pasa desapercibida semejando un cuadro gripal, con tos, coriza y rinorrea acuosa; la mayoría de las veces cursa sin fiebre.
• Fase paroxística: puede durar hasta 4 semanas y se caracteriza por episodios paroxísticos de tos seguida por una inspiración con la glotis parcialmente cerrada que produce un estridor típico; se acompaña de cianosis y ocasionalmente vómito postusivo. En los
niños menores de 6 meses, estos episodios de tos paroxística pueden asociarse a apnea y bradicardia, lo cual empeora el pronóstico; los niños más grandes y los adultos pueden tener síntomas menos graves durante esta fase.
• Fase de convalecencia: se caracteriza por la mejoría de la tos en cuanto a gravedad y frecuencia, pero esta puede durar varios meses o incluso un año.
Se han descrito algunos factores que se consideran de riesgo para la presentación de complicaciones o predictores para enfermedad crítica, los cuales se resumen en la Figura 3. En un estudio de casos y controles realizado por Winter y colaboradores (2015) en la universidad de California, se describen como factores de riesgo adicionales la edad menor de 4 meses, bajo peso al nacer, menor edad gestacional en el
Volumen 22 Número 1 Precop SCP 25
Diana Marcela Muñoz Manquillo, Jennifer Tatiana Henao Pabón, Yessica Adriana Bravo Enríquez, Juan Pablo Rojas Hernández
TP TP TP
LFA-1 CD62L
Taquipnea > 60 respiraciones por minuto
Tosferina maligna, una entidad milenaria y mortal
Hipoxia persistente después de tos en salvas
Adaptado de: Daniels HL, et al. Pediatr Rev. 2018;39(5):247-57.
momento de la presentación de la enfermedad y ausencia de vacuna de la difteria, el tétanos y la tosferina acelular (DTaP). Palvo y colaboradores (2017) informaron un punto de corte de 41 000 leucocitos/mm3 como predictor de ingreso a la UCI, con una sensibilidad del 65 %
Leucocitosis > 50 000 células/mm3
Bradicardia < 60 latidos por minuto
y una especificidad del 90 % y como predictor de mortalidad, con una sensibilidad del 100 % y especificidad del 81,6 %.
En la Tabla 1 se resumen los factores de riesgo para enfermedad complicada y las
Factores de riesgo de enfermedad complicada Complicaciones de tosferina
Bajo peso al nacer
Edad < 4 meses
Ausencia de vacunación DTaP
Taquipnea > 60 rpm
Bradicardia < 60 lpm
Hipoxia persistente luego de accesos de tos
Leucocitosis > 50 000 leucocitos/mm3
Neumonía
Apnea
Bradicardia
Hipertensión pulmonar
Fracturas costales
Enfisema subcutáneo
Neumotórax
SDRA-insuficiencia ventilatoria
Neurológicos: convulsiones, encefalopatía, hemorragia intracraneal
Hemorragias conjuntivales
lpm: latidos por minuto; rpm: respiraciones por minuto; SDRA: síndrome de dificultad respiratoria aguda. Adaptada de: Kuperman A, et al. Transfusion. 2014;54(6):1630-3.
Volumen 22 Número 1 Precop SCP 26
Figura 3. Predictores de enfermedad crítica asociada a tosferina.
Tabla 1. Factores de riesgo para enfermedad complicada y complicaciones asociadas a tosferina
complicaciones asociadas a la tosferina. Las complicaciones más graves de la hiperleucocitosis son la hemorragia intracraneal y la insuficiencia pulmonar debida a la leucostasis. Se ha sugerido que la gravedad puede estar directamente relacionada con la hiperviscosidad y la trombosis pulmonar resultante.
DIAGNÓSTICO
Una revisión sistemática realizada en 2017 por Ebell y colaboradores sobre el diagnóstico de tosferina concluye que la sospecha clínica del médico es el predictor más preciso de infección por B. pertussis, por lo que es indispensable pensar en esta patología ante síntomas clásicos, especialmente en lactantes menores. La guía de práctica clínica colombiana de 2014, dentro de su apartado para la identificación y manejo clínico de tosferina, tiene en cuenta las variaciones según la edad para la definición de caso y los clasifica así:
• menor de tres meses: toda infección respiratoria aguda acompañada de al menos uno de los siguientes síntomas: tos en accesos, estridor, apnea, cianosis o vómito después de toser;
• de tres meses a 12 años: toda infección respiratoria con tos de más de una semana de duración, acompañada de uno o más de los siguientes síntomas: tos paroxística, estridor o vómito después de la tos, sin otra causa aparente; o niños con episodios de tos paroxística intensa acompañada de estridor de cualquier tiempo de evolución;
• mayores de 12 años: toda infección respiratoria acompañada de tos prolongada de más de dos semanas de duración y presencia o no de paroxismos, expectoración y vómito.
Todo caso probable debe ser reportado ante el Sistema Nacional de Vigilancia en Salud Pública (SIVIGILA) y se deben tomar las muestras pertinentes para la confirmación de la enfermedad mediante cultivo, reacción en cadena de polimerasa (PCR) o serología
dependiendo de la fase en la que se realice la sospecha diagnóstica. Las definiciones de caso se describen en la Tabla 2
El cultivo tiene una especificidad del 100 %, pero una sensibilidad muy variable, que va del 12 % al 60 %, debido al difícil aislamiento microbiológico, que disminuye considerablemente después de las dos primeras semanas. Para aumentar la posibilidad del crecimiento de la bacteria, la muestra debe ser tomada idealmente por aspirado nasofaríngeo, además de que requiere almacenamiento y transporte en los medios adecuados y procesamiento en cultivos específicos para B. pertussis. La PCR tiene una sensibilidad del 70 %-99 % y una especificidad que oscila entre 81 % y 100 %, se puede realizar hasta antes de las cuatro semanas de iniciados los síntomas, por lo cual es más factible realizar el diagnóstico con este método, porque la mayoría de los casos sospechosos se detectan en la fase paroxística.
Si la sospecha se realiza una vez han pasado las cuatro semanas, el método diagnóstico de elección es la serología (inmunoglobulina G [IgG] y M [IgM]), con una sensibilidad del 60 %80 % y una especificidad del 73 %-99 %. El rendimiento mejora si se realiza por muestra pareada; es decir, una tomada en el momento de la sospecha y otra 4 a 6 semanas después cuando posiblemente los títulos de anticuerpos hayan aumentado; una elevación al doble del valor inicial tiene una sensibilidad entre 90 % y 92 %, y una especificidad del 72 % en comparación con el cultivo inicial; sin embargo, esto no es tan factible en el escenario clínico real (Figura 4).
El aislamiento del paciente durante su fase contagiosa una vez se sospeche la enfermedad es fundamental para evitar su propagación. Se debe aislar desde que se realiza el diagnóstico hasta que el paciente haya recibido 5 días de tratamiento con claritromicina o 3 días con azitromicina o hasta completar 21 días en caso de no haber recibido tratamiento antibiótico.
Volumen 22 Número 1 Precop SCP 27
Diana Marcela Muñoz Manquillo, Jennifer Tatiana Henao Pabón, Yessica Adriana Bravo Enríquez, Juan Pablo Rojas Hernández
Tabla 2. Definiciones de casos empleadas para el diagnóstico de la tosferina
Tipo de caso
Características de la clasificación
Probable Todo caso que cumple con los criterios de la definición clínica de caso y que no está epidemiológicamente relacionado con un caso confirmado por el laboratorio.
Confirmado por laboratorio Todo caso probable confirmado por el laboratorio mediante cultivo, PCR o IFD con resultado positivo.
Confirmado por nexo epidemiológico
Confirmado por clínica
Caso que cumple con los criterios de la definición clínica de caso y que está epidemiológicamente ligado de forma directa a un caso confirmado por el laboratorio.
Caso probable al cual no se le tomó una muestra, o que tiene muestras con fallas en el proceso de recolección, conservación o procesamiento y del cual no se pudo demostrar asociación epidemiológica a un caso confirmado. La clasificación de un caso como compatible representa una falla en la vigilancia epidemiológica del evento y requiere una unidad de análisis para su clasificación final, donde se revisa la evidencia clínica, paraclínica, epidemiológica y científica.
Descartado Caso con resultado negativo en cultivo o PCR. Resultado negativo por IFD: requieren unidad de análisis; si el cuadro clínico evidencia leucocitos entre 15 000 y 100 000 mm3 durante la fase catarral, o 30 000-40 000 mm3 durante la fase paroxística, y con linfocitosis entre el 60 % y el 80 %, se considera un caso compatible; de lo contrario, se descarta.
IFD: inmunofluorescencia directa; PCR: reacción en cadena de la polimerasa. Tomado de: Instituto Nacional de Salud (INS). Protocolo de Vigilancia de Tosferina. Versión 4 [Internet]; 13 de mayo de 2022. Disponible en: https://www.ins.gov.co/ buscador-eventos/Lineamientos/Pro_Tosferina.pdf
Figura 4. Pruebas diagnósticas útiles en tosferina. Momento óptimo de realización de las pruebas diagnósticas microbiológicas de tosferina.
Pruebas diagnósticas útiles en tosferina (semanas)
Nota: el cambio de color refleja una disminución de la sensibilidad y/o especificidad de la prueba. Tomado de: Montesdeoca A. Tosferina. Pediatr Integral. 2018;22(6):254-63.
DIAGNÓSTICO DIFERENCIAL
Dentro de las enfermedades infecciosas que pueden tener una presentación similar a la tosferina vale la pena destacar la infección por Adenovirus, que puede causar una tos paroxística emetizante; la presencia de faringitis,
conjuntivitis y síntomas gastrointestinales ayudan a diferenciarla de la infección por B. pertussis . Mycoplasma pneumoniae produce un cuadro de tos prolongada y neumonía; la auscultación pulmonar con estertores y los hallazgos en la radiografía de tórax permiten diferenciarlo de la tosferina. La neumonía por
Tosferina maligna, una entidad milenaria y mortal Volumen 22 Número 1 Precop SCP 28
0 2 4 6 8 10 12 Cultivo PCR Serología
Chlamydia trachomatis puede generar un cuadro de tos quintosa con inspiraciones entre cada episodio, el 50 % de los niños tendrá conjuntivitis asociada y generalmente tienen un conteo normal de leucocitos en el hemograma. La infección por virus respiratorio sincitial debuta con tos y apnea, asociado a sibilancias, fiebre y rinorrea, y se presenta usualmente en lactantes menores. Bordetella parapertussis causa un síndrome similar a la tosferina y representa el 5 % de los aislamientos de Bordetella en los Estados Unidos; suele manifestarse con un cuadro clínico menos grave, en el que la duración de la tos es más corta y los accesos de vómito posteriores a la tos son menos frecuentes.
TRATAMIENTO
La antibioticoterapia es el pilar del tratamiento contra la tosferina. El tratamiento sintomático de la tos asociada con infección por B. pertussis no ha sido muy eficaz en los ensayos clínicos, la difenhidramina y el salbutamol no cambiaron la cantidad de paroxismos de tos en un día y la dexametasona no redujo la duración de la estancia hospitalaria.
Antibióticos
La terapia antibiótica específica es uno de los pilares del manejo durante las primeras dos semanas, antes de que aparezcan los paroxismos típicos de tos. Se realiza con antibióticos del grupo de los macrólidos, que se asocian a una reducción en la duración y la gravedad de los síntomas, así como en las tasas de transmisibilidad ( Tabla 3).
Diferentes reportes han destacado el beneficio del tratamiento antibiótico temprano para lactantes pequeños con tosferina crítica. En un estudio sueco, iniciar tratamiento con antibióticos los primeros 6 días después del inicio de la tos se asoció con una menor duración de la misma, en comparación con el inicio de
tratamiento 2 semanas después. La resistencia a los antibióticos no ha sido una preocupación importante para B. pertussis ; sin embargo, existen casos reportados en China con cepas de B. pertussis emergentes con resistencia a los macrólidos.
Algunas consideraciones especiales en este punto de tratamiento son:
• La azitromicina está autorizada en menores de 1 mes, pero debe administrarse con precaución en pacientes con cardiopatías de base, por la posibilidad de prolongar el intervalo QT.
• Los pacientes menores de 6 semanas deben ser monitorizados por el riesgo de estenosis pilórica hipertrófica infantil asociada a la terapia con macrólidos, principalmente con eritromicina. Es de recalcar que son mayores los beneficios que otorga la terapia antibiótica ante la sospecha de un curso clínico compatible con tosferina.
• La trimetoprima-sulfametoxazol utilizada como segunda línea de manejo está contraindicada en niños menores de 2 meses, pero puede utilizarse como alternativa en casos de cepas con resistencia a macrólidos.
Quimioprofilaxis
Se recomienda para pacientes de alto riesgo y todos los contactos cercanos, independientemente de la edad o el estado de inmunización, porque es posible que la vacunación previa no prevenga la infección en todos los casos. Es más eficaz cuando se administra en las primeras 3 semanas después de la exposición ( Tabla 3).
Los pacientes de alto riesgo incluyen lactantes menores de 12 meses, mujeres en el tercer trimestre de embarazo, personas inmunocomprometidas, pacientes con patologías preexistentes que pueden empeorar con la tosferina y personas en estrecho contacto con personas de alto riesgo.
Volumen 22 Número 1 Precop SCP 29
Diana Marcela Muñoz Manquillo, Jennifer Tatiana Henao Pabón, Yessica Adriana Bravo Enríquez, Juan Pablo Rojas Hernández
Antibiótico Edad
< 1 mes 1-5 meses > 6 meses Adultos
Agentes primarios
Azitromicina 10 mg/kg/día una vez al día por 5 días
10 mg/kg, una vez al día por 5 días
Claritromicina No recomendado 15 mg/kg/día, en dos dosis, por 7 días.
Eritromicina No es el preferido 40-50 mg / kg / día, en 4 dosis, por 14 días.
Agentes alternativos
TMP-SMX Contraindicado > 2 meses: TMP 8 mg/kg/día SMX 40 mg/kg/día, en 2 dosis, por 14 días.
10 mg/kg (máx. 500 mg) una vez al día, día 1; luego (del día 2 al 5), 5 mg/kg (máx. 250 mg) una vez al día.
15 mg/kg (máx. 1 g/ día), en dos dosis, por 7 días.
40-50 mg/kg/día (máx. 2 gramos día), en 4 dosis, por 14 días.
500 mg una vez al día, día 1; (luego del día 2 al 5), 250 mg una vez al día.
1 g/día, en dos dosis, por 7 días.
2 gramos día en 4 dosis, por 14 días.
TMP 8 mg/kg/día SMX 40 mg/kg/día, en 2 dosis, por 14 días. Max TMP 320 mg/día
TMP 320 mg SMX 1600 mg/día, en 2 dosis, por 14 días.
TMP-SMX: trimetoprima/sulfametoxazol. Adaptado de: Daniels HL, et al. Pediatr Rev. 2018;39(5):247-57.
TOSFERINA MALIGNA
El punto cardinal para el tratamiento médico de la tosferina grave es el manejo temprano y anticipatorio. Una vez identificado el paciente con factores de riesgo o aquel con antecedente de enfermedad pulmonar, muscular o neurológica, que tiene un mayor riesgo de complicaciones, este deberá recibir un soporte adicional, idealmente en UCI, con el fin de minimizar las complicaciones más frecuentes en esta patología. En los casos de infección grave por B. pertussis, las medidas de sostén están dirigidas a garantizar una adecuada oxigenación y a mantener la estabilidad hemodinámica y resistencias pulmonares bajas.
Los ciclos de hiperhidratación se han descrito como una terapia benéfica, que garantiza un adecuado volumen intravascular en estados de hiperviscosidad; sin embargo, no existe una estrategia protocolizada de implementación en esta patología. La oxigenoterapia se considera otro punto importante dentro del soporte básico de manejo. Se indica de forma temprana en presencia de eventos de apnea, cianosis, tos en paroxismos, dificultad respiratoria asociada a sobreinfecciones por otros patógenos y diagnóstico de hipertensión pulmonar. Una vez instaurada la fatiga de músculos respiratorios, que lleva rápidamente a un estado de hipercapnia, principalmente en el grupo de los lactantes menores, está indicado el soporte con ventilación mecánica.
Tosferina maligna, una entidad milenaria y mortal Volumen 22 Número 1 Precop SCP 30
Tabla 3. Opciones terapéuticas y quimioprofilácticos para la tosferina
Múltiples series de casos han descrito que los estados de hiperleucocitosis están correlacionados con un riesgo diez veces mayor de muerte. Además de la leucocitosis extrema, se presenta hipoxemia refractaria, síndrome de dificultad respiratoria aguda pediátrica (SDRAp) e hipertensión pulmonar dentro del espectro de la infección grave; estos eventos suelen ser de rápida progresión y responden de forma errática, con bajas tasas de éxito a las maniobras de ventilación avanzadas, incluida la ventilación oscilatoria de alta frecuencia, el manejo con óxido nítrico inhalado y el soporte vital extracorpóreo.
El tratamiento de la tosferina potencialmente mortal está enfocado en disminuir la tasa de complicaciones incluida alguna medida útil y agresiva para reducir la cantidad de leucocitos y las toxinas de secreción. Es así como se han postulado terapias de leucodepleción encaminadas a la reducción de elementos tóxicos, las cuales pueden llevarse a cabo mediante dos técnicas: la leucoféresis y la exanguinotransfusión, que actualmente aún son controversiales.
La leucorreducción efectiva en la población pediátrica se puede lograr mediante un equipo de leucoféresis automatizado. Este método requiere un aparato de aféresis apropiado, personal capacitado y manejo en UCI por la alta probabilidad de reacciones adversas graves. La terapia manual se ha utilizado en otras patologías como la enfermedad hemolítica del recién nacido y la anemia de células falciformes; sin embargo, existen riesgos asociados a esta terapia como insuficiencia cardíaca, hipotermia, hipocalcemia, hipercalcemia e hipoglucemia, que se han informado en varios reportes de casos de tosferina grave.
En casos de leucocitosis extrema, la exanguinotransfusión también se ha descrito como una terapia de emergencia efectiva, dada su capacidad de renovar masa sanguínea, lo que disminuye la formación y el desarrollo de trombos leucocitoclásticos en la vasculatura
pulmonar. Debe iniciarse idealmente antes de la instauración de la hipotensión y de la insuficiencia hemodinámica, puede ser preferible a los métodos de leucodepleción porque elimina la TP y reduce el recuento neto de glóbulos blancos. Además, se describe una mayor experticia con esta técnica por parte del personal de cuidados intensivos, así como un menor requerimiento de dispositivos complejos.
Otro método de emergencia utilizado en las UCI para esta patología es la hemodiafiltración venovenosa continua. Esta técnica no cuenta con un soporte clínico con evidencia contundente que indique mejoría en los estados de hiperviscosidad y tampoco existen datos asociados a disminución de la mortalidad global con esta terapia.
La oxigenación por membrana extracorpórea (ECMO) se ha descrito como una medida terapéutica en casos potencialmente mortales, pues proporciona un soporte artificial cardíaco y respiratorio, y aporta una ventaja de supervivencia en casos de hipertensión pulmonar y falla multiorgánica por tosferina; no obstante, cuando se ofrece como terapia de rescate puede resultar muy costosa por el tiempo prolongado de uso, en la literatura se ha reportado desde 43 días hasta 90 días de hospitalización, con costos de hasta 1,5 millones de dólares. El Grupo de Cuidados Intensivos Pediátricos de Nueva Zelanda y Australia informan una carga financiera de 1 millón de dólares por año.
En un análisis retrospectivo de 100 casos en lactantes menores de 4 meses con tosferina crítica, quienes requirieron ECMO más maniobras de leucodepleción por transfusión de intercambio en cuidado intensivo, se logró una reducción en la tasa de mortalidad del 44 % al 10 %. Sin embargo, la tasa de éxito del tratamiento para estos lactantes es relativamente baja, con una tasa de mortalidad de un 70 %. Con base en los datos expuestos previamente, se reitera la necesidad de la realización de más estudios con el fin de aclarar los beneficios reales de
Volumen 22 Número 1 Precop SCP 31
Diana Marcela Muñoz Manquillo, Jennifer Tatiana Henao Pabón, Yessica Adriana Bravo Enríquez, Juan Pablo Rojas Hernández
estas terapias, ya que traen consigo efectos adversos graves y altos costos.
La literatura describe posibles terapias que se encuentran aún en fase experimental, que incluyen inmunosupresores y moduladores de canales aniónicos como pendrina, acetazolamida y fingolimod. Como terapias de interés en el campo investigativo, se relata el uso de anticuerpos específicos para la toxina pertussis, inmunoglobulina intrauterina contra la tosferina (P-IGIV) y anticuerpos monoclonales murinos humanizados específicos para la TP en animales infectados experimentalmente con B. pertussis. Estas son terapias específicas y dirigidas para el tratamiento de la leucocitosis y otros efectos asociados, que aún se encuentran en estudio para su aplicación.
Finalmente, se aporta un flujograma de manejo en cuidado intensivo para pacientes con tosferina maligna que brinda una guía para el actuar de forma secuencial y de acuerdo con la aparición de complicaciones ( Tabla 4). Cabe anotar que la propuesta original plantea metas de ventilación difíciles de alcanzar cuando se instaura un deterioro pulmonar grave, como es el caso de esta patología, todo esto asociado a un empeoramiento de la condición clínica y ventilatoria por volutrauma, barotrauma, atelectrauma y biotrauma. Por este motivo, ante estos riesgos deben considerarse estrategias de ventilación protectora con grados de hipercapnia e hipoxemia permisivas que incluyan pH mayores de 7,15, presión parcial de dióxido de carbono (pCO2) entre 60 y 65 mm Hg y presión parcial de oxígeno (pO2) mayores de 50 mm Hg en el contexto de un SDRAp instaurado.
PREVENCIÓN
La estrategia más efectiva para prevenir la tosferina es la vacunación. El Programa Ampliado de Inmunizaciones (PAI) en Colombia incluye la vacuna contra la tosferina en su fracción completa asociada a toxoide tetánico y diftérico,
conocida como DPT. Se aplica como parte de la vacuna pentavalente (que incluye antígenos contra hepatitis B y Haemophilus influenzae) a los dos, cuatro y seis meses, con refuerzo en su presentación triple bacteriana (DPT) a los 18 meses y 5 años. Se sabe que hay eventos adversos a la vacuna muy temidos por los padres, dentro de los que se incluyen reacciones locales, fiebre, convulsiones febriles y síndrome de llanto persistente, por lo cual en muchos países se ha empezado a administrar la vacuna en su forma acelular (DTaP), compuesta de varios antígenos purificados que incluyen al menos toxina pertúsica, pertactina y algunas fimbrias que se han relacionado con una menor aparición de estos síntomas.
¿EN QUÉ SE DIFERENCIAN
DTAP, TDAP, DT Y TD?
Existen cuatro combinaciones de vacunas que se utilizan para prevenir la difteria, tétano y tosferina: DTaP, Tdap, DT y Td. Dos de estas (DTaP y DT) se les administran a niños menores de 7 años, y dos (Tdap y Td) se les administran a niños mayores y adultos.
Los Centros para el Control y la Prevención de Enfermedades (CDC) recomiendan que todas las personas a partir de los 11 años, incluidas las mujeres embarazadas, reciban la vacuna contra la tosferina en su presentación Tdap. En algunos países ya se incluye dentro de su calendario la vacuna para los niños a partir de los siete años y se recomiendan refuerzos cada diez años. Según la Academia Americana de Pediatría, las únicas contraindicaciones para la vacunación son una reacción anafiláctica secundaria a la administración de la vacuna y encefalopatía dentro de los 7 días posteriores a la administración de la dosis que no sea atribuible a otra causa.
En los neonatos y lactantes pequeños, en quienes se presentan las mayores tasas de mortalidad, la estrategia con mayor evidencia
Tosferina maligna, una entidad milenaria y mortal Volumen 22 Número 1 Precop SCP 32
Tabla 4. Enfoque terapéutico para pacientes con tosferina maligna en UCI
Ingreso para monitorización no invasiva
- Crisis de cianosis o apnea
- Evidencias de sobreinfección
- Taquicardia sinusal > 190 lpm de causa no aclarada
- Recuento leucocitario > 50 000 mm3
Si evoluciona con hipoxia o choque
- Monitorice la PA invasiva, ECG continuo, saturometría continua
- Asegure PaO2 > 50 mm Hg (si es necesario, con asistencia respiratoria mecánica)
- Optimice la precarga (asegure PA en > percentil 5 para la edad)
- Evalúe el uso de drogas vasoactivas (milrinona, dobutamina, levosimendán)
- Realice un ecocardiograma con medición de presiones pulmonares y función ventricular
- Inicie antibioticoterapia empírica para cubrir la sobreinfección
- Normalice el calcio, el fósforo, el magnesio, el sodio, el potasio, la glucemia
Si evoluciona con hipertensión pulmonar
- Inicie sedoanalgesia continua
- Mantenga pH > 7,15
- PaCO2 entre 60 y 65 mm Hg
- Uso de ONi
Ante el empeoramiento de oxigenación o acidosis respiratoria
- Inicie VAFO si el índice de oxigenación es > 16 o PaO2 < 50 mm Hg con PAW > 16 cm H2O
- Uso de ONi o vasodilatadores pulmonares (sildenafilo)
- Evite el balance excesivo de fluidos; use furosemida o hemofiltración
Ante el ascenso progresivo del recuento leucocitario
- Considere la factibilidad de leucoféresis o exanguinotransfusión
- Evalúe la velocidad de ascenso ulterior de leucocitos para una segunda exanguinotransfusión
- Ante el empeoramiento, evalúe la ECMO, de estar disponible
PA: presión arterial; ONi: óxido nítrico inhalado; PaCO2: presión arterial de dióxido de carbono; PaO2: presión arterial de oxígeno; PAW: presión en la vía aérea; VAFO: ventilación de alta frecuencia oscilatoria. Adaptada de: Taffarel P et al. Arch Argent Pediatr. 2015;113(5):456-64.
y un buen perfil de seguridad, inmunogenicidad y efectividad es la vacunación a las madres embarazadas con Tdap a partir de las 26 semanas de gestación, que debe repetirse en cada embarazo. La vacuna permite el paso transplacentario de anticuerpos al bebé y esto le otorga inmunidad. Otra de las estrategias para la prevención de lactantes no vacunados es el cooconing o estrategia capullo, que se ha recomendado desde hace varios años en Estados Unidos, Francia, Australia y Alemania. Consiste
en vacunar al entorno familiar (padre, hermanos, abuelos, cuidadores) cercano al recién nacido con Tdap, al menos cuatro semanas antes de tener contacto con el niño para ofrecerle un ambiente seguro.
PRONÓSTICO
Se han establecido algunos predictores de mortalidad elevada y secuelas neurológicas asociadas
Volumen 22 Número 1 Precop SCP 33
Diana Marcela Muñoz Manquillo, Jennifer Tatiana Henao Pabón, Yessica Adriana Bravo Enríquez, Juan Pablo Rojas Hernández
Tosferina maligna, una entidad milenaria y mortal
a tosferina maligna, como la presencia de apnea y bradicardia durante los episodios de tos, el cambio en el estado mental, las convulsiones en pacientes menores de seis meses de edad y principalmente en menores de dos meses,
la asociación con neumonía, la presencia de comorbilidades y el estado de choque. Los factores predictivos aislados de muerte son la bradicardia en episodios de tos, las convulsiones y la hipertensión pulmonar.
LECTURAS RECOMENDADAS
1. Argondizo-Correia C, Rodrigues AKS, de Brito CA. Neonatal Immunity to Bordetella pertussis Infection and Current Prevention Strategies. J Immunol Res. 2019;2019:7134168. doi: 10.1155/2019/7134168.
2. Carbonetti NH. Pertussis leukocytosis: mechanisms, clinical relevance and treatment. Pathog Dis. 2016;74(7):ftw087. doi: 10.1093/femspd/ftw087.
3. Daniels HL, Sabella C. Bordetella pertussis (Pertussis). Pediatr Rev. 2018;39(5):247-257. doi: 10.1542/ pir.2017-0229.
4. Instituto Nacional de Salud (INS). Protocolo de Vigilancia de Tosferina. Versión 4 [Internet]; 13 de mayo de 2022. Disponible en: https://www.ins.gov. co/buscador-eventos/Lineamientos/Pro_Tosferina.pdf
5. Machado MB, Passos SD. Severe pertussis in childhood: update and controversy - systematic review. Rev Paul Pediatr. 2019;37(3):351-362. doi: 10.1590/1984-0462/;2019;37;3;00006.
6. Guía de práctica clínica para la identificación y el manejo clínico de la tosferina en menores de 18 años de edad. Actualización 2014. Bogotá: Ministerio de Salud y Protección Social; 2014.
7. Montesdeoca A. Tosferina. Pediatr Integral. 2018;22(6):254-63.
8. Moore A, Harnden A, Grant CC, Patel S, Irwin RS; CHEST Expert Cough Panel. Clinically Diagnosing Pertussis-associated Cough in Adults and Children: CHEST Guideline and Expert Panel Report. Chest. 2019;155(1):147-154. doi: 10.1016/j.chest.2018.09.027.
9. Nguyen VTN, Simon L. Pertussis: The Whooping Cough. Prim Care. 2018;45(3):423-431. doi: 10.1016/j. pop.2018.05.003.
10. Orloff KE, Turner DA, Rehder KJ. The Current State of Pediatric Acute Respiratory Distress Syndrome. Pediatr Allergy Immunol Pulmonol. 2019;32(2):35-44. doi: 10.1089/ped.2019.0999.
11. Scanlon K, Skerry C, Carbonetti N. Association of Pertussis Toxin with Severe Pertussis Disease. Toxins (Basel). 2019;11(7):373. doi: 10.3390/toxins11070373.
12. Taffarel P, Jorro Barón F, Bonetto G. Actualización en terapias de leucorreducción como alternativas para el tratamiento de coqueluche grave [Update on leukoreduction therapies as alternatives for the treatment of severe pertussis]. Arch Argent Pediatr. 2015;113(5):456-64. Spanish. doi: 10.5546/aap.2015.456
Volumen 22 Número 1 Precop SCP 34
Manejo
de las infecciones por StaphylococcuS aureuS en pediatría
Sebastián Camilo Medina Rivera1
Freddi Giovanni Soto2
INTRODUCCIÓN
Desde la identificación y caracterización original de Staphylococcus aureus , hasta el desarrollo de nuevas terapias para su tratamiento y la posibilidad de desarrollar una vacuna, el camino que se ha recorrido en el conocimiento de este microorganismo y sus características ha sido largo y lleno de altibajos.
Conocido por ser un coco grampositivo, catalasa y coagulasa positivo, que puede ser desde un microorganismo colonizador de curso asintomático hasta el causante potencial de secuelas y mortalidad a través de múltiples entidades clínicas como bacteriemia, osteomielitis, neumonía necrosante y endocarditis, S. aureus es una bacteria de especial interés para el médico general y para el pediatra.
FACTORES FISIOPATOLÓGICOS GENERALES Resistencia
Una de las principales características históricas del S. aureus es la evolución de su resistencia a los antibióticos que se han usado para su
tratamiento. S. aureus logró mecanismos de resistencia contra la penicilina muy pronto en la historia, así que a principios de los años 60 era bien conocida dicha resistencia. Actualmente es muy raro encontrar S. aureus sensible a penicilina, debido a la presencia de una β -lactamasa propia, codificada en el operón blaZ de origen cromosómico y en transposones.
Como respuesta a esta resistencia a la penicilina se creó la meticilina, que por su alta toxicidad renal no siguió su curso dentro del campo clínico; sin embargo, continuó usándose como marcador de referencia en el laboratorio. De ese uso nominal aparece la definición de S. aureus resistente a la meticilina (SAMR), contraparte de S aureus sensible a la meticilina (SAMS), entendiéndose que ningún β -lactámico que previamente pudiera tener efecto antiestafilocócico tendrá efecto contra el SAMR. Esta resistencia a la meticilina está mediada por la producción de proteínas de unión a penicilina tipo 2A (PBP2a), en S. aureus con resistencia hay adquisición del gen mecA que codifica para generar sitios de unión con menor afinidad a los β -lactámicos.
A raíz del aumento progresivo de la resistencia a meticilina, la vancomicina fue el antibiótico
Volumen 22 Número 1 Precop SCP 35
1. Pediatra, Clínica de Marly, Fundación Hospital de la Misericordia (HOMI)
2. Pediatra infectólogo, Instituto Roosevelt
que recibió la carga de tratar las infecciones complicadas que requirieran efecto bactericida contra S. aureus por más de 50 años, por lo que la aparición de mecanismos de resistencia a este fármaco no se hizo esperar. A través de un plásmido de conjugación proveniente de Enterococcus spp. que contenía el gen Van A , se logró un cambio en el sitio de unión a glucopéptidos, lo que se tradujo en presencia de S. aureus resistente a vancomicina (SARV). Además, existe S. aureus con susceptibilidad intermedia a vancomicina (VISA) y poblaciones heterogéneas de S. aureus (hVISA) que, mediante un proceso de adaptación gradual, han engrosado sus paredes para dificultar el paso del glucopéptido al interior de la bacteria, estas poblaciones son más frecuentes que el VISA.
Existen adicionalmente mecanismos de resistencia a macrólidos, clindamicina y sulfas, que son antibióticos usados en menor medida para el manejo de infecciones graves por S aureus, pero que en nuestro medio cuentan con relevancia clínica.
Virulencia
Los factores de virulencia de S. aureus se describen en la Tabla 1
ENTIDADES CLÍNICAS
Dentro del espectro de manifestaciones de la infección por S. aureus podemos encontrar 4
Factores
MSCCRAMMS (clumping factor), proteínas de unión a fibronectina, colágeno y sialoproteínas de unión a hueso
Biofilm (biopelícula), acumulación de polisacárido, formación de pequeñas colonias (variantes)
Proteína A, cápsula serotipos 5 y 8, leucocidina Panton-Valentine (PVL), modulinas solubles en fenol, proteínas inhibidoras de la quimiotaxis, toxina-g
Proteasas, lipasas, nucleasas, hialuronidasas, fosfolipasas C, elastasas (metaloproteasas), coagulasa
Enterotoxinas, toxina del choque tóxico1(TSST-1), toxina exfoliativa A y B, toxina α-peptidoglicano, ácidos lipoteicoicos
Bacteriocinas, ACME
Unión a proteínas del hospedero, importante en infección osteoarticular, catéteres y sondas
Acumulación de polisacáridos, persistencia en dispositivos e invasión en tejido proinflamatorio
Evasión de sistema inmune, destrucción de células de defensa Aumento de destrucción de tejidos, abscesos, procesos necrosantes
Invasión, destrucción y penetración profunda de tejidos Importante en infecciones necróticas
Efecto de superantígeno, desencadenante de cascada inmunológica, activación de macrófagos y linfocitos T, daño a distancia
Inhibición de otras bacterias e inhibición de radicales libres de oxígeno
Adaptada de: Cervantes-García E, et al. Rev Latinoam Patol Clin Med Lab. 2014;61(1):28-40.
fnbB, cna, sdr, bbp
ica, hemB
Luk-PV, lukF-PV, hlg, cap5, psm-α, chp, eap
v8, hysA, hla, plc sepa, arc
Sea-q (no sef), tstH, eta, etb, hla
Conjunto de genes arc, genes opp-3, bsa
Volumen 22 Número 1 Precop SCP 36
Manejo de las infecciones por StaphylococcuS aureuS en pediatría
Tabla 1. Factores de virulencia de S. aureus
Factor Acción Genes
de virulencia
clfA, clfB, fnbA,
grupos de importancia clínica: enfermedades secundarias a toxinas, infecciones de piel y tejidos blandos, infecciones invasivas e infecciones asociadas al cuidado de la salud.
Enfermedades secundarias a toxinas
Se caracterizan por no estar mediadas de manera directa por el crecimiento bacteriano y la invasión de S. aureus, sino por la respuesta de nuestros tejidos a las enzimas producidas por este, aun a distancia de los focos de infección.
Síndrome de choque tóxico
Caracterizado por la presencia de fiebre, signos clínicos de choque, eritrodermia y descamación, junto con el compromiso de mínimo 3 órganos sistémicos. No requiere del aislamiento en cultivo de S. aureus; sin embargo, si se sospecha la infección primaria, es posible aislarlo hasta en un 90 % de los casos.
La principal causante de este síndrome es la toxina 1 del síndrome de choque tóxico (TSST1), una proteína termoestable sintetizada por genes cromosómicos que tiene función de superantígeno y desencadena una cascada de reacción de citocinas mediada por macrófagos y linfocitos T, que dependiendo de las concentraciones puede generar el efecto de extravasación endotelial o efecto citotóxico.
Síndrome de piel escaldada
Llamado también enfermedad de Ritter y descrita en 1878, se caracteriza por una reacción cutánea de características ampollosas y de descamación intraepidérmica, mediada principalmente por toxinas exfoliativas dentro de las que resaltan las endotelinas tipo A (ETA) y tipo B (ETB). La hidrólisis del dominio extracelular aminoterminal de la desmogleína 1 por las toxinas exfoliativas estafilocócicas da como resultado la interrupción de la adhesión y la escisión de los queratinocitos dentro del estrato granuloso, lo que conduce a la formación de ampollas.
Clínicamente está precedido por odinofagia o conjuntivitis, con una posterior aparición en las siguientes 48 horas de lesiones bullosas, flácidas y delicadas con signo de Nikolsky positivo (desprendimiento de la epidermis con el frote de la misma) y que pueden presentarse desde formas locales en sitios de flexión hasta grandes superficies de la piel. Es más frecuente en menores de 5 años, con una frecuencia aumentada durante el período neonatal, posiblemente por la inmadurez renal que puede llevar a una menor excreción de las toxinas.
Intoxicación alimentaria
Se conoce como estafiloenterotoxicosis o estafiloenterotoxemia a la ingesta de toxinas producidas por S. aureus, en la que resalta su período de incubación corto de menos de 8 horas, con manifestaciones clínicas que pueden ir desde náuseas, vómitos, dolor abdominal y diarrea, hasta formas graves con estados de choque. Sin embargo, su curso suele ser corto, de gravedad leve a moderada, que dura aproximadamente 24 a 48 horas.
Infecciones de tejidos blandos
Es la mayor causa de infecciones con aislamiento de S. aureus registradas en nuestro medio, tiene una presentación variada que puede ir desde celulitis hasta abscesos o fascitis con procesos necróticos asociados.
Los factores de riesgo asociados a la recurrencia de estas infecciones están ligados a la colonización, condiciones individuales de la piel (eczema, dermatitis), contacto directo con lesiones activas de pacientes con infecciones de este tipo y condiciones médicas de base.
Clásicamente, se ha descrito que la primera línea de tratamiento es la incisión y drenaje de las lesiones en la piel que sean susceptibles; sin embargo, en los últimos años el uso de antibiótico sistémico de manera conjunta al drenaje ha disminuido la recurrencia.
Volumen 22 Número 1 Precop SCP 37
Sebastián Camilo Medina Rivera, Freddi Giovanni Soto
El tratamiento en general va a estar determinado por la gravedad de la infección y la epidemiología local, mientras que la duración del tratamiento sigue siendo tema de debate; aunque cada vez se proponen esquemas más cortos en la mayoría de enfermedades, cursos tan cortos como 3 días podrían resultar en mayores recurrencias de la infección a un mes.
Infecciones invasivas
En este grupo tenemos las entidades que vemos con mayor frecuencia en el ámbito hospitalario, se caracterizan por presentar manifestaciones clínicas moderadas a graves, con alto riesgo de complicación y morbimortalidad.
Neumonía
Luego de la ampliación de la vacunación para Haemophilus influenzae y Streptococcus pneumoniae, S. aureus se ha convertido en una etiología con mayor relevancia en neumonía adquirida en la comunidad (NAC). Ya sea por sus factores de virulencia intrínsecos o por estar fuera del cubrimiento de los regímenes antibióticos de primera línea para neumonía adquirida en la comunidad, la infección pulmonar por S. aureus se ha caracterizado por una progresión rápida, que puede resultar en un curso clínico complicado con mayores tiempos de estancia hospitalaria, mayor requerimiento de ingreso a la unidad de cuidados intensivos pediátricos (UCIP) y mayor necesidad de ventilación mecánica o intervenciones quirúrgicas y aumento de la mortalidad.
A diferencia de la presentación clásica de la NAC, en la neumonía por S. aureus es muy frecuente encontrar complicaciones como derrame pleural, focos de necrosis, cavitaciones o empiema y son justamente estos hallazgos los que deben hacernos sospechar de manera temprana la presencia de este microorganismo para iniciar cubrimiento antibiótico adecuado sin suspender cubrimiento para neumococo
o H. influenzae (que también puede generar cursos de enfermedad complicada en algunos de sus serotipos más frecuentes).
La sobreinfección por S. aureus después de neumonías virales tampoco es infrecuente y genera un aumento de hasta 8 veces el riesgo relativo de mortalidad en niños previamente sanos, como bien se evidenció en la epidemia de influenza H1N1 en 2009. Es por esto que, a pesar de tener un primer reporte de infección viral, ante un cuadro clínico atípico o presencia de complicaciones, es necesario iniciar el cubrimiento antibiótico previa toma de hemocultivos y cultivos de aquellos sitios susceptibles de drenaje o manejo quirúrgico, y se sabe que hasta un 26 % puede cursar con bacteriemia y un 52 % puede tener crecimiento del S. aureus en derrames y empiemas.
Infecciones de sistema nervioso central
La infección por S. aureus al nivel del sistema nervioso central (SNC) no suele ser frecuente y, de suceder, está asociada a procedimientos quirúrgicos, siembras a distancia por bacteriemia o compromiso por extensión de focos parameníngeos. La presencia de dispositivos en el SNC como derivaciones ventriculoperitoneales aparece hasta en un 70 % de estas infecciones, seguida por meningitis hemorrágicas hasta en un 13 % y un 10 % manifestada como abscesos epidurales de localización espinal.
Debe sospecharse en pacientes con fiebre y alteraciones neurológicas (cefalea, alteración del estado de consciencia, emesis), dolor cervical o de espalda y compromisos medulares. En el caso de sospecha de infección en dispositivos intracraneales, la disfunción de los mismos y la presencia de signos inflamatorios en el trayecto o los puntos de entrada de los dispositivos pueden ser orientadoras.
La toma de muestras de líquido cefalorraquídeo e imágenes (resonancia magnética nuclear
Manejo
Volumen 22 Número 1 Precop SCP 38
de las infecciones por StaphylococcuS aureuS en pediatría
[RMN] contrastada, de elección) debe ser prioritaria y el inicio de antibiótico debe considerar una adecuada penetración al SNC, así como el retiro de los dispositivos involucrados y el drenaje de colecciones susceptibles para lograr el éxito terapéutico.
Infecciones musculoesqueléticas
La clínica de las infecciones musculoesqueléticas va desde el compromiso muscular en las piomiositis hasta las infecciones osteoarticulares, que son secundarias en su mayoría a siembras hematógenas, por lo que las manifestaciones pueden ir desde síntomas locales hasta compromiso sistémico grave.
El compromiso muscular suele estar localizado en su mayoría hacia la región pélvica y los músculos de extremidades inferiores. Por su parte, las infecciones osteomusculares son frecuentes en huesos largos de miembros inferiores, seguidas de los huesos largos de los miembros superiores, en una alta relación con el flujo sanguíneo aumentado en las epífisis y placas de crecimiento de los mismos. Tienen alta posibilidad de complicación y secuelas con presencia de colecciones subperiósticas y trombosis venosas sépticas y no sépticas que por drenaje anatómico pueden terminar en émbolos sépticos pulmonares.
Deben sospecharse en aquellos pacientes que presenten fiebre, signos inflamatorios locales, dolor localizado desproporcionado respecto al estímulo, limitación de los arcos de movimiento, alteración para la marcha y pérdida de la fuerza. El diagnóstico parte de la clínica, pero la proteína C-reactiva (PCR) será de importancia no solo para el diagnóstico sino también para el seguimiento una vez iniciado el tratamiento. Dada la frecuencia de siembra hematológica, la toma de hemocultivos es fundamental para orientar el tratamiento antibiótico dirigido final. La RMN contrastada será la imagen de elección y de gran ayuda tanto para el diagnóstico como
para la evaluación del compromiso total de la infección y la planeación del abordaje quirúrgico, que junto al inicio temprano de antibiótico (especialmente en pacientes con compromiso grave y rápido deterioro) son pilares del tratamiento. El manejo quirúrgico (drenaje por punción, desbridamiento y curetaje) permite ampliar la posibilidad de aislamiento microbiológico y orientación de tratamiento dirigido.
El tratamiento antibiótico empírico debe escogerse según la susceptibilidad local para S. aureus y el estado clínico del paciente, y debe ajustarse según los aislamientos obtenidos en muestras quirúrgicas y hemocultivos. La duración de la terapia intravenosa, el cambio a vía oral y la duración final de tratamiento han sido tema de amplia discusión, y se han propuesto desde 7 días de tratamiento parenteral con cambio a oral (una vez se logre una disminución significativa de los reactantes de fase aguda y mejoría clínica evidente sin requerimiento de nuevas intervenciones), hasta completar cursos de entre 3 y 4 semanas en ausencia de complicaciones. Sin embargo, la personalización del tratamiento y el seguimiento ambulatorio son vitales en este tipo de patología.
Bacteriemia
S. aureus es una causa frecuente de infecciones del torrente sanguíneo, con un alto grado de morbimortalidad asociada. Puede ser causa y consecuencia de infecciones a distancia en distintos sistemas, que resultan en otras infecciones invasoras o de piel y tejidos blandos. Sin embargo, la aparición de infecciones del torrente sin un origen claro puede oscilar entre el 5 % y el 30 %, y se asocia con mayor mortalidad.
Dentro de los factores de riesgo descritos para este tipo de infección se encuentran la colonización, la presencia de dispositivos endovasculares, inmunodeficiencias (primarias y secundarias), prematuridad y enfermedad
Volumen 22 Número 1 Precop SCP 39
Sebastián Camilo Medina Rivera, Freddi Giovanni Soto
cardíaca congénita. La presencia de fiebre sin foco evidente con compromiso sistémico y de marcadores inflamatorios elevados con o sin choque, especialmente en aquellos pacientes con los factores de riesgo mencionados, deben aumentar el índice de sospecha. Se han descrito como factores de riesgo para bacteriemia prolongada la presencia de SAMR, infecciones musculoesqueléticas, infección endovascular y retraso en el control del foco primario de infección.
El uso de vancomicina con β -lactámico (oxacilina) asociado se propone como primera línea para manejo empírico, se busca un efecto bactericida con buena penetración a diferentes tejidos y adecuada biodisponibilidad. El tratamiento debe ser ajustado tan pronto se disponga del aislamiento y se conozca la susceptibilidad antimicrobiana. En cuanto a la duración, se propone de 7 a 14 días de tratamiento endovenoso en pacientes sin complicaciones, mientras que en el paciente con curso complicado y tendencia al deterioro se propone el seguimiento con hemocultivos hasta lograr 1 muestra sin crecimiento.
Endocarditis e infección endovascular
Es una entidad no muy frecuente en pediatría; sin embargo, la presencia de S. aureus en endocarditis puede ir hasta un 32 % y la mortalidad por este microorganismo puede ascender hasta un 66 %. La sospecha clínica en pediatría puede ser más compleja, al no ser tan frecuente la aparición de los signos clínicos clásicos descritos en adultos como ruidos cardiacos anómalos en la auscultación, insuficiencia cardiaca congestiva y fenómenos embólicos; mientras que síntomas como mialgias, fiebre persistente, astenia, adinamia y pérdida de peso pueden ser más característicos de la entidad en la población pediátrica.
Ante la sospecha clínica, la obtención de hemocultivos (3 sets) de 3 punciones diferentes aumenta la probabilidad de aislamiento microbiológico y la realización de ecocardiograma transtorácico (ETT) puede ser suficiente para lograr hallazgos compatibles con la entidad, sin que un ETT normal descarte la infección.
El retiro inmediato de posibles focos de infección persistente como los catéteres venosos centrales (CVC) es vital para un adecuado tratamiento, que a su vez dependerá de distintos factores como el fenotipo de resistencia, la presencia de dispositivos endovasculares y la presencia de complicaciones, y es de elección para el tratamiento el uso de fármacos con efecto bactericida y la asociación a gentamicina y rifampicina para infecciones en presencia de material protésico cardíaco.
Infecciones asociadas al cuidado de la salud
La colonización en pacientes hospitalizados aumenta en la medida que aumenta la duración de la estancia hospitalaria, así como con los dispositivos invasivos que tenga el paciente, especialmente aquellos de tipo vascular o de vía aérea. De esta forma, hay 3 entidades clínicas altamente asociadas a S. aureus: infección asociada a catéter, infección asociada al ventilador e infecciones de sitio operatorio, que por su baja frecuencia y manejo característico no serán tema de revisión del presente artículo.
TRATAMIENTO
El tratamiento antibiótico de las infecciones antiestafilocócicas según la localización, así como las dosis y consideraciones especiales para cada uno de ellos, se describen en las Tablas 2 y 3.
Manejo
Volumen 22 Número 1 Precop SCP 40
de las infecciones por StaphylococcuS aureuS en pediatría
Tratamiento
Entidad Tratamiento Duración de terapia
Neumonía complicada
Manejo empírico Ceftriaxona +
- Paciente estable: clindamicina
- Paciente inestable: vancomicina Aislamiento final:
- SAMS: oxacilina
- SAMR: vancomicina o linezolida
- Ceftarolina como opción en monoterapia (cubrimiento para SAMR). Revisar indicaciones con infectología.
- 7 a 21 días según la condición clínica y no requerimiento de nuevas intervenciones
- SAMS (7-14 días)
- SAMR (14 días mínimo)
- Tratamiento IV total
Consideraciones especiales
Se hace cubrimiento empírico para microorganismos frecuentes incluido S. aureus. Se ajusta el tratamiento con aislamiento.
Se realiza el drenaje de empiema o manejo quirúrgico de tejido necrótico.
Sin uso de daptomicina por inactivación por surfactante.
Artritis séptica
Manejo empírico:
- Paciente estable: clindamicina
- Paciente inestable: vancomicina + oxacilina
- SAMS: oxacilina o cefazolina IV o
- Cefalosporina de 1° oral
- SAMR: vancomicina, clindamicina o TMP-SMX
Osteomielitis Manejo empírico:
- Paciente estable: clindamicina
- Paciente inestable: vancomicina + oxacilina
- SAMR: vancomicina
- SAMS: oxacilina o cefazolina IV
- Cefalosporina de 1° oral
- SAMR: vancomicina, clindamicina o TMP-SMX
SNC Manejo empírico:
- Vancomicina (sospecha de empiema o infección de DVP)
- SAMS: oxacilina
- SAMR: vancomicina o linezolida (revisar indicaciones con infectología)
- Mínimo 21 días
- Cambio a oral según el drenaje quirúrgico, disminución de PCR y estabilidad clínica
Búsqueda activa de bacteriemia asociada y complicaciones. Con adecuada evolución clínica, hacer cambio a terapia oral sin retraso.
Opciones orales dependen de disponibilidad y tolerancia. Seguimiento ambulatorio estricto con reactantes de fase aguda y condición clínica.
- Mínimo 28 días
- Cambio a oral según el drenaje quirúrgico, disminución de PCR y estabilidad clínica
Búsqueda activa de bacteriemia asociada y complicaciones. Con adecuada evolución clínica, hacer cambio a terapia oral sin retraso.
Opciones orales dependen de disponibilidad y tolerancia. Seguimiento ambulatorio estricto con reactantes de fase aguda y condición clínica.
Absceso cerebral o empiema subdural (4-6 semanas IV) con adecuado drenaje, disminución de PCR y mejoría clínica
En los casos de infección de DVP, el tratamiento debe realizarse IV completo por 10 días y toma de nuevo cultivo (sin complicación) o 21 días y toma de nuevo cultivo (hidrocefalia multicompartimental, ventriculitis, peritonitis complicada). Siempre se debe hacer retiro del sistema, externalización de la derivación y continuar el tratamiento IV hasta 10 días después de lograr cultivos de LCR negativos. Internalización del sistema después de 3 cultivos de LCR negativos.
Volumen 22 Número 1 Precop SCP 41
Sebastián Camilo Medina Rivera, Freddi Giovanni Soto
Tabla 2. Principales entidades clínicas causadas por S. aureus y tratamiento
Bacteriemia
Manejo empírico:
- Oxacilina + vancomicina
- SAMS: oxacilina
- SAMR: vancomicina
- SAMS: 7-14 días
- SAMR: 14 días si los cultivos de control son negativos
- Tratamiento IV completo
Consideraciones especiales
Búsqueda activa de focos metastásicos (osteoarticular, endocarditis, neumonía, catéter central).
ETT si hay clínica de endocarditis, fiebre por más de 72 horas. Evaluar el uso de terapia combinada para reducir toxinas (clindamicina/ linezolida).
Endocarditis
Manejo empírico:
- Oxacilina + vancomicina
- SAMS: oxacilina/cefazolina
- SAMR: vancomicina/ daptomicina (revisar indicaciones con infectología)
- SAMS: 6 semanas
- SAMR: 4-6 semanas
- Tratamiento IV completo
Si hay material endoprotésico, adicionar rifampicina por 6 semanas y gentamicina por las primeras 2 semanas.
Monitorización cercana de eventos adversos.
Celulitis, impétigo, absceso
Manejo empírico:
- Según gravedad
- SAMS: oxacilina-cefalosporina de 1° generación
- SAMR: clindamicina o Vancomicina IV
- Clindamicina o TMP-SMX
Fascitis Manejo empírico:
- Vancomicina
- SAMS: oxacilina
- SAMR: vancomicina o linezolida (revisar indicaciones con infectología)
- 7 a 10 días
- Cambio a oral si hay disminución de PCR y estabilidad clínica
Tratamiento inicial IV si el paciente presenta respuesta inflamatoria, compromiso extenso o compromiso facial.
Evaluar la posibilidad de manejo oral temprano. Si hay recurrencia, evaluar descolonización.
14-21 días dependiendo del requerimiento de manejo quirúrgico y la evolución clínica
Evaluar la coinfección con gramnegativos y realizar el cubrimiento según epidemiologia local y factores de riesgo para Pseudomonas spp.
DVP: derivación ventrículo-peritoneal; ECOTT: ecocardiograma transtorácico; IV: intravenoso; LCR: líquido cefalorraquídeo; PCR: proteína C-reactiva; SAMR: S. aureus resistente a la meticilina; SAMS: S. aureus sensible a la meticilina; TMP-SMX: trimetoprima-sulfametoxazol.
Adaptado de: Kalu IC, et al. Infect Dis Clin North Am. 2022;36(1):73-100; McMullan BJ, et al. Pediatrics. 2020;146(3):e20200134; McMullan BJ, et al. Lancet Infect Dis. 2016;16(8):e139-52; Avedissian SN, et al. Expert Rev Anti Infect Ther. 2021;19(9):1107-116.
Manejo
Volumen 22 Número 1 Precop SCP 42
de las infecciones por StaphylococcuS aureuS en pediatría
de terapia
Tratamiento Entidad Tratamiento Duración
Tabla 2. Principales entidades clínicas causadas por S. aureus y tratamiento (continuación)
Tabla
Antibiótico Dosis Consideraciones
Oxacilina 200 mg/kg/día IV cada 4 horas Dosis altas: elevación de transaminasas
Cefazolina 150 mg/kg/día IV cada 6-8 horas Toxicidad renal
Vancomicina 60 mg/kg/día IV cada 6 horas Concentración: 15-20 mg/L
AUC/MIC 400 mg/h/L
Nefrotoxicidad
Clindamicina 40 mg/kg/día IV o VO cada 6 horas Colitis pseudomembranosa
Linezolida 30 mg/kg/día IV o VO cada 8 horas Freno medular después de 2 semanas de uso, neuritis óptica.
Uso en neumonía complicada e infecciones del SNC por buena penetración a tejidos, uso en fascitis por inhibición de toxinas.
Daptomicina 8-10 mg/kg/día IV cada 24 horas Niños > 1 año: rabdomiólisis. Uso en endocarditis por SAMR cuando no se logra el control de la bacteriemia con vancomicina. No usar en neumonía por inhibición con el surfactante pulmonar.
Ceftarolina 8-12 mg/kg/dosis IV cada 8 horas Niños > 2 meses. Uso en monoterapia para neumonía complicada.
TMP/SMX 10 mg/kg/día VO cada 12 horas Tratamiento IPTB e IOA por SAMR.
Rifampicina 15 mg/kg/día VO cada 24 horas Uso en biofilm o elementos protésicos.
AUC: área bajo la curva; IOA: infección osteoarticular; IPTB: infección de piel y tejidos blandos; IV: intravenoso; MIC: concentración mínima inhibitoria; VO: vía oral.
Adaptada de: Avedissian SN, et al. Expert Rev Anti Infect Ther. 2021;19(9):1107-116.
LECTURAS RECOMENDADAS
3. Matsumoto K, Oda K, Shoji K, Hanai Y, Takahashi Y, Fujii S, et al. Clinical Practice Guidelines for Therapeutic Drug Monitoring of Vancomycin in the Framework of Model-Informed Precision Dosing: A Consensus Review by the Japanese Society of Chemotherapy and the Japanese Society of Therapeutic Drug Monitoring. Pharmaceutics. 2022;14(3):489. doi: 10.3390/ pharmaceutics14030489.
Novel Therapeutic Strategies. Front Immunol. 2021;12:705360. doi: 10.3389/fimmu.2021.705360.
4. Rybak MJ, Le J, Lodise TP, Levine DP, Bradley JS, Liu C, et al. Executive Summary: Therapeutic Monitoring of Vancomycin for Serious Methicillin-Resistant
Volumen 22 Número 1 Precop SCP 43
Sebastián Camilo Medina Rivera, Freddi Giovanni Soto
1. Campbell AJ, Dotel R, Braddick M, Britton PN, Eisen DP, Francis JR, et al. Clindamycin adjunctive therapy for severe Staphylococcus aureus treatment evaluation (CASSETTE)-an open-labelled pilot randomized controlled trial. JAC Antimicrob Resist. 2022;4(1):dlac014. doi: 10.1093/jacamr/dlac014.
2. Clegg J, Soldaini E, McLoughlin RM, Rittenhouse S, Bagnoli F, Phogat S. Staphylococcus aureus Vaccine Research and Development: The Past, Present and Future, Including
3. Dosis de antibióticos antiestafilocócicos
Manejo de las infecciones por StaphylococcuS aureuS en pediatría
Staphylococcus aureus Infections: A Revised Consensus Guideline and Review of the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, the Pediatric Infectious Diseases Society, and the Society of Infectious Diseases Pharmacists. Pharmacotherapy. 2020;40(4):363-367. doi: 10.1002/phar.2376.
5. Sharma R, Hammerschlag MR. Treatment of MethicillinResistant Staphylococcus aureus (MRSA) Infections in
Children: a Reappraisal of Vancomycin. Curr Infect Dis Rep. 2019;21(10):37. doi: 10.1007/s11908-019-0695-4.
6. Sharma R, Francois D, Hammerschlag MR. New Antimicrobial Agents for the Treatment of Staphylococcal Infections in Children. Pediatr Clin North Am. 2017;64(6):1369-387. doi: 10.1016/j.pcl.2017.08.005.
Volumen 22 Número 1 Precop SCP 44
Abordaje del paciente pediátrico en contacto con tuberculosis
INTRODUCCIÓN
La tuberculosis (TB) es una enfermedad infecciosa causada por bacterias del complejo Mycobacterium tuberculosis o bacilo de Koch, la cual es más frecuente en algunas regiones del mundo. Colombia se considera un país de prevalencia media para esta infección, con una incidencia de 25 casos por cada 100 000 habitantes para 2021, y muestra un aumento con respecto a lo reportado en 2020 (21 casos por cada 100 000 habitantes).
El complejo M. tuberculosis comprende al menos 9 especies de micobacterias íntimamente relacionadas: M. tuberculosis, M. bovis, M. africanum, M. microti, M. canetti, M. caprae y M. pinnipedii, que son causantes de enfermedad en humanos, y Mycobacterium orygis y Mycobacterium mungi solo reportadas en animales. Este microrganismo es un bacilo curvo, débilmente grampositivo, aerobio estricto, de una longitud de 2-4 μm. La transmisión se produce de persona a persona a través de gotas con moco transportadas por el aire.
Existen factores de riesgo para la adquisición de la enfermedad tuberculosa como el contacto de niños con adultos de alto riesgo, convivir en países con una prevalencia elevada, el hacinamiento, el uso de sustancias psicoactivas endovenosas y trabajadores sanitarios que atienden población de alto riesgo. La progresión de la TB latente a enfermedad tuberculosa es más probable en niños menores de 5 años, sobre todo menores de 2 años, y en personas con coinfección por virus de la inmunodeficiencia humana (VIH) u otros tipos de inmunosupresión.
En Colombia contamos con la resolución 227 de 2020, en la cual se da el lineamiento técnico para el manejo de la TB en el país. En niños, el riesgo de progresión a enfermedad tuberculosa es mucho mayor que en los adultos, por lo que el contacto de los niños con un adulto diagnosticado con TB plantea retos adicionales en el abordaje diagnóstico y en la instauración de medidas de profilaxis para prevenir la infección activa.
Volumen 22 Número 1 Precop SCP 45
1. Pediatra infectólogo, Clínica Infantil Colsubsidio, Clínica Infantil Santa María del Lago, Méderi
2. Residente de Pediatría, Fundación Universitaria Sanitas
Juan Pablo Londoño Ruiz1
Juan José Nofal Ladino2
EPIDEMIOLOGÍA
La Organización Mundial de la Salud (OMS) calculó que, para el 2022, 9,9 millones de personas enfermaron de TB a nivel mundial, con un aproximado de 1,5 millones de muertes, de las cuales 214 000 tenían VIH. En América Latina, en 2020 se estimaron 291 000 casos de TB, con un total de muertes calculadas para la región de 27 000, de las cuales el 29 % (7900) corresponde a la coinfección por TB/VIH.
Para Colombia, la incidencia de TB para el 2022 fue de 6,35 por cada 100 000 personas y, de estas, 5,4 (85,19 %) corresponden a TB pulmonar y 0,95 (14,81 %) a presentaciones extrapulmonares. Esto refleja un aumento del 13,36 % del total de casos respecto al período epidemiológico del 2021.
La presentación de TB tiene mayor frecuencia en varones (8,46 por cada 100.000 habitantes) que en mujeres (4,34 por cada 100.000 habitantes). Dentro los factores de riesgo más importantes, se encontró la presencia de desnutrición en un 16%-71% y la coinfección con VIH en un 13,36 %.
En un estudio publicado en 2020 que buscó los predictores de infección latente en los pacientes que fueron contacto estrecho con un caso índice de TB, se documentó que el 46 % (1390/3040) de los contactos presentaban TB latente. El análisis multivariado mostró como factores de riesgo para desarrollar TB latente luego del contacto con el paciente con TB la exposición a casos índice mayores de 5 años, con baciloscopia positiva, compartir la misma habitación en la casa y la exposición a más de un paciente índice. La prevalencia de TB latente aumenta 8,2 % por cada 250 horas de exposición al caso índice.
FISIOPATOLOGÍA
El complejo primario de la TB incluye la infección local en la puerta de entrada y los
ganglios linfáticos regionales que drenan al área correspondiente. En el 98 % de los casos la puerta de entrada será el pulmón. Al toser se generan aerosoles con pequeñas partículas líquidas llamadas gotas de Flügge, en cuyo interior se encuentran los bacilos tuberculosos.
Estas gotas, al evaporarse, dejan el núcleo del bacilo que tiene la capacidad de flotar en el medio ambiente y ser desplazado por el aire, lo cual favorece la aspiración por otras personas. De este modo, las partículas que midan entre 1 y 5 μm tendrán la capacidad de llegar hasta los alveolos y desencadenar la primoinfección; mientras que las partículas con tamaños mayores, por lo general de 10 μm, podrán ser eliminadas por el sistema mucociliar. Otras vías de contagio como la digestiva por el contacto con leche de vaca, en este caso por M. bovis, se controlan gracias a procesos como la pasteurización.
Una vez ingresan los bacilos, estos llegan a los alveolos, donde serán fagocitados y destruidos por los macrófagos. La respuesta a M. tuberculosis en los alveolos desencadena la respuesta inflamatoria a nivel tisular conocida como primoinfección tuberculosa. En principio, se genera una alveolitis exudativa donde los macrófagos eliminan inicialmente a la micobacteria y en caso de infecciones no masivas la infección se controla de manera local. Para controlar este foco, se forman granulomas compuestos de macrófagos, células dendríticas, linfocitos y células epiteliales, lo que se conoce como infección latente.
Cuando la infección se propaga al sistema linfático intrapulmonar, paratraqueal o mediastínico, se conoce como complejo bipolar (secundario). En esta fase es habitual que se produzcan diseminaciones bacilares por vía hematógena a los segmentos apicales pulmonares, riñones, hígado y huesos, y son controladas localmente. El sistema inmunológico celular inicia su respuesta alrededor de las semanas 2 a 10 posteriores a la infección inicial, los macrófagos reconocen los antígenos del bacilo y los presentan
Abordaje del paciente pediátrico en contacto con tuberculosis Volumen 22 Número 1 Precop SCP 46
a los linfocitos T, que mediante la liberación de mediadores proinflamatorios fomentan la transformación de una cantidad determinada de macrófagos en células especializadas (células epiteliales y gigantes de Langerhans).
Este conjunto de células rodea e intenta destruir los bacilos, creando el granuloma tuberculoso, el cual con el tiempo dejar á el núcleo de necrosis caseosa característico. En la mayoría de los casos, la activación del sistema inmunológico controlar á la infección, dejando una cicatriz fibrosa que generalmente se calcificará.
En la mayoría de las ocasiones, la respuesta inmunológica controlará la infección. Solo un pequeño porcentaje de las personas infectadas (aproximadamente el 10 % de los adultos sanos) llegará a desarrollar la enfermedad tuberculosa en algún momento de su vida. En este contexto, la primoinfección usualmente es asintomática y no es usual que deje secuelas detectables a nivel imagenológico, pero sí en la memoria inmunológica, la cual se manifiesta con la prueba de la tuberculina o en los ensayos de liberación de interferón, los que permitirán diferenciar a los individuos infectados de los no infectados. De esta manera, la respuesta individual determinar á tres posibles contextos: exposición sin infección, infección sin enfermedad y la enfermedad activa.
La forma secundaria de la enfermedad se debe a una reinfección exógena pese al relativo grado de inmunidad del sujeto infectado. Sin embargo, lo más común es la reinfección endógena por micobacterias latentes. Estas formas son más comunes en el adulto (Figura 1).
Se estima que solo el 30 % de las personas expuestas resultan infectadas y, de estas, el 90 % controlan la infección, aunque se han descrito infecciones tras solo 15-20 minutos de exposición ocasional a individuos altamente bacilíferos.
En otros sujetos esta respuesta es inadecuada y el bacilo continúa multiplicándose dentro del macrófago, se extiende por el intersticio pulmonar hasta los ganglios linfáticos regionales, hiliares y mediastínicos, y activa una respuesta inmunológica adaptativa en el foco de infección, en el curso de semanas, en la que es esencial el papel de los linfocitos B y, sobre todo, de los linfocitos T CD4+ y CD8+ con producción de interferón gamma (IFN-γ).
En la mayoría de las ocasiones, estos granulomas son suficientes para controlar, pero no para eliminar, la carga bacilar que puede persistir en este microambiente durante décadas. Esto se considera una infección por TB. En algunos casos, especialmente en niños pequeños e inmunosuprimidos, la inmunidad adaptativa es insuficiente para controlar la infección y la micobacteria continúa replicándose y la infección progresa, lo que da lugar a enfermedad pulmonar o se disemina como enfermedad extrapulmonar, y esto produce una forma de TB conocida como primoinfección tuberculosa en los primeros meses luego del contagio.
A diferencia de los adultos, los niños excretan una menor cantidad de bacilos en las secreciones respiratorias. Los niños se infectan generalmente a través del contacto con un adulto infectado, no es usual que esto suceda a través del contacto con otro niño infectado. Sin embargo, la reactivación puede ocurrir en adolescentes y adultos jóvenes infectados en la primera infancia.
La historia natural de la infección se muestra en la Figura 2 .
POBLACIÓN VULNERABLE
Desde que la OMS declaró la epidemia de TB como emergencia de salud pública mundial, se han realizado múltiples acciones encaminadas
Volumen 22 Número 1 Precop SCP 47
Juan Pablo Londoño Ruiz, Juan José Nofal Ladino
M. tuberculosis
Figura 1. Fisiopatología de la infección por tuberculosis.
CPA
Célula T CD4
Activación de células T CD4 Expansión clonal IFN-γ estimulado por ESAT 6/CFP 10 IL-8 Linfocitos B

Neutrófilos IL-12
Productos reactivos del oxígeno
> Enzimas lisosomales * TNF o IL-1 > reclutamiento de linfocitos IL-12, IL-27
> Diferenciación Ty1, producción de IFN-γ > quimiocinas
> Expresión de coestimuladores B7
> Expresión de moléculas CMH
> IL-6
ADA
+ Lisozima, neopterina
a disminuir la carga global de enfermedad. En 2014 la OMS y la Organización Panamericana de la Salud (OPS) adoptaron la Estrategia Fin de la Tuberculosis, con el objetivo de poner fin a la epidemia en 2035. Esta estrategia busca dar prioridad a las necesidades y perspectivas de los grupos indígenas más vulnerables; establecer sistemas de prevención y control sostenibles a largo plazo a nivel regional, nacional y local, teniendo en cuenta las diferencias de sexo y raza, sin olvidar a las personas con discapacidad, niños, jóvenes y ancianos.
Los factores de riesgo descritos para la enfermedad tuberculosa son la pobreza extrema, la
desnutrición, el alcoholismo, el abuso de drogas, el hacinamiento y la calidad de la vivienda, la prevención del VIH, las infecciones de transmisión sexual, el consumo de tabaco, la diabetes y otras poblaciones indígenas. Aunque estos factores se encuentran concentrados en los grupos de riesgo descritos, la enfermedad sigue siendo un grave problema de salud pública a nivel mundial.
Existen varios factores de riesgo de progresión de TB latente a enfermedad tuberculosa activa, entre ellos niños menores de 5 años, personas con VIH, trasplantados, pacientes con uso de medicamentos dirigidos contra el factor
Abordaje
Volumen 22 Número 1 Precop SCP 48
del paciente pediátrico en contacto con tuberculosis
Adaptado de: Holmberg PJ, et al. Pediatr Rev. 2019;40(4):168-78.
IL-4 CPA Cth1 Activación IFN-γ IL-12 IFN-γ IFN-γ Opsonización Macrófago Activación de macrófagos
Manifestaciones
Sintomático Carga bacteriana en aumento
Asintomáticos o síntomas leves
Asintomáticos
Tuberculina o prueba de liberación de interferón → positivos Cultivos intermitentemente positivos Baciloscopia puede ser negativa
Hallazgos en radiografía de tórax
Cultivos positivos Baciloscopia positiva Hallazgos en radiografía de tórax
de necrosis tumoral (anti-TNF), pacientes en diálisis y pacientes con silicosis.
El riesgo de progresión de la TB latente a enfermedad tuberculosa varía con la edad, como se muestra en la Tabla 1. Observe que la enfermedad tiene dos picos de riesgo, uno en los menores de 2 años y otro en la adolescencia (10 a 15 años).
DIAGNÓSTICO
Tuberculina
Una vez se consolida la sospecha clínica, la tuberculina es un método útil para determinar la infección tuberculosa, su reacción está determinada por la capacidad del M. tuberculosis de producir hipersensibilidad
Volumen 22 Número 1 Precop SCP 49
Juan Pablo Londoño Ruiz, Juan José Nofal Ladino
Exposición Infección TB subclínica TB clínica
Estadio de la tuberculosis
Figura 2. Historia natural de la tuberculosis.
Adaptada de: Roya-Pabón CL et al. Pneumonia (Nathan). 2016;8:23.
Edad de infección primaria < 1 año 1-2 años 2-5 años 5-10 años 10-15 años Adultos Riesgo de enfermedad pulmonar (%) 30-40 10-20 5 2 10-20 5-10 Riesgo de enfermedad diseminada (%) 10-20 2-5 0,5 < 0,5 < 0,5 < 0,5
Tabla 1. Riesgo de enfermedad pulmonar y enfermedad diseminada por edad
Adaptada
de: Marais BJ et al. Int J Tuberc Lung Dis. 2004;8(3):278-85.
Abordaje del paciente pediátrico en contacto con tuberculosis
retardada a componentes específicos del bacilo. La reactividad tuberculínica aparece a las 2 a 12 semanas después de la infección inicial, con una mediana de intervalo de 3 a 4 semanas. Para su realización, se recomienda emplear la técnica de Mantoux, mediante la cual se debe realizar la inoculación intradérmica de 0,1 mL de derivado proteico purificado (PPD) con una aguja calibre 27 en la cara anterior del antebrazo, con lo cual se debe formar una pápula de aproximadamente 6 a 10 mm.
La reacción a la tuberculina debe ser interpretada 72 horas después de inoculada, momento en que se produce la máxima induración. Es importante que se evalúe exclusivamente la induración y el diámetro máximo de la misma y no el eritema, que puede ser mayor que la induración. Adicionalmente, es importante tener en cuenta que las vacunas de virus vivos atenuados (sarampión, rubeola, parotiditis, varicela, polio oral, fiebre amarilla y tifoidea oral) pueden producir anergia tuberculínica durante 4 a 6 semanas. En la Figura 3 se puede
ver una prueba tuberculínica positiva, con una induración marcada. Recuerde usar un elemento rígido para tomar la medición.
La interpretación de la tuberculina se debe realizar como se muestra en la Tabla 2
Una tuberculina negativa no excluye la enfermedad por TB. Los falsos negativos pueden estar justificados por:
• factores dependientes del huésped: corta edad, infección reciente, comorbilidad, vacunaciones y tratamientos que produzcan inmunosupresión y TB diseminada o con afectación de las serosas (miliar, meningitis); y
• factores relacionados con la técnica (administración y lectura defectuosas).
Ensayo de liberación de interferón gamma
Existen técnicas basadas en la medición de la producción de IFN-g por las células T sensibilizadas frente a M. tuberculosis, denominadas Interferon Gamma Release Assays (IGRA). El IGRA se basa en la medición de la producción del IFN-g por los linfocitos T obtenidos por punción periférica.
Existen dos pruebas comerciales en el momento:
• Prueba QuantiFERON ® -TB Gold en tubo (QFT-GIT)
• Prueba T–SPOT® para la TB (T–Spot)
El QFT-GIT se basa en una técnica de enzimunoanálisis de adsorción (ELISA) y reporta el resultado en unidades internacionales (UI) de interferón por mililitro. El T-Spot está basado en un ensayo por inmunoadsorción ligado a enzimas de puntos (ELISPOT) y mide la cantidad de células productoras de interferón.
Se ha demostrado la utilidad de las técnicas de IGRA en el diagnóstico de la tuberculosis latente en el grupo de contactos de un caso de
Volumen 22 Número 1 Precop SCP 50
Figura 3. Prueba tuberculínica positiva. Observe que la induración es más pequeña que el eritema.
Foto cortesía del Dr. Juan Pablo Londoño, infectólogo pediatra, de un paciente atendido en la Clínica Infantil Colsubsidio.
Resultado
Induración menor de 5 mm Cualquier grupo
Induración mayor o igual a 5 mm
Poblaciones
Interpretación
Negativa
Induración mayor o igual a 10 mm
- Conversión de PPD previamente negativa
- Niños con desnutrición grave, marasmo o Kwashiorkor
- Personas con VIH
- Persona con contacto reciente con un caso de TB
- Presencia de alteraciones radiológicas
- Inmunosupresión o uso de tratamientos inmunosupresores
- Niños que pertenezcan a los grupos previos
- Inmunocompetentes
- Trabajadores de la salud
Positiva
Positiva
Tomado de: Ministerio de Salud y Protección Social Colombia. Resolución 227 de 2020, por medio de la cual se adoptan los lineamientos técnicos y operativos del Programa Nacional de Prevención y Control de la Tuberculosis - PNPCT y se dictan otras disposiciones; 2020.
TB bacilífera, con una sensibilidad y especificidad superiores al 80 % en el diagnóstico de infección tuberculosa, tanto en adultos como en niños. Tienen mayor especificidad que la tuberculina, ya que su resultado no se ve afectado por la vacunación con bacilo de Calmette-Guérin (BCG) ni por infecciones por micobacterias no tuberculosas. Además, la repetición del análisis no provoca efecto booster, lo que incrementa la utilidad de las IGRA en el diagnóstico de TB latente en pacientes vacunados con BCG.
Las técnicas IGRA ayudan en el diagnóstico de enfermedad en los casos difíciles, como en pacientes inmunodeprimidos y con TB extrapulmonar (TB miliar y meníngea). Tienen el beneficio adicional de solo requerir una visita para su medición. Se observan falsos negativos en niños pequeños con enfermedad tuberculosa, en los que se pueden encontrar pruebas indeterminadas y en casos de infección latente con exposición muy antigua.
No existen estudios que muestren un beneficio de una prueba sobre la otra para uso universal. Por la disponibilidad de la prueba y el menor costo, el uso de tuberculina en nuestro medio
es mucho más frecuente. En la Tabla 3 se pueden observar las ventajas y desventajas de cada una de las pruebas. Ninguna de las pruebas permite diferenciar entre la infección latente y la enfermedad activa.
Barata Mayor precio
Mayor accesibilidad
Baja especificidad en algunas situaciones: BCG, infecciones por micobacterias no tuberculosas
Menor accesibilidad
Alta especificidad
Útil en pacientes inmunocomprometidos
Dos visitas Una visita
Dificultad en la lectura: se requiere personal bien entrenado
Baja variabilidad en la interpretación de los resultados
Adaptada de: Gautam M. En: Clinical Tuberculosis: A Practical Handbook; 2015. p. 139-56.
Volumen 22 Número 1 Precop SCP 51
Juan Pablo Londoño Ruiz, Juan José Nofal Ladino
Tabla 3. Comparación entre tuberculina e IGRA
Tuberculina IGRA
Tabla 2. Interpretación de la prueba de tuberculina (PPD)
DIAGNÓSTICO MICROBIOLÓGICO PARA ENFERMEDAD ACTIVA
La confirmación bacteriológica mediante el aislamiento del M. tuberculosis en cultivo es considerada como el patrón de oro del diagnóstico, pero es difícil de conseguir en niños y el resultado requiere varias semanas. Su sensibilidad es baja y depende de la forma de presentación de la enfermedad y del tipo de muestra.
A excepción de los niños mayores y adolescentes que puedan expectorar, tradicionalmente se recogen aspirados gástricos en 3 días consecutivos, a primera hora de la mañana, en ayunas y con el niño ingresado, aunque no parecen existir diferencias significativas cuando se toman de forma ambulatoria. La sensibilidad del cultivo varía entre el 30 % y 40 %.
En Colombia, la prueba de detección molecular es el método de elección con resultados obtenidos en 2 horas. La reacción en cadena de la polimerasa (PCR) realiza la detección de componentes específicos del ácido desoxirribonucleico (ADN) del complejo M. tuberculosis, además de la determinación de sensibilidad a fármacos antituberculosos (perfil de resistencia a rifampicina, isoniazida u otros fármacos) con una especificidad del 98 % y una sensibilidad del 68 %-88 %. Este método es especialmente efectivo para personas previamente tratadas, seropositivos para VIH, inmunosuprimidos, niños menores de 15 años y población vulnerable o grupos de riesgo.
El objetivo no es revisar a profundidad las pruebas que permiten el diagnóstico de la TB activa en niños, pero se debe tener presente que siempre que se desee descartar esta, se deben realizar tanto pruebas moleculares como cultivo.
ENFOQUE DIAGNÓSTICO
Se deben tener en cuenta las siguientes definiciones:
• Profilaxis: uso de un medicamento (usualmente isoniazida) posterior al contacto con un caso de TB, mientras se cumple la ventana inmunológica y se define si se suspende o se inicia tratamiento para TB latente.
• Tratamiento de TB latente: uso de un medicamento (usualmente isoniazida), con el objetivo de tratar la infección tuberculosa y prevenir la progresión a enfermedad sintomática.
• Tratamiento de TB sintomática: uso de terapia combinada (usualmente cuatro medicamentos) para tratar la enfermedad tuberculosa.
Un caso positivo de TB en un niño siempre es un caso centinela, por lo que se debe buscar activamente el adulto fuente.
Para el estudio del paciente pediátrico que es contacto con un adulto diagnosticado con TB, se debe tener en cuenta si se trata de un paciente sintomático o asintomático (Figura 4).
En los pacientes sintomáticos se debe descartar enfermedad activa usando el algoritmo de la resolución, se solicita radiografía de tórax, PPD, cultivo en medio líquido y PCR para M. tuberculosis. Con respecto a las baciloscopias, no están incluidas en el estudio de enfermedad activa si se realiza prueba molecular; sin embargo, sigue siendo una herramienta muy útil en los escenarios de difícil acceso de la prueba molecular y como diagnóstico diferencial de nocardiosis pulmonar y de otras micobacterias no tuberculosas.
En los pacientes asintomáticos se debe realizar PPD o IGRA (los autores de este texto recomiendan utilizar como primera medida PPD en la mayoría de los casos; el uso de IGRA, dado su baja disponibilidad y su costo, se debe reservar para situaciones muy particulares) y una radiografía de tórax. No se solicitan cultivos o PCR para M. tuberculosis en este escenario. En estos pacientes, si no hay sospecha de enfermedad tuberculosa activa, se
Abordaje
Volumen 22 Número 1 Precop SCP 52
del paciente pediátrico en contacto con tuberculosis
Niños menores de 5 años con contacto estrecho con paciente con tuberculosis
Realice tamizaje clínico para descartar TB activa: tos con o sin expectoración > 14 días, fiebre > 8 días, pérdida o no ganancia de peso, disminución del nivel de actividad o juego
Ninguna
Realice PPD y Rx de tórax
Uno o más
Investigue enfermedad tuberculosa
PPD > 5 mm y Rx normal
Tratamiento de infección latente
PPD < 5 mm y Rx normal
Inmunosupresión
PPD positiva o negativa y Rx anormal
Investigue enfermedad tuberculosa
Sí No
Trate la infección latente durante 6 meses*
Trate la infección latente por 3 meses y repita la PPD
PPD ≥ 5 mm a los 3 meses y asintomático
Continúe el tratamiento de TB latente por 6 meses
* Debe descartar infección activa y asegurarse de que no haya recibido tratamiento para TB activa ni latente antes.
PPD < 5 mm a los 3 meses y asintomático
Suspender el tratamiento de TB latente
Adaptado de: Ministerio de Salud y Protección Social Colombia. Resolución 227 de 2020, por medio de la cual se adoptan los lineamientos técnicos y operativos del Programa Nacional de Prevención y Control de la Tuberculosis - PNPCT y se dictan otras disposiciones; 2020.
debe iniciar profilaxis con isoniazida y según los resultados de las pruebas se definirá si se completan los 6 meses de la profilaxis (infección latente confirmada) o si se repite la PPD a los 3 meses (tiempo que toma en positivizarse la PPD luego del contacto de riesgo) para definir la suspensión o la continuación del tratamiento para TB latente.
En los niños mayores de 5 años, el uso de profilaxis o de tratamiento para TB latente no se encuentra ampliamente estudiado en la literatura. El libro operacional de la TB publicado por la OMS en 2022 tiene como recomendación condicional el uso de profilaxis en todos los mayores de 5 años que son contactos con adultos bacilíferos. Colombia no ha emitido una
Juan
Londoño
Volumen 22 Número 1 Precop SCP 53
Pablo
Ruiz, Juan José Nofal Ladino
Figura 4. Algoritmo de diagnóstico y tratamiento para pacientes menores de 5 años en contacto con tuberculosis.
recomendación formal sobre esta población aún. Los autores consideran que los niños mayores de 5 años en contacto con un adulto bacilífero, sin factores de riesgo adicionales para progresión a enfermedad tuberculosa activa, deben ser estudiados con radiografía de tórax y PPD. Incluso ante la confirmación de infección tuberculosa latente, al tener un menor riesgo de progresión, pueden ser seguidos clínicamente sin la indicación estricta de profilaxis, a diferencia de los niños menores a esta edad. Se debe esperar una discusión más amplia y estudios adicionales que permitan aclarar este punto.
PROFILAXIS Y ESQUEMAS
Tratamiento para niños con infección latente por tuberculosis (profilaxis posexposición)
El tratamiento de la infección latente por TB es un balance entre el beneficio (esquemas actuales con efectividad del 60 %-90 %) de prevenir la progresión a enfermedad activa y el riesgo de los efectos adversos derivados de la terapia.
En las poblaciones de riesgo, este beneficio supera ampliamente los riesgos.
Se recomienda tratar a los niños de poblaciones de riesgo (menores de 5 años y con las comorbilidades descritas) con infección tuberculosa latente para prevenir el desarrollo de la TB. Se debe prestar especial atención a los lactantes, niños pequeños y niños inmunocomprometidos con infección latente por TB o niños que han estado en contacto cercano con una persona con enfermedad de TB, ya que tienen un mayor riesgo de contraer la enfermedad.
Existen varias opciones de tratamiento en este escenario, los cuales se describen en la Tabla 4.
El esquema preferido para el tratamiento de TB latente en Colombia es el de isoniazida por 6 meses, el medicamento se encuentra disponible en presentación de tabletas de 100 y 300 mg, también es posible utilizar preparaciones magistrales en los niños más pequeños ( Tabla 5). El uso de esquemas con rifampicina o rifapentina se deben utilizar con precaución en niños que viven con VIH por el alto riesgo de interacciones con la terapia antirretroviral.
Rifapentina dependiente de la dosis de peso:
- 10-14 kg: 300 mg
- 14-25 kg: 450 mg
- 25,1-32 kg: 600 mg
- 32,1-50 kg: 750 mg
- > 50 kg: 900 mg
*Esquema preferido en Colombia para pacientes sin VIH. **Esquema preferido en Colombia para pacientes con VIH.
Adaptado de: WHO operational handbook on tuberculosis. Module 3: Diagnosis. Rapid diagnotics for tuberculosis detection. World Health Organization; 2021.
Volumen 22 Número 1 Precop SCP 54
Abordaje del paciente pediátrico en contacto con tuberculosis
Medicamento Dosis Dosis máxima Tiempo de duración Isoniazida* - 10 mg/kg/día 300 mg/día 6 o 9 meses Isoniazida + rifapentina semanal** Isoniazida - > 12 años: 15 mg/kg/dosis
< 12 años:
mg/kg/dosis 900 mg/semana 3 meses (12 dosis)
Tabla 4. Esquemas de tratamiento de la infección tuberculosa latente
-
25
900 mg/semana Isoniazida + Rifampicina - 10 mg/kg/día - 15 mg/kg/día 300 mg/día 600 mg/día 3 meses
Tabla 5. Dosificación de isoniazida por peso
Adaptado de: WHO operational handbook on tuberculosis. Module 3: Diagnosis. Rapid diagnotics for tuberculosis detection. World Health Organization; 2021.
LECTURAS RECOMENDADAS
1. Carvalho I, Goletti D, Manga S, Silva DR, Manissero D, Migliori G. Managing latent tuberculosis infection and tuberculosis in children. Pulmonology. 2018;24(2):106114. doi: 10.1016/j.rppnen.2017.10.007.
2. Comportamiento de la Vigilancia de Tuberculosis, Colombia. Bol epidemiol Sem. 2022;11:1–31.
3. Fitzgerald DW, Sterling TR. Mycobacterium tuberculosis. En: Mandell, Douglas y Bennett Enfermedades infecciosas Principios y práctica. 9. a edición. España: Elsevier; 2022. p. 2985-3021.
4. Gautam M. Latent tuberculosis infection. Clin Tuberc A Pract Handb. 2015;(February):139–56. Gautam M. Latent tuberculosis infection. En: Clinical Tuberculosis: A Practical Handbook; 2015. p. 139-56. Disponible en: https:// www.taylorfrancis.com/chapters/edit/10.1201/b2075512/latent-tuberculosis-infection-manish-gautam?context =ubx&refId=54ab3600-c6d9-44d4-864c-88be47259605
5. Global tuberculosis report 2021. World Health Organization; 2021.
6. Gomez-Pastrana D. Tuberculosis in children - Is PCR the diagnostic solution? Clin Microbiol Infect. 2002;8(9):541–4. doi: 10.1046/j.1469-0691.2002.00428.x.
7. Holmberg PJ, Temesgen Z, Banerjee R. Tuberculosis in Children. Pediatr Rev. 2019;40(4):168-178. doi: 10.1542/ pir.2018-0093.
8. Jaganath D, Beaudry J, Salazar-Austin N. Tuberculosis in Children. Infect Dis Clin North Am. 2022;36(1):49-71. doi: 10.1016/j.idc.2021.11.008.
9. Jones UM, David T, Jenkins R. Tuberculosis screening update. Nursing (Lond). 2020;50(8):12–5. doi: 10.1097/01.NURSE.0000684244.35254.46.
10. Lozano JA. Tuberculosis. Patogenia, diagnóstico y tratamiento. Offarm. 2002;21(8):102–10.
11. Marais BJ, Gie RP, Schaaf HS, Beyers N, Donald PR, Starke JR. Childhood pulmonary tuberculosis: Old wisdom and new challenges. Am J Respir Crit Care Med. 2006;173(10):1078–90.
12. Marais BJ, Gie RP, Schaaf HS, Hesseling AC, Obihara CC, Nelson LJ, et al. The clinical epidemiology of childhood pulmonary tuberculosis: a critical review of literature from the pre-chemotherapy era. Int J Tuberc Lung Dis. 2004;8(3):278–85.
13. Méndez Echevarría A, Baquero-Artigao F, La Paz Madrid H. Tuberculosis pulmonar. Pediatr Integr. 2016;20(2):109–18.
14. Muñoz Villanueva PI. Situación de la tuberculosis en población vulnerable. Rev Nac (Itauguá). 2021;13(1):1–3. doi: 10.18004/rdn2021.jun.01.001.003.
15. Piskur Z, Mykolyshyn L. Comorbidities at the tuberculosis among children. Wiad Lek. 2021;74(10):2433–8.
16. Ravimohan S, Kornfeld H, Weissman D, Bisson GP. Tuberculosis and lung damage: from epidemiology to pathophysiology. Eur Respir Rev. 2018;27(147):170077. doi: 10.1183/16000617.0077-2017.
Ladino Volumen 22 Número 1 Precop SCP 55
Juan Pablo Londoño Ruiz, Juan José Nofal
Peso 4-8 kg 8-12 kg 12-16 kg 16-25 kg > 25 kg Tableta de 100 mg 0,5 1 1,5 2 3 (o tableta de 300 mg)
Abordaje del paciente pediátrico en contacto con tuberculosis
17. Reichler MR, Khan A, Yuan Y, Chen B, McAuley J, Mangura B, et al. Duration of Exposure Among Close Contacts of Patients With Infectious Tuberculosis and Risk of Latent Tuberculosis Infection. Clin Infect Dis. 2020;71(7):1627-1634. doi: 10.1093/cid/ciz1044.
18. Resolución 227 de 2020, por medio de la cual se adoptan los lineamientos técnicos y operativos del Programa Nacional de Prevención y Control de la Tuberculosis - PNPCT y se dictan otras disposiciones. Ministerio de Salud y Protección Social Colombia; 2020.
19. Rodriguez-Takeuchi SY, Renjifo ME, Medina FJ. Extrapulmonary Tuberculosis: Pathophysiology and Imaging
Findings. Radiographics. 2019;39(7):2023-2037. doi: 10.1148/rg.2019190109.
20. Roya-Pabón CL, Perez-Velez CM. Tuberculosis exposure, infection and disease in children: a systematic diagnostic approach. Pneumonia (Nathan). 2016;8:23. doi: 10.1186/s41479-016-0023-9.
21. Singh V, Kabra SK. Advances in Tuberculosis: Diagnostics. Indian J Pediatr. 2019;86(5):439–40. doi: 10.1007/ s12098-019-02942-3.
22. WHO operational handbook on tuberculosis. Module 3: Diagnosis. Rapid diagnotics for tuberculosis detection. World Health Organization; 2021.
Volumen 22 Número 1 Precop SCP 56
EXAMEN CONSULTADO
1. La fiebre sin foco se define como:
a. Fiebre de menos de 5 días, sin una etiología luego de una historia clínica y una exploración física exhaustiva y minuciosa.
b. Fiebre que dura más de 5 días sin una etiología clara al interrogatorio.
c. Fiebre que dura una semana y no tiene foco luego de una exploración física exhaustiva.
d. Fiebre secundaria a una IBPG.
2. La bacteriemia oculta se define como:
a. Identificación de un patógeno bacteriano en un líquido diferente a la sangre.
b. Identificación de un patógeno bacteriano en cualquier muestra de sitio estéril en un paciente con fiebre sin foco.
c. Identificación en sangre de un patógeno bacteriano en un paciente con fiebre sin foco.
d. Identificación de un patógeno viral o bacteriano en un paciente con fiebre.
3. Entre los factores independientes de riesgo de IBG en menores de 3 meses se encuentran:
a. Lactante menor sano con esquema de vacunación completo.
b. Menores de 1 mes, enfermedades de base como anemia de células falciformes o cardiopatías.
c. Antibioterapia el mes previo a la consulta.
d. Uso de dispositivos médicos temporales.
4. El tratamiento del lactante febril debe estar orientado al:
a. Manejo integral con el fin de mejorar el estado general y controlar la infección.
b. Uso de medidas generales farmacológicas y no farmacológicas para controlar solo la fiebre.
c. Manejo antibiótico inmediato disponible sin tener en cuenta los posibles gérmenes.
d. Uso de antibióticos a pesar de tener cultivos negativos.
5. Un paciente de 10 años presenta un cuadro de 3 días de evolución consistente en dolor, eritema y rubor en el párpado derecho asociado a fiebre y malestar general. En el examen físico no es posible evaluar el globo ocular. ¿Cuál es su diagnóstico y conducta a seguir?
a. Celulitis periorbitaria, inicio antibiótico endovenoso de primera línea, analgesia y, cuando disminuya el edema, se examina nuevamente.
b. Sospecha de celulitis orbitaria, inicio antibiótico endovenoso de primera línea y solicitud de TAC contrastada de senos paranasales.
c. Celulitis orbitaria, inicio antibiótico oral, se da el alta con signos de alarma.
d. Celulitis orbitaria, inicio antibiótico de primera línea endovenoso y solicitud de interconsulta a cirugía pediátrica.
6. Un paciente de 4 años con un esquema de vacunación completo, con antecedente de viaje reciente y con múltiples picaduras de insecto en el rostro desarrolla posteriormente celulitis periorbitaria. ¿Cuál cree usted que es el principal agente etiológico?
a. S. aureus.
b. H. influenzae.
c. S. pneumoniae.
d. M. catarrhalis.
7. ¿Cuál es el agente principal asociado a celulitis orbitaria en neonatos?
a. S. aureus.
b. H. influenzae.
c. S. pneumoniae.
d. M. catarrhalis.
8. ¿Cuál de las siguientes es causa de ingreso a hospitalización para manejo antibiótico endovenoso?
a. Celulitis periorbitaria leve.
b. Paciente que tolera la vía oral, viven cerca al hospital.
c. Fiebre.
d. Movilidad ocular dolorosa.
9. La toxina pertúsica causa los siguientes efectos sistémicos excepto:
a. Hiperinsulinismo.
b. Hiperleucocitosis.
c. Convulsiones.
d. Hipoglicemia.
e. Hiperviscosidad sanguínea.
10. Durante la fase paroxística del cuadro clásico de tosferina no complicada esperamos encontrar:
a. Episodios paroxísticos, estridor espiratorio, cianosis y vómito postusivo.
b. Dificultad respiratoria marcada, convulsiones por hipoxia, fracturas costales.
c. Falla multiorgánica, disfunción ventricular derecha, hipertensión arterial pulmonar grave.
d. Síntomas nasales con coriza, rinorrea y alzas térmicas.
11. Un paciente lactante de 40 días de vida presenta un cuadro clínico de una semana de evolución que inicia como un cuadro gripal, ahora con tos cianosante, evento de apnea y alteración del estado de conciencia. Usted notifica el caso probable de tosferina. Para confirmar el diagnóstico en este paciente, el método de elección que usted solicitaría en este momento sería:
a. PCR de muestra nasofaríngea obtenida por escobillón.
b. Hemograma y radiografía de tórax.
c. Serología pareada.
d. PCR y cultivo de muestra tomada por aspirado nasofaríngeo.
12. La estrategia de prevención más efectiva para prevenir la tosferina en los neonatos consiste en:
a. Vacunación a la madre gestante en el primer trimestre del embarazo.
b. Vacunación al recién nacido.
c. Vacunación a la madre gestante después de la semana 26 con Tdap.
d. Vacunación del personal de salud que atiende el parto.
13. ¿Cuál de las siguientes opciones corresponde a un factor de resistencia del S. aureus?
a. Resistencia a los transposones.
b. Desarrollo de bombas de eflujo.
c. Cambio en las proteínas de unión PBP2a.
d. Enzimas antiglucopéptidos.
14. ¿Cuál de las siguientes afirmaciones sobre la estafiloenterotoxicosis es cierta?
a. Tiene una duración de una semana en promedio.
b. Tiene un período de incubación de menos de 8 horas.
c. Es producida por la invasión directa del S. aureus en la vellosidad intestinal.
d. Es producto de la TSST-1.
15. ¿Cuál de las siguientes opciones NO corresponde a un factor de riesgo para bacteriemia por S. aureus?
a. Dispositivos endovasculares.
b. Eczema.
c. Inmunodeficiencias.
d. Colonización.
16. ¿Cuál de las siguientes entidades permite tratamiento oral?
a. Osteomielitis aguda.
b. Bacteriemia.
c. Endocarditis.
d. Infección de SNC por DVP.
17. Con respecto al uso de la tuberculina o PPD es cierto que:
a. Se debe administrar 0,1 mL subcutánea y leerla a las 48-72 horas.
b. Permite diferenciar entre TB latente y enfermedad activa.
c. Se debe interpretar como positiva si la induración es > a 5 mm si hay contacto estrecho con un paciente positivo.
d. Una PPD positiva indica enfermedad tuberculosa y se debe iniciar tratamiento mientras se espera el resultado de los cultivos.
18. Con respecto a los niños contactos con pacientes con TB es FALSO que:
a. Se les debe solicitar PPD y radiografía de tórax a todos los contactos.
b. En los pacientes de alto riesgo está indicada la profilaxis.
c. Se debe solicitar PPD, radiografía de tórax, baciloscopia, cultivo y PCR para M. tuberculosis a todos los contactos.
d. En los contactos sintomáticos se debe descartar la enfermedad activa antes del inicio de la profilaxis/tratamiento para TB latente.
19. Sergio es un niño de 4 años sin antecedentes de importancia. Su abuelo, Luis, que vive con él en la misma casa, es diagnosticado con TB pulmonar. Sergio es llevado a su consulta asintomático. Elija la opción de manejo:
a. Solicitar PPD y radiografía de tórax para revisarlos en siguiente consulta.
b. Solicitar PPD y radiografía de tórax, e indicar el inicio de isoniazida 10 mg/kg/día una vez se confirme que la radiografía de tórax es normal. Si la PPD es positiva, se debe continuar el manejo por 6 meses.
c. Solicitar PPD, radiografía de tórax, baciloscopias, cultivo y PCR para M. tuberculosis. Debe iniciar el manejo con isoniazida mientras espera los resultados. Si se confirma positivo, se debe iniciar tetraconjugado.
d. Solicitar PPD y radiografía de tórax. No tiene indicación de uso de isoniazida.
20. Cuál de los siguientes no es una opción de terapia para TB latente:
a. Isoniazida 10 mg/kg/día-dosis máxima 300 mg al día por 6 o 9 meses.
b. Isoniazida 15-25 mg/kg/día + rifapentina máximo 900 mg/día semanal por 3 meses.
c. Isoniazida 10 mg/kg/día + rifampicina máximo 600 mg/día + etambutol + pirazinamida.
d. Isoniazida 10 mg/kg/día + rifampicina 15 mg/kg/día por 3 meses.
Volumen 22 Número 1 Precop SCP 62 Volumen 21 Número 4 Clave de respuestas 1: B 2: C 3: D 4: C 5: A 6: D 7: A 8: C 9: D 10: C 11: A 12: C 13: A 14: C 15: D 16: C 17: D 18: B 19: B 20: C 21: A 22: B 23: C 24: D 25: B 26: C 27: A 28: B 29: A 30: E 31: D


Sociedad Colombiana de Pediatría www.scp.com.co
precop
Coordinación general e información
Calle 83 n.o 16A-44, Oficina 701
Edificio Cima. Bogotá, D.C.
Teléfonos: (1) 6495352 - 7464706/07
precop@scp.com.co







