Tos crónica en pediatría: aproximación diagnóstica y terapéutica
Asma cada vez más frecuente
Neumonía adquirida en la comunidad
Fibrosis quística
Importancia del sueño en pediatría
Curso continuo de actualización en Pediatría CCAP
Volumen 22 Número 2 Abril - Junio 2023
ISSN 2145-4590
Curso continuo de actualización en Pediatría CCAP
Volumen 22 Número 2
Abril - Junio 2023
Sociedad Colombiana de Pediatría
Junta Directiva Nacional 2022 - 2024
Presidente Vicepresidente
Secretario
Vocal
Vocal
Vocal
Vocal
Vocal
Vocal
Vocal
Fiscal
Vocal Representante de Capítulos
Expresidente
Dr. Mauricio Javier Guerrero Román
Dra. Eliana Zemanate Zúñiga
Dr. Alberto José Esmeral Ojeda
Dra. Claudia Patricia Beltrán Arroyave
Dr. Jerónimo Zuluaga Vargas
Dra. Ángela María Giraldo Mejía
Dr. Víctor Manuel Mora Bautista
Dra. Liliam María Macías Lara
Dr. Mauricio Hernández Cadena
Dra. Iliana Francineth Curiel Arizmendi
Dr. Iván Alejandro Villalobos Cano
Dra. Nury Isabel Mancilla Gómez
Dra. Marcela María Fama Pereira
Comité Editorial
Dra. Nelly Lecompte Beltrán Pediatra (Editora)
Dra. Eliana Zemanate Zúñiga Pediatra Intensivista
Dr. León Jairo Londoño Velásquez Pediatra (Editor Ejecutivo)
Dr. Jürg Niederbacher Velásquez Pediatra Neumólogo
Sociedad Colombiana de Pediatría www.scp.com.co
precop
Subdirección de Programas Dirigidos al Pediatra
Calle 83 n.o 16A-44, Oficina 701
Edificio Cima. Bogotá, D.C.
Teléfonos: (601) 6495352 - 7464706/07
precop@scp.com.co
Producción editorial Grupo Distribuna
Carrera 9 B # 117 A-05
Barrio Santa Bárbara Central
Bogotá, D.C., Colombia
Teléfonos: (571) 6202294 - 2158335
(571) 2132379
www.libreriamedica.com
Tos crónica en pediatría: aproximación diagnóstica y terapéutica
Pedro José Baquero Marín
Aura María Orozco
Bertha Inés Agudelo Vega
Ángela María Giraldo Mejía
Asma cada vez más frecuente
Jenny Jurado Hernández
Iván Francisco Álvarez Orozco
Neumonía adquirida en la comunidad
Mauricio Guerrero Román
Juan Pablo Rojas Hernández
Jesly Hael Doria Atencia
Fibrosis quística
Iván Stand, MD
Daniela Páez Jiménez, MD
María Rosa Vega, MD
Importancia del sueño en pediatría
Iván Francisco Álvarez Orozco
Sonia Restrepo Gualteros
Al final de los artículos encontrarán las preguntas del examen consultado sin sus respectivas respuestas, las cuales serán publicadas en el siguiente número.
Cada fascículo PRECOP está disponible de manera online y sus evaluaciones podrán ser resueltas por todos los profesionales de la salud a través de este medio, ingresando por: www.scp.com.co/precop.
Volumen 22 Número 2 Precop SCP 3
4
Contenido
12
49
28 40
Tos crónica en pediatría: aproximación diagnóstica y terapéutica
Aura María Orozco2
INTRODUCCIÓN
La tos representa una de las principales causas de ingreso, estudios de extensión y manejo en los servicios de urgencias. Su amplia relación con entidades clínicas de tipo infeccioso, así como parte fundamental del espectro clínico de condiciones reumatológicas, inmunitarias, oncológicas, entre otras, hace de este síntoma una entidad clínica que requiere un reconocimiento y atención detallada por parte del personal médico que atiende pacientes pediátricos con el objetivo de mejorar la atención y desenlaces derivados de su abordaje.
Teniendo en cuenta las múltiples etiologías en las cuales la tos podría ser su síntoma cardinal, la temporalidad adquiere un papel fundamental en el tiempo de atención y gestión de las potenciales causas que podrían explicar la presencia de tos. De esta manera, el Colegio Americano
de Médicos del Tórax (CHEST) ha definido una duración de tos mayor de cuatro semanas como el tiempo suficiente para definir la tos crónica con el objetivo de realizar un abordaje sistemático y oportuno de las potenciales entidades de mayor gravedad que tengan tos crónica dentro de su cuadro clínico.
Actualmente la tos crónica tiene una prevalencia estimada del 1 % al 3 %; sin embargo, gran parte de los pacientes no consulta por este síntoma, lo cual se traduce en un subregistro de los pacientes pediátricos con tos crónica. Pese a esto, algunos reportes han podido estimar una prevalencia de hasta el 25 %. Una revisión sistemática realizada por Anne y colaboradores encontró que el uso de protocolos de abordaje y algoritmos de manejo en la población pediátrica que cumple con la definición de tos crónica podría mejorar los resultados clínicos; por tanto, no se recomienda la utilización de
1. Programa de Especialización en Pediatría. Universidad Tecnológica de Pereira.
2. Programa de Especialización en Pediatría. Universidad Tecnológica de Pereira.
3. Neumóloga Pediatra, Clínica Comfamiliar. Pereira, Risaralda.
4. Pediatra Puericultora, Clínica Comfamiliar. Pereira, Risaralda.
Volumen 22 Número 2 Precop SCP 4
Pedro José Baquero Marín1
Bertha Inés Agudelo Vega3
Ángela María Giraldo Mejía4
terapias empíricas y el manejo debe diferir según la enfermedad asociada y el tratamiento de la causa subyacente que en algún momento podría impactar en los resultados clínicos del paciente (cuerpo extraño, bronquiectasias, fibrosis quística, neumonía crónica), por lo que es de suma importancia realizar un enfoque completo siguiendo las recomendaciones de la evidencia clínica actual.
PATOGENIA
La tos tiene una función refleja que puede prevenir los efectos nocivos de la aspiración del contenido gástrico hacia los pulmones y proteger el tracto respiratorio del riesgo de infecciones o factores irritantes. Implica una respuesta refleja a través de eventos secuenciales respiratorios, coordinados y sincronizados por una red neuromuscular compleja. Lo anterior se da gracias a dos vías aferentes vagales paralelas que se originan en los ganglios nodosos y yugulares, los cuales tienen neuronas quimiosensibles, principalmente sensibles a estímulos químicos y a la inflación pulmonar, su activación provoca la constricción de las vías respiratorias y la secreción de moco, tos y estornudos.
Se ha sugerido un “modelo de dos vías” de tos, en el que los receptores quimiosensibles yugulares inician la tos en las vías respiratorias proximales, mientras que la activación quimiosensorial nodosa en las vías respiratorias distales puede inhibir la tos. Los mecanorreceptores que se originan en los ganglios nodosos y son transportados por el nervio vago pueden superponerse con terminales quimiosensoriales yugulares en las vías respiratorias proximales. Por tanto, la laringe, la tráquea y los bronquios principales pueden ser activados por estímulos tanto mecánicos como químicos. Los nervios aferentes del reflejo de la tos transportan señales inducidas por estímulos, pero también generan respuestas complejas a nivel local y distal, como en el caso de la producción de
factores neurotróficos durante la inflamación viral y la inflamación que conduce a varios cambios neuronales, incluidos la modulación de la expresión génica en los ganglios vagales distales y cambios fenotípicos en el nervio aferente.
Aunque las vías y los procesos fisiológicos de la tos son los mismos en niños que en adultos, se reconocen algunas peculiaridades en los niños que deben ser tenidas en cuenta por el médico tratante para un abordaje adecuado de cada caso:
• Al finalizar el estímulo inicial hay una disminución gradual de la tos en niños, por lo que un enfoque terapéutico específico de la enfermedad tiene éxito en casi todos los casos de tos crónica.
• Existe una importante relación entre la tos crónica y los cambios estructurales y conformacionales de las vías aéreas, ya que a medida que crecen las vías respiratorias es necesaria una tráquea cada vez más rígida para evitar la deformación excesiva y un eventual colapso durante la espiración, cosa que no ocurre en la traqueomalacia, cuya marcada compresión dinámica de la tráquea afecta la eliminación eficiente de moco y produce la típica tos estridente.
• A diferencia de los adultos, los niños tienen mayor superficie de ocupación de glándulas mucosas en las vías respiratorias y, por tanto, mayor secreción de moco. Las vibraciones de las vías aéreas más grandes causan tos durante el flujo turbulento en la expiración, además de que se requiere la presencia de moco para una diferencia detectable en la calidad del sonido de la tos; es por eso que numerosos estudios han demostrado la utilidad de las características de la tos (húmeda o seca) para guiar el diagnóstico.
• El sistema nervioso central y periférico de los niños se encuentra en desarrollo, por lo que se plantea la hipótesis de que una lesión durante el desarrollo puede producir alteraciones de por vida en las conexiones nerviosas. Se cree que la inflamación y las
Volumen 22 Número 2 Precop SCP 5
Pedro José Baquero Marín, Aura María Orozco, Bertha Inés Agudelo Vega, Ángela María Giraldo Mejía
infecciones de las vías respiratorias durante los primeros años de vida pueden provocar cambios en la neurobiología de las vías respiratorias que pueden persistir hasta la edad adulta.
• Debido a la maduración de la inmunidad adquirida con la edad, la respuesta inmunológica experimenta una progresiva transformación a medida que el niño crece, por lo que la exposición de las vías respiratorias a agentes nocivos puede causar más daño en niños que en los adultos, lo cual puede conducir a una mayor vulnerabilidad a las infecciones asociadas a tos crónica.
MANIFESTACIONES CLÍNICAS
Además de la historia clínica y del examen físico, el enfoque de la tos crónica depende de las características de la tos, por lo que, de manera práctica, la tos pediátrica se ha dividido de la siguiente manera:
• Tos esperada: es un cuadro de tos asociado a infecciones virales comunes de las vías respiratorias superiores en niños, con una duración generalmente < 2 semanas y se puede prolongar por más tiempo en una pequeña minoría.
• Tos específica: generalmente se asocia a una enfermedad subyacente o que cursa con signos y síntomas de una enfermedad sistémica ( Tabla 1). Estos hallazgos indican una etiología de la tos crónica y la necesidad de más investigaciones que dependerán de los hallazgos clínicos. Los diagnósticos que se deben considerar incluyen bronquitis bacteriana persistente, bronquiectasias, cuerpo extraño, enfermedad pulmonar por aspiración, infecciones respiratorias atípicas, anomalías cardíacas y enfermedad pulmonar intersticial, entre otros. Adicionalmente, algunos niños pueden tener una tos reconocible o típica que sugiere una etiología específica ( Tabla 2).
• Tos inespecífica: se caracteriza por una tos seca o improductiva en ausencia de
indicadores específicos de tos con una radiografía de tórax y espirometría normales.
La tos específica se superpone con la tos inesperada, y esta se superpone con la tos esperada; por tanto, los niños con tos crónica deben ser reevaluados hasta que se encuentre un diagnóstico y, si es posible, se logre la resolución de la tos.
ENFOQUE DIAGNÓSTICO
La historia clínica y el examen físico constituyen las herramientas iniciales para el abordaje de un paciente con cumplimiento de la definición de caso para tos crónica. El interrogatorio como parte inicial del abordaje del paciente permite detectar los indicadores de tos crónica previamente mencionados, los cuales podrían estar asociados con alguna enfermedad primaria y tener una relación de causalidad con el síntoma presente.
Actualmente la disponibilidad de múltiples técnicas diagnósticas tales como estudios de función pulmonar, imágenes diagnósticas, pruebas de monitorización y diagnóstico invasivo han facilitado la detección y seguimiento de múltiples entidades clínicas dentro de la labor médica. Sin embargo, la sobreutilización de algunas de estas estrategias se traduce en algunos escenarios al aumento en la exposición innecesaria a radiación, dificultades para la realización del estudio teniendo en cuenta la edad de los pacientes a tratar, así como sobrecostos para el sistema de salud. Ante esta dificultad, entidades como el Colegio Americano de Médicos del Tórax (ACCP) y la Sociedad Respiratoria Europea (ERS) han dispuesto directrices para los profesionales de la salud con el objetivo de aumentar la precisión clínica al momento de solicitar algún tipo de prueba y el rendimiento de la mismas dentro del escenario clínico idóneo. En la Figura 1 se presenta una estrategia de abordaje sistematizado en los pacientes con tos crónica de acuerdo con las directrices actualmente disponibles.
Tos crónica en pediatría: aproximación diagnóstica y terapéutica Volumen 22 Número 2 Precop SCP 6
Tabla 1. Indicadores de tos específica*
Anomalía Ejemplos de patologías
Hallazgos auscultatorios Sibilancias: ver más abajo Crépitos: cualquier lesión de las vías respiratorias (por secreciones) o enfermedad del parénquima como la enfermedad intersticial
Anomalías cardíacas Anomalías asociadas de las vías respiratorias, insuficiencia cardíaca, arritmia
Dolor en el pecho Arritmia, asma
Ahogo Inhalación de cuerpo extraño
Disnea o taquipnea Cualquier enfermedad de las vías respiratorias o del parénquima pulmonar
Deformidad de la pared torácica
Cualquier enfermedad de las vías respiratorias o del parénquima pulmonar
Dedos en palillo de tambor Enfermedad pulmonar supurativa
Tos húmeda/productiva diaria Bronquitis bacteriana prolongada, enfermedad pulmonar supurativa, aspiración recurrente, infecciones atípicas, tuberculosis, panbronquitis difusa
Disnea de esfuerzo Cualquier enfermedad de las vías respiratorias o del parénquima pulmonar
Dolor facial/secreción nasal purulenta Sinusitis crónica, bronquitis bacteriana prolongada, discinesia ciliar primaria
Dificultad para la alimentación Cualquier enfermedad sistémica grave, incluida la enfermedad pulmonar, aspiración
Falta de crecimiento Cualquier enfermedad sistémica grave, incluida enfermedad pulmonar como la fibrosis quística
Voz ronca/estridor
Hemoptisis
Hipoxia/cianosis
Anomalías del neurodesarrollo
Problemas laríngeos, anomalías de las vías respiratorias
Enfermedad pulmonar supurativa, anomalías vasculares
Cualquier enfermedad de las vías respiratorias o del parénquima, enfermedad cardíaca
Neumonía aspirativa
Neumonía recurrente Inmunodeficiencia, infecciones atípicas, enfermedad pulmonar supurativa, anomalías pulmonares congénitas, fístulas traqueoesofágicas tipo H
Infecciones recurrentes Inmunodeficiencias
Antecedentes de enfermedad pulmonar o esofágica crónica (p. ej., enfermedad pulmonar neonatal, atresia esofágica)
Múltiples causas (p. ej., segunda fístula tipo H, bronquiectasias, aspiración, asma)
Sibilancias monofónicas Obstrucción de las vías respiratorias grandes (p. ej., por aspiración de un cuerpo extraño, malacia o estenosis, anillos vasculares, linfadenopatía y tumores mediastínicos)
La tuberculosis debe considerarse en entornos seleccionados (p. ej., alta prevalencia o VIH)
Sibilancias polifónicas Asma, bronquiolitis obliterante, bronquiolitis
*Dado que las causas de la tos crónica abarcan todo el espectro de la neumología pediátrica y las enfermedades extrapulmonares, esta lista describe los síntomas y signos más comunes y no es exhaustiva.
Modificado de: Chang AB et al. Chest. 2020;158(1):303-29.
Volumen 22 Número 2 Precop SCP 7
Pedro José Baquero Marín, Aura María Orozco, Bertha Inés Agudelo Vega, Ángela María Giraldo Mejía
Tabla 2. Tos reconocible en niños
Características de la tos Etiología subyacente sugerida
Tos metálica o tos perruna Crup, traqueomalacia, tos por costumbre
Tos productiva de yesos Bronquitis plástica
Tocando la bocina Psicógena
Paroxística Tosferina y Bordetella parapertussis
Staccato Clamidia en lactantes
Modificado de: Chang AB et al. Chest. 2020;158(1):303-29.
Adicionalmente, una vez se valora al paciente, es importante determinar las comorbilidades que pueden dificultar la resolución de la tos y que, una vez atendidas, podrían aumentar la probabilidad de mejoría clínica, como es el caso de asma inadecuadamente tratada, enfermedad por reflujo gastroesofágico, entre otras.
De forma concomitante con el abordaje clínico del paciente se deben examinar los estudios complementarios para el estudio de la tos
crónica, los cuales se describen con mayor detalle en la Tabla 3.
MANEJO
El manejo de la tos en la mayoría de los escenarios clínicos está relacionado con la búsqueda de brindar mayor comodidad al paciente y disminuir el factor estresante en los padres. A partir de esto se han implementado múltiples
Tabla 3. Estudios complementarios en el estudio de pacientes pediátricos con tos crónica
Tipo de estudio Evidencia Justificación
Tomografía computarizada de tórax
No se recomienda de rutina su realización
FENO No existe una recomendación clara para su utilización clínica
Monitorización de pH gástrico en 24 horas
Tomografía de senos paranasales, laringoscopia con fibra óptica, rinoscopia
La ausencia de síntomas dispépticos no justifica su realización clínica
No existe evidencia aun con compromiso nasal de su realización clínica
Entre 6,5 % y 58 % de los estudios realizados en algunas cohortes tienen hallazgos patológicos en contextos clínicos de tos crónica y radiografía de tórax normal sin encontrarse una relación específica de causalidad (ERJ).
Método no invasivo para determinar la concentración indirecta de eosinófilos disponibles en la vía aérea. Algunas cohortes han determinado pacientes con niveles de FENO bajo que no son respondedores a corticosteroides inhalados.
Los pacientes con tos crónica suelen tener algún grado de compromiso a nivel esofágico secundario del cambio de fuerzas por la repetición del evento, lo cual podría aumentar el riesgo de falsos positivos.
La cronicidad de la tos puede inducir cambios locales en la laringe; sin embargo, los cambios a nivel nasal no están directamente relacionados con la tos.
ERJ: European Respiratory Journal; FENO: fracción de óxido nítrico exhalado. Adaptada de: Morice AH et al. Eur Respir J. 2020;55(1):1901136.
Tos crónica en pediatría: aproximación diagnóstica
Volumen 22 Número 2 Precop SCP 8
y terapéutica
Dolor torácico
Disnea de esfuerzo
Hemoptisis
Hipocratismo digital Deformidad en la pared torácica Retraso del crecimiento Alteración del neurodesarrollo
Infección pulmonar recurrente Contacto con paciente sintomático respiratorio o confirmado de tuberculosis
Considere buscar un indicador de tos crónica y refiera a neumología pediátrica
Paciente < 17 años con tos con duración > 4 semanas
Historia clínica detallada Examen físico completo
Tiene el paciente algún indicador de tos crónica
Su paciente es menor de cinco años
Solicite radiografía de tórax y espirometría pre- y posbroncodilatador
Solicite radiografía de tórax y oscilometría de impulso
Su resultado es normal
Considere tos crónica inespecífica en su paciente
Tos seca
Realice prueba de alérgenos Determine agentes irritativos en el entorno Valore una posible tos posinfecciosa
Seguimiento en 4 semanas
Mejoró
Inicie budesonida 200 μg cada 12 horas durante 4-8 semanas
Considere la resolución del cuadro clínico y continúe el seguimiento
Tos húmeda
Seguimiento en 8 semanas
Mejoró
Adaptada de: Morice AH et al. Eur Respir J. 2020;55(1):1901136.
Tome cultivo de esputo
Considere bronquitis bacteriana prolongada Inicie cubrimiento antibiótico de acuerdo con el perfil de su institución
Mejoró 2 semanas después del inicio
Volumen 22 Número 2 Precop SCP 9
Pedro José Baquero Marín, Aura María Orozco, Bertha Inés Agudelo Vega, Ángela María Giraldo Mejía
Figura 1. Flujograma de atención del paciente pediátrico con tos crónica.
Sí Sí No No No No No No Sí Sí Sí Sí
estrategias terapéuticas con el fin último de lograr controlarla sin la identificación de un indicador de tos específica que pudiera alertar sobre un problema mayor que los escenarios comunes, como tos posinfecciosa. De esta manera, la utilización de agentes antitusivos de venta libre ha aumentado su prescripción y consumo en las últimas dos décadas, lo cual se traduce en un control parcial de la sintomatología presentada; sin embargo, ha aumentado la exposición del menor a eventos adversos derivados de altos requerimientos de dosis para lograr un efecto terapéutico eficaz. Teniendo en cuenta este escenario, la utilización de herramientas de tipo no farmacológico directo ha aumentado su prescripción, tales como frotes con sustancias que posteriormente se evaporan, como alcanfor, mentol o aceites de eucalipto, los cuales aunque han demostrado que pueden mejorar la sintomatología en períodos de tos superiores a siete días, en dosis superiores podrían aumentar el riesgo de eventos convulsivos en una relación que ha sido demostrada en estudios realizados con alcanfor.
Actualmente, las múltiples terapias disponibles y recomendadas tratan de proporcionar un mensaje claro al prescriptor, así como al paciente, centrado en la variabilidad del tiempo necesario para lograrse un efecto esperado en esta condición clínica, con el objetivo de mejorar y optimizar la heterogeneidad de estrategias utilizadas dentro del quehacer médico, lo cual aumenta el riesgo de eventos adversos farmacológicos y secundarios a errores en la prescripción; sin embargo, la evidencia apunta a la no sobreutilización de las terapias farmacológicas disponibles, teniendo en cuenta que los ensayos clínicos en pediatría en relación con los realizados en la población de adultos son mucho más escasos, lo cual se traduce en una disminución de la disponibilidad de evidencia clínica de calidad. Teniendo en cuenta lo anterior, dentro de las estrategias adaptadas está la utilización de un corticoide inhalado en dosis media por períodos de hasta
4 semanas, aunque algunos autores destacan un mayor efecto ante la utilización por períodos de hasta 8 semanas antes de considerar una intervención no satisfactoria y continuar el estudio de tos crónica.
Así mismo, se ha valorado otro tipo de estrategias entre las cuales se destaca la utilización de antiácidos y opioides, los cuales no han mejorado los desenlaces clínicos y, por el contrario, aumentan el riesgo de exposición a diferentes tipos de eventos adversos. Sin embargo, se ha intentado establecer la pertinencia en la utilización de terapia antibiótica para los pacientes con tos crónica inespecífica, denominada desde el año 2006 como bronquitis bacteriana prolongada; pese a esto, con el paso del tiempo se ha simplificado su definición original, dada la dificultad inicial para su diagnóstico por el requerimiento de la detección de un patógeno en la realización de una broncoscopia flexible y lavado broncoalveolar, con respuesta clínica dos semanas después del tratamiento con antibióticos.
En la actualidad, el proceso de simplificación se centra en el cumplimiento de tos crónica, sin indicadores de especificidad con adecuada respuesta clínica después del inicio de terapia antimicrobiana; particularmente, amoxicilina/ ácido clavulánico. Ante estos cambios, la probabilidad de implementar terapias antimicrobianas ha aumentado de manera significativa en los últimos años debido a la vinculación de terapias con un efecto clínico indirecto, como es el caso de los macrólidos con su potencial efecto antiinflamatorio, que genera un aumento en las tasas de resistencia antimicrobiana; sin embargo, ante esto las guías han sugerido la suspensión de la misma en caso de no lograrse un control de los síntomas después de dos semanas de uso adecuado, dado que el potencial efecto benéfico en caso de no haberse logrado en dicho momento no supera el 18 %-24 % de los pacientes, lo que sugiere un incremento en costos y riesgos de resistencia en escenarios sin un beneficio claro.
Tos crónica en pediatría: aproximación diagnóstica y terapéutica Volumen 22 Número 2 Precop SCP 10
CONCLUSIONES
La tos crónica continúa siendo un motivo frecuente de consulta en los servicios de consulta externa y urgencias, específicamente durante la temporada invernal. El reconocimiento de los indicadores de tos crónica permite orientar de una manera directa al médico al
LECTURAS RECOMENDADAS
1. Arain Z, Lakser O. Contemplating Chronic Cough in Children. Pediatr Ann. 2019;48(3):e115-e120.
2. Chang AB, Oppenheimer JJ, Irwin RS, et al. Managing Chronic Cough as a Symptom in Children and Management Algorithms. Chest. 2020;158(1):303-29.
3. Chang AB, Oppenheimer JJ, Weinberger M, et al. Use of Management Pathways or Algorithms in Children With Chronic Cough. Chest. 2016;149(1):106-19.
4. Cheng Z, Chua Y, How C, et al. Approach to chronic cough in children. Singapore Med J. 2021;62(10):513-9.
5. Chung KF, McGarvey L, Song WJ, et al. Cough hypersensitivity and chronic cough. Nat Rev Dis Primer. 2022;8(1):45.
6. Gallucci M, Pedretti M, Giannetti A, et al. When the Cough Does Not Improve: A Review on Protracted Bacterial Bronchitis in Children. Front Pediatr. 2020;8:433.
7. Kantar A, Seminara M. Why chronic cough in children is different. Pulm Pharmacol Ther. 2019;56:51-5.
8. Korppi M. Cough and cold medicines should not be recommended for children. Acta Paediatr. 2021;110(8):2301-2.
9. Lam SHF, Homme J, Avarello J, et al. Use of antitussive medications in acute cough in young children. J Am Coll Emerg Physicians Open. 2021;2(3):e12467.
reconocimiento de condiciones clínicas que requieren o no estudios diagnósticos invasivos y evitar la sobreutilización de los mismos, los costos derivados de su intervención, así como el momento oportuno para derivar a servicios especializados como pediatría y neumología pediátrica para un tratamiento oportuno.
10. McCallum GB, Bailey EJ, Morris PS, et al. Clinical pathways for chronic cough in children. Cochrane Database Syst Rev. 2014;(9):CD006595.
11. Morice AH, Millqvist E, Bieksiene K, et al. ERS guidelines on the diagnosis and treatment of chronic cough in adults and children. Eur Respir J. 2020;55(1):1901136.
12. O’Grady KAF, Grimwood K, Torzillo PJ, et al. Effectiveness of a chronic cough management algorithm at the transitional stage from acute to chronic cough in children: a multicenter, nested, single-blind, randomised controlled trial. Lancet Child Adolesc Health. 2019;3(12):889-98.
13. Prime SJ, Carter HE, McPhail SM, et al. Chronic wet cough in Australian children: Societal costs and quality of life. Pediatr Pulmonol. 2021;56(8):2707-16.
14. Ruffles TJC, Goyal V, Marchant JM, et al. Duration of amoxicillin-clavulanate for protracted bacterial bronchitis in children (DACS): a multi-centre, double blind, randomised controlled trial. Lancet Respir Med. 2021;9(10):1121-9.
15. Thomson KM, Dyer C, Liu F, et al. Effects of antibiotic resistance, drug target attainment, bacterial pathogenicity and virulence, and antibiotic access and affordability on outcomes in neonatal sepsis: an international microbiology and drug evaluation prospective substudy (BARNARDS). Lancet Infect Dis. 2021;21(12):1677-88.
Volumen 22 Número 2 Precop SCP 11
Pedro José Baquero Marín, Aura María Orozco, Bertha Inés Agudelo Vega, Ángela María Giraldo Mejía
Asma cada vez más frecuente
Jenny Jurado Hernández1
INTRODUCCIÓN
Históricamente, el asma ha sido la enfermedad respiratoria crónica más común de la población pediátrica, con un impacto multidimensional reconocido a nivel mundial, que ha llevado desde hace varias décadas a la generación y el fortalecimiento de la gestión clínica, científica y administrativa en torno a esta problemática de salud pública, para facilitar el abordaje preventivo, diagnóstico y terapéutico y el seguimiento de los niños con esta patología. Estos esfuerzos han tenido como propósito lograr y mantener el control de la enfermedad, así como mejorar algunos aspectos de la calidad de vida de los pacientes y sus familias con el objetivo de reducir la carga sanitaria, económica y social.
Aunque los índices de morbimortalidad del asma han disminuido en los últimos años, y se cuenta con nuevas y diferentes estrategias terapéuticas orientadas, en cierta medida, a la individualización de su manejo, aún se
encuentran dificultades y vacíos en la comprensión del enfoque diagnóstico, en la evaluación periódica y en los ajustes del tratamiento de esta población que motivan a continuar la educación médica para visibilizar la enfermedad e intervenir de manera integrada, pertinente y oportuna a los pacientes, de modo que se favorezcan los mejores desenlaces clínicos posibles a largo plazo. En este capítulo se revisarán algunos aspectos claves en relación con la epidemiología, la fisiopatología, las manifestaciones clínicas, el diagnóstico, el tratamiento y el seguimiento de los niños con asma.
DEFINICIÓN
El asma es una enfermedad heterogénea que se caracteriza, predominantemente, por la inflamación crónica de la vía aérea y la presentación de síntomas respiratorios como sibilancias, tos, disnea y opresión torácica de manera episódica y con intensidad y frecuencia variables, junto con la obstrucción variable del flujo aéreo.
Volumen 22 Número 2 Precop SCP 12
1. Pediatra neumóloga, Hospital das Clínicas, Universidad de São Paulo. Especialista en Docencia Universitaria y Gerencia de Instituciones de Salud Subdirectora de docencia e investigación, Hospital Militar Central Bogotá, Colombia.
2. Pediatra, Universidad de Cartagena. Neumólogo pediatra, Universidad El Bosque. Experto en medicina de sueño, Asociación Colombiana de Medicina de Sueño. Neumocenter, Valledupar, Colombia.
Iván Francisco Álvarez Orozco2
EPIDEMIOLOGÍA
La prevalencia general de la sintomatología de asma en los niños y adolescentes es cercana al 10 %; sin embargo, se describen variaciones de acuerdo con el grupo de edad, las regiones y los países, por la influencia de factores genéticos o relacionados con exposiciones perinatales, prenatales y posnatales y, al parecer, por la mayor ocurrencia de enfermedades infecciosas en la infancia que se manifiestan con sibilancias.
La prevalencia de asma es mayor en los hombres antes de la pubertad y posteriormente es semejante entre hombres y mujeres. En Colombia, el estudio disponible sobre la prevalencia de asma realizado en 2010 señala una prevalencia de síntomas de asma de 19 % en los niños menores de 4 años y de 17 % en aquellos de 5 a 17 años. Estas cifras y el comportamiento de la enfermedad observado en otros países de América Latina, Estados Unidos y Europa vienen alertando, desde hace varios años, acerca de una enfermedad cada vez más frecuente y posiblemente con subdiagnóstico y subtratamiento. A esto se suma la alta carga económica que generan las exacerbaciones asmáticas, de manera que hasta el 80 % de los costos de la enfermedad se derivan de las atenciones en urgencias, y más del 50 % de las hospitalizaciones.
Dentro de los factores de riesgo que se asocian con el asma están la herencia y los factores genéticos, la exposición a virus, humo de cigarrillo, polución del aire, algunos alérgenos (ácaros del polvo), el sexo masculino antes de la pubertad, la obesidad, el estrés, la falta de exposiciones microbianas benéficas, la urbanización y el bajo nivel socioeconómico. Algunos de estos, como la herencia y la obesidad, se asocian simultáneamente con la persistencia de asma de la infancia a la adultez, condición sobre la cual factores específicos como la polisensibilización, las infecciones recurrentes de la vía aérea, las comorbilidades, la eosinofilia, la función pulmonar anormal, la frecuencia e intensidad de los
episodios de sibilancias y la historia familiar o personal de atopia también inciden.
Por otra parte, con respecto a la gravedad de los síntomas de asma, así como se denota con la prevalencia, esta se encuentra condicionada por variaciones regionales, diversos factores de riesgo y exposiciones ambientales. Se calcula que 2 % a 10 % de los niños asmáticos escolares y adolescentes tienen síntomas crónicos o exacerbaciones graves a pesar de la terapia con varios medicamentos. Adicionalmente, llama la atención que el estudio de tendencia global de la carga de síntomas de asma en los niños en las últimas tres décadas sugiere que aproximadamente 1 de cada 20 escolares tiene síntomas de asma grave, lo que alerta acerca de la importancia de alcanzar el control de la enfermedad con estrategias para mejorar el acceso a terapias efectivas.
Por este contexto y el impacto en general del asma, también se ha visto la necesidad de promover y contar con programas o centros de atención integral en asma que, mediante el cuidado interdisciplinario, la monitorización estrecha y la educación hacia el empoderamiento en el automanejo y autocontrol contribuyan a este objetivo, así como a la reducción de las hospitalizaciones y las visitas a urgencias por exacerbaciones, el ausentismo escolar, el ausentismo laboral y los costos derivados de la atención en salud que en gran medida provienen del manejo en una hospitalización.
De igual manera, cada vez se insiste más en la importancia de la prevención primaria en asma, para evitar la exposición a estímulos que lo desencadenen, incluidas las intervenciones tempranas durante la gestación. Actualmente sigue recomendándose el parto vía vaginal en la medida que sea posible, la detección y la corrección de la insuficiencia de vitamina D en las mujeres asmáticas embarazadas o que están planeando su embarazo por la disminución en el riesgo de episodios tempranos de sibilancias en los niños y la evitación de la exposición al
Jenny Jurado Hernández, Iván
Álvarez
Volumen 22 Número 2 Precop SCP 13
Francisco
Orozco
humo de cigarrillo durante el embarazo o después del nacimiento y del uso de antibióticos de amplio espectro en el primer año de vida.
FISIOPATOGENIA
Aunque la patogénesis del asma no está completamente entendida, se reconoce su naturaleza multifactorial, el rol de varios mecanismos fisiopatológicos, las diferentes interacciones entre ellos y la participación de células estructurales e inmunes como los responsables de la obstrucción al flujo del aire y la expresión clínica heterogénea de la enfermedad. Los principales mecanismos subyacentes son la inflamación de la vía aérea, la hiperreactividad bronquial (hipercontractilidad del músculo liso e hipersecreción de moco) y la remodelación de la vía aérea. Otros corresponden a la sensibilización en el asma alérgica, la hiperrespuesta inmunitaria, la disfunción epitelial y la disfunción neural sensorial.
Paralelamente, con los avances en el estudio de la genética y el desarrollo del asma, ha sido posible determinar la mayor influencia genética en su presentación de inicio temprano (en la infancia) que en aquella que comienza en la vida adulta, en especial por genes localizados en el locus 17q12-21. Otros genes involucrados son interleucina 33 (IL-33) y linfopoyetina estromal tímica (TSLP). El efecto de las interacciones entre estos factores y el ambiente ha resultado en asma, lo que aclara que su ocurrencia no depende de los genes únicamente. Así, por ejemplo, se ha descrito una afectación de la función epitelial e inmunitaria que condiciona el asma en los casos de interrelación de algunos genes en el locus 17q12-21 y exposiciones como las infecciones virales y el humo de tabaco.
IMPORTANCIA DE LOS FENOTIPOS
En el estudio de la historia natural del asma y teniendo en cuenta el reto que ha representado
el enfoque de las sibilancias en los niños desde etapas tempranas de la vida, sobre todo por su variable causalidad, se han identificado grupos de pacientes que según la edad de presentación de estas y su trayectoria a través del tiempo se pueden considerar asmáticos. En esta conceptualización por fenotipos, que es útil porque se pueden estudiar los mecanismos subyacentes a la enfermedad, así como predecir el curso clínico y facilitar la orientación del tratamiento, actualmente continúa siendo importante en la atención pediátrica el reconocimiento de los siguientes grupos:
• Niños con sibilancias transitorias tempranas: en este grupo se encuentran los niños cuya sintomatología inicia y mejora antes de los 3 a 4 años. Por lo general, no tienen síntomas entre los resfriados. Este fenotipo se relaciona con una función pulmonar disminuida al nacer, tabaquismo materno durante la gestación, prematuridad, sexo masculino, presencia de hermanos mayores y la ausencia de atopia.
• Niños con sibilancias transitorias tardías: los niños comienzan los síntomas antes de los 3 años y mejoran en la adolescencia. El desencadenante clave del cuadro clínico es la infección respiratoria viral, y no hay atopia.
• Niños con sibilancias persistentes: los niños tienen exacerbaciones provocadas por resfriados, alérgenos o irritantes y cursan con síntomas entre estas. En este grupo, usualmente la función pulmonar es normal al nacer y se identifica atopia. Existe una tendencia a enfermedades como la rinitis alérgica y el eccema. Aunque la sintomatología inicia desde temprana edad, esta puede persistir hasta la vida adulta.
En la actualidad, la concepción de fenotipos se ha ampliado en relación con múltiples características específicas (clínicas, fisiológicas, procesos inflamatorios subyacentes con marcadores identificables, factores de riesgo ambientales y genéticos y sus interacciones, la respuesta a la terapia, la historia natural y las comorbilidades)
Asma cada vez más frecuente Volumen 22 Número 2 Precop SCP 14
y su uso no debe limitarse solo a la comprensión individual de cada uno de ellos sino a entender que existe la posibilidad de tener riesgos comunes y varios de los factores mencionados a través de distintos fenotipos, para dar paso tanto a las intervenciones específicas como a las generales.
MANIFESTACIONES CLÍNICAS
El comportamiento heterogéneo del asma guarda relación con la edad de inicio, la gravedad y su presentación clínica. Se manifiesta por síntomas o signos respiratorios variables como tos, sibilancias, dificultad respiratoria y opresión torácica, los cuales se atribuyen con mayor probabilidad a esta enfermedad cuando son frecuentes y recurrentes; se incrementan en la noche o en las madrugadas; se desencadenan o empeoran con el ejercicio, el aire frío o húmedo, la risa, el llanto, las emociones o la exposición a mascotas; ocurren sin infecciones del tracto respiratorio superior; se acompañan de sibilancias a la auscultación pulmonar; se presentan bajo el contexto de historia personal de atopia o historia familiar de asma o ambas; no tienen otra causa que los explique y mejoran en respuesta a la terapia. Algunos pacientes experimentan exacerbaciones de asma enmarcadas en síntomas más intensos y persistentes que requieren un tratamiento escalonado y una evaluación médica no programada, y se asocian con el deterioro de la función pulmonar.
Teniendo en cuenta que cerca del 80 % de los síntomas de asma inician en la edad preescolar y la principal declinación de la función pulmonar ocurre antes de los 5 años, una de las herramientas que más se ha utilizado en la práctica clínica para la identificación de preescolares con riesgo alto de desarrollar síntomas de asma persistente es el índice predictor de asma (IPA), que evalúa
la presencia de un criterio primario, dado por tres o más episodios de sibilancias en el último año, y unos criterios secundarios que se dividen en mayores (uno de los padres con asma, diagnóstico personal de dermatitis atópica) y menores (diagnóstico médico de rinitis alérgica, sibilancias no relacionadas a infecciones virales, eosinofilia periférica mayor o igual a 4 %). Un IPA positivo corresponde a la presencia del criterio primario más, al menos, un criterio mayor o dos criterios menores. Tener un IPA positivo entre los 6 y 13 años se asocia con un riesgo 4,3 a 9,8 veces superior de tener asma en comparación con un índice negativo. A los 6 años, un índice positivo tiene un valor predictivo positivo (VPP) del 47 % (probabilidad de los niños con IPA positivo de tener asma en la edad escolar) y un valor predictivo negativo (VPN) del 91 % (probabilidad de que los niños con IPA negativo no tengan asma en la edad escolar).
Aunque existen otras escalas predictivas, los beneficios que ha mostrado el uso del IPA comprenden la combinación de criterios clínicos y de laboratorio más accesibles, el aporte en la disminución de la morbilidad de los pacientes mediante el reconocimiento temprano y la reducción en la prescripción de terapias controladoras en aquellos niños que probablemente tienen sibilancias transitorias más que asma.
Otra estrategia que ha contribuido a reforzar la determinación de la probabilidad de asma o de respuesta al tratamiento, en menores de 5 años, consiste en el seguimiento y la intervención luego de la identificación del siguiente patrón clínico: síntomas recurrentes (tos, sibilancias, dificultad respiratoria) por un período mayor de 10 días durante las infecciones del tracto respiratorio superior, tres o más episodios graves o el empeoramiento nocturno de la sintomatología, la presencia de síntomas entre los episodios y durante el juego o con el llanto, y la atopia o la historia familiar de asma.
Jenny Jurado Hernández, Iván
Álvarez
Volumen 22 Número 2 Precop SCP 15
Francisco
Orozco
DIAGNÓSTICO
Diagnosticar el asma en los niños continúa siendo un reto en aquellos con menos de 2 años, y sigue fundamentándose en el cuadro clínico en cualquier grupo de edad pediátrica. A partir de los 5 años, es recomendable la demostración de la obstrucción del flujo aéreo; sin embargo, un resultado negativo en la evaluación funcional no descarta su presencia e implica la revisión periódica del paciente durante el seguimiento para asegurar que el diagnóstico es correcto. Complementar el cuadro clínico con una valoración de la respuesta a una prueba terapéutica realizada con corticoide inhalado o un ciclo de corticoide sistémico, en los casos de alta probabilidad, sirve para apoyar el diagnóstico de asma.
Dentro del estudio diagnóstico, los componentes que idealmente deben ser evaluados, de manera integrada e individualizada, son la presentación clínica, la función pulmonar, la gravedad, el nivel de control, los rasgos o características tratables (por ejemplo, comorbilidades) o factores modificables (por ejemplo, algunas exposiciones ambientales, técnica inhalatoria incorrecta y falta de adherencia), la aproximación basada en fenotipos (por ejemplo, alérgico y no alérgico) y los biomarcadores inflamatorios, según cada caso.
CONSIDERACIONES CLAVE DE LA EVALUACIÓN DE LA FUNCIÓN PULMONAR
Para la confirmación del diagnóstico de asma se acude a la realización de una prueba de función pulmonar, siempre que sea posible, previo al inicio de un tratamiento a largo plazo. En este sentido, la principal herramienta funcional en la evaluación del asma es la espirometría prey posbroncodilatador. Usualmente, los niños con una edad mayor o igual a 5 años logran efectuarla. El criterio funcional que se espera
encontrar es la obstrucción de la vía aérea que mejora con la administración de broncodilatador. Se considera obstrucción si se obtiene una relación entre el volumen espiratorio forzado en el primer segundo (VEF1) y la capacidad vital forzada (CVF) menor que el límite inferior de la normalidad (LIN) o menor que el 80 % del valor predicho (relación VEF1/CV < LIN o < 80 % del predicho) y como parámetro de reversibilidad el aumento de VEF1 > 12 % en los niños.
Cuando el resultado de la espirometría pre- y posbroncodilatador es normal y se mantiene la sospecha de asma, se puede acudir a una prueba de provocación bronquial (con estímulos como la metacolina, o el ejercicio) o a la medición de la variación del pico flujo espiratorio, para apoyar la confirmación diagnóstica.
La prueba de metacolina, cuyo objetivo es evaluar el grado de hiperreactividad bronquial, consiste en la administración de cantidades ascendentes de metacolina vía nebulizada, seguida de la determinación de obstrucción bronquial mediante espirometrías seriadas. El grado de hiperreactividad se determina con la dosis de metacolina con la cual ocurre una caída del VEF1 mayor o igual a un 20 %.
La prueba de provocación bronquial con ejercicio implica el desarrollo de ejercicio en una banda sin fin o en una bicicleta y la consecuente medición espirométrica de la caída del VEF1; si esta es superior a un 15 % en los 20 minutos que siguen a la realización de este ejercicio, se considera positiva.
Alternativamente, la medición de la variabilidad del pico flujo espiratorio se ha incluido como parte del estudio; sin embargo, actualmente se usa poco. Un incremento mayor o igual a 20 % en el pico flujo espiratorio 15 minutos después de la administración de broncodilatador, o una mejoría en los síntomas y el pico flujo espiratorio posterior a 4 semanas de tratamiento se asocia con asma.
Asma cada vez más frecuente Volumen 22 Número 2 Precop SCP 16
En los pacientes entre 3 y 5 años, y en aquellos cuya espirometría es normal, una ayuda diagnóstica funcional que ha tomado relevancia en el estudio del asma ha sido la oscilometría de impulso pre- y posbroncodilatador como una medición sensible de alteración de la fisiología de la vía aérea. Esta prueba tiene como ventajas no requerir maniobras de espiración forzada, ni una cooperación mayor del paciente para su ejecución. Aunque los parámetros de resistencia, reactancia y respuesta al broncodilatador han sido de gran interés en la evaluación, otros como el área de reactancia y la diferencia entre las resistencias a nivel de 5 y 20 hertz han mostrado utilidad en apoyar el diagnóstico de asma, predecir la pérdida futura del control del asma o la monitorización de cambios con el tratamiento.
Actualmente, la medición de la fracción exhalada de óxido nítrico (FENO), un marcador inflamatorio de la vía aérea, se considera una prueba de fácil realización que aporta a la evaluación diagnóstica. En niños menores de 5 años, un resultado de FENO elevado posterior a 4 semanas de infección respiratoria predice la presencia de asma en la edad escolar e incrementa la posibilidad de sibilancias, asma y uso de corticoides en este período, independiente del cuadro clínico. Dentro de sus aplicaciones también están la identificación de asma tipo 2 alto, el tratamiento guiado por FENO en asma grave y en la población pediátrica, y como herramienta de seguimiento de los pacientes.
OTROS ESTUDIOS PARACLÍNICOS
En el estudio del niño con sospecha o confirmación de asma, se puede complementar la evaluación con un hemograma, especialmente por el recuento de eosinófilos, el cual además de ser uno de los criterios del IPA que se aplica en preescolares, sirve en general como marcador inflamatorio (asma tipo 2 alto).
La medición de inmunoglobulina E (IgE) sérica sugiere un fenotipo alérgico, y las pruebas
específicas de alergia lo confirman. En pediatría, aunque no se indiquen de forma rutinaria las pruebas de alergia, es importante establecer el significado de las pruebas positivas en el contexto de la historia del paciente, o acudir a la historia clínica para evaluar la sensibilidad a alérgenos estacionales y perennes. En la determinación del fenotipo de asma alérgica, La Guía Española para el Manejo del Asma (GEMA) recomienda partir de si la exposición a aeroal é rgenos desencadena o empeora la enfermedad y considerar la sospecha de asma alérgica si la respuesta es positiva a este interrogante; en este caso, solicitar la prueba intradérmica, que en caso de ser positiva se debe evaluar la concordancia con la historia clínica, y si se encuentra, considerar el asma alérgica; en cambio, si es negativa, se debe establecer la sensibilización sin relevancia clínica. Cuando la prueba de alergia es negativa se considera el fenotipo de asma no alérgica y se buscan otros factores que contribuyan al asma.
La radiografía de tórax generalmente es normal o puede revelar signos de atrapamiento aéreo. Esta se solicita ante la sospecha de asma para descartar otras entidades que la asemejen. No se realiza dentro del seguimiento ni como examen de rutina en el caso de las exacerbaciones.
En los pacientes con asma grave, se complementa la confirmación diagnóstica con la determinación del fenotipo (alérgico y no alérgico) a través de la medición de los marcadores inflamatorios ya señalados: los eosinófilos séricos y en esputo, la IgE sérica, las pruebas de alergia y la FENO. Las medidas de inflamación eosinofílica como los eosinófilos y la FENO no solo se han empleado como herramientas diagnósticas, sino también para la monitorización de esta patología.
DIAGNÓSTICOS DIFERENCIALES
El espectro amplio de enfermedades que hacen parte de los diagnósticos diferenciales
Jenny Jurado Hernández, Iván
Volumen 22 Número 2 Precop SCP 17
Francisco Álvarez Orozco
(enfermedad pulmonar crónica del recién nacido, displasia broncopulmonar, secuelas de bronquiolitis, bronquiectasias, discinesia ciliar primaria, fibrosis quística, disfunción laríngea, alteraciones estructurales de la vía aérea, enfermedad por reflujo gastroesofágico, aspiración por cuerpo extraño, inmunodeficiencia, cardiopatía congénita, entre otras) hace indispensable acudir al cuadro clínico que disminuye la probabilidad de asma para comenzar a buscar, según el caso, alguno de estos diagnósticos.
Una baja probabilidad de asma se considera cuando hay tos aislada (sin otros síntomas), producción crónica de esputo, disnea asociada a mareo o sensación de hormigueo, dolor torácico aislado, disnea inducida por ejercicio con respiración ruidosa, un examen físico del tórax o función pulmonar normal durante los episodios respiratorios, o un examen físico anormal por signos como estertores o hipocratismo digital. En los menores de 5 años, los elementos clínicos claves para orientar la búsqueda de otros diagnósticos son el inicio muy temprano o neonatal de síntomas, la presencia de hipoxemia sin enfermedad viral, la falta de crecimiento o de ganancia de peso, las sibilancias continuas, sintomatología que no se asocia con desencadenantes típicos, los signos cardiovasculares o pulmonares focales (hipocratismo), el vómito que no se asocia a síntomas respiratorios y la no respuesta al tratamiento. El abordaje de uno o más diagnósticos diferenciales es individualizado y se complementa con paraclínicos específicos, partiendo también del contexto clínico.
TRATAMIENTO
El manejo del asma es multidimensional. Este enfoque integral y personalizado tiene como objetivo lograr y mantener el control de la enfermedad, lo que implica contar con un buen control de la sintomatología, mantener las actividades normales, reducir el riesgo de muerte por asma, las exacerbaciones, la limitación persistente al flujo
de aire y los efectos adversos del tratamiento. Para conducir la terapia (farmacológica y no farmacológica), primero se clasifica la gravedad de la enfermedad y se hace una aproximación inicial individual a los principales o potenciales desencadenantes, los factores de riesgo para persistencia del asma, los aspectos modificables, las necesidades y expectativas del paciente y la técnica inhalatoria correcta, que incluye el uso de inhalocámara acorde con la edad (preferiblemente con máscara en menores de 5 a 6 años y con boquilla en mayores de esta edad, siempre y cuando el niño logre hacer una técnica adecuada).
CLASIFICACIÓN INICIAL DE LA GRAVEDAD DEL ASMA
En el paciente con asma es importante utilizar el cuadro clínico y, si es posible, la función pulmonar para clasificar la gravedad de la enfermedad antes del inicio del tratamiento. Esta aproximación ayuda a tomar la decisión acerca del medicamento y la dosis con que se va a comenzar la terapia, teniendo en cuenta que, a mayor gravedad del asma, el paciente va a necesitar una dosis superior de medicamento o incluso varios. Cuando se valora al paciente que aún no ha recibido tratamiento, se hace una clasificación inicial de la gravedad y se reevalúa una vez se alcance el control.
En la Tabla 1 se presenta una propuesta de clasificación inicial de la gravedad del asma, la cual corresponde a la intensidad intrínseca de la enfermedad. Aunque un paciente comparta características clínicas descritas en los diferentes grados de gravedad del asma, se ubicará en la categoría de mayor gravedad en la que se encuentran parámetros.
TRATAMIENTO ANTIINFLAMATORIO INICIAL
En el paciente con asma que no tiene tratamiento se recomienda la terapia controladora
Asma cada vez más frecuente Volumen 22 Número 2 Precop SCP 18
Tabla 1. Clasificación inicial de la gravedad del asma
Cuadro clínico (durante las últimas 4 semanas) Asma
Síntomas Leve Moderada Grave
Despertares nocturnos de ≥ 5 años > 2 días/semana (no diario) La mayoría de los días Diarios
Despertares nocturnos de < 5 años
Uso de SABA para rescate
3-4 noches/mes < 2 veces por semana > 2 veces por semana (incluso todas las noches)
1-2 noches/mes La mayoría de los días Diario o incluso varias veces al día
Interferencia con actividades normales > 2 días/semana Alguna limitación Limitación frecuente
Síntomas con el ejercicio Ninguna Algún síntoma Síntomas frecuentes
VEF1 % predicho Ninguno Anormal (70 %-80 %) < 70 %
VEF1/CVF Normal Anormal (< 80%) Anormal (< 80 %)
Exacerbaciones con corticoides sistémicos ≥ 1/año ≥ 2/año ≥ 2/año
CVF: capacidad vital forzada; SABA: agonista β de corta acción; VEF1: volumen espiratorio forzado en el primer segundo.
Adaptada de: Expert Panel Working Group of the National Heart, Lung, and Blood Institute (NHLBI) administered and coordinated National Asthma Education and Prevention Program Coordinating Committee (NAEPPCC); et al. J Allergy Clin Immunol. 2020;146(6):1217-1270; GEMA 5.2. Guía Española para el Manejo del Asma. Madrid: Sociedad Española de Neumología y Cirugía del Tórax; 2022.
temprana tomando en consideración la frecuencia de los síntomas y la presencia de factores de riesgo, los diferentes aspectos que afectan la selección de alguna de las opciones terapéuticas y la educación en la técnica inhalatoria correcta, esta última es fundamental para que el manejo tenga una mayor tasa de éxito.
Ante síntomas de asma más de 2 veces al mes, despertares nocturnos una vez al mes, cualquier síntoma de asma y cualquier factor de riesgo para asma es recomendable el uso de corticoide inhalado a dosis bajas como punto de partida. La potencia y la eficacia de esta terapia antiinflamatoria continúa posicionándola como la más recomendada en los niños, sin desconocer que los avances farmacológicos han llevado a la inclusión de terapias combinadas como el corticoide más el broncodilatador de acción prolongada (LABA)
vía inhalada en los escolares y adolescentes y en determinados escenarios, con muy buenos resultados.
EVALUACIÓN DEL CONTROL DEL ASMA
La estrategia GINA (Global Initiative National for Asthma) que define el control del asma como el nivel en el cual las manifestaciones de asma no pueden ser observadas, o se han disminuido o desaparecido con el tratamiento, resume a partir de dos dominios el control de la enfermedad: el control de síntomas y el riesgo futuro de desenlaces adversos. Junto con estos criterios, es necesario indagar acerca de las exacerbaciones y las veces que han causado visitas a urgencias, hospitalizaciones o ingresos a la unidad de cuidados intensivos.
Jenny Jurado Hernández,
Volumen 22 Número 2 Precop SCP 19
Iván Francisco Álvarez Orozco
La evaluación de control de los síntomas se efectúa mediante una anamnesis dirigida a dar respuesta a cuatro preguntas sencillas, con base en la información que proporcionan los pacientes y familiares o cuidadores de las últimas cuatro semanas: ¿ el niño tiene síntomas más de dos veces a la semana?, ¿ tiene algún despertar nocturno debido al asma?, ¿ necesita tratamiento de rescate más de dos veces en la semana?, ¿ tiene alguna limitación en su actividad por el asma? En los pacientes menores de 5 años, la primera pregunta se cambia a ¿tiene síntomas diurnos por más de unos minutos, más de una vez por semana? Obtener 1 a 2 respuestas afirmativas orienta a asma parcialmente controlada, 3 a 4 respuestas afirmativas, a un asma no controlada, y ninguna respuesta afirmativa, a asma controlada.
Actualmente se recomienda buscar la mayor objetividad y precisión mediante la aplicación de alguna herramienta validada para determinar el estado de control; por ejemplo, el Asthma Control Test o (ACT) en adolescentes (una puntuación mayor o igual a 21 indica un asma controlada, de 19 a 20 parcialmente controlada y menor o igual a 18 no controlada), y el Asthma Control Test in children (cACT) en niños de 4 a 12 años, o el Test for Respiratory and Asthma Control in Kids (TRACK) y el cuestionario de Control del Asma en los Niños (CAN), entre otros.
En la determinación del riesgo futuro de desenlaces adversos se miden tres aspectos: la presencia de factores de riesgo para exacerbaciones ( Tabla 2), los factores de riesgo para limitación al flujo aéreo que tiene el paciente y los factores que favorecen los eventos adversos con medicamentos. Frente a la identificación de uno o más de ellos, se recomienda maximizar la intervención sobre los factores que son susceptibles de modificación al igual que el manejo de las comorbilidades, puesto que su persistencia condiciona el desarrollo del asma difícil de tratar.
Tabla 2. Factores de riesgo para exacerbaciones de asma
Factores de riesgo para exacerbaciones
Síntomas de asma no controlada
> 1 exacerbación grave en los últimos 12 meses
Historia de incubación o ingreso a cuidados intensivos por asma
Uso excesivo de agonistas β de acción corta (3 canister/año)
Uso inapropiado de corticoides inhalados:
- no prescripción
- mala adherencia
- mala técnica inhalatoria
Problemas socioeconómicos o psicológicos mayores
Exposiciones: cigarrillo, alérgenos
Comorbilidades: obesidad, rinosinusitis, alergia alimentaria confirmada, eosinofilia
Volumen espiratorio forzado en el primer segundo (VEF1) bajo
Adaptada de: Global Strategy for Asthma Management and Prevention. GINA; 2022.
Cuando se evalúan los factores de riesgo para el desarrollo de obstrucción fija de la vía aérea es clave preguntar si hay historia de bronquiolitis, prematuridad o bajo peso al nacer, asma grave con varias hospitalizaciones y eosinofilia. Dentro de los factores que favorecen la ocurrencia de eventos adversos sistémicos con los medicamentos se debe examinar el uso frecuente de corticoides orales, el manejo con corticoide inhalado a dosis altas o corticoides inhalados potentes, y el uso concomitante de inhibidores citocromo P50. En el caso de efectos secundarios locales, los factores que pueden encontrarse son una técnica inhalatoria incorrecta o el uso de corticoides inhalados potentes y a dosis altas.
TERAPIA FARMACOLÓGICA ESCALONADA
Para el manejo escalonado del asma se tiene en cuenta el nivel de control de la enfermedad
Asma cada vez más frecuente Volumen 22 Número 2 Precop SCP 20
durante el seguimiento, lo que permite aumentar o reducir la terapia de forma periódica según cada caso hasta encontrar el mejor balance clínico y funcional. La Tabla 3 menciona las opciones terapéuticas y las Figuras 1, 2, 3 y 4 resumen las principales opciones según el grupo de edad. En las figuras se incluyen el cuadro clínico o el compromiso de la función pulmonar que llevarían a iniciar la terapia farmacológica en determinado paso, y la secuencia de tratamientos que pueden ser
aplicados como resultado de la evaluación del estado de control del asma, con el propósito de evitar la inercia terapéutica. En general, en el asma leve se siguen los pasos 1 y 2, en el asma moderada los pasos 3 y 4, y en el asma grave el paso 5. En la monitorización de la respuesta a la terapia, la gravedad del asma del paciente va a estar determinada por las necesidades mínimas de tratamiento farmacológico de mantenimiento con el cual se logra mantener el control.
Medicamento Beneficios y otras consideraciones
Corticoide inhalado - Medicamento de primera línea para el control del asma por su efecto y potencia antiinflamatoria.
- En mayores de 3 años: mejoría clínica, de la función pulmonar y de la inflamación bronquial; disminución del riesgo de exacerbaciones y hospitalizaciones e impacto favorable en la calidad de vida.
- En lactantes y preescolares: menos episodios de asma y sibilancias recurrentes, con mayor respuesta en los niños con IPA positivo.
- El tratamiento intermitente o continuo no altera la historia natural del asma.
- Tiene un perfil de seguridad adecuado. Puede presentarse una reducción de la velocidad de crecimiento al inicio de la terapia (1 a 3 años), aunque es un efecto transitorio y que no repercute en la talla final o el crecimiento definitivo. Sin embargo, cuando su uso continuo es prolongado, la talla final puede ser menor, como un efecto dependiente de la dosis. Es importante hacer el seguimiento.
Antagonistas de los receptores de antileucotrienos
Combinación de agonistas adrenérgicos β2 de acción prolongada y corticoide inhalado
- Medicamento antiinflamatorio alternativo o complementario para el control del asma.
- En preescolares con asma/sibilancias provocadas por virus disminuye la sintomatología y el requerimiento de corticoide oral.
- Su uso debe ser supervisado frente a la posibilidad de efectos adversos, en especial neuropsiquiátricos.
- La asociación de LABA con un corticoide inhalado como terapia de mantenimiento para el asma es efectiva y segura en escolares y adolescentes.
- En niños de 4 a 11 años, la administración de formoterol y budesonida en el mismo inhalador reduce las exacerbaciones y el requerimiento de corticoide sistémico, tanto como terapia de mantenimiento como de alivio, conocida como estrategia MART
- En niños de 6 a 11 años con asma persistente no controlada con corticoide a dosis baja, la combinación de LABA más corticoide inhalado tiene un efecto positivo a nivel clínico y funcional semejante al alcanzado con doblar la dosis de corticoide inhalado, por lo que se sugiere evaluar el fenotipo clínico y la heterogeneidad de la respuesta de cada paciente frente a estos medicamentos.
- El uso de LABA más corticoide inhalado contemplado en los pasos 1 y 2 del tratamiento escalonado del asma en adolescentes, comparado con corticoide inhalado diario + SABA a necesidad, muestra un resultado similar en el control de las exacerbaciones graves, una disminución del 25 %-50 % de la dosis de corticoide en la terapia combinada y un control semejante de los síntomas, la función pulmonar, la medición de FENO y el broncoespasmo inducido por ejercicio.
Jenny Jurado Hernández, Iván
Volumen 22 Número 2 Precop SCP 21
Francisco Álvarez Orozco
Tabla 3. Medicamentos para el tratamiento del asma
Medicamento Beneficios y otras consideraciones
Antagonista muscarínico de acción prolongada (tiotropio)
Biológicos
- Medicamento útil en niños escolares y adolescentes con asma grave mal controlada con corticoide inhalado a dosis altas más LABA.
- Medicamentos que tratan la inflamación subyacente mediante el bloqueo de distintos mediadores, en pacientes con asma grave, mayores de 6 años.
- Existen diferentes anticuerpos monoclonales como el omalizumab que actúa frente a la IgE, el mepolizumab que bloquea la IL-5 y el dupilumab que bloquea la IL-4 y la IL-13.
- Las indicaciones y el seguimiento se ciñen a las recomendaciones de las guías de manejo en asma grave, y su uso y disponibilidad a las regulaciones locales en cada país.
Otros
- El macrólido azitromicina se ha considerado una terapia adicional en pacientes con asma grave no controlada a pesar del tratamiento óptimo, y que cursen con exacerbaciones frecuentes, independientemente del fenotipo inflamatorio, dado su impacto en la reducción de las exacerbaciones y la mejoría clínica en aspectos de la calidad de vida. Su uso debe ser individualizado, especialmente en aquellos asmáticos que se exacerban y con fenotipo no T2.
- El corticoide oral es un antiinflamatorio potente con indicación de uso en la exacerbación de asma y en los casos de asma grave no controlada a pesar del manejo adecuado. Su asociación con eventos adversos ha llevado a priorizar otras terapias farmacológicas antes que su uso; sin embargo, contribuye al control y requiere una monitorización estricta.
- La inmunoterapia con alérgenos (extractos bien estandarizados) ha mostrado beneficio en pacientes rigurosamente seleccionados, con asma alérgica bien controlada con niveles bajos o medios de tratamiento farmacológico, siempre y cuando se haya demostrado una sensibilización clínicamente relevante, mediada por IgE, frente a aeroalérgenos comunes.
Adaptada de: Global Strategy for Asthma Management and Prevention. GINA; 2022; GEMA 5.2. Guía Española para el Manejo del Asma. Madrid: Sociedad Española de Neumología y Cirugía del Tórax; 2022.
Con el fin de evitar el uso excesivo de agonistas β 2 de acción corta, terapia que desafortunadamente en muchos casos se ha tomado como primera línea para el asma por su rápido alivio de síntomas y bajo costo, y considerando que el niño con asma leve también tiene riesgo de exacerbaciones graves, las recomendaciones actuales enfatizan en que siempre que el paciente requiera el uso de estos fármacos debe administrarse el corticoide inhalado. Este último disminuye el riesgo de muerte por asma, las exacerbaciones graves y las hospitalizaciones que requieren corticoides sistémicos.
TRATAMIENTO FARMACOLÓGICO EN ADOLESCENTES
En todos los adolescentes con asma leve se recomienda el uso de corticoide inhalado como terapia controladora, ya sea de uso diario o a demanda como corticoide a dosis baja más formoterol. En esta población se plantean dos esquemas (conocidos como TRACK 1 y 2 según GINA) útiles para el manejo.
En las Tablas 4 , 5 y 6 se especifican las dosis baja, media y alta de los corticoides inhalados, para cada grupo de edad.
Asma cada vez más frecuente Volumen 22 Número 2 Precop SCP 22
Tabla 3. Medicamentos para el tratamiento del asma (continuación)
Controlador alternativo
Figura
Síntomas menos de 2 veces/ mes
Asma cada vez más frecuente
Síntomas 2 o más veces/mes, pero menos de 4-5 días/ semana
Síntomas la mayoría de días, o despertar con asma 1 o más veces/semana
Síntomas diarios o despertar con asma 1 o más veces/semana y función pulmonar baja
PASO 4
Puede ser necesario un ciclo corto de corticoide sistémico en caso de asma grave no controlada
PASO 5
PASO 1
CI siempre que se use SABA
PASO 2
CI a dosis baja de mantenimiento
PASO 3
CI a dosis bajaLABA
CI a dosis media/ alta-LABA de mantenimiento
RESCATE: SABA según necesidad
Adición de LAMA Remisión para evaluación fenotípica + anti-IgE, anti-IL5/5R, anti-IL-4R. Considerar dosis alta de CIformoterol
Antes de considerar un régimen con SABA como rescate, verifique que sea probable que el paciente sea adherente al uso del controlador diario
Anti-IL: antiinterleucina; CI: corticoide inhalado; LABA: agonista β de acción prolongada; LAMA: antagonista muscarínico de larga acción; LTRA: antileucotrieno; SABA: agonista β de acción corta.
Adaptada de: Global Strategy for Asthma Management and Prevention. GINA; 2022.
Figura
Tratamiento escalonado del asma en menores de 5 años.
PASO 3
PASO 4
Controlador preferido
Otras opciones de controlador
PASO 1
PASO 2
CI a dosis baja diario
LTRA o curso corto e intermitente de CI al inicio de la enfermedad respiratoria
Doblar la dosis baja de CI
CI a dosis baja +LTRA. Considerar remisión a especialista
RESCATE: SABA según necesidad
Ajuste de tratamiento según necesidades individuales
CI: corticoide inhalado; LTRA: antileucotrieno; SABA: agonista β de acción corta.
Adaptada de: Global Strategy for Asthma Management and Prevention. GINA; 2022.
Continuidad de controlador y remisión a evaluación especializada
Adición de LTRA o aumento de la frecuencia de CI, o adición de CI intermitente
Volumen 22 Número 2 Precop SCP 24
3. Tratamiento escalonado del asma en adolescentes (esquema 2).
4.
HFA: hidrofluoroalcano. Adaptada de: Global Strategy for Asthma Management and Prevention. GINA; 2022.
medida
de dosis medida presurizado; HFA: hidrofluoroalcano. Adaptada de: Global Strategy for Asthma Management and Prevention. GINA; 2022.
IDMp:
Jenny Jurado Hernández, Iván Francisco Álvarez Orozco Volumen 22 Número 2 Precop SCP 25
Corticoide Dosis baja Dosis intermedia Dosis alta Dipropionato de beclometasona (HFA, partícula estándar, IDMp) 100-200 > 200-400 > 400 Dipropionato de beclometasona (HFA, partícula ultrafina, IDMp) 50-100 > 100-200 > 200 Budesonida 100-200 > 200-400 > 400 Propionato de fluticasona 100-200 > 200-500 > 500 Furoato de fluticasona 50 50Mometasona 100 100 > 200 Ciclesonida 80 > 80-160 > 160 IDMp: inhalador de dosis medida presurizado; HFA: hidrofluoroalcano. Adaptada de: Global Strategy for Asthma Management and Prevention. GINA; 2022.
Tabla 4. Dosis diarias de corticoide inhalado (en microgramos) para niños de 6-11 años
Corticoide Dosis baja Dosis intermedia Dosis alta Dipropionato de beclometasona (HFA, partícula estándar, IDMp) 200-500 > 500-1000 > 1000 Dipropionato de beclometasona (HFA, partícula ultrafina, IDMp) 100-200 > 200-400 > 400 Budesonida 200-400 > 400-800 > 800 Propionato de fluticasona 100-250 > 250-500 > 500 Furoato de fluticasona 100 100 200 Mometasona 200-400 200-400 > 400 Ciclesonida 80-160 > 160-320 > 320 IDMp: inhalador
Tabla 5. Dosis diarias de corticoide inhalado (en microgramos) para adolescentes
de dosis
presurizado;
Corticoide Dosis baja total Dipropionato de beclometasona (HFA, partícula estándar, IDMp) 100 Dipropionato de beclometasona (HFA, partícula ultrafina, IDMp) 50 Budesonida 100 Propionato de fluticasona (HFA, partícula estándar, IDMp) 50 Furoato de fluticasona (HFA, partícula estándar, IDMp) 100
Tabla 6. Dosis diarias de corticoide inhalado (en microgramos) para niños menores o iguales a 5 años
inhalador
TRATAMIENTO NO FARMACOLÓGICO
En el niño asmático, las medidas no farmacológicas se centran en la prevención y la evitación de desencadenantes y condiciones que puedan aumentar la morbilidad respiratoria o la mortalidad. El control del ambiente es fundamental y consiste en evitar la exposición al humo de cualquier tipo de cigarrillo, lograr el abandono del tabaquismo o el vapeo cuando alguno de estos exista, y minimizar la exposición a otros contaminantes ambientales.
Las estrategias que han mostrado mayor eficacia para reducir los niveles de exposición a alérgenos en los pacientes con asma alérgica incluyen el uso de fundas de colchón impermeables en el caso del asma por ácaros, el retiro de los animales del domicilio si realmente el asma es causada por epitelios y la utilización racional de plaguicidas en el caso de asma por cucaracha. La evidencia reciente sugiere que la aplicación concomitante de varias de estas medidas y la educación contribuyen a la prevención de las exacerbaciones. Por otra parte, en los pacientes con exacerbaciones por aspirina y antiinflamatorios no esteroideos debidamente comprobada debe evitarse su uso.
Una recomendación adicional es la vacunación anual contra la influenza para mitigar el alto riesgo de complicaciones que tienen los pacientes con esta enfermedad crónica. Así mismo, está indicada la vacunación contra neumococo para disminuir el riesgo de padecer enfermedad neumocócica invasiva, en especial en aquellos con asma grave.
SEGUIMIENTO
La monitorización clínica, de la función pulmonar y de los eventos adversos debe ser periódica. En los niños con asma leve o moderada el seguimiento clínico puede ser trimestral y con espirometría pre- y posbroncodilatador anual, y
en aquellos con asma grave el acompañamiento clínico puede ser incluso mensual, con la revisión de la función pulmonar cada seis meses, la cual incluye determinar si el VEF1 y la CVF están mostrando el incremento esperado con el crecimiento. Pueden presentarse variaciones en la programación de consultas de control según las particularidades de cada caso. Siempre que no se esté logrando el control de la enfermedad a pesar del manejo apropiado, hay que preguntarse si el diagnóstico es correcto, observar los factores que inciden en la falta de control, en especial la adhesión, la técnica inhalatoria y las comorbilidades, y de acuerdo con ello ajustar o complementar el manejo.
La educación sigue siendo la intervención principal para favorecer la aceptación y el entendimiento de la enfermedad, promover y seguir el plan de manejo, fortalecer la adherencia, reconocer y tratar oportunamente las exacerbaciones, y prevenir y controlar los desencadenantes. Contar con un plan de acción escrito que guíe el cuidado en las situaciones de estabilidad y de exacerbación y tener una red de apoyo familiar y asistencial con una perspectiva integral son cruciales para maximizar los resultados esperados. En esta misma línea, es recomendable fortalecer los programas ambulatorios de manejo y seguimiento del asma, y ampliar la cantidad de centros dedicados al cuidado coordinado y al apoyo interdisciplinario y experto para reducir la carga de la enfermedad.
APUNTES EN MEDICINA PERSONALIZADA EN ASMA
La medicina personalizada en asma funciona en torno a la identificación de marcadores clínicos, biológicos y genéticos que caractericen mejor al paciente y su asma, y a la vez permitan el desarrollo de intervenciones diagnósticas y terapéuticas tempranas y oportunas para cada necesidad. Por esto, es deseable la determinación de fenotipos y endotipos en pediatría,
Asma cada vez más frecuente Volumen 22 Número 2 Precop SCP 26
el enfoque individualizado basado en rasgos tratables y en predictores de respuesta a medicamentos para el asma, así como el abordaje personalizado según los desencadenantes. Todo lo anterior está en concordancia con la precisión en el manejo, la adherencia y la monitorización a largo plazo de una enfermedad
LECTURAS RECOMENDADAS
1. Beasley R, Semprini A, Mitchell EA. Risk factors for asthma: is prevention possible? Lancet. 2015;386(9998):107585. doi: 10.1016/S0140-6736(15)00156-7.
2. British Thoracic Society; Scottish Intercollegiate Guidelines Network. British guideline on the management of asthma. A national clinical guideline. Londres: British Thoracic Society; Scottish Intercollegiate Guidelines Network; 2019.
3. Dennis RJ, Caraballo L, García E, Rojas MX, Rondon MA, Pérez A, et al. Prevalence of asthma and other allergic conditions in Colombia 2009-2010: a crosssectional study. BMC Pulm Med. 2012;12:17. doi: 10.1186/1471-2466-12-17.
4. Expert Panel Working Group of the National Heart, Lung, and Blood Institute (NHLBI) administered and coordinated National Asthma Education and Prevention Program Coordinating Committee (NAEPPCC); Cloutier MM, Baptist AP, Blake KV, Brooks EG, Bryant-Stephens T, et al. 2020 Focused Updates to the Asthma Management Guidelines: A Report from the National Asthma Education and Prevention Program Coordinating Committee Expert Panel Working Group. J Allergy Clin Immunol. 2020;146(6):1217-1270. doi: 10.1016/j.jaci.2020.10.003.
5. Forno E, Gogna M, Cepeda A, Yañez A, Solé D, Cooper P, et al. Asthma in Latin America. Thorax. 2015;70(9):898-905. doi: 10.1136/thoraxjnl-2015-207199.
6. Gaillard EA, Kuehni CE, Turner S, Goutaki M, Holden KA, de Jong CCM, et al. European Respiratory Society clinical practice guidelines for the diagnosis of asthma in children aged 5-16 years. Eur Respir J. 2021;58(5):2004173.
multifactorial; sin embargo, su implementación parte de reducir o evitar el infradiagnóstico del asma que posiblemente es debido a las dificultades de acceso a la atención en salud y su continuidad, y las brechas en la adquisición o el mejoramiento de las competencias clínicas y administrativas que ayudarían al diagnóstico.
7. GEMA 5.2. Guía Española para el Manejo del Asma. Madrid: Sociedad Española de Neumología y Cirugía del Tórax; 2022. Disponible en: https://se-fc.org/wpcontent/uploads/2022/05/GEMA-5.2-Final.pdf
8. Global Strategy for Asthma Management and Prevention. GINA; 2022. Disponible en: https://ginasthma.org/ wp-content/uploads/2022/07/GINA-Main-Report2022-FINAL-22-07-01-WMS.pdf
9. Kaminsky DA, Simpson SJ, Berger KI, Calverley P, de Melo PL, Dandurand R, et al. Clinical significance and applications of oscillometry. Eur Respir Rev. 2022;31(163):210208. doi: 10.1183/16000617.0208-2021.
10. Martin J, Townshend J, Brodlie M. Diagnosis and management of asthma in children. BMJ Paediatr Open. 2022;6(1):e001277. doi: 10.1136/bmjpo-2021-001277.
11. National Institute for Health and Care Institute - NICE. Asthma: diagnosis, monitoring and chronic asthma management. NICE guideline [NG80]; 2017 [actualizado el 22 de marzo de 2021]. Disponible en: www.nice.org. uk/guidance/ng80
12. Patel SJ, Teach SJ. Asthma. Pediatr Rev. 2019;40(11):549567. doi: 10.1542/pir.2018-0282.
13. Porsbjerg C, Melén E, Lehtimäki L, Shaw D. Asthma. Lancet. 2023;401(10379):858-873. doi: 10.1016/ S0140-6736(22)02125-0.
14. Serebrisky D, Wiznia A. Pediatric Asthma: A Global Epidemic. Ann Glob Health. 2019;85(1):6. doi: 10.5334/ aogh.2416.
Jenny Jurado Hernández, Iván Francisco Álvarez Orozco Volumen 22 Número 2 Precop SCP 27
Neumonía adquirida en la comunidad
INTRODUCCIÓN
La neumonía es una enfermedad que ha estado presente a lo largo de la historia, fue descrita por Hipócrates (c. 460 a. C.-370 a. C.) con detalles de sus características clínicas e inclusive la descripción del manejo de complicaciones asociadas, y representa una alta morbimortalidad en la historia humana. Fue hasta la llegada de la microbiología moderna y de la antibioticoterapia cuando se marcó un hito en el pronóstico de los pacientes con neumonía; pese a ello y la tecnología del siglo XXI, incluido el diagnóstico molecular, la neumonía es la principal causa de mortalidad mundial individual infantil.
La tasa de mortalidad varía entre países desarrollados y no desarrollados y es mayor en las regiones de Asia Meridional y África Subsahariana; según datos de la Organización Mundial de la Salud, para el 2019 tenía una mortalidad de 740 180 en niños menores de 5 años, lo que representa el 14 % de las defunciones en todo el mundo. El Fondo de las Naciones
Unidas para la Infancia (UNICEF) estima que cada 45 segundos muere un niño por causa de la neumonía, lo que quiere decir que mientras leemos este capítulo están muriendo niños por la carga de esta enfermedad.
Pese a su prevalencia, tiene definiciones variables, poca tipificación etiológica y altas tasas de mortalidad que se acentúan en entornos sociales de riesgo, lo que aumenta la carga de la enfermedad en la salud pública. Por lo anterior, representa una necesidad imperante para el pediatra conocer las características fisiopatológicas, clínicas, terapéuticas, sus complicaciones y estrategias preventivas, con el fin de mejorar el panorama y la carga que representa esta enfermedad.
DEFINICIÓN
La neumonía adquirida en la comunidad (NAC) se define como presencia de fiebre, síntomas respiratorios agudos o ambos, con compromiso
Volumen 22 Número 2 Precop SCP 28
1. Presidente de la Sociedad Colombiana de Pediatría. Pediatra, servicio de hematooncología pediátrica, Fundación Hospital Infantil Napoleón Franco Pareja (HINFP). Cartagena, Colombia.
2. Pediatra Infectólogo. Magíster en Epidemiología. Fundación Clínica Infantil Club Noel. Universidad Libre, seccional Cali. Cali, Colombia.
3. Residente tercer año de Pediatría, Universidad del Sinú. Cartagena, Colombia.
Mauricio Guerrero Román1
Juan Pablo Rojas Hernández2
Jesly Hael Doria Atencia3
del parénquima respiratorio evidente en el examen físico o en la radiografía de tórax por la presencia de infiltrados cuando es posible realizarla.
La Organización Mundial de la Salud (OMS) define para países de ingresos medios y bajos, donde las radiografías de tórax no están de forma rutinaria, la presencia de tos, dificultad para respirar, taquipnea o tiraje torácico como signos patognomónicos de neumonía.
TIPOS DE NEUMONÍA
• Adquirida en la comunidad: Infección pulmonar aguda en un individuo previamente sano cuyo contagio ocurre en la comunidad (fuera de entornos hospitalarios).
• Neumonía atípica o errante: describe a pacientes mayores de 5 años o en edad escolar y adultos jóvenes con signos clínicos “atípicos”, y suele no requerir ingreso hospitalario. Predominan las infecciones por virus y bacterias no encapsuladas.
• Neumonía asociada a los cuidados de la salud: se desarrolla dentro de las 48 horas posteriores a la admisión hospitalaria.
ETIOLOGÍA SEGÚN EL GRUPO ETARIO
La neumonía representa un desafío para el clínico y puede tener diversas causas tanto infecciosas como no infecciosas. Aunque las causas infecciosas son más comunes, también existen algunas causas no infecciosas que pueden desencadenar esta enfermedad (Figura 1). Siempre es importante considerar estas causas no infecciosas al evaluar y tratar a un niño con neumonía adquirida en la comunidad, ya que su identificación temprana puede guiar el enfoque terapéutico y prevenir complicaciones adicionales.
Con respecto a la etiología infecciosa, en la mayoría de los casos no se puede documentar
- Viral
- Bacteriana
Infecciosa
- Alimento
Aspiración
- Jugo gástrico
- Cuerpo extraño
un microorganismo específico y su etiología varía según la edad, y las causas virales son las más frecuentes en los pacientes entre 29 días y 4 años de edad. Los virus más comunes son virus respiratorio sincitial, rinovirus humano, metapneumovirus humano y adenovirus; cerca del 25 % de los pacientes que requieren hospitalización tienen coinfección viral-viral ( Tabla 1).

Según la progresión de la edad aumentan las causas bacterianas; por ejemplo, en los pacientes entre 5 y 12 años, pese a que la etiología viral sigue siendo la causa más común de NAC, los gérmenes atípicos como el Mycoplasma empiezan a destacarse, y el principal microorganismo causal de neumonías bacterianas es el Streptococcus pneumoniae.
Recientes estudios destacan que en el 17 % de los pacientes con tos prolongada con previo pródromo viral o con síntomas clásicos de tosferina se logra el aislamiento de Bordetella pertussis, debido a que la inmunidad disminuye con el paso del tiempo; por esto debe considerarse entre las opciones diagnósticas. Los adolescentes tienen
Volumen 22 Número 2 Precop SCP 29
Mauricio Guerrero Román, Juan Pablo Rojas Hernández, Jesly Hael Doria Atencia
Figura 1. Etiología de la neumonía.
Imagen propiedad de los autores.
Reacciones de hipersensibilidad
Neumonitis inducida por fármacos o por radiación
Tabla 1. Etiología de la neumonía según la edad
Etiología de neumonía no complicada según la edad
1-3 meses 3 meses a 6 años > 6 años
Streptococcus pneumoniae S. pneumoniae M. pneumoniae
Chlamydia trachomatis Mycoplasma pneumoniae C. pneumoniae
Bordetella pertussis Clamydophila pneumoniae S. pneumoniae
Staphylococcus aureus Haemophilus influenzae Rinovirus humano
Ureplasma urealyticum Virus sincitial respiratorio Influenza A y B
Virus sincitial respiratorio Rinovirus humano Virus sincitial respiratorio
Rinovirus humano Metapneumovirus humano Metapneumovirus humano
Metapneumovirus humano Adenovirus Parainfluenza 1, 2 y 3
Adenovirus Influenza A y B Coronavirus
Influenza A y B Parainfluenza 1, 2 y 3 Adenovirus
Parainfluenza 1, 2 y 3
Coronavirus
Coronavirus Mycobacterium tuberculosis
Modificada de: Popovsky EY et al. En: Janes S (editor). Encyclopedia of Respiratory Medicine. 2.a edición. Elsevier; 2022. p. 119–131.
etiologías más similares a los adultos, y los virus siguen siendo la causa más común.
La población neonatal dista de los diferentes grupos etarios, ya que tienen riesgo de neumonía congénita adquirida perinatalmente por contaminación ascendente de patógenos o por diseminación hematógena, e inclusive riesgo de neumonía de aparición temprana que se asocia a gérmenes del canal vaginal.
Dentro de los agentes bacterianos más frecuentes se destaca el S. pneumoniae (neumococo). Con la introducción de la vacuna antineumocócica conjugada heptavalente (PCV-7; serotipos 4, 6B, 9V, 14, 18C, 19F y 23F) aumentaron los casos del serotipo 19A; fenómeno explicado por el reemplazo de serotipos, no contenidos en PCV-7. Ulteriormente se desarrollaron otras vacunas conjugadas, entre ellas la decavalente (PCV-10), que añade a la heptavalente los serotipos 1, 5 y 7F conjugados a 13 μg de la proteína D del H. influenzae no tipificable.
Finalmente, la vacuna conjugada tridecavalente (PCV-13) contiene polisacáridos capsulares de 13 serotipos de S. pneumoniae (4, 6B, 9V, 14, 18C, 19F, 23F –incluidos en la PCV7– más los serotipos 1, 3, 5, 6A, 7F y 19A), todos conjugados a una mutante no tóxica de la toxina diftérica (CRM197). El esquema acogido en Colombia es el de administrar a los 2 y 4 meses y un refuerzo a los 12 meses (esquema 2 + 1) de PCV-13. Quienes tengan factores de riesgo, entre ellos los pacientes con anemia de células falciformes, después de los 2 años requieren la aplicación de vacunación antineumocócica polisacárida 23 valente (PPSV-23).
Aunque la vacunación marca una protección ante esta enfermedad, los niños con situaciones especiales, como la anemia de células falciformes, corren el riesgo de infecciones por gérmenes encapsulados o patógenos menos usuales, frecuentes en los pacientes inmunodeprimidos ( Tabla 2).
Neumonía adquirida en la comunidad Volumen 22 Número 2 Precop SCP 30
Tabla 2 Etiología en circunstancias especiales
Etiología de neumonía en circunstancias especiales
Inmunosuprimidos No vacunados Anemia de células falciformes
S. pneumoniae S. pneumoniae Organismos encapsulados, S. pneumoniae, H. influenzae tipo B
S. aureus S. aureus B. pertussis
Fibrosis quística
H. influenzae tipo B
S. aureus
P. aeruginosa H. influenzae tipo B M. pneumoniae Stenotrophonionas maltophilia
Micobacterias Varicela
Pneumocystis jirovecii Rubeola
Hongos (Aspergillus)
P. aeruginosa
Achromobacter xylosoxidans
Hongos
Burkholderia cepacia
Modificada de: Popovsky EY et al. En: Janes S (editor). Encyclopedia of Respiratory Medicine. 2.a edición. Elsevier; 2022. p. 119–131.
FISIOPATOLOGÍA SEGÚN LA ETIOLOGÍA
Neumonía viral
Las neumonías de etiología viral son consecuencia de la inoculación directa del virus en las vías respiratorias superiores; después de la inhalación de secreciones infecciosas o fómites en los entornos infantiles, el virus baja distalmente por el tracto respiratorio y logra la desepitelización y degradación celular, lo que genera la pérdida de formación del surfactante y, por consiguiente, la formación de membranas hialinas y edema pulmonar, el cual se exacerba gracias a la infiltración de los mononucleares , que desencadenan un aumento en la cascada de citocinas, y esto se traduce en edema y en disminución del área para el intercambio gaseoso (Figura 2).
El diámetro del calibre de la vía respiratoria, asociado a la falta de poros de Kohn, hace más propenso a los lactantes menores a tener atelectasias y sibilancias durante los episodios
de neumonía, lo que se traduce en una predisposición a enfermedad viral más grave.
Neumonía bacteriana
Para el desarrollo de la neumonía de etiología bacteriana se requiere la alteración específica del mecanismo de defensa pulmonar contra patógenos bacterianos: epitelio ciliado, macrófagos alveolares, sistema retículo-endotelial o respuesta inmunitaria innata. Una alteración en cualquiera de estos mecanismos representa la posibilidad de ingreso bacteriano, colonización y destrucción celular.
Entre los factores determinantes está la desepitelización generada por infección viral previa en el tracto respiratorio superior, lo que genera un aumento del riesgo de colonización bacteriana; es decir, los cambios en el microbioma nasofaríngeo representan un factor determinante para la colonización bacteriana. Una vez colonizadas, las bacterias migran por inhalación, aspiración o por diseminación hematógena, como en el caso de S. pneumoniae , que es el
Volumen 22 Número 2 Precop SCP 31
Mauricio Guerrero Román, Juan Pablo Rojas Hernández, Jesly Hael Doria Atencia
patógeno bacteriano más común en pediatría y se adhiere a los bronquios, se multiplica e inicia la cascada inflamatoria alveolar con liberación de exudado, que en las fases iniciales está mayoritariamente compuesto por fibrina y linfocitos polimorfonucleares (hepatización roja) con un posterior aumento de la actividad de macrófagos (hepatización blanca), y a su vez favorece la proliferación en alveolos adyacentes, lo que provocaría una neumonía multilobar (Figura 3).
Cuando es causada por S. aureus, la destrucción tisular es mayor, lo que genera más frecuentemente manifestaciones de enfermedad complicada: abscesos pulmonares y necrosis.
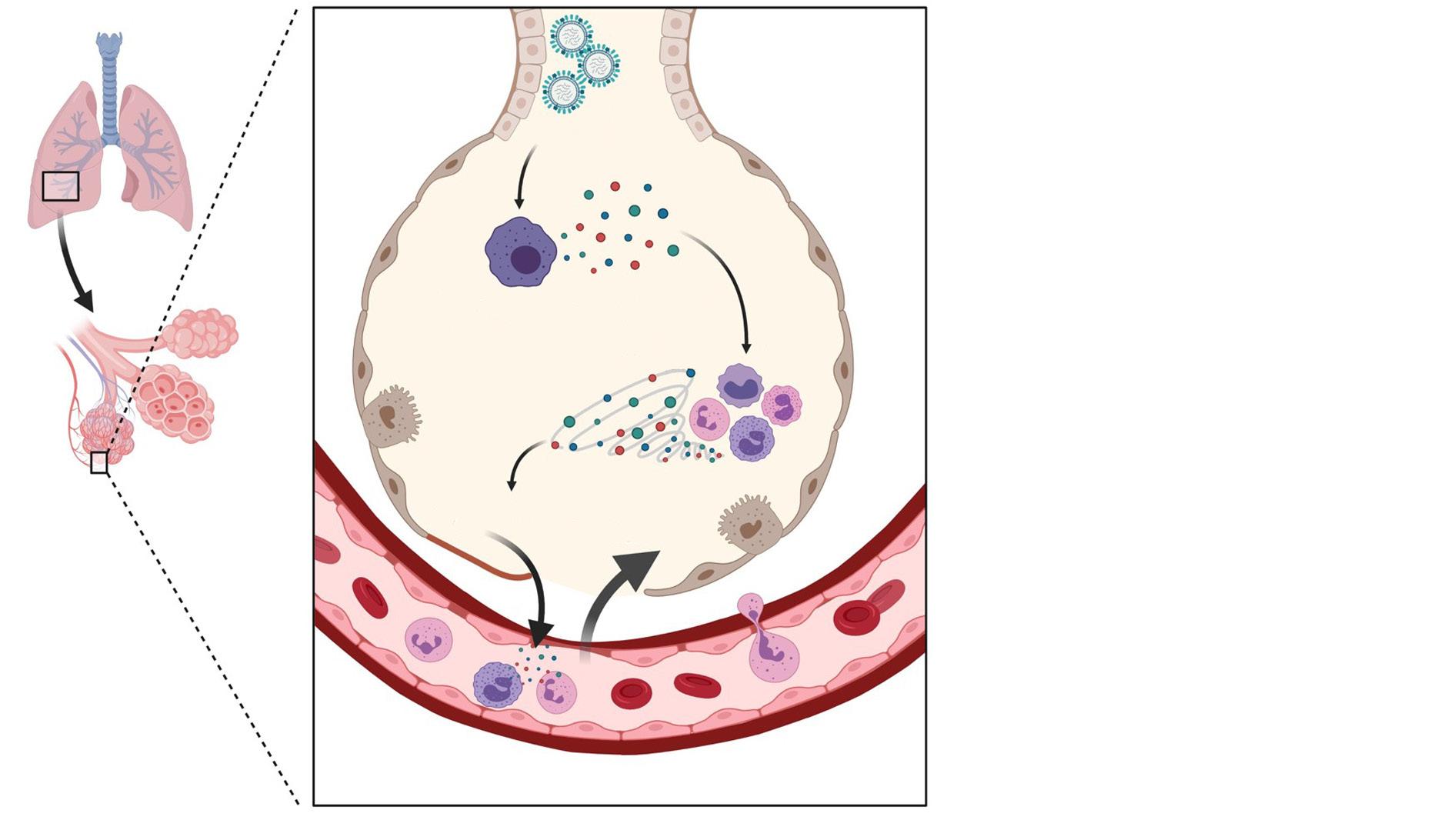
MANIFESTACIONES CLÍNICAS
No existe una presentación clínica universal, lo que se convierte en una dificultad para el diagnóstico clínico. Según los estudios de investigación, los hallazgos en el examen físico más frecuentes son sibilancias y signos de dificultad
El
El sistema inmunitario reconoce al virus y produce citocinas
Las citocinas atraen células inmunitarias que producen más citocinas y desregulación inmunitaria
Se genera una lesión pulmonar y una respuesta inflamatoria
Daño endotelial, extravasación tisular, mayor susceptibilidad a infecciones
respiratoria; los hallazgos como crépitos o sibilancias dependen mucho de la subjetividad y no se ha demostrado la asociación con los hallazgos radiológicos.
Los síntomas pueden variar según la edad e incluyen tos, taquipnea, disnea, fiebre, sibilancias y dolor en el pecho; los síntomas no respiratorios pueden incluir letargo, irritabilidad, mala alimentación, dolor abdominal y vómitos, especialmente en niños < 5 años.
Resulta difícil diagnosticar esta entidad por la variedad de los síntomas, sumado a que estos signos están presentes en NAC de manera muy variable. Pese a que en algunas definiciones se incluyen los hallazgos radiológicos, como en las guías desarrolladas por la Sociedad de Enfermedades Infecciosas Pediátricas (PIDS) y la Sociedad de Enfermedades Infecciosas de América (IDSA), se desaconseja el uso rutinario de radiografías en pacientes sin requerimiento de manejo intrahospitalario, apoyados por la OMS, que recomienda el uso de signos clínicos simples para dirigir la terapia antibiótica óptima,
Neumonía adquirida en la comunidad Volumen 22 Número 2 Precop SCP 32
Figura 2. Fisiopatología NAC viral.
1 1 2 2 3 3 4 4 5 5 Macrófagos
Lesión Edema
Imagen elaborada por los autores.
Tormenta de citocinas
virus infecta el pulmón
y se usa como punto de referencia inicial la frecuencia respiratoria según el grupo de edad ( Tablas 3 y 4).
DIAGNÓSTICO DIFERENCIAL
Incluye infecciones del tracto respiratorio, anomalías cardíacas e inclusive cuadros autoinmunes o gastrointestinales.
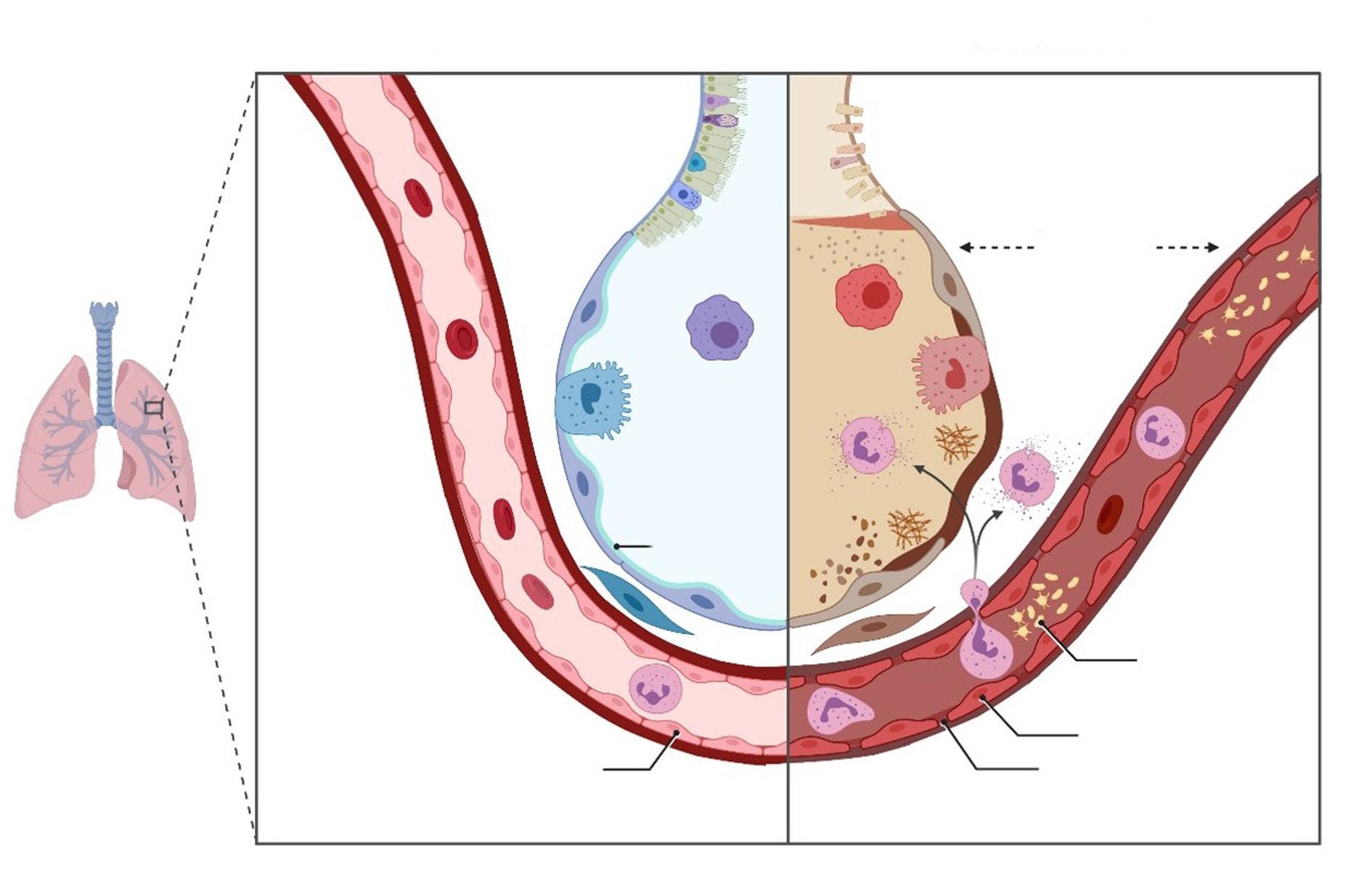
La anamnesis debe ser minuciosa, centrada en la duración y calidad de la tos, presencia o no de fiebre y síntomas asociados. Aunque el dolor abdominal y los episodios eméticos tienen múltiples diagnósticos diferenciales, los pacientes con neumonías basales o complicadas que comprometen el dermatoma de T9 pueden tener dolor pulmonar o abdominal. En pacientes con neumonía recurrente o complicaciones graves se deben considerar inmunodeficiencias o fibrosis quística. En caso de que la recurrencia
sea en el mismo lóbulo, se deben considerar alteraciones anatómicas.
Sobre todo en los adolescentes, es importante tener en cuenta la lesión pulmonar asociada al uso de cigarrillos electrónicos, que puede presentar síntomas como fiebre, escalofríos, tos, dolor torácico e inclusive abdominal.
DIAGNÓSTICO
Debido a que el diagnóstico guiado solo por los signos y síntomas representa un desafío, es esencial una historia clínica minuciosa. Lo cierto es que las características clínicas no distinguen la etiología de la neumonía.
Imágenes
La radiografía representa el estándar de referencia en entornos que la dispongan, pese a ello
Volumen 22 Número 2 Precop SCP 33
Mauricio Guerrero Román, Juan Pablo Rojas Hernández, Jesly Hael Doria Atencia
Figura 3. Fisiopatología NAC bacteriana.
Glóbulos rojos
Imagen elaborada por los autores.
Alvéolo sano Lesión alveolar Endotelio celular Macrófago alveolar Neumocito Sps II Neumocito Sps I Surfactante Fibroblasto Destrucción celular
Ensanchamiento del intersticio por edema
Activación de neutrófilos Migración de neutrófilos
Fibrina Neutrófilos Plaquetas Células del endotelio vascular inflamadas Brecha
OMS para las tasas respiratorias por edad
Traducido y modificado de: Dirlewanger et al. Eur J Pediatr. 2002;161(8):460-1.
Tabla 4. Definición clínica de neumonía según la OMS
Tirajes Cianosis central o no puede beber
*Fiebre ≥ 38 °C axilar. **Ver tablas de frecuencias. Traducido y modificado de: Dirlewanger et al. Eur J Pediatr. 2002;161(8):460-1.
no es 100 % sensible o específica. Se sugiere realizar radiografía de tórax a los pacientes con hipoxemia (saturación < 90 %) o dificultad respiratoria significativa; la directriz PIDS/IDSA recomienda doble proyección, mientras que la Sociedad Torácica Británica recomienda no realizar proyecciones adicionales.
La tomografía de tórax se debe considerar ante hallazgos como infiltrados nodulares, neumonía necrosante, derrame pleural o abscesos, aunque no es rutinaria. La ecografía pulmonar es una ayuda diagnóstica emergente muy útil, gracias a la ausencia de radiación y su portabilidad; no obstante, no existen pautas formales de uso, la limitante es que se trata de un procedimiento dependiente del operador.
Lo cierto es que no se recomienda de forma rutinaria el uso de imágenes de control, las radiografías están indicadas en pacientes sin mejoría clínica en las 48-72 horas después del inicio del antibiótico; en los casos específicos de neumonía recurrente lobar o con colapso lobar se pueden realizar imágenes de control
en 4 a 6 semanas para evaluar la posibilidad subyacente de colapso alveolar, masa torácica o aspiración de cuerpo extraño.
Paraclínicos
Estudios microbiológicos
Hay múltiples desafíos para la tipificación microbiológica en la NAC pediátrica: el rendimiento de los hemocultivos es muy bajo, por lo que no se recomienda la realización en niños sanos e inmunizados en manejo ambulatorio; a los pacientes críticos con neumonía grave, que requieren hospitalización según las guías PIDS/IDSA, se les debe realizar la toma de hemocultivos pese a que su rendimiento en caso de bacteriemia oscila entre 2,5 % y 7 %; dada la tasa baja de crecimiento bacteriano, se sugiere un enfoque específico para obtener hemocultivos en neumonía complicada:
• paciente no inmunizado completamente;
• falla terapéutica de forma ambulatoria;
• menores de 6 meses;
Neumonía adquirida en la comunidad Volumen 22 Número 2 Precop SCP 34
Edad FR normal aproximada Taquipnea 0-2 meses 40-60 rpm > 60 rpm 2-12 meses 25-40 rpm > 50 rpm 1-5 años 20-30 rpm > 40 rpm > 5 años 15-20 rpm > 20 rpm
Tabla 3. Criterios de la
Fiebre* Taquipnea**
Estadio I (no grave) + + Estadio II (grave) + + + Estadio III (muy grave) + + + +
• acceso venoso central;
• neumonía complicada, incluidos los casos con derrame pleural, ya que tienen tasas más altas de bacteriemia (> 10 %).
Se sugiere realizar el hemocultivo de forma rutinaria en estos pacientes, de preferencia antes de la administración de antibióticos.
El cultivo de esputo se utiliza en adultos; sin embargo, en población pediátrica no es confiable. Entre las opciones microbiológicas se incluyen pruebas serológicas y de reacción en cadena de la polimerasa (PCR); las pruebas moleculares están disponibles de manera comercial en paneles respiratorios sindrómicos, con especificidad alta, pero sensibilidad variable; independientemente del panel, la interpretación debe ser cuidadosa teniendo en cuenta el contexto clínico al momento de la toma de decisiones.
Reactantes de fase aguda
El hemograma no se recomienda de forma rutinaria en el manejo de la neumonía para pacientes ambulatorios; pese a que el recuento de glóbulos blancos puede estar elevado en neumonía bacteriana, el grado de elevación no diferencia la etiología bacteriana de la viral. Con respecto a la procalcitonina, para diferenciar la infección viral de la bacteriana, en general las concentraciones de procalcitonina son más altas en niños con infección bacteriana que por microorganismos virales o atípicos.
La proteína C-reactiva actúa como un reactante de fase aguda producido por el hígado posterior al estímulo de las citocinas, tiene baja sensibilidad y especificidad para diferenciar la etiología, por lo que las guías actuales no recomiendan su uso. La velocidad de sedimentación globular (VSG) o procalcitonina se usan de forma rutinaria como biomarcadores para diferenciar entre las infecciones de origen viral y bacteriano.
TRATAMIENTO
Según la gravedad de los pacientes, se debe determinar la pertinencia de manejo intrahospitalario o ambulatorio; se sugiere el hospitalario en los siguientes casos:
• según las guías PIDS/IDSA, si la saturación es < 90 % al aire ambiente. Tener en cuenta los valores de saturación establecidos de acuerdo con la altitud en donde resida el paciente;
• si hay deshidratación o incapacidad para alimentar al niño;
• si existe riesgo social que imposibilite una atención segura en el domicilio.
La Sociedad Británica del Tórax recomienda el uso de antibiótico en los niños con diagnóstico claro de neumonía y, a su vez, sugieren un enfoque de indicaciones para el manejo ambulatorio. En menores de 4 años con síntomas leves, de etiología viral con ausencia de hallazgos que sugieran coinfección viral-bacteriana, no se debe administrar antibiótico.
El manejo ambulatorio se sugiere en menores de 5 años con amoxicilina oral en dosis de 90 mg/kg/día en dos dosis. En mayores de 5 años, la primera línea de tratamiento varía entre la amoxicilina y los macrólidos ( Tabla 5).
El tratamiento de los pacientes hospitalizados comienza con el manejo estabilizador de base; la recomendación en pacientes con intolerancia a la vía oral, signos de septicemia o neumonía complicada es ofrecer terapia endovenosa.
El manejo de primera línea intrahospitalario es ampicilina o penicilina cristalina en pacientes inmunizados y ceftriaxona o cefotaxima en niños graves, no totalmente inmunizados o en zonas de resistencia intermedia a la penicilina (Figura 4). En caso de sospecha de infección por M. pneumoniae o Chlamydia pneumoniae ,
Volumen 22 Número 2 Precop SCP 35
Mauricio Guerrero Román, Juan Pablo Rojas Hernández, Jesly Hael Doria Atencia
Medicamento
Tabla 5. Medicamentos y dosificación
Dosis
Amoxicilina 90 mg/kg/día vía oral dividida en 2 tomas (máximo 4 g/día) durante 7-10 días
Azitromicina 10 mg/kg/día por vía oral durante 1 día (máximo 500 mg/día), luego 5 mg/kg/día por vía oral (máximo 250 mg/día) durante 4 días
Claritromicina 15 mg/kg/día por vía oral en 2 dosis divididas (máximo 1 g/día) durante 7-10 días
Eritromicina 40 mg/kg/día por vía oral en 4 dosis divididas (máximo 2 g/día) durante 7-10 días
Fuente:Traducido de: Messinger AI et al. Pediatr Rev. 2017;38(9):394-409.
se sugiere agregar un macrólido oral o parenteral, la vía de administración no modifica la biodisponibilidad.
La Academia Estadounidense de Pediatría en su algoritmo de manejo sugiere sospechar S. aureus en pacientes con influenza y neumonía superpuesta, así como en aquellos con enfermedad rápidamente progresiva o signos y síntomas de sepsis o choque tóxico; aunque la ampicilina
proporciona un cubrimiento adecuado frente al S. pyogenes, es necesario ampliar la cobertura contra S. aureus resistente a la meticilina (SARM) teniendo en cuenta la epidemiología local con los patrones de influenza que se muestran en la Figura 4.
En pacientes con saturación ≤ 92 % se sugiere la suplementación con el fin de mantener saturaciones en las metas.
Iniciar tratamiento con diagnóstico de neumonía
Primera línea: Ampicilina IV
Alergia a las penicilinas: Ceftriaxona IV
Alergias a los β-lactámicos: Levofloxacina IV/O
¿Es SARM con cobertura deseada?
Clindamicina IV/O o Vancomicina IV
Adaptar la terapia al microorganismo y susceptibilidad
SARM: S aureus resistente a la meticilina.
Traducido de: Messinger AI et al. Pediatr Rev. 2017;38(9):394-409.
Neumonía adquirida en la comunidad Volumen 22 Número 2 Precop SCP 36
No añadir terapia adicional Sí No
Figura 4. Algoritmo de manejo en neumonía.
Los antivirales específicos para influenza se recomiendan en pacientes con influenza confirmada o infección grave complicada o progresiva, con criterios de hospitalización. Se sugiere seguir las recomendaciones de los Centros para el Control y Prevención de Enfermedades (CDC) para definir el uso de un antiviral contra la influenza:
• enfermedad grave, complicada o progresiva;
• menores de 2 años;
• comorbilidad de base:
- Trastornos pulmonares crónicos (incluido el asma);
- Cardiovasculares (excepto hipertensión aislada);
- Renales, hepáticos, hematológicos (incluida la enfermedad de células falciformes);
• metabólicos o endocrinos (incluida la diabetes mellitus):
- índice de masa corporal ≥ 40 kg/m2 .
- enfermedades neurológicas y del neurodesarrollo;
- inmunodepresión, incluida la inmunosupresión debida a medicamentos o infección por virus de la inmunodeficiencia humana (VIH);
- adolescentes que están embarazadas o en posparto (dentro de las 2 semanas posteriores al parto).
TRATAMIENTO COMPLEMENTARIO
Los antipiréticos pueden mejorar la comodidad de los pacientes, los corticoides no se recomiendan en las guías actuales, pero hay ensayos aleatorizados que describen el uso de corticoides sistémicos para la reducción de disnea en pacientes con neumonía atípica.
El papel del sulfato de zinc para el manejo de neumonía es inconsistente en el momento, pero su papel potencial a nivel inmunitario, sobre todo en pacientes con déficit de zinc, sugiere mejorías en la respuesta inmunitaria. El surfactante en ensayos aleatorizados no se
recomienda para el tratamiento de neumonía bacteriana.
SEGUIMIENTO CLÍNICO
Se debe evaluar respuesta terapéutica dentro de 48 horas a 72 después del inicio del tratamiento, si continua con mala evolución las guías de PIDS/IDSA sugieren:
• remitir al centro de mayor complejidad según la gravedad;
• evaluar estudios de extensión y progresión de tipo imagenológico;
• determinar patrones de resistencia, evaluando la posibilidad de requerimiento de lavado broncoalveolar para tinción de Gram y cultivo.
Criterios de alta
Para el egreso se debe documentar mejoría clínica > 24 horas, no requerimiento de suplencia de oxígeno y saturación ambiente > 90 % > 24 horas (comentario: 92 % en nuestro medio). Para los pacientes con tubo torácico, el alta es apropiada después de retirar el tubo 12-24 horas si cumple con la ausencia de deterioro a la extracción del tubo y la no reacumulación de derrame paraneumónico o neumotórax.
PRONÓSTICO
En la gran mayoría de los pacientes el pronóstico es bueno, la neumonía viral se resuelve solo con medidas de soporte y la clave para un buen pronóstico recae en un diagnóstico temprano y un manejo apropiado.
COMPLICACIONES
Las complicaciones asociadas a neumonía son empiema, derrame pleural, absceso pulmonar, neumonía necrosante y septicemia.
Volumen 22 Número 2 Precop SCP 37
Mauricio Guerrero Román, Juan Pablo Rojas Hernández, Jesly Hael Doria Atencia
LECTURAS RECOMENDADAS
1. Akashi Y, Hayashi D, Suzuki H, et al. Clinical features and seasonal variations in the prevalence of macrolideresistant Mycoplasma pneumoniae. J Gen Fam Med. 2018;19(6):191-197.
2. Al Hazzani AA, Bawazeer RAB, Shehata AI. Epidemiological characterization of serotype group B Streptococci neonatal infections associated with interleukin-6 level as a sensitive parameter for the early diagnosis. Saudi J Biol Sci. 2018;25(7):1356-1364.
3. Arif F. Updated Recommendations Of Rcog On Prevention Of Early Onset Neonatal Group B Streptococcus Infection. J Ayub Med Coll Abbottabad. 2018;30(3):490.
4. Bradley JS, Byington CL, Shah SS, et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America. Clin Infect Dis. 2011;53(7):e25-76.
5. Cevey-Macherel M, Galetto-Lacour A, Gervaix A, et al. Etiology of community-acquired pneumonia in hospitalized children based on WHO clinical guidelines. Eur J Pediatr. 2009;168(12):1429-36.
6. Chen JC, Jenkins-Marsh S, Flenady V, et al. Early-onset group B streptococcal disease in a risk factor-based prevention setting: A 15-year population-based study. Aust N Z J Obstet Gynaecol. 2019;59(3):422-429.
7. Cutts FT, Zaman SM, Enwere G, et al. Efficacy of nine-valent pneumococcal conjugate vaccine against pneumonia and invasive pneumococcal disease in The Gambia: randomised, double-blind, placebo-controlled trial. Lancet. 2005;365(9465):1139-46.
8. Dirlewanger M, Krahenbuhl JD, Fanconi S, et al. Community-acquired pneumonia in children aged 2 months to 5 years: application of the WHO guidelines in a developed country setting (Switzerland). Eur J Pediatr. 2002;161(8):460-1.
9. Dryahina K, Sovová K, Nemec A, et al. Differentiation of pulmonary bacterial pathogens in cystic fibrosis by volatile metabolites emitted by their in vitro cultures: Pseudomonas aeruginosa, Staphylococcus aureus, Stenotrophomonas maltophilia and the Burkholderia cepacia complex. J Breath Res. 2016;10(3):037102.
10. GBD 2016 Lower Respiratory Infections Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory infections in 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis. 2018;18(11):1191-1210.
11. Gessner BD, Sutanto A, Linehan M, et al. Incidences of vaccine-preventable Haemophilus influenzae type b pneumonia and meningitis in Indonesian children: hamlet-randomised vaccine-probe trial. Lancet. 2005;365(9453):43-52.
12. Guía de práctica clínica en el tratamiento del niño con neumonía adquirida en la comunidad (internet). Medellín: Asociación colombiana de neumología pediátrica. 2010.
13. Gupta GR. Tackling pneumonia and diarrhoea: the deadliest diseases for the world’s poorest children. Lancet. 2012;379(9832):2123-4.
14. Harris M, Clark J, Coote N, Fletcher P, Harnden A, McKean M, Thomson A; British Thoracic Society Standards of Care Committee. British Thoracic Society guidelines for the management of community acquired pneumonia in children: update 2011. Thorax. 2011 Oct;66 Suppl 2:ii1-23.
15. Liu YN, Zhang YF, Xu Q, et al. Infection and co-infection patterns of community-acquired pneumonia in patients of different ages in China from 2009 to 2020: a national surveillance study. Lancet Microbe. 2023;4(5):e330-e339.
16. Martí-Carvajal AJ, Conterno LO. Antibiotics for treating community-acquired pneumonia in people with sickle cell disease. Cochrane Database Syst Rev. 2016;11(11):CD005598.
Neumonía adquirida en la comunidad Volumen 22 Número 2 Precop SCP 38
17. Messinger AI, Kupfer O, Hurst A, et al. Management of Pediatric Community-acquired Bacterial Pneumonia. Pediatr Rev. 2017;38(9):394-409.
18. Omer SB, Sutanto A, Sarwo H, et al. Climatic, temporal, and geographic characteristics of respiratory syncytial virus disease in a tropical island population. Epidemiol Infect. 2008;136(10):1319-27.
19. Popovsky EY, Florin TA. Community-Acquired Pneumonia in Childhood. En: Janes S (editor). Encyclopedia of Respiratory Medicine. 2.a edición. Elsevier; 2022. p. 119–131.
20. Rudan I, Nair H, Marušić A, Campbell H. Reducing mortality from childhood pneumonia and diarrhoea: The leading priority is also the greatest opportunity. J Glob Health. 2013;3(1):010101.
21. Rudan I, O’Brien KL, Nair H, et al. Epidemiology and etiology of childhood pneumonia in 2010: estimates of incidence, severe morbidity, mortality, underlying risk factors and causative pathogens for 192 countries. J Glob Health. 2013;3(1):010401.
22. Saraya T. Mycoplasma pneumoniae infection: Basics. J Gen Fam Med. 2017;18(3):118-125.
23. Verhoeven D. Influence of Immunological Maturity on Respiratory Syncytial Virus-Induced Morbidity in Young Children. Viral Immunol. 2019;32(2):76-83.
24. Wu X, Sun T, Cai Y, et al. Clinical characteristics and outcomes of immunocompromised patients with severe community-acquired pneumonia: A singlecenter retrospective cohort study. Front Public Health. 2023;11:1070581.
Volumen 22 Número 2 Precop SCP 39
Mauricio Guerrero Román, Juan Pablo Rojas Hernández, Jesly Hael Doria Atencia
Fibrosis quística
Iván Stand, MD1
Daniela Páez Jiménez, MD2
María Rosa Vega, MD3
INTRODUCCIÓN
La fibrosis quística (FQ) es un trastorno genético, autosómico recesivo, que provoca daños graves en las vías respiratorias y digestivas secundarios a la alteración física y química de las secreciones producidas por las glándulas del organismo. A pesar de que se conoce una prevalencia de aproximadamente 70 000 personas enfermas en el mundo, la FQ es la enfermedad hereditaria más frecuente en caucásicos, con consecuencias en la expectativa de vida. En Estados Unidos la incidencia es de 1:1900 a 1:3700, a diferencia de Asia (1:32 000) y África (1:15 000), que revelan una incidencia más baja. En cuanto a los países latinoamericanos, no hay información clara de su prevalencia, aunque se estima 1 caso por cada 9000 recién nacidos vivos. En 1989, se identifica el gen afectado en FQ y desde ese momento se han descubierto más de 2000 mutaciones que pueden codificar algún defecto de la enfermedad. La mutación Df508- localizada en el cromosoma 7q31.2 es la más encontrada y corresponde a la pérdida del aminoácido fenilalanina en la posición 508.
FISIOPATOLOGÍA
La proteína producida por el gen regulador de la conductancia transmembrana (CFTR) es una glucoproteína transportadora de membrana dependiente del monofosfato de adenosina cíclico (AMPc), responsable de los canales de transporte de iones de cloro y sodio en células epiteliales. La CFTR se encuentra en la membrana apical de células epiteliales de las vías aéreas, glándulas submucosas del tracto gastrointestinal, hígado, vesícula biliar y páncreas.
En FQ se ha demostrado que la mutación en el gen que codifica la CFTR ocasiona un transporte anormal de iones principalmente del cloro, que ocasiona secreciones deshidratadas y viscosas que conllevan a taponamiento de las vías respiratorias con moco espeso y afectación en la función pulmonar progresivamente; a nivel digestivo, insuficiencia pancreática y hepatopatía, además de la deshidratación por pérdida de iones en el sudor, o la azoospermia obstructiva por agenesia de los conductos aferentes, que condiciona a infertilidad en hombres.
Volumen 22 Número 2 Precop SCP 40
1. Neumólogo Pediatra, Clínica Porto Azul. Docente del posgrado de Pediatría, Universidad del Norte y Universidad Simón Bolívar.
2. Residente de Pediatría, Universidad del Norte.
3. Residente de Pediatría, Universidad del Norte.
A pesar de existir más de 2000 mutaciones para CFTR, se han clasificado en 6 clases distintas que reflejan anormalidades en la síntesis, estructura y función ( Tabla 1). La clase II es la más común y mejor caracterizada, una copia (phe508del) está presente en el 70 % de la población afectada y 2 copias están en aproximadamente el 50 %. La cantidad de CFTR funcional presente en la superficie celular, que está determinado por el genotipo, explica de alguna forma el amplio espectro de fenotipos en FQ, que correlaciona la cantidad y gravedad de órganos afectados. Las mutaciones de clase I, II y III están asociadas con la aparición temprana de síntomas respiratorios y manifestaciones digestivas, mientras que las mutaciones de clase IV y V se asocian a síntomas respiratorios más leves y tardíos, además de suficiencia pancreática.
el epitelio, pero a su vez, al evitar apoptosis y fagocitosis, se acumulan en las vías respiratorias y esto ocasiona un deterioro en la función ciliar, además de paralizar el aclaramiento bacteriano y degradar las proteínas estructurales, lo que se manifiesta como bronquiectasias.
MANIFESTACIONES CLÍNICAS
El diagnóstico clínico de FQ se caracteriza por la triada de infecciones sinopulmonares recurrentes, esteatorrea y falla del medro. La insuficiencia pancreática exocrina puede estar presente en un 85 %. Las características del cuadro clínico dependerán no solo del genotipo y del tiempo de evolución sino también de la edad de inicio y el ritmo de progresión de la enfermedad.
Clase I Defecto de síntesis
Clase II Defecto de procesamiento y tráfico intracelular
Clase III Defecto de activación y regulación
Clase IV Defecto de conductancia
Clase V Reducción de la cantidad
Clase VI Renovación acelerada
Tabla elaborada por los autores.
En la enfermedad pulmonar ocasionada por FQ hay compromiso temprano de las vías aéreas, pues al transformarse el moco en una secreción espesa y deshidratada se impide el correcto aclaramiento mucociliar, lo que favorece la colonización bacteriana, y esto induce a una intensa respuesta inflamatoria incluso en pacientes con enfermedad leve. Aunque el paciente con FQ pueda encontrarse asintomático, presenta una inflamación neutrofílica en sus vías respiratorias que puede ser protectora y destructiva a la vez. Las proteasas de neutrófilos, incluidas las elastasas, son importantes para matar a las bacterias que se encuentran colonizando
• Prenatal: el hallazgo ecográfico prenatal de intestino hiperecogénico sugestivo de obstrucción intestinal está en el 10 % de fetos con FQ.
• Neonatal: retraso en el paso del meconio, el íleo meconial que conduce a obstrucción intestinal se manifiesta con dolor abdominal, asas intestinales distendidas que pueden complicarse hasta perforación y peritonitis en un 50 %. El prolapso rectal ocurre en el 20 %. Otras manifestaciones son el síndrome de depleción de sal, que se manifiesta con alcalosis metabólica, hiponatremia, hipopotasemia e hipocloremia; ictericia neonatal secundaria a estasis biliar; edema; hipoproteinemia; acrodermatitis entesopática resultado de la malabsorción; y enfermedad hemorrágica del recién nacido por deficiencia de vitamina K.
• Lactante: los síntomas respiratorios suelen ser su primera manifestación de la enfermedad, con tos, broncoespasmo y neumonías recurrentes. Algunos pueden presentar aumento del diámetro anteroposterior del tórax. El paciente con insuficiencia pancreática presentará heces voluminosas, brillantes y fétidas; falla del medro, pero
Iván Stand, Daniela Páez Jiménez, María Rosa Vega Volumen 22 Número 2 Precop SCP 41
Tabla 1. Clases de mutaciones de CFTR
con apetito conservado o aumentado, y distensión abdominal.
• Preescolar y escolar: las manifestaciones pulmonares y digestivas están presentes en un 85 %, y se caracterizan por neumonías a repetición, bronquiectasias, crisis de dolor abdominal, síndrome de obstrucción distal que se comporta similar al íleo meconial, prolapso rectal en un 15 %, infecciones en las vías aéreas superiores y esteatorrea asociada a desnutrición.
• Adolescente: los signos clínicos incluyen sinusitis, neumonías, asma mal controlada refractaria, poliposis, bronquiectasias e hipocratismo digital. A nivel gastrointestinal hay pobre ganancia de peso, esteatorrea, prolapso rectal, estreñimiento u obstrucción intestinal, pancreatitis y diabetes no autoinmune.
CRIBADO NEONATAL
El cribado neonatal con tripsina inmunorreactiva (TIR) presenta una buena eficacia diagnóstica, con una sensibilidad de 85,7 %, especificidad baja y un valor predictivo positivo bajo, lo que se traduce en una elevada cantidad de falsos positivos. Por tanto, lo recomendado es realizarlo a todos los recién nacidos, para que en conjunto con una segunda prueba se mejore la validez diagnóstica, con respecto a usarla sola. Actualmente se ha documentado que la introducción del cribado neonatal de FQ supone una evidente mejoría en la calidad de vida y supervivencia de estos pacientes, al realizar un diagnóstico precoz.
DIAGNÓSTICO
La Fundación Estadounidense de Fibrosis
Quística en su consenso sobre el diagnóstico de FQ concluye que el diagnóstico se hará con las manifestaciones clínicas asociadas a la documentación de disfunción de CFTR.
• Manifestaciones clínicas:
- enfermedad crónica sinopulmonar con colonización bacteriana o infección persistente de vías aéreas;
- alteraciones nutricionales y gastrointestinales que incluyen íleo meconial, cirrosis biliar, insuficiencia pancreática y falla del medro;
- síndrome de pérdida de sal;
- azoospermia obstructiva en hombres;
- historia de FQ en un hermano o primo hermano;
- cribado neonatal positivo.
• Disfunción de CFTR:
- concentración elevada de cloro en el sudor en 2 o más ocasiones;
- identificación de 2 mutaciones de CFTR.
En este consenso se indica que, al obtener un cribado neonatal positivo, se debe garantizar en el paciente de 36 semanas o más y con un peso mayor de 2 kg la realización de la prueba de sudor después de los 10 días de vida antes de finalizar etapa neonatal.
La prueba de sudor se considera la primera herramienta diagnóstica y debe realizarse siempre que exista una sospecha de FQ, y se confirma el diagnóstico al obtener reportes de 60 mEq/L. Cuando se obtienen valores no concluyentes (30-59 mEq/L), pero persiste la sospecha diagnóstica, se indica realizar el análisis genético de CFTR y en algunas ocasiones se hace necesario realizar pruebas ampliadas de CFTR que permiten el diagnóstico definitivo en la mayoría de los pacientes (Figura 1).
MANEJO DEL PACIENTE CON FIBROSIS QUÍSTICA
Cuidados generales
Manejo nutricional
En cada paciente existe un ambiente multifactorial y unipersonal influenciado por la gravedad de su patología pulmonar, la edad a la que se hizo su diagnóstico, el genotipo, el grado de funcionalidad pancreática, las costumbres alimentarias de su región, la dieta familiar,
Fibrosis quística Volumen 22 Número 2 Precop SCP 42
Presentación clínica de FQ: Cribado neonatal positivo Signos o síntomas Historia familiar
los suplementos nutricionales, entre otros; de forma general, estos pacientes tienen un mayor gasto energético debido a las pérdidas aumentadas y la mala utilización de nutrientes, por lo que el aporte deberá ser entre 125 % y 130 % de las recomendaciones dadas para un niño sano. Una vez hecho el diagnóstico debe evaluarse en todo paciente el estado de suficiencia pancreática mediante el dosaje de elastasa; si esta se encuentra en niveles inferiores a 200 μg/g de materia fecal, determina que el paciente es insuficiente pancreático y deberá suplementarse con enzimas pancreáticas y vitaminas liposolubles.
Fisioterapia respiratoria
Las técnicas de drenaje de las secreciones pulmonares en pacientes con patologías pulmonares crónicas constituyen un pilar en su atención integral; por su parte, las técnicas que deben ser utilizadas en esta mucoviscidosis deben poseer ciertas características: ser eficientes, de fácil aplicación, y que promuevan la adherencia y el automanejo de la enfermedad. No existe una pauta universal para cada niño, estas deben individualizarse. A continuación, se resumen algunas de las múltiples estrategias disponibles (Figura 2).
Iván Stand, Daniela Páez Jiménez, María Rosa Vega Volumen 22 Número 2 Precop SCP 43
fisiológico de CFTR Diagnóstico de FQ no resuelto FQ confirmada FQ improbable
Figura 1. Algoritmo diagnóstico de FQ.
Prueba de sudor Estudio genético de CFTR Estudio
≤ 29 mEq/L Sin mutaciones de CFTR Función conservada de CFTR 30-59 mEq/L Genotipo de CFTR desconocido Estudio no disponible ≥ 60 mEq/L ≥ 2 mutaciones de CFTR Disfunción de CFTR Imagen elaborada por los autores.
• Drenaje postural: esta técnica incluye el uso de la gravedad en posiciones de drenaje postural, la percusión y la vibración. La percusión consiste en un aplauso rítmico en la pared torácica del paciente con una mano ahuecada, mientras se le pide que respire profundamente. Las vibraciones son oscilaciones finas de las manos colocadas sobre la pared torácica y dirigida hacia el interior intentando una coordinación con la exhalación. Al utilizar técnicas manuales con recién nacidos y niños muy inmaduros deben tomarse precauciones para evitar movimientos excesivos de la cabeza.
• Técnica respiratoria de espiración (TEF): se lleva a cabo mediante una combinación de una o dos espiraciones forzadas combinadas con períodos de control de la respiración; esta técnica se puede iniciar en diferentes volúmenes pulmonares y ayuda a despejar las vías aéreas de distinto calibre. Los huffings a volumen pulmonar bajo remueven secreciones distales y a volúmenes pulmonares altos moviliza las secreciones más proximales. No es aconsejable su uso en pacientes con hiperreactividad de la vía aérea, puede ser utilizada en niños pequeños desde los 18 meses.
• Presión espiratoria positiva (PEP): se produce mediante un dispositivo mecánico que genera presión en la boca en forma continua o discontinua. El objetivo es evitar el colapso precoz de la vía aérea y mejorar la ventilación
colateral, de modo que desarrolla un gradiente de presión distal a la obstrucción y logra desplazar las secreciones hacia las vías más centrales desde donde pueden ser eliminadas con más facilidad. Existen en el mercado varios dispositivos disponibles que generan presión continua, como el TheraPep®, y para creación de presión discontinua, el Flutter ®.
• Dornasa α : las secreciones respiratorias están formadas por la gran cantidad de ADN procedente de la degradación de neutrófilos presentes en las vías aéreas. La dornasa α es una forma recombinante de la enzima humana desoxirribonucleasa (DNasa), que digiere los polímeros de ADN extracelular liberados por los neutrófilos necrosados, y de este modo disminuye la viscosidad de las secreciones purulentas. Estudios robustos han demostrado que la inhalación de la misma una vez por día mejora la función pulmonar y reduce enfermedades respiratorias, por lo que cada vez más se aconseja su uso en edades tempranas.
La solución salina hipertónica hidrata las secreciones mucosas mediante la generación de gradientes osmóticos y mejora el aclaramiento mucociliar. La inhalación de solución salina hipertónica dos veces al día precedida del uso de broncodilatadores ha demostrado ser una terapia efectiva a la hora de mejorar el batido ciliar y la función pulmonar, y reducir las exacerbaciones.
PASIVAS
Drenaje postural, tos (todas las edades)
Drenaje postural, soplido (globos, flautas, burbujas), técnicas de espiración forzada
Ciclo activo de la respiración, drenaje autógeno, técnicas de espiración forzada, dispositivos de presión positiva, ejercicio y otros
Fibrosis quística Volumen 22 Número 2 Precop SCP 44 AUTOMANEJO TRANSICIÓN
Figura 2. Modelo de automanejo y técnicas utilizadas en la kinesiología respiratoria de pacientes con FQ.
Imagen elaborada por los autores.
Manejo de las infecciones respiratorias
El tratamiento antibiótico en los pacientes con FQ tiene como principal objetivo prevenir y controlar las infecciones respiratorias, este debe realizarse en forma precoz ante la aparición de los primeros gérmenes tales como la Pseudomonas aeruginosa, la infección crónica debe ser tratada para disminuir la morbilidad y aumentar la supervivencia de los pacientes portadores de esta patología. Se han dilucidado 3 fases en la infección respiratoria en FQ, que se describen a continuación.
• Primoinfección: se produce un primer cultivo positivo de P. aeruginosa, que suele tener cepas no mucosas y multisensibles. Los cultivos negativos después del primer cultivo pueden indicar una infección inicial abortada o la erradicación de P. aeruginosa luego del tratamiento antimicrobiano. Se considera erradicación cuando se obtienen, al menos, 2 cultivos negativos para P. aeruginosa realizados a partir de 1-2 semanas después de terminar el tratamiento y con una diferencia de 2-4 semanas entre sí.
• Infección intermitente: se obtienen resultados intermitentemente positivos y negativos en cultivos consecutivos después de una infección inicial. Puede reflejar una infección permanente con bajos niveles cuantitativos, heterogeneidad en la procedencia de las muestras, o erradicación aparentemente transitoria, pero con colonización persistente de los senos paranasales que provoca reinfecciones recurrentes. Los aislados tienen diferentes morfotipos, incluido el mucoso.
• Infección crónica: es habitual en la enfermedad avanzada. Aparecen colonias mucosas con diversidad de morfotipos, por la especialización y evolución adaptativa de P. aeruginosa a las condiciones del medio endobronquial. Las exacerbaciones, de causas mal conocidas, suelen coincidir con el aumento de la carga bacteriana o variaciones antigénicas.
Tratamiento de la primoinfección
El tratamiento frente a P. aeruginosa es la piedra angular para controlar la progresión de la enfermedad respiratoria. La erradicación de P. aeruginosa se consigue en pocas ocasiones una vez establecida la infección crónica, por lo que lo más eficaz es tratarla precozmente; existen muchos protocolos de erradicación los cuales son muy variados, sin que ninguno haya demostrado una clara superioridad. El tratamiento precoz de la infección inicial por P. aeruginosa retrasa la infección crónica y debe iniciarse tan pronto se realice el aislamiento, ya que consigue altas tasas de erradicación (63 %-100 %). Se recomienda iniciar un antibiótico inhalado durante un mes ( Tabla 2) y, posteriormente, se debe realizar un cultivo de control 1-2 semanas después de finalizar el tratamiento de erradicación.
Manejo de la exacerbación crónica
La administración prolongada de antibióticos ha demostrado eficacia en la infección crónica por P. aeruginosa, la vía de elección es la inhalada y los intervalos de administración son de 2 a 3 veces por día; no obstante, con algunos nebulizadores la dosis puede reducirse a la mitad. Recientemente se ha aprobado la tobramicina en polvo seco, de la que se registró una adecuada eficacia y su tolerabilidad en periodos on-off de 28 días ( Tabla 3).
Manejo de exacerbaciones
Las exacerbaciones aumentan la mortalidad, el deterioro respiratorio y de la calidad de vida. Sin embargo, actualmente no existe una definición consensuada; la terapia a elegir se basa generalmente en los estudios de sensibilidad obtenidos en el último reporte de cultivo. Tradicionalmente se emplean 2 antimicrobianos con diferente mecanismo de acción con el objetivo de favorecer su actuación y reducir la selección
Iván
Volumen 22 Número 2 Precop SCP 45
Stand, Daniela Páez Jiménez, María Rosa Vega
Tabla 2. Tratamiento antimicrobiano en la primoinfección bronquial por P. aeruginosa
Recomendaciones de manejo en infección por P. aeruginosa
Primer cultivo positivo por P. aeruginosa (primoinfección)
Sin clínica Comentario
- Colistina inhalada 1 mes, 0,5-2 millones U, 2-3 veces día +
- Ciprofloxacino oral 15-20 mg/kg 2 veces día 2-3 semanas o
- Tobramicina inhalada 28 días, 300 mg, 2 veces al día o
- Aztreonam inhalado 28 días, 75 mg, 3 veces al día
Realizar cultivo 1-2 semanas después de finalizar el tratamiento:
- si es negativo: prolongar la misma pauta de tratamiento continuo con colistina (máximo 3-6 meses) o con 1-3 ciclos on-off con tobramicina o aztreonam (máximo 6 meses) (II-A);
- si es positivo: repetir la misma pauta de tratamiento o cambiar por otra combinación (ciprofloxacino + un antibiótico inhalado no utilizado en el primer ciclo) (III-A). Realizar un nuevo cultivo 1-2 semanas después de finalizar el tratamiento y, si continúa siendo positivo, aplicar el protocolo de la infección crónica (I-A). Los protocolos de erradicación ensayados son muy variados, con pautas que incluyen antibióticos inhalados y orales. Si fracasan al menos 2 estrategias con esta pauta, se han propuesto antibióticos inhalados más IV simultáneamente (I-B).
Con clínica (seguir la recomendación de la infección crónica con exacerbación)
Tomada de: Cantón R et al. Arch Bronconeumol. 2015;51(3):140-50.
Tabla 3. Tratamiento antimicrobiano en la infección crónica por P. aeruginosa
Recomendaciones de manejo en infección por P. aeruginosa Infección crónica por P. aeruginosa
Clínica estable Comentario
- Colistina inhalada en tratamiento continuo, 0,5-2 millones U, 2-3 veces día o
- Tobramicina inhalada en ciclos on-off cada 28 días, 300 mg, 2 veces al día o
- Tobramicina inhalada en polvo seco en ciclos on-off, 112 mg, 2 veces al día o
- Aztreonam inhalado en ciclos on-off cada 28 días, 75 mg, 3 veces al día
Mantener la pauta inhalada mientras el riesgo-beneficio sea favorable. En afectación pulmonar moderada-grave o respuesta insuficiente en los ciclos on-off:
- emplear los antibióticos inhalados de manera continua, alternando/rotando sin períodos de descanso entre ellos o con intervalos off más cortos de 28 días;
- asociar un antibiótico oral o IV con actividad antipseudomonas según la sensibilidad, a demanda o en ciclos (cada 3-6 meses). Valorar mantener la pauta inhalada si está pautada con anterioridad;
- prolongar el tratamiento IV si no hay mejoría o existe afectación grave (3-4 semanas). En ausencia de respuesta al tratamiento o en multirresistencia, adecuar el tratamiento combinado IV al perfil de sensibilidad.
de mutantes resistentes. En las exacerbaciones leves a moderadas debe iniciarse el tratamiento con ciprofloxacino oral por 2-3 semanas; si estas son graves, suele recomendarse una
combinación de un β -lactámico antipseudomónico con un aminoglucósido a altas dosis ( Tabla 4).
Fibrosis quística Volumen 22 Número 2 Precop SCP 46
Tomada de: Cantón R et al. Arch Bronconeumol. 2015;51(3):140-50.
Tabla 4. Tratamiento antimicrobiano en la exacerbación por P. aeruginosa
Recomendaciones de manejo en infección por P. aeruginosa
Exacerbación leve Exacerbación grave
Tratamiento con un antibiótico oral con actividad antipseudomonas, 2-3 semanas:
- Ciprofloxacino (15-20 mg/kg/12 h)
- Ceftazidima IV 50-70 mg/kg/8 h o
- Cefepima IV 50 mg/kg/8 h 2-3 semanas + tobramicina IV 5-10 mg/kg/24 h o
- Amikacina IV 30-35 mg/kg/24 h 2-3 semanas
Tomada de: Cantón R et al. Arch Bronconeumol. 2015;51(3):140-50.
Nuevas terapias
Las terapias moduladoras del CFTR se han desarrollado para tratar la FQ en su defecto básico: el mal funcionamiento del canal. Sin embargo, hay que tener en consideración que estas no pueden ser usadas como tratamientos únicos. Existen dos tipos de terapias: las potenciadoras, que mejoran la apertura del canal de CFTR para incrementar el transporte del cloro cuando la proteína está inserta en la membrana apical, y las correctoras, que mejoran el tráfico intracelular de la proteína desde el retículo endoplásmico hacia la membrana celular. La Administración de Medicamentos y Alimentos (FDA) incluso ha realizado la aprobación incluso de terapias combinadas como la de elexacaftor + tezacaftor en 2019 y tezacaftor + ivacaftor; aunque por el momento son de alto costo, suponen grandes avances a un futuro promisorio para la población portadora de las mutaciones respondedoras a estos manejos.
LECTURAS RECOMENDADAS
1. Cantón R, Máiz L, Escribano A, Olveira C, Oliver A, Asensio O, et al. Consenso español para la prevención y el tratamiento de la infección bronquial por Pseudomonas aeruginosa en el paciente con fibrosis quística. Arch Bronconeumol. 2015;51(3):140-50. doi: 10.1016/j. arbres.2014.09.021.
PRONÓSTICO
La FQ es una patología genética que en nuestro medio sigue teniendo un diagnóstico tardío, lo cual impacta negativamente en la expectativa de vida. Por esta razón, sigue siendo importante la posibilidad de tener acceso oportuno a la realización de la tamización neonatal. Así mismo, una vez se haya establecido el diagnóstico, los pacientes deben ser seguidos por un equipo multidisciplinar con la finalidad de realizar el seguimiento y la elaboración de un plan de acción competente que integre los requerimientos nutricionales, medicamentosos y kinesiológicos, y el manejo antibiótico en caso de que se requiera. Por lo anterior, todo pediatra debe estar familiarizado con los últimos conocimientos relacionados con este tema, así como con el desarrollo de las nuevas terapias dirigidas a mejorar la funcionalidad de la proteína CFTR, las cuales parece que pueden cambiar a mediano-largo plazo las expectativas de vida y el pronóstico en esta población.
2. Comité Nacional de Neumonología, Comité Nacional de Nutrición, Comité Nacional de Gastroenterología, Grupo de Trabajo de Kinesiología. Guía de diagnóstico y tratamiento de pacientes con fibrosis quística. Actualización. Arch Argent Pediatr 2021;119(1):S17-S35. . doi: 10.5546/aap.2021.S17.
Iván Stand,
Volumen 22 Número 2 Precop SCP 47
Daniela Páez Jiménez, María Rosa Vega
Fibrosis quística
3. Davis SD, Ferkol T. Identifying the origins of cystic fibrosis lung disease. N Engl J Med. 2013;368(21):2026-8. doi: 10.1056/NEJMe1303487.
4. Escobar H, Sojo A. Fibrosis quística: protocolos diagnósticos y terapéuticos en pediatría. En: Asociación Española de Pediatría (editor). Protocolos diagnósticos y terapéuticos en pediatría [Internet]. AEPED. p. 99–110. Disponible en: http://www.aeped.es/sites/default/files/ documentos/10-FQ.pdf
5. Farrell PM, White TB, Ren CL, Hempstead SE, Accurso F, Derichs N, et al. Diagnosis of Cystic Fibrosis: Consensus Guidelines from the Cystic Fibrosis Foundation. J Pediatr. 2017;181S:S4-S15.e1. doi: 10.1016/j. jpeds.2016.09.064.
6. Lubovich S. Fibrosis quística diagnóstico y tratamiento. En: IX Curso latinoamericano de actualización en
neumonología pediátrica a distancia. Argentina:2021.p 1-22.
7. Moscoso GD. Actualización en kinesiología respiratoria en pacientes con fibrosis quística. Neumol Pediatr. 2017;12(4):182-6.
8. Paranjape SM, Mogayzel PJ Jr. Cystic fibrosis. Pediatr Rev. 2014;35(5):194-205. doi: 10.1542/pir.35-5-194.
9. Ruiz de Valbuena M. Fibrosis quística y sus manifestaciones respiratorias. Sección neumología infantil Hospital infantil Universitario La Paz. Pediatría Integral. 2016;20(2):119-27.
10. Vásquez C, Aristizábal R, Daza W. Fibrosis quística en Colombia. Neumología Pediátrica. Neumol Ped. 2010; 5(1):44-50.
Volumen 22 Número 2 Precop SCP 48
Importancia del sueño en pediatría
Iván Francisco Álvarez Orozco1
Sonia Restrepo Gualteros2
INTRODUCCIÓN
En la mitología griega, el sueño fue designado como hypnos y la palabra en latín equivalente a sueño es somnus. Hypnos es el dios del sueño y su hermano Thanatos es el dios de la muerte, ambos hijos de la Nix (noche). El sueño es un estado fisiológico, rítmico y dinámico caracterizado por una disminución periódica, transitoria y reversible de la conciencia, una reducción de la respuesta a los estímulos externos, acompañada de cambios fisiológicos en procesos neuroendocrinos y de trasmisión neuronal compleja, de vital importancia en la correcta integración de los sistemas que operan en el sistema nervioso central.
FUNCIONES DEL SUEÑO
El sueño es una función básica en la vida del niño y el adulto, hasta el punto de que ocupa la tercera parte de la vida de un ser humano y es la actividad a la que más tiempo dedica el niño
en sus primeros años de vida. No obstante, a pesar de los avances en el campo de la medicina del sueño en los últimos años, aún se plantean muchos interrogantes por aclarar.
Las funciones del sueño han sido objeto de varias teorías que podemos agrupar en tres grandes ítems:
1. Mecanismo conservador de energía.
2. Facilitador del aprendizaje y la memoria a través de la generación de cambios en la plasticidad neuronal y sinaptogénesis.
3. Proceso de restauración de varios componentes celulares y biosíntesis de macromoléculas y protección contra el estrés oxidativo.
En una mirada más profunda, las funciones de los estados del sueño difieren y están en relación con sus cambios a través de la vida del niño; es así como se ha sugerido que el sueño N-REM (non-rapid eye movement o sueño sin movimientos oculares rápidos) desempeña un papel primordial en la conservación de la
Volumen 22 Número 2 Precop SCP 49
1. Pediatra, Universidad de Cartagena. Neumólogo pediatra, Universidad El bosque. Experto en Medicina de Sueño, Asociación Colombiana de Medicina de Sueño. Neumocenter, Valledupar, Colombia.
2. Neumóloga pediatra, Universidad El Bosque. Presidente, Asociación Colombiana de Neumología Pediátrica. Experta en Medicina del Sueño, Asociación Colombiana de Medicina del sueño.
energía, mientras que el sueño REM (rapid eye movement o sueño con movimientos oculares rápidos) está involucrado en la recuperación del sistema nervioso, el aprendizaje, la plasticidad neuronal y la sinaptogénesis.
El sueño tiene una clara relación con el adecuado funcionamiento del sistema inmunológico, los cambios endocrinológicos, cardiovasculares y neuronales que pueden afectar el desarrollo y bienestar físico, neurológico y mental del niño. Estudios en humanos y animales muestran que el sistema sueño-vigilia y el sistema inmunológico están estrechamente relacionados, de tal manera que un adecuado tiempo y calidad de sueño ayudan a restaurar el apropiado funcionamiento del sistema inmunológico. Algunos trabajos han mostrado que un sueño insuficiente se relaciona con debilidad en la respuesta del sistema inmunológico a las vacunas y al riesgo de infecciones. Identificar de forma temprana los trastornos de sueño es de vital importancia para evitar malos desenlaces en salud en la población infantil.
EPIDEMIOLOGÍA
Existe una alta prevalencia de trastornos del sueño comparables en forma global con patologías como el asma. Se estima que el 12% de los niños experimentan problemas diarios asociados con el sueño, mientras que el 76%
experimentan problemas de sueño en forma ocasional. Poblaciones pediátricas con patologías asociadas, como trastornos del neurodesarrollo, epilepsia, condición de Down, enfermedades neuromusculares, alteraciones craneofaciales, déficit de atención e hiperactividad y autismo, así como asma y otras condiciones alérgicas, tienen una prevalencia más elevada, que oscila entre el 50% y el 90% de los casos. Un estudio de prevalencia de problemas neurológicos en Europa ubicó a los problemas del sueño en tercer lugar en términos de prevalencia e impacto, solo superado por la cefalea y los trastornos de ansiedad; este estudio mostró que los costos secundarios a los trastornos del sueño fueron alrededor de 35 billones de dólares en el año 2010, más que los costos asociados con la epilepsia y la esclerosis múltiple juntas.
La mayoría de los trastornos del sueño que presentan los niños y adolescentes los podemos agrupar en dos grandes categorías: disomnias y parasomnias. En la Tabla 1 se presenta la clasificación de estos trastornos del sueño. Las disomnias interfieren con el proceso de inicio del sueño. Síntomas como dificultad para conciliar el sueño y quedarse dormido en momentos inapropiados del día son característicos de las disomnias.
Por otro lado, las parasomnias producen una disrupción del sueño una vez que se ha producido el inicio de este; manifestar un
Disomnias
Insomnio: resistencia a la hora de acostarse Terrores nocturnos
Trastornos del ritmo circadiano sueño-vigilia (inicio retardado del sueño)
Parasomnias
Sonambulismo
Trastornos del sueño relacionados con la respiración Trastorno de alimentación relacionado con el sueño
Narcolepsia Pesadillas
Trastornos del movimiento rítmico
Adaptada de: American Academy of Sleep Medicine; 2014.
Importancia del sueño en pediatría Volumen 22 Número 2 Precop SCP 50
Tabla 1. Clasificación de los trastornos del sueño
comportamiento sugerente de vigilia mientras que se está dormido es característico de las parasomnias. Por esta razón, se les suele llamar como parasomnias de excitación parcial; es decir, el niño parece estar parcialmente despierto.
La mayoría de las parasomnias ocurren dentro del primer tercio del ciclo del sueño junto con la transición del sueño delta a las etapas de sueño más ligero. En la Tabla 2 se enumeran las principales características de las diferentes parasomnias en la niñez.
El sueño ha sido de los tópicos olvidados en la medicina general y la pediatría, en particular desde la etapa de formación, donde los estudios han mostrado que el tiempo invertido en formación en sueño ocupa menos de 4,4 horas en
promedio durante la residencia de pediatría en Estados Unidos de Norteamérica. Esto lleva a que durante la entrevista los médicos no realicen preguntas en relación con el sueño y que los padres también obvien este tópico asumiendo como normal muchas situaciones que no lo son, lo que ha generado un infradiagnóstico por parte de los médicos de atención primaria, pediatras, neuropediatras y neumólogos pediatras. Por su parte, la no intervención oportuna da lugar a una afectación negativa sobre el crecimiento somático y la salud física y mental de los niños.
Es por ello por lo que es menester que los profesionales de la salud (médicos de atención primaria, pediatras y psicólogos), las instituciones sanitarias, las universidades, los servicios sociales y los entes gubernamentales conviertan
Pesadillas Terrores nocturnos Sonambulismo Despertares confusionales
A cuántos niños afecta A casi todos Menos del 10% Menos del 20% Menos del 20%
Edad en la que es más común Entre 6 y 10 años Entre 4 y 12 años Entre 8 y 12 años Menos de 5 años
Momento cuando tiende a ocurrir Última mitad de la noche Primera mitad de la noche Primera mitad de la noche Primera mitad de la noche
Emoción primaria Miedo Miedo y confusión Confusión Confusión
Comportamiento Se despierta de repente Se sienta y grita Se levanta de la cama y camina Se sienta y mira al frente, se agita en la cama
Apariencia Asustado y alerta Aterrorizado y confundido, temblando y sudando
Calma Agitado y confundido
Sonidos Llora y describe un sueño Fuerte grito y llanto Tranquilo Habla confusa, llantos o gritos
Respuesta Busca consuelo No responde o se resiste al consuelo
Insensible Agitado y se resiste a consolarlo
Volver al sueño normal Demorado Rápido Rápido Rápido
Recuerdo del evento Recuerdo claro Sin recuerdo Poca o ninguna memoria Poca o ninguna memoria
Adaptada de: Moon R. American Academy of Pediatrics; 2013.
Iván
Volumen 22 Número 2 Precop SCP 51
Francisco Álvarez Orozco, Sonia Restrepo Gualteros
Tabla 2. Características de las diferentes parasomnias en los niños
la educación en sueño en una prioridad y de esta manera participen en la difusión de la importancia del sueño en la salud de los niños y adolescentes y se adopte como rutina la evaluación del sueño normal y la tamización de sus trastornos en la consulta médica.
EVOLUCIÓN DEL SUEÑO EN LA NIÑEZ Y SU ABORDAJE EN LA PRÁCTICA
Cuando enfrentamos al paciente pediátrico en la consulta, lo primero que debemos hacer para diagnosticar un posible trastorno del sueño es investigar y entender el comportamiento del niño despierto. Deberíamos enfocar nuestras preguntas sobre el rendimiento académico, la presencia de somnolencia diurna, el número y la duración de las siestas, la capacidad de atención reducida, los cambios de ánimo frecuentes sin causa aparente, la hiperactividad incrementada, las conductas agresivas e impulsivas y las medidas de higiene de sueño, la presencia de televisión, tabletas o videojuegos en la habitación y su frecuencia de uso, así como los horarios laborales de los padres que podrían afectar los hábitos de sueño en los niños.
Debido a que los trastornos del sueño en niños son diversos dependiendo del grupo etario, es importante adaptar herramientas de tamización y evaluación según la edad. Lo primero que debemos tener claro es qué es normal en cada edad, para lo cual se describirán los cambios fisiológicos normales que se presentan en el sueño desde la etapa de recién nacido hasta la adolescencia, los trastornos del sueño más frecuentes encontrados en cada ciclo del desarrollo y, de acuerdo con ello, los interrogantes que deben plantearse en cada etapa.
Sueño en el recién nacido
Hay muchas situaciones relacionadas con el sueño que pueden resultar muy estresantes para padres y cuidadores. Uno de los interrogantes
más comunes de los padres es la impresión de la inversión del ciclo vigilia-sueño entre la noche y el día. Aunque los padres pueden no notar una diferencia significativa en la distribución de las horas de sueño entre el día y la noche, ha sido demostrado que hay una tendencia desde los primeros días de nacido del bebé a dormir más durante la noche. Se ha estimado que los recién nacidos duermen, en promedio, 16 horas al día, con un patrón de sueño policíclico entre una y cuatro horas. Se considera que la naturaleza fragmentada del sueño a esta edad está en relación con la necesidad biológica de recibir alimentación frecuente y con la inmadurez de los mecanismos reguladores circadianos. El ciclo ultradiano recurrente de sueño REM y de sueño N-REM tiene una duración menor en los lactantes (50-60 minutos) que en los adultos (90-100 minutos) y se prolonga de manera gradual a través de la niñez y la adolescencia.
El sueño REM también evoluciona considerablemente durante el primer año de vida. Los recién nacidos pasan en el estado de sueño REM el 50% de su tiempo total de sueño y este porcentaje disminuye hasta el 40% a los 3-5 meses y hasta el 30% a los 6-23 meses. Se desconocen las razones por las que la elevada proporción del sueño REM tiene una función vital en el recién nacido; sin embargo, se ha postulado que el sueño REM puede desempeñar una función importante en la maduración cerebral durante las fases tempranas del desarrollo.
La anamnesis del sueño en el recién nacido debe incluir:
• Edad gestacional y complicaciones neonatales.
• Ingreso a cuidados neonatales.
• Presencia de apnea o historia familiar de BRUE (evento breve resuelto de causa inexplicable).
• Ambiente para dormir (dónde, cuánto y cómo duerme el bebé, comparte cama, exposición al tabaquismo, entre otros).
• Ambiente seguro para dormir (cuna separada y fuerte, ausencia de peluches o almohadas,
Importancia del sueño en pediatría Volumen 22 Número 2 Precop SCP 52
dormir boca arriba, evitar superficies blandas para disminuir el riesgo de asfixia, entre otros).
La experiencia de recién nacidos ingresados a cuidados neonatales genera inquietudes sobre el efecto de la sobreestimulación por sonidos continuos en relación con la monitorización y luz excesiva que pueden afectar el sueño de los bebés. Ha habido pocos estudios en este campo, pero simples intervenciones como la música disminuyen el estrés en los padres y mejoran la calidad del sueño en los recién nacidos.
Sueño en lactantes
A los 3-4 meses de edad, los lactantes desarrollan bloques de sueño más consistentemente, lo que produce un alivio en los padres quienes refieren que su bebé ahora duerme la noche completa, esto debido a que durante los primeros 6 meses de vida la secreción de melatonina madura progresivamente, con una fuerte correlación vista entre las concentraciones de melatonina y los ciclos de sueño/vigilia. Esta correlación está ausente en los niños con pérdida de la visión: la alteración en el patrón de sueño de niños invidentes mejora con la administración de melatonina exógena.
Las siestas empiezan a disminuir a los 6 meses de vida, aunque en las mayoría de los lactantes estas continúan durante el segundo semestre de vida. Es un período de cambios significativos en el patrón de sueño normal y las preguntas en esta etapa deben estar dirigidas en particular a los siguientes aspectos:
• Número y duración de las siestas; en total, estas no deben exceder las 3-4 horas.
• Tiempo total de sueño (sueño nocturno alrededor de 9-10 horas, tiempo total, 12-13 horas).
• Rituales y rutinas de sueño incipientes aparecen a esta edad.
• Presencia de cólicos, enfermedades (enfermedad por reflujo gastroesofágico, que ha
sido asociada con microdespertares y en algunas ocasiones con apnea y el uso de medicaciones).
• Antecedentes de BRUE.
• Desarrollo psicomotor (la alteración en el desarrollo psicomotor puede estar en relación con alteraciones del sueño; la hipotonía se relaciona con la presencia de hipoventilación).
• Uso de chupetes y biberones.
• Rutinas y comportamiento de los padres ante el llanto y las necesidades de sus bebés.
Sueño en niños preescolares y escolares
El sueño de los niños en edad preescolar y escolar se caracteriza por una evolución adicional de su duración y arquitectura. La duración diaria del sueño total disminuye desde un promedio de 13,2 horas a los 2 años hasta un promedio de 11,8 horas a los 4 años.
Los hábitos de sueño del niño preescolar son bifásicos, con el sueño concentrado en la noche y dos siestas durante el día. Las siestas diurnas también se reducen hasta una siesta diurna única durante el tercer año de la vida; para la edad de 6 años, las siestas se consideran anormales y sugieren un trastorno específico del sueño que debe investigarse. Así mismo, en esta etapa continúa una disminución del tiempo total de sueño y sueño REM en forma gradual con la edad.
En general, a los 2-3 años los niños son adaptados a las rutinas y rituales de la familia con respecto al sueño. El uso de medios audiovisuales, horarios extendidos de los padres o compartir habitación con los hermanos puede alterar los horarios de dormir.
Ciertas parasomnias tienen el pico de presentación a esta edad, como son los terrores nocturnos, que tienen una prevalencia del 3% al 5%; inicialmente empiezan su presentación a los 18 meses de edad, con un pico de presentación entre los 3 y 4 años, con resolución
Iván
Volumen 22 Número 2 Precop SCP 53
Francisco Álvarez Orozco, Sonia Restrepo Gualteros
espontánea en la preadolescencia. Ocurren cuando la persona es incapaz de despertarse completamente desde el sueño no REM. Se caracterizan porque durante la primera mitad de la noche, aproximadamente luego de tres horas de estar durmiendo, el niño presenta despertares bruscos durante el sueño profundo (de ondas lentas) con gritos, llanto durante aproximadamente 10 minutos, sensación de miedo y síntomas autonómicos como sudoración, taquicardias, respiración rápida y temblores. Los niños suelen referir ser atacados e intentan defenderse. No recuerdan el episodio y suelen tener antecedentes familiares, que se desencadenan luego de fiebre, estrés o privación de sueño. Usualmente generan mucha ansiedad en los padres, pero no para los niños, quienes no tienen recuerdo del evento al día siguiente.
El despertar confusional es el trastorno más frecuente en niños menores de 5 años, con una prevalencia del 15% al 20%. Se caracteriza por un despertar parcial, con desorientación y confusión, asociado a movimientos motores leves. Los niños pueden expresarse con un lenguaje coherente, lucen como si estuviesen despiertos, no presentan cambios autonómicos a diferencia de los terrores nocturnos. La forma infantil es benigna y tiende a disminuir con la edad. Cuando se presenta en niños mayores, suele evolucionar a sonambulismo en la adolescencia.
En los niños escolares o preadolescentes hay otros factores sociales y ambientales que también influyen con frecuencia en el sueño. En algunos casos las actividades a última hora de la tarde, como las tareas escolares que deben realizarse en casa, la televisión y las actividades deportivas, pueden dar lugar a un grado de estimulación suficiente como para retrasar la hora de acostarse y retrasar también el inicio del sueño, incluso si se mantienen horarios regulares para irse a la cama. El consumo de bebidas con cafeína y el uso de medicamentos que influyen sobre el sueño (por ejemplo, antidepresivos o estimulantes que se prescriben
frente al trastorno por déficit de atención con hiperactividad [TDAH]) también pueden alterar el inicio o la continuidad del sueño.
Los datos obtenidos mediante la prueba múltiple de latencia del sueño (PMLS) revelan que las latencias medias del sueño son sustancialmente mayores que las correspondientes a los adolescentes y los adultos, lo cual sugiere que los preadolescentes pueden presentar una tendencia intrínseca al sueño inferior a la de los adolescentes y los adultos. Se ha propuesto que esta puede ser una de las razones por las que los niños con trastornos del sueño no siempre actúan con somnolencia, además de que muestran una probabilidad mayor de experimentar sintomatología diurna de inatención e hiperactividad.
En esta edad, una de las parasomnias que debemos investigar es el sonambulismo, que afecta a niños entre los 4 y 8 años; aproximadamente, el 20%-40% de los niños presentan al menos un episodio de sonambulismo durante la vida. Consiste en la instauración durante el sueño N-REM de conductas motoras complejas que progresan hacia la deambulación; habitualmente, los niños están tranquilos, el episodio finaliza con el regreso del niño a la cama y con amnesia del evento a la mañana siguiente. La morbilidad del sonambulismo es el resultado de lesiones accidentales durante el episodio.
En cuanto a las pesadillas, las hay de comienzo temprano, a los 3 años, y de comienzo tardío, en la edad escolar. Se caracterizan por la aparición repetida de episodios prolongados, sueños vívidos y extremadamente perturbadores que típicamente incluyen amenazas a la supervivencia, la seguridad o peligro físico. Asimismo, se identifican porque aparecen al final de la noche en las cuales predomina el sueño REM: el niño se despierta, realmente tiene recuerdo del episodio y es difícil que vuelva a conciliar el sueño. Pueden ser espontáneas o recurrentes; estas últimas se asocian con problemas emocionales, trastorno de ansiedad y del comportamiento,
Importancia del sueño en pediatría Volumen 22 Número 2 Precop SCP 54
miedos nocturnos excesivos y resistencia para acostarse. El tratamiento no suele ser necesario, salvo en niños mayores en quienes la terapia conductual está indicada.
Las siguientes preguntas deben incluirse en la entrevista a esta edad:
• Rutina y rituales de sueño.
• Transición de la cuna a la cama alrededor de los 2, 3 o 5 años.
• Siestas (número y duración).
• Síntomas de déficit de atención, hiperactividad o cambios de comportamiento en la guardería y la escuela.
• Pesadillas o miedos nocturnos, sonambulismo.
• Ambiente para dormir (comparte habitación, uso de chupetes, entre otros).
• Somnolencia y problemas para despertar.
• Enuresis (no debe ocurrir más allá de los 6 años).
• Uso de dispositivos electrónicos.
• Alergias, asma o rinitis.
• Ronquido.
Sueño en el adolescente
La adolescencia es la etapa de la vida donde se presentan los cambios que marcan la transición entre la infancia y la vida adulta. La Organización Mundial de la Salud considera adolescencia al período que va desde los 10 hasta los 24 años.
El sueño tiene un papel fundamental en todas las etapas de la vida; en la adolescencia, para conseguir una adecuada salud, los adolescentes deben dormir entre 8 y 10 horas de forma regular; sin embargo, existe una variabilidad individual que está influenciada por factores genéticos, conductuales, médicos y ambientales.
El déficit de sueño produce alteraciones de la conducta, del rendimiento académico y del crecimiento y trastorna la vida en el entorno familiar. Por esta razón es necesario detectar tempranamente los trastornos del sueño,
estudiar las causas e intervenir en ellas para evitar las consecuencias del sueño insuficiente. El diagnóstico en ocasiones es un proceso complejo; por esto es importante entender cómo funciona el sueño del adolescente.
La transición desde la vigilia hasta el sueño se produce de forma paulatina. Durante la noche se alternan dos tipos de sueño: el sueño N-REM y el sueño REM.
El ciclo circadiano incluye un período de luz y oscuridad de 24 horas y está relacionado íntimamente con el sueño y la vigilia. Su ritmo lo controlan relojes biológicos con una programación genética.
El ritmo vigilia/sueño está regulado por el núcleo supraquiasmático del hipotálamo, que actúa como nuestro reloj biológico, el cual requiere de sincronizadores externos e internos que ayudan a mantener el ritmo organizado:
Los sincronizadores externos más relevantes son la luz y las normas o hábitos sociales.
En cuanto a los sincronizadores internos, los más importantes son la secreción de melatonina, el ritmo de la temperatura y el ritmo de secreción de cortisol.
Las hipótesis actuales apuntan a que el ritmo circadiano de 24 horas sufre un retardo durante la adolescencia, es decir, que la necesidad de sueño aparece más tarde y se cree que el ritmo de vigilia/sueño tendría una periodicidad de 25 a 26 horas. Esto podría ser una de las características del sueño en los adolescentes, que nunca encuentran el momento de acostarse, con un retraso de aproximadamente dos horas (retraso de fase) y por lo general retrasan el momento de levantarse.
Se ha visto además que el despertar ideal para el adolescente está alrededor de las 9 a 10 de la mañana.
Iván
Volumen 22 Número 2 Precop SCP 55
Francisco Álvarez Orozco, Sonia Restrepo Gualteros
Por lo anteriormente expuesto, la mayoría de los estudiantes llegan a clases privados de sueño. La cantidad de horas dormidas repercute directamente en el rendimiento escolar y la capacidad de aprendizaje. Así, el tener una buena noche de sueño después de una experiencia de aprendizaje es crítica para la retención de lo vivido.
La melatonina es la hormona que regula el ciclo de sueño-vigilia, inhibe el estado de vigilia y permite que se activen las estructuras que inician el sueño. Varía según el ciclo circadiano diario, con un pico máximo entre las 3:00 y las 4:00 a. m., para disminuir al amanecer con la luz.
Muchos adolescentes desarrollan actividades durante la noche: las demandas académicas, las redes sociales y la tecnología (televisión, móvil, tabletas, ordenadores, internet, entre otros), invaden el sueño ( jet lag social). La melatonina desciende con el brillo de las pantallas y al mantenerse estas activas durante la noche y no disminuir el nivel de actividad necesario alteran la conciliación del sueño. La presión social hace que el adolescente, que quiere ser aceptado por su grupo, sacrifique las horas de sueño. Este déficit, sumado al retraso de fase propio de la adolescencia, con frecuencia se perpetúa durante la semana y no se compensa en el fin de semana.
Otros factores que influyen de forma negativa en la calidad del sueño son el consumo de sustancias como la cafeína, que constituye el estimulante psicoactivo legal más consumido en la adolescencia y que posee un efecto que altera el sueño del adolescente; esta se encuentra en bebidas energéticas y estimulantes y es de fácil adquisición por esta población. El alcohol, el tabaco y el cannabis también influyen negativamente en el sueño. Además, los estados sentimentales son muy importantes en esta etapa. El estado afectivo de enamoramiento típico de esta edad se acompaña unas veces de
sensaciones de satisfacción, alegría y bienestar y otras de gran angustia y preocupación; ambos estados alteran el sueño.
Los trastornos mentales o emocionales ocurren hasta en un 20% de los adolescentes y con frecuencia se asocian a alteraciones del sueño. El trastorno mental más común es la depresión y es casi el doble de frecuente en las niñas. Existe una relación recíproca entre el insomnio y la depresión y cabe destacar que el insomnio es, además, un factor predictor independiente de suicidio.
Los trastornos del sueño en esta etapa de la vida son muy frecuentes, con rangos variables de prevalencia entre un 10% y un 40%, siendo más frecuentes en las jóvenes. No todos los adolescentes con dificultades del sueño tienen alteraciones que limitan su funcionamiento vital, pero a esta edad suelen minimizarse los síntomas, lo que en ocasiones hace difícil que los reconozcan como un problema.
Sumado a lo anterior, es frecuente que en esta etapa se inicie también la conducción de vehículos automovilísticos, lo que podría incrementar los accidentes de tráfico. Por esta razón, se han propuesto varias recomendaciones para mejorar la calidad del sueño durante esta época de la vida con el objetivo de mejorar el tiempo total de sueño, su calidad y de esta manera lograr el mejor desempeño emocional, escolar y físico en los adolescentes.
Dentro de estas recomendaciones se encuentran tener horarios regulares los días entre semana y los fines de semana, realizar actividad física, incluidos los fines de semana, mantener la habitación ventilada con suficiente oscuridad para la noche y suficiente iluminación en las mañanas, tener un desayuno rápido y sencillo todos los días y permitir, en los casos que sea necesario, realizar una siesta no mayor de 20 minutos. Las bebidas oscuras o energizantes deben restringirse al máximo.
Importancia del sueño en pediatría Volumen 22 Número 2 Precop SCP 56
Hasta ahora, la recomendación que ha tenido mejor evidencia para lograr el número de horas sugeridas para esta época de la vida (9 horas) es el ingreso escolar 30-45 minutos más tarde, lo que permite extender el tiempo de sueño con resultados muy favorables sobre el desempeño escolar y la mejoría en calidad de vida.
HERRAMIENTAS DIAGNÓSTICAS COMPLEMENTARIAS
Debemos tener en mente que existen muchos cuestionarios que investigan los síntomas relacionados con el sueño, algunos para ser llenados por padres, otros por los niños y algunos aplican para ambos, los cuales están diseñados con diferentes objetivos, como son el tipo de trastornos del sueño y los diferentes grupos etarios por evaluar. Es menester que los pediatras y médicos de atención primaria que ven niños en su consulta estén familiarizados con ellos. A continuación, enumeramos varios de los más conocidos en la medicina del sueño pediátrico:
1. Escala pediátrica de somnolencia diurna ( pediatric daytime sleepiness scale).
2. Cuestionario general sobre hábitos de sueño en los niños (children’s sleep habits questionnaire).
3. BEARS Questionnaire , dirigido a niños de 2 a 18 años (valora cinco aspectos del sueño: existencia de problemas al acostarse, somnolencia diurna excesiva, despertares nocturnos, regularidad y duración del sueño y presencia de ronquido). En la Tabla 3 se muestra esta herramienta.
4. Cuestionario pediátrico de sueño de Chervin, utilizado como tamización para apnea obstructiva del sueño. En la Tabla 4 se presenta la herramienta PSQ de Chervin para trastornos respiratorios del sueño.
5. Cuestionario para el cribaje del síndrome de piernas inquietas.
6. Brief Screening Questionnaire for Infant Sleep Problems (BISQ), herramienta de cribado
dirigida a detectar factores de riesgo para muerte súbita, rutinas para dormir y problemas de sueño en niños hasta de 2 años.
Otros métodos diagnósticos complementarios que nos ayudan en la confirmación de ciertos trastornos del sueño y en el diagnóstico diferencial son la polisomnografía, la poligrafía, la actigrafía, el electroencefalograma y la videotelemetría.
PSICOEDUCACIÓN Y PREVENCIÓN DE LOS PROBLEMAS DEL SUEÑO EN NIÑOS
Conciliar el sueño es un proceso de aprendizaje que comienza de forma temprana en la infancia. Aprender a alcanzar la independencia para la inducción del sueño es necesario en las prácticas saludables del sueño. Esto se logra cuando el entorno del niño es propicio para el inicio del sueño, independientemente de factores biológicos como el aumento de la presión del sueño. Acostar a los niños con sueño, pero despiertos en un ambiente propicio (es decir, tranquilo y oscuro) facilita este proceso. Cuando esto ocurre, el niño establece señales de asociación del inicio del sueño para su inducción independiente.
La inducción del sueño ocurre al final de cada ciclo de sueño a lo largo de la noche. Cuando se establece la inducción independiente del sueño, los niños se despiertan brevemente al final de cada ciclo y reanudan el sueño de forma independiente.
La inducción independiente del sueño es un objetivo fundamental del desarrollo en los niños; sin embargo, a menudo se forman asociaciones de inicio del sueño que mantienen la inducción del sueño dependiente; las asociaciones del inicio del sueño más comunes en los bebés incluyen ser mecidos o alimentados; en el caso de los niños pequeños, la presencia del cuidador en la habitación, la música y lectura;
Iván
Volumen 22 Número 2 Precop SCP 57
Francisco Álvarez Orozco, Sonia Restrepo Gualteros
Tabla 3. BEARS: cribado de trastornos del sueño en la infancia
2-5 años 6-12 años 13-18 años
1. Problemas para acostarse - ¿Su hijo tiene algún problema a la hora de irse a la cama para quedarse dormido?
2. Excesiva somnolencia diurna
- ¿Su hijo parece cansado o somnoliento durante el día?
- ¿Todavía duerme siestas?
- ¿Su hijo tiene algún problema a la hora de acostarse? (P)
- ¿Tienes algún problema a la hora de acostarte? (N)
- ¿A su hijo le cuesta despertarse por las mañanas, parece somnoliento durante el día o duerme siestas? (P)
- ¿Te sientes muy cansado? (N)
- ¿Tienes algún problema para dormirte a la hora de acostarte? (N)
- ¿Tienes mucho sueño durante el día, en el colegio, mientras conduces? (N)
3. Despertares durante la noche
- ¿Su hijo despierta mucho durante la noche?
- ¿Su hijo parece que se despierta mucho durante la noche?
- ¿Sonambulismo o pesadillas? (P)
- ¿Te despiertas mucho por la noche? (N)
- ¿Tienes problemas para volverte a dormir cuando te despiertas? (N)
- ¿Te despiertas mucho por la noche?
- ¿Tienes problemas para volverte a dormir cuando te despiertas?
4. Regularidad y duración del sueño
- ¿Su hijo se va a la cama y se despierta más o menos a la misma hora?
- ¿A qué horas?
5. Ronquidos - ¿Su hijo ronca mucho por las noches o tiene dificultad para respirar?
- ¿A qué hora se va su hijo a la cama y se despierta los días que hay colegio?
- ¿Y los fines de semana?
- ¿Usted piensa que duerme lo suficiente? (P)
- ¿Su hijo ronca fuerte por las noches o tiene dificultad para respirar? (P)
(P): preguntas dirigidas a los padres; (N): preguntar directamente al niño.
- ¿A qué hora te vas a la cama los días que hay colegio?
- ¿Y los fines de semana?
- ¿Cuánto tiempo duermes habitualmente? (N)
- ¿Su hijo ronca fuerte por las noches? (P)
La escala BEARS está dividida en las cinco áreas principales del sueño, lo que facilita el cribado de los trastornos del sueño en niños de 2 a 18 años. Cada área tiene una pregunta para cada grupo de edad.
B = Problemas para acostarse (bedtime problems)
E = Excesiva somnolencia diurna (excessive daytime sleepiness)
A = Despertares durante la noche (awakenings during the night)
R = Regularidad y duración del sueño (regularity and duration of sleep)
S = Ronquidos (snoring)
Adaptada de: Ugarte R. Asociación Española de Pediatría de Atención Primaria; 2015.
y en adolescentes, la televisión y el teléfono celular. Cuando estas asociaciones de inicio del sueño están ausentes, los niños luchan por conciliar el sueño o reanudar el sueño después de despertarse.
Los bebés experimentan cambios rápidos en sus patrones de sueño/vigilia y en la fisiología del sueño. En los recién nacidos, los períodos de sueño y vigilia ocurren aleatoriamente durante el día y la noche. A las 6 semanas
Importancia del sueño en pediatría Volumen 22 Número 2 Precop SCP 58
1. ¿Ronca más de la mitad del tiempo?
2. ¿Siempre ronca?
3. ¿Ronca con fuerza?
4. ¿Tiene una respiración agitada o movida?
5. ¿Tiene problemas para respirar o lucha para respirar?
6. ¿Alguna vez ha visto a su hijo parar de respirar durante la noche?
7. ¿Durante el día su hijo suele respirar con la boca abierta?
8. ¿Se levanta con la boca seca?
9. ¿Se orina de manera ocasional en la cama?
10. ¿Su hijo se levanta como si no hubiese descansado?
11. ¿Tiene problemas de excesivo sueño (somnolencia) durante el día?
12. ¿Le ha comentado algún profesor que su hijo parece dormido o adormilado durante el día?
13. ¿Le cuesta despertarle por las mañanas?
14. ¿Se levanta a la mañana con dolor de cabeza?
15. ¿Su hijo no ha tenido un crecimiento normal en algún momento desde que nació?
16. ¿Tiene sobrepeso?
17. ¿Su hijo a menudo parece que no escucha cuando se le habla directamente?
18. ¿Tiene dificultades en tareas organizadas?
19. ¿Se distrae fácilmente con estímulos ajenos?
20. ¿Mueve continuamente sus manos o pies o no para en la silla?
21. ¿A menudo actúa como si tuviera un motor?
22. ¿Interrumpe o se entromete con otros (por ejemplo, en conversaciones con juegos?
Positivo si ≥8 respuestas positivas; sensibilidad del 78% y especificidad del 72%.
Adaptada de: Grupo de Sueño de SEPEAP. Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria; 2022.
de edad, la mayoría de los bebés muestran un claro patrón diurno/nocturno de sueño y despertar, con clara diferenciación de día y noche a los 3 meses y un patrón de dormir de noche consolidado a los 9 meses. Estos rápidos cambios combinados con la incapacidad del bebé para establecer de forma independiente
la inducción del sueño pueden dificultar que los cuidadores interpreten correctamente las señales de somnolencia de sus bebés.
Comprender el ciclo básico de descanso y actividad puede ayudar a los cuidadores a enseñar a sus bebés habilidades de inducción
Iván
Volumen 22 Número 2 Precop SCP 59
Francisco Álvarez Orozco, Sonia Restrepo Gualteros
Sí No NS
Tabla 4. PSQ de Chervin para trastornos respiratorios del sueño
independiente del sueño. Los bebés experimentan inicialmente la presión del sueño después de 90 minutos de vigilia y necesitan la ayuda de un cuidador para conciliarlo. Supervisar la hora de despertar del bebé, anticipando señales de somnolencia de 75 a 90 minutos después, y ayudar al bebé a quedarse dormido al disminuir la estimulación y a calmarse preparan el escenario para la adquisición de habilidades de inducción del sueño de manera independiente. A medida que los bebés se desarrollan y crecen, sus períodos de vigilia aumentan y son capaces de quedarse dormidos de forma independiente.
Además, la mayoría de los problemas del sueño no se resuelven espontáneamente. Los pediatras están en una posición ideal para proporcionar una psicoeducación que aumente la conciencia de la importancia del sueño y promueva un comportamiento de sueño saludable mediante el asesoramiento a los problemas de sueño referidos por los padres en la consulta y la evaluación del papel del sueño en otras condiciones médicas informadas por sus repercusiones discutidas previamente (asma, alergias, trastorno del desarrollo, anemia de células falciformes, entre otras condiciones).
En cuanto a los aspectos clave que facilitan las prácticas de sueño saludable y que los pediatras y médicos familiares pueden implementar en la práctica diaria están el tiempo total de sueño recomendado, la higiene del sueño, la rutina de la hora de acostarse, el ambiente del dormitorio y los objetos de transición.
TIEMPO TOTAL DE SUEÑO RECOMENDADO
El primer paso para ayudar a los niños a lograr suficiente tiempo total de sueño es aprender cuánto sueño necesita y cuándo. Esta información se entrega de manera óptima durante las visitas de control del niño sano. Los temas importantes incluyen el tiempo óptimo de
sueño, la distribución de la noche frente al día y el papel cada vez menor de las siestas.
Debemos conocer los requerimientos de tiempo de acuerdo con la edad de los niños y de esta forma identificar la presencia de sueño insuficiente con las negativas consecuencias asociadas a ella. Las recomendaciones que proporciona la Academia Estadounidense de Pediatría son las que se muestran en la Tabla 5
Edad Horas de sueño recomendadas en un período de 24 horas
Bebés: 4-12 meses 12-16 (incluidas las siestas)
1 a 2 años 11-14 (incluidas las siestas)
Preescolares: 3 a 5 años 10-13 (incluidas las siestas)
Escolares: 6 a 12 años 9-12
Adolescentes:13 a 18 años 8-10
Adaptada de: Paruthi S, et al. J Clin Sleep Med. 2016;12(6):785-6.
Mantener un cuadro en el registro médico del niño puede guiar la consulta. Esto permite a los pediatras compartir información precisa con los cuidadores y los pacientes.
Mientras exploran el horario actual de sueño/ vigilia, los pediatras pueden evaluar si un niño está durmiendo lo suficiente, cuánto tiempo pasa el niño en cama y cuándo se está durmiendo. Cuando se reportan problemas para dormir, los pediatras pueden informar a los cuidadores sobre el sueño y establecer expectativas apropiadas (tiempo total de sueño, latencia de inicio, despertares nocturnos breves, entre otros); por ejemplo, aunque el inicio inmediato del sueño parecería óptimo, es más probable que
Importancia del sueño en pediatría Volumen 22 Número 2 Precop SCP 60
Tabla 5. Horas de sueño recomendadas por edades
sea una señal de sueño insuficiente; las latencias de inicio del sueño saludable varían de 15 a 30 minutos. Como otro ejemplo, los cuidadores pueden esperar a que los niños duerman toda la noche, mientras que los ciclos de sueño normales están puntuados con breves crestas en breves períodos de vigilia parcial.
Incluso, cuando no se informen los problemas del sueño, las preguntas relacionadas con este deben hacer parte de la entrevista del pediatra. Además, debemos tener en cuenta que la calidad del sueño de un niño puede verse afectada por los ronquidos u otros trastornos del sueño.
Cuando un niño no está logrando un tiempo total de sueño adecuado para su edad, es mejor prescribirle aumentos graduales. Esto puede lograrse estableciendo una hora más temprana para acostarse o una hora más tarde para despertarse; esta decisión debe ser consensuada entre la familia y el pediatra. Si se escoge la hora de acostarse más temprano, el cuidador debe ser instruido para comenzar la hora de acostarse un poco antes (por ejemplo, 15 minutos antes) para algunas noches durante la semana; cuando el niño se está quedando dormido en un lapso inferior a 20 minutos, la hora de acostarse puede moverse de nuevo y este proceso continúa hasta que se obtenga la cantidad óptima de sueño esperada.
Debe tenerse en cuenta que si se adopta una hora de acostarse demasiado temprana puede resultar en que el niño se acueste despierto en la cama durante períodos prolongados.
Higiene del sueño
La regla cardinal de la higiene del sueño de los niños es que el único propósito de su cama es dormir. Los niños que violan esta regla (por ejemplo, lectura, videos, televisión, juegos o redes sociales) corren un mayor riesgo de tener problemas para dormir. La evaluación del sueño debe incluir todas las actividades antes y después de acostarse. Las intervenciones del
sueño deben eliminar todas las actividades no relacionadas funcionalmente con la inducción del sueño. Las reglas complementarias incluyen evitar la práctica de ejercicio vigoroso y la ingesta de cafeína una o dos horas antes de acostarse; se recomienda adoptar un horario regular de sueño/vigilia y el establecimiento de una rutina para dormir y un ambiente del dormitorio (ausencia de luz y silencioso) que favorezca el sueño.
Rutinas a la hora de acostarse
Una rutina saludable a la hora de acostarse es aquella cuyas propiedades aumentan la presión del sueño. Más allá de ser facilitadoras del sueño, las rutinas a la hora de acostarse también pueden proporcionar tiempo de interacción positiva entre cuidadores y niños más pequeños. Las reglas generales para establecer rutinas a la hora de acostarse son:
1) Mantener la rutina lo más consistente posible; 2) Asegurar que todas las actividades en la rutina aumenten la presión del sueño (es decir, llevar a cabo la rutina justo antes de acostarse; ponerse la pijama o ropa reservada para dormir, lectura de un cuento); y 3) Asegurarse de que la rutina culmine con que el niño se duerma de forma independiente. Hay algunas consideraciones especiales para los bebés. Específicamente, la alimentación con biberón debe ocurrir antes de colocar al bebé en la cama. Una vez alimentado, debe ponerse al niño en la cama somnoliento, aunque despierto.
Ambiente del dormitorio
El ambiente del dormitorio también es una consideración importante para enseñar hábitos de sueño. Un entorno óptimo de dormitorio que sea propicio para el sueño debe ser tranquilo, con baja iluminación o sin ella; la luz baja se define como luz insuficiente para leer un libro. La exposición a la luz solar promueve despertares temprano en la mañana. Bloquear la luz del sol con cortinas es útil en estos casos. El punto básico es que un ambiente de sueño propicio aumenta la presión del sueño, que, a su vez, es necesaria
Iván
Volumen 22 Número 2 Precop SCP 61
Francisco Álvarez Orozco, Sonia Restrepo Gualteros
para aprender la inducción independiente del sueño y lograr un sueño de calidad.
Objetos de transición
Para lograr la inducción independiente del sueño, los niños deben ser capaces de calmarse por sí mismos o reducir la excitación. Los objetos de apego preferidos (por ejemplo, una manta, un animal de peluche o un chupete) pueden ayudar a que los niños alcancen estos objetivos. Cuando los objetos se combinan con la hora de acostarse y conciliar el sueño ayudan a los niños a pasar de forma independiente de estar despiertos a estar dormidos. Los objetos de transición también ayudan a los niños a reanudar el sueño de forma independiente después de despertarse por la noche.
CONCLUSIONES
Muchos niños presentan trastornos del sueño y posiblemente la mayoría está en riesgo de tener algún tipo de problema del sueño. Por lo tanto, el consultorio del pediatra es el lugar ideal para impartir educación sanitaria sobre la importancia del sueño, su dinámica y cómo corregir los problemas de sueño cuando ocurren.
Ayudar a lograr la inducción independiente del sueño es un objetivo fundamental del desarrollo en los niños.
LECTURAS RECOMENDADAS
1. American Academy of Sleep Medicine. The international classification of sleep disorders: diagnostic and coding manual. 3. a edición. Westchester: American Academy of Sleep Medicine; 2014.
2. Bruce ES, Lunt L, McDonagh JE. Sleep in adolescents and young adults. Clin Med (Lond). 2017;17(5):424-8. https://doi.org/10.7861/clinmedicine.17-5-424
Los problemas del sueño se encuentran entre las preocupaciones más comunes de los padres y cuidadores en pediatría, los cuales refieren alrededor de un 30% de problemas de sueño. Hasta el 40% de los niños y adolescentes presentan un trastorno del sueño durante su vida.
Debemos recordar que los trastornos del sueño tienen un gran impacto en el desarrollo de los niños y adolescentes y que presentan ciertas características:
• Tienden a ocurrir muy temprano.
• Tienden a cronificarse.
• Afectan el desarrollo físico, emocional, cognitivo y social de los niños y adolescentes.
• Tienen una gran influencia en la dinámica de la familia.
El sueño y la salud mental están intrínsecamente vinculados. Por tanto, los profesionales sanitarios deben proporcionar al paciente una mayor atención, incluidas preguntas sobre el sueño cuando los niños y adolescentes presentan síntomas de salud mental. Las mejoras en los hábitos para dormir pueden resultar en una disminución de los problemas de salud mental.
Establecer prácticas de sueño saludable en los niños desde los primeros años de vida es una contribución significativa a su salud y bienestar.
3. Carskadon MA, Dement WC. Normal human sleep: an overview. En: Kryger MH, Roth T, Dement WC (editores). Principles and practice of sleep medicine. 4. a edición. Filadelfia: Elsevier Saunders; 2005. p. 13-23.
4. Grupo de Sueño de SEPEAP. Test de Chervin. Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria; 2022. Disponible en: https://rb.gy/5wknt
Importancia del sueño en pediatría Volumen 22 Número 2 Precop SCP 62
5. Mason GM, Lokhandwala S, Riggins T, Spencer RMC. Sleep and human cognitive development. Sleep Med Rev. 2021;57:101472. https://doi.org/10.1016/j. smrv.2021.101472
6. Mindell JA, Owens JA. A clinical guide to pediatric sleep: diagnosis and management of sleep problems. Filadelfia: Lippincott, Williams and Wilkins; 2003.
7. Moon R (editora). Sleep: What Every Parent Needs to Know. Estados Unidos: American Academy of Pediatrics; 2013.
8. Owens J, Witmans M. Sleep problems. Curr Probl Pediatr Adolesc Health Care. 2004;34(4):154-79. https:// doi.org/10.1016/j.cppeds.2003.10.003
9. Owens JA, Weiss MR. Insufficient sleep in adolescents: causes and consequences. Minerva Pediatr. 2017;69(4):326-36. https://doi.org/10.23736/ S0026-4946.17.04914-3
10. Owens JA. The practice of pediatric sleep medicine: results of a community survey. Pediatrics. 2001;108(3):E51. https://doi.org/10.1542/peds.108.3.e51
11. Paruthi S, Brooks L, D’Ambrosio C, Hall W, Kotagal S, Lloyd R, et al. Recommended Amount of Sleep for Pediatric Populations: A Consensus Statement of the American Academy of Sleep Medicine. J Clin Sleep Med. 2016;12(6):785-6.
12. Smaldone A, Honig JC, Byrne MW. Sleepless in America: inadequate sleep and relationships to health and wellbeing of our nation’s children. Pediatrics. 2007;119(Suppl 1):s29-37. https://doi.org/10.1542/peds.2006-2089F
13. Spruyt K. Neurocognitive Effects of Sleep Disruption in Children and Adolescents. Child Adolesc Psychiatr Clin N Am. 2021;30(1):27-45. https://doi.org/10.1016/j. chc.2020.08.003
14. Steinsbekk S, Berg-Nielsen TS, Wichstrøm L. Sleep disorders in preschoolers: prevalence and comorbidity with psychiatric symptoms. J Dev Behav Pediatr. 2013;34(9):633-41. https://doi.org/10.1097/01. DBP.0000437636.33306.49
15. Ugarte R; Grupo de Sueño de la AEPAP. BEARS. Cribado de trastornos de sueño en la infancia. Asociación Española de Pediatría de Atención Primaria; 2015. Disponible en: https://rb.gy/tio6d
Iván Francisco
Volumen 22 Número 2 Precop SCP 63
Álvarez Orozco, Sonia Restrepo Gualteros
EXAMEN CONSULTADO
1. Una de las diferencias de la tos crónica en los niños con respecto a los adultos es que:
a. La tos en los niños tiende a ser más refractaria al tratamiento.
b. Las vías aéreas de los adultos tienen mayor superficie de ocupación por glándulas mucosas, por lo que tienen mayor producción de moco.
c. Los niños tienen mayor vulnerabilidad a infecciones que producen tos crónica.
d. Los procesos inflamatorios o infecciosos no producen alteraciones a largo plazo en las vías respiratorias de los niños.
2. La tos específica se refiere a lo siguiente, excepto que:
a. Se asocia a una enfermedad subyacente.
b. Puede cursar con signos y síntomas de una enfermedad sistémica.
c. Los hallazgos clínicos indican una etiología y la necesidad de investigaciones más profundas.
d. Se caracteriza por ser una tos seca o improductiva.
3. La tos crónica diaria húmeda o productiva en niños, se puede deber a las siguientes etiologías, excepto a:
a. Bronquitis bacteriana prolongada
b. Tosferina
c. Tuberculosis
d. Panbronquitis difusa
4. Cuál de los siguientes no es un componente de la bronquitis bacteriana prolongada:
a. Siempre requiere detección molecular.
b. Tos mayor a cuatro semanas.
c. Ausencia de indicadores de tos crónica específica.
d. Mejoría con tratamiento antibiótico dos semanas después del inicio del mismo.
5. Con respecto al uso del índice predictor de asma (IPA), no es cierto que:
a. Un IPA positivo corresponde a la presencia del criterio primario más, al menos un criterio mayor o dos criterios menores.
b. Los criterios menores incluyen diagnóstico médico de rinitis alérgica, sibilancias no relacionadas a infecciones virales, eosinofilia periférica igual o mayor de 4 %.
c. A los 6 años, un IPA positivo tiene un valor predictivo positivo del 27 % (probabilidad de los niños con IPA positivo de tener asma en la edad escolar).
d. Los criterios mayores comprenden uno de los padres con asma y el diagnóstico personal de dermatitis atópica.
6. ¿Cuál es el criterio funcional que se espera encontrar en la evaluación de la espirometría pre- y posbroncodilatador para confirmar el diagnóstico de asma?
a. Patrón de obstrucción de la vía aérea que mejora con la administración de broncodilatador.
b. Patrón sugestivo de restricción.
c. Atrapamiento aéreo.
d. Relación VEF1/CVF mayor de 90 %.
7. En la evaluación del control del asma, la determinación del riesgo futuro de desenlaces adversos en el paciente se mide a través de los siguientes parámetros, excepto:
a. La presencia de factores de riesgo para exacerbaciones.
b. Los factores que favorecen los eventos adversos con medicamentos.
c. Los factores de riesgo para la limitación al flujo aéreo.
d. El uso de la inmunoterapia.
8. Las medidas no farmacológicas que hacen parte del tratamiento del asma son:
a. La evitación de desencadenantes ambientales como la exposición al humo de cigarrillo y otros contaminantes, y el uso de fundas de colchón impermeables en el caso del asma por ácaros.
b. El uso de broncodilatador de acción corta ante la aparición de síntomas.
c. La vacunación anual contra neumococo.
d. El uso de corticoide inhalado como terapia de mantenimiento.
9. En general, ¿cuál es el principal microorganismo causante de neumonía bacteriana a nivel mundial?
a. S. aureus
b. S. pneumoniae
c. M. pneumoniae
d. Listeria monocytogenes
10. El diagnóstico para neumonía según la OMS se basa en:
a. La presencia de infiltrados en la radiografía de tórax.
b. Cambios en la radiografía de tórax, dificultad para respirar, taquipnea o tiraje torácico, asociados a hemocultivos positivos.
c. La presencia de tos, dificultad para respirar, taquipnea o tiraje torácico.
d. Reactantes de la fase aguda positivos, asociados a tos y dificultad variable.
11. La PCR, VSG o procalcitonina se recomiendan de forma rutinaria como biomarcador para diferenciar entre infecciones de origen viral o bacteriano:
a. Verdadero.
b. Falso.
12. Cuál serotipo de S. pneumoniae se ha asociado con mayores casos de enfermedad neumocócica invasiva:
a. Serotipo 6B
b. Serotipo 19F
c. Serotipo 19A
d. Serotipo 23F
e. Serotipo 4
13. Para el diagnóstico de FQ:
a. Se realiza por medio de los hallazgos clínicos en el paciente.
b. Debe haber clínica del paciente y la prueba de tamizaje positiva.
c. Además de hallazgos clínicos, se confirma con prueba de sudor > 60 mEq/L.
d. Es necesario realizar un exoma para confirmar disfunción enzimática.
14. Cuál de las siguientes manifestaciones NO es característica del paciente con FQ:
a. Síntomas sinopulmonares crónicos.
b. Falla del medro.
c. Íleo meconial.
d. Cardiopatía congénita.
e. Azoospermia obstructiva.
15. La proteína implicada en las manifestaciones clínicas de la FQ es:
a. NADPH
b. CFTR
c. PCR
d. DNAsa
e. Dornasa α
16. El tratamiento antibiótico en los pacientes con FQ tiene como principal objetivo prevenir y controlar las infecciones respiratorias, este debe realizarse en forma precoz ante la aparición de los primeros gérmenes tales como:
a. Escherichia coli
b. Salmonella spp.
c. P. aeruginosa
d. Staphylococcus aureus
17. En la consulta, la anamnesis dirigida acerca del sueño del recién nacido debe incluir los siguientes aspectos:
a. Edad gestacional y complicaciones neonatales.
b. Presencia de apnea o historia familiar de BRUE (evento breve resuelto de causa inexplicable).
c. Ambiente para dormir (dónde, cuánto y cómo duerme el bebé, comparte cama, exposición al tabaquismo).
d. Ambiente seguro para dormir (cuna separada y fuerte, ausencia de peluches o almohadas, dormir boca arriba, evitar las superficies blandas para disminuir el riesgo de asfixia).
e. Todas las anteriores deben evaluarse.
18. Una de las siguientes afirmaciones es falsa con respecto al sonambulismo:
a. Afecta a niños entre los 4 y 8 años.
b. Consiste en la instauración durante el sueño REM de conductas motoras complejas que progresan hacia la deambulación.
c. Aproximadamente del 20% al 40% de los niños presentan al menos un episodio de sonambulismo durante la vida.
d. En cuanto a los trastornos del sueño, se clasifica como una parasomnia.
e. El niño presenta amnesia del evento a la mañana siguiente.
19. Con respecto al rango de horas de sueño recomendadas en los niños, es cierto que:
a. El rango de horas de sueño recomendado en los niños de 1 a 2 años es de 11 a 14 horas (incluidas las siestas).
b. El tiempo de sueño recomendado en los adolescentes de 12 años es de 15 horas.
c. En escolares, el número promedio de horas de sueño recomendado es de 14 horas.
d. En preescolares, el número promedio de horas de sueño recomendado es de 14 horas.
e. El número promedio de horas de sueño es igual en todos los grupos de edad.
20. En cuanto a los aspectos clave que facilitan las prácticas de sueño saludable y que pueden implementarse en la práctica clínica diaria, están:
a. El tiempo total de sueño recomendado.
b. La higiene del sueño.
c. La rutina de la hora de acostarse.
d. El ambiente del dormitorio.
e. Todas las anteriores pueden implementarse.
Volumen 22 Número 2 Precop SCP 70 Volumen 22 Número 1 Clave de respuestas 1: A 2: C 3: B 4: A 5: B 6: A 7: A 8: D 9: C 10: A 11: D 12: C 13: C 14: B 15: B 16: A 17: C 18: C 19: B 20: C

Sociedad Colombiana de Pediatría www.scp.com.co
precop
Subdirección de Programas Dirigidos al Pediatra
Calle 83 n.o 16A-44, Oficina 701
Edificio Cima. Bogotá, D.C.
Teléfonos: (1) 6495352 - 7464706/07
precop@scp.com.co







