


Edición 149 - Octubre 2022
Importante paso para lograr una asociación regulatoria en materia sanitaria con EE. UU.
Compradores de norteamérica visitaron Ecuador para conocer de cerca el camarón SSP
Primera brigada de regularización camaronera 2022 Pedernales - Manabí
Shrimp Market News y Data

Aqua Expo 2022 tendrá la exposición comercial más grande de la historia
Condecorados Aqua Expo 2022
El órgano linfoide (LO) como objetivo principal adicional del virus iridiscente de los decápodos 1 (DIV1) en Penaeus vannamei
IHHNV: Orígenes y realidades luego de 40 años
Estado actual de la infección por virus de la necrosis hipodérmica y hematopoyética infecciosa (IHHNV) en la industria camaronera peruana y ecuatoriana
VIBRIOSIS
El constante desafío de los camaroneros
Efectos de la suplementación dietética con polvo de Arthrobacter bussei sobre el crecimiento, la capacidad antioxidante y la inmunidad innata del camarón blanco del Pacífico (Litopenaeus vannamei)
Sustitución parcial de alimentos frescos congelados por una dieta experimental en reproductores de Litopenaeus vannamei (Boone, 1931) (Decapoda: Dendrobranchiata: Penaeidae)
Alimentando un futuro sostenible: la inclusión de ingredientes noveles en alimentos para camarón
La biorremediación y sus beneficios a la producción acuícola y a los ambientes de cultivo
Efecto de probióticos en la producción y salud de postlarvas del Camarón Blanco del Pacífico
Cambios en la supervivencia, osmorregulación y hemocitos de postlarvas de Litopenaeus vannamei aclimatadas a diferentes intervalos de reducción de salinidad
Restauración de manglar, importancia y recomendaciones para su ejecución
ESTADÍSTICAS
Exportaciones de camarón y tilapia
Reporte de mercado de EE. UU. Reporte de mercado de China
NOTICIAS
Noticias de interés
Noticias empresariales
Presidente Ejecutivo Ing. José Antonio Camposano
Editora “AquaCultura” Msc. Shirley Suasnavas ssuasnavas@cna-ecuador.com
Consejo Editorial
MSc. Yahira Piedrahita Mphil. Leonardo Maridueña Ing. José Antonio Lince Econ. Danny Vélez Ing. Alex de Wind
Diseño y diagramación Ing. Orly Saltos osaltos@cna-ecuador.com
Ing. Roberto Peñafiel rpenafiel@cna-ecuador.com
Foto de portada www.istockphoto.com
Corrección de estilo Silvia Idrovo Valverde Comercialización Gabriela Nivelo gnivelo@cna-ecuador.com
ÍNDICE
INFORMACIÓN DE COYUNTURA ARTÍCULOS TÉCNICOS
8 12 30 16 18 20 22 37 42 52 58 67 75 82 86 92 100 106 114 118 122 128
José Antonio Camposano Presidente Ejecutivo

Sector privado: principal dinamizador de la economía y generador de empleo
largo de su historia, el sector privado ha demostrado ser el principal protagonista en la expansión económica de las naciones, especialmente si nos referimos a expansión económica permanente, pues aquellas motivadas por el gasto estatal han sido incapaces de sostenerse en el tiempo debido al histórico manejo desordenado de las finanzas públicas contagiadas por el populismo que tanto mal les ha hecho a nuestros países.
Alo
La premisa anterior no busca disminuir el legítimo rol del Estado, sin embargo, es necesario reiterar que está plenamente comprobado que los países que han construido una sociedad equitativa son aquellos que han permitido que la iniciativa privada se desenvuelva con libertad, con especial énfasis en la iniciativa privada socialmente responsable. En el Ecuador existen ejemplos de actividades productivas que a lo largo de su trayectoria han progresado y, junto a ellas, se han generado condiciones de bienestar para la población.
Hoy puedo decir con total imparcialidad que el sector camaronero ha asumido responsablemente su rol en la economía nacional como una de las principales actividades productivas que ha creado más plazas de trabajo en el país sobrepasando las 275,000 directas e indirectas, justo en tiempos de pandemia, conflictos armados y crisis económica.
Para ello, hay que recordar que en el camino recorrido hemos atravesado por muchas crisis; algunas de ellas nos llevaron al borde de la desaparición y, aunque muchos miembros no lograron sobrepasar
los obstáculos del camino, otros persistieron gracias a su empuje, entrega y sagacidad. Con el paso del tiempo la cría y cultivo de camarón se ha fortalecido sin que eso signifique que hemos bajado la guardia, pues estamos conscientes de que siempre haremos frente a factores exógenos propios de la actividad orientada a la exportación.
Crear y sostener empleo en el Ecuador no es una tarea sencilla y debería ser considerada como el indicador principal para medir el impacto social de las actividades económicas, pues la necesidad de un medio de sustento para millones de familias en el país es crítica. Por ello, los anuncios de inversiones por parte de nuestro sector en diversos ámbitos como la tecnificación de los cultivos, la innovación en la producción de alimento balanceado o nuevas líneas de valor agregado de camarón deben ser entendidos como la creación de nuevos espacios laborales que serán ocupados por ecuatorianos que ven en ese oficio la oportunidad de salir adelante.
En este mes que inauguraremos una nueva edición de AQUAEXPO en Guayaquil, los invito a recorrer nuestra feria y constatar la capacidad que tiene nuestro sector para dinamizar diversas ramas de la economía nacional. También los invito a sumarse a los esfuerzos que hacemos como cadena de valor para producir más plazas de empleo para hombres y mujeres que aportan, desde sus capacidades particulares, pero a través de su trabajo en equipo, a la eficiencia del Mejor Camarón del Mundo•
EDITORIAL
PRIMER VICEPRESIDENTE
Ing. José Antonio Lince
DIRECTORIO
PRESIDENTE DEL DIRECTORIO
Econ. Carlos Miranda
SEGUNDO VICEPRESIDENTE

Ing. Marcelo Vélez
Ing. Ricardo Solá Blgo. Carlos Sánchez Ing. Alex Olsen Ing. Ori Nadan Ing. Luis Francisco Burgos Ing. Jorge Redrovan Sr. Isauro Fajardo Tinoco Ing. Kléber Sigúenza Ing. Oswin Crespo Econ. Sandro Coglitore Ing. Rodrigo Laniado Ing. Diego Puente Ing. Bastien Hurtado
VOCALES
Ing. Alejandro Ruiz Ing. Alex Elghoul Ing. Humberto Dieguez Ing. Rodrigo Vélez Dr. Marcos Tello Ing. Santiago León Cap. Segundo Calderón Ing. Miguel Loaiza Ing. Freddy Arias Sr. Leonardo de Wind Ing. Fabricio Vargas Ing. Francisco Pons Dr. Alejandro Aguayo
Econ. Heinz Grunauer Ing. Víctor Ramos Ing. David Eguiguren Ing. Eduardo Seminario Ing. Roberto Aguirre Ing. Johnny Adum Ing. Miguel Uscocovich Ing. Iván Rodríguez Sra. Verónica Dueñas Econ. Danny Vélez Sr. Telmo Romero Ing. Ufredo Coronel Sr. Luis Gálvez Correa

Importante paso para lograr una asociación regulatoria en materia sanitaria con EE. UU.
Conel propósito de lograr una asociación regulatoria en materia sanitaria de productos acuícolas y pesqueros, el Viceministerio de Acuacultura y Pesca del Ministerio de Producción, Comercio Exterior, Inversiones y Pesca (MPCEIP) y la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) firmaron un acuerdo de confidencialidad como primera fase de una importante alianza estratégica con uno de los principales mercados para el camarón ecuatoriano.

El acto se realizó el 18 de agosto en Guayaquil y fue presidido por el ministro de Producción, Comercio Exterior, Inversiones y Pesca, Julio José Prado. La firma del convenio estuvo a cargo de Andrés Arens, viceministro de Acuacultura y Pesca y de Mark Abdoo, comisionado asociado de Política y Estrategia Global de la FDA; además, contó con la presencia de la subsecretaria de Calidad e Inocuidad SCI Diana Poveda, el subsecretario de Acuacultura, Axel Vedani y directivos de la Cámara Nacional de Acuacultura.

En el marco del evento, los delegados de la FDA visitaron las áreas de trabajo que regula la SCI, específicamente las relacionadas al sector acuícola, tales como: criaderos, fincas, plantas procesadoras, fábricas y distribuidores de alimentos balanceados, y laboratorios; además mantuvieron reuniones
con representantes del sector productivo y exportador del país.
La agenda de la delegación FDA concluyó el viernes 19 de agosto pasado.
“Hemos iniciado este primer paso de firmar un acuerdo de confidencialidad para afianzar una alianza en materia sanitaria con una de las entidades referentes a nivel mundial en la materia, como lo es la FDA. El objetivo final es obtener un acuerdo de 'Asociación Regulatoria Sanitaria' que permitirá ofrecer las garantias sanitarias y de inocuidad de los productos acuícolas, como del intercambio de información entre entidades. Esta acción derivará a que el flujo comercial con Estados Unidos se agilice con productos que ofrezcan la seguridad sanitaria que buscan los consumidores de dicho país”.
- OCTUBRE 2022COYUNTURA 8
Andrés Arens, viceministro de Acuacultura y Pesca; Julio José Prado, ministro de Producción, Comercio Exterior, Inversiones y Pesca; y de Mark Abdoo, comisionado asociado de Política y Estrategia Global de la FDA.
Diana Poveda Subsecretaria de Calidad e Inocuidad
LA ENTREVISTA
El viceministro de Acuacultura Andrés Arens en entrevista para CNA Video Podcast y la Revista Aquacultura respondió algunas interrogantes respecto a esta importante noticia.

¿Qué significa para la industria camaronera ecuatoriana, esta firma del convenio de confidencialidad?
Es un paso muy importante. El primero de muchos pasos que vamos a tener que dar hasta llegar a firmar un acuerdo regulatorio con la FDA. La intención es que los productos ecuatorianos, comenzando por los productos acuícolas, tengan una vía rápida al momento de cumplir los requisitos sanitarios y de verificación de los requisitos sanitarios de ingreso en Estados Unidos. Así también la FDA podrá orientar sus recursos humanos y económicos a la revisión de otros productos que ya tendrían esta precalificación, porque se han homologado y verificado las prácticas que la autoridad sanitaria en Ecuador tiene y cumple.

¿Cómo logramos que Ecuador sea el primer país que firma el convenio con la FDA? Es un trabajo que se viene realizando desde hace algunos años, y ya entró en vía rápida. Es una de las prioridades de este gobierno y que la Subsecretaría de Calidad e Inocuidad ha impulsado muchísimo para que esta atención que había logrado el sector camaronero ecuatoriano de parte de la FDA pudiera materializarse en algo que facilite el ingreso de nuestros productos a uno de los principales mercados del mundo y que esperamos se convierta también en un gran comprador de camarón.
Las buenas prácticas de Ecuador, la calidad del camarón ecuatoriano, la buena reputación de la industria camaronera ecuatoriana… ¿Cree que jugó un papel muy importante para que la FDA propicie la firma de este convenio con Ecuador?
Sí, importantísimo. Yo creo que, todo el trabajo que se ha hecho alrededor del eslogan del “Mejor Camarón del Mundo”, que no es solo un eslogan, sino que es una realidad por los requisitos sanitarios que cumple, por la calidad del producto que llevamos a todos los mercados del mundo han hecho que llame la atención de las autoridades de varios países y en este caso, la FDA ha tomado en cuenta al Ecuador para ser el primer país del mundo con quien va a firmar un acuerdo regulatorio y que nos permitiría tener, esta vía rápida de ingreso de nuestros productos a Estados Unidos.
¿Cuál fue la impresión que se llevó la delegación de la FDA cuando firmó este convenio?
Tuvieron una grata impresión. Nos mencionaron que ellos no se imaginaban que ni en el mejor de los escenarios pudiéramos avanzar tan rápido en este proceso. Se han dado cuenta de que la autoridad sanitaria en materia acuícola y pesquera está a la vanguardia en protocolos, en tecnología y que el personal está muy capacitado para poder dar una garantía de la calidad y de la inocuidad de los productos, en este caso, los productos acuícolas del país y la impresión que se han llevado después de la visita que han realizado ya las máximas autoridades, previo a la firma, han podido dar fe de todo lo que el gobierno y el sector también ha avanzado. Se han dado cuenta de el papel que juega el sector privado desde el nivel de asociatividad, porque tiene un gremio muy robusto que va a la cabeza al fomentar estos cambios positivos y que están orientados en aplicar las mejores tecnologías e innovación en el sector acuícola, para justamente poder confirmar y garantizar a todos los consumidores del camarón ecuatoriano que realmente este es "el mejor camarón
del mundo" y que son productos seguros en temas sanitarios y en temas de inocuidad.
¿Fortalece la estrategia de Ecuador de llegar a ser el primer exportador de camarón en Estados Unidos, el más grande proveedor?
En este tema particular, lo que nosotros estamos haciendo es facilitando que más camarón ecuatoriano entre a Estados Unidos, que siga aumentando la exportación camaronera hacia este país, que este sea el primer paso para que otros productos también, luego, puedan utilizar esta vía, esta vía rápida: productos derivados de la pesca y otros productos agrícolas en un futuro. Pero con esto, sin lugar a dudas, nosotros apuntamos a mejorar las condiciones para que el sector privado pueda acceder a mercados con alto poder adquisitivo y con un volumen de compras muy interesante para el sector.
¿Ecuador está un paso más adelante de sus competidores con esta firma?
Definitivamente, somos el primer país en el mundo en tener un acuerdo de confidencialidad previo a la firma de un acuerdo regulatorio. Cuando se firme el acuerdo regulatorio para temas de sanidad e inocuidad, seremos el primer país en el mundo en tener un acuerdo de este estilo para camarón, lo que permitirá que el exportador ecuatoriano tenga esta vía rápida y que facilite el ingreso de su producto, mientras que otros exportadores de otros orígenes no tendrán la misma facilidad y tendrán que hacer todo el trabajo que hemos venido haciendo nosotros durante algunos años.
¿En qué etapa nos encontramos en este acuerdo de confidencialidad? ¿Qué viene
- OCTUBRE 2022 COYUNTURA 9
luego?
Bueno, ahora a trabajar en el intercambio de información. Justamente con esto sentamos las bases para poder intercambiar la información necesaria para poder conseguir el acuerdo regulatorio. Vendrán algunas visitas. Se visitarán todos los establecimientos de la cadena productiva, desde los laboratorios de larvas, las fincas camaroneras, los establecimientos de procesamiento, inclusive algunos proveedores de insumos. Seguramente con eso, se podrá verificar durante un período de tiempo y calculamos que no será menos de un año. Nosotros somos siempre bastante ambiciosos y creemos que en un año podremos firmar el acuerdo regulatorio y ese sería, digamos, la culminación de este proceso de certificación con la FDA.
¿Cómo y cuándo podríamos ver esos resultados de este convenio de confidencialidad?
Yo creo que sin lugar a dudas, que sigan aumentando aceleradamente las exportaciones hacia Estados Unidos será uno de los indicadores. Otro indicador muy importante será recibir la retroalimentación de los importadores estadounidenses sobre la facilidad y los tiempos a la hora de recibir nuestro camarón en Estados Unidos. De esa manera podremos evaluar si es que el acuerdo regulatorio está surtiendo efectos y consigue lo que queremos, que es aumentar el volumen de exportaciones hacia Estados Unidos.
¿Qué otros productos se van a incluir en este acuerdo?
Inicialmente la atención la ha llamado el sector camaronero y los productos acuícolas, pero ya estamos en conversaciones para incluir los productos de la cadena pesquera dentro de este acuerdo regulatorio. Tomará un tiempo, sin lugar a dudas, pero ya tenemos el camino trazado y será muchísimo más fácil después de haber recorrido durante estos últimos años el camino para abrir esta brecha para el sector camaronero. Incluir productos como el atún, el pez espada, que son productos muy apreciados en Estados Unidos para el sector consumidor de mariscos.
¿La autoridad sanitaria en Ecuador tiene previsto firmar tal vez nuevos acuerdos
de confidencialidad con otros destinos importantes, como por ejemplo China, que es el principal destino del camarón ecuatoriano?
Bueno, con China y con Corea, que son dos mercados interesantes para nuestro camarón, tenemos ya firmados otros acuerdos en materia sanitaria, memorandos de entendimiento y líneas sanitarias, protocolos sanitarios que compartimos con estos dos países. Estamos siempre abiertos a mejorarlos y a cumplir con las nuevas exigencias a nivel internacional, pero por lo pronto, tenemos ya firmado acuerdos con estos mercados que nos permiten el flujo continuo de camarón hacia estos dos destinos importantes que he mencionado que son China y Corea.
¿Cuál es la importancia de contar con una Subsecretaría de Calidad e Inocuidad robustecida y afianzada en su institucionalidad?
Esta ha sido una de las prioridades de la administración pesquera desde que retomamos la misma hace 14 meses. Desde ahí hemos logrado el incremento del presupuesto, del gasto corriente, la contratación de nuevo personal, 63 personas nuevas para la Subsecretaría de Calidad e Inocuidad, para poder cumplir con todas las competencias orgánicas y estatutarias, para poder cumplir de una mejor manera también en los servicios que ofrecemos a los exportadores y productores ecuatorianos en materia acuícola y pesquera. También hemos asegurado en este gobierno, el flujo de presupuesto para los siguientes tres años dentro de un proyecto de inversión especial para asegurar las exportaciones acuícolas y pesqueras, de no menos de 30 millones de dólares, en los siguientes tres años. Así que, los temas de recursos están asegurados. La institucionalidad se ha robustecido por el ingreso de nuevo personal que permite repartir mejor las cargas laborales y dar un mejor servicio a todos los usuarios y seguramente seguiremos trabajando en ir mejorando otros aspectos.
La inclusión también, o la apertura de cooperación con laboratorios del sector privado para atender la demanda que siempre crece en temas sanitarios y de inocuidad.
El pasado 19 de septiembre, en el marco de cooperación entre el MPCEIP y la FDA, funcionarios de la SCI reciben entrenamiento para la evaluación sensorial de la calidad del camarón en la empresa OMARSA. 36 personas participan de la capacitación, entre ellos representantes de la CNA•
“El propósito de este convenio es lograr una asociación regulatoria en materia sanitaria, con el fin de que tanto las autoridades ecuatorianas como estadounidenses, puedan colaborar más cerca y poder ofrecer las garantías y controles necesarios para el ingreso de productos pesqueros y acuícolas a ese mercado. Esto permitirá que las exportaciones acuícolas a los Estados Unidos ofrezcan las garantías oficiales de tal manera que se facilite el acceso a dicho país”.
 José Antonio Camposano Presidente Ejecutivo de la Cámara Nacional de Acuacultura
José Antonio Camposano Presidente Ejecutivo de la Cámara Nacional de Acuacultura
“El acuerdo regulatorio que suscriben la FDA y la Subsecretaría de Calidad e Inocuidad es el gran inicio de un proceso de colaboración entre nuestra autoridad sanitaria y la de uno de nuestros mercados más importantes. Esto nos permitirá que las exportaciones de camarón hacia Estados Unidos ofrezcan garantías oficiales, facilitando los procesos para el ingreso a este país. En lo personal, es algo que he venido impulsando desde el año 2010, cuando se discutía el borrador de la Ley de Modernización de los Alimentos de los Estados Unidos”.
Yahira Piedrahita Directora Ejecutiva de la Cámara Nacional de Acuacultura

- OCTUBRE 2022COYUNTURA 10

Compradores de norteamérica visitaron Ecuador para conocer de cerca el camarón SSP
Lainiciativa Sustainable Shrimp Partnership (SSP) junto con la certificación internacional para camarón Aquaculture Stewardship Council (ASC), organizaron el pasado mes de julio el primer “Seminario del Camarón” en Ecuador con el propósito de dar a conocer la producción sustentable y la trazabilidad del producto ecuatoriano.

Más de 20 representantes de cadenas de supermercados y empresas de food service de Norteamérica participaron de este Seminario, que incluyó visitas a finca camaronera y plantas procesadoras de las empresas miembros de SSP, ubicadas en la provincia del Guayas. La delegación internacional conoció de cerca las prácticas acuícolas y evidenciaron el compromiso de los productores camaroneros ecuatorianos en cumplir con los más altos estándares de calidad, de responsabilidad social y ambiental, asegurando un cuidado especial en cada etapa del ciclo de producción.
Como parte del Seminario, también se efectuó un Taller en el hotel Hilton Colón de Guayaquil, donde los representantes de las empresas minoristas y distribuidores

de mariscos de Estados Unidos y Canadá pudieron conocer a través de representantes de nuestra industria por qué el camarón ecuatoriano es considerado el Mejor del Mundo. Así mismo, se realizaron varios paneles en los que participaron los representantes internacionales para dar a conocer a nuestros productores ecuatorianos cuáles son sus requerimientos y expectativas en temas de sostenibilidad.

“El seminario del camarón en Ecuador fue una oportunidad de aprendizaje invaluable. Reunirnos directamente con los acuicultores y productores nos permitió compartir con ellos los compromisos de sustentabilidad de Sysco en esta categoría, incluida la importancia de la certificación del Aquaculture Stewardship Council (ASC)”.
Anthony Downs Director Category Management Seafood / Sysco
12
“La colaboración de ASC con SSP es un esfuerzo trascendental para llevar a toda la industria camaronera hacia un futuro más viable. Los productores de camarón certificados por ASC de Ecuador sirven como ejemplo del arduo trabajo de los estándares ASC. Nuestra misión de transformar la acuicultura hacia la sustentabilidad ambiental y la responsabilidad social se basa en la creación de valor en toda la cadena, y eso comienza en la finca. Al brindarles a los minoristas norteamericanos la oportunidad de relacionarse directamente con los productores ecuatorianos y los productos con la etiqueta ASC que están entregando a los clientes, estamos brindando un camino claro para comprender que los camarones de calidad, criados con cuidado y sin antibióticos, ofrecen una cantidad de soluciones alcanzables para empresas y consumidores, manteniendo al mismo tiempo impactos positivos en las comunidades locales y el medio ambiente".
Peter Redmond

Gerente Senior de Desarrollo de Mercados de ASC Norteamérica.
“Los productores ecuatorianos definitivamente están orgullosos de su camarón. Han demostrado una gran capacidad de adaptarse a las necesidades del mercado, pero siempre priorizando el bienestar de los consumidores y colaboradores, al igual que la conservación del ecosistema. Son personas que están comprometidas con la confiabilidad, la seguridad alimentaria, la sostenibilidad, la trazabilidad y están decididos a incentivar un cambio en la industria global mostrando que es posible producir camarón de calidad premium y seguro. Esta es la razón por la cual, junto con ASC, decidimos que Ecuador es un lugar perfecto para mostrar la manera de producir mariscos”.


 Pamela Nath Directora de SSP
Pamela Nath Directora de SSP

13
Ecuador ha demostrado ser un proveedor constante y confiable, lo que lo ha convertido en el principal productor y exportador de camarón Vannamei en el mundo. Su ecosistema único y condiciones climáticas privilegiadas hacen de Ecuador un lugar perfecto para el cultivo de camarón a lo que deben sumarse factores como la genética, nutrición y manejo en finca, que

han evolucionado a lo largo de más de medio siglo de trayectoria.
En 2021, Ecuador exportó alrededor de 1.855 millones de libras, lo que representó cerca de $5.078 millones de dólares. Sólo a EE. UU. se exportaron alrededor de 406 millones de libras, lo que significó un aumento del 56% con respecto a 2020. El consumidor
estadounidense prefiere presentaciones con valor agregado, como camarón sin cabeza, pelado y desvenado, entre otros.
Ecuador tiene como objetivo satisfacer esta demanda y por esta razón muchas plantas procesadoras están haciendo inversiones para expandir su oferta de camarones para el mercado de los Estados Unidos.
“Estoy en esta industria desde el año 1984 y es la primera vez que se logra traer a la mesa, un grupo tan diverso e importante de compradores en forma gremial. Este tipo de procesos dan un mensaje muy positivo hacia el exterior de que en el Ecuador se están haciendo las cosas bien, de que Ecuador tiene un potencial de crecimiento, que hay interés en el país de diversificar las exportaciones, y lo más importante de todo, es dando al mercado un camarón sano, saludable y sustentable”.

“Ecuador tiene que empezar a abrirse al mercado en el segmento de los supermercados y de la distribución masiva, y aquí vino un grupo muy representativo de ese segmento. Hemos podido demostrarles la diferencia que existe en la producción ecuatoriana de camarón, sobre todo las ventajas, los beneficios y la calidad de nuestro camarón, que queremos que también sea transmitida a los consumidores de Norteamérica. A través de esta visita hemos podido resaltar la posición de Ecuador como líder mundial en la producción y exportación de camarón”.
“El hecho de que un importante grupo de compradores, de los más exigentes retailers de Estados Unidos, hayan puesto sus ojos en Ecuador y decidieron venir a ver, de primera mano, las prácticas que nos hacen mejores y aquellas razones por las cuales Ecuador produce el Mejor Camarón del Mundo, es algo que sin duda alguna habla muy bien de nuestra industria. Creo que esta visita va a generar un impacto muy positivo en los esfuerzos comerciales que hemos venido realizando para tener mayor presencia en este mercado”.



 Rodrigo Laniado CEO de SONGA y Miembro Fundador de SSP
Rodrigo Laniado CEO de SONGA y Miembro Fundador de SSP


 Sandro Coglitore Gerente General de Omarsa y Miembro Fundador de SSP
José Antonio Lince
Presidente Ejecutivo del Grupo ALMAR y Miembro Fundador de SSP
Sandro Coglitore Gerente General de Omarsa y Miembro Fundador de SSP
José Antonio Lince
Presidente Ejecutivo del Grupo ALMAR y Miembro Fundador de SSP
14
Delegación visitó la planta SONGA
Delegación visitó la planta OMARSA
Delegación visitó la planta PRODUMAR

Primera brigada de regularización camaronera 2022 Pedernales - Manabí
El15 de agosto, en el centro Comercial Municipal de Pedernales en Manabí se instaló la primera brigada de regularización camaronera. Varias autoridades provinciales se dieron cita en el acto inicial que fue liderado por el Subsecretario de Acuacultura Axel Vedani.

El proceso inició a nivel nacional, el pasado 25 de abril, tras emisión del Decreto Ejecutivo que fue presentado por el Ministerio de Producción, Comercio Exterior, Inversiones y Pesca.
Actualmente, existen más de 4090 predios camaroneros que representan 218.350,98 hectáreas a nivel nacional, de este Universo Total, existen alrededor de 724 predios irregulares, representados en 18.901,46 hectáreas sin su respectivo Acuerdo Ministerial.
Hasta la presente fecha, 69 predios camaroneros están en proceso de regularización, estos representan 1.064,46 hectáreas a nivel nacional. Hasta el cierre de esta edición, las brigadas han logrado asesorar y recopilar expedientes de regularización de 49 predios camaroneros que suman 759,72 hectáreas entre las provincias de Manabí y Esmeraldas. El proceso de regularización está dirigido a los camaroneros que tienen predios en zonas de playa y bahía.
En estas cuatro semanas de brigadas realizadas en la provincia de Manabí y Esmeraldas, se ha atendido de manera prioritaria los siguientes tipos de trámite:
- 10 Cesiones de Derecho de Concesión
- 12 Autorizaciones para Ejercer la Actividad Acuícola en Zonas Altas.
- 5 Autorizaciones para funcionamiento de
Ministerio de Producción, Comercio Exterior, Inversiones

Pesca.
Laboratorios de Especies Bioacuáticas - 8 Renovaciones de Concesión
"Aprovechamos las brigadas de regularización para atender el resto de productos y servicios que ofrece la subsecretaría a los productores, ya que no solo se ha evidenciado irregularidad en cuanto a predios de playa y bahía, sino también con otras actividades". Axel Vedani, Subsecretario de Acuacultura.
COYUNTURA
PROVINCIA El Oro Guayas Manabí Esmeraldas TOTAL PREDIOS EN ZONA DE PLAYA Y BAHÍA N° Ha. 11 166,51 9 138,23 34 345,42 15 414,30 69 1.064,46 Fuente:
y
Lo que ha ocasionado una motivación del pequeño y mediano productor, en regularizar su actividad en cualquiera de sus fases, al encontrar en la actual administración las facilidades para disminuir el tiempo de obtención de su respectivo Acuerdo Ministerial.
PUNTOS DE ATENCIÓN
Esmeraldas: Coordinación Zonal 1, Puerto Artesanal Pesquero. Plataforma de Servicios Estatales, Centro de Atención Ciudadana, Bloque B, piso 2, ala oeste.
Manabí: Inspectoría de Control Acuícola de Pedernales, (zona centro-sur): Inspectoría de Control Acuícola en la ciudad de Bahía de Caráquez, Mercado Municipal.
El Oro: Coordinación Zonal 7, en la ciudad de Machala, calle Vela entre 25 de Junio y Sucre, edificio EXPREDESUR, piso 2.
Guayas/Santa Elena: Ventanilla Única en la ciudad de Guayaquil, Av. Malecón y Blvd. 9 de Octubre, piso 15 del edificio La Previsora.
REQUISITOS
•Llenar la solicitud de ingreso

•Adjuntar el comprobante del pago de tasa de 500 dólares en cualquier institución bancaria
•Presentar tres ejemplares del plano del terreno
•Certificado de Intersección (MAATE) que demuestre que no existe una intersección con algún patrimonio forestal y/o zona intangible
•Declaración juramentada ante un notario público demostrando que el área ha sido explotada por un mínimo de 5 años
En abril del 2023 finalizará el proceso de regularización. La próxima brigada de regularización se realizará en la provincia de El Oro durante el último trimestre de 2022•

“La regularización es un hito fundamental para el sector camaronero, pues los predios de playa y bahía que no están regularizados todavía no tienen acceso al crédito, es ilegal comercializar su camarón y no acceden a programas de desarrollo como por ejemplo: la electrificación”.

- OCTUBRE 2022
Oswin Crespo Presidente de Cooperativa de productores de camarón de Manabi y Esmeraldas COOPRACAME
Ricardina Puertas, miembro de la directiva de COOPRACAME; Nilton Díaz, Gerente Zonal de Portoviejo BANECUADOR; Axel Vedani, Subsecretario de Acuacultura; Antonio Icaza Morla, Gerente General de CNEL EP y Luis Robles, Director Adjunto de la Cámara Nacional de Acuacultura.
SHRIMP MARKET NEWS Y DATA

Dos importantes herramientas para análisis de mercado

La
Cámara Nacional de Acuacultura desde hace 29 años, agrupa y representa al sector acuícola ecuatoriano y desde aquel tiempo se ha preocupado por mantener informado al camaronero sobre el comportamiento de las exportaciones en sus principales mercados, a través de su reporte estadístico mensual enviado a sus socios y suscritos en el sitio web institucional www. cna-ecuador.com.
“La CNA ha sido siempre un referente en materia de estadísticas de exportaciones de camarón ecuatoriano. Nuestro Reporte de Exportaciones Mensuales de Camarón es un documento clave para conocer el comportamiento del sector exportador ecuatoriano, de esta manera, revisamos nuestras suscripciones, procesamos la información y la consolidamos en un solo reporte para que, de manera sistemática y amigable, nuestros suscriptores puedan estar más al día del mercado internacional del camarón”.

Daniel Pesantes
Gerente de Comercio Exterior de la Cámara Nacional de Acuacultura
Sin embargo, ante el crecimiento acelerado de la industria, se ha creado una demanda de nuevos productos y servicios comunicacionales que sirvan para darle la oportunidad a sus usuarios de tener herramientas para su análisis y toma de decisiones.
Es así que, en noviembre de 2020 se creó el boletín de inteligencia comercial Shrimp

Market News SMN que presenta información de primera mano sobre noticias de diferentes acontecimientos que se generan a nivel mundial, específicamente en los principales mercados compradores de camarón, así como en nuestros competidores.
En menos de 3 años, se han emitido 59 boletines que han sido difundidos de forma quincenal los días martes. Shrimp Market News tiene una base de más de 1300 suscriptores y se ha convertido en un referente de información coyuntural del mercado internacional.
Continuando con la innovación, el departamento de Comercio Exterior consideró fundamental generar información adicional que ayude a la capacidad de análisis de los diferentes actores del sector, por lo que decidió elaborar informes estadísticos más focalizados. De esta manera nació su nuevo producto comunicacional Shrimp Market Data SMD, la nueva serie de reportes estadísticos de la Cámara Nacional de Acuacultura donde podrá conocer de manera periódica y actualizada las cifras del comercio exterior y el comportamiento del intercambio comercial de los principales mercados de camarón.


SMD presenta información actualizada de los principales mercados competidores de Ecuador, como: India, Vietnam e Indonesia. Mediante estos reportes de mercados

competidores, el suscriptor puede conocer mensualmente a qué países están exportando, su crecimiento y tendencia; para de esta manera, comprender un poco más del comercio mundial del camarón.
De igual manera, también consideramos de importancia que los suscriptores conozcan cómo se están comportando los principales países importadores de camarón: Estados Unidos, China y la Unión Europea.
Al momento se han elaborado y difundido más de 10 reportes, tanto para mercados importadores como exportadores. SMD se elabora de manera mensual para cada mercado de interés, con el objetivo que el suscriptor pueda revisar de manera permanente información actualizada de las cifras de comercio exterior de estos mercados.
El equipo técnico de la Cámara Nacional de Acuacultura ha identificado una demanda creciente en informarse sobre los procedimientos de acceso a los diferentes mercados internacionales, como aranceles y requisitos sanitarios, por lo que actualmente el departamento de comercio exterior se encuentra trabajando en un nuevo piloto que se prevé esté listo a inicios del 2023•
Aqua Expo 2022 tendrá la exposición comercial más grande de la historia
Elevento técnico camaronero más importante del continente se realizará del 17 al 20 de octubre en el Centro de Convenciones de Guayaquil. La exposición comercial tendrá un área de alrededor de 7 mil metros cuadrados, donde se realizará el montaje de más de 200 stands. Empresas nacionales y extranjeras mostrarán la innovación de la industria, a través de productos y servicios para todos los eslabones de la cadena acuícola. Se espera que alrededor de tres mil personas visiten la feria comercial diariamente este año.

En lo que respecta al congreso Aqua Expo

2022, el programa técnico se desarrollará en dos salas de forma simultánea, abordando temas de salud animal, nutrición y manejo de la alimentación, calidad e inocuidad, procesos eficientes de producción, uso de nuevas tecnologías, sostenibilidad, certificaciones y proyecciones del mercado del camarón. Más de 60 conferencistas nacionales y extranjeros participarán en exposiciones y paneles.
El acto inaugural se realizará el 17 de octubre a las 19h30 y contará con la presencia de autoridades de gobierno y seccionales, así como representantes de la industria y la
academia. El evento es patrocinado por Agrantech, BioMar, BiofortSP, Cargill, DSM, Nicovita, Skretting y USSEC.
Se ha logrado una alianza con medios internacionales como AquaFeed, Panorama Acuícola e Infofish para la difusión y cobertura del congreso.
La Cámara Nacional de Acuacultura, entidad organizadora del evento por más de dos décadas, invita al sector acuícola mundial a ser parte de la innovación y el crecimiento de la industria que cada año se reúne en un solo lugar: Aqua Expo 2022.

- OCTUBRE 2022COYUNTURA 20
Más de 200 stands mostrarán la innovación del sector acuícola mundial

LÍDER
ATTILIO CÁSTANO BAQUERIZO

Attilio
Eduardo Cástano Baquerizo nació el 8 de mayo de 1959. Está casado desde hace 35 años con Verónica Maquilón Sánchez con quien tiene dos hijos, Attilio y Diego.
Su formación profesional la realizó en Georgia Institute of Technology, donde se graduó de Bachelor of Science and Industrial Management.
Su actividad profesional comenzó en abril de 1984, poco tiempo después de haber concluido sus estudios universitarios. Empezó como supervisor de la construcción de la camaronera Gambalit de 235 ha. ubicada en la isla Mondragón, para después convertirse en supervisor de producción.
Después vino Langolit, laboratorio integrado de maduración y larvicultura. Estuvo a cargo de todo el proyecto desde la construcción y luego de la operación, labores que desempeñó hasta octubre de 1988.
En noviembre de 1988 emprendió en algunas actividades de diferente índole, dando paso a lo que hoy es Apracom S.A., razón social
adoptada en 1999. Empezó como una empresa enfocada en el mercado nacional, pero con el paso del tiempo sus servicios se fueron expandiendo hacia Colombia, Perú, Bolivia, Paraguay y recientemente hacia México. Estos negocios los realizó de manera paralela a su actividad como productor camaronero, la cual concluyó el 15 de diciembre de 2021 con la venta de Gambalit.
Sus primeros pasos como empresario fueron: importación de artemia, importación de pruebas biológicas para detectar enfermedades de camarón, asesorías a Bioltecsa, primer laboratorio que logró producir larvas de camarón en el Perú, importación e implementación de pruebas para inocuidad alimentaria, entre otros.
Como muchos empresarios de este país ha sufrido más de un revés con la inestabilidad política-económica, presencia de enfermedades, epidemias e inseguridad; sin embargo, su espíritu de lucha y tenacidad lo han llevado a estar a la vanguardia para adaptarse a las circunstancias que se van presentando.
A mediados de 2014 se convirtió en el pionero en la implementación de la alimentación automática bajo demanda sónica en América Latina, lo cual es considerado su mayor logro profesional debido al aporte que ha dado a la industria camaronera. Este hito en la industria rompió paradigmas establecidos, incorporando conceptos innovadores que mejorarían la productividad y competitividad en la producción de camarón, tales como:
-Reducción en la conversión de alimentos, es decir, menor cantidad de alimento requerido para conseguir cada kg. de camarón.
-Aceleración en el crecimiento del animal, lo que permite aumentar los ciclos de cultivos anuales.
-Mejoramiento de condiciones biológicas en las piscinas debido al menor consumo de alimento, lo que permite producir más kilogramos por hectárea por ciclo.
“La alimentación automática bajo demanda sónica es una tecnología dinámica que implica un continuo mejoramiento tecnológico tanto en el software como en el hardware, por lo que me atrevo a predecir que la industria
DEL SECTOR CAMARONERO
Acuicultor, experto en tecnificación camaronera
22
camaronera dentro de 10 años no será la misma a lo que es hoy en día, se van a ver grandes cambios como los que hemos visto desde el 2014 cuando empezamos con este proyecto. En el año 2013 se exportaron 216 mil toneladas de camarón, durante el primer semestre de 2022 se han exportado 500 mil toneladas, lo que permite proyectar que para finales de este año se llegarían a 1.15 millones de toneladas de camarón exportadas. Estas cifras impresionantes se dan gracias al avance de la tecnificación

de la industria, proceso del cual me siento orgulloso de ser parte”, indicó Attilio.
El estar relacionado por años al sector acuícola lo ha llevado a formar parte de los distintos gremios camaroneros: fue miembro fundador de la Asociación de Laboratorios de Larvas de Camarón del Ecuador ALAB, miembro de la Cámara de Productores de Camarón y miembro fundador de la Cámara Nacional de Acuacultura CNA.
Attilio Cástano siempre ha estado ligado a la industria camaronera, ahora ya no como productor sino como proveedor de tecnología, por lo que su mayor reto es mantener a la industria altamente tecnificada para seguir siendo competitiva con los otros países productores.

Debido a su trayectoria y contribución al sector, el Comité organizador de Aqua Expo le dará un reconocimiento en su evento técnico comercial de octubre 2022•

CONDECORADO AQUA EXPO- OCTUBRE 2022
“Nuestras acciones, sin importar el resultado, nos llevan hacia una enseñanza, lo importante es estar atentos y sacar lo mejor de nuestro aprendizaje diario”.
Attilio Cástano Baquerizo Líder Camaronero
Attilio Cástano y su hijo Diego Cástano Maquilón en la planta APRACOM, empresa familiar.
FRANCISCO PONS NEUMANE
Nació
en Guayaquil, es hijo de María Eloísa Neumane y Francisco Pons Y Millas quien era un reconocido productor bananero de la parroquia Tenguel, del cantón Guayaquil en la provincia del Guayas.

Francisco Pons Neumane está casado con Mariana Zevallos, desde hace más de 50 años. Tiene 3 hijos: Francesca, Francisco y Muriel; a su vez tiene 8 nietos. Estudió en el Colegio “San José” La Salle y obtuvo su título de Ingeniero Comercial y Magíster en finanzas en la Universidad de Guayaquil.
Su actividad profesional comenzó en enero de 1967, cuando asumió su primer reto como Gerente Comercial y Representante Legal de All America Cables and Radio donde permaneció por más de 3 años; luego asumió la Gerencia General de reconocidas empresas locales y multinacionales. Durante su ejercicio profesional realizó seminarios de administración, alta gerencia, organización, dirección empresarial y desarrollo gerencial. Dictó conferencias en los clubes: Rotary
Norte y Centro; sobre “El Mercado de Valores en el Ecuador”.
Se involucró en el mundo acuícola a finales de 1982 cuando la familia Maspons le propuso trabajar en el “Grupo El Rosario” que inicialmente tenía una camaronera en la Isla Bellavista en el Golfo de Guayaquil. Ocupó el cargo de gerente general y pudo ser parte de la construcción y desarrollo de los laboratorios de larvas y las piscinas camaroneras. “Se construyeron fincas camaroneras en la hacienda La Josefina, en la isla Bellavista y laboratorios de larvas de camarón en Punta Blanca creados con la asitencia de un grupo extranjero en sus inicios. Fue una época de puro desarrollo y construcción. Aprendí cosas que en la universidad no aprendí: el trabajar duro, el competir, el tener metas y planificar”, afirmó Pons.
Tiempo después en 1986, adquirió una camaronera de 100 hectáreas y en el año 1991 adquirió otro predio de 400 hectáreas en la Isla Escalante; sin embargo, trabajar en el Golfo de Guayaquil era muy duro y riesgoso por la delincuencia que se registra desde aquella época.
Fue gerente general y propietario de la camaronera “Camadipsa”, tiempo después, en la finca Productora de Camarón “Piscícola San Andrés, Nutriagro”; laboratorio de larva de camarón y BRUMESA, finca productora de camarón.
Sus estudios financieros, de administración y organización fueron muy útiles al momento de incorporarlos a su trabajo de campo. Afirma que le apasiona la mecánica y organizar todo desde su diseño y planificación. “Tienes que ensuciarte, tienes que saber de motores, tienes que saber de construir, tienes que saber interpretar un balance, tienes que saber todo”.
Pero en 1999 la industria camaronera ecuatoriana, vivió su peor época con la llegada de la Mancha Blanca: “Fueron cinco años muy duros en los cuales sembrabas y sacabas 80 - 100 libras en camarón, en diez hectáreas. De las 400-500 hectáreas que teníamos, nosotros nos quedamos con 100 solamente en producción. Uno de los éxitos del camaronero de hoy, es haber puesto esfuerzo y ha sido por mérito propio, individual. No tuvimos un aporte del gobierno ni nada en ese sentido, sino
LÍDER DEL SECTOR CAMARONERO
24
Acuicultor, experto en finanzas, docente y deportista
“Yo siempre pongo mente y corazón, tanto en mi vida diaria, mi trabajo, mi familia y el deporte. Creo en el negocio familiar de acuacultura, ahora tenemos el reto de ser más eficientes de la mano con la tecnología¨

que fue, una motivación del propio sector en la cual decimos ‘no, ese es el camino’ y comenzamos a esforzarnos en trabajar en genética, en los reproductores para hacer una larva mucho más fuerte, mucho más resistente que a la larga dio resultados”.
Otro de los desafíos a lo que se enfrentaba en aquella época era estar al día con la innovación, pues el sector acuícola crecía de forma acelerada “Los nuevos procedimientos de acuacultura: recambios de agua, construcciones de compuertas, diseño de
los muros, todo lo que era la parte operativa. En los laboratorios era una tecnología nueva incorporar la maduración y todo lo que era el proceso de la larvicultura era muy importante en esa época”.
Su hijo Francisco, graduado en la Universidad de Texas A&M en la rama de acuacultura, sigue su legado, quien desde hace más de 10 años está muy involucrado en la parte productiva de su camaronera ubicada en Chanduy, provincia de Santa Elena. Se dedica principalmente al manejo de piscinas
y los procesos de alimentación, por lo que siempre están intercambiando experiencias.
Otra de las facetas del experto en finanzas y acuicultor es la docencia, ha ejercido como seminarista y catedrático de la Universidad Católica de Guayaquil. Pero su mayor pasión desde muy pequeño es el deporte.
Debido a su trayectoria y contribución al sector, el Comité organizador de Aqua Expo le dará un reconocimiento en su evento técnico comercial de octubre 2022•


CONDECORADO AQUA EXPO- OCTUBRE 2022
Francisco Pons Neumane Líder camaronero.
Francisco Pons y su hijo Francisco Pons Zevallos
LÍDER DEL SECTOR CAMARONERO
RICCARDO CARLO DELFINI MECHELLI

Riccardo
Carlo Delfini Mechelli nació el 5 de febrero de 1940 en Adís Abeba, Etiopía, excolonia italiana; sus padres fueron Enrico Delfini Incarnati, ingeniero civil y Gabriella Mechelli Basili, maestra de escuela. Está casado con María Elvira Mateus Ponce y tiene 3 hijos: María Elvira, Riccardo y Gabriella.
Su formación profesional la realizó en Michigan Technological University de Estados Unidos. Se graduó de Ingeniero eléctrico y realizó estudios de postgrado en física, ingeniería nuclear y matemáticas avanzadas.
En Ecuador, su actividad profesional se inició en la Escuela Superior Politécnica del Litoral donde fue profesor de ingeniería eléctrica en potencia y distribución y en matemáticas aplicadas. Con solo 26 años llegó a ser director del Departamento de Ingeniería Eléctrica. Más adelante, contribuyó con la planificación estructural y académica de la ESPOL y fue el promotor de la carrera de ingeniería electrónica.
En 1966 Ricardo Delfini fundó la empresa de ingeniería Delfini & Cía. Ltda. (DELTA), junto con su padre y sus hermanos Alfonso y Francesco. Su aporte al sector acuícola ha
sido principalmente el diseño y fabricación de bombas de gran caudal y de equipos de refrigeración industrial para plantas de procesamiento de camarón.
Riccardo Delfini se involucró con el sector acuícola a mediados de la década del 70. Indica que “cuando en Ecuador se inició el desarrollo de la industria acuícola vimos la oportunidad de contribuir en el crecimiento de esta industria desarrollando equipos de bombeo de fabricación nacional. Para ese entonces las bombas que se comercializaban en el país eran todas de origen extranjero y DELTA se propuso ofrecer al sector un equipo de altísima eficiencia diseñado para operar en agua de mar. En el año 1978 iniciamos la investigación bibliográfica y experimental para alcanzar ese objetivo, lográndose ofrecer al mercado las primeras bombas en versión comercial a inicios de la década de los 80.”
Considera como sus mayores logros el haber servido activamente al sector acuícola no solo en el desarrollo de equipos de bombeo de la más alta eficiencia y calidad, sino también el haber acompañado a muchos camaroneros en la tecnificación exitosa de sus fincas. Como resultado de la continua investigación
en la mejora de las bombas DELTA, se han logrado eficiencias que superan el 90%, esto ha resultado en un significativo ahorro energético y por ende económico al sector.
Una de las experiencias más duras que le tocó afrontar fue durante la crisis de la mancha blanca que afectó a todo el sector camaronero, a consecuencia de lo cual la demanda de equipos de bombeo se redujo significativamente en el mercado nacional. Sin embargo, gracias a la demanda del mercado internacional, en el cual DELTA ya había incursionado, la compañía pudo sobrellevar este difícil período. Su empresa buscó incrementar las ventas en el mercado externo y poco a poco aumentaron las exportaciones de bombas ecuatorianas a otros países. Como resultado de este enfoque internacional, hoy en día DELTA tiene bombas operando en 26 países alrededor el mundo y las exportaciones de estos equipos representan entre el 40 y 50% de su producción.
Entre sus anécdotas recordó: “En medio de una reunión con el equipo de ingenieros de DELTA en el año 2008, mientras discutíamos el problema que atravesábamos en ese entonces por la crisis mundial en
Referente de la ingeniería en Ecuador. Destacado ingeniero eléctrico, matemático, y docente universitario.
- OCTUBRE 2022 26
el suministro de acero y la afectación directa sobre los precios de nuestras bombas, presenté en la reunión el bosquejo de una solución para la crisis del momento; se trataba del dibujo a mano alzada de la bomba de descarga abierta. Esta novedosa opción representaba un equipo de menor costo por el menor requerimiento de acero (entre el 20 y 25% menos) para su construcción, y lo más importante, sin afectar la eficiencia hidráulica del equipo. Este nuevo concepto de bomba de gran caudal, inicialmente concebido para ahorrar materiales, representa hoy en día un importante porcentaje de las bombas DELTA de gran caudal que se encuentran operando en el sector acuícola del país y del exterior, incluyendo el Medio Oriente. Esta anécdota es otro caso que demuestra que en los momentos más difíciles es cuando se presentan oportunidades de desarrollar ideas novedosas”, indicó Riccardo Delfini Mechelli.


En lo que respecta a su mensaje para el sector camaronero indicó: ¨Vivimos tiempos en los que, como pocas veces antes, el costo de la energía se ha vuelto un factor crítico que afecta la rentabilidad de las empresas a nivel mundial. Esta situación se ha agravado por lo que está ocurriendo en Europa en estos momentos. En este sentido, y en relación con el sector camaronero, debo destacar que la eficiencia de los equipos de bombeo tiene una importante incidencia en los costos de operación de las fincas¨.
Por su trayectoria y contribución social – económica, Riccardo Delfini Mechelli recibió a mediados de 2022 el Doctorado Honoris Causa de la ESPOL y en octubre del mismo año, el Comité Técnico de Aqua Expo le otorgará un reconocimiento por su importante aporte a la industria camaronera ecuatoriana•

¨Los camaroneros deben considerar que lo importante, al implementar un sistema de bombeo, no es tanto la inversión inicial, sino su costo de operación. Un sistema de bombeo eficiente se paga en muy poco tiempo por el ahorro en combustible o energía eléctrica que consume. Un sistema eficiente contribuye, además, a disminuir el impacto de la operación del sistema en los efectos que contribuyen al cambio climático".
Riccardo Carlo Delfini Mechelli
CONDECORADO AQUA EXPO 27
De izquierda a derecha: Ing. Riccardo Enrico Delfini Mateus (hijo), Sra. María Elvira Mateus Ponce (esposa), Ing. Riccardo Delfini Mechelli (con investidura del Doctorado Honoris Causa otorgado por la ESPOL), Gabriella Maria Delfini Mateus (hija) y Maria Elvira Delfini Mateus (hija).


El órgano linfoide (LO) como objetivo principal adicional del virus iridiscente de los decápodos 1 (DIV1) en Penaeus vannamei
Autores:
Piyachat Sanguanruta
Dararat Thaiuea
Jumroensri Thawonsuwanb
Diva J. Aldama-Canoc, Timothy W. Flegelc,d Kallaya Sritunyalucksanaa,*
aEquipo de Investigación en Salud de Anima les Acuáticos, Grupo de Investigación en Bio tecnología Acuícola Integral, Centro Nacio nal de Ingeniería Genética y Biotecnología (BIOTEC), Agencia Nacional de Desarrollo de Ciencia y Tecnología (NSTDA), oficina de Yo thi, Rama VI Rd., Bangkok 10400, Tailandia
bCentro de Investigación y Desarrollo de Salud de Animales Acuáticos de Songkhla (SAAHRDC), División de Investigación y De sarrollo de Salud de Animales Acuáticos, Departamento de Pesca, 130/2 Pawong, Amphur Muang, Songkhla 90100, Tailandia
cCentro de Excelencia en Biología Molecu lar y Biotecnología de Camarón (Centex Shrimp), Facultad de Ciencias, Universidad Mahidol, Rama VI Rd., Bangkok 10400, Tai landia d Centro Nacional de Ingeniería Ge nética y Biotecnología (BIOTEC), Agencia Na cional de Desarrollo Científico y Tecnológico (NSTDA), Klong Luang, Pathumthani 12120, Tailandia
Elnombre DIV1 (virus iridiscente de decápodos 1) se propuso simultáneamente con una descripción de sus infecciones en Exopalaemon carinicauda (Chen et al., 2019). Sin embargo, se describió por primera vez en China como C. quadricarinatus iridovirus/CQIV, infeccioso para C. quadricarinatus, Procambarus clarkii y P. vannamei (Xu et al., 2016; Li et al., 2017), o como virus iridiscente de hemocitos del camarón (SHIV) (Qiu et al., 2017; Qiu et al., 2018) infecciosas para P. vannamei, P. chinensis y Macrobrachium rosenbergii. Por lo tanto, DIV1 tiene una amplia gama de huéspedes conocidos que incluye varias especies de crustáceos cultivados económicamente importantes. DIV1 produce lesiones histopatológicas únicas en el tejido hematopoyético.
Los reportes anteriores sobre el DIV1 de China que incluían análisis histológicos (Xu et al., 2016; Qiu et al., 2017; Chen et al., 2019), describieron lesiones de tipo DIV1 en el tejido hematopoyético (HPT) para todas las especies de crustáceos infectados estudiadas. Otras publicaciones sobre DIV1 no incluyeron análisis histológico y no fueron relevantes para nuestro trabajo. Las lesiones de DIV1 consistieron en inclusiones citoplásmicas basófilas únicas en el HPT (Qiu et al., 2017) y pueden considerarse patognomónicas por infecciones de DIV1 También describieron lesiones adicionales en branquias, tejido conectivo y células intersticiales del hepatopáncreas (HP). No describieron lesiones en el órgano linfoide (LO). Esto no sorprende porque el LO se encuentra solo en camarones peneidos (Rusaini, 2010). Incluso así, a veces está ausente en las secciones de tejido porque sus dos lóbulos son pequeños, están cerca de la línea media sagital del cefalotórax y están unidos a la superficie anterior del HP justo debajo de su unión con la cámara posterior del estómago. Para las preparaciones
histológicas, el cefalotórax generalmente se corta en dos partes en posición sagital media y se coloca con el lado interno hacia abajo en un cassette de inclusión. Por lo tanto, si el bloque de parafina resultante se corta demasiado antes de que las secciones de tejido se transfieran a un portaobjetos del microscopio, es posible que el LO no se incluya en las secciones.
El propósito de este informe es brindar una descripción académica completa de las actividades que llevaron a nuestro descubrimiento que el LO del camarón blanco Penaeus vannamei es útil para detectar y confirmar infecciones con el virus iridiscente de decápodos (DIV1). Los resultados se publicaron previamente como un anuncio urgente resumido (Sanguanrut et al., 2020) sin detalles adjuntos. La información de que el LO era un órgano objetivo de DIV1 se incorporó a la ficha de enfermedad de DIV1 (Qui y Huang, 2020) disponible o de descarga gratuita en el sitio web (enaca.org) de la Red de Centros de Acuicultura en Asia-Pacífico (NACA). Los únicos camarones peneidos mencionados como infectados con DIV1 en informes previos fueron P. vannamei (Li et al., 2017; Xu et al., 2016; Qiu et al., 2017) y P. chinensis (Qiu et al., 2017), y el LO no se mencionó como objetivo para DIV1 en estas 3 publicaciones. Dado que P. vannamei es la especie dominante de camarón cultivada en el mundo hoy en día, creemos que es importante que la información para acelerar el diagnóstico de infecciones por DIV1 mediante análisis histológico, es un asunto urgente. Por tanto, describir sus lesiones en el OI es un paso importante en esta dirección. Aquí describimos las pruebas de PCR más el análisis histopatológico (HA) y los ensayos de hibridación de ADN in situ (ISH) que revelan que, además del HPT, el LO de Penaeus vannamei es un objetivo principal para DIV1.
Materiales y métodos
Procedencia de los tejidos preservados utilizados y material complementario
Recibimos camarones congelados sospechosos de estar infectados con DIV1 de una fuente no revelada, junto con una solicitud para determinar de manera confidencial y concluyente, si las muestras estaban infectadas con DIV1. Para cumplir con esta solicitud, se consideró necesario utilizar la tecnología de reacción en cadena de la polimerasa (PCR) y la secuenciación de amplicones para realizar pruebas del DIV1
- OCTUBRE 2022 30 PATOLOGÍA
kallaya@biotec.or.th (K. Sritunyalucksana) www.elsevier.com/locate/aquaculture https://doi.org/10.1016/j.aquacultu re.2021.737482
en los camarones congelados, seguido de la confirmación mediante análisis histológico (HA) y un análisis de hibridación in situ (ISH). Dado que el HA y el ISH no son posibles para camarones congelados, fue necesario llevar a cabo un trabajo preparatorio adicional que incluye 1) la preparación de un extracto viral del camarón congelado como inóculo para el bioensayo (es decir, inyección de P. vannamei saludables), 2) confirmación por PCR de que el DIV1 estaba presente en el inóculo y 3) preparación de bloques de tejido para análisis histológico e ISH. Este informe se refiere únicamente al análisis histológico y al trabajo de ISH con esos bloques de tejido. Por lo tanto, todo el trabajo preparatorio realizado se hizo simplemente para validar que los tejidos examinados histológicamente procedían de camarones realmente infectados con DIV1. Por estas razones, los detalles de los métodos y los resultados de los 3 pasos preparatorios para la validación de tejidos se brindan como material complementario y no se incluyen en el cuerpo principal del paper. Estas secciones incluyen, Información complementaria 1: Preparación de extractos de tejido (es decir, inóculo) de camarones congelados; Información complementaria 2: métodos y resultados de PCR para la detección del DIV1 en el inóculo y en camarones de bioensayo; Información complementaria 3: Inyección de P. vannamei saludable con el inóculo del DIV1 de reserva; Información complementaria 4: Toma de muestras y preparación de muestras para análisis histopatológicos. El manejo del tejido congelado y las pruebas de infección se llevaron a cabo en una instalación de cuarentena biosegura, y lo único que se exportó fueron homogeneizados de tejido en tampón de lisis (materiales no infecciosos) y bloques de parafina que contenían tejidos de camarón incrustados.
Hibridación in situ (ISH)
Cada prueba ISH constaba de 5 portaobjetos de secciones de tejido adyacentes de aproximadamente 5 μm de espesor, uno para tinción H&E normal (Bell y Lightner, 1988), un control negativo sin sonda, un control negativo con sonda para el virus de la cabeza amarilla (YHV) y una sonda positiva para cada uno de los dos genes objetivos DIV1 (ATPasa y MCP). Las 2 sondas de hibridación DIV1 se sintetizaron utilizando primers SHIV-F1/SHIV-R1 para la ATPasa del gen (tamaño del amplicón = 457 pb) y usando primers DIV1-F576/DIV1-R576 (tamaño del
amplicón = 576 pb) para el gen objetivo MCP. Ver Materiales complementarios 2 para los protocolos de PCR.
La sonda de control negativo de YHV (277 pb) se sintetizó basándose en la región ORF1b del genoma del virus de la cabeza amarilla (YHV) (sonda YHV) (Cowley et al., 2004). Esto es superior a un control sin sonda porque los resultados negativos del ISH indicarían que cualquier resultado positivo con las sondas DIV1 no podría ser un resultado falso positivo debido a la unión no específica de la sonda DIV1-ADN. Además, un resultado negativo indicaría que los supuestos núcleos picnóticos y cariorrecticos observados en las branquias y el órgano linfoide de las muestras inyectadas con DIV1 no surgieron de una infección por YHV, que también produce núcleos picnóticos y cariorrecticos en las branquias y el órgano linfoide de camarones peneidos (Chantanachookin et al., 1993).
Todas las sondas se sintetizaron utilizando un kit de marcaje PCR DIG (Roach, Alemania) y se purificaron con el kit de limpieza Gel/ PCR (Geneaid, Taiwán) con los protocolos descritos por los fabricantes del kit. La parafina embebida en secciones de tejido se incubó sobre los 60 °C durante 1h para derretir la parafina y luego desparafinarla con xileno antes de la rehidratación en una serie graduada de etanol a agua destilada y luego tampón TNE (500 mM Tris-Cl, 100 mM NaCl, 10 mM EDTA).
Los cortes de tejido rehidratados se trataron con 5 μg/ml de proteinasa K en tampón TNE a 37 °C durante 15 min en una cámara humidificada antes de la incubación con EDTA 0.5 M durante 1h, formaldehído frío al 4% durante 5 min y agua destilada a temperatura ambiente (RT) durante 5 min. Las secciones se incubaron en tampón de prehibridación [4x SSC con formamida desionizada al 50% (v/v)] a 37 °C durante al menos 10 min. Luego, 100–200 ng de cada sonda marcada con DIG se mezcló con tampón de hibridación [50% de formamida desionizada, sulfato de dextrano al 5% (p/v), 1 solución de Denhardt (Sigma, EE. UU.), 0.25 mg/ml de ADN de esperma de salmón (Invitrogen, EE. UU.), 4X SSC)] y luego se desnaturaliza a 95°C durante 5 min antes enfriamiento inmediato sobre hielo. Cada sonda desnaturalizada se pipeteó en una sección de tejido adecuada, se cubrió con un cubreobjetos y se calentó a 95 °C durante
5 min. Luego, los portaobjetos se incubaron a 42°C durante la noche en una cámara humidificada antes de lavar secuencialmente en 2× SSC a 37 °C, 1× SSC a 42 °C, 0.5× SSC a 42 °C seguido de Tampón I (1 M TrisHCL, 1.5 M NaCl, pH 7.5) durante 5 min cada uno.
Finalmente, las secciones se incubaron con tampón de bloqueo al 0.5% (Roche, Alemania) en 1x tampón I a temperatura ambiente (RT) durante 1 h. Los portaobjetos se incubaron con un anticuerpo anti-DIG-AP 1:500 (Roach, Alemania) a 37 °C durante 1h y se lavaron 2x10 min con tampón I. La señal se desarrolló usando una solución NBT/BCIP (Roche, Alemania) en una cámara oscura a RT, después de lo cual cada portaobjetos se tiñó nuevamente con Bismarck Brown Y al 0.5% (Sigma, EE. UU.), luego se deshidrató y se cubrió con Permount (Fisher Scientific, EE.UU.) y fue examinado con microscopía óptica (Leica DM750, modelo ICC50W con cámara digital y software LASV4.12).
Resultados y discusión
Confirmación histológica de infecciones por DIV1 en tejido hematopoyético (HPT) Una fotomicrografía del HPT normal (Fig. 1A) se puede comparar con una fotomicrografía representativa obtenida de uno de los 3 P. vannamei moribundos que había sido inyectados con la dilución 10—1 del stock inóculo (Fig. 1B). La microfotografía del camarón inyectado con virus (Fig. 1B) muestra inclusiones citoplásmicas ligeramente basófilas en las células del HPT (flechas negras), a menudo adyacentes a núcleos celulares. Estos son comparables a los que se reportaron de P. vannamei moribundos puestos a prueba con DIV1 en China (Qiu et al., 2017) y se consideraron patognomónicos para la patología DIV1 porque dichas inclusiones no se habían reportado previamente en el HPT. El tejido HPT en nuestro camarón de prueba también mostró algunas inclusiones circulares profundamente basófilas de varios tamaños (flechas blancas) que tenían poco valor de diagnóstico ya que no podían distinguirse de los núcleos picnóticos y cariorrecticos. Se reportaron inclusiones similares en China (Qiu et al., 2017). En nuestras muestras estudiadas, la organización estructural del HPT también fue anormal (por ejemplo, los núcleos estaban más espaciados, agrandados, menos teñidos y, a veces, contenían áreas vacías) (Fig. 1B)
- OCTUBRE 2022 31 PATOLOGÍA
PATOLOGÍA
en comparación con el HPT de un camarón normal (Fig. .1A). Los 3 especímenes del grupo de inóculo 10-1 y uno de los 2 camarones moribundos obtenidos del grupo de inóculo 10-3, mostraron una histología HPT anormal.

Lesiones distintivas del LO acompañadas de lesiones patognomónicas del HPT Aunque no se lo describió en las primeras publicaciones sobre DIV1 (Qiu et al.,2017; Xu et al., 2016), encontramos que los 3 camarones moribundos del grupo de inóculo 10—1 y 1 del grupo de inóculo 10-3 mostraron patología HPT (Fig. 1) junto con patología tisular del LO (Fig. 2). Las anomalías del LO consistían en la desorganización de la matriz de túbulos del LO acompañado de una morfología anormal de los núcleos, más la presencia de núcleos cariorrecticos y picnóticos que no podían distinguirse de las inclusiones virales citoplasmáticas basófilas. Esta patología del LO se parece un poco a la del virus de la cabeza amarilla (YHV) (Chantanachookin et al., 1993) y, por lo tanto, no es suficiente para el diagnóstico específico de la infección por DIV1.
En algunas muestras, también estaban presentes órganos linfoides esferoides o en proceso de formación, pero los túbulos mostraban una desorganización similar e inclusiones citoplasmáticas (no se muestra). Aunque la patología del LO no es lo suficientemente distintiva en sí misma para indicar una infección por DIV1, creemos que se puede usar para respaldar el diagnóstico presuntivo de la enfermedad por DIV1 cuando se combina con las características de las lesiones patognomónicas en el HPT o se combina con los resultados de secuenciación de amplicones de PCR positivos para DIV1. Además, el LO anormal puede localizarse y reconocerse rápidamente usando un lente de microscopio de objetivo 10x y puede confirmarse usando una lente de objetivo 40x mientras que el reconocimiento y confirmación de las inclusiones patognomónicas en el HPT requiere al menos un objetivo de 40x seguido de uno de 100x. objetivo para la confirmación. Así, para acelerar la detección de infecciones DIV1, el LO se puede utilizar como un marcador preliminar. Si se observa una lesión del tipo DIV1 con un objetivo de 10x, se lo puede confirmar con un lente de 40x, y luego se puede examinar el HPT
(general y relativamente cerca, en dirección dorsal-anterior) con objetivos de 40x y 100x.
Los resultados del ISH confirmaron la presencia de DIV1-DNA en HPT de camarones moribundos
Las pruebas ISH se llevaron a cabo con secciones del HPT adyacente, similares a las que se muestran arriba con tinción H&E en la Fig. 1. Tanto la hibridación de sondas de ADN (ATPasa y MCP) tuvieron fuertes reacciones
ISH positivas para los 3 especímenes en el grupo de inóculo 10—1 y 1 espécimen del grupo de inóculo 10—3. Las comparaciones de las dos reacciones de la sonda se muestran en las figuras suplementarias S4 y S5, incluida una comparación de controles negativos similares sin sonda y con sonda YHV. El examen de áreas positivas de ISH con un microscopio óptico de gran aumento (objetivo de lente 100x) reveló que las señales positivas de ISH se originaron a partir de inclusiones citoplasmáticas, a menudo adyacentes a los núcleos de las células
HPT del huésped (Fig. 3C). Estas posiciones correspondían a la ubicación citoplásmica de las inclusiones patognomónicas ligeramente basófilas para la infección por DIV1 que se observan en publicaciones chinas previas y en nuestras muestras (Fig. 1). Aunque confirmaron la presencia de DIV1 en nuestras muestras, no pudimos identificar inclusiones basófilas que coincidieran específicamente con señales positivas de hibridación in situ en secciones de tejido adyacentes. Puede ser que el grosor de las inclusiones era demasiado pequeño para abarcar la
Fig. 1. Fotomicrografías de ejemplo de tejido HPT normal y tejido HPT que muestran lesiones patognomónicas de DIV1. (A) Tejido HPT normal de una muestra de camarón normal. (B) HPT de un camarón moribundo de nuestra prueba de ensayo que muestra las inclusiones citoplásmicas patognomónicas, ligeramente basófilas (flechas negras) junto con inclusiones basófilas densas (flechas blancas). Nótese también la aparición de núcleos relativamente vacíos (asteriscos).
Fig. 2. Fotomicrografías de tejido del LO normal y LO anormal presente en camarones moribundos de las pruebas de inyección de DIV1. (A) Bajo aumento del tejido normal del LO. (B) Bajo aumento del tejido anormal del LO de un camarón moribundo que muestra una matriz tubular desorganizada con inclusiones densamente basófilas que se asemejan a núcleos picnóticos y cariorrecticos. (C) Gran aumento del tejido del LO que se muestra en B con el asterisco (*) en la misma posición del tejido en ambas fotomicrografías.

- OCTUBRE 2022 32
profundidad de tres secciones de tejido adyacentes de aproximadamente 5 μm de espesor.
Los resultados del ISH confirmaron la presencia de DIV1-ADN en el LO de camarones moribundos En la (Fig. 4) se muestran ejemplos de fotomicrografías de bajo aumento del LO de un camarón moribundo del grupo de inóculo 10—1 que se muestra en la (Fig. 4). La sección teñida con H&E (Fig. 4A) muestra un LO anormal central de forma triangular
con el HP en la parte superior derecha y una lesión muscular en la parte inferior izquierda. En la Fig. 4C, el LO y varios otros tejidos de origen mesodérmico muestran reacciones positivas de ISH (tinción oscura) para DIV1 Fotomicrografías de gran aumento (Fig. 5) de secciones adyacentes en los mismos slides que se muestran en la Fig. 4, pero que incluyen solo el tejido del LO anormal teñido por H&E y por ISH (es decir, menos el control negativo que ya se muestra en la Fig. 4B). Los núcleos normales (flechas, Fig. 5A) son
difíciles de encontrar en la microfotografía teñida con H&E y es difícil determinar la naturaleza de las inclusiones densamente basófilas. Asumimos que comprendían una mezcla de núcleos picnóticos y cariorrecticos además de inclusiones citoplasmáticas del DIV1. Al igual que con el HPT, no hubo una correspondencia directa de las señales de ISH con las inclusiones densamente basófilas en secciones adyacentes teñidas con H&E. Una vez más, suponemos que la infección viral las inclusiones eran demasiado delgadas para abarcar el grosor de tres secciones de tejido consecutivas de aproximadamente 5 μm de grosor. Sin embargo, estamos seguros de que las señales ISH positivas en la Fig. 5B surgen de focos citoplasmáticos de ácido nucleico DIV1. La única otra enfermedad
Fig. 3. Fotomicrografías de ejemplo de los resultados de la prueba ISH para DIV1 en el HPT de un espécimen de camarón moribundo de las pruebas de inyección. (A) Sección teñida con H&E que muestra inclusiones citoplásmicas ligeramente basófilas características de la histopatología de DIV1 (flechas negras). (B) Sección de tejido adyacente que muestra una reacción ISH negativa con el control sin sonda. (C) Sección de tejido adyacente que muestra reacciones ISH positivas (sonda MCP) en ubicaciones citoplásmicas (flechas blancas).


Las 2 flechas inferiores a la derecha indican claramente las inclusiones junto a los núcleos. La barra de ampliación en A aplica a las tres fotomicrografías.
Figura 4. Fotomicrografías a bajo aumento que muestran reacciones positivas del ISH (sonda MCP) para DIV1 en el tejido del LO, en una lesión muscular cercana y en tejido conectivo.

(A) Sección de tejido teñido con H&E que muestra un LO anormal, una lesión muscular adyacente, tejido conectivo y una porción del hepatopáncreas (HP). (B) Sección de tejido adyacente que muestra una reacción ISH negativa con la sonda de control negativo YHV. (C) Sección de tejido adyacente que muestra reacciones positivas de ISH en el LO, en la lesión muscular, en el tejido conectivo, en la glándula antenal y en los espacios intersticiales del hepatopáncreas (HP).
Fig. 5. Microfotografías de gran aumento de una sección de tejido adyacente de tejido del LO teñido con H&E e ISH (sonda ATPasa) del mismo espécimen que en la Fig. 4 que muestra lesiones DIV1. El control negativo (ya en la Fig. 4) no se muestra aquí. (A) Sección teñida con H&E que muestra tejido del LO desorganizado en el que es difícil distinguir los núcleos normales (flechas negras) pero donde están presentes muchas inclusiones basófilas claras a oscuras de varios tamaños. (B) Sección teñida con ISH con algunos núcleos normales (flechas negras) más señales positivas de ISH que no se pueden vincular fácilmente con estructuras identificables en la sección de tejido adyacente teñido con H&E. Sin embargo, está claro que no son núcleos.
- OCTUBRE 2022 33 PATOLOGÍA
del camarón que causa una mezcla de inclusiones densamente basófilas más núcleos picnóticos y cariorrecticos en el LO es YHV1 (Chantanachookin et al., 1993; Flegel, 2006). Sin embargo, la reacción negativa de ISH obtenida con el control negativo (Fig. 4B), que consiste en una sonda diseñada para YHV1, también fue útil para confirmar que las lesiones en los camarones desafiados con DIV1 no surgieron de YHV1
Resultados adicionales de ISH que pueden ser de mayor interés Aunque el LO es el enfoque principal de este informe, también confirmamos que DIV1 produce reacciones ISH positivas generalizadas en los tejidos conectivos del cefalotórax de P. vannamei, como se describió previamente (Xu et al., 2016; Qiu et al., 2017). Estos incluyeron reacciones ISH en el tejido intersticial del HP y en el tejido conectivo alrededor del cordón nervioso ventral. Sin embargo, esos reportes no siempre incluyeron secciones de tejido adyacentes con un control ISH sin sonda y tinción con H&E. Para aquellos interesados en obtener más detalles, hemos incluido un análisis de tres portaobjetos de varios tejidos que parecían normales con la tinción H&E pero que mostraron fuertes reacciones positivas de ISH (Figuras complementarias S6 a S11). Por ejemplo, se produjeron fuertes reacciones de ISH dentro del tejido conectivo subepitelial del ciego del intestino medio anterior (AMC) que está adyacente al HP (Fig. S6 y S7) y también en el pericardio (no se muestra). Además, se revela que las fuertes reacciones de ISH que ocurrieron en las branquias de P. vannamei no surgieron de las inclusiones profundamente basófilas que se asemejan a los núcleos picnóticos y cariorrecticos que se describieron como asociados con la enfermedad DIV1 en esas publicaciones (Fig. S8). Además, las células epiteliales aparentemente normales de las células de la glándula antenal mediante tinción con H&E también produjeron fuertes reacciones de ISH que no podían asociarse claramente con una tinción citoplasmática identificable mediante H&E (Fig. S9). Además, ocasionalmente se observaron fuertes reacciones de ISH en los músculos esqueléticos y en las células epiteliales subcuticulares (Fig. S10 y S11). Las señales de ISH ocasionalmente se podían ver junto a los núcleos (por ejemplo, Fig. S11-C), pero no se podían vincular claramente 1:1 con una tinción coincidente en lugar y tamaño
en las secciones H&E adyacentes. Por otro lado, nunca se vio que las señales de ISH surgieran claramente del interior de los núcleos y la mayoría eran más pequeñas, de forma diferente o más numerosas que los núcleos, lo que indica que surgieron de fuentes citoplasmáticas. No podemos explicar esta anomalía H&E ya que debería dar una reacción de tinción basófila con el ADN, pero había suficientes controles (sin sonda y con sonda YHV) para probar que las reacciones eran señales de hibridación específicas para el ácido nucleico DIV1. Es posible que un método de tinción que no sea H&E pueda resolver este problema.
Debido a las graves consecuencias del diagnóstico de DIV1 en nuevos lugares, recomendamos que la confirmación de infecciones incluya 1) detección por PCR y secuenciación de 2 genomas DIV1 distintos para demostrar una alta homología con el DIV1 conocido y eliminar parcialmente la posibilidad de que surjan resultados falsos positivos de elementos virales endógenos (EVE); 2) demostración de lesiones patognomónicas DIV1 en el HPT junto con lesiones del LO similares al DIV1 en camarones infectados mediante tinción H&E e ISH. Si no se dispone de muestras adecuadas para el análisis histológico, se deben realizar bioensayos seguidos de tinción con H&E e ISH. Esencialmente, estas recomendaciones son consistentes con las medidas requeridas por la Organización Mundial de Sanidad Animal (OIE) para determinar si una especie es susceptible a un patógeno.
Conclusiones
Hemos confirmado y complementado reportes anteriores (Xu et al., 2016; Qiu et al., 2017) de que DIV1 causa infecciones sistémicas en P. vannamei que incluye a muchos tejidos de origen embrionario mesodérmico, pero excluye el cordón nervioso ventral (excepto el tejido conectivo que lo rodea). También excluyen tejidos de origen endodérmico (p. ej., epitelio del túbulo del HP, epitelio del ciego del intestino medio anterior y epitelio del intestino medio). Ahora hay que añadir la infección ocasional del epitelio subcuticular que es de origen embrionario ectodérmico. La mayoría de estos tejidos parecían superficialmente normales mediante la tinción con H&E y solo el HPT y el LO mostraban lesiones obvias, mientras que solo el HPT mostraba lesiones únicas útiles para un diagnóstico
tentativo de infección por DIV1 mediante la tinción estándar con H&E. Por lo tanto, recomendamos que el HPT junto con el LO sean los tejidos clave a examinar mientras se usa el análisis histológico por H&E para diagnosticar un caso sospechoso de enfermedad DIV1. De estos dos, el LO puede ser útil en la detección de infecciones DIV1 examinando primero el LO para el tipo de patología DIV1 que describimos usando una lente de objetivo 10x y confirmándolos con un lente de objetivo 40x. Luego, se pueden usar lentes de objetivo de 40x y 100x para examinar el HPT para confirmar lesiones DIV1 patognomónicas. Si el LO es normal, nuestra experiencia hasta el momento ha demostrado que el HPT también será normal y libre de lesiones patognomónicas DIV1•
Referencias
Bell, T.A., Lightner, D.V., 1988. A Handbook of Normal Shrimp Histology. World Aquaculture Society, Baton Rouge, LA. Chantanachookin, C., Boonyaratanapalin, S., Kasornchan dra, J., Direkbusarakom, S., Ekpanithanpong, U., Supamata ya, K., Flegel, T.W., 1993. Histology and ultrastructure reveal a new granulosis-like virus in Penaeus monodon affected by "yellow-head" disease. Dis. Aquat. Org. 17, 145–157. Chen, X., Qiu, L., Wang, H., Zou, P., Dong, X., Li, F., Huang, J., 2019. Susceptibility of Exopalaemon carinicauda to the infection with shrimp hemocyte iridescent virus (SHIV 20141215), a strain of decapod iridescent virus 1 (DIV1). Viruses. 11, 387. https://doi.org/10.3390/v11040387. Cowley, J.A., Cadogan, L.C., Wongteerasupaya, C., Hodgson, R.A.J., Boonsaeng, V., Walker, P.J., 2004. Multiplex RT-nested PCR differentiation of gill-associated virus (Australia) from yellow head virus (Thai land) of Penaeus monodon. J. Virol. Methods 117, 49–59. ht tps://doi.org/10.1016/j.jviromet.2003.11.018. Flegel, T.W., 2006. Detection of major penaeid shrimp viruses in Asia, a historical perspective with emphasis on Thailand. Aqua culture 258 (1–4), 1–33. https://doi. org/10.1016/j.aqua culture.2006.05.013. Li, F., Xu, L., Yang, F., 2017. Genomic characterization of a novel iridovirus from redclaw crayfish Cherax quadricarinatus: evidence for a new genus within the family Iridoviridae. J. Gen. Virol. 98, 2589–2595. https://doi. org/10.1099/jgv.0.000904. Qiu, L., Chen, M.-M., Wan, X.-Y., Li, C., Zhang, Q.-L., Wang, R.-Y., Wang, X.-H., 2017. Characteri zation of a new member of Iridoviridae, shrimp hemocyte iri descent virus (SHIV), found in white leg shrimp (Litopenaeus vannamei). Sci. Rep. 7 https://doi. org/10.1038/s41598017-10738-8. Qiu, L., Chen, M.-M., Wang, R.-Y., Wan, X.-Y., Li, C., Zhang, Q.-L., Huang, J., 2018. Complete genome sequen ce of shrimp hemocyte iridescent virus (SHIV) isolated from white leg shrimp, Litopenaeus vannamei. Arch. Virol. 163, 781–785. https://doi. org/10.1007/s00705-017-3642-4. Qui, L., Huang, J.. Diseases of Crustaceans – _Infection with Decapod Iridescent Virus 1 (DIV1), Network of Aquaculture Centres in Asia-Pacific. https://enaca.org. Rusaini, Owens, L., 2010. Insight into the lymphoid organ of penaeid prawns: a review. Fish Shellfish Immunol. 29, 367–377. https://doi. org/10.1016/j.fsi.2010.05.011. Sanguanrut, P., Thaiue, D., Thawonsuwan, J., Flegel, T.W., Sritunyalucksana, K., 2020. Urgent announcement on usefulness of the lymphoid organ (LO) as an additional prime target for diagnosis of decapod iridescent virus 1 (DIV1) in diseased P. vannamei. In: Network of Aquaculture Centres in Asia-Pacific. Xu, L., Wang, T., Li, F., Yang, F., 2016. Isolation and preliminary characterization of a new pathogenic iridovirus from redclaw crayfish Cherax quadricarinatus. Dis. Aquat. Org. 120, 17–26. https://doi. org/10.3354/dao03007.
- OCTUBRE 2022 34 PATOLOGÍA


IHHNV: Orígenes y realidades luego de 40 años
La acuacultura no es muy diferente de otras actividades productivas relacionadas con el cultivo de organismos. Existe tendencia de investigar a los patógenos, según el grado de afectación que este puede generar en la producción, por lo que pueden aparecer resultados inesperados. La evolución de los conceptos e ideas deben ir en paralelo al desarrollo científico y la evidencia que se observa en el campo. Las regulaciones también deben evolucionar; y es esto lo que permite mejorar e implementar medidas preventivas o de mitigación, según el caso, que tengan sentido común y se ajusten a la realidades.

El virus conocido como Virus de Necrosis Infección Hematopoyética e Hipodérmica (IHHNV, por sus siglas en inglés) es un ejemplo de lo antes descrito. Una revisión de la literatura científica sobre el comportamiento de este virus nos brinda la oportunidad de apreciar no solo cómo evoluciona, sino cómo interactúa un virus con sus huéspedes y cómo han cambiado los conceptos y la visión sobre la enfermedad.
Todos los virus mutan, es natural esperar que esto suceda. Algunos lo hacen a mayor velocidad que otros, pero tarde o temprano ocurre una mutación. Del mismo modo, los huéspedes encontrarán formas de coexistir con ellos (Flint et al., 2015). Siendo así, enterarnos de que existe una mutación de un virus ya conocido no debe resultar una sorpresa, puesto que es un proceso biológico evolutivo natural. Los seres vivos han interactuado con los virus desde los inicios de la vida en la tierra y han desarrollado formas de enfrentarlos y sobrevivir. Si las bacterias lo hacen (Asad & Katsourakis 2012, Gao et al., 2022, Virrareal 2001), los camarones también lo deben hacer (Flegel 2007, 2020, Utari et al., 2017), u otro crustáceo (Rusaini et al., 2013).
IHHNV fue descrito por primera vez por Lightner y coautores en 1983 (Lightner et al., 1983a, b) infectando dos especies de camarones Penaeus vannamei y P. stylirostris importados a Hawaii. Es importante notar que al momento de esa publicación la histología era la técnica usada para la detección y descripción, junto con la microscopía electrónica; por lo que originalmente se describieron lesiones histológicas severas
PATOLOGÍA
Autores: Xavier Romero1 Eduardo Reyes2 1 Jefe de Salud Animal, Grupo Almar, Durán Ecuador 2Director de Producción, Grupo Almar xavier.romero@produmar.com.ec
asociadas a la presencia de este virus en P. stylirostris, aunque no se conocía los orígenes exactos del IHHNV o de qué población salvaje provenían. En los años siguientes se descubrió que el virus es originario de poblaciones salvajes de P. monodon (Tang et al., 2003). Si un día, en algún laboratorio las tres especies: P.vannamei P. stylirostris y P. monodon compartieron la misma fuente agua o cohabitaron, es factible que el contagio, y el salto de este virus de una especie a otra, hubiera ocurrido.
En P. monodon IHHNV siempre no produce daños histológicos. La especie más sensible al virus era P. stylirostris y es sobre la cual se reportan más daños y mortalidades (Lightner & Bell 1987). Es interesante observar en la descripción de IHHNV de Lightner et al. (1983b) (Journal of the World Mariculture Society 14: 212-225) que en la Tabla 4, página 222 de esta publicación se presenta una lista de unos animales codificados como 82-14 especie P. monodon, y se menciona la fuente de la muestra como “Ecuador/Tahití”. También las muestras 82-35-2 otro u otros P. monodon, cuya fuente de la muestra vuelve a repetir “Ecuador/Tahití” y esta es la fuente de la muestra.
¿Significa esto que ya se había intentado introducir P. monodon en el Ecuador? Si esto ocurrió, sería deducir que este virus se introdujo a las Américas mucho antes de que fuese descubierto, ya que años después se determinó que es originario del Indo Pacífico. Existe en poblaciones salvajes de esta zona y el posible origen de la línea viral de Hawaii y América sea las Filipinas (Tang et al., 2003). Esto llama a prestar siempre especial atención sobre el movimiento de animales vivos y los riesgos que ello implica, al introducir accidentalmente un virus todavía desconocido por la comunidad científica (Flegel 2006).
Para entender qué sucede en una investigación no existe nada mejor que leer el trabajo científico original muy despacio y prestando atención a los detalles; incluyendo la Discusión, que es la sección de una publicación donde los autores expresan las limitaciones e interpretación de los resultados obtenidos. El trabajo clásico que demostró la asociación entre IHHNV y el Síndrome de Enanismo y Deformidad del
Rostro (Runt-Deformity Syndrome, RDS) es de Kalagayan et al., (1991), publicado en el Journal of the World Aquaculture Society Vol. 22(4) págs. 235-24. Este trabajo es muy citado en posteriores investigaciones y publicaciones.
Esta publicación es un ejemplo de una discusión bien estructurada. Los autores destacan aspectos muy importantes de sus resultados y condiciones. Así, en la pág. 241, primera columna segundo párrafo los autores resaltan que: “mientras que IHHNV parece ser un determinante directo de RDS en P. vannamei, cofactores adicionales podrían moderar la expresión de esta enfermedad. Muchos de los animales positivos a IHHNV no estaban enanizados (runts). Más del 70% de los animales “normales” en crecimiento en los grupos positivos a IHHNV fueron positivos a IHHNV. Estos animales presentaron crecimiento aceptable y fueron asintomáticos en términos de RDS. Así, la simple infección por IHHNV no es una explicación etiológica completa para RDS. Cofactores además del virus son necesarios para producir la enfermedad”.
La mención de los cofactores debe destacarse, ya que se alinea con los conceptos básicos de Epidemiología (Thrusfield 2005) y la interacción de cofactores para que se exprese un patógeno, más la visión holística sobre patógeno, huésped y ambiente (Sniesko 1974). Otro punto que destacan los autores es la densidad usada en los experimentos: de 500 -1,500 camarones/ m2, lo que representa: “un incremento de 5 a 15 veces sobre los valores usados en fincas comerciales” cultivadas en esa época. Debemos resaltar que, a través de los años, las densidades han ido incrementándose y en la actualidad, en sistemas superintensivos, se acercan a las empleadas en las pruebas de Kakagayan et al., (1991), de 300-500 animales/m2, con producciones proyectadas de 30,000-70,000 kg/ha (Nisar et al., 2022). Este enfoque todavía debe superar los retos de adoptar una tecnología a escala comercial y masiva.
Finalmente, el trabajo termina con un comentario que debe servir para entender el contexto de lo encontrado y descrito: “Estudios para determinar el papel del huésped (particularmente aspectos genéticos),
Referencias
Aranguren-Caro L.F., M.M. Gomez-Sanchez, Y. Piedrahita, H.N. Mai, R. Cruz-Flores, R.R.R Alenton & A.K. Dhar (2022) Current status of infection with infectious hypodermal and hematopoietic necrosis virus (IHHNV) in the Peruvian and Ecuadorian shrimp industry. PLOS One doi.org/10/1371/ journal.pone.0272456
Aswad A. & A. Katzourakis (2012). Paleovirology and virally derived immunity. Trends in Ecology and Evolution 27(11): 627-636.
Gao L.A., M.E.Wilkinson, J. Strecker, K.S. Marakova, R..K. Macrae, E.V. Koonin, F. Zhang (2022) Prokaryotic innate immunity through pattern recognition of conserved viral proteins. Science Vol. 377, Issue 6607. doi:10.1126/science.abm4096
Flint J., V.R. Racaniello, G.F. Rall, A.M. Skalka & L.W. Enquist (2015) Principles of Virology Vol. I & II. ASM Press.
Flegel T.W. (2006) The special danger of viral pathogens in shrimp translocated for aquaculture. ScienceAsia 32: 215-221.
Flegel T.W. (2007). Update on viral accommodation, a model for host-viral interaction in shrimp and other arthropods. Developmental and Comparative Immunology 31, 217-231.
Flegel T.W. (2020). Research progress on viral accommodation 2009 to 2019. Developmental and Comparative Immunology 112, 103771
Goic B. & M.C. Saleh (2012). Living with the enemy: viral persistent infections from a friendly viewpoint. Current Opinion in Microbiology 15, 531-537.
OIE 2019. Manual of Diagnostic Test for Aquatic Diseases. OIE, Paris, Francia Kalagayan H., D. Godin, R. Kanna, G. Hagino, J. Sweeney, J. Wyban (1991) IHHNV virus as an etiological factor in Runt-deformity Syndrome (RDS) of juvenile Penaeus vannamei cultured in Hawaii.
Journal of the World Aquaculture Society Vol. 22(4): 235-243.
Karzourakis A. & R.J. Gifford (2010). Endogenous Viral Elements in Animal Genomes. PLoS Genetics 6(1): 1-14. e1001191
Morales-Cotarrubias M.S., L.M. Nunan, D.V. Lightner, J.C. Mota-Urbina, M.C. Garza-Aguirre, M.C. Chavez-Sanchez (1999) Prevalence of Infectious Hypodermal and Hematopoietic Virus (IHHNV) in wild adult blue shrimp Penaeus stylirostris from the Northern Gulf of California, Mexico. Journal of Aquatic Animal Health 11: 296-301.
Nisar U., D. Peng, Y. Muy & Y. Sun (2022) A solution for sustainable utilization of aquaculture waste: A comprehensive review of biofloc technology and aquamimicry. Frontiers in Nutrition Vol 8 doi:10.3389/fnut.2021.791738
Lightner D.V., R.M. Redman, T.A. Bell (1983a) Infectious hypodermal and hematopoietic necrosis virus, a newly recognized virus disease of penaeid shrimp. Journal of Invertebrate Pathology 42(1) 6270.
Lightner D.V., R.M. Redman, T.A. Bell, J.A. Brock (1983b) Detection of IHHNV virus in Penaeus stylirostris and P. vannamei imported into Hawaii. Journal of the World Mariculture Society 14: 212225.
Lightner D.V. & T.A. Bell (1987) IHHNV disease of P. stylirostris: effects of shrimp size on disease expression. Journal of Fish Diseases 10: 165-170.
Lightner D.V. (1985) A review of the diseases of cultured penaeid shrimps and prawns with emphasis on recent discoveries and developments. Proceedings of the First International Conference on the Cultured penaeid prawn/shrimp. SEAFDEC Aquaculture Development, Pgs 79-103. Iloilo City,
- OCTUBRE 2022 38 PATOLOGÍA
ambiente y cofactores en el manejo para la expresión de RDS son necesarios”. Parecería que estaban anticipándose a lo descrito aproximadamente 30 años después por Aranguren et al., (2022) y a lo que sucedería durante las décadas siguientes a nivel de cultivo en piscinas y los efectos de IHHNV sobre poblaciones de camarones que aparentemente se han adaptado y desarrollado tolerancia o resistencia.
En 1995, y basados en la evidencia de esa época, se incluye a IHHNV entre los patógenos de Reporte Obligatorio por parte de la Organización Internacional de Salud Animal (OMSA). Los efectos negativos de IHHNV sobre los camarones cultivados y las mortalidades causadas son resumidos en una recopilación sobre enfermedades de camarones (Lightner 1996).
Durante las décadas de los años 1990, 2000 y 2010 se hicieron diversas publicaciones sobre IHHNV, desde propuestas relacionadas con los posibles efectos negativos sobre la población de camarones salvajes en América (Morales-Cotarrubias et al., 1999) hasta los orígenes de este virus y su inserción en el genoma del huésped los camarones peneidos (Tang & Lightner, 2006). Estas citas y otros estudios están resumidos en una publicación (Vega-Heredia et al., 2012); así mismo, se presentaron trabajos sobre el desarrollo de líneas genéticas en P. stylirostris resistentes a IHHNV (Tang et al., 2000).
Durante esos mismos años, la presencia de IHHNV se convirtió en la mejor excusa y en el argumento para justificar todo problema asociado a falta de crecimiento en el campo. Al respecto, existe una excelente publicación que resume todos los patógenos que han sido asociados a lo que se conoce como “los síndromes de crecimiento”. Esta lista incluye diez patógenos potenciales de camarones peneidos, incluidos otros virus de camarones como Parvovirus Hepatopancreático, HPV (Hepatopancreatic Parvo-like Virus), Monodon baculovirus (MBV), Baculovirus penaei (BP), virus de la Cabeza Amarilla (YHV Type 4), además de bacterias y microsporidios (Valappil et al., 2021). Además, Lightner (1985) reporta “runts” (enanizados) asociados a enteritis hemocítica. En consecuencia, al observar
problemas de crecimiento en camarones cultivados se debe pensar más allá de la mera presencia de IHHNV.
Al analizar camarones de muestras procedentes de piscinas de producción con técnicas modernas y altamente sensibles, como el PCR y PCR cuantitativo (qPCR), poco a poco surgía la evidencia de que la presencia de IHHNV no afectaba los niveles de producción de P. vannamei y que es posible encontrar estanques con presencia de animales positivos sin enanismo ni rostro torcido (RDS) y con buenos resultados a la cosecha, lo cual demuestra que se pueden desarrollar líneas seleccionadas genéticamente para tolerar y/o resistir este virus. La selección natural funciona de una forma u otra.

Lo anterior no niega ni descarta que existan publicaciones donde se asocia la presencia de IHHNV con efectos negativos sobre la producción y crecimiento (Sellars et al., 2019). Sin embargo, la pregunta ante estos resultados y otros similares es la misma que Kalagayan et al., (1989) propusieron hace más de 30 años: ¿cuál es el rol de los aspectos genéticos?, o sea el stock utilizado y su sensibilidad ante este u otros virus.
En este mismo contexto, existen trabajos que obtienen y sostienen propuestas diferentes. Así Withyachumnarnkul et al. (2006) sostienen que la presencia de IHHNV en P. monodon no afecta seriamente el crecimiento o la fecundidad en animales con ligera infección. Quizá estas diferencias en resultados sean ocasionadas por las distintas líneas genéticas usadas en los diferentes ensayos, realizados por grupos de investigación en distintos países.
Algo innegable es que existen y se puede desarrollar poblaciones de camarón tolerantes ante IHHNV. Quizás este enfoque sea el camino más apropiado a seguir para el futuro de la industria. Esta selección posiblemente ya ocurrió en la naturaleza y al tomar animales salvajes como fuente original, los mismos ya eran tolerantes porque sus padres fueron los sobrevivientes a los efectos de este virus. Esta posibilidad la discuten en la publicación de Aranguren et al (2022) sobre los resultados y sobrevivencia de P. stylirostris SPF utilizados en sus experimentos, ya que todos sobrevivieron el desafío del bioensayo. Esto era impensable en los años en que se descubrió el IHHNV y se describieron sus efectos de sobre P. stylirostris, hace casi cuatro décadas.
- OCTUBRE 2022 39 PATOLOGÍA
Si esta misma selección sucede en los cultivos, y existe evidencia científica que apunta a efectos no perjudiciales a nivel comercial, ¿por qué entonces no retirar al IHHNV de la lista de la OIE? Esta propuesta tiene un antecedente, pues ya se hizo con otros virus que en su momento ocasionaron problemas, como el caso de Baculovirus penaei y Monodon baculovirus, los cuales fueron retirados de la lista de patógenos reportables o de reporte obligatorio en el año 2009 y ya no fueron incluidos en el Manual de Tests de Diagnóstico para Enfermedades Acuáticas en el 2012 como patógenos reportables (OIE 2019). Algo es evidente, todo virus bajo las condiciones adecuadas de estrés y stocks genéticamente no diversos ocasionará problemas en la fisiología del camarón o de cualquier otro crustáceo.
Una reciente publicación informa sobre cómo la integración viral de IHHNV en P. monodon puede servir, utilizando el proceso de ARN de interferencia (RNAi), para ayudar a los animales a responder a la presencia del virus, así como la detección de estas áreas en el genoma podrían servir para identificar los individuos más resistentes y seleccionarlos como reproductores (Taengchaiyaphum et al., 2022). Por tanto, no todo sobre la presencia de IHHNV es negativo, y esto muestra una vez más que la evolución huésped-patógeno sucede.
El conocimiento básico de la interacción entre patógeno, huésped y ambiente, junto a una visión holística de lo que es una enfermedad, es un concepto que debe aplicarse en la toma de decisiones. Algo que debe quedar claro es que la presencia del patógeno no es lo mismo que la presencia de la enfermedad, pues siempre existen factores como la interacción con el ambiente, la constitución genética del huésped, las condiciones de estrés, manejo del cultivo, densidades y muchos otros factores que son los que catapultan lo que conocemos como enfermedad en un animal y que eventualmente llevan a la muerte de los animales cultivados.
Debido a que el camarón se lo cultiva mayormente en sistemas abiertos, en mayor o menor grado, resulta imposible desinfectar grandes volúmenes de agua, tanto en sistemas intensivos como extensivos, por mucho esfuerzo que se destine a ello. Todo
lo que se puede hacer es iniciar el ciclo de cultivo con animales libres de patógenos específicos y/o con animales resistentes o tolerantes a estos. Pero es muy probable que, durante los días de cultivo, algún animal se contagie de uno de los muchos virus u otros patógenos conocidos existentes, y quizás hasta de alguno desconocido por la comunidad científica.
En la práctica, para sistemas abiertos de cultivo industriales, desde intensivos hasta semiintensivos, es poco realista pretender filtrar diariamente miles de toneladas de agua e intentar liberarla de todos los virus y patógenos posibles, conocidos y por conocer. Luego de que un animal se infecta, ya sea por el patógeno de turno u otro aún desconocido (lo cual sucede o sucederá tarde o temprano en una población de camarones) se tendrá que aprender a vivir con el enemigo, junto al enemigo, o rodeado del enemigo. Los camarones han hecho esto por millones de años en el medio acuático y los acuacultores tendremos que también aprender a hacerlo.
Así mismo, las regulaciones deben evolucionar y adaptarse a la evidencia científica y de campo existentes. Mantener a un virus como el IHHNV en una lista de patógenos de notificación obligatoria por parte de una autoridad de salud animal solo muestra poca adaptación a los avances, resultados de campo y recientes descubrimientos de la ciencia. No olvidemos ese proceso básico que nos ha llevado al progreso: la evolución. Este principio debe aplicarse en las regulaciones, así como sucede naturalmente en la biología•
Philippines.
Lightner D.V. (1996) A Handbook of shrimp Pathology and Diagnostic Procedures for diseases of cultured penaeid shrimp. World Aquaculture Society, Baton Rouge Louisiana USA.
Rusaini R., K.A. La Fauce, J. Elliman, R. Bowater, & L.Owens (2013). Endogenous Brevidensovirus-like elements in Cherax quadricarinatus: Friend or Foe?. Aquaculture 396-399: 136-145.
Sellars M.J., J.A.A. Cowley, D. Musson, M. Rao, M.L. Menzies, & B.S. Murphy (2019) Reduced growth performance of Black Tiger Shrimp (Penaeus monodon) infected with infectious hypodermal and hematopoietic necrosis virus. Aquaculture 499: 160166 doi.org/10.1016/j.aquaculture.2018.09.032
Sniesko S.K. (1974) The effect of environmental stress on outbreaks of infectious diseases of fish. Journal of Fish Biology 6: 197-208.
Taengchaiyaphum S., P. Wongkhaluang, K. Sittikankaew, N. Karoonuthaisiri, T. Flegel & K. Sritunyalucksana (2022) Shrimp genome sequence contains independent clusters of ancient and current Endogenous Viral Elements (EVE) of the parvovirus IHHNV. BMC Genomics 23:565 doi. org/10.1186/s12864-022-08802-3
Tang K.F.J., S.V. Durand, B.L. White, R.M. Redman, C.R. Pantoja & D.V. Lightner (2000) Postlarvae and juveniles of a selected line of Penaeus stylirostris are resistant to infectious hypodermal and hematopoietic necrosis virus infection. Aquaculture 190: 203-210.
Tang K.F.J., B.T. Poulos, J. Wang, R.T. Redman, H.H. Shih & D.V. Lightner (2003) Geographic variations among infectious hypodermal and hematopoietic necrosis virus (IHHNV) isolates and characteristics of their infection. Diseases of Aquatic Organisms 53: 91-99.
Tang K.F.J.& D.V. Lightner (2006). Infectious hypothermal and hematopoietic necrosis virus (IHHNV)-related sequences in the genome of the black tiger prawn Penaeus monodon from Africa and Australia. Virus Research 118: 185-191.
Thrusfield M. (1995) Veterinary Epidemiology 2nd Edition. Blackwell Science Ltd. London, UK.
Utari H.B. C. Soowannayan, T.W. Flegel, B. Whityachumnarnkul, & M. Kruatrachue (2017).
Variable RNA expression from recently acquired, endogenous viral elements (EVE) of white spot syndrome virus (WSSV) in shrimp. Developmental and Comparative Immunology 76: 370-379.
Valappil R.K., G.D. Stentiford & D. Bass (2021) The rise of the syndrome- sub-optimal growth disorders in farmed shrimp. Reviews in Aquaculture doi. org/10.1111/raq.12550
Vega-Heredia V., F. Mendoza-Cano & A. SanchezPaz (2012). The Infectious hypothermal and hematopoietic necrosis virus: a brief review of what we do and do not know. Transboundary and Emerging Diseases 59, 95-105.
Para más información sobre este este artículo escriba a: xavier.romero@produmar.com.ec
Villareal L.P. (2011) Viral ancestors of antiviral systems. Viruses 3, 1933-1958. doi: 10.3390/ v3101933
Whityachumnarnkul B., K. Chayaburakul, S. LaoAroon, P. Plodpai, K. Sritunyalucksana & G. Nash (2006) Low impact of Infectious hypothermal and hematopoietic necrosis virus (IHHNV) on growth and reproductive performance of Penaeus monodon Diseases of Aquatic Organisms 69: 129-136.
- OCTUBRE 2022 40 PATOLOGÍA

Estado actual de la infección por virus de la necrosis hipodérmica y hematopoyética infecciosa (IHHNV) en la industria camaronera peruana y ecuatoriana
Autores:
Luis Fernando Aranguren Caro 1*
Muriel María Gómez-Sánchez2
Yahira Piedrahita3, Hung Nam Mai1
Roberto Cruz-Flores1,4
Rod Russel R. Alenton1
Arun K. Dhar1
1 Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, Arizona, United States of America
2 Subdirección de Sanidad, Dirección de Sanidad e inocuidad, National Fisheries Health Agency in Peru (SANIPES), San Isidro, Lima, Perú
3 Cámara Nacional de Acuacultura, CNA, Avenida Francisco de Orellana y Miguel H Alcivar, Guayaquil, Ecuador
4 Centro de Investigación Científica y Educación Superior de Ensenada (CICESE), Ensenada, Baja California, México
*lfarangu@email.arizona.edu
La versión original de este artículo puede descargarse de forma gratuita en: https:// doi.org/10.1371/journal.pone.0272456
La
infección por el virus de la necrosis hipodérmica y hematopoyética
infecciosa (IHHNV) es una enfermedad de crustáceos que causó mortalidad a gran escala en Penaeus stylirostris, deformidad y retardo del crecimiento en Penaeus vannamei y Penaeus monodon. Se estudió la presencia de IHHNV en tres importantes regiones productoras de camarón en Ecuador: Guayas, El Oro y Esmeraldas. Los datos muestran que el IHHNV es endémico
en las fincas camaroneras en estas regiones. Las secuencias genómicas completas de genotipos representativos de IHHNV circulantes en Ecuador y Perú mostraron que estos genotipos formaron un grupo separado dentro los genotipos Tipo II y eran divergentes de otros aislamientos geográficos de IHHNV que se originaron en Asia, África, Australia y Brasil.
En bioensayos experimentales utilizando camarones libres de patógenos específicos (SPF) P. vannamei, P. monodon y P. stylirostris, e IHHNV representativo aislado de Ecuador y Perú, el virus no causó mortalidad ni indujo signos clínicos en ninguna de las tres especies de camarones peneidos. Aunque los cuerpos de inclusión de Cowdry tipo A, específicos del IHHNV fueron detectados histológicamente en P. vannamei y P. monodon desafiados experimentalmente y confirmado por hibridación in situ, no se observaron tales inclusiones en P. stylirostris. Adicionalmente, en camarones P. vannamei se presentó una mayor carga viral, seguida de P. monodon y P. stylirostris. Con base en los datos de vigilancia de IHHNV, se concluye que las líneas de P. vannamei cultivadas actualmente en Ecuador son tolerantes a los genotipos de IHHNV circulantes.
La secuencia del genoma de IHHNV y los datos del bioensayo experimental mostraron que, aunque los genotipos que circulan actualmente son infecciosos, no inducen lesiones clínicas en ninguna de las tres especies. Estos hallazgos sugieren una relación evolutiva de virus-huésped donde los genotipos circulantes de IHHNV coexisten en equilibrio con P. vannamei cultivados en Perú y Ecuador.
El virus de la necrosis hipodérmica y hematopoyética infecciosa (IHHNV, por sus siglas en inglés) se ha incluido como un patógeno de crustáceos de notificación obligatoria por la Organización Mundial de Sanidad Animal desde 1995 y es muy frecuente en América, Asia y Australia. Anteriormente, el virus causó mortalidades a gran escala en el camarón azul del Pacífico (Penaeus stylirostris) y se sabe que causa un retraso en el crecimiento, descrito como síndrome de deformidad y enanismo (RDS, por sus siglas en inglés), en el camarón blanco del Pacífico (Penaeus vannamei) y en el camarón tigre negro (Penaeus monodon). El IHHNV es un virus sin envoltura que mide entre 22 y 23 nm de tamaño y contiene un genoma de ADN monocatenario de ~4,1 kb de longitud. Este virus se clasifica como “Decapod penstylhamaparvovirus 1” en la familia Parvoviridae y la subfamilia Hamaparvovirinae. Se ha demostrado que los parvovirus tienen una alta tasa de mutación, similar a los virus de ARN. La tasa de sustitución de nucleótidos de IHHNV se estimó en 1.39 × 10-4 sustituciones/sitio/ año. Por lo tanto, la aparición de nuevos genotipos en diferentes regiones de cultivo de camarones no sorprende; actualmente, se ha documentado la presencia de cinco genotipos (tres tipos infecciosos: I, II y III, y dos tipos no infecciosos: A y B) de IHHNV.
El IHHNV es un patógeno endémico en la mayoría de los países de América Latina, incluido Ecuador, México, Honduras, Colombia, Brasil y Perú. Se ha notificado infección por IHHNV en varios estadios en P. vannamei, incluyendo postlarvas, juveniles y reproductores, sin mostrar signos clínicos, ni RDS. A nivel de finca, la prevalencia del virus puede oscilar entre el 10% y el 50%, y los animales pueden parecer sanos. Sin embargo, no se sabe si la presencia del virus hace que los camarones sean más susceptibles a otros patógenos y si los animales crónicamente infectados tienen un impacto en el crecimiento y la productividad acuícola.
El estado actual del impacto del IHHNV en la industria camaronera ecuatoriana y peruana es insuficiente para determinar el impacto del patógeno a nivel de finca. Sin embargo, según la OIE, en los años 2012-2019, se han notificado oficialmente un total de 25 y 21
- OCTUBRE 2022 42 PATOLOGÍA
casos de IHHNV en estanques de engorde en Ecuador y Perú, respectivamente. El objetivo de este estudio fue determinar la influencia de las cepas infecciosas circulantes de IHHNV presentes en Perú y Ecuador en la producción de camarón en estos dos países utilizando tres enfoques diferentes. Estos incluyen 1) determinar la prevalencia de IHHNV y evaluar el efecto de IHHNV en el crecimiento del camarón en estanques comerciales de crecimiento; 2) determinar la secuencia completa del genoma de los genotipos de IHHNV en Ecuador y Perú y examinar su relación con otros aislamientos de IHHNV notificados en otras partes del mundo; y 3) evaluar la infectividad de los aislados de IHHNV de Perú y Ecuador en tres especies diferentes de peneidos, P. vannamei, P. monodon y P. stylirostris.
Materiales y métodos
Muestras y lugar de muestreo Muestras de camarón positivo para IHHNV fueron recolectados en Tumbes y Piura, al norte de Perú, y en tres regiones en Ecuador, incluyendo El Oro, Guayaquil y Esmeraldas (Fig. 1).
El muestreo en Perú fue realizado por el Organismo Nacional de Sanidad Pesquera del Perú (SANIPES) y en Ecuador por la Cámara Nacional de Acuacultura (CNA).
Se recolectaron seis aislados de IHHNV de Perú entre 2019 y 2020 de las regiones camaroneras de Tumbes (5): (3.48˚ S, 80.36 ˚ O; 3,46˚ S, 80,27˚ O; 3,45˚ S, 80,30˚ O; 3,47˚ S, 80,33˚ O; 3,52˚ S, 80,39˚ O) y Piura (1) (5,12˚ S, 80,58˚ O).
En Ecuador, piscinas de engorde que mostraron un alto coeficiente de variación (CV% > 20%) con un historial de ocurrencia de IHHNV fueron seleccionados en 2020. Se analizaron ocho estanques de engorde distribuidos en Guayas (5), El Oro (1) y Esmeraldas (2). De cada estanque se tomó muestras aleatorias de 30 camarones, se pesaron y se conservaron sus pleópodos y tejidos branquiales en etanol al 95% para el análisis de PCR en tiempo real. Camarones adicionales recolectados en cada una de estas ubicaciones se congelaron individualmente (−20 ˚C) para su análisis posterior. Finalmente, del mismo estanque, se fijaron de 5 a 10 camarones en fijador de Davidson para el análisis histológico.
Fig 1. Ubicación de la región donde se obtuvo las muestras de IHHNV en Sudamérica (A). La ampliación de los cuadros en A indica las áreas de muestreos con el símbolo de una estrella (B). El mapa correspondiente es adquirido de USCF National Map Viewer solo para propósitos ilustrativos (http://viewer.nationalmap.gov/viewer/)

Muestras de Perú y Ecuador se enviaron al Laboratorio de Patología Acuícola de la Universidad de Arizona (UA-APL) para su análisis posterior.
Detección de IHHNV y secuenciación del genoma Extracción de ADN. La extracción de ADN se realizó individualmente en cada muestra utilizando el Qiagen DNeasy Blood y Tissue Kit, siguiendo el protocolo del fabricante. Después de la extracción, el ADN se almacenó a -20 ˚C hasta su posterior análisis.
PCR en tiempo real. Se utilizó el método recomendado por la OIE para la detección y cuantificación. Las secuencias de nucleótidos de los cebadores (primers) utilizados fueron IHHNV1608F: 5’-TAC TCC GGA CAC CCA ACC A-3’ y IHHNV1688R: 5’-GGC TCT GGC AGC AAA GGT AA-3’, y la secuencia de la sonda TaqMan fue IHHNV-P1: 5’-[FAM] ACC AGA CAT AGA GCT ACA ATC CTC GCC TAT TTG[TAMRA]-3’. Las reacciones de amplificación contenían 0,5 μM de cada cebador, 0,1 μM de sonda TaqMan, 1X TaqMan Fast virus 1-step Master Mix (Life Technologies, Carlsbad, CA, EE. UU.), 20 ng de ADN y agua HPLC en un volumen de reacción de 10 μl. El perfil de ciclos térmicos consistió en 20 s a 95 ˚C, seguido de 40 ciclos de 1 s a 95 ˚C y 20 s a 60 ˚C. La detección de amplificación y el análisis de datos para ensayos de PCR en tiempo real se llevaron a cabo utilizando un sistema de PCR en tiempo real StepOnePlus (Life Technologies, EE. UU.).
Secuenciación del genoma completo. ADN extraído de muestras (seis de Perú, A, C, D, E, F, y G; y uno de Ecuador, E1) que dieron positivo por PCR en tiempo real fueron enviados para Secuenciación de
Próxima Generación (NGS). La preparación de la librería genómica (library) se realizó con TruSeq Stranded Total DNA Library Prep (Illumina, San Diego, CA. EE.UU.). La secuenciación se realizó mediante un sistema Illumina HiSeq 2500 (PE 2X150 pb) (Illumina, EE. UU.). La librería genómica para las muestras de ADN se generó en OmegaBioservices utilizando el kit de la librería genómica KAPA Hyper prep para WGS (Roche, Alemania).
Las lecturas de ADN generadas a partir de NGS se emparejaron y las lecturas y adaptadores de baja calidad fueron recortados antes del mapeo al genoma de referencia de IHHNV (número de acceso de GenBank: AF218266) utilizando Geneious Prime (Biomatters, Nueva Zelanda). Se utilizó un mapeador Geneious para análisis de mapeo, y los parámetros se establecieron para detectar variantes estructurales. Todos los demás parámetros se establecieron en sus valores predeterminados. El cóntigo IHHNV final se editó manualmente. Se usó la anotación de la cepa de referencia para anotar los cóntigos (segmentos de ADN superpuestos que juntos representan una región consenso de ADN) de IHHNV.
Análisis filogenético
Las secuencias de nucleótidos de 7 aislados de IHHNV (6 de Perú y 1 de Ecuador) y 18 aislados de IHHNV conocidos obtenidos de la base de datos GenBank se alinearon utilizando MAFFT (Auto: según el tamaño de los datos, 200 PAM, k = 2) (Geneious Prime, v2019). El mejor modelo para el árbol filogenético se estimó utilizando jmodel Test 2.1.10. Se construyó un árbol filogenético utilizando MrBayes (http://www.phylogeny. fr/one_task.cgi?task_type=mrbayes)
- OCTUBRE 2022 43 PATOLOGÍA
(KY85, 4by4, invariable+Gramma, número de generaciones = 10 000). Los números indican la probabilidad posterior. Además, las secuencias de aminoácidos deducidas de la proteína de la cápside de los aislamientos de IHHNV se alinearon usando MAFFT (Auto: según el tamaño de los datos, 200 PAM, k = 2), y el mejor modelo para el árbol filogenético se estimó usando ProtTest 3.4.2 [23]. Se construyó un árbol filogenético utilizando el software MrBayes (http://www.phylogeny.fr/ one_task.cgi?task_type=mrbayes).
Repeticiones terminales y análisis de secuencias palindrómicas
Dos secuencias (Perú D y C) generaron cóntigos que excedieron la longitud de la más grande secuencia conocida de IHHNV en la base de datos del NCBI. Estas dos secuencias tienen una longitud de ~4000 nt y presentan una oportunidad única para analizar las repeticiones terminales directas (DTR) que contienen secuencias palindrómicas que forman estructuras similares a horquillas. Los DTR fueron curados manualmente usando Geneious Prime, y las ambigüedades en las secuencias se resolvieron asignando el nucleótido que presentó la mayor proporción en una posición de nucleótido particular. Las repeticiones del terminal se identificaron con el complemento de buscador de repeticiones Geneious Prime ajustando los parámetros predeterminados para identificar repeticiones de más de 20 nt y permitir cuatro desajustes. Las estructuras de horquilla putativas se modelaron utilizando el servidor web ProbKnot.
Prueba de desafío del IHHNV
Se realizaron dos pruebas de desafío independientes de IHHNV en el Laboratorio de Patología Acuícola (APL) de la Universidad de Arizona en 2020 y 2021. Para estas pruebas de desafío se utilizaron tres
especies diferentes de camarones peneidos juveniles libres de patógenos específicos (SPF) (Tabla 1). Penaeus vannamei y P. monodon se obtuvieron de proveedores en los EE. UU., y P. stylirostris se obtuvo de un proveedor en Austria (White Panther and Shrimp Improvement Systems, originalmente de México). El peso promedio de los juveniles de cada una de estas tres especies fue de 1.5±1.0 g. Se sembró veinte animales en un acuario de vidrio de 90 L. En los tanques utilizados, la temperatura se mantuvo en 27.5±1.1˚C, la salinidad en 28.3±1.1 ppt, el pH en 7.9±0.1, el NH3 en 0.05±0.1 ppm y el NO2 en 0.05±0.1 ppm. Los camarones fueron alimentados una vez al día con alimento granulado comercial (Rangen 35%; Buhl, Idaho). Los detalles del diseño experimental se presentan en la Tabla 1.
Se prepararon dos inóculos diferentes de IHHNV para la prueba de desafío: uno de Perú (Tumbes, Caso 20-842F) y uno de Ecuador (Guayas, 21-273). Se homogeneizaron los cefalotórax de P. vannamei infectados con IHHNV congelados en un tampón (0,02 M Tris-HCl, pH 7.4, tampón 0.4 MNaCl; 1 g 10 ml−1) utilizando un mezclador de tejidos y se clarificaron a 3500 × g durante 20 min y a 5000 × g durante 20 min a 4 ˚C, respectivamente. El sobrenadante fue filtrado utilizando un filtro de 0.2 μm, se diluyó (1:20) en solución salina al 2 %, en alícuotas y congelado a -80 °C. Los camarones fueron inyectados con 100 μL de IHHNV. La carga viral en el inóculo utilizado para inyectar a cada animal se calculó como 9.0 × 106 copias del genoma de IHHNV. La mortalidad se registró diariamente desde el inicio del experimento. Al final de la prueba de desafío (es decir, 39 días posteriores a la inoculación, dpi) y a los 30 dpi para los Desafíos 1 y 2, respectivamente, se tomaron muestras individuales de cinco sobrevivientes de cada

tanque para análisis de histología y PCR en tiempo real. Las muestras de branquias se recolectaron individualmente en etanol al 95% para el análisis de PCR en tiempo real para la detección del IHHNV. El resto de los camarones se fijó en el fijador de Davidson (Bell y Lightner, 1988) para el análisis histológico de hematoxilina y eosina (H&E) para examinar los cambios patológicos inducidos por el IHHNV.
Histopatología e hibridación in situ
Se procesaron muestras fijadas con alcohol, formalina y ácido acético de Davidson, se incluyeron en parafina, y seccionaron (5 μm de espesor) utilizando métodos estándar. Después de teñir con H&E, las secciones fueron analizados por microscopía de luz. La severidad de la infección/lesión del IHHNV se calificó de G0-G4 según Lightner (Lightner 1996), siendo G0 la ausencia de lesiones y G4 siendo la presencia de lesiones severas y destrucción tisular avanzada
Las sondas utilizadas para la hibridación in situ (ISH) contenían una mezcla de sondas marcadas con digoxigenina fabricadas con el kit de síntesis PCR DIG Probe (Roche) y etiquetado final del oligonucleótido 30 (Sigma-Aldrich, EE. UU.). Los cebadores (primers) de IHHNV 309F: 5’-TCC AAC ACT TAG TCA AAA CCA A[DIG]-3’ and 309R: 5’TGT CTG CTA CGATGA TTA TCC A[DIG]-3’ se utilizaron para el etiquetado de 30 extremos. Se procesaron camarones fijados con fijador de Davidson y se prepararon secciones de tejido (5 μm de espesor). Después de la desparafinización, hidratación, digestión con proteinasa K y prehibridación, las secciones se cubrieron con 500 μL de solución de hibridación que contenía cebadores marcados con DIG (100 fmol).
Los portaobjetos se colocaron sobre una superficie calentada a 90 °C durante 10 min
Tabla 1. Diseños experimentales de dos pruebas de desafío independientes de IHHNV utilizando tres especies diferentes de camarones peneidos.
- OCTUBRE 2022 44 PATOLOGÍA
y se hibridaron durante la noche a 50 °C. La detección final se realizó con un anticuerpo anti-digoxigenina conjugado con fosfatasa alcalina (Roche), que se visualizó usando nitro azul de tetrazolio y 5-bromo-4-cloro-3indolil fosfato.
Análisis estadístico
Análisis de varianza a una vía (ANOVA) seguido de la prueba de Tukey para comparaciones de media desigual n post-hoc se realizaron para determinar la diferencia en la supervivencia entre los grupos experimentales. El número de copias de ADN se expresó en log10 y se sometió a análisis estadístico mediante la prueba de normalidad de Shapiro-Wilk y la prueba no paramétrica de Mann Whitney con un IC del 95 % para comparar P. vannamei infectado con IHHNV frente a P. monodon frente a P stylirostris. La correlación entre la carga y la prevalencia de IHHNV se analizó mediante un análisis de correlación no paramétrico utilizando tau-b de Kendall y rho de Spearman (SPSS v16).

Resultados
Análisis de la finca
Muestras de camarón Penaeus vannamei recolectadas de estanques de engorde en tres regiones diferentes de Ecuador, incluidas El Oro, Esmeraldas y Guayas, se examinaron para detectar el IHHNV usando análisis de PCR en tiempo real, siguiendo el protocolo recomendado por la OIE. Los detalles de las muestras recolectadas de estas regiones, la prevalencia de IHHNV y los datos de carga viral se resumen en la Tabla 2.
En total, se analizaron 240 camarones de ocho estanques de engorde. El tamaño promedio de los camarones por estanque varió entre 6.2 y 28.6 g. El coeficiente de variación osciló entre 13.6% y 52.7%.
El IHHNV estuvo presente en todos los
estanques de engorde, con una prevalencia que oscilaba entre el 3.3% y el 100% (Tabla 2). Hubo una correlación significativa entre el número de copias de IHHNV y la prevalencia de IHHNV (%) (R2 = 0.32, p < 0.01).
No hubo una correlación significativa entre el peso promedio de los camarones en un estanque determinado y la prevalencia de IHHNV (p > 0.05) en los ocho estanques de engorde analizados (Fig. 2). Se calculó el número de copias de IHHNV de cada muestra para determinar si había alguna correlación entre la carga viral y el peso del animal en un estanque. Para lograr este objetivo, la carga de IHHNV se dividió en tres categorías arbitrarias: no detectadas, copias bajas a medias (IHHNV ≤ 1 ×102 copias/ng de ADN) y copias altas (> 1 ×102 copias/ ng de ADN). Es importante resaltar que no todos los estanques de engorde tenían camarones en las tres categorías. Por lo tanto, para este análisis solo se utilizaron tres estanques (estanques 2, 3 y 7) que contenían camarones que representaban las tres categorías (Fig. 3).
Los tres estanques que tenían camarones en las tres categorías mostraron una tendencia negativa en los pesos de los camarones vs. carga de IHHNV. En uno de los estanques de engorde (estanque 2), hubo incluso diferencia significativa en el peso promedio (p < 0.05) entre camarones con una carga alta de IHHNV (8.1±2.0 g), camarones con carga baja a media de IHHNV (12.3±3.2 g) y camarones sin IHHNV detectado (12.6 ± 0.0 g) (Fig. 3).
Histopatología e hibridación in situ
De los 72 camarones de las ocho piscinas de engorde que se analizaron para la histología de H&E, solo siete presentaron lesiones típicas de IHHNV. Estas lesiones se
caracterizan por la presencia de inclusiones intranucleares eosinofílicas de Cowdry tipo A (CAI) con cromatina marginada en células del epitelio cuticular, epicardio cardíaco y tejido conectivo. En todos los casos, la severidad de la infección por IHHNV fue baja y la escala de severidad osciló entre G-trace y G1. No hubo casos de camarones con lesiones moderadas o severas de IHHNV. Curiosamente, 3 de los 7 camarones que mostraron lesiones histológicas se encontraron en un estanque que mostraba una prevalencia del 100 % de IHHNV mediante PCR en tiempo real (piscina 5).
Secuenciación de Próxima Generación y Ensamblaje de mapeo
ADN genómico total aislado de 7 muestras infectadas con IHHNV, 6 de Perú y 1 de Ecuador fue sometido a análisis NGS. En la Tabla 3 se presenta un resumen de los datos de la secuencia de nucleótidos generados mediante NGS. Los datos de nucleótidos seleccionados de los siete aislamientos casi representaban el genoma completo del IHHNV. La longitud de la secuencia de nucleótidos de estos siete aislamientos de IHHNV varió de 3,726 a 4,122 bases y contenía los tres marcos de lectura abiertos (ORF), similar a la secuencia de referencia depositada en la base de datos GenBank (Tabla 3). Estos incluyen ORF1 que representa la proteína no estructural 1 (NS1) que contiene 663 aminoácidos (aa), ORF2 que codifica una proteína NS-2 que contiene 363 aa y un ORF de proteína de la cápside que contiene 329 aa.
Análisis de filogenia
La secuencia del genoma completo de los aislamientos de IHHNV de este estudio se alineó con 18 secuencias casi completas conocidas de IHHNV disponibles en la base de datos GenBank antes del análisis
Tabla 2. Número de camarones Penaeus vannamei por estanque analizado, peso promedio (g), desviación estándar (DE) y coeficiente de variación CV (%).
- OCTUBRE 2022 45 PATOLOGÍA
filogenético. Los resultados mostraron que siete secuencias de IHHNV se agruparon con IHHNV aislado de Perú, que se separó de otros aislamientos de IHHNV de países de América Latina (Fig. 4). Los aislamientos C, E y F originarios de Perú formaron un grupo con el aislamiento de IHHNV informado previamente en Perú en 2019, con una probabilidad posterior de 99–100. El aislamiento G se agrupó con el aislamiento E1 con una probabilidad posterior de 88. Los aislamientos D y A se obtuvieron de otros aislamientos peruanos. Asimismo, el árbol filogenético construido basado en la secuencia de aminoácidos deducida de la proteína de la cápside también mostró que el IHHNV de Perú y Ecuador formaron un cluster que se separó del IHHNV previamente aislado de la región latinoamericana (Fig. 5). Además, el cluster Perú-Ecuador fue respaldado por probabilidades posteriores de 98 y 100 (Fig. 5).
Repeticiones terminales y análisis de secuencias palindrómicas
Dos de las siete secuencias del genoma de IHNNV obtenidas para este estudio (aislamientos C y D originarios de Perú), contenían DTR en los extremos 50 y 30 del genoma viral. El DTR1 en el aislado D tenía una longitud de 197 nt, con una similitud de secuencia de nucleótidos del 99% entre las secuencias de los extremos 50 y 30 de esta repetición (Fig. 6A). En el aislado C de IHHNV, el DTR1 estaba incompleto y tenía una longitud de 114 nt, con una similitud del 98% entre los extremos 50 y 30 de esta secuencia. La similitud entre el DTR1 de los dos aislados de IHHNV fue del 98.4%. A diferencia del DTR1, la secuencia palindrómica del DTR 2 en ambas cepas mostró una similitud del 100%. El DTR2 en el aislado D de IHHNV fue 12 nt más largo (92 nt) que el del aislado C de IHHNV (80 nt) (Fig. 6A). Además, la repetición 2 formó una estructura de horquilla (Fig. 6B).
Patogenicidad de las diferentes cepas de IHHNV que circulan en Perú y Ecuador Se realizaron dos desafíos de IHHNV utilizando un aislado de Perú y otro aislado de Ecuador. Al final del desafío de IHHNV, es decir, a los 39 d.p.i (Perú) y 30 d.p.i (Ecuador), la supervivencia final fue alta en ambos desafíos experimentales. La supervivencia en los camarones expuestos a IHHNV fue
Fig 2. Comparación del peso promedio de los camarones frente a su estatus IHHNV (positivo / no detectado) en ocho piscinas de engorde de tres regiones de Ecuador. Las barras de error representan la desviación estándar.

Fig 3. Comparación de la carga de IHHNV (alta, baja a media y no detectada) frente al peso promedio de Penaeus vannamei en las piscinas de engorde 2, 3 y 7 en Ecuador. “*” representa una diferencia significativa por ANOVA unidireccional (P < 0.05).
similar a la del grupo no expuesto (Tabla 4).
La tasa de supervivencia final de P. vannamei en los desafíos 1 y 2 fue alta (Tabla 4). En los camarones expuestos a IHHNV, la infección por IHHNV se analizó mediante PCR en tiempo real e histopatología; y luego se confirmó mediante ISH. Dos especies adicionales de peneidos, P. monodon y P. stylirostris, se incluyeron en el desafío experimental 2. Las tasas de supervivencia final de estas dos especies también fueron tan altas como las de P. vannamei (Tabla 4). Al final del desafío, no hubo evidencia de RDS u otros signos clínicos en los camarones desafiados con IHHNV. La PCR en tiempo real confirmó IHHNV en las tres especies: P. vannamei, P. monodon y P. stylirostris. El número de copias de IHHNV fue más alto en la población de P. vannamei, seguida por P. monodon y P. stylirostris (P < 0.001) (Fig. 7).
Para confirmar la infección por IHHNV en los camarones desafiados experimentalmente, se realizó histología H&E e ISH utilizando sondas específicas para IHHNV. En la Tabla 4, se presentan los resultados histológicos de H&E y los datos de ISH. La infección por
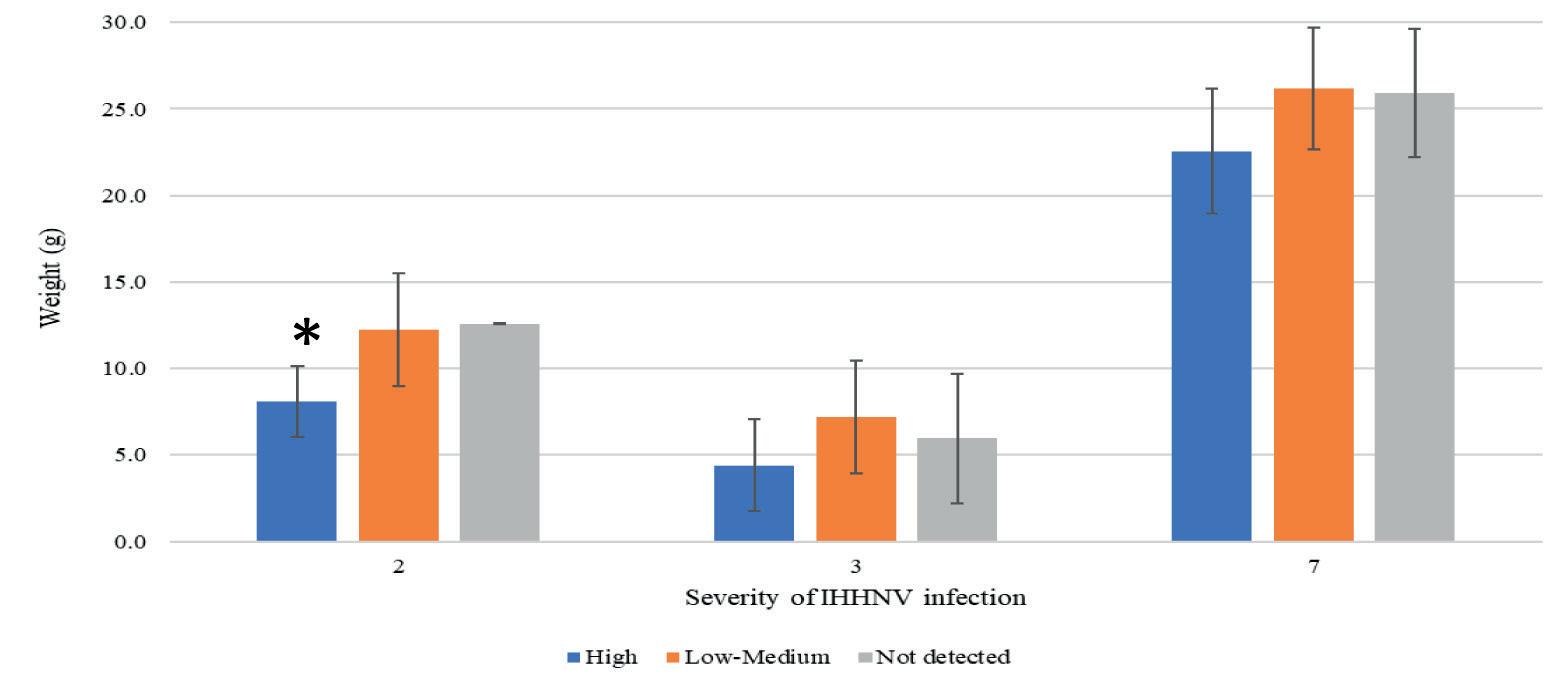
IHHNV se confirmó mediante histología H&E e ISH en P. vannamei y P. monodon en varios tejidos y órganos, incluido el epitelio cuticular de los filamentos branquiales y la glándula antenal, el cordón nervioso, el órgano linfoide y el epicardio. Por el contrario, no hubo evidencia de lesiones de IHHNV ni por histología de H&E ni por ISH en P. stylirostris.
En la Fig. 8, los cuerpos de inclusión intranucleares de IHHNV típicos se muestran mediante histología H&E y se confirman por ISH en P. vannamei y P. monodon en camarones desafiados con IHHNV.
Discusión
Aquí, presentamos datos sobre la prevalencia de IHHNV y su impacto en el crecimiento de P. vannamei en estanques de engorde en tres regiones productoras de camarón importantes en Ecuador. Además, determinamos la secuencia del genoma del virus en P. vannamei originario de Ecuador y Perú, donde el IHHNV es endémico. Finalmente, realizamos un bioensayo experimental utilizando aislamientos de IHHNV originarios de Ecuador y Perú para determinar la virulencia del virus en tres
- OCTUBRE 2022 46 PATOLOGÍA
Negativo
Alto
Positivo
Medio-bajo Severidad de la infección por IHHNV No detectado
especies de camarones peneidos SPF: P. vannamei, P. monodon y P. stylirostris.
Análisis de la finca
Muestras de Penaeus vannamei de piscinas de engorde que representan tres regiones diferentes en Ecuador fueron examinadas para IHHNV. El virus estuvo presente en muestras recolectadas de los ocho estanques de engorde ubicados en las tres regiones diferentes (Tabla 1). La prevalencia de IHHNV varía ampliamente, desde el 3.3% hasta el 100%. En el análisis de PCR en tiempo real, algunos camarones mostraron resultados negativos, mientras que otros mostraron un número de copias de hasta 2.9 × 105 copias/ng de ADN (Tabla 2). Para establecer la asociación entre el peso del camarón y la presencia de IHHNV, la población de cada estanque se dividió en dos grupos según los resultados de la PCR en tiempo real (IHHNVpositivo e IHHNV no detectado). Como se muestra en la Fig. 2, no hubo ninguna correlación significativa entre el peso promedio de los camarones y la presencia de IHHNV dentro del mismo estanque. Sellars et al. mostró que en una granja de P. monodon en Australia, el rendimiento del crecimiento y la supervivencia se redujeron en estanques de engorde con un alto número de copias de IHHNV (0.5 × 103 a 2.24 × 106 copias/ng TNA). En nuestro estudio, el número medio de copias de IHHNV varió entre 5.9 × 100 y 1.4 × 104 copias/ng de ADN, que es inferior a la carga de IHHNV informada por Sellars et al., lo que puede explicar parcialmente la poca o ninguna influencia en el rendimiento del crecimiento. Hubo una correlación directa significativa entre el número de copias de IHHNV y la prevalencia de IHHNV en los estanques de engorde.
La prevalencia y el número de copias fue alto. Resultados similares en estanques de
engorde fueron reportados por Sellars et al. Estos hallazgos son consistentes con el patrón de infección con agentes infecciosos. Walker et al. sugirió que cuando las cargas virales aumentan a niveles agudos, pueden comprometer la salud de los camarones. En nuestro estudio, las lesiones histológicas de IHHNV se observaron solo en camarones de estanques de engorde donde la prevalencia de IHHNV fue del 100%. Por el contrario, los camarones de estanques con baja prevalencia de IHHNV no mostraron lesiones histológicas.
Para comprender mejor el efecto de la carga de IHHNV en el crecimiento de los camarones P. vannamei en un estanque determinado, las poblaciones de camarones se dividieron en tres categorías según el número de copias de IHHNV: no detectado, bajo a medio y alto. Criterios similares fueron utilizados por Sellars et al. para evaluar el impacto de IHHNV en el crecimiento de P. monodon Solo tres de los ocho estanques de engorde (estanques 2, 3 y 7) tenían camarones representativos de las tres categorías. Como se describe en la Fig. 3, hubo una tendencia inversa entre el número de copias de IHHNV y el peso de los camarones, con animales que tenían cargas virales más altas y pesos más bajos. En un caso (estanque 2), se observó una correlación significativa. Estos estanques de engorde tenían el número medio más alto de copias de IHHNV. Por ejemplo, el número promedio de copias de IHHNV en animales recolectados en los estanques 2, 3 y 7 fue de 4.54 × 103 copias/ng de ADN, 1.43 ×104 copias/ng de ADN y 4.12 × 103 copias/ng de ADN, respectivamente (Tabla 2). Un estanque de engorde (estanque 5) que también mostró un alto número medio de copias de IHHNV, no fue analizado debido al hecho de que el 100% de los camarones dieron positivo para IHHNV. Vale la pena señalar que no se
observó RDS en los camarones recolectados de ninguno de los tres estanques o los cinco estanques restantes.
Históricamente, se informó que el IHHNV causaba RDS en P. vannamei, lo que resultaba en grandes disparidades de tamaño y deformidades en el crecimiento. Un informe reciente de la India documentó deformidades que incluyen sexto segmento abdominal deformado, rostro deformado, aspereza cuticular y antenas arrugadas, y una amplia variación en el tamaño de los estanques de engorde en P. vannamei analizados de 350 fincas camaroneras. Desafortunadamente, en ese estudio, solo se analizaron camarones con signos clínicos; por lo tanto, no fue posible determinar la prevalencia de IHHNV en individuos sanos de los mismos estanques. Otro informe de la India reportó la presencia de dos patógenos, el virus del síndrome de la Mancha Blanca (WSSV) y el IHHNV, sin ninguna deformidad externa. Desde esta perspectiva, nuestros hallazgos sugieren a primera vista la capacidad inherente de ciertas líneas genéticas de P. vannamei para llevar una carga viral alta sin mostrar signos clínicos.
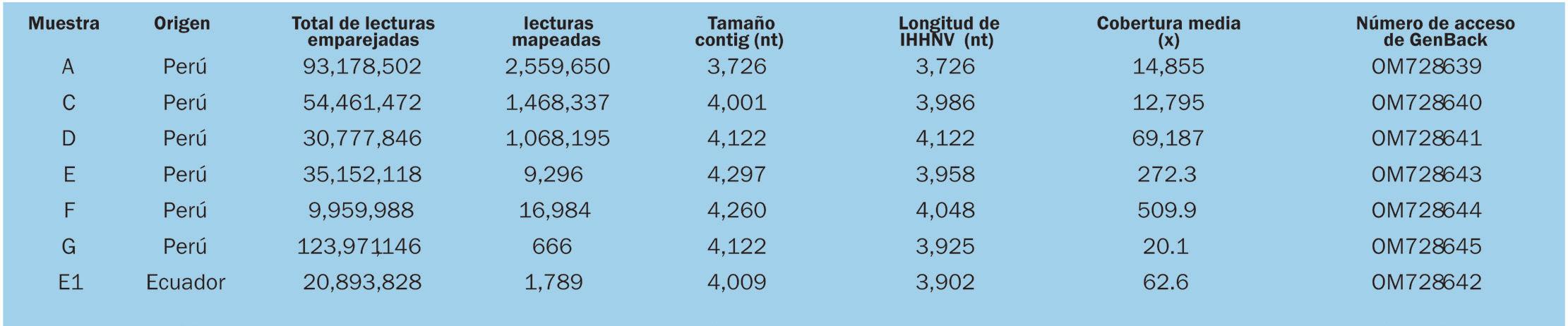
Secuencia del genoma de IHHNV y análisis filogenéticos
En este estudio, la secuencia completa del genoma de IHHNV (AF218266) se utilizó como referencia. El genoma de IHHNV varía en longitud; por ejemplo, el IHHNV aislado de Brasil tiene una longitud de 3739 nt, y el IHHNV aislado de India tiene una longitud de 3,908 nt o incluso 4,1 kb. En este estudio, el genoma de IHHNV tenía un tamaño promedio de 3,957 nt, que estaba en el rango del tamaño genómico de IHHNV. El genoma de IHHNV contiene tres marcos abiertos de lectura (ORF por sus siglas en inglés) principales que codifican las proteínas 666
Tabla 3. Resumen de los datos de Secuenciación de Próxima Generación (NGS) del genoma de IHHNV del camarón Penaeus vannamei originario de Perú y Ecuador.
- OCTUBRE 2022 47 PATOLOGÍA
aa- NS1, 363 aa-NS2 y 329 aa del cápside. El árbol filogenético construido a partir de la secuencia completa del genoma de IHHNV reveló que todos los aislamientos de IHHNV de Perú y Ecuador pertenecía al mismo grupo de IHHNV de tipo 2. Sin embargo, parece que forman un nuevo subcluster dentro de este grupo tipo 2. De hecho, el árbol filogenético construido a partir de las secuencias de la proteína CP también reveló un subcluster único que contenía todos los IHHNV de Perú y Ecuador. Por lo tanto, proponemos un nuevo tipo de IHHNV aislado de estas dos regiones geográficas. Una posible explicación de esta alta similitud entre el IHHNV de Ecuador y Perú puede ser debido al frecuente movimiento de postlarvas de Ecuador a Perú. Durante la vigilancia activa realizada por SANIPES, se analizaron por PCR muestras de postlarvas importadas de lotes ecuatorianos. La frecuencia de IHHNV en estas muestras fue del 55% (15 de 27 muestras) en 2019, del 52% (75 de 144 muestras) en 2020 y del 76.3% (55 de 72 muestras) en 2021.
Identificación de repeticiones terminales y secuencias palindrómicas en el genoma del IHHNV
Identificamos DTR en los extremos 5’ y 3’ del genoma de IHHNV (cepas C y D), y el DTR en el extremo 3’ contenía secuencias palindrómicas que formaban supuestas estructuras en forma de horquilla que son características de la familia Parvoviridae
Como se observó en el HPV, solo las secuencias del extremo 3’ fueron capaces de formar supuestas estructuras similares a horquillas y, a diferencia de otros parvovirus de camarón, en el metalodensovirus de P. monodon, no observamos una estructura en forma de T en las repeticiones terminales invertidas. Esto demuestra la singularidad de las nuevas secuencias de IHHNV encontradas en América Latina.
Virulencia de aislamientos de IHHNV de Ecuador y Perú determinada por desafío experimental
Para el desafío experimental, IHHNV de Ecuador y de Perú fue utilizado para infectar experimentalmente camarones SPF. La virulencia de los aislamientos de IHHNV se determinó en función de la tasa de supervivencia final, RDS, número de copias de IHHNV, lesiones histológicas e ISH. Aunque se usó SPF P. vannamei para los
Fig 4. Árbol filogenético basado en secuencias de nucleótidos de IHHNV aislado de Perú (A, C, D, E, F y G), Ecuador (E1) y otros aislamientos conocidos de IHHNV depositados en la base de datos GenBank. Las secuencias de nucleótidos se alinearon usando MAFFT (Auto: según datos tamaño, 200 PAM, k = 2), y el mejor modelo para el árbol filogenético fue estimado por jmodel Test 2.1.10 [20]. El árbol filogenético fue construido usando MrBayes (http://www.phylogeny.fr/one_task.cgi?task_ type=mrbayes) (KY85, 4by4, invariable+Gramma, número de generación = 10.000). Los números en las ramas de los árboles indican probabilidad posterior. Las secuencias de nucleótidos del IHHNV aisladas de Perú y Ecuador se muestran dentro de un recuadro azul.


Fig. 5. Árbol filogenético basado en la secuencia de aminoácidos predicha del gen de la proteína de la cápside de aislamientos de IHHNV originarios de Perú (A, C, D, E, F y G), Ecuador (E1) y otras secuencias homólogas conocidas de IHHNV depositadas en la base de datos GenBank. Las secuencias de aminoácidos se alinearon usando MAFFT (Auto: según el tamaño de los datos, blossom), y el mejor modelo para el árbol filogenético fue estimado por ProtTest 3.4.2 . El árbol filogenético se construyó utilizando MrBayes (http://www.phylogeny.fr/one_task.cgi?task_type=mrbayes) (GTR, VT, sin tasa de variación, número de generaciones: 10 000). El número en las ramas de los árboles indica probabilidad posterior. Los aislamientos de IHHNV de Ecuador y Perú están marcados con un recuadro azul.
bioensayos de IHHNV para aislamientos de Ecuador y Perú, se analizaron dos especies de camarón adicionales: P. monodon y P. stylirostris, para el bioensayo de IHHNV de Ecuador. En general, la supervivencia fue muy alta en las tres especies (97-100%), incluso cuando el inóculo se administró mediante inyección con un alto número
de copias virales (9.0 × 106 copias). Estos resultados respaldan claramente la idea de que estas líneas SPF son tolerantes al IHHNV utilizado en el bioensayo. A pesar de la muy baja mortalidad en el bioensayo, los camarones inyectados con IHHNV tenían una alta carga de IHHNV al final del experimento. Las cepas de IHHNV de Perú y Ecuador
- OCTUBRE 2022 48 PATOLOGÍA
Tipo 1 Tipo 3 Tipo 2 Tipo 1 Tipo 2 Tipo 3
no causaron mortalidad en dos especies de camarón endémicas (P. vannamei y P. stylirostris) y una especie de camarón exótica (P. monodon). Estos hallazgos pueden explicarse en parte considerando los antecedentes históricos de la población de P. stylirostris. La línea genética de P. stylirostris utilizada en este estudio se originó en México y es probable que sea un progenitor de una población resistente al IHHNV que se seleccionó de sobrevivientes de un brote de IHHNV. Alrededor de 1999, había una línea de P. stylirostris llamada “Super Shrimp®” que se confirmó que era resistente a IHHNV después de la prueba de desafío de IHHNV durante 32 días sin mostrar ninguna evidencia IHHNV, según lo evaluado por PCR en tiempo real. En 2010, esta línea genética se llevó desde México hasta Hawaii, donde se mantuvo durante aproximadamente 10 años en instalaciones con altas medidas de bioseguridad. Este stock genético parecía conservar la tolerancia/resistencia al IHHNV.
Cuando se comparó la carga de IHHNV en P. vannamei criada en piscinas de engorde en Ecuador con la carga de IHHNV encontrada en los SPF P. vannamei de la prueba de desafío, hubo una diferencia significativa en las cargas virales (P < 0.001), con un mayor número de copias de IHHNV en la población SPF utilizada para la prueba de desafío que en P. vannamei cultivado en finca (Fig. 9). Aunque se desconocen los antecedentes genéticos de la línea SPF utilizada en el bioensayo y el P. vannamei criado en finca, los datos sugieren una alta tolerancia de las poblaciones endémicas de camarón que se están criando en la industria camaronera ecuatoriana. Actualmente, en América Latina, la mayoría de los camarones se han criado en condiciones en las que el IHHNV es endémico, y los animales criados en estanques de producción que son utilizados como reproductores, aparentemente han adquirido una selección no intencional para
Fig. 6. Estructuras terminales de los aislamientos C y D de IHHNV. (A) Repeticiones terminales directas (repetición 1) ubicadas en los extremos 50 y 30 y las secuencias palindrómicas (repetición 2) ubicadas en el extremo 30 de los genomas de las cepas D y D de IHHNV C. (B) Modelo de horquilla de las secuencias palindrómicas (repetición 2) ubicadas en el extremo 30 del aislado D de IHHNV.

la resistencia a enfermedades, incluido el IHHNV. Esta tolerancia/resistencia puede explicar la ausencia de RDS asociado con la infección por IHHNV en estanques comerciales de engorde que crían P. vannamei.
En la industria del camarón en América Latina, el IHHNV ha sido uno de los patógenos más prevalentes reportados en los últimos 20 años por el Sistema Mundial de Información sobre Sanidad Animal (WAHIS). La acomodación viral es una hipótesis propuesta a principios de 2009 y luego actualizada en 2019. Está relacionado con una infección persistente tolerada en la que los virus o fragmentos de su genoma se insertan en el genoma del camarón por un mecanismo autónomo del huésped que podría tener un efecto protector, lo que podría explicar la ausencia de signos clínicos. Además, Taengchaiyaphum confirmó recientemente una reducción significativa en el número de copias de IHHNV en P. vannamei donde estaba presente una copia viral circular de IHHNV (cvcDNA). Este fenómeno podría explicar la ausencia de RDS y lesiones histológicas severas en camarones infectados con IHHNV en America Latina.
Conclusiones

IHHNV es un patógeno con alta prevalencia en fincas camaroneras en América Latina. Estudiamos la prevalencia de IHHNV en estanques comerciales de engorde en tres importantes regiones productoras de camarón de Ecuador y evaluamos su impacto en el crecimiento del camarón. Al confirmar la presencia del virus en estanques comerciales en Ecuador, determinamos la secuencia del genoma del virus en su rango endémico de Ecuador y Perú. Finalmente, usando un bioensayo experimental, determinamos la virulencia de IHHNV de Ecuador y Perú usando tres especies diferentes de camarones peneidos: P. vannamei, P. monodon y P. stylirostris. Nuestros datos revelaron que IHHNV no causó mortalidad en las especies desafiadas y no tuvo un impacto notable en la producción de camarones.
Es probable que una amplia variación en la prevalencia de IHHNV se deba a muchos factores, como los días de cultivo transcurridos cuando se recolectaron las muestras, el estado de salud de las postlarvas utilizadas para sembrar los estanques, antecedentes genéticos de las postlarvas, condiciones de cultivo, manejo de la finca y
Tabla 4. Tasa de supervivencia final en Penaeus vannamei, P. monodon y P. stylirostris luego del desafío con IHHNV mediante inyección a los 39 (Perú) y 30 (Ecuador) días posteriores al desafío.
- OCTUBRE 2022 49 PATOLOGÍA
Consenso
otros factores desconocidos. Dejando a un lado los datos de prevalencia porcentual, en estanques con animales que no portaban IHHNV a aquellos con niveles altos de IHHV, encontramos una tendencia negativa entre la carga de IHHNV y el peso del camarón en el estanque correspondiente. Los datos de NGS revelaron que los genotipos de IHHNV que circulan en Ecuador y Perú representan la forma infecciosa de IHHNV.
Finalmente, en bioensayos de laboratorio que duraron 30 días utilizando aislamientos de IHHNV de Ecuador y Perú, no pudimos reproducir ninguna manifestación clínica de infección por IHHNV en P. vannamei ni mortalidad significativa en ninguna de las tres especies de camarones peneidos. Además, aunque se detectó IHHNV en las tres especies mediante PCR en tiempo real, la carga viral fue significativamente mayor en P. vannamei que en P. monodon y P. stylirostris. Además, mediante el análisis histológico de H&E, se detectaron cuerpos de inclusión tipo A de Cowdry, que se consideran patognomónicos de la infección por el IHHNV, en P. vannamei y P. monodon, pero no en P. stylirostris. Se realizó ISH para delinear las lesiones específicas de IHHNV en P. vannamei y P. monodon.
Aunque nuestros datos sobre la carga cuantitativa de IHHNV y su efecto sobre el crecimiento son limitados, sugieren una correlación negativa entre estos dos parámetros. Por lo tanto, un conjunto de datos más sólido con una mayor cantidad de muestras, junto con el estado de salud de las postlarvas utilizadas para sembrar un estanque será inmensamente beneficioso para una investigación más precisa de una relación cuantitativa entre el crecimiento del camarón y la carga de patógenos del genotipo de IHHNV circulante en América Latina•
Fig. 7. Número de copias de IHHNV en tres poblaciones de camarones desafiadas con IHHNV. Las letras a, b y c denotan diferencias significativas por ANOVA de una vía (p < 0.001).
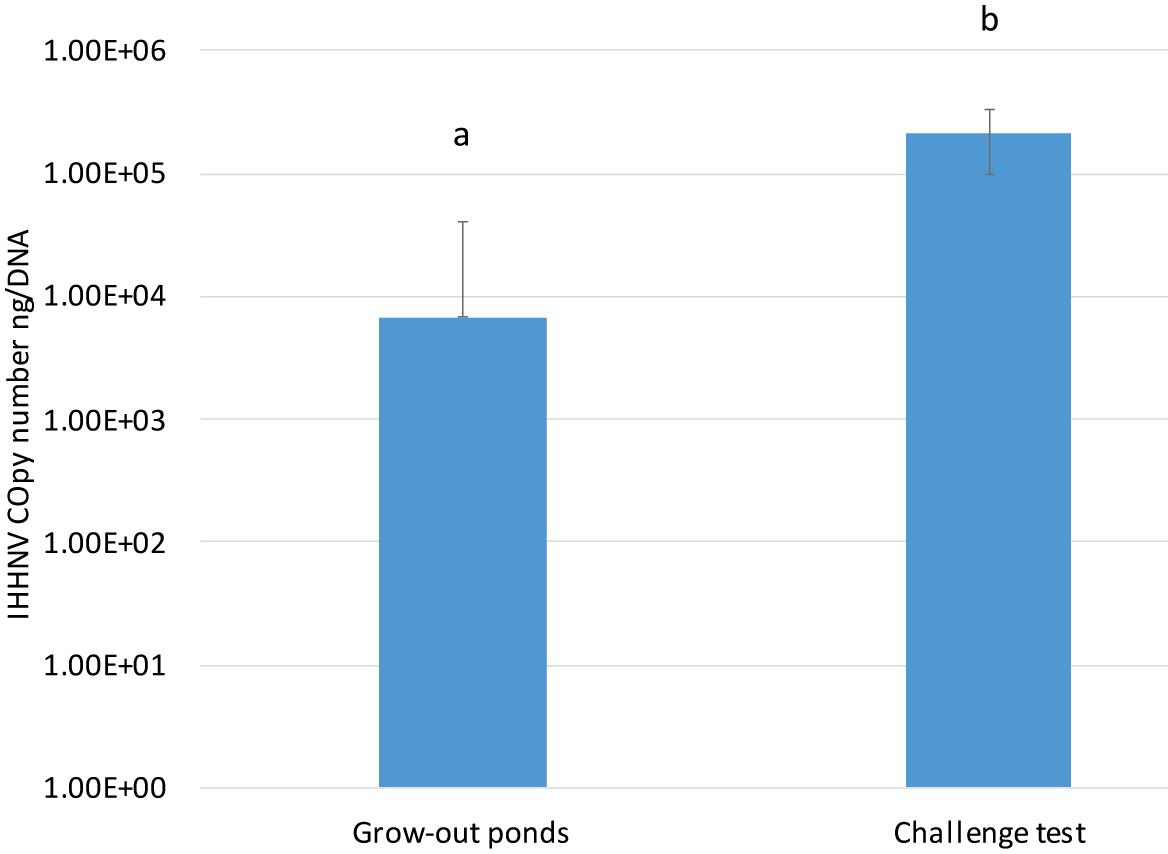
Fig. 8. Histología H&E e ISH de camarones P. vannamei y P. monodon desafiados experimentalmente con IHHNV. Los paneles A, C, E y G representan la histología de H&E, y los paneles B, D, F y H representan los resultados de ISH utilizando sondas específicas de IHHNV. A&B: P. vannamei infectado con aislado de IHHNV de Perú, C&D: P. vannamei infectado con aislado de IHHNV de Ecuador, E&F: P. monodon infectado con aislado de IHHNV de Ecuador, G&H: Camarón de control libre de patógenos específicos (SPF) de P. vannamei. A & B muestra una sección de la glándula antenal. C-H muestran secciones de epitelio cuticular. Las puntas de flecha muestran el cuerpo de inclusión intranuclear eosinofílico (Cowdry tipo A). Las flechas muestran una reacción positiva por ISH (precipitado oscuro). La estrella negra representa una sección del epitelio cuticular. La estrella azul muestra una sección de tejido conectivo esponjoso.

Fig. 9. Número de copias de IHHNV en una línea SPF de P. vannamei desafiada experimentalmente con IHHNV frente al número de copias en 240 camarones P. vannamei de ocho estanques de crecimiento en Ecuador.

Las letras ayb denotan diferencias significativas por ANOVA de una sola vía (p < 0.001).
Agradecimientos
Los autores desean agradecer al Dr. James Brock por la revisión crítica del manuscrito, a la Sra. Tiffany Bledsoe por su ayuda en la preparación de placas para el análisis histológico de H&E y a Paul Schofield por su asistencia en los bioensayos.
Contribuciones de autor
Conceptualización: Luis Fernando Aranguren Caro.
Análisis formal: Luis Fernando Aranguren Caro, Hung Nam Mai, Roberto Cruz-Flores, Arun K. Dhar.
Adquisición de fondos: Muriel María Gómez-Sánchez, Yahira Piedrahita.
Investigación: Hung Nam Mai.
Metodología: Luis Fernando Aranguren Caro, Hung Nam Mai.
Administración del proyecto: Muriel María Gómez-Sánchez, Yahira Piedrahita.
Software: Roberto Cruz-Flores.
Supervisión: Luis Fernando Aranguren Caro.
Validación: Hung Nam Mai, Rod Russel R. Alenton.
Redacción – borrador original: Luis Fernando Aranguren Caro, Hung Nam Mai, Roberto Cruz-Flores, Rod Russel R. Alenton, Arun K. Dhar. Redacción, revisión y edición: Hung Nam Mai, Roberto Cruz-Flores, Rod Russel R. Alenton,Arun K. Dhar.
- OCTUBRE 2022 50 PATOLOGÍA
Especies de camarones
Estanques de engorde Prueba de desafío

VIBRIOSIS
El constante desafío de los camaroneros
Hace
seis años, escribí un breve artículo que resumía los desafíos que enfrentan los camaroneros cuando se trata de lidiar con las infecciones por vibrio. Esta es una actualización. Las infecciones bacterianas del camarón de cultivo son bastante comunes y probablemente la principal causa de mortalidad. Los vibrios son sin duda un actor importante en esto, pero no son la única causa. Con demasiada frecuencia, el hecho de no tomar medidas proactivas da como resultado fallas en el tratamiento reactivo de las enfermedades una vez que ocurren.
La Tabla 1 es una lista parcial de especies de vibrio que se han asociado con brotes de enfermedades en camarón en varios momentos del ciclo de producción. El lector debe tener en cuenta que dentro de una especie determinada puede haber muchas cepas que no pueden causar enfermedades. De hecho, la virulencia es rara. También es importante tener en cuenta que la mayoría de los brotes de vibrios se deben a bacterias oportunistas. Los animales se ven debilitados por factores estresantes que pueden incluir patógenos virales, y esto es lo que los hace susceptibles. La industria debería centrarse en minimizar la presencia de factores estresantes en lugar de tratar de controlar selectivamente las cargas de vibrio. Hacer uno sin el otro es contraproducente.
Como es evidente, una amplia gama de cepas específicas de especies seleccionadas de vibrios pueden causar problemas de enfermedades similares. Esto no significa que todos los miembros de las especies sean de interés o que aquellos que son de interés se aborden mejor intentando excluir a todos los miembros del género de los sistemas de producción. Las fotos a continuación muestran algunas de las apariencias de camarones afectados por vibrios
Vibrios en general
Los vibrios son bacilos curvos gramnegativos. La mayoría puede crecer en ausencia de oxígeno (denominados anaerobios facultativos). Este no es el método preferido de crecimiento, pero les permite prosperar en entornos que no son óptimos. Prefieren temperaturas de 15 °C (59 °F) o más. Son un componente de la mayoría de los ecosistemas acuáticos. La mayoría se
- OCTUBRE 2022
Autor: Dr. Stephen Newman Experto en microbiología, conservación y desarrollo acuícola sgnewm@aqua-in-tech.com
encuentran en el mar y en agua salobre, aunque V. cholerae también se encuentra en agua dulce. Están muy evolucionados, tienen dos cromosomas que les permite ser genéticamente bastante flexibles. El número exacto de especies es muy variable, ya que se identifican más regularmente. Se estima que hay más de 150 especies con probablemente miles de cepas.
La mayoría son benignos y no pueden causar enfermedades a menos que estén presentes en niveles que solo pueda lograrse cultivándolos en laboratorio. Son omnipresentes en el agua y colonizan muchos animales acuáticos, incluyendo a peces, camarones y cangrejos, entre otros, así como algas, formas planctónicas de una variedad de organismos y materia orgánica en suspensión. Fácilmente forman ensamblajes complejos conocidos como biofilms, que les permiten producir enfermedades y asegurar la persistencia en el ambiente. Son fundamentales en la biodegradación de la quitina. La Tabla 1 enumera la mayoría de los que han estado implicados en enfermedades de camarón. La mayoría de estas especies tienen múltiples cepas, muchas de las cuales no son patógenas. Hay dos grandes categorías en las que se dividen los patógenos.

Los patógenos obligados que causan enfermedades cuando están presentes. Una sola célula puede ser suficiente para iniciar un proceso de enfermedad. Un número muy pequeño de bacterias es suficiente para desencadenar un proceso patológico que mata al huésped. Por lo general, el animal no tiene la capacidad de defenderse contra la infección y sucumbe rápidamente. Estos son relativamente raros.
Los patógenos oportunistas causan enfermedades cuando otros factores debilitan al huésped. La mayoría de las bacterias que matan al camarón entran en esta categoría. En ausencia de factores estresantes, estos pueden ser benignos. Pueden estar presentes en niveles muy altos y, sin embargo, no causar ningún problema. La mayoría de las enfermedades bacterianas en el camarón de cultivo se debe a patógenos oportunistas.
Especies Reacción TCBS (Verde-G o Amarillo-Y) Enfermedad/Comentarios
V. alginolyticus
V. anguillarum V. harveyi
V. parahaemolyticus
V. vulnificus
splendidus
fluvialis
campbellii
V. mimicus V. owensii
orientalis
V. mediterranei V. logei
penaeicida
-Síndrome de Zoea, necrosis hepatopancreática séptica (laboratorio y engorde), enfermedad de la concha
-Enfermedad de la concha (juveniles y adultos)
Vibriosis luminiscente (huevos y larvas), Síndrome de mortalidad temprana (EMS o AHPNS-Necrosis hepatopancreática aguda) (larvas, juveniles y engorde)
Síndrome de Mortalidad Temprana (necrosis hepatopancreática aguda) (larvas, juveniles y engorde), síndrome de Zoea, necrosis séptica (laboratorio y engorde), enfermedad de la concha
-Necrosis séptica (laboratorio y engorde), enfermedad de la concha
-Enfermedad de la concha, Vibriosis luminiscente (huevos y larvas)
-Enfermedad de la concha
-Síndrome de Zoea, Necrosis séptica (laboratorio y engorde), Síndrome de Mortalidad Temprana (Necrosis hepatopancreática aguda) (larvas, juveniles y engorde)
-Síndrome de Zoea, Necrosis séptica (laboratorio y engorde), enfermedad de la concha. Muy similar a V. cholerae
-Síndrome de Mortalidad Temprana (Necrosis hepatopancreática aguda) (larvas, juveniles y engorde)
Vibriosis luminiscente (huevos y larvas), también conocida como V. bivalvicida
Vibriosis luminiscente (huevos y larvas), Vibriosis luminiscente (huevos y larvas), -Síndrome de Summer en engorde -Síndrome de Summer en engorde
- OCTUBRE 2022 53 PATOLOGÍA
Tabla 1. Especies de Vibrio asociadas con enfermedades en el camarón de cultivo
V.
V.
V.
V.
V.
V.
nigripulchritudo
Y Y Y
BG,
G (hay cepas raras Y)*G
G
(hay cepas Y)
Y/G Y
Y
G
G Y Y Y
* *
**BG-verde azulado * crece muy poco en TCBS
Foto 1: Vibriosis Sistémica: Músculo abdominal opaco/cromatóforos rojos expandidos
Conceptos erróneos sobre el papel de los vibrios en las enfermedades de camarón
Se enumeran a continuación, algunos de los conceptos erróneos más comunes.
Concepto erróneo #1. Los vibrios son todos bacterias malas, y ningún otro género bacteriano lo es. Muchas otras especies de bacterias han sido implicadas en brotes de enfermedades en el camarón de cultivo. La mayoría son probablemente tan oportunistas como lo son la mayoría de los vibrios. Algunos de los géneros que han sido implicados son Aeromonas, Pseudomonas, Streptococcus, Bacillus, Photobacterium, Pasteurella, Shewenella entre otros. Además, el hecho de que la mayoría de las bacterias no se puedan cultivar en medios de agar lleva a la inferencia de que puede haber muchos otros patógenos bacterianos que aún no se han identificado. La mayoría de las bacterias que mata al camarón están actuando de manera oportunista.
Concepto erróneo #2. Los vibrios malos son verdes en agar tiosulfato citrato bilis sacarosa (TCBS) y los buenos son amarillos Este medio selectivo fue desarrollado hace algunos años para la selección de vibrios No todos los vibrios crecen en él y la distinción comúnmente utilizada del color de la colonia en el agar, que se tergiversa como relacionada con la virulencia, refleja la capacidad de usar la sacarosa del azúcar. No existe una correlación entre esto y la presencia de toxinas o la capacidad de producir enfermedades. Sin embargo, esta idea errónea persiste. Muchos afirman que si se puede mantener las colonias verdes de TCBS (no puede digerir la sacarosa) fuera del laboratorio y la camaronera, no necesita preocuparse por el impacto de las colonias amarillas de TCBS. Afirman que estas son benignas. El vibrio más virulento que he visto fue una cepa de Vibrio alginolyticus TCBS amarillo que causó un brote en Belice. Los vibrios fermentadores de sacarosa (amarillos) en TCBS pueden ser muy virulentos.
Concepto erróneo #3. Una bioseguridad responsable requiere esfuerzos para moderar las cargas de vibrio. Los vibrios cumplen un papel muy importante en la degradación de la quitina. La quitina es la segunda biomolécula más abundante en la
Lesión muscular por cepa altamente patógena de V. alginolyticus
naturaleza después de la celulosa. Constituye las paredes celulares de crustáceos, hongos e insectos. Es una molécula lineal polimérica, polímero beta 1,4 de N-acetil-D-glucosamina. Donde haya quitina en los ecosistemas acuáticos habrá vibrios. Dado que la quitina es un componente estructural principal de todos los crustáceos, los vibrios se asocian naturalmente con su presencia. Deshacerse de ellos abre nichos para otros patógenos potenciales. Los patógenos potenciales pueden llenar nichos vacíos y no hay garantía de que no sea peor que cualquier vibrio que haya eliminado. Los esfuerzos para mitigar el impacto de las cargas de vibrio deben ser de manera general y no estar orientados a reducir las cargas hasta el punto en que vacíos en los nichos permitan que dominen otras bacterias que son igualmente capaces de causar enfermedades.

Concepto erróneo #4. Los animales cultivados serán más sanos y fuertes si hay niveles bajos de vibrios en un sistema de producción. La enfermedad es el resultado de una interacción entre un animal huésped, el medio ambiente y el patógeno potencial. Los animales que se producen de una manera que minimiza el estrés al que están sometidos tienen las mejores posibilidades de prosperar. Es mucho más probable que los animales fuertes y sanos se den cuenta de su potencial genético que
los animales estresados. A menos que los vibrios presentes sean patógenos obligados y estén presentes en niveles umbral (niveles necesarios para garantizar la enfermedad en animales sanos), los esfuerzos para controlarlos de manera absoluta no protegerán a los animales de enfermedades. Otros no vibrios causarán enfermedades.
Concepto erróneo #5. El estrés no es acumulativo. El estrés viene en muchas formas diferentes. Cuando el camarón o los peces sufren de anoxia u otros factores estresantes y se recuperan, no se puede suponer que se recuperarán hasta el punto en el que se encontraban antes del evento. Los animales responden de muchas maneras al estrés. Dependerá de cuáles son los factores estresantes y cuánto tiempo están presentes. Lo mismo se aplica cuando los animales han estado expuestos a materiales tóxicos. Puede parecer que están bien, pero esta exposición puede tener impactos duraderos en la homeostasis del animal. Muchos creen que está bien permitir que los animales estén expuestos a niveles subletales de toxinas. Ningún animal se está muriendo por lo que no ven un problema. Los animales debilitados son más susceptibles a patógenos oportunistas y niveles de umbral más bajos de patógenos obligados. Los métodos de producción responsable deben tener esto en cuenta. El objetivo debería ser
- OCTUBRE 2022 54 PATOLOGÍA
Enfermedad de la concha por vibrios
producir cosechas con poco o ningún estrés, no ver cuánto estrés uno puede soportar.
Concepto erróneo #6. La prueba de detección mediante la reacción en cadena de la polimerasa (PCR) proporciona una garantía absoluta de que los animales están libres de los patógenos para los que se les está haciendo la prueba. La PCR es una herramienta poderosa que nunca fue pensada para ser utilizada en la forma en que la industria acuícola la usa. Las pruebas de PCR estándar no son cuantitativas. Es un sí o no. La presencia de un presunto patógeno no significa que esté ocurriendo un proceso activo de enfermedad o que vaya a ocurrir. La ausencia no significa que no esté presente. Solo significa que la muestra fue negativa.
La PCR también puede ser cuantitativa. Esto se conoce como PCR en tiempo real. Puede usarse para seguir el crecimiento de un patógeno (obligatorio y oportunista) en una población susceptible. Si los niveles aumentan con el tiempo y esto ocurre de manera concomitante con una degradación del desempeño animal, entonces es seguro asumir que estos están potencialmente relacionados. Aunque los resultados de la PCR pueden ser bastante útiles, tienen una deficiencia grave. Cuando se examinan animales en función de las estadísticas (es decir, se toma una submuestra de un pequeño porcentaje de una población y se analizan estos animales como una ventana a lo que está ocurriendo en la población en su conjunto) siempre existe la posibilidad de que el patógeno esté presente y que el screening lo pasó por alto (falsos negativos).

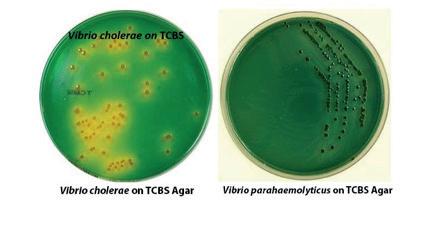
Solo siguiendo el desempeño de los animales en campo se puede estar seguro de que los resultados de PCR para una población son consistentemente válidos. Además, si no se asegura que la forma en que se analizan los animales sea consistente con el comportamiento conocido del patógeno potencial de interés, se producirán falsos negativos. Quizás el mejor ejemplo es el virus que causa la Mancha Blanca, WSSV. Este virus no crece bien a temperaturas de agua más cálidas. Prospera a temperaturas más frías. Si no analiza animales que se mantienen a temperaturas más frías, siempre obtendrá falsos negativos.

- OCTUBRE 2022 55 PATOLOGÍA
Bastón curvo típico con flagelos
Vibrio cholerae en agar TCBS
Vibrio parahaemolyticus en agar TCBS
V. alginolyticus en agar TCBS
Otro ejemplo sería que las cepas de V. parahaemolyticus que contienen las toxinas PIRa y PIRb pueden no ser detectables mediante PCR estándar sin enriquecimiento. La toxina puede estar presente como lo demuestra el daño a los tejidos susceptibles, pero la prueba de PCR resulta negativa. Las muestras de origen sospechoso de la bacteria deben cultivarse en caldo durante 12 a 24 horas antes de realizar una prueba de PCR. En muchos casos, las muestras que inicialmente resultaron negativas mediante la prueba de PCR pueden ser positivas.
Conclusiones:
Es un desafío constante ser consistentemente exitoso en el cultivo de camarón. Es aún más difícil cuando hay una gran cantidad de información errónea que circula ampliamente como un hecho. La clave para una producción exitosa y sostenible es ver la
información por lo que es y asegurarse que no interfiera con la realidad.
Si bien no hay duda de que los vibrios son la causa principal de los brotes de enfermedades bacterianas en el camarón de cultivo, no se puede ignorar el papel de los factores estresantes. Los productores gastan una gran cantidad de dinero y tiempo tratando de controlar los vibrios cuando ignoran los factores estresantes de forma rutinaria. Algo de estrés siempre es inherente a cualquier paradigma productivo.
La selección genética puede ser bastante útil para generar líneas de animales más tolerantes a enfermedades, que los animales silvestres. De hecho, esta es la base de la domesticación. Hasta que los productores acepten la realidad de que el estrés prevenible es lo que permite que
las bacterias oportunistas los afecten, estas bacterias seguirán cobrando un alto precio en la industria acuícola mundial. Es muy probable que tratar de eliminarlos de una manera a todos solo conduzca a otros desafíos desconocidos y tal vez mayores•

- OCTUBRE 2022PATOLOGÍA
Para más información sobre este este artículo escriba a: sgnewm@aqua-in-tech.com

Efectos de la suplementación dietética con polvo de Arthrobacter bussei sobre el crecimiento, la capacidad antioxidante y la inmunidad innata del camarón blanco del Pacífico (Litopenaeus vannamei)
Autores:
Soohwan Kima
Hyuncheol Jeonb Sungchul C. Baic, d Jun Wook Hura,* HyonSob Hana,*
a Facultad de Biociencias Marinas Aplicadas, Universidad Nacional de Kunsan, 558 Daehak-ro, Gunsan, Jeonbuk 54150, República de Corea b Departamento de Biomateriales Marinos y Acuicultura, Universidad Nacional de Pukyong, Busan 48513, República de Corea c Centro de Investigaciones Nutricionales de Piensos y Alimentos, Universidad Nacional de Pukyong, Busan 48547, República de Corea d Programa piloto de la Universidad Mundial de la Pesca de la FAO, Busan 48547, República de Corea
Laproducción comercial de Litopenaeus vannamei entre, varios crustáceos cultivados, ha ido en constante aumento en todo el mundo. Sin embargo, el cultivo de camarón ha enfrentado recientemente graves pérdidas económicas (Sanguanrut et al., 2018; Ochoa-Meza et al., 2019) debido a la reciente intensificación de prácticas acuícolas y la aparición de brotes de enfermedades del camarón (por ejemplo, el Síndrome de la Mancha Blanca y Síndrome de Mortalidad Temprana). Los antibióticos y productos químicos se han utilizado de forma rutinaria para tratar y prevenir enfermedades en el camarón. Sin embargo, el uso indebido y el abuso de estos productos químicos han dado lugar a la resistencia de los patógenos, lo que no solo plantea una grave amenaza ambiental, sino que también socava la sostenibilidad de la producción de camarón (Nadella et al., 2021). En respuesta a estos problemas, estudios recientes han comenzado a enfocarse en mejorar el crecimiento y la inmunidad del camarón mediante la incorporación de suplementos de productos naturales (por ejemplo, extractos de plantas, extractos de algas marinas y microorganismos) en los alimentos (Omont et al., 2019; Alloul et al., 2021; Delgado et al., 2021; Saejung et al., 2021). Dado el aumento en la demanda mundial de L. vannamei, una mayor investigación sobre suplementos alimenticios funcionales proporcionaría una base para el desarrollo de prácticas acuícolas más sostenibles.
Además de los suplementos alimenticios animales y vegetales, los microorganismos que contienen carotenoides están emergiendo como nuevas alternativas comerciales de suplementos alimenticios porque no se ven afectados por el agotamiento de tierras de cultivo y el cambio climático (Wade et al., 2017a, 2017b). Los suplementos alimenticios microbianos industriales generalmente contienen carotenoides derivados principalmente de microalgas y levaduras (Ayiku et al., 2020; Yu et al., 2020). Por ejemplo, la astaxantina (pigmento rojo) y el β-caroteno (pigmento rojo anaranjado) son importantes para la pigmentación de los peces de cultivo y se ha demostrado que promueven el crecimiento y mejoran la inmunidad (Song et al., 2017; Hassaan et al., 2021). Los microorganismos que contienen carotenoides rojos se explotan

- OCTUBRE 2022NUTRICIÓN
smartfish@kunsan.ac.kr https://doi.org/10.1016/j. aqrep.2022.101270
cada vez más por sus beneficios potenciales en la acuicultura (Del Campo et al., 2007). En particular, los microorganismos rojos (Haematococcus pluvialis, Phaffia rhodozyma, Paracoccus carotinifaciens, etc.) que contienen carotenoides rojos, como la astaxantina, se utilizan en la acuicultura como complementos alimenticios funcionales debido a varias ventajas, como la capacidad antioxidante, efecto en la coloración y mejora la inmunidad (Johnson et al., 1980; Ju et al., 2012; Hayashi et al., 2021). Los animales acuáticos no pueden biosintetizar los carotenoides y, por lo tanto, deben depender de la ingesta dietética para adquirir estos importantes nutrientes (Fawzy et al., 2022). Aunque la investigación sobre suplementos alimenticios microbianos está activa, la investigación sobre suplementos alimenticios bacterianos para camarón que contenga pigmento rojo rosa aún es limitada, excepto en el caso de la astaxantina.

Se ha reportado que los pigmentos rojo-rosados producidos por bacterias pertenecientes al género Arthrobacter poseen propiedades antioxidantes y antibióticas, además de servir como colorantes alimentarios y proporcionar beneficios nutricionales (Flegler et al., 2020). Entre los miembros del género Arthrobacter, A. bussei se aisló por primera vez del queso en la región alemana de Allgäu en 2020 y se descubrió que contenía la bacterioruberina carotenoide C50 (Flegler et al., 2020). Sin embargo, a pesar del potencial industrial de A. bussei, la investigación sobre esta bacteria ha sido limitada desde que se identificó por primera vez.
A pesar de haber sido previamente identificado solo en muestras de alimentos, A. bussei se identificó recientemente en muestras de agua del embalse de Saemangeum en nuestro laboratorio. Por lo tanto, este estudio se realizó para evaluar los efectos de la suplementación dietética con polvo de A. bussei en el rendimiento del crecimiento, los parámetros hematológicos, la capacidad antioxidante y la inmunidad innata de L. vannamei.
Materiales y métodos Declaración de Ética
Estos experimentos siguieron las pautas de las normas del Comité Institucional
de Cuidado y Uso de Animales emitidas por la Universidad Nacional de Kunsan, Gunsan, República de Corea. Se hizo todo lo posible para minimizar el sufrimiento de los camarones.
Aislamiento de bacterias del embalse de Saemangeum
Las muestras de bacterias se recogieron del embalse de Saemangeum (35°52’07.3”N, 126°0’29.8”E) ubicado en la provincia de Jeonbuk, República de Corea. Las especies bacterianas se identificaron mediante secuenciación ADNr 16S. Los genomas de los microorganismos se secuenciaron utilizando el kit de secuenciación de ciclo BigDye Terminator v3.1 (Applied Biosystems, Hampton, EE. UU.) de acuerdo con las instrucciones del fabricante después de la amplificación por PCR utilizando un par de primers, el 27F-CM (5′-AGA GTT TGA TCM TGG CTC AG-3′) y 1492R (5′-TAC GGY TAC CTT GTT A-C GAC TT-3′) (Tepaa-morndech et al., 2019; Kim et al., 2021). Después del análisis BLASTn, se encontró que A. bussei era 99 % similar a la cepa KR32 de A. bussei (Fig. 1). El A. bussei descubierto en este estudio fue depositado en la Colección Coreana de Cultivos Tipo (KCTC) (Número de Acceso: KCTC18981P).
Dietas experimentales
El A. bussei se cultivó utilizando un método
de cultivo general. La cepa (2.76 × 108 CFU/ mL) se añadió a una solución de cultivo en la que se incorporaron 10.0 g de triptona, 5.0 g de extracto de levadura, 10.0 g de cloruro de sodio y 10.0 g de dextrina, se mezclaron en 1 L de agua de mar y luego se cultivaron durante 50 h a 26°C. La solución de cultivo se centrifugó (3000 g, 10 min) y se lavó para obtener una cepa bacteriana, que luego se liofilizó para preparar un polvo y luego se suplementó a las dietas. Se prepararon y evaluaron un total de seis dietas experimentales a través de un ensayo de alimentación. Se utilizó como control (CON) un alimento base con un 40 % de harina de pescado (Tabla 1), y el contenido de harina de pescado de las dietas experimentales se reemplazó parcialmente con polvo de A. bussei (0.2 %, 0.4 %, 0.6 %, 0.8 %, y 1.0%; AB-1, AB-2, AB-3, AB-4 y AB5, respectivamente). Para la preparación de las dietas experimentales, los ingredientes del alimento se mezclaron en una batidora comercial, luego de lo cual se agregó aceite de pescado, seguido del agua destilada correspondiente al 12% del peso total del pienso. Todas las dietas se mezclaron continuamente y luego se pasaron a través de una picadora de carne comercial (MN22S, Hankook Fuji Industries, Hwaseong-si, Corea) para la extrusión, lo que resultó en gránulos de 2 mm de diámetro. El alimento experimental preparado se desecó en un
- OCTUBRE 2022 59 NUTRICIÓN
Fig. 1. Árbol filogenético derivado de las secuencias del gen ARNr 16S de microorganismos efectivos y sus especies estrechamente relacionadas.
secador (LDO-150 F, LabTech, Namyangjusi, Korea) durante 24 h, luego almacenado a -20°C hasta que se requiera para los experimentos de alimentación.
Camarón y condición experimental
La prueba de alimentación se llevó a cabo en una instalación de cultivo de camarón bajo techo en la Universidad Nacional de Kunsan (Gunsan, República de Corea). Los juveniles de L. vannamei se compraron en una granja camaronera (Taean, República de Corea). Se permitió que los camarones se aclimataran a las condiciones e instalaciones experimentales durante 14 días, durante los cuales fueron alimentados con alimento comercial. Después del período de aclimatación, se sembraron aleatoriamente camarones de tamaño similar (desviación estándar ± media, 0.40 ± 0.01 g) en tanques acrílicos de 50 L (18 tanques con 25 camarones por tanque). Los camarones fueron alimentados cuatro veces al día (9:00, 13:00, 17:00 y 21:00) y las raciones de alimento se ajustaron al 6–14 % del peso corporal del camarón durante 6 semanas. Todos los experimentos se realizaron con un sistema estático y un recambio del 90 % del agua de cultivo cada 4 días. La temperatura media del agua durante los experimentos de cultivo se mantuvo en 29.0–30.0°C. Se mantuvieron los niveles apropiados de oxígeno disuelto instalando piedras difusoras de aire en todos los tanques de agua experimentales, y se mantuvo un fotoperíodo de 12:12 (luz: oscuridad) usando una lámpara fluorescente.
Rendimiento del crecimiento y análisis bioquímico
Después de someterse a mediciones de peso, los camarones se mantuvieron en ayunas durante 18 horas y el crecimiento se midió en términos del peso total del camarón. Después del pesaje final, ocho camarones de cada tanque fueron seleccionados al azar y anestesiados en agua helada para análisis bioquímicos. La hemolinfa de los camarones se recolectó utilizando una jeringa tratada con solución de Alsever (Sigma-Aldrich, St. Louis, EE.UU.), y las muestras se dejaron coagular a temperatura ambiente durante 30 min. Luego, el suero se separó por centrifugación (5000 g, 10 min). Los niveles de transaminasa glutámico oxalacética (GOT) y transaminasa glutámico-piruvato (GPT) en
Tabla 1. Formulación dietética y composición proximal de la dieta base para camarón blanco del Pacífico (Litopenaeus vannamei) (% materia seca).
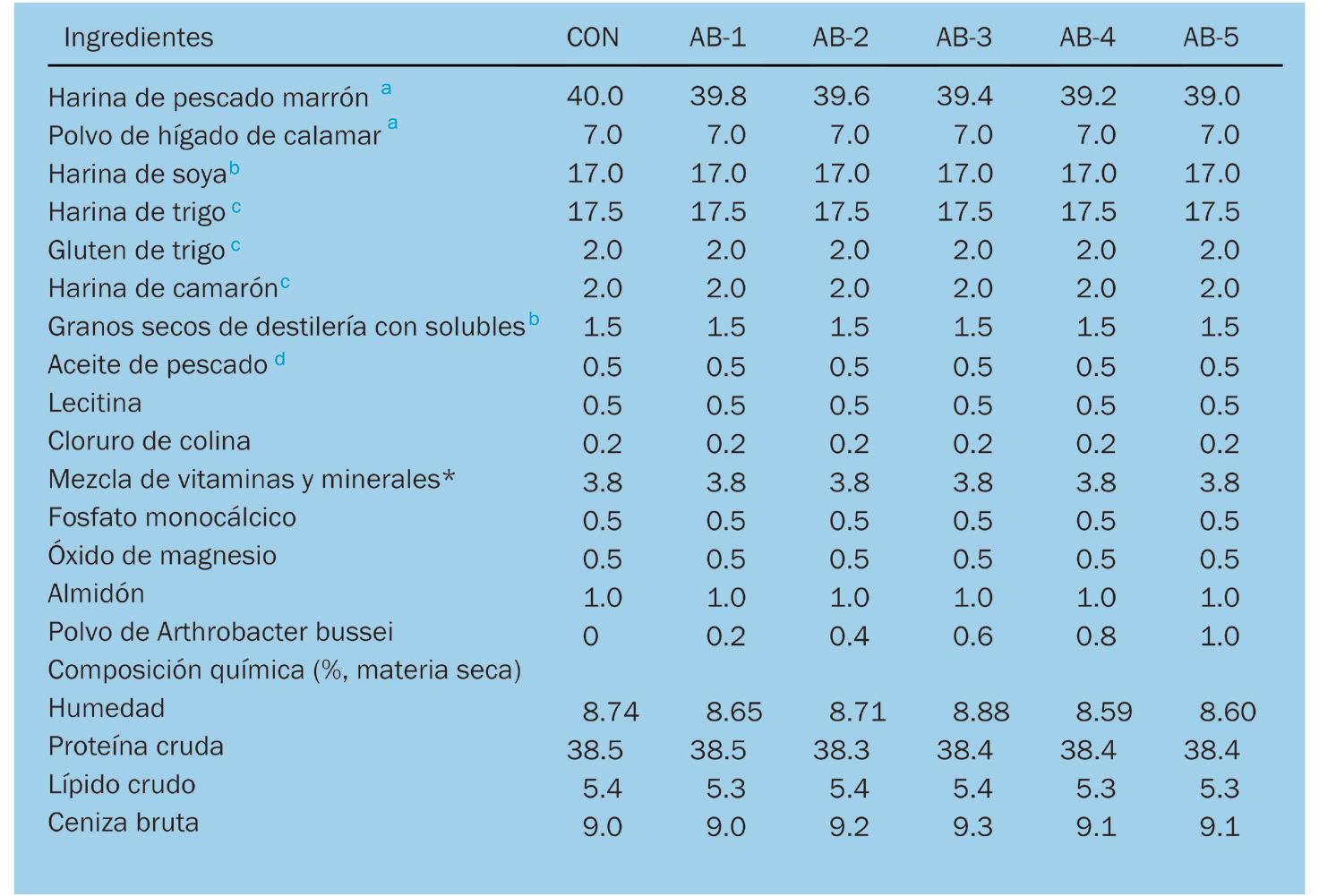
*Contiene (como mg kg—1 en las dietas): Ácido Ascórbico, 300; d-pantotenato de Calcio, 150; Bitartrato de colina, 3000; Inositol, 150; Menadiona, 6; Niacina, 150; Pyridoxine HCl, 15; Rivoflavina, 30; Mononitrato de tiamina, 15; DL-Alfa Tocoferol Acetato, 201; Acetato de Retinilo, 6; Biotina, 1.5; Ácido Fólico, 5.4; Cobalamina, 0.06; NaCl, 437.4; MgSO47H2O, 1379.8; ZnSO4 7H2O, 226,4; Citrato de Fe, 299; MnSO4, 0.016; FeSO4, 0.0378; CuSO4, 0.00033; Yodato de Calcio, 0.0006; MgO, 0.00135; NaSeO3, 0.00025.
aSuministrado por Suhyup feed, Uiryeong, Corea del Sur. bSuministrado por CJ CheilJedang Corporation, Seúl, Corea del Sur. cSuministrado por The feed, Goyang, Corea del Sur. dSuministrado por Ewha Oil& Fat Industial Co., Ltd., Busan, Corea del Sur.
el suero se midieron usando un analizador químico (FujiDRI-CHEM 3500i, Fuji Photo Film, Ltd., Tokio, Japón).
Análisis de composición proximal
El análisis de la composición de proximal se realizó utilizando los métodos estándar de la AOAC (AOAC, 1995). Primero, las muestras se liofilizaron durante 48 h antes del análisis proximal. El contenido de humedad se determinó secando las muestras en estufa a 105°C y el contenido de cenizas por combustión a 550°C. El contenido de proteína bruta se determinó mediante el método Kjeldahl y los niveles de lípidos brutos se analizaron mediante extracción
SoXhlet usando un sistema Tecator 1046
SoXhlet (Tecator AB, Munkedal, Suecia) como se describe por Folch et al. (1957).
Actividad enzimática antioxidante y análisis de inmunidad innata
La actividad de superóxido dismutasa (SOD) se analizó utilizando el kit de ensayo OXiTec SOD (Biomax, Seúl, Corea). La SOD es una enzima antioxidante importante que cataliza la transformación de aniones de peróxido de hidrógeno (especies reactivas de oxígeno [ROS]) generadas durante varios procesos celulares, por ejemplo, radicales libres) en oxígeno y peróxido de hidrógeno, y se utiliza como índice para medir la capacidad de actividad antioxidante. Brevemente, se transfirieron 20 µL de muestras de sangre a 96 microplacas, después de lo cual se añadieron 200 µL de solución enzimática a cada microplaca. A continuación, 20 µL de la solución enzimática se añadió a cada microplaca, se mezcló cuidadosamente y se dejó reaccionar a 37°C durante 20 min. Luego se midió la absorbencia a 450 nm utilizando un lector de microplacas (Thermo Fisher Scientific, Waltham, EE.UU).
- OCTUBRE 2022 60 NUTRICIÓN
La actividad del glutatión peroxidasa sérica (GSH-PX) se analizó utilizando el kit de ensayo OXiTec GSH-PX (Biomax, Seúl, Corea). La GSH-PX actúa como una coenzima para enzimas como la glutatión peroxidasa, la glutatión S-transferasa y la tioltransferasa, y desempeña un papel importante en el metabolismo de fármacos, el metabolismo del calcio, el ciclo del r-glutamil, el mantenimiento de la unión de proteínas, la eliminación de sustancias tóxicas y los radicales libres, eliminación, y funciones de plaquetas y membranas celulares, entre otras. Por lo tanto, los aumentos de ROS en la sangre van acompañados de aumentos en las concentraciones de disulfuro de glutatión (GSSG) y la relación GPX/GSSG. Por lo tanto, la concentración de GSSG y la relación GPX/ GSSG pueden usarse como indicadores del grado de estrés oxidativo en células o tejidos. Después de dispensar 50 µL de cada muestra de suero en una placa de 96 microplacas, se agregaron 50 µL de cromógeno (DTNB) a cada microplaca. Posteriormente, se añadieron 50 µL de enzima (glutatión reductasa) a cada microplaca, se incubó durante 5 min a temperatura ambiente, luego se agregaron 50 µL de NADPH a cada microplaca. Después de dejar que la mezcla reaccionara durante 3 minutos, se midió la absorbencia a 412 nm con un lector de microplacas (Thermo Fisher Scientific, Waltham, EE. UU.).
La actividad de lisozima se analizó utilizando el kit de ensayo de actividad de lisozima (BioVision Inc., Milpitas, CA, EE. UU.). La lisozima es una enzima de respuesta inmunitaria no específica (innata) con propiedades antibacterianas. En concreto, esta enzima hidroliza el enlace β-1,4-glucosídico del peptidoglucano, un componente de la pared celular bacteriana, destruyendo así la pared celular bacteriana. La lisozima es particularmente eficaz contra las bacterias grampositivas. Por lo tanto, la actividad de la lisozima se usa ampliamente como indicador de respuestas inmunitarias no específicas en organismos de cultivo, incluyendo a camarones y peces. La adición de factores de activación inmune como ácido ascórbico, β-glucano y probióticos en los alimentos para camarón se ha relacionado con una mayor actividad de lisozima en la hemolinfa y otros tejidos del camarón, lo que confirma las propiedades inmunoestimuladoras de estos compuestos.
Análisis estadístico
Todos la data se analizó mediante análisis de varianza de una vía (ANOVA), seguido de la prueba de Duncan en SPSS Statistics para Windows, versión 26.0 (IBM Corp., Armonk, NY, EE.UU.). La significación estadística se determinó en P < 0.05. Toda la data se reporta como desviación estándar media. La data porcentual se transformó en arcoseno antes del análisis.
Resultados
Rendimiento del crecimiento y composición del cuerpo entero
La Tabla 2 resume el crecimiento, la eficiencia alimenticia (FE) y la tasa de supervivencia de los camarones experimentales después de la prueba de alimentación de 6 semanas.
Los grupos experimentales (AB-2, AB-3, AB-4 y AB-5) alimentados con polvo de A. bussei mostraron resultados de peso corporal final medio (FBW), aumento de peso (WG), FE y tasa de crecimiento específico (SGR) significativamente más altos que el grupo CON (P < 0.05). El tratamiento con polvo de A. bussei no afectó significativamente la tasa de supervivencia.
La Tabla 3 muestra los resultados de los análisis de la composición proximal del cuerpo entero de los camarones después
de la prueba de alimentación. No se identificaron diferencias significativas en la proteína cruda y lípido crudo entre los grupos experimentales (P > 0.05). El contenido de proteína cruda y lípidos crudos de los camarones fue de 78.04 a 79.99 % y de 2.57 a 3.49 %, respectivamente, lo que concuerda con estudios anteriores (Kim et al., 2021).
Parámetros hematológicos
La Fig. 2 muestra los niveles medios de GOT y GPT de los diferentes camarones experimentales. Los niveles medios de GOT y GPT de los grupos experimentales suplementados con polvo de A. bussei fueron significativamente más bajos que los del grupo CON (P < 0.05).
Actividad enzimática antioxidante e inmunidad innata
La Fig. 3 muestra los resultados del análisis de la actividad enzimática antioxidante (SOD y GSH-PX) y la inmunidad innata (lisozima).
Los grupos experimentales AB-2, AB-3, AB-4 y AB-5 mostraron una actividad SOD significativamente mayor que el grupo CON. Además, todos los grupos experimentales suplementados con polvo de A. bussei mostraron una actividad de lisozima significativamente mayor que el grupo CON (P < 0.05). La actividad de GSH-PX fue
Tabla 2. Desempeño del crecimiento del camarón blanco del Pacífico (Litopenaeus vannamei) alimentado con las seis dietas experimentales durante el período experimental de 6 semanas1.
1Los valores son medias de grupos triplicados de camarones donde los valores en cada fila con diferentes superíndices son significativamente diferentes (P <0.05)). 2Peso corporal inicial (IBW, g).

3Peso corporal final (FBW, g). 4Ganancia de peso (GT, %) = (peso final - peso inicial) × 100/peso inicial.
5Tasa de eficiencia alimenticia (FE, %) = (ganancia de peso húmedo/consumo de alimento seco) × 100. 6Tasa de crecimiento específico (SGR, %/día) = (log peso final – log peso inicial) × 100/días. 7Tasa de supervivencia (%) = (número inicial de camarones – número final de camarones) × 100/ número inicial de camarones.
- OCTUBRE 2022 61 NUTRICIÓN
Tabla 3. Composición proximal del cuerpo entero del camarón blanco del Pacífico (Litopenaeus vannamei) alimentado con las dietas experimentales con polvo SMG de Arthrobacter bussei durante el período experimental de 6 semanas.a

aBase de materia seca. bPolvo SMG Arthrobacter bussei (ABP)
significativamente mayor en el grupo AB-5 que en los grupos CON y AB-2 (P < 0.05).

Discusión
Este estudio evaluó la aplicación de la bacteria roja-rosada A. bussei, rica en bacterioruberina, como suplemento alimenticio en la acuicultura del camarón blanco del Pacífico. La bacteriouberina, un carotenoide de pigmento rojo similar a la astaxantina es un carotenoide C50 que se encuentra en algunas especies de arqueas extremadamente halófilas (Yang et al., 2015). La causa principal del color rojorosado de los lagos hipersalinos, como el Gran Lago Salado (EE.UU.), el lago Urmia (Irán) y el lago Hillier (Australia), es que las halobacterias abundantes en el lago contienen bacterioruberina como principal carotenoide. (Jehlička et al., 2013; Naziri et al., 2014; de la Vega et al., 2016; Ram et al., 2020). La bacteriouberina tiene una estructura molecular bastante diferente de los carotenoides C40 identificados en algas, hongos y plantas, ya que tiene una longitud de cadena de isoprenoide conjugado primario de 13 dobles enlaces conjugados, que contienen cuatro grupos hidroxilo sin conjugación subsidiaria que surge de grupos terminales (de la Vega et al., 2016; Zalazar et al., 2019). Se ha reportado que la bacteriouberina posee fuertes propiedades antioxidantes y actividades anticancerígenas, además de prevenir la enfermedad inflamatoria intestinal, y ha mostrado un gran potencial para aplicaciones médicas (Hou y Cui, 2018; Xie et al., 2021). A pesar de poseer estas diversas ventajas, se ha investigado poco sobre los microorganismos productores de bacterioruberina y el uso de carotenoides derivados de este microorganismo en el campo de la acuicultura debido a la naturaleza de las arqueas que contienen bacterioruberina, que
necesitan altos niveles de salinidad (20– 30 % p/v) para la proliferación (Xie et al., 2021). La salinidad óptima de A. bussei utilizada en este estudio es de 32 ppt, y la cantidad de salinidad necesaria para el cultivo es inferior a la de las arqueas. Además, mientras que las especies de arqueas halófilas tienen un período de cultivo de al menos 1 semana (Kebbouche-Gana et al., 2009), se puede cosechar A. bussei en aproximadamente 24 a 76 h. Es más fácil de producir A. bussei aislada del embalse de Saemangeum que las arqueas halófilas, por lo que se espera que sea aplicable no solo en el campo de la acuicultura, sino también en varios campos, como las industrias médica, alimentaria y ganadera.
El crecimiento y FE del grupo alimentado con la dieta que contenía al menos el polvo de A. bussei al 0.2% mejoró significativamente. Hasta la fecha, se han encontrado resultados de investigación contradictorios en estudios
de camarones que contienen carotenoides en el alimento o en los que el alimento se complementa con microbios que contienen carotenoides. Algunos estudios no han reportado diferencias significativas en el crecimiento de camarones alimentados con aditivos microbianos que contienen carotenoides. Cuando L. vannamei se alimentó durante 25 días con Haematococcus pluvialis (una especie de microalga representativa que contiene el carotenoide astaxantina C40) agregado al alimento, no afectó el crecimiento de L. vannamei (Xie et al., 2018). La adición de β-caroteno y astaxantina al alimento durante 8 semanas no afectó significativamente el crecimiento del camarón (Boonyaratpalin et al., 2001). Por otro lado, algunos estudios mostraron mejoras significativas en el crecimiento y FE entre camarones alimentados con una dieta que contenía carotenoides en comparación con camarones alimentados con una dieta libre de carotenoides (Wade et al., 2017a,
Fig. 2. (A) Actividad de la transaminasa glutamato-oxalacetato (GOT) y (B) Actividad de la transaminasa glutamato-piruvato (GPT) del camarón blanco del Pacífico (Litopenaeus vannamei) alimentado con las dietas experimentales. Los puntos de data representan las medias de tratamiento y las barras de error representan el error estándar de la media (SEM).
- OCTUBRE 2022 62 NUTRICIÓN
2017b). La suplementación dietética con Rhodosporidium paludigenum, una levadura roja que contiene astaxantina, aumentó significativamente el crecimiento y la capacidad antioxidante de L. vannamei (Yang et al., 2010). Tetraselmis sp. y H. pluvialis que contienen carotenoides demostraron ser capaces de reemplazar del 12.5 al 40% de la harina de pescado en el alimento para camarón (Kiron et al., 2012; Ju et al., 2012). Las variaciones en estos resultados pueden haber surgido de la variación en la fuente de carotenoides (microorganismos, algas y plantas) o por el tipo y contenido de carotenoides. En general, en el cultivo de camarón, los microorganismos se complementan con alimentos como probióticos (Zuo et al., 2019). Los efectos positivos de los probióticos incluyen aportes nutricionales, mejor crecimiento y potenciación de FE, y mejora de la inmunidad innata (Wang et al., 2019).
La mejora del rendimiento del crecimiento puede deberse a la capacidad de los probióticos para influir en la digestión mediada por la producción de enzimas (Xie et al., 2019). Xiao et al. (2014) demostraron que cuando Arthrobacter sp. CW9 se inoculó en agua para reproducir L. vannamei y se cultivaba durante 24 días, el crecimiento de L. vannamei mejoró significativamente. Las especies de Arthrobacter tienen la capacidad de producir muchas sustancias valiosas como carotenoides, ácido eicosapentaenoico, aminoácidos, vitaminas, enzimas y ciertos factores de crecimiento y polisacáridos, y tienen muchas propiedades beneficiosas y beneficios nutricionales que los convierten en probióticos ideales en la acuicultura (Abrashev et al., 1998; Li et al., 2006; Karthik et al., 2015). Por lo tanto, el efecto de mejora del crecimiento asociado con A. bussei puede deberse a los carotenoides y sustancias fisiológicamente activas que produce esta especie. En este estudio, no se encontraron diferencias significativas en la composición corporal total de camarones alimentados con dietas que contenían diferentes niveles de A. bussei Aunque se supone que A. bussei no tiene un efecto directo en todo el cuerpo sobre los componentes del camarón, se considera necesario separar los análisis de músculo, cuerpo entero y sangre para optimizar la validez experimental.
Fig. 3. (A) Actividad de superóxido dismutasa (SOD), (B) lisozima (LYZ) y (C) Actividad del glutatión peroxidasa (GSH-PX) del camarón blanco del Pacífico (Litopenaeus vannamei) alimentado con las dietas experimentales. Los puntos de data y las barras de error representan las medias y el error estándar de la media (SEM), respectivamente.
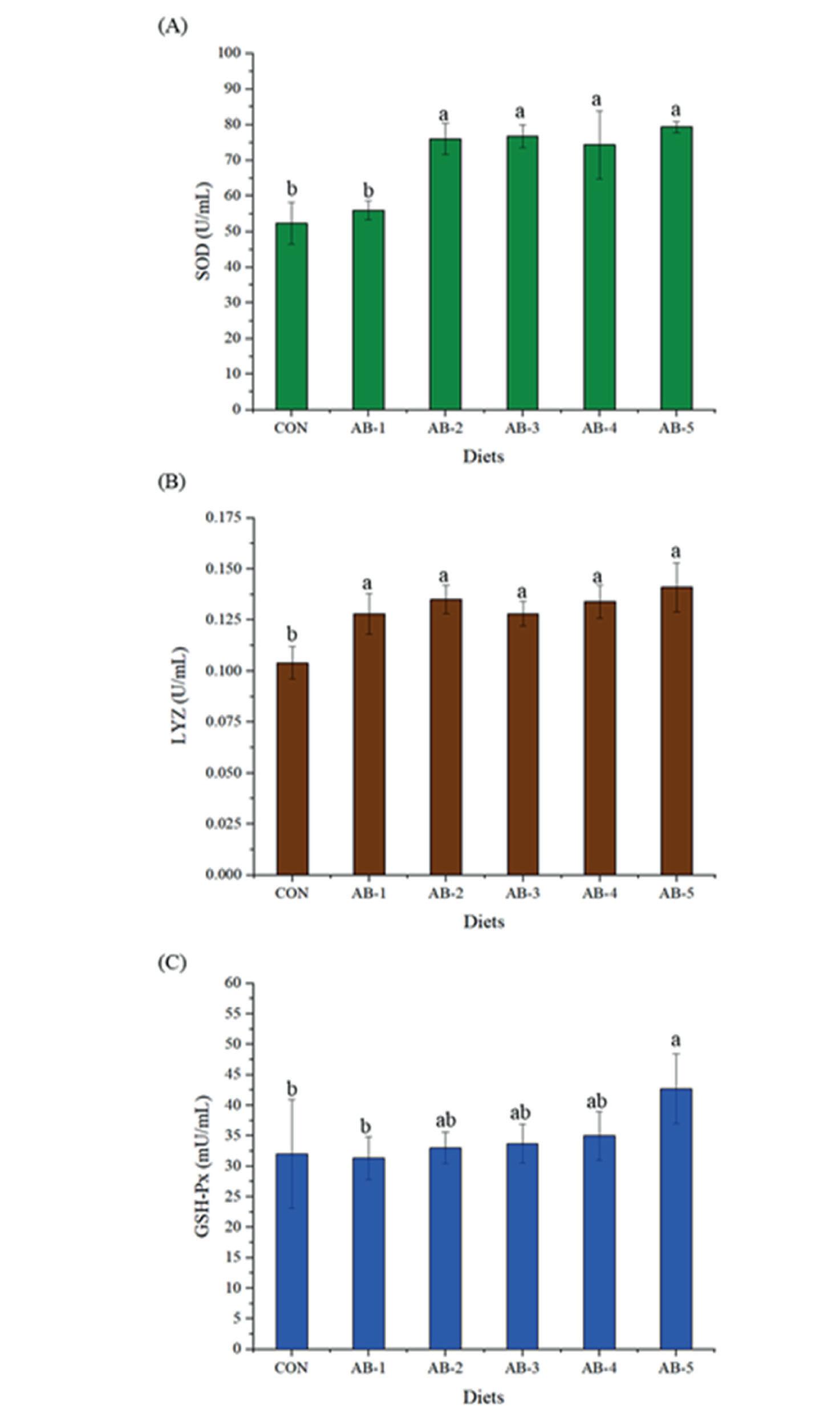
- OCTUBRE 2022 63 NUTRICIÓN
En animales acuáticos, el GOT y GPT se utilizan como indicadores que reflejan el estado fisiológico del hígado y los hepatocitos (Pan et al., 2003). Se observan niveles relativamente bajos de GOT y GPT en la hemolinfa en condiciones normales (Cheng y Wu, 2019). De manera similar, se ha demostrado que el aumento del contenido de astaxantina en el alimento para P. monodon mejora la resistencia al estrés por amoníaco en los camarones, y se reportó que los niveles bajos de GOT y GPT reflejan mejoras asociadas con la astaxantina en la función hepatopancreática de los camarones (Pan et al., 2003). Además, Yu et al. (2020) alimentaron con flóculos microbianos a Opsariichthys kaopingensis durante 30 días y encontraron que esto estaba asociado con niveles significativamente reducidos de GPT. Atribuyeron esta disminución gradual de GPT al beneficio del huésped a través de los metabolitos secundarios de los probióticos, mejorando la inmunidad y aumentando la resistencia a las enfermedades (Yu et al., 2020). En este estudio, se demostró por primera vez que el suplemento de polvo de A. bussei en el alimento afecta la función hepatopancreática y aumenta el potencial protector contra el estrés oxidativo en L. vannamei.
La lisozima también es un componente importante del sistema inmunitario innato que protege a los organismos de la invasión de patógenos (Fawzy et al., 2022). En este estudio, la actividad de la lisozima aumentó significativamente con el aumento de los niveles de A. bussei en la dieta, lo que indica un efecto positivo de A. bussei en la dieta sobre la inmunidad de L. vannamei De manera similar, la expresión del gen de la lisozima hepatopancreática fue significativamente mayor en los camarones alimentados con polvo de H. pluvialis que en el grupo CON (Yu et al., 2021). Amar et al. (2004) demostraron que la alimentación de truchas arcoíris con D. salina durante 9 semanas se asoció con un aumento significativo de la actividad de la lisozima sérica. Esto indica que los microorganismos que contienen carotenoides rojos pueden ser inmunoestimulantes de L. vannamei La salud de los animales acuáticos está relacionada con la sobreproducción de ROS, y los antioxidantes protegen las membranas celulares de la producción de radicales
libres (Liu et al., 2007). Por lo tanto, el metabolismo normal depende de la tasa de producción de radicales libres y la actividad de los factores protectores peroxidativos de lípidos (Liu et al., 2007). La SOD y GSH-PX son las principales enzimas antioxidantes en organismos que desempeñan funciones importantes en la eliminación de ROS (Yu et al., 2021). Este estudio encontró que la SOD y GSH-PX aumentaron a medida que aumentaba el nivel de polvo de A. bussei en el alimento. La bacteriouberina se considera un poderoso antioxidante debido a su estructura química única (Yu et al., 2021). Debido a la existencia de un sistema conjugado largo con 13 dobles enlaces conjugados, la capacidad antioxidante de la bacterioruberina es mayor que la del β-caroteno, que tiene solo 11 dobles enlaces conjugados (Jehlička et al., 2013; de la Vega et al., 2016). Cuando se suministran bacterias del género Halorubrum, que contienen bacterioruberina, a L. vannamei, la actividad inhibidora de la eliminación de radicales libres es particularmente pronunciada (Xie et al., 2021). Por lo tanto, se considera que la bacterioruberina es el componente central del mecanismo subyacente a la función antioxidante que mejora a medida que aumenta el contenido de polvo de A. bussei en el alimento de L. vannnamei.
Conclusiones
Colectivamente, nuestros hallazgos sugirieron que el polvo de A. bussei puede mejorar la tasa de crecimiento, FE, salud, capacidad antioxidante e inmunidad no específica de L. vannamei. En particular, la alta función antioxidante de la bacterioruberina que contiene A. bussei se considera un factor importante que contribuye a este efecto positivo. Para comprender con precisión el mecanismo subyacente a los efectos beneficiosos de la bacterioruberina en los camarones, es necesario investigar la producción de enzimas digestivas y la expresión de genes relacionados con los antioxidantes por parte de los microorganismos. Recomendamos la suplementación dietética con polvo de A. bussei de al menos 0.2% para el camarón blanco del Pacífico•
Referencias
Abrashev, I.R., Genova, V.E., Sotirova, A.V., Ilieva, K.Z., 1998. Purification and partial characterization of neuraminidase from the non-pathogenic Arthrobacter nicotianae. Enzyme Microb. Technol. 22 (3), 142–146. https://doi.org/10.1016/S01410229 (97)00107-5. Alloul, A., Wille, M., Lucenti, P., Bossier, P., Van Stappen, G., Vlaeminck, S.E., 2021. Purple bacteria as added-value protein ingredient in shrimp feed: Penaeus vannamei growth performance, and tolerance against Vibrio and ammonia stress. Aquaculture 530, 735788. https:// doi.org/10.1016/j.aquaculture.2020.735788. Amar, E.C., Kiron, V., Satoh, S., Watanabe, T., 2004. Enhancement of innate immunity in rainbow trout (Oncorhynchus mykiss Walbaum) associated with dietary intake of carotenoids from natural products. Fish Shellfish Immunol. 16 (4), 527–537. https:// doi.org/10.1016/j.fsi.2003.09.004. AOAC, 1995.
Official Methods of Analysis, 16th ed. Association of Official Analytical Chemists, Arlington, Virginia. Ayiku, S., Shen, J.F., Tan, B.P., Dong, X.H., Liu, H.Y., 2020. Effects of dietary yeast culture on shrimp growth, immune response, intestinal health and disease resistance against Vibrio harveyi. Fish Shellfish Immunol. 102, 286–295. https://doi. org/ 10.1016/j.fsi.2020.04.036. Boonyaratpalin, M., Thongrod, S., Supamattaya, K., Britton, G., Schlipalius, L.E., 2001. Effects of β-carotene source, Dunaliella salina, and astaxanthin on pigmentation, growth, survival and health of Penaeus monodon Aquac. Res. 32, 182–190. https:// doi. org/10.1046/j.1355-557x.2001.00039.x. Cheng, Y., Wu, S., 2019. Effect of dietary astaxanthin on the growth performance and nonspecific immunity of red swamp crayfish Procambarus clarkii. Aquaculture 512, 734341. https://doi.org/10.1016/j.aquaculture.2019.734341. Del Campo, J.A., GarcíaGonz´alez, M., Guerrero, M.G., 2007. Outdoor cultivation of microalgae for carotenoid production: current state and perspectives. Appl. Microbiol. Biotechnol. 74 (6), 1163–1174. https://doi. org/10.1007/s00253-007- 0844-9. Delgado, E., Valles-Rosales, D.J., Flores, N.C., Reyes-J´aquez, D., 2021. Evaluation of fish oil content and cottonseed meal with ultralow gossypol content on the functional properties of an extruded shrimp feed. Aquac. Rep. 19, 100588 https://doi.org/ 10.1016/j.aqrep.2021.100588. Fawzy, S., Wang, W., Zhou, Y., Xue, Y., Yi, G., Wu, M., Huang, X., 2022. Can dietary β-carotene supplementation provide an alternative to astaxanthin on the performance of growth, pigmentation, biochemical, and immunophysiological parameters of Litopenaeus vannamei? Aquac. Rep. 23, 101054 https://doi.org/ 10.1016/j. aqrep.2022.101054. Flegler, A., Runzheimer, K., Kombeitz, V., M¨anz, A.T., von Heilborn, D.H., Etzbach, L., Schieber, A., H¨olzl, G., Hüttel, B., Woehle, C., Lipski, A., 2020. Arthrobacter bussei sp. nov., a pink-coloured organism isolated from cheese made of cow’s milk. Int. J. Syst. Evolut. Microbiol. 70 (5), 3027–3036. https://doi.org/10.1099/ ijsem.0.004125.
Más referencias bibliográficas: https://bit. ly/3C2QUuz
- OCTUBRE 2022 64 NUTRICIÓN


Sustitución parcial de alimentos frescos congelados por una dieta experimental en reproductores de Litopenaeus vannamei (Boone, 1931) (Decapoda: Dendrobranchiata: Penaeidae)
Autores:
Sara Ortiz-Guill´ en a, b Eden Magan ˜ a-Gallegos c Miguel Ar´ evalo d Gerard Cuzon d , Gabriela Gaxiola d,*
a Av. Ciudad Universitaria 3000, C.P., Coyoacán, 04510 Ciudad de México, México
b Posgrado de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, C.P., Coyoacán, 04510 Ciudad de México, México
c Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, Prolongación Avenida Niños Héroes S/N, Puerto Morelos, Quintana Roo 77580, México
d Unidad Multidisciplinaria de Docencia e Investigación de Sisal, Facultad de Ciencias, Universidad Nacional Autónoma de México, Yucatán, México
mggc@ciencias.unam.mx (G. Gaxiola). https://doi.org/10.1016/j.anireprosci.2022.107001
Hace
casi dos décadas, la norma en los laboratorios de camarón era utilizar alimentos frescos congelados, en más del 84% de los laboratorios en el hemisferio occidental y el 100 % de los laboratorios en Asia (Wouters et al., 2002). Esta tendencia continúa actualmente y se ha avanzado poco en la sustitución de alimentos vivos o procesados en las últimas décadas (Chimsung, 2014; Du et al., 2004; Ghorbani-Vaghei et al., 2017; Tacon, 2017; Wouters et al., 2002). Esto podría deberse a la relativa facilidad con la que se pueden comprar alimentos vivos o frescos y al escaso éxito de las formulaciones para reproductores.
En los laboratorios, los alimentos frescos como calamares, mejillones, poliquetos y biomasa de Artemia son los principales componentes de la dieta de los reproductores (Maneii et al., 2019; Tacon, 2017). Se eligieron estos alimentos porque tienen un alto contenido de proteínas, lípidos, ácidos grasos, colesterol y otros nutrientes y se ha demostrado que aumentan la maduración y la reproducción del camarón (Wouters et al., 2001). Por otro lado, las desventajas de los alimentos frescos incluyen los altos costos, la necesidad de almacenamiento en congelador, presencia de fouling en el agua, calidad nutricional inconsistente y mayor riesgo de transmisión de

NUTRICIÓN
bacterias y virus patógenos (Chimsung, 2014; Maneii et al., 2019; Wouters et al., 2002). Como resultado, su reemplazo y el desarrollo de dietas artificiales para reproductores deberían ser una prioridad de investigación.
Algunos estudios muestran que las dietas artificiales experimentales se pueden usar para complementar alimentos frescos congelados sin afectar el rendimiento de los reproductores o la calidad de la descendencia (Arshadi et al., 2018; Chimsung, 2014; Du et al., 2004; Wouters et al., 2002). Sin embargo, estos estudios siguen basándose en los dos alimentos más caros, poliquetos y biomasa de Artemia, porque se consideran esenciales.
Por lo tanto, el objetivo de este estudio fue evaluar una dieta experimental y su sustitución parcial o total por alimentos frescos congelados. Del mismo modo, se esperaba que esta dieta experimental sustituyera a los alimentos frescos más caros, la biomasa de Artemia y los poliquetos.
Materiales y métodos Enfoque ético
El Comité de Ética Académica y Responsabilidad Científica (CEARC) de la Facultad de Ciencias de la UNAM aprobó todos los protocolos del estudio (2022_03_31). La investigación se realizó de acuerdo con los principios de la Declaración de Basilea y las recomendaciones del Comité para la Actualización de la Guía para el Cuidado y Uso de Animales de Laboratorio (Consejo Nacional de Investigación, 2011).
Origen del stock y cultivo Se donaron 15 postlarvas de Litopenaeus vannamei a la UMDI Sisal (FC-UNAM ubicada en Playa Sisal 21°09′5 N y 90°02′5 W, Yucatán, México) de la finca La Marca, en febrero de 2010.
Los organismos se cultivaron en ocho tanques circulares externos, cada uno con una capacidad de 20,000 L en sistemas de biofloc, con aireación constante proporcionada por un aireador de 5hp. La producción de reproductores de L. vannamei se realizó de acuerdo con Magaña-Gallegos et al. (2021). El sistema de biofloc en los tanques se manejó utilizando la metodología establecida para la fase de “engorde” descrita por Magaña-Gallegos et al. (2021).
Los camarones se eligieron para el área de reproductores al final de la fase de premaduración (Magaña-Gallegos et al., 2021) en función de su tamaño (~30 g), falta de melanización corporal, presencia de todos los apéndices, y hepatopáncreas completo y estructura intestinal (Braga et al., 2015).
Tratamientos dietéticos
Se evaluaron tres tratamientos dietéticos. El primer tratamiento dietético, denominado “FF”, consistió en un régimen de alimentación compuesto únicamente por alimentos frescos congelados que contenían calamares, poliquetos, mejillones y biomasa de Artemia. El alimento en el tratamiento FF se distribuyó al 20% de la biomasa total
(peso húmedo) de cada tanque en una proporción 1:1:1:1 de calamar, poliqueto, mejillón y biomasa de Artemia (Emerenciano et al., 2013; Nascimento et al., 1991). El segundo tratamiento dietético denominado “ED” fue 100% una dieta experimental artificial (en adelante dieta experimental).
La alimentación para el tratamiento de ED consistió en 5% de la biomasa de cada tanque (peso seco) (Nascimento et al., 1991). El tercer tratamiento dietético denominado “DM” consistió en una dieta mixta de alimentos frescos congelados y la dieta experimental (Nascimento et al., 1991). En el tratamiento MD sólo se utilizaron calamares y mejillones al 10% de la biomasa de cada tanque (peso húmedo), mientras
Tabla 1: Ingredientes y composición de la dieta experimental suministrada a reproductores de Litopenaeus vannamei durante 40 días.
Ingredientes
g/kg Harina de calamara 50 Suero de lecheb 120 Harina de pescadoc 300 Proteína de soya concentrada 100 Levadura de cerveza 50 Ensilado de residuos de pescadoe 100
Aceite de hígado de bacalaof 40 Colesterol 5
Lecitina de soyaf 20 Mezcla de Aminoácidosg + grenetinah 24 Pre-miXi de vitaminas y minerales DSMi 25 Carofila 0.1
Harina de trigoj 156 Carboximetilcelulosab 10 Composición proximal Proteína cruda 511 Lípidos 144
a Harina de calamar (Loligungula brevis del Golfo de México)
b MaltaCleyton S.A. de C.V. Yucatán, MX.
c Proteínas Marinas y Agropecuarias S.A. de C.V. Jalisco, MX.
d Vimifos, S.A. de C.V. Jalisco, MX.
e Descartes de Epinephelus morio.
f Proteínas y Oleicos S.A. de C.V., Mérida, Yucatán, México.
g LYS, THR, LEU, TRP, Future Foods.
h Productora de Alimentos Mexicanos, S.A. de C.V. Mérida, Yucatán, México
i DMS (peces tropicales), Productos Nutricionales México S.A. de C. V. Composición: vitamina A, vitamina D3, vitamina E, vitamina K3, vitamina B1, vitamina B2, vitamina B12, ácido fólico, vitamina B6, ácido pantoténico, niacina , biotina, colina, vitamina C, hierro, manganeso, sodio, cobre, yodo, zinc, cobalto, selenio, molibdeno, calcio, fósforo, magnesio, sodio, potasio, carofila, lisina, treonina, carbonato de calcio, metionina, triptófano , lasolacid sódico, monensina, tilosina, salinomicina, avoparcina, flavomicina arsanilico, amprolio, bacitracina de zinc, virginiamicina, propinato de calcio, ácido silícico, lignosulfonato, lecitina, BHT, BHA, probióticos, glutasa keta, lipasa, proteasas, amilasas, celulasas y acemita.
j Gluten y Almidones de México, S.A de CV.
- OCTUBRE 2022 68 NUTRICIÓN
Fig. 1. Análisis de componentes principales (PCA) realizado en los perfiles de ácidos grasos de varias dietas suministradas a reproductores de Litopenaeus vannamei durante 40 días: poliquetos, calamar, biomasa de Artemia, mejillón y dieta experimental. (a) Biplot del PCA. (b) Contribución de los alimen tos al componente principal (PC) 1 y 2.

que la dieta experimental se proporcionó al 2.5% de la biomasa de cada tanque (peso seco) (Nascimento et al., 1991). Para la dieta experimental, todos los ingredientes secos se tamizaron con un tamiz de 250 µm y se mezclaron durante 20 min. Los aminoácidos se encapsularon en gelatina disuelta en agua a 45°C, se enfrió a 4°C y se agregó a la mezcla (Cho, Kaushik y Woodward, 1992; Cuzon, 2010, comunicación personal). Luego, se añadieron aceites y carboximetilcelulosa y se mezclaron durante 15 min para formar la masa que se pasa a través de una picadora de carne para extruirla. Las hebras de 5 mm de diámetro se secaron a 60°C durante 8h y se mantuvieron a - 20°C hasta su uso.
Cuatro veces al día, se alimentaron a los reproductores. Se administró biomasa de Artemia para el tratamiento FF y la dieta experimental para el tratamiento MD a las 0100 h. El calamar fue proporcionado a las 0800 h. para los tratamientos FF y MD. Los poliquetos para el tratamiento FF y la dieta experimental para el tratamiento MD se administraron a las 1400 h. El mejillón se administró a las 2000 h para los tratamientos FF y MD. La dieta experimental se consumió en todo momento durante el tratamiento de ED.
Diseño experimental y manejo de reproductores
El experimento tuvo una duración de 40 días y se impusieron tres tratamientos: FF, ED y MD. Se utilizaron grupos de 20 hembras y 30 machos por tratamiento (proporción hembra a macho, 1:1.5; ~30 g; densidad
3.98 camarones/m2). Los especímenes se cultivaron en seis tanques redondos de maduración alineados (dos tanques por tratamiento; Emerenciano et al., 2013; Nakayama et al., 2008), cada uno de 4.0 m de diámetro y 40 cm de altura. Todos los tanques estaban conectados a un sistema de recirculación de agua con un enfriador Delta Star DSHP-9 (Aqualogic, San Diego, CA, EE.UU.) para control de temperatura y aireación continua. El fotoperiodo fue de 12 L:12D. La tasa de recambio de agua semanal se fijó al 100% y los parámetros del agua de mar (SD ± media) fueron 28 ± 1°C, 35 g/L de salinidad, 8.1 ± 0.1 pH y 6.1 ± 0.2 mg/L de oxígeno disuelto.
Las hembras fueron marcadas individualmente, se realizó la ablación del pedúnculo ocular y se monitorearon los parámetros de evaluación relacionados con el desempeño de los reproductores y la calidad de la descendencia utilizando la metodología descrita por MagañaGallegos et al. (2021). Se seleccionaron hembras con ovarios completamente maduros y espermatóforo (Corral-Rosales et al., 2018) mediante observación directa de las gónadas a las 7:30 p.m. A lo largo del experimento, las hembras con ovarios maduros fueron transferidas a tanques de desove individuales de 100 L utilizando los procedimientos descritos por Emerenciano et al. (2021) y Magaña-Gallegos et al. (2021). Las hembras se devolvieron a sus tanques de maduración despues del desove.
Rendimiento reproductivo y régimen de
Referencias
Arshadi, A., Yavari, V., Oujifard, A., Mousavi, S.M., Gisbert, E., Mozanzadeh, M.T., 2018. Dietary nucleotide mixture effects on reproductive and performance, ovary fatty acid profile and biochemical parameters of female Pacific shrimp Litopenaeus vannamei. Aquac. Nutr. 24, 515–523. https:// doi.org/10.1111/anu.12584. Braga, A., Lopes, D.L.A., Magalh˜aes, V., Poersch, L.H., Wasielesky, W., 2015. Use of biofloc technology during the pre-maturation period of Litopenaeus vannamei males: effect of feeds with different protein levels on the spermatophore and sperm quality. Aquac. Res. 46, 1965–1973. https://doi.org/10.1111/are.12352. Chimsung, N., 2014. Maturation diets for black tiger shrimp (Penaeus monodon) broodstock: a review. Songklanakarin. J. Sci. Technol. 36, 265–273. Cho, C.Y., Kaushik, S., Woodward, B., 1992. Dietary arginine requirement of young rainbow trout (Oncorhynchus mykiss). Comp. Biochem. Physiol. Part A Physiol. 102, 211–216. Corral-Rosales, D.C., Cruz-Su´arez, L.E., Ricque-Marie, D., Rodríguez-Jaramillo, C., Palacios, E., 2018. Modulation of reproductive exhaustion using Ulva clathrata in Pacific white shrimp Litopenaeus vannamei (Boone, 1931) broodstock during commercial maturation. Aquac. Res. 49, 3711–3722. https://doi.org/10.1111/ are.13839. Du, S., Hu, C., Shen, Q., 2004. Replacement of a natural diet by a prepared dry feed for successful maturation and spawning of female Litopenaeus vannamei (Boone) broodstock. J. World Aquac. Soc. 35, 518–522. https://doi. org/10.1111/j.1749-7345.2004.tb00118.x. Emerenciano, M., Cuzon, G., Arevalo, M., Mascaro, M., Gaxiola, G., 2013. Effect of short-term fresh food supplementation on reproductive performance, biochemical composition, and fatty acid profile of Litopenaeus vannamei (Boone) reared under biofloc conditions. Aquac. Int. 21, 987–1007. https://doi. org/10.1007/s10499- 012-9607-4. Emerenciano, M., Cuzon, G., Mascaro, M., Arevalo, M., Nore˜na-Barroso, E., Jer´onimo, G., Racotta, I., Gaxiola, G., 2012. Reproductive performance, biochemical composition and fatty acid profile of wild-caught and 2nd generation domesticated Farfantepenaeus duorarum (Burkenroad, 1939) broodstock. Aquaculture 344–349, 194–204. https://doi.org/10.1016/j.aquaculture.2012.03.014. Ghorbani-Vaghei, R., Abolhasani, M.H., Matinfar, A., Dadgar, S., Ghorbani, R., 2017. Production of artificial diets for female broodstock of western white shrimp (Litopenaeus vannamei) and study on their singular effect. Iran. J. Fish. Sci. 16, 1204–1213. Hoa, N.D., Wouters, R., Wille, M., Thanh, V., Dong, T.K., Van Hao, N., Sorgeloos, P., 2009. A fresh-food maturation diet with an adequate HUFA composition for broodstock nutrition studies in black tiger shrimp Penaeus monodon (Fabricius, 1798). Aquaculture 297, 116–121. https://doi. org/10.1016/j. aquaculture.2009.09.005. Kassambara, A., Mundt, F., 2017. Package ‘factoextra’. Extr. Vis. Results Multivar. data Anal. 76. Lˆe, S., Josse, J., Husson, F., 2008. FactoMineR: an R package for multivariate analysis. J. Stat. Softw. 25, 1–18. Leung-Trujillo, J.R., Lawrence, A.L., 1987. Observations on the decline in sperm quality of Penaeus setiferus under laboratory conditions. Aquaculture 65, 363–370. https://doi.org/10.1016/0044-8486(87)90249-3. Liao, Y.-Y., Lee, T.-S., Lin, Y.-M, 2006. A Fisher exact test will be more proper. Radiology 239, 300–301. https://doi.org/10.1148/ radiol.2391051114. Maga˜na-Gallegos, E., Ar´evalo, M.,
- OCTUBRE 2022 69 NUTRICIÓN
Tabla 2.- Peso, supervivencia y desempeño reproductivo de hembras (media ± SE) recolectados du rante un período experimental de 40 días de reproductores de Litopenaeus vannamei con tres trata mientos dietéticos. FF = Alimento fresco (poliquetos, calamar, biomasa de Artemia, mejillón), ED= Dieta experimental, MD = Alimento fresco más dieta experimental. La columna a la derecha de cada tratamiento indica el número de organismos o muestras (n).
† Chi-cuadrado, ‡ Prueba exacta de Fisher, § ANOVA unidireccional, ¶ Prueba T (FF vs FF + ED). Las diferencias significativas (P < 0.05) se indican mediante letras en superíndice dentro de las filas.
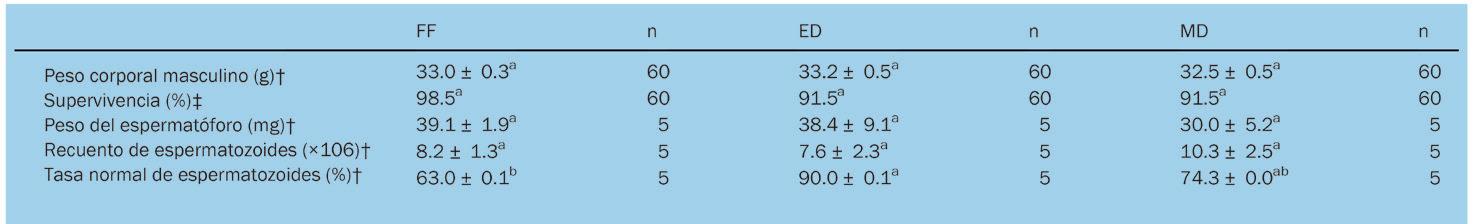
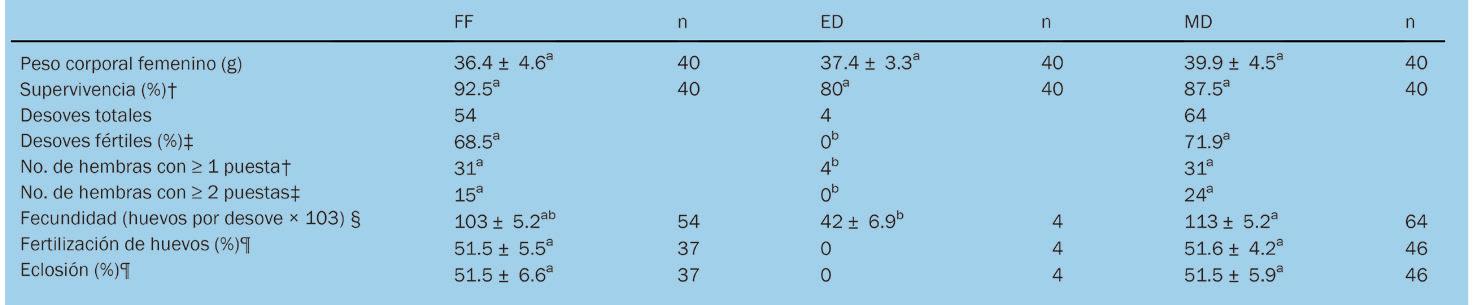
Tabla 3. Parámetros morfométricos, supervivencia, calidad espermática y espermatóforo (media ± SE) de machos de Litopenaeus vannamei al final del experimento de 40 días alimentados con diferen tes regímenes dietéticos. FF = Alimento fresco (poliquetos, calamar, biomasa de Artemia, mejillón), ED= Dieta experimental, MD = Alimento fresco más dieta experimental. La columna a la derecha de cada tratamiento indica el número de organismos o muestras (n).
† ANOVA de una vía. ‡Prueba exacta de Fisher. Las diferencias significativas (P < 0.05) se indican mediante letras en superíndice dentro de las filas.
muestreo
El desempeño reproductivo se evaluó con los siguientes parámetros: número de desoves por hembra (desoves sucesivos), eficiencia de desove, huevos totales en relación con la cantidad de huevos por hembra, número de huevos fertilizados en relación con el número total de huevos desovados, tasa de eclosión en relación con el total de huevos desovados.
Se utilizaron cinco réplicas de 4.7 mL colectadas de los tanques de desove para estimar el número de huevos por hembra (Emerenciano et al., 2013; Magaña-Gallegos et al., 2021). Los huevos se transfirieron a un tanque de incubación y los nauplios se estimaron utilizando cinco réplicas de 4.7 mL de cada tanque.
Para los machos, se evaluó el espermatóforo y la calidad del esperma (n = 5 por tratamiento). Ambos espermatóforos se extruyeron manualmente (Nakayama et al., 2008), pero solo se eligió y pesó uno. El espermatóforo se homogeneizó en una solución salina libre de calcio (Leung-Trujillo y Lawrence, 1987).
Posteriormente se añadió 0.1 mL de azul tripán (Braga et al., 2015). Después de 10 min, el sobrenadante se decantó en un tubo Eppendorf nuevo (Leung-Trujillo y Lawrence, 1987). Se utilizó una cámara Newbauer y un microscopio óptico para contar y clasificar las células. Los espermatozoides teñidos de azul se clasificaron como muertos, mientras que los espermatozoides con malformaciones del cuerpo principal y/o de la punta (rotos, torcidos o ausentes) se clasificaron como anormales (Leung-Trujillo y Lawrence, 1987).
Análisis de fuente de nutrientes
Según nuestro reporte anterior (MagañaGallegos et al., 2021) se determinó el perfil de ácidos grasos (AG) en los alimentos frescos congelados y dieta experimental utilizando cromatografía de gases en un Perkin Elmer Clarus 500 GC (Perkin Elmer Inc., Shelton, CT, EE.UU.) equipado con una columna capilar Perkin Elmer Elite-WAX (30 m X 0.25 mm X 0.25 μm de espesor de película, polietilenglicol de enlaces cruzados) y un detector de ionización de llama.
Cuzon, G., Gaxiola, G., 2021. Effects of using the biofloc system and eyestalk ablation on reproductive performance and egg quality of Litopenaeus vannamei (Boone, 1931)(Decapoda: Dendrobranchiata: Penaeidae). Anim. Reprod. Sci. 228, 106749 https://doi.org/10.1016/j. anireprosci.2021.106749. Maga˜na-Gallegos, E., Gonz´alez-Zú˜niga, R., Cuzon, G., Arevalo, M., Pacheco, E., Valenzuela, M.A.J., Gaxiola, G., Chan-Vivas, E., L´opez-Aguiar, K., Nore˜na-Barroso, E., 2018. Nutritional contribution of biofloc within the diet of growout and broodstock of Litopenaeus vannamei, determined by stable isotopes and fatty acids. J. World Aquac. Soc. 49, 919–932. https://doi.org/10.1111/jwas.12513. Maneii, K., Oujifard, A., Ghasemi, A., Mozanzadeh, M.T., 2019. Reproductive performance and vitellogenin mRNA transcript abundance in the hepatopancreas of female Litopenaeus vannamei fed diets with different soy lecithin content. Anim. Reprod. Sci. 211, 106228 https://doi.org/10.1016/j.anireprosci.2019.106228. Mead, R., Curnow, R.N., Hasted, A.M., 2017. Statistical methods in agriculture and experimental biology. Chapman and Hall/ CRC. Nakayama, C.L., Peixoto, S., Bianchini, A., Robaldo, R.B., Cavalli, R.O., 2008. Performance of Farfantepenaeus paulensis (P´erez-Farfante, 1967) broodstock in tanks with sand and hard substrate. Aquac. Res. 39, 398–405. https://doi. org/10.1111/j.1365-2109.2007.01800.x. Nascimento, I.A., Bray, W.A., Trujillo, J.R.L., Lawrence, A., 1991. Reproduction of ablated and unablated Penaeus schmitti in captivity using diets consisting of fresh-frozen natural and dried formulated feeds. Aquaculture 99, 387–398. https://doi.org/10.1016/00448486(91)90257-8. National Research Council, 2011. Guide for the Care and Use of Laboratory Animals: Eighth Edition. The National Academies Press, Washington. https://doi.org/ 10.17226/12910. Palacios, E., Racotta, I.S., 2003. Effect of number of spawns on the resulting spawn quality of 1–yearold pond-reared Penaeus vannamei (Boone) broodstock. Aquac. Res. 34, 427–435. https://doi.org/10.1046/j.13652109.2003.00826.x. RStudio Team, 2021. RStudio: Integrated Development Environment for R. 1.4.1717. RStudio Integr. Dev. Environ. R. R Core Team, 2021. R: A language and environment for statistical computing (Version 4.1. 0). R Found. Stat. Comput. Vienna, Austria. Tacon, A.G.J., 2017. Biosecure shrimp feeds and feeding practices: guidelines for future development. J. World Aquac. Soc. 48, 381–392. https://doi. org/10.1111/ jwas.12406. Wouters, R., Lavens, P., Nieto, J., Sorgeloos, P., 2001. Penaeid shrimp broodstock nutrition: An updated review on research and development. Aquaculture 202, 1–21. https://doi.org/10.1016/S0044-8486(01)005701. Wouters, R., Zambrano, B., Espin, M., Calderon, J., Lavens, P., Sorgeloos, P., 2002. Experimental broodstock diets as partial fresh food substitutes in white shrimp Litopenaeus vannamei B. Aquac. Nutr. 8, 249–256. https://doi.org/10.1046/j.13652095.2002.00213.x. Zar, J.H., 1999. Biostatistical analysis, 4th ed. Prentice Hall. Zuur, A.F., Ieno, E.N., Smith, G.M., 2007. Analysing Ecological Data, Profiles of drug substances, excipients, and related methodology. Springer Press, New York. https://doi.org/10.1016/B978-0-12-387667-6.00013-0.
- OCTUBRE 2022 70 NUTRICIÓN
Análisis estadístico
La tasa de supervivencia de hembras y el número de hembras con ≥ 1 desove se analizó mediante una prueba de chi-cuadrado para evaluar la independencia de la proporción entre estas variables y tratamientos (Mead et al., 2017). Dado que los números esperados eran menos de cinco para algunas células de los desoves fértiles, el número de hembras con ≥ 2 desoves y la supervivencia de los machos, realizamos la prueba exacta de Fisher, que es más apropiada que la chicuadrado (Liao et al., 2006). La fecundidad, el peso de los espermatóforos, el conteo de espermatozoides y la tasa normal de espermatozoides se analizaron con un ANOVA de una vía. La fertilización del huevo y la eclosión se analizaron con una prueba T; el tratamiento ED siempre fue cero. Antes del análisis, toda la data porcentual se convirtió a la raíz cuadrada del arcoseno (Zar, 1999). La prueba de Levene demostró homogeneidad de varianza, mientras que la prueba de Shapiro-o-Wilk confirmó la normalidad.
El análisis de las fuentes alimenticias en relación con sus ácidos grasos se analizó con un análisis de componentes principales (PCA). El objetivo de utilizar el PCA fue caracterizar las fuentes de alimentos en relación con sus ácidos grasos (MagañaGallegos et al., 2018).
El biplot PCA representa la ordenación de las fuentes de alimentos, que están representadas por flechas (Zuur et al., 2007). Todo el análisis estadístico se realizó con R (R Core Team, 2021) y Rstudio (RStudio Team, 2021), y el PCA se realizó con los paquetes factoMineR y factoextra (Kassambara and Mundt, 2017; Lê et al., 2008).

Resultados
La supervivencia de las hembras no estuvo influenciada por el régimen dietético (prueba de Chi-cuadrado: X2 = 2.7, P = 0,2; Tabla 2). Los huevos fértiles fueron influenciados por el régimen dietético y fueron más frecuentes en los tratamientos FF y MD versus el tratamiento ED (P = 0.02, prueba exacta de Fisher).
Las hembras con ≥ 1 desoves fueron influenciadas por el régimen dietético y fueron mayores en los tratamientos FF y MD que en el tratamiento de ED (prueba de Chi-cuadrado: X2 = 49.091, P < 0.01; Tabla 1). Las hembras con ≥ 2 desoves también fueron influenciadas por el tratamiento dietético, y fueron más predominantes en los tratamientos FF y MD que en el tratamiento ED (P= 0.02, prueba exacta de Fisher). Los tratamientos dietéticos tuvieron un efecto significativo sobre la fecundidad (ANOVA de una vía, P < 0.05).
El tratamiento MD tuvo una fecundidad
significativamente mayor que el tratamiento ED, según comparaciones post hoc (prueba de Tukey, P < 0.05). El tratamiento MD, por otro lado, no difirió significativamente de los tratamientos ED y FF (prueba de Tukey, P < 0.05). Los tratamientos dietéticos (FF y MD) no tuvieron efecto sobre la fertilización de huevos o la eclosión (P > 0.05, prueba T). No se encontró fertilización en los cuatro desoves del tratamiento ED.
La supervivencia de los machos no estuvo influenciada por el régimen dietético (P = 0.2, prueba exacta de Fisher). Los tratamientos dietéticos no tuvieron efecto sobre el peso del espermatóforo o el conteo de espermatozoides (ANOVA de una vía, P < 0.05). Los tratamientos dietéticos, por otro lado, tuvieron un efecto significativo en la tasa normal de espermatozoides (ANOVA de una vía, P < 0.05). En las comparaciones post hoc, la tasa normal de espermatozoides en el tratamiento ED fue significativamente mayor que en el tratamiento FF (prueba de Tukey, P < 0.05), pero no en el tratamiento MD. Los tratamientos MD y FF no difirieron significativamente (prueba de Tukey, P > 0.05).
Los resultados del análisis de componentes principales (PCA) de las fuentes de alimentos en función de sus ácidos grasos revelaron dos componentes principales que explicaron el 94.6 % de la varianza de la data (PC1 = 66%,
- OCTUBRE 2022 71 NUTRICIÓN
Tabla 4.- Perfiles de ácidos grasos (% de ácidos grasos totales; media ± SE) de los alimentos suministrados a los reproductores Litopenaeus vannamei. n = 2 por alimentación.
PC2 = 28.6%; Fig. 1a). La dieta experimental, la biomasa de Artemia, los poliquetos y los mejillones fueron los principales alimentos que contribuyeron a la varianza explicada en el componente principal 1 (Fig. 1b).
El calamar fue el alimento principal que explica la variación en el componente principal 2 (Fig. 1b). Según el PCA, los ácidos grasos saturados fueron similares entre todas las fuentes de alimentos (Fig. 1, Tabla 4). Las concentraciones más altas de ácidos grasos monoinsaturados se encontraron en la biomasa de Artemia, mejillones y el alimento experimental, y el ácido oleico (C18:1 n-9) fue abundante en estas fuentes de alimento (Fig. 1, Tabla 4).
La más alta concentración de n-3 se encontró en calamares, poliquetos y la dieta experimental, y el ácido eicosapentaenoico (EPA; C20:5 n-3) y el ácido docosahexaenoico (DHA; C22:6 n-3) estuvieron bien representados en estas fuentes de alimentos (Fig. 1, Tabla 4). Tabla 2.
Discusión
Este estudio mostró que las hembras en el tratamiento MD no difirieron significativamente del tratamiento FF en términos de desoves fértiles, hembras con ≥ 1 desove, hembras con ≥ 2 desoves y fecundidad (Tabla 1).
En cuanto al tratamiento ED, hubo cuatro desoves y ninguna fertilización. La dieta, por otro lado, no tuvo ningún efecto sobre la supervivencia de los machos, el peso de los espermatóforos o el conteo de espermatozoides (Tabla 3). Sin embargo, la dieta influye en la tasa normal de espermatozoides, donde el tratamiento ED fue mayor que el tratamiento FF pero similar al tratamiento MD (Tabla 3). Según algunos estudios, el bajo rendimiento femenino es consecuencia del bajo rendimiento masculino porque es un efecto combinado de ambos (Palacios y Racotta, 2003). Sin embargo, los machos en los tratamientos ED y MD tenían esperma de buena calidad, lo que implica que los machos no tienen ningún efecto sobre el rendimiento reproductivo femenino en términos de fecundidad y fertilización de huevos. Esto se demuestra en el tratamiento MD, donde las hembras tuvieron 64 desoves, buena fecundidad y fertilización de huevos,
al igual que en el tratamiento FF, a pesar de ser alimentadas con la dieta experimental. La dieta experimental, sola o en combinación con calamares y mejillones, mejora el rendimiento de los machos, particularmente en términos de tasa normal de espermatozoides, pero es insuficiente para satisfacer las necesidades nutricionales de las hembras (tratamiento ED). Sin embargo, cuando la dieta experimental se combinó con calamares y mejillones (tratamiento MD), las hembras tuvieron una fecundidad similar a las del tratamiento FF (Tabla 2).

La nutrición se ha relacionado con el desempeño reproductivo (Chimsung, 2014; Wouters et al., 2001). Las dietas desequilibradas o incompletas tienen un impacto negativo en el rendimiento reproductivo e incluso pueden impedir que los animales se reproduzcan (Wouters et al., 2001).
La dieta experimental contenía 51.1% de proteína y 14.4% de lípidos (Tabla 1). Los niveles de lípidos en las dietas artificiales de reproductores deben estar alrededor del 10% (Wouters et al., 2001). Niveles por encima de esto, ralentiza la maduración ovárica (Wouters et al., 2001). Nuestra dieta experimental contenía un 14.4% de lípidos, superior a lo recomendado. Esto puede tener un impacto negativo en la tasa de ingestión y, como resultado, deficiencia de nutrientes (Chimsung, 2014; Wouters et al., 2001).
La dieta experimental presentó importantes nutrientes como ácido oleico (C18:1n-9), alta concentración de n-3, EPA (C20:5n-3) y DHA (C22:6n-3) (Fig. 1, Tabla 4). Estos ácidos grasos son importantes en la maduración de los ovarios, huevos, la fecundidad, la
producción y la calidad del huevo (Hoa et al., 2009; Wouters et al., 2001). A pesar de las concentraciones presentadas de n-3, EPA y DHA, la dieta experimental fue insuficiente para satisfacer todas las necesidades de las hembras del tratamiento ED.
Los altos niveles de lípidos y los niveles de ácidos grasos poliinsaturados, particularmente EPA y DHA, en la dieta experimental pueden haber contribuido al nulo desove y la baja fecundidad en las hembras en el tratamiento de ED.
Este efecto no ocurrió en las hembras que recibieron el tratamiento MD porque la dieta experimental mejoró con calamares y mejillones, aumentando los niveles de n-3, lo que podría haber contribuido a una mejor fecundidad en las hembras. Hoa et al. (2009) y Wouters et al. (2001) recomendaron incluir en la dieta un mejor balance entre las relaciones n-3/n-6, ARA/EPA y DHA/EPA para mejorar la nutrición de reproductores y el desempeño de las hembras, particularmente en la fecundidad. Como resultado, la combinación de alimentos frescos con una dieta experimental da como resultado un rendimiento reproductivo más equilibrado.
Conclusión
El tratamiento MD mostró una fecundidad similar en las hembras y una tasa de esperma normal en los machos en comparación con el tratamiento FF. Estos hallazgos confirman que es posible sustituir el 50% de los alimentos frescos por una dieta experimental. Usando nuestra dieta experimental, pudimos eliminar la biomasa de poliquetos y artemia de la dieta de los reproductores, convirtiéndola en un reemplazo viable para los alimentos frescos de alto costo•
- OCTUBRE 2022 72 NUTRICIÓN


La acuicultura es el sector de producción con el mayor crecimiento a nivel mundial. Únicamente la producción de camarones Litopenaeus vannamei ha logrado superar los 6 millones de toneladas, el equivalente al 51.7% del total de crustáceos provenientes de la acuicultura (FAO, 2022). Por este motivo es considerado uno de los sectores más valiosos que prometen cumplir los objetivos para el desarrollo sostenible de la Organización de las Naciones Unidas (ONU) manteniendo la seguridad alimentaria y los beneficios económicos de una industria en constante desarrollo.

Al ser uno de los sectores con mayor crecimiento continuamente se enfrenta a desafíos relacionados a la sostenibilidad ambiental (Sampantamit et al., 2020; Thilsted et al., 2016). Es así, que la industria de camarón es uno de los mayores demandantes de harina de pescado (HP) como fuente de proteína en el sector acuícola (Balasubramanian et al., 2022; Naylor et al., 2009; Shepherd y Jackson, 2013), este ingrediente incorporado a las dietas comerciales por el alto requerimiento de proteína para la producción de camarón (Molina-Poveda, 2016), ha sido el foco de atención de muchos estudios de investigación destinados para el reemplazo por fuentes de proteínas alternativas (Froehlich et al., 2018; Naylor et al., 2009; Pelletier et al., 2018) lo que ha permitido a las fábricas de alimento acuícola reducir el contenido de HP en sus dietas comerciales y con ello mantener el desarrollo de la industria.
Esta sustitución es considerada ambientalmente sostenible, ya que reduce significativamente la dependencia de los recursos marinos finitos (Gatlin et al., 2007; Naylor et al., 2009). Sin embargo, los requerimientos nutricionales de las especies cultivadas son la principal limitante en el porcentaje de sustitución debido a la variabilidad o disponibilidad de nutrientes esenciales en los ingredientes vegetales terrestres (FAO, 2009; Gatlin et al., 2007) como son los aminoácidos, ácidos grasos esenciales, minerales y vitaminas necesarias para asegurar el máximo crecimiento y una buena salud del organismo (Dawson et al., 2018).
NUTRICIÓN
Actualmente, la preocupación por la
Alimentando un futuro sostenible: la inclusión de ingredientes noveles en alimentos para camarón
Autores:
César Molina Poveda Carlos Mora Pinargote Manuel Espinoza Ortega.
Skretting Aquaculture Innovation
cesar.molina@skretting.com
sostenibilidad de las materias primas llega también a las fuentes vegetales debido al traslado de la demanda de los recursos oceánicos a la producción acuícola, lo que podría generar presión y competencia con otros sectores de producción de alimentos basados en fuentes de origen terrestre (Boissy et al., 2011; Pahlow et al., 2015), presionando el medio ambiente, la biodiversidad, y la disponibilidad y precios de cultivos (Blanchard et al., 2017; Malcorps et al., 2019; Pelletier et al., 2018; Troell et al., 2014). Estos potenciales efectos no contribuirían al desarrollo de dietas sostenible según la definición de la Organización para la Agricultura y la Alimentación (FAO), y afectaría el cumplimiento de los objetivos de la ONU en cuanto a seguridad alimentaria, reducción del hambre y protección de la vida en la tierra y en el mar.
En este contexto, considerando los requerimientos nutricionales del alimento para camarón y la importancia para mantener la sostenibilidad de la acuicultura como soporte en la rápida intensificación del cultivo. La nutrición animal y la alimentación deben superar los siguientes desafíos para alcanzar la sostenibilidad, i.e.: (1) disponibilidad y costos de los ingredientes para el desarrollo de los alimentos, (2) incremento de la competencia de la materia prima con otros sectores, y (3) previsión de la oferta y la demanda del mercado local y global junto con el mantenimiento de la calidad ambiental, la aceptabilidad social y el crecimiento económico de los sistemas
acuícolas (Caruso, 2015; Hasan, 2000). De aquí nace, la utilización y búsqueda de ingredientes llamados nóveles.
Insectos y lombrices de tierra
La disponibilidad de la HP cada vez más limitada ante el crecimiento constante de la producción acuícola y sus crecientes costos han impulsado alternativas de alimentación sostenibles para la acuicultura. Los insectos forman parte de la dieta natural de varias especies acuícolas en estado silvestre, por lo tanto, pueden ser una alternativa para sustituir parcial o totalmente la HP.
La producción de insectos requiere de cantidades mínimas de tierra y agua, tienen ciclos de vida cortos y pueden criarse con biorresiduos de alta productividad lográndose buenos coeficientes de conversión alimenticia (Makkar et al., 2014). En cuanto a las características nutricionales, la composición de sus nutrientes cambia según la etapa de vida, las condiciones de crecimiento y la alimentación. Una dieta de pescado de buena calidad puede tener hasta un 73% de proteína, mientras que la harina de soya puede alcanzar hasta el 50% de proteína; según la especie de insecto y el método de procesamiento, el contenido de proteínas de la harina oscila entre el 50 –82% (Gasco et al., 2020; Manzano-Agugliaro et al., 2012).
Los perfiles de aminoácidos de un insecto dependen también del taxón. Varios insectos presentan perfiles comparables a los de la HP,
Referencias
Anupama, Ravindra, P., 2000. Value-added food: Biotechnol Adv 18, 459–479. https://doi.org/10.1016/S07349750(00)00045-8
Araújo, B.C., Mata-Sotres, J.A., Viana, M.T., Tinajero, A., Braga, A., 2019. Fish oil-free diets for Pacific white shrimp Litopenaeus vannamei: The effects of DHA-EPA supplementation on juvenile growth performance and muscle fatty acid profile. Aquaculture 511, 1–5. https://doi. org/10.1016/j.aquaculture.2019.734276
Arnold, S., Smullen, R., Briggs, M., West, M., Glencross, B., 2016. The combined effect of feed frequency and ration size of diets with and without microbial biomass on the growth and feed conversion of juvenile Penaeus monodon. Aquac Nutr 22, 1340–1347. https://doi.org/10.1111/anu.12338
Asche, F., Roll, K.H., Tveterås, S., 2008. Future Trends in Aquaculture: Productivity Growth and Increased Production, in: Aquaculture in the Ecosystem. Springer Netherlands, Dordrecht, pp. 271–292. https://doi.org/10.1007/978-14020-6810-2_9
Balasubramanian, B., Liu, W.-C., Sattanathan, G. (Eds.), 2022. Aquaculture Science and Engineering. Springer Nature Singapore, Singapore. https://doi.org/10.1007/978981-19-0817-0
Balcázar, J., Blas, I., Ruizzarzuela, I., Cunninggham, D., Vendrell, D., Muzquiz, J., 2006. The role of probiotics in aquaculture. Vet Microbiol 114, 173–186. https://doi. org/10.1016/j.vetmic.2006.01.009
Barroso, F.G., de Haro, C., Sánchez-Muros, M.J., Venegas, E., Martínez-Sánchez, A., Pérez-Bañón, C., 2014. The potential of various insect species for use as food for fish. Aquaculture 422–423, 193–201. https://doi.org/10.1016/j. aquaculture.2013.12.024
Bauer, W., Prentice-Hernandez, C., Tesser, M.B., Wasielesky, W., Poersch, L.H.S., 2012. Substitution of fishmeal with microbial floc meal and soy protein concentrate in diets for the pacific white shrimp Litopenaeus vannamei. Aquaculture 342–343, 112–116. https://doi.org/10.1016/j. aquaculture.2012.02.023
Bharti, V., Kumar-Pandey, P., Kumar-Koushiesh, S., 2014. Single Cell Proteins: a Novel Approach in Aquaculture Systems.
Blanchard, J.L., Watson, R.A., Fulton, E.A., Cottrell, R.S., Nash, K.L., Bryndum-Buchholz, A., Büchner, M., Carozza, D.A., Cheung, W.W.L., Elliott, J., Davidson, L.N.K., Dulvy, N.K., Dunne, J.P., Eddy, T.D., Galbraith, E., Lotze, H.K., Maury, O., Müller, C., Tittensor, D.P., Jennings, S., 2017. Linked sustainability challenges and trade-offs among fisheries, aquaculture and agriculture. Nat Ecol Evol 1, 1240–1249. https://doi.org/10.1038/s41559-017-0258-8
Boissy, J., Aubin, J., Drissi, A., van der Werf, H.M.G., Bell, G.J., Kaushik, S.J., 2011. Environmental impacts of plant-based salmonid diets at feed and farm scales. Aquaculture 321, 61–70. https://doi.org/10.1016/j.aquaculture.2011.08.033
Burr, G., Gatlin, D., Ricke, S., 2005. Microbial Ecology of the Gastrointestinal Tract of Fish and the Potential Application of Prebiotics and Probiotics in Finfish Aquaculture. J World Aquac Soc 36, 425–436. https://doi. org/10.1111/j.1749-7345.2005.tb00390.x
Caruso, G., 2015. Fishery Wastes and By-products: A Resource to Be Valorised. Journal of Fisheries Sciences 10, 12–15.
Chen, Y., Chi, S., Zhang, S., Dong, X., Yang, Q., Liu, H., Zhang, W., Deng, J., Tan, B., Xie, S., 2021. Replacement of fish meal with Methanotroph (Methylococcus capsulatus, Bath) bacteria meal in the diets of Pacific white shrimp (Litopenaeus vannamei). Aquaculture 541, 736801. https:// doi.org/10.1016/j.aquaculture.2021.736801
Chiu, S.-T., Wong, S.-L., Shiu, Y.-L., Chiu, C.-H., Guei, W.-C., Liu, C.-H., 2016. Using a fermented mixture of soybean meal and earthworm meal to replace fish meal in the diet of white shrimp, Penaeus vannamei (Boone). Aquac Res 47, 3489–3500. https://doi.org/10.1111/are.12799
- OCTUBRE 2022 76 NUTRICIÓN
Figura 1. Pasos generales de la elaboración de la harina de insectos previo a la inclusión en dietas acuícolas.
y otros se asemejan a la harina de soya con ciertas deficiencias de aminoácidos como la lisina y metionina (Barroso et al., 2014); muchos otros tienen una gran cantidad de taurina (26 mol/g), un aminoácido con efectos positivos sobre la resistencia a estrés ambiental en el camarón (Sowa y Keeley, 1996; Yue et al., 2013; Zhou et al., 2017).
Los valores nutricionales de los insectos pueden ser fuertemente influenciados por la dieta, utilizando fuentes de nutrientes como vitaminas y minerales pueden ayudar a mejorar el valor nutricional de la harina producida (Figura 1). Por ejemplo, la adición de calcio y fósforo durante la crianza de insectos podrían mejorar las concentraciones de estos minerales una vez producida la harina (Makkar et al., 2014; Rumpold y Schlüter, 2013).
Otra fuente alternativa de proteína sostenible es el uso de lombrices de tierra, estas pueden crecer eficientemente en sustratos que son desperdicios o subproductos con un valor económico muy bajo o nulo (Parolini et al., 2020). La harina de lombrices puede contener entre el 55 - 70% de proteína cruda y una variedad de vitaminas, como niacina y vitamina B12, con un mayor contenido de aminoácidos, principalmente la lisina y metionina, en comparación con la HP (Mohanta et al., 2016).
Los estudios en camarón han reportado el reemplazo exitoso de hasta el 50% de HP por harina de insectos con resultados que han aumentado la ganancia de peso, la digestibilidad y disminuyendo el FCA (Choi et al., 2018; Cummins et al., 2017; Motte et al., 2019; Panini et al., 2017). Por otro lado, a pesar de que los estudios del uso de harina de lombrices en dietas para camarón son escasos y no concluyentes referente al efecto sobre el rendimiento del camarón, (Chiu et al., 2016) mostró que es posible reemplazar un 80% de HP en dietas para juveniles L. vannamei usando una mezcla de soya fermentada y harina de lombrices. En peces los porcentajes de sustitución usando únicamente harina de lombrices han mostrado ser exitosos y variables dependiendo de la especie (Ghosh, 2004; Mohanta et al., 2016; Vodounnou et al., 2016).
Por esta razón, dadas las características nutricionales, facilidad de crianza y la producción de biomasa, los insectos y lombrices son los mejores candidatos como fuentes ambientalmente amigables de nutrientes, de acuerdo con el Objetivo 14 de la ONU, apoyando también la sostenibilidad del crecimiento de la industria acuícola (Hodar et al., 2020).
Proteínas de origen bacteriano y fúngico
La biomasa microbiana, también conocida como “proteína unicelular” o SCP por sus siglas en inglés (Single Cell Protein) puede ser preparada a partir de diferentes fuentes de microorganismos que incluyen algas, hongos y bacterias. Las SCP tienen un reconocido potencial para las dietas acuícolas y pueden ser consideradas como fuente de proteína alternativa a la HP, con propiedades inmunoestimulantes y probióticas que incrementan el crecimiento, salud y resistencia a enfermedades del animal (Ige, 2013). Además, algunas SCP son capaces de sintetizar carotenoides de novo, lo cual mejora el color de la carne de varias especies acuáticas, incluidas el camarón L. vannamei (Parisenti et al., 2011) e incrementan su valor en el mercado (Mitra, 2021; Ritala et al., 2017).
Al igual que los insectos, la calidad nutricional de las SCP pueden ser potenciadas mediante suplementos; cambiando las condiciones de crecimiento, mejorando el medio de cultivo, y la aplicación de tratamientos postcosecha (Øverland y Skrede, 2017). Además, la producción de proteínas unicelulares recicla los desechos de la agricultura y las industrias porque los microbios pueden utilizar estas sustancias como fuentes de nutrientes (Bharti et al., 2014).
En la acuicultura los microbios probióticos han revolucionado el crecimiento económico por mejorar la supervivencia, resistencia a enfermedades, eficiencia de digestibilidad y crecimiento (Figura 2; Balcázar et al., 2006; Burr et al., 2005). En la actualidad, muchos estudios han sido desarrollados para comprender los efectos del crecimiento y la eficiencia de alimentación por la inclusión parcial de harina de bacterias (BPM) o harina biofloc en el camarón (Chumpol et al., 2018; Hamidoghli et al., 2019; Tlusty y Thorsen, 2017).
Choi, I.H., Kim, J.M., Kim, N.J., Kim, J.D., Park, C., Park, J.H., Chung, T.H., 2018. Replacing fish meal by mealworm Tenebrio molitor on the growth performance and immunologic responses of white shrimp Litopenaeus vannamei. Acta Sci 40, 39077. https://doi.org/10.4025/actascianimsci. v40i1.39077
Chumpol, S., Kantachote, D., Nitoda, T., Kanzaki, H., 2018. Administration of purple nonsulfur bacteria as single cell protein by mixing with shrimp feed to enhance growth, immune response and survival in white shrimp ( Litopenaeus vannamei ) cultivation. Aquaculture 489, 85–95. https://doi. org/10.1016/j.aquaculture.2018.02.009
Cummins, V.C., Rawles, S.D., Thompson, K.R., Velasquez, A., Kobayashi, Y., Hager, J., Webster, C.D., 2017. Evaluation of black soldier fly (Hermetia illucens) larvae meal as partial or total replacement of marine fish meal in practical diets for Pacific white shrimp (Litopenaeus vannamei). Aquaculture 473, 337–344. https://doi.org/10.1016/j. aquaculture.2017.02.022
Dantas, E.M., Valle, B.C.S., Brito, C.M.S., Calazans, N.K.F., Peixoto, S.R.M., Soares, R.B., 2016. Partial replacement of fishmeal with biofloc meal in the diet of postlarvae of the Pacific white shrimp Litopenaeus vannamei. Aquac Nutr 22, 335–342. https://doi.org/10.1111/anu.12249
Dawson, M.R., Alam, M.S., Watanabe, W.O., Carroll, P.M., Seaton, P.J., 2018. Evaluation of Poultry By Product Meal as an Alternative to Fish Meal in the Diet of Juvenile Black Sea Bass Reared in a Recirculating Aquaculture System. N Am J Aquac 80, 74–87. https://doi.org/10.1002/naaq.10009
Ekasari, J., Hanif Azhar, M., Surawidjaja, E.H., Nuryati, S., de Schryver, P., Bossier, P., 2014. Immune response and disease resistance of shrimp fed biofloc grown on different carbon sources. Fish Shellfish Immunol 41, 332–339. https://doi. org/10.1016/j.fsi.2014.09.004
Ekasari, J., Rivandi, D.R., Firdausi, A.P., Surawidjaja, E.H., Zairin, M., Bossier, P., de Schryver, P., 2015. Biofloc technology positively affects Nile tilapia (Oreochromis niloticus) larvae performance. Aquaculture 441, 72–77. https://doi.org/10.1016/j.aquaculture.2015.02.019
FAO, 2022. The State of World Fisheries and Aquaculture 2022. FAO. https://doi.org/10.4060/cc0461en FAO, 2009. Fish as feed inputs for aquaculture-practices, sustainability and implications: A global synthesis. Food and Agriculture Organization of the United Nations, Rome. Froehlich, H.E., Jacobsen, N.S., Essington, T.E., Clavelle, T., Halpern, B.S., 2018. Avoiding the ecological limits of forage fish for fed aquaculture. Nat Sustain 1, 298–303. https:// doi.org/10.1038/s41893-018-0077-1
Gasco, L., Acuti, G., Bani, P., Dalle Zotte, A., Danieli, P.P., de Angelis, A., Fortina, R., Marino, R., Parisi, G., Piccolo, G., Pinotti, L., Prandini, A., Schiavone, A., Terova, G., Tulli, F., Roncarati, A., 2020. Insect and fish by-products as sustainable alternatives to conventional animal proteins in animal nutrition. Ital J Anim Sci. https://doi. org/10.1080/1828051X.2020.1743209
Gatlin, D.M., Barrows, F.T., Brown, P., Dabrowski, K., Gaylord, T.G., Hardy, R.W., Herman, E., Hu, G., Krogdahl, Å., Nelson, R., Overturf, K., Rust, M., Sealey, W., Skonberg, D., J Souza, E., Stone, D., Wilson, R., Wurtele, E., 2007. Expanding the utilization of sustainable plant products in aquafeeds: a review. Aquac Res 38, 551–579. https://doi.org/10.1111/ j.1365-2109.2007.01704.x
Ghosh, C., 2004. Integrated vermi-pisciculture an alternative option for recycling of solid municipal waste in rural India. Bioresour Technol 93, 71–75. https://doi.org/10.1016/j. biortech.2003.09.014
Glencross, B.D., Tocher, D.R., Matthew, C., Gordon Bell, J., 2014. Interactions between dietary docosahexaenoic acid and other long-chain polyunsaturated fatty acids on performance and fatty acid retention in post-smolt Atlantic salmon (Salmo salar). Fish Physiol Biochem 40, 1213–1227. https://doi.org/10.1007/s10695-014-9917-8
Hamidoghli, A., Yun, H., Won, S., Kim, S., Farris, N.W., Bai, S.C., 2019. Evaluation of a single-cell protein as a dietary fish
- OCTUBRE 2022 77 NUTRICIÓN
Bacterias del género Bacillus, Streptococcus y Lactobacillus sp. con una reconocida reputación en la acuicultura han sido las más prometedoras por diferentes razones: (1) tienen un tiempo de generación corto debido a que se multiplican rápidamente en un período corto (dentro de 20 a 120 minutos); (2) Los productos obtenidos contienen un 50 - 80% de proteína cruda con ciertos aminoácidos esenciales; (3), pueden multiplicarse rápidamente sobre material orgánico de desecho y también pueden reproducirse en agua natural suplementada con nutrientes y minerales, lo cual ayuda a superar las deficiencias de vitaminas durante su producción (Sharif et al., 2021).
Este tipo de SCP también ofrece una gran cantidad de patrones moleculares asociados a microbios (MAMP), que estimulan el sistema inmune del animal, lo que resulta en una mayor resistencia a las enfermedades (Ekasari et al., 2015, 2014). Por lo tanto, se logra una alta productividad y rentabilidad utilizando menos recursos y al mismo tiempo reduciendo el impacto ambiental (Asche et al., 2008; Dantas et al., 2016).
Respecto a los hongos, ofrecen una gran concentración de ácidos nucleicos (7 – 10 %) y ácidos grasos (ARA, DHA y EPA), en ocasiones mayor a las encontradas en las algas, convirtiéndolo en una materia prima con potencial en la producción de alimento para larvas de camarón y reproductores (Nasseri et al., 2011; Turnbull et al., 1992; Ugalde y Castrillo, 2002). Sin embargo, la principal desventaja del uso de la harina de hongos es la producción de micotoxinas por ciertas especies, este problema puede superarse mediante la selección cuidadosa de las cepas, las condiciones de cultivo, y la formulación del producto final (Anupama y Ravindra, 2000).
Los estudios llevados a cabo en camarón L. vannamei usando harinas de diferentes fuentes de microorganismos como reemplazo de la HP han mostrado resultados prometedores sin afectar el crecimiento, el FCA y la supervivencia del camarón. Bauer et al. (2012) reportó la posibilidad de reemplazar completamente la HP por una mezcla de concentrado de soya y harina microbiana sin efectos adversos.
A pesar de no encontrarse un efecto sobre el crecimiento, Chen et al. (2021) observó que al aumentar la inclusión de harina microbiana aumentaba significativamente también la actividad de enzimas antioxidantes y el grosor de la pared del intestino. Por otro lado, Kuhn et al. (2009) demostró que el reemplazó no solo aplica sobre la HP, sino que es posible reemplazar la harina de soya por harina microbiana en dietas para L. vannamei
Microalgas
Actualmente, el 30% de la producción global de algas es usada en la alimentación animal. El uso de microalgas como un aditivo en la acuicultura ha ganado considerable atención por sus ventajas, incluido la ganancia del peso, aumento de niveles de triglicéridos y el contenido proteico en el cuerpo, incremento de la resistencia a enfermedades, reducción de liberación de nitrógeno en el ambiente, y una mejor digestibilidad (Balasubramanian et al., 2022).
Varias microalgas han sido usadas como alimento en estadios larvarios de bivalvos, camarones y algunas especies de peces en sistemas de monocultivo intensivo, estas pueden ser ingeridas ya sea directamente por el animal (alimento vivo) o indirectamente por medio de otros organismos (Artemia) o formar parte de un alimento comercial para larvas (Liu et al., 2020).
Al igual que la mayoría de las fuentes descritas en este artículo, la síntesis de proteínas en las microalgas se ve afectada por las condiciones de cultivo y el medio. El contenido de proteína de la biomasa seca ronda entre el 26.5 y 53.3%. Adicionalmente, la biomasa de microalgas contiene altas concentraciones de ácidos grasos poliinsaturados (PUFA) que, sobre circunstancias inusuales, tales como bajas temperaturas, soportan el crecimiento y supervivencia del camarón (Araújo et al., 2019; Maisashvili et al., 2015; Priyadarshani et al., 2012; Sangha et al., 2000). Las microalgas con altos contenido PUFA ofrecen un potencial mucho mejor para la acuicultura que la soya y el maní, las cuales son usadas ampliamente como materia prima para la manufactura de alimentos. Como resultado, las microalgas pueden ser consideradas una fuente efectiva y de bajo costo de PUFA para la acuicultura (Li et al., 2014; Walker y
meal substitute for whiteleg shrimp Litopenaeus vannamei. Fisheries Science 85, 147–155. https://doi.org/10.1007/ s12562-018-1275-5
Hasan, M.R., 2000. Nutrition and Feeding for Sustainable Aquaculture Development in the Third Millennium, in: Subasinghe, R.P., Bueno, P., Phillips, M.J., Hough, C., McGladdery, S.E., Arthur, J.R. (Eds.), Aquaculture in the Third Millennium. NACA, Bangkok and FAO, Rome, Bangkok, pp. 193–219.
Hodar, A.R., Vasava, R.J., Mahavadiya, D.R., Joshi, N.H., 2020. Fish meal and fish oil replacement for aqua feed formulation by using alternative sources: A review. J. Exp. Zool. India 23, 13–21.
Ige, B.A., 2013. Probiotics use in intensive fish farming. Afr J Microbiol Res 7, 2701–2711. https://doi.org/10.5897/ AJMRx12-021
Kuhn, D.D., Boardman, G.D., Lawrence, A.L., Marsh, L., Flick, G.J., 2009. Microbial floc meal as a replacement ingredient for fish meal and soybean protein in shrimp feed. Aquaculture 296, 51–57. https://doi.org/10.1016/j. aquaculture.2009.07.025
Li, M., Wu, W., Zhou, P., Xie, F., Zhou, Q., Mai, K., 2014. Comparison effect of dietary astaxanthin and Haematococcus pluvialis on growth performance, antioxidant status and immune response of large yellow croaker Pseudosciaena crocea. Aquaculture 434, 227–232. https:// doi.org/10.1016/j.aquaculture.2014.08.022
Liu, W.-C., Zhou, S.-H., Balasubramanian, B., Zeng, F.-Y., Sun, C.-B., Pang, H.-Y., 2020. Dietary seaweed (Enteromorpha) polysaccharides improves growth performance involved in regulation of immune responses, intestinal morphology and microbial community in banana shrimp Fenneropenaeus merguiensis. Fish Shellfish Immunol 104, 202–212. https:// doi.org/10.1016/j.fsi.2020.05.079
Maisashvili, A., Bryant, H., Richardson, J., Anderson, D., Wickersham, T., Drewery, M., 2015. The values of whole algae and lipid extracted algae meal for aquaculture. Algal Res 9, 133–142. https://doi.org/10.1016/j.algal.2015.03.006
Makkar, H.P.S., Tran, G., Heuzé, V., Ankers, P., 2014. State-of-the-art on use of insects as animal feed. Anim Feed Sci Technol 197, 1–33. https://doi.org/10.1016/j. anifeedsci.2014.07.008
Malcorps, W., Kok, B., van‘t Land, M., Fritz, M., van Doren, D., Servin, K., van der Heijden, P., Palmer, R., Auchterlonie, N., Rietkerk, M., Santos, M., Davies, S., 2019. The Sustainability Conundrum of Fishmeal Substitution by Plant Ingredients in Shrimp Feeds. Sustainability 11, 1212. https://doi. org/10.3390/su11041212
Manzano-Agugliaro, F., Sanchez-Muros, M.J., Barroso, F.G., Martínez-Sánchez, A., Rojo, S., Pérez-Bañón, C., 2012. Insects for biodiesel production. Renewable and Sustainable Energy Reviews. https://doi.org/10.1016/j.rser.2012.03.017
Mitra, A., 2021. Thought of Alternate Aquafeed: Conundrum in Aquaculture Sustainability? Proc Zool Soc 74, 1–18. https://doi.org/10.1007/s12595-020-00352-4
Mohanta, K.N., Subramanian, S., Korikanthimath, V.S., 2016. Potential of earthworm (Eisenia foetida) as dietary protein source for rohu (Labeo rohita) advanced fry. Cogent Food Agric 2. https://doi.org/10.1080/23311932.2016.11385
94
Molina-Poveda, C. 2016. Nutrient requirements. - Nates, Sergio F. (Ed.) Aquafeed Formulation. San Diego, Academic Press: 75-216.
Motte, C., Rios, A., Lefebvre, T., Do, H., Henry, M., Jintasataporn, O., 2019. Replacing Fish Meal with Defatted Insect Meal (Yellow Mealworm Tenebrio molitor) Improves the Growth and Immunity of Pacific White Shrimp (Litopenaeus vannamei). Animals 9, 258. https://doi.org/10.3390/ ani9050258
Nasseri, A.T., Rasoul-Ami, S., Morowvat, M.H., Ghasemi, Y., 2011. Single Cell Protein: Production and Process. Am J Food Technol 6, 103–116. https://doi.org/10.3923/ ajft.2011.103.116
Naylor, R.L., Hardy, R.W., Bureau, D.P., Chiu, A., Elliott, M.,
- OCTUBRE 2022 78 NUTRICIÓN
Berlinsky, 2011).
Estudios usando una combinación de biomasa microbiana y microalgas ha sido extensamente probada en camarón Penaeus monodon para superar las desventajas en el crecimiento cuando la HP o el aceite de pescado son removidos de la dieta, mientras que otro trabajo describió un mejoramiento en las tasas de crecimiento cuando se incluyó proteína microbiana al 10% en dietas bajas en HP (Arnold et al., 2016; Glencross et al., 2014).
Ensayos de alimentación en camarón Litopenaeus vannamei
El siguiente estudio se llevó a cabo por el equipo de Investigación y Desarrollo de Skretting Ecuador y fueron diseñados para evaluar el efecto sobre los parámetros zootécnicos de una fuente de proteínas novel de origen animal (PN-A).
Un ensayo con juveniles de L. vannamei de 5,3g sembrados a razón de 15 camarones/ m2 fue llevado a cabo en un sistema de recirculación con cinco repeticiones por dieta. Basado en una fórmula comercial, se prepararon cinco dietas experimentales que aportaron 35% de proteína y 7% de lípidos, donde se sustituyó el 0%, 25%, 50%, 75% y 100% de proteína de HP por proteína de PNA. Al término de 56 días de alimentación los resultados (Tabla 1) no mostraron diferencias significativas (p > 0,05) en términos de peso final, biomasa final, FCA y supervivencia todas las dietas evaluadas con excepción de la dieta 100NP-A que dio estadísticamente (p < 0,05) una menor respuesta comparados con el alimento 0NP-A, que fue la dieta control que no tenía ningún nivel de substitución de HP. A pesar, de que estadísticamente no se encontró diferencias en la dieta 75NP-A con 75% de reemplazo de HP, es evidente el inicio de una reducción del peso y la biomasa que se acentuó cuando los camarones recibieron
Tabla
el alimento 100NP-A con cero inclusión de HP.
En camarón ha sido muy estudiado el uso de proteínas unicelulares microbianas en diferentes estadios de vida (Tabla 2).
Nethaji et al. (2022) alimento postlarvas de camarón L. vannamei (0.03 g) con dietas que contenían diferentes niveles de inclusión de harina biofloc (BF): 10 (BFT10), 20 (BFT20), 30 (BFT30) y 40% (BFT40), comparadas con una dieta base sin inclusión (BFT0) y un alimento comercial (CD). El estudio encontró (Tabla 2a) un rendimiento significativamente (p < 0,05) mayor en términos de peso final (1,30g), ganancia de peso (1,27g) y tasa de crecimiento específica (6,21%/día) en los camarones alimentados con la dieta BFT30 comparado a los dos alimentos controles. La conversión alimenticia (1,38) fue la más baja entre los alimentos ensayados. Adicionalmente, los camarones alimentados con BFT30 mostraron una mayor actividad enzimática de amilasas y lipasas.
Por otro lado, Shao et al. (2017) evaluó el potencial de reemplazo de HP por BF en camarones juveniles L. vannamei (7.76g) a niveles de reemplazo del 0 (HP) y 15% (BF), usando como referencia un alimento comercial (CD). El ensayo de alimentación con 8000 camarones (peso inicial 7,76g) por tanque de concreto (36 m3) ubicado en un invernadero fue conducido por seis semanas. Los parámetros zootécnicos registrados mostraron que el reemplazo del 15% de la HP con BF no causó ninguna afectación (P > 0,05) en el crecimiento de los camarones en comparación con el grupo de HP (Tabla 2b). Sin embargo, los parámetros crecimiento, biomasa, conversión alimenticia y proteica de los camarones que recibieron HP como de BF fueron significativamente (p < 0,05) más altos que el grupo alimentado con el CD. Los resultados también mostraron un
que contenían diferentes
(PN-A).
Farrell, A.P., Forster, I., Gatlin, D.M., Goldburg, R.J., Hua, K., Nichols, P.D., 2009. Feeding aquaculture in an era of finite resources. Proceedings of the National Academy of Sciences 106, 15103–15110. https://doi.org/10.1073/ pnas.0905235106
Nethaji, M., Ahilan, B., Kathirvelpandiyan, A., Felix, N., Uma, A., Mosses, T.L.S.S., Lingam, R.S.S., 2022. Biofloc meal incorporated diet improves the growth and physiological responses of Penaeus vannamei. Aquaculture International. https://doi.org/10.1007/s10499-022-00929-0
Øverland, M., Skrede, A., 2017. Yeast derived from lignocellulosic biomass as a sustainable feed resource for use in aquaculture. J Sci Food Agric 97, 733–742. https:// doi.org/10.1002/jsfa.8007
Pahlow, M., van Oel, P.R., Mekonnen, M.M., Hoekstra, A.Y., 2015. Increasing pressure on freshwater resources due to terrestrial feed ingredients for aquaculture production. Science of The Total Environment 536, 847–857. https:// doi.org/10.1016/j.scitotenv.2015.07.124
Panini, R.L., Pinto, S.S., Nóbrega, R.O., Vieira, F.N., Fracalossi, D.M., Samuels, R.I., Prudêncio, E.S., Silva, C.P., Amboni, R.D.M.C., 2017. Effects of dietary replacement of fishmeal by mealworm meal on muscle quality of farmed shrimp
Litopenaeus vannamei. Food Research International 102, 445–450. https://doi.org/10.1016/j.foodres.2017.09.017
Parisenti, J., Beirao, L.H., Maraschin, M., Mouriño, J.L., do Nascimiento Vieira, F., Bedin, L.H., Rodrigues, E., 2011. Pigmentation and carotenoid content of shrimp fed with Haematococcus pluvialis and soy lecithin. Aquac Nutr 17, e530–e535. https://doi.org/10.1111/j.13652095.2010.00794.x
Parolini, M., Ganzaroli, A., Bacenetti, J., 2020. Earthworm as an alternative protein source in poultry and fish farming: Current applications and future perspectives. Science of the Total Environment. https://doi.org/10.1016/j. scitotenv.2020.139460
Pelletier, N., Klinger, D.H., Sims, N.A., Yoshioka, J.-R., Kittinger, J.N., 2018. Nutritional Attributes, Substitutability, Scalability, and Environmental Intensity of an Illustrative Subset of Current and Future Protein Sources for Aquaculture Feeds: Joint Consideration of Potential Synergies and Tradeoffs. Environ Sci Technol 52, 5532–5544. https://doi. org/10.1021/acs.est.7b05468
Priyadarshani, I., Sahu, D., Rath, B., 2012. Algae in Aquaculture. Int J Health Sci Res 2, 108–114.
Ritala, A., Häkkinen, S.T., Toivari, M., Wiebe, M.G., 2017. Single Cell Protein—State-of-the-Art, Industrial Landscape and Patents 2001–2016. Front Microbiol 8. https://doi. org/10.3389/fmicb.2017.02009
Rumpold, B.A., Schlüter, O.K., 2013. Potential and challenges of insects as an innovative source for food and feed production. Innovative Food Science & Emerging Technologies 17, 1–11. https://doi.org/10.1016/j. ifset.2012.11.005
Sampantamit, T., Ho, L., van Echelpoel, W., Lachat, C., Goethals, P., 2020. Links and Trade-Offs between Fisheries and Environmental Protection in Relation to the Sustainable Development Goals in Thailand. Water (Basel) 12, 399. https://doi.org/10.3390/w12020399
Sangha, R.S., Puello Cruz, A.C., Chavez-Sanchez, M.C., Jones, D.A., 2000. Survival and growth of Litopenaeus vannamei (Boone) larvae fed a single dose of live algae and artificial diets with supplements. Aquac Res 31, 683–689. https:// doi.org/10.1046/j.1365-2109.2000.00487.x
Shao, J., Liu, M., Wang, B., Jiang, K., Wang, M., Wang, L., 2017. Evaluation of biofloc meal as an ingredient in diets for white shrimp Litopenaeus vannamei under practical conditions: Effect on growth performance, digestive enzymes and TOR signaling pathway. Aquaculture 479, 516–521. https://doi.org/10.1016/j.aquaculture.2017.06.034
Sharif, M., Zafar, M.H., Aqib, A.I., Saeed, M., Farag, M.R., Alagawany, M., 2021. Single cell protein: Sources, mechanism of production, nutritional value and its uses in aquaculture nutrition. Aquaculture 531, 735885. https://
- OCTUBRE 2022 79 NUTRICIÓN
1. Desempeño del camarón alimentado con las dietas experimentales
niveles de sustitución de harina de pescado por la fuente de proteína novel animal
TCE= Tasa de Crecimiento Específica; FCA= Factor de Conversión Alimenticia 0NP-A 19,16 ± 0,89a 4,95 ± 0,12a 229,86 ± 10,71a 100a 1,82 ± 0,13ab 25NP-A 19,43 ± 1,29a 4,99 ± 0,17a 207,61 ± 18,47ab 90 ± 12a 1,73 ± 0,11a 50NP-A 19,22 ± 0,64a 4,97 ± 0,09a 215,96 ± 27,53ab 94 ± 13a 1,79 ± 0,09ab 75NP-A 18,12 ± 1,49ab 4,80 ± 0,22ab 217,41 ± 17,94ab 100a 1,92 ± 0,24ab 100NP-A 17,55 ± 0,25b 4,72 ± 0,04b 210,58 ± 3,05b 100a 1,97 ± 0,02b Código Peso final (g) TCE (% día-1) Biomasa final (g tanque-1) Supervivencia(%) FCA
incremento en la expresión de ciertos genes relacionados a la inmunidad.
Conclusión
Para ofrecer un proceso ambientalmente amigable y sostenible en la producción de camarón, se debe buscar la maximización de las ganancias utilizando nuevos recursos de manera eficiente y minimizando el impacto social y ambiental. A pesar de que el conocimiento aún se encuentra en desarrollo, el área de investigación está comprometida en la búsqueda de ingredientes con mayor
disponibilidad y menor huella de carbono porque la innovación en la producción de alimentos acuícolas apoyará la sostenibilidad de la industria, su economía y mantendrá el ritmo de producción de camarón. Por la información aquí presentada, las nuevas alternativas son variadas y los resultados bastante prometedores, pero sin duda el lograr la sostenibilidad de la industria depende de cada uno de los eslabones del sector camaronero•
doi.org/10.1016/j.aquaculture.2020.735885
Shepherd, C.J., Jackson, A.J., 2013. Global fishmeal and fish-oil supply: inputs, outputs and markets. J Fish Biol 83, 1046–1066. https://doi.org/10.1111/jfb.12224
Sowa, S.M., Keeley, L.L., 1996. Free amino acids in the hemolymph of the cockroach, Blaberus discoidalis. Comp Biochem Physiol A Physiol 113, 131–134. https://doi. org/10.1016/0300-9629(95)02043-8
Thilsted, S.H., Thorne-Lyman, A., Webb, P., Bogard, J.R., Subasinghe, R., Phillips, M.J., Allison, E.H., 2016. Sustaining healthy diets: The role of capture fisheries and aquaculture for improving nutrition in the post-2015 era. Food Policy 61, 126–131. https://doi.org/10.1016/j.foodpol.2016.02.005
Tlusty, M.F., Thorsen, Ø., 2017. Claiming seafood is ‘sustainable’ risks limiting improvements. Fish and Fisheries 18, 340–346. https://doi.org/10.1111/faf.12170
Tabla 2. Resultados de dos estudios realizados en postlarvas y juveniles de camarón L. vannamei alimentados con diferentes niveles de substitución de harina de pescado por harina biofloc.

a. Estudio en postlarvas L. vannamei (Nethaji et al., 2022)
Código Peso final(g) TCE(% día-1) Peso ganado(g) Supervivencia(%) FCA
C 0,82
± 0,02c 48d 1,63 ± 0,03ab
BFT0 0,85 ± 0,03c 5,50 ± 0,20b 0,81 ± 0,03c 53c 1,62 ± 0,02a
BFT10 0,86 ± 0,01bc 5,61 ± 0,11b 0,82 ± 0,03c 55bc 1,52 ± 0,02cd
BFT20 1,02 ± 0,08b 5,81 ± 0,16ab 0,99 ± 0,08b 59ab 1,55 ± 0,03bc
BFT30 1,30 ± 0,06a 6,21 ± 0,01a 1,27 ± 0,06a 62a 1,38 ± 0,01c BFT40 0,99 ± 0,01bc 5,84 ± 0,01ab 0,96 ± 0,01bc 60a 1,44 ± 0,03de
b. Estudio en juveniles L. vannamei (Shao et al., 2017) Código Peso final(g) TCE(% día-1) Biomasa del tanque (kg) PER FCA
HP 16,03 ± 0,87a 1,72 ± 0,13a 88,57 ± 4,72a 1,38 ± 0,14a 0,66 ± 0,07a BF 16,11 ± 0,85a 1,74 ± 0,13a 86,00 ± 5,38ab 1,39 ± 0,14a 0,67 ± 0,06a CD 13,57 ± 0,93b 1,33 ± 0,16b 76,88 ± 5,28b 0,97 ± 0,15b 0,46 ± 0,07b
TCE= Tasa de Crecimiento Específica; FCA= Factor
Proteica
Figura 2.
Litopenaeus vannamei.
tras la
de
(SPC)
de
Troell, M., Naylor, R.L., Metian, M., Beveridge, M., Tyedmers, P.H., Folke, C., Arrow, K.J., Barrett, S., Crépin, A.-S., Ehrlich, P.R., Gren, Å., Kautsky, N., Levin, S.A., Nyborg, K., Österblom, H., Polasky, S., Scheffer, M., Walker, B.H., Xepapadeas, T., de Zeeuw, A., 2014. Does aquaculture add resilience to the global food system? Proceedings of the National Academy of Sciences 111, 13257–13263. https://doi.org/10.1073/ pnas.1404067111
Turnbull, W.H., Leeds, A.R., Edwards, D.G., 1992. Mycoprotein reduces blood lipids in free-living subjects. Am J Clin Nutr 55, 415–419. https://doi.org/10.1093/ajcn/55.2.415
Ugalde, U.O., Castrillo, J.I., 2002. Single cell proteins from fungi and yeasts, in: Applied Mycology and Biotechnology. pp. 123–149. https://doi.org/10.1016/S18745334(02)80008-9
Vodounnou, D.S.J. v., Kpogue, D.N.S., Tossavi, C.E., Mennsah, G.A., Fiogbe, E.D., 2016. Effect of animal waste and vegetable compost on production and growth of earthworm (Eisenia fetida) during vermiculture. International Journal of Recycling of Organic Waste in Agriculture 5, 87–92. https:// doi.org/10.1007/s40093-016-0119-5
Walker, A.B., Berlinsky, D.L., 2011. Effects of partial replacement of fish meal protein by microalgae on growth, feed intake, and body composition of Atlantic cod. N Am J Aquac 73, 76–83. https://doi.org/10.1080/15222055.20 10.549030
Yue, Y.R., Liu, Y.J., Tian, L.X., Gan, L., Yang, H.J., Liang, G.Y., He, J.Y., 2013. The effect of dietary taurine supplementation on growth performance, feed utilization and taurine contents in tissues of juvenile white shrimp (Litopenaeus vannamei, Boone, 1931) fed with low-fishmeal diets. Aquac Res 44, 1317–1325. https://doi.org/10.1111/j.13652109.2012.03135.x
Zhou, M., Wu, Z., Liang, R., Gu, N., 2017. Effects of dietary taurine, carnitine and cholesterol supplementation on growth performance and immunological status of Litopenaeus vannamei under cold exposure. Aquac Res 48, 1279–1290. https://doi.org/10.1111/are.12970
- OCTUBRE 2022 80 NUTRICIÓN
Beneficios
inclusión
proteínas unicelulares
en la dieta
camarón
”
de Conversión Alimenticia; PER= Tasa de Eficiencia
± 0,05c 5,53 ± 0,02b 0,80

La biorremediación y sus beneficios a la producción acuícola y a los ambientes de cultivo
El concepto de acuicultura sostenible es cada vez más reconocido para incorporar dimensiones espaciales y temporales de parámetros ambientales, económicos y sociales. Para crear un marco conceptual para comprender y definir la acuicultura sostenible debemos considerar las múltiples variables que afectan esa sostenibilidad y viabilidad.
El sector camaronero acuícola debe ser proactivo y trabajar para desarrollar e implementar sistemas de gestión ambiental basados en las mejores prácticas de gestión (BMP) para prevenir o mitigar los impactos ambientales adversos. Además, se espera para este año de 2022 un crecimiento de 5-8 % más arriba de la producción de 2021, esta que ya fue casi 9% más grande que 2020 en el sector camaronero.
A pesar de la importancia de los mercados y de la rentabilidad para sostener el crecimiento de la industria del camarón, ha habido un enfoque tal vez limitado en la importancia de como comprender las enfermedades para influir en el desarrollo de la industria a nivel mundial o en ubicaciones geográficas específicas. Como ejemplo, podemos citar la producción de camarón en Ecuador, el mismo que teniendo brotes de algunas enfermedades como WSSV, AHPND, NHPb y vibriosis sistémica, ha logrado con resiliencia y adaptación, además que inicialmente con menor densidad de siembra en estanques, que son más grandes de lo que se puede observar en la mayoría de los otros países productores de camarón, aumentar su capacidad de producción a través de las buenas prácticas y utilización de conceptos de maduración de agua, suelos y monitoreo constante de la salud animal además de un uso mínimo de antibióticos y productos farmacéuticos. La utilización de probióticos y biorremediadores para manutención de la capacidad de carga de las piscinas son enfoques que se deben mantener para un saneamiento microbiano evitando así brotes de enfermedades.
En resumen, la industria del camarón en Ecuador es un ejemplo hoy de como lecciones de aplicar en la producción, prácticas de sostenibilidad ambiental, que pueden dirigir la industria a la sostenibilidad económica a largo plazo.

- OCTUBRE 2022
Autores: José Luiz Mourino Thiago Soligo jose.mourino@ufsc.br thiago.soligo@dsm.com Departamento de Acuacultura , Universidad Federal de Santa Catarina, Brasil DSM Nutritional Products Latin America San José, Costa Rica.
Es evidente hoy, que la microbiota intestinal afecta la susceptibilidad de los camarones a la infección por patógenos y que desempeña funciones fundamentales en la protección contra patógenos. Durante el crecimiento del camarón es evidente que la microbiota intestinal cambia conforme su desarrollo, sin embargo, ya se reconoce a través de las técnicas de metagenómica bacteriana, que cuando hay aumento de los miembros de las Gammaproteobacteria como los Vibrios aumenta también la mortalidad. Y por eso hay un monitoreo constante de vibrios en fincas de producción camaronera por su presencia estar asociada a riesgos.
Durante brotes de enfermedades, el cambio sustancial de la composición de la microbiota intestinal ocurre, pero hay también una evidente perdida de la diversidad microbiana. Existen evidencias actualmente de que los grados de desviación en la microbiota intestinal están estrechamente relacionados con la gravedad de la enfermedad del camarón, lo que refuerza que el equilibrio de una microbiota intestinal para conferir al animal una cierta resistencia contra los patógenos.
La triade hospedero patógeno y ambiente en estos casos es fuertemente evidenciada en el caso de los camarones, pues en el ambiente acuático los animales entran en contacto directo y continuo con el entorno, principalmente con la microbiotas del agua y sedimento. El entorno ejerce un profundo efecto sobre la microbiota intestinal de los camarones, resultando en distintas comunidades microbianas entre la microbiota intestinal, el agua y los sedimentos de cría correspondientes. La influencia alcanza más de la mitad de los taxones bacterianos intestinales, que también son compartidos entre el fondo y el agua de los estanques. En particular, en comparación con el agua de cría, la comunidad bacteriana en el intestino del camarón es más similar a la del sedimento del estanque que del agua. Ya en condiciones de campo, los camarones a menudo están coinfectados por múltiples patógenos que pueden acelerar y acentuar su mortalidad. Los alimentos no consumidos y los desechos excretados de los camarones generalmente causan el deterioro de la calidad del agua y los sedimentos durante el cultivo, lo que genera un ambiente

propicio para estos patógenos proliferaren y dominaren el ambiente.
Utilizando teorías ecológicas, la colonización estocástica conduce a las variaciones en la microbiota intestinal y por su vez, pueden hasta en estadios iniciales de desarrollo retrasar la madurez de la microbiota intestinal del camarón. En estanques camaroneros, dependiendo de las condiciones fisicoquímicas, cargas de nitrógeno y manejo, se alcanzan varias concentraciones y raciones de amoníaco, nitrito, nitrato y sulfitos que directamente interactúan con la microbiota del camarón.
Además de la aplicación de probióticos como aditivo para piensos, el concepto adicional de biorremediadores o “probióticos de agua” también es pertinente en la acuicultura, debido a la intrincada relación de los organismos acuáticos con su entorno circundante. Una gran mayoría de estudios ya comprobaron la una capacidad de biorremediación efectiva de algunas cepas de Bacillus spp. en términos de mejorar la calidad del agua y suelos, sin embargo, otros estudios no fueron efectivos. Esta diferencia de resultados puede ser por condiciones necesarias de estos microorganismos a actuaren, como necesidad de alcalinidad, pH, oxígeno o mismo nutrición bacteriana, o también por que ciertas cepas son mas especificas para el problema ambiental a ser combatido.
Una posible solución además de la selección de cepas con especificidad es utilizar, con
las cepas para cada acción, un combo multi cepa que proporcionará más efectividad en combatir las altas concentraciones de amonio, materia orgánica, nitrógeno, sulfuros y hasta inhibir o modificar las proporciones de los vibriones del fondo de los estanques, generando un efecto sinérgico en contraste con el uso de un probiótico de una sola cepa. Actualmente existen microrganismos heterótrofos biorremediadores no usuales en acuacultura, además de los Lactobacillus spp y Bacillus spp ampliamente utilizados en diferentes productos, que logran por ejemplo, producir oxido-nítrito reductasa (enzimas para reducción de nitrito), como algunas cepas del microorganismo Paracoccus, que son capaces de producir hasta cuatro oxido-reductasas requeridas para la vía de desnitrificación. Por ser un género versátil y por poseer una amplia gama de diversas capacidades degradativas y aplicaciones potenciales en biorremediación, se han utilizado ellas para diversos fines de biorremediación, como, por ejemplo, bajar niveles de sulfuros en condiciones anoxias.
Ellas utilizan el sulfuro como fuentes de energía, degradando compuestos ricos en carbono. Otras cepas aisladas de este mismo grupo son capaces de hacer lo que llamamos de “desnitrificación aeróbica”, la disimilación completa de nitrato a di nitrógeno (u óxido nitroso) en condiciones de crecimiento aeróbico. Estos microorganismos quimiorganotrofos también pueden oxidar el amoníaco a nitrito durante su crecimiento utilizando fuentes de energía orgánica, lo que llamamos de nitrificación heterótrofa.
- OCTUBRE 2022 83 PRODUCCIÓN
Figura 1- altos niveles de material orgánico
Acoplada a la desnitrificación, la nitrificación heterótrofa permite la transformación completa del amoníaco en di nitrógeno por un solo organismo.Además de este ejemplo no usual en productos de biorremediación para acuacultura, hay microrganismos como los de la familia Thiobacillus, que se pueden utilizar para reducir los niveles de sulfuros en piscinas camaroneras. Los estudios indican que las bacterias reductoras de sulfuros tardan suficiente tiempo en establecerse en las piscinas recién construidas y, por lo tanto, las tasas iniciales de eliminación de sulfato no son alentadoras al inicio, pero después de su colonización inicial, son altamente efectivas en esta remoción. Este género es capaz de crecer en un hábitat que tiene compuestos de azufre inorgánicos u orgánicos reducidos.
Cuando miramos los diferentes productos de biorremediación en acuacultura, pocos aun, utilizan géneros tan diversos en el tratamiento de compuestos tóxicos (Ej. sulfuro de hidrógeno). El azufre liberado por la degradación de las proteínas de plantas y animales en descomposición se acumula en el fondo de las piscinas, luego se oxida aeróbica o anaeróbicamente a sulfato y luego a azufre. Este azufre se utiliza para producir H2S por lo que se incorpora en el proceso de reducción de sulfato anaeróbico. Esta oxidación del sulfuro puede proceder en condiciones libres de oxígeno, utilizando nitrato como aceptor de electrones. La oxidación del sulfuro en condiciones anóxicas es llevada a cabo principalmente por bacterias del género Thiobacillus en fondos. Un representante prominente no convencional para la reducción de nitratos en acuacultura es una especie de Thiobacillus, el Thiobacillus denitrificans, este género además de tener estas características de reducir los sulfuros también puede utilizar el nitrito o nitrato como aceptor terminal de electrones.

Generalmente, para definir bacterias efectivas para biorremediación en acuacultura evaluamos la producción enzimática de ellas en diferentes condiciones, como por ejemplo la producción proteasas en diferentes pH´s con o sin oxígeno. Existen hoy en el mercado acuícola, productos que pueden estar fortificados para nutrir los microorganismos biorremediadores o mismo potenciar su efecto, como por ejemplo la utilización
conjunta de microrganismos multicepa con aminoácidos, prebioticos, una amplia gama de vitaminas y minerales, además de una importante contribución de enzimas proteolíticas. Las enzimas producidas por los microrganismos aumenta la disponibilidad de compuestos previamente rompidos para una más fácil degradación y oxidación en las piscinas.
En general, la biorremediación implica el uso de microorganismos y sus enzimas para la degradación y transformación de contaminantes en otra forma que sea menos tóxica para el medio ambiente y
principalmente para el camarón. En suelos, en comparación con los microrganismos, las enzimas son más específicas de su sustrato y de naturaleza móvil debido a su tamaño más pequeño. Por su vez su utilización conjunta con microrganismos puede mejorar la calidad del agua, a través de la reducción de metabolitos tóxicos, mejorar de las condiciones de los sedimentos, control de los niveles de materia orgánica además de modular y prospectar una microbiota más saludable que influía la salud del camarón, lo dejando con cierta robustez sin perder la sostenibilidad del cultivo del camarón•
- OCTUBRE 2022 84 PRODUCCIÓN
Figura 2- Producción de proteasa por diferentes cepas de Bacillus.
Figura 3-Exceso de material orgánico y compuestos tóxicos ocasionan mortalidad y pérdida de calidad del camarón cultivado.

Efecto de probióticos en la producción y salud de postlarvas del Camarón Blanco del Pacífico
Los resultados mostraron una mejor producción y supervivencia en el ensayo de AHPND.
Los probióticos comerciales evaluados en este ensayo aumentaron la producción del camarón en laboratorio y mejoraron la calidad y la resistencia a enfermedades de las postlarvas.

Autores:
Jack Crockett
Autor para correspondencia
BiOWISH Technologies Inc. Cincinnati, Ohio 45208 EE. UU. Jcrockett@biowishtech.com
Loc Tran, Ph.D.
Laboratorio ShrimpVet Universidad de Nong Lam, ciudad de Thu Duc, HCMC Vietnam
Richard Carpintero, Ph.D.
BiOWISH Technologies Inc. Cincinnati, Ohio 45208 EE. UU.
Sih Yang Sim, Ph.D.
BiOWISH Technologies Inc. Cincinnati, Ohio 45208 EE. UU.
Josh Ison, Doctor en Filosofía.
BiOWISH Technologies Inc. Cincinnati, Ohio 45208 EE. UU.
Este
artículo presenta los resultados de una investigación llevada a cabo en el laboratorio ShrimpVet en la provincia de Ninh Thuan, Vietnam. El propósito de este ensayo fue evaluar la efectividad de la aplicación de un protocolo de tratamiento que involucra dos probióticos comerciales (BiOWiSH® AquaFarm y BiOWiSH® MultiBio 3PS) en la producción de postlarvas (PL) de camarón blanco del Pacífico (Litopenaeus vannamei) en laboratorio, en comparación con un protocolo de producción de PL que se basa en el intercambio de agua solo para controlar el nitrógeno inorgánico, los desechos orgánicos y los patógenos.
Configuración experimental
En el ensayo, hubo dos tratamientos con tres tanques réplica para cada tratamiento. El tratamiento 1 (T1) fue el control e implicó seguir las prácticas de bioseguridad establecidas en el laboratorio sin ningún tipo de probióticos. El intercambio de agua se realizó para mantener la calidad del agua en los tanques de cultivo de larvas, a una tasa de intercambio de 15 a 20 por ciento de agua de mar tratada por día. La bioseguridad del laboratorio incluyó el tratamiento del agua, la desinfección del laboratorio, sanitización del personal y la desinfección de alimentos vivos y frescos.
El tratamiento 2 (T2) usó los dos probióticos comerciales: el BiOWiSH® AquaFarm se usó para controlar el nitrógeno inorgánico e inhibir Vibrio en la columna de agua, y BiOWiSH® MultiBio 3PS se aplicó al alimento para mejorar la salud intestinal. El protocolo de intercambio de agua en el tratamiento 2 fue idéntico al del tratamiento 1, y la única diferencia entre los tratamientos fue la aplicación de los probióticos en el T2.
Los nauplios de L. vannamei utilizados en el ensayo fueron proporcionados por ShrimpVet, previamente examinados para detectar varias enfermedades del camarón, incluyendo al virus del síndrome de la Mancha Blanca (WSSV), el virus del síndrome de Taura (TSV), el virus de la Mionecrosis infecciosa (IMNV), la enfermedad de Necrosis Hepatopancreática Aguda (AHPND), y Enterocytozoon hepatopenaei (EHP) mediante técnicas de reacción en cadena de la polimerasa (PCR).
- OCTUBRE 2022PRODUCCIÓN
Primero se llenaron seis tanques de concreto (2.25 x 2.25 x 1.58 metros = 8 m3 cada uno) con 4.5 m3 de agua y se sembraron 450,000 nauplios 5 (N5) por tanque, todos los tanques fueron sembrados de la misma fuente. Luego, los tanques se llenaron hasta 7 m3 a medida que se agregaban algas, se seleccionaron al azar para ambos tratamientos y se utilizó la misma fuente de agua de mar. La salinidad inicial fue de 30 ppt, que se redujo gradualmente a 15 ppt antes de la cosecha. El intercambio de agua y el sifón del tanque fueron idénticos para ambos tratamientos.
El agua de mar utilizada en los tanques se filtró a través de filtros de arena y filtros de bolsa de malla (1.0 μm) antes de ser bombeada a un estanque de reserva para la desinfección primaria por cloración (30 ppm de hipoclorito de sodio durante 24 horas). Después de la cloración y la sedimentación de partículas, el agua se filtró a través de un cartucho de filtro (0.5 μm), luego se desinfectó con luz ultravioleta (UV) y se bombeó al depósito de agua de mar tratada. Antes de utilizar el agua de mar, se comprobó el cloro residual: si todavía había cloro, se aplicó tiosulfato de sodio, en una proporción de 1 ppm de tiosulfato por cada ppm de cloro residual.
Los parámetros de calidad del agua que incluyen temperatura, oxígeno disuelto (D.O.), pH, salinidad, nitrógeno amoniacal total (TAN) y nitrógeno nitrito (NO2-N) se mantuvieron en rangos óptimos para el
Vista de los tanques del laboratorio donde se realizó el ensayo (izquierda); y aplicación del probiótico a un tanque de cultivo de larvas (derecha).
crecimiento normal del camarón (Van Wyk et al., 1999). Se incluyó un equipo de análisis de calidad de agua, oxígeno disuelto con medidor electrónico, pH con sensor portátil, salinidad con refractómetro, nitrógeno amoniacal total y nitrógeno nitrito con kits de prueba colorimétricos. Se recogieron muestras de agua para el análisis bacteriano en agar triptona soja (TSA), agar (PCA) y agar tiosulfato citrato bilis sacarosa (TCBS).
En el tratamiento 2, se aplicó el probiótico AquaFarm al agua todos los días. Se aplicó un gramo de producto fermentado por m3 de volumen del tanque de Nauplio a Zoea3 (Z3).

Debido a que el alimento acumulado produce tanto amoníaco como nutrientes disponibles para Vibrio, se aplicaron dos gramos de producto fermentado por m3 de volumen de tanque desde las etapas mysis1 (M1) hasta postlarva10 (PL10).
Para el procedimiento de fermentación del probiótico BiOWiSH® AquaFarm, se debe consultar al autor de correspondencia. Se llevó a cabo una fermentación para que las esporas germinen y se conviertan en células vegetativas y puedan comenzar a actuar inmediatamente después de su aplicación.
Este estudio evaluó el efecto de dos probióticos comerciales en la producción y la salud de postlarvas del Camarón Blanco del Pacífico, y los resultados mostraron una mejora en la producción, la salud y supervivencia en el ensayo con AHPND. Las fotos proporcionadas por los autores muestran nauplios (izquierda); y postlarvas de 10 días, PL10 (centro) bajo el microscopio y nadando libremente en un tanque de larvas.
- OCTUBRE 2022 87 PRODUCCIÓN
Cada día se comenzaba un nuevo lote para su uso al día siguiente.
Se produjeron microalgas vivas (Thalassiosira pseudonana) y nauplios vivos de Artemia en el laboratorio en condiciones bioseguras. Las Artemias fueron esterilizadas con ácido fórmico antes de la alimentación. Se ofrecieron microalgas a las larvas desde los últimos estadios de nauplios, de modo que tras la metamorfosis al primer estadio de alimentación (Zoea1-2, Z1-2), las larvas pudieron comenzar a alimentarse de inmediato. La concentración algal objetivo fue de 5,000 a 10,000 células por ml. Las algas consumidas se reemplazaban diariamente.
En el tratamiento 2 por cada 100 gramos de alimento artificial, se aplicó al alimento 7 gramos de BiOWiSH® MultiBio 3PS (7 por ciento); la cantidad de alimento utilizada fue idéntica para cada tratamiento.

Todos los alimentos preparados se mantuvieron en recipientes herméticos debidamente identificados, a temperatura ambiente (~ 22-25 °C) hasta su uso. Para la etapa larvaria zoea3 (Z3), se suministraron alimentos artificiales con un tamaño de partícula de 10–80 μm y nauplios vivos de Artemia hasta ocho veces por período de 24 horas, hasta saciedad. Para las etapas de mysis, se suministró de la misma manera, alimento artificial de partículas de 50–150 μm de tamaño y Artemia
Las postlarvas se alimentaron con dietas artificiales que tenían un tamaño de partícula de 200 a 300 μm para PL1-8 y un tamaño de partícula de 300 a 500 μm para PL9-10. El alimento se aplicó a menudo en pequeñas cantidades, una vez cada 3 horas (ocho veces al día) durante cada período de 24 horas. Las postlarvas se cosecharon cuando alcanzaron la fase PL10 el día 17, y se recolectaron muestras para el análisis de la salud de las PL según el documento técnico de pesca de la FAO No. 450 (2003).
Al finalizar la prueba de laboratorio, un grupo de camarones de los 6 tanques de incubación se transfirió a una instalación de ensayo y se sometieron a una prueba de ensayo contra la enfermedad de Necrosis Hepatopancreática Aguda (AHPND).
Técnicos verificando la variación de tamaño y la condición del hepatopáncreas de las larvas de camarón en desarrollo durante la prueba.

Figura 1. Cantidad de alimento aplicado a cada tanque diariamente; los estadios larvarios (N5 a PL10) para cada día se presentan en el eje X.
Resultados y discusión
Los parámetros de calidad del agua monitoreados durante la prueba estuvieron dentro de los niveles aceptables para el cultivo de L. vannamei. Para el grupo T1 (control), los valores medios (y el rango) fueron los siguientes: temperatura del agua 30.4 °C (29.8 – 33 °C); oxígeno disuelto 6.5 mg/L (6.2 – 7.1 mg/L); pH 8.0 (7.9 – 8.1); nitrógeno amoniacal total, TAN 1.8 mg/L (0.0 – 2.0 mg/L); y nitrito 0.0 mg/L. Para el grupo T2 BiOWiSH: temperatura 30.3 °C (29.8 –33.4 °C); oxígeno disuelto 6.7 mg/L (6.1 –7.0 mg/L); pH 8.0 (7.7 – 8.2); TAN 1.4 mg/L (0.0 – 2.0 mg/L); y nitrito 0.0 mg/L. Cabe señalar que el TAN promedio fue un 22.2% más bajo para el tratamiento T2 BiOWiSH® que para el control T1.
La Figura 1 muestra la cantidad de alimento que se aplica diariamente a cada tanque para los estadios larvales en desarrollo, desde el nauplio 5 (N5) hasta la postlarva 10 (PL10). La etapa larvaria se detalla a continuación cada día.
La alimentación se incrementó continuamente durante la prueba y se realizó un cambio de agua diariamente de aproximadamente el 20 por ciento desde el día 8 hasta el día 17. La aplicación del probiótico BiOWiSH® AquaFarm activado se incrementó de 1 gramo a 2 gramos por m3 en el día 5.
Con respecto a los análisis bacterianos que realizamos durante el ensayo, la Figura 2 muestra los resultados para ambos tratamientos en agar TSA y PCA. Los
- OCTUBRE 2022 88 PRODUCCIÓN
Alimento artificial (48 -53% proteína)
Fase larvaria
Alimento (g)
recuentos bacterianos en ambos agares fueron más altos para el tratamiento 2 que para el tratamiento 1. La aplicación diaria de probióticos probablemente incrementó los recuentos bacterianos en el tratamiento 2. Los recuentos del PCA pueden ser más bajos que los recuentos del TSA porque el agar PCA carecía de los nutrientes requeridos por las bacterias fastidiosas. Las considerables diferencias entre los tratamientos en agar PCA implica que cada uno tenía una población bacteriana distinta.
La Figura 3 muestra los recuentos de Vibrio amarillo y verde para ambos tratamientos. Los recuentos de Vibrio amarillo son similares. En general, los Vibrio amarillos no son patógenos. Los recuentos de Vibrio verde son mayores en el tratamiento 1 que en el tratamiento 2. Muchos vibrios verdes pueden ser patógenos.
Los gráficos de la Figura 4 comparan los recuentos de bacterias heterótrofas totales con los recuentos de Vibrio verde. En el tratamiento 1 hay una diferencia de aproximadamente 2 log entre las bacterias heterótrofas totales y el Vibrio verde. Durante varios días hubo solo una diferencia de 1 log. En el tratamiento 2 hay una diferencia de aproximadamente 3 log entre las bacterias heterótrofas totales y el Vibrio verde durante la mayor parte del ensayo. Esto implica que el Vibrio verde fue inhibido por bacterias heterótrofas en el tratamiento 2.
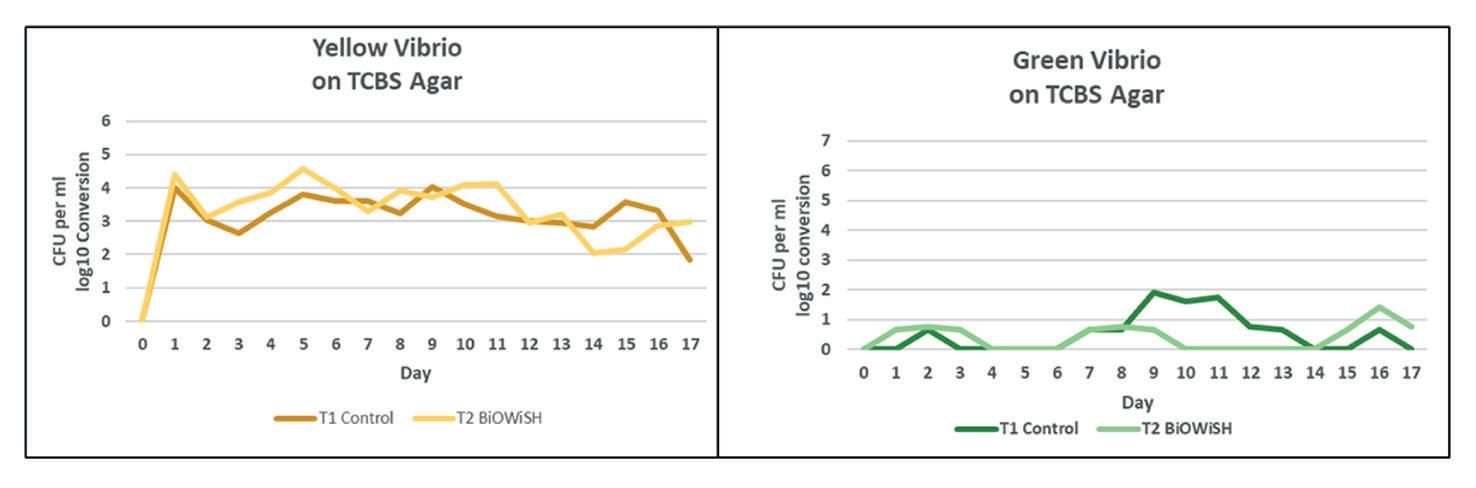
Durante la producción en laboratorio, la supervivencia del tratamiento 1 fue del 60.57%, mientras que la supervivencia del tratamiento 2 fue del 70.53%. Basados en la producción actual del laboratorio, este aumento de supervivencia sería equivalente a 148 millones de PL adicionales por año.
Cuando se cosecharon los tanques de incubación, se evaluó la salud de las postlarvas con una muestra de 30 PL puntuadas por tanque para varias categorías de salud. La puntuación varió de 0 a 10 (cuanto mayor sea el valor, mejor), y los resultados se muestran en la Tabla 1.
El tratamiento 2 obtuvo una puntuación más alta en todas las categorías excepto en la variación de tamaño, que fue idéntica para ambos tratamientos. La mejora de la salud
Total de Bacterias heterotróficas en agar TSA Colonias bacterianas en agar PCA
CFU por ml conversión log10 CFU por ml conversión log10
Día
Día
Figura 2. Resultados de ambos tratamientos para bacterias heterótrofas en agar TSA (izquierda) y colonias bacterianas en agar PCA (derecha).
Vibrio amarillo en agar TCBS
CFU por ml conversión log10
CFU por ml conversión log10
Vibrio verde en agar TCBS
Día Día
Figura 3. Recuentos de Vibrio amarillo y verde en agar TCBS para ambos tratamientos.
Total de Bacterias heterotróficas vs. Vibrio verde Control T1
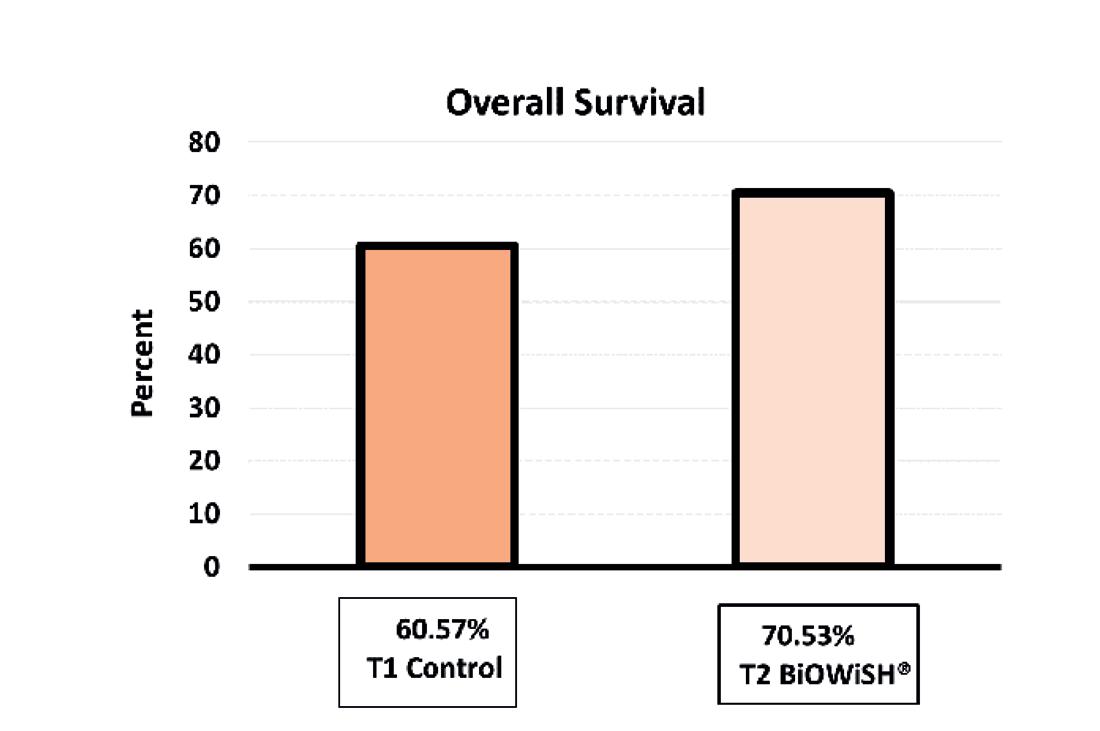


CFU por ml conversión log10 CFU por ml conversión log10
Total de Bacterias heterotróficas vs. Vibrio verde BiOWiSH® T2
Día Día
Figura 4. Comparación de recuentos de bacterias heterótrofas totales con recuentos de Vibrio verde para los tratamientos T1 y T2.
Supervivencia promedio
Porcentaje
Figura 5. Porcentaje de supervivencia del camarón para los tratamientos 1 y 2 durante la producción en laboratorio.
- OCTUBRE 2022 89 PRODUCCIÓN
en el tratamiento 2 probablemente podría atribuirse a una mayor supervivencia.
La prueba de ensayo de la enfermedad AHPND se llevó a cabo en el laboratorio ShrimpVet en la ciudad de Ho Chi Minh, Vietnam. Las postlarvas del ensayo se colocaron en tanques de 8 L sin recambio de agua durante un período de 14 días, y los resultados se presentan en la Figura 6. La supervivencia del control negativo fue del 100%, lo que indica que las condiciones en los tanques de prueba, además de la presencia de Vibrio parahaemolyticus, no causaban mortalidad. La supervivencia del tratamiento 1 fue del 37.6 por ciento en comparación con la supervivencia del tratamiento 2 del 48.7 por ciento. La mejora de la salud probablemente influyó en la resistencia a las enfermedades.
Conclusiones

La puntuación del análisis de salud fue un 39.7% mayor en el tratamiento 2. La
supervivencia a la enfermedad AHPND en el ensayo fue un 29.6% mayor en el tratamiento 2, lo que indica una mayor resistencia a la enfermedad. La supervivencia general de los camarones fue un 16.4% mayor en el tratamiento 2. Estos resultados indican que los probióticos BiOWiSH® utilizados en este ensayo, aumentaron la producción de camarón en laboratorio y mejoraron la calidad y la resistencia a las enfermedades de las postlarvas, muy similar a lo que ya se ha observado en los criaderos de camarones y peces, y sistemas de engorde•
Referencias disponibles con el autor de correspondencia.
Tabla 1. Evaluación de la salud de postlarvas según las diversas categorías evaluadas.

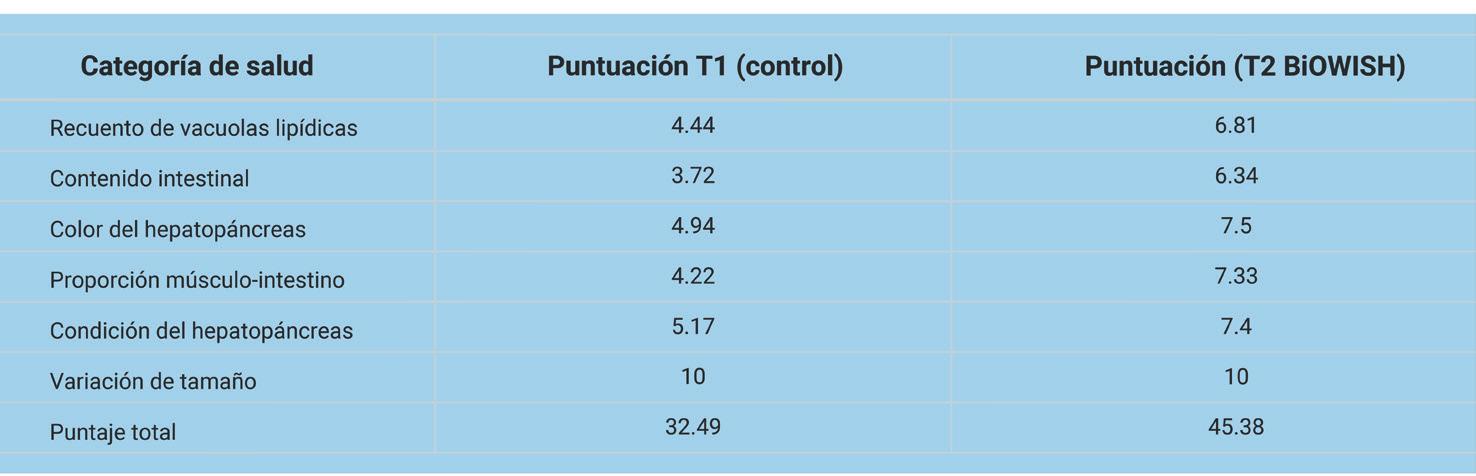
- OCTUBRE 2022 90
Figura 6. Resultados de supervivencia de camarón para la prueba de ensayo de AHPND.
Ensayo de supervivencia a enfermedad
Porcentaje
Para más información sobre este este artículo escriba a: Jcrockett@biowishtech.com

Cambios en la supervivencia, osmorregulación y hemocitos de postlarvas de Litopenaeus vannamei aclimatadas a diferentes intervalos de reducción de salinidad
Autores:
Mohsan Abrori a, b
Agoes Soegiantoa,*, 1 Dwi Winarnia
a Departamento de Biología, Facultad de Ciencia y Tecnología, Universitas Airlangga, Surabaya, Java Oriental, Indonesia
b Politeknik Kementerian Kelautan dan Perikanan (Politécnica Marina y Pesquera), Jembrana, Bali, Indonesia
*Dirección de Correspondencia: Departamento de Biología, Facultad de Ciencia y Tecnología, Universitas Airlangga, Jl. Mulyorejo, Surabaya, Indonesia.
abrori2727@gmail.com (M. Abrori)
agoes_soegianto@fst.unair.ac.id
agoes_soegianto@unair.ac.id (A. Soegianto), dwi-w@fst.unair.ac.id (D. Winarni)
Elcultivo de camarón en Indonesia ha crecido rápidamente, particularmente después de la introducción del camarón blanco (Litopenaeus vannamei) del Pacífico Sur en 2001. Este camarón se cultiva típicamente en sistemas semiintensivos a lo largo de la costa. Este camarón puede aumentar la producción de estanques de agua salobre debido a su alta tasa de supervivencia y su capacidad para vivir en una alta densidad de población (Tahe et al., 2011). Sin embargo, el aumento de producción del camarón blanco ahora se ve limitado por terrenos costeros limitados y costosos. La producción de camarón en tierras altas y costeras utilizando agua de baja salinidad de acuíferos es una alternativa adecuada para la acuicultura costera y la diversificación agrícola (Van Wyk et al., 1999; McGraw et al., 2002; McGraw y Scarpa, 2004). Muchos países, incluyendo a Indonesia, actualmente utilizan agua de baja salinidad de acuíferos para cultivar camarón (McGraw et al., 2002; Tahe et al., 2011).

Se cree que L. vannamei es una de las mejores opciones para el cultivo en tierras altas debido a su mayor tolerancia a bajas salinidades que otras especies como L. setiferus, L. stylirostris y P. chinensis (Keiser y Aldrich, 1976; Chen et al., 1996; Su et al., 2005; Jayasankar et al., 2009). Estudios previos han reportado que L. vannamei se puede cultivar con éxito en condiciones de baja salinidad (Samocha et al., 1998, 2002; Ednoff, 2001). La supervivencia en las fases iniciales de cultivo, por otro lado, depende principalmente de la aclimatación a ambientes de baja salinidad (Laramore et al., 2001; McGraw et al., 2002; McGraw y Scarpa, 2004). Las postlarvas (PL) de laboratorios comerciales generalmente se transportan a altas salinidades. Para transferir y cultivar con éxito estas PL en bajas salinidades, el primer paso tendría que ser desarrollar una técnica de aclimatación a la salinidad. La habilidad de responder a los cambios fisiológicos en las PLs es una función importante de manejo para las transferencias de PLs de los laboratorios a las camaroneras (Samocha et al., 2002; McGraw y Scarpa, 2004).
Los cambios en la salinidad del ambiente pueden alterar el equilibrio osmótico del camarón. Los camarones pueden tener que
- OCTUBRE 2022PRODUCCIÓN
www.sciencedirect.com/science/article/pii/ S2352513422002186
gastar una significativa cantidad de energía para ajustar el equilibrio osmótico (Feng et al., 2008; Chong-Robles et al.,2014). La osmorregulación depende en gran medida de la acción de la actividad Na+-K+-ATPasa (NKA), agua y concentraciones iónicas de hemolinfa tales como Na+, K+, y Cl (Péqueux et al., 2006; Charmantier et al., 2009; Pham et al., 2012). Las branquias proporcionan la mayor parte de la función osmorreguladora cuando los animales se transfieren de aguas salinas altas a bajas (Charmantier, 1998; Péqueux et al., 2006; Pham et al., 2012). Además, el estrés por salinidad puede debilitar la inmunidad del camarón, lo que puede estar asociado con la disminución de los niveles totales de hemocitos, lo que hace que los camarones sean más vulnerables a infecciones (Jia et al., 2014). El objetivo de este estudio fue evaluar el estrés osmótico en PL de L. vannamei que van desde agua de mar (35‰) a una baja salinidad (5‰) con diferentes niveles de estrés osmótico progresivo. La supervivencia, osmolaridad de la hemolinfa, el nivel de iones (Na+, K+, Cl ), Na+-K+-ATPasa y el recuento total de hemocitos, estuvieron entre los parámetros evaluados.
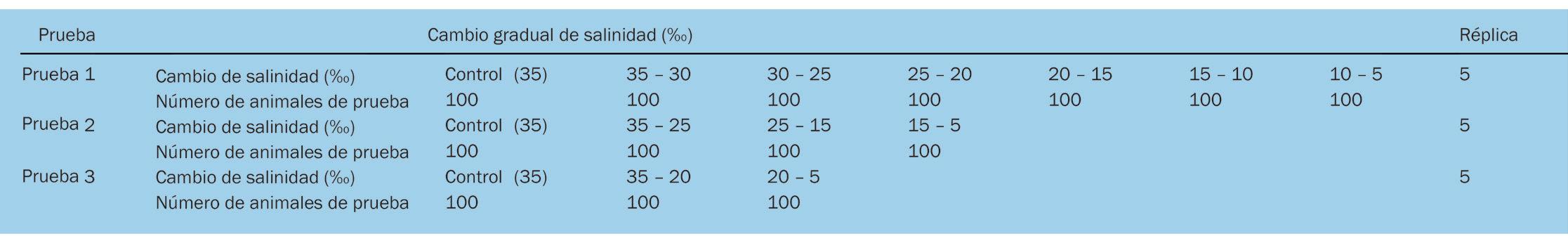
Materiales y métodos Aclimatación
Los experimentos se realizaron en la Estación Politécnica Marina y Pesquera de Sidoarjo (SMFPS) en Paciran, Java Oriental, Indonesia.
Las postlarvas (PL) experimentales de Litopenaeus vannamei libres de patógenos se obtuvieron de un laboratorio comercial de camarón en Situbondo, Java Oriental.
Las postlarvas utilizadas en este estudio eran genéticamente idénticas, ya que todas derivan de un único progenitor. Se recibieron postlarvas (PL) de siete días de edad y se aclimataron a un tanque de retención de 4000 L durante 5 días para obtener PL12
que se utilizaron en este experimento. El uso de PL12 se basó en una práctica común entre los productores locales al introducir postlarvas en los estanques. La aclimatación y todos los ensayos se realizaron bajo las mismas condiciones: aireación continua, fotoperiodo de 12 h de luz y 12 h de oscuridad, temperatura del agua de 3031°C, pH de 7.8-8.3 y oxígeno disuelto de 6.7-7.2 mg/L.
El agua de mar (35 ‰) se obtuvo del mar de Java a través de una tubería a la SMFPS, luego se filtró a través de un filtro de arena y se almacenó en un tanque de retención de agua de mar durante al menos 24 h antes de ser utilizada para la aclimatación y la experimentación. Dado que la osmorregulación requería energía, las PL fueron alimentadas con Artemia viva dos veces al día durante la aclimatación (ChongRobles et al., 2014).
Prueba de tolerancia a la salinidad Una prueba preliminar reveló que la mayoría de las PL morían y tenían un exoesqueleto blando a 0‰, por lo que los ajustes de salinidad utilizados en este estudio duraron hasta 5‰. Se realizaron tres sets de ensayos para examinar los efectos de la reducción de la salinidad de 35‰ a 5‰ con tres intervalos diferentes (5, 10 y 15‰ por 24 h) en la reducción de la salinidad. Cada ensayo constaba de cinco repeticiones. La salinidad se redujo agregando agua dulce a intervalos de 24 h hasta alcanzar la salinidad deseada. El agua dulce se obtuvo del agua subterránea. Durante estos tres ensayos, las PLs fueron alimentadas con Artemia viva dos veces al día. Cada día, alrededor de 200 Artemias vivas fueron alimentadas a los animales de prueba. Los detritos y residuos de muda en el fondo del tanque se sifonearon todos los días.
Para la primera prueba (Prueba 1), aproximadamente 100 PL12 se colocaron en cada uno de siete tanques diferentes de 10 L (Tabla 1). A intervalos de 24 horas, la salinidad se redujo gradualmente en 5‰ mediante la adición de agua dulce, excepto en el control. El ensayo se llevó a cabo en 6x24 h. Al final de cada período de aclimatación se calculó el porcentaje de supervivencia (SP), y 25 post larvas fueron recolectadas, anestesiadas por enfriamiento rápido, y se midió: el nivel de osmolaridad de la hemolinfa (HO), iones (Na+, Cl , K+) y recuento total de hemocitos (THC), así como 25 post larvas para Na+/K+-ATPasa (NKA) de todo el cuerpo.
Se colocaron aproximadamente 100 PL12 en cada uno de los cuatro tanques diferentes de 10 L en la segunda prueba (Prueba 2). La salinidad se redujo gradualmente en un 10‰ a intervalos de 24 horas mediante la adición de agua dulce (Tabla 1). El ensayo se completó en 3x24 h. Luego se evaluaron los mismos parámetros que en la primera prueba al final de cada período de aclimatación. Para el tercer ensayo (Prueba 3), se colocaron 100 PL12 en cada uno de los tres tanques diferentes de 10 L (Tabla 1). La salinidad se redujo constantemente en un 15‰ a intervalos de 24 horas mediante la adición de agua dulce. El ensayo finalizó en 2x24 h. Luego se examinaron parámetros similares a los de la primera prueba al final de cada período de aclimatación.
Medición del porcentaje de supervivencia, osmolaridad de la hemolinfa, nivel de iones, NKA y recuento total de hemocitos
En cada ensayo se determinó el número de supervivientes cada 24 h después del choque osmótico. La supervivencia se expresó como porcentaje (S% = (número final de PL vivas/número inicial de PL) X100) para
Tabla 1. Número de postlarvas de Litopenaeus vannamei utilizadas durante el ensayo de supervivencia con un cambio de salinidad cada 24 h.
Nota: Prueba 1: la salinidad se redujo de manera constante a 5‰ a intervalos de 24 horas mediante la adición de agua dulce.
Prueba 2: la salinidad se redujo de manera constante a 10‰ a intervalos de 24 horas mediante la adición de agua dulce. Prueba 3: la salinidad se redujo de manera constante a 15‰ a intervalos de 24 horas mediante la adición de agua dulce. El control (35‰) de todos los ensayos se terminó después de 24 h.
- OCTUBRE 2022 93 PRODUCCIÓN
cada choque post osmótico (Chong-Robles et al., 2014).
La recolección de hemolinfa de las PL se realizó a través del siguiente procedimiento. Los tubos colectores de hemolinfa se fabricaron cortando el fondo de tubos tipo Eppendorf de 0.5 ml. Se montó el tubo tipo Eppendorf de 0.5 ml en un tubo tipo Eppendorf de 1.5 ml, con un pequeño trozo de malla de nylon insertado entre la columna y el tubo. Se analizaron aproximadamente 25 PLs de cada tratamiento, se limpiaron con PBS, se colocaron en papel de seda para absorber el PBS residual, se arrancó el cefalotórax de las PL con pinzas, se transfirieron rápidamente a los tubos colectores de hemolinfa y se centrifugó durante 5 min a 5000 rpm a 4°C. Una pequeña gota de hemolinfa se recogió en el fondo del tubo (Bai y Tatar, 2012; Huang et al., 2015).
Se midió una muestra de hemolinfa de 20 µL de un tubo colector de hemolinfa y se expresó en mOsm/kg utilizando un osmómetro de micromuestras Fiske® 210 (Norwood, MA, EE. UU.).
Para determinar los niveles de Na+, Cl– y K+, se tomó 25 µL de hemolinfa y se diluyó con 25 µL de agua desionizada, se agitó y luego se analizaron 22 µL de muestra de hemolinfa diluida usando un analizador de electrolitos (SpotChem EL SE-1520, Kyoto, Japón) y se expresaron en mmol/L.
La NKA de las branquias se determinó mediante un sándwich-ELISA según lo descrito por Handayani et al. (2020). Se lavaron aproximadamente 25 PL en PBS (pH 7.4), se pesaron y se colocaron en tubos tipo Eppendorf de 1.5 ml antes de homogeneizarse en PBS sobre hielo con un homogeneizador de vidrio. Después de eso, se centrifugó a 4°C durante unos 20 min a 2000–3000 rpm. Todas las placas de microtitulación habían sido recubiertas previamente con un anticuerpo anti-NKA (Bioassay Technology Laboratory Biotech Co. Ltd, Shanghái, China). Para determinar el nivel de NKA, cada placa microtituladora obtuvo una muestra estándar de 50 µL, una en blanco y una muestra de 40 µL. Inmediatamente, se agregaron 10 µL de anticuerpo anti-NKA y 50 µL de estreptavidina-peroxidasa de rábano picante
Fig. 1. Porcentaje de supervivencia de postlarvas (PL12) de Litopenaeus vannamei aclimatadas a diferentes intervalos de reducción de salinidad. Las letras diferentes indican una diferencia significativa (p < 0.05).
Fig. 2. Osmolaridad de postlarvas (PL12) de Litopenaeus vannamei aclimatadas a diferentes intervalos de reducción de salinidad. Las letras diferentes indican una diferencia significativa (p < 0.05).
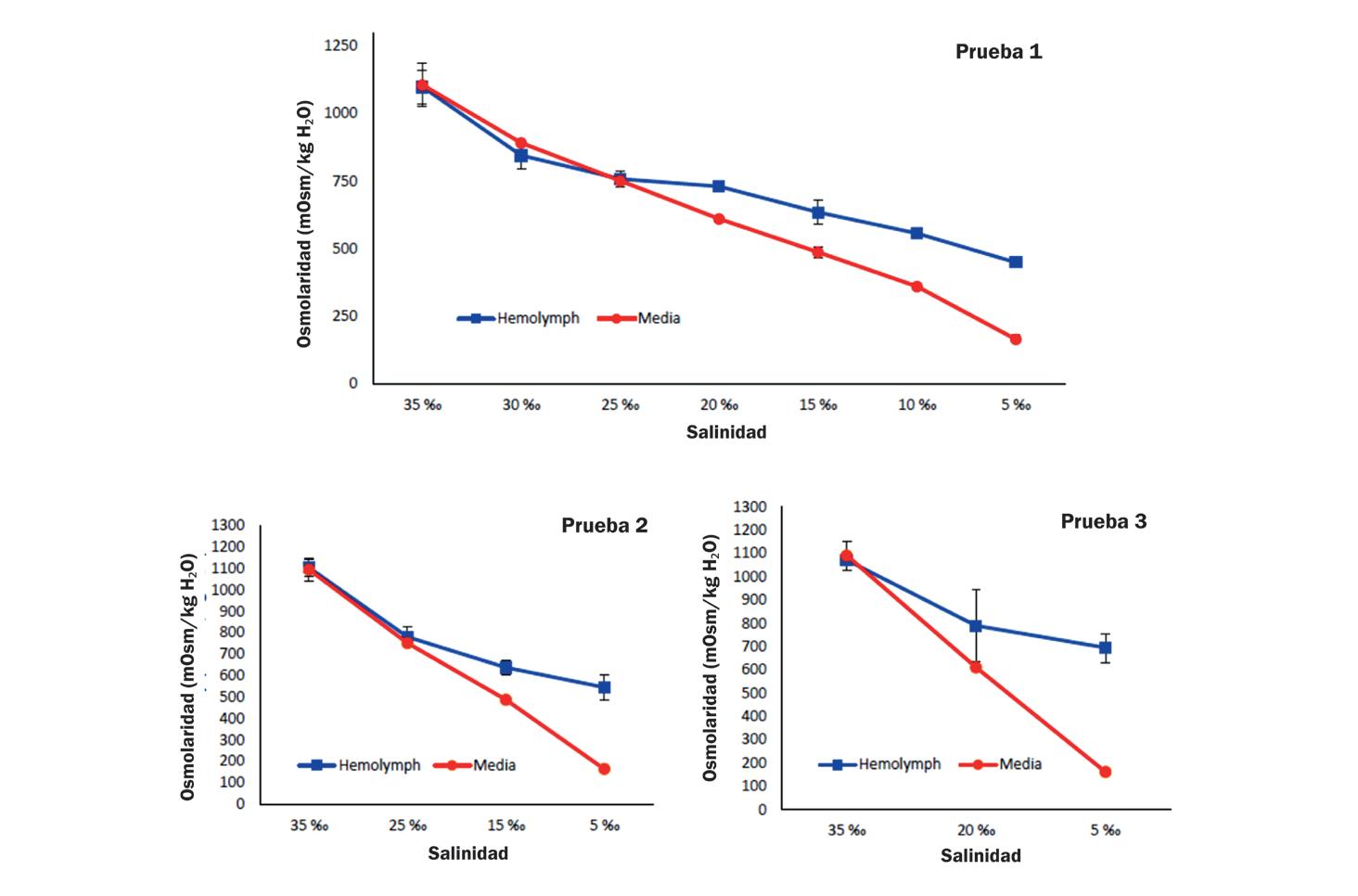

a cada placa excepto el control en blanco. A continuación, las placas de microtitulación se mezclaron por completo, se cubrieron con un sellador y se incubaron a 37°C durante 60 min.
Después de retirar el sellador, la placa se aspiró automáticamente y se limpió 5 veces con un tampón de lavado. Se limpió el plato usando toallas de papel. En cada placa, se colocó 50 µL de solución de sustrato A y 50
µL de la solución de sustrato B, se sellaron y se incubaron a 37°C en la oscuridad durante aproximadamente 10 min. Para detener la reacción enzimática, se añadió a cada placa 50 µL de solución stop. Después de 10 min de administrar la solución stop, y el color azul se convirtió inmediatamente en amarillo, la muestra se analizó con un lector de microplacas automatizado (Bio-Rad, modelo iMark, Japón) a 450 nm. El nivel de NKA se dio en ng/ml. Todos los reactivos utilizados
- OCTUBRE 2022 94 PRODUCCIÓN
para analizar NKA fueron proporcionados por Bioassay Technology Laboratory Biotech Co. Ltd, Shanghái, China.
Se añadieron aproximadamente 25 µL de hemolinfa a un tubo Eppendorf que contenía 225 µL de solución de azul de tripano. Se colocó una gota de hemolinfa en solución de azul de tripano en un hemocitómetro y se calculó el recuento total de hemocitos (THC) utilizando un microscopio óptico. (Supamattaya et al., 2005).
Análisis estadístico
Todos los resultados se proporcionaron como medias de desviaciones estándar. Antes del análisis, la data porcentual se convirtió en arcoseno y se proporcionaron valores reales. Se utilizó IBM® SPSS® Statistics versión 25 para el análisis estadístico. Las diferencias de los tratamientos de salinidad se evaluaron mediante un análisis de varianza (ANOVA) de una vía, y se consideró significativa una p < 0.05. Se utilizaron pruebas de comparación múltiple de Tukey (p < 0.05) para categorizar las medias de los tratamientos.
Resultados
Los efectos de reducir la salinidad de 35‰ a 5‰ con tres diferentes intervalos de reducción de salinidad sobre la supervivencia de postlarvas de P. vannamei se muestran en la Fig. 1. La supervivencia de las postlarvas disminuyó a medida que disminuyó la salinidad del medio. En el ensayo 1 (la prueba se realizó en 6x24 h), la supervivencia de las postlarvas no fue significativamente diferente a los 35, 30 y 25‰, disminuyó ligeramente a los 20 y 15‰, y se redujo significativamente a 91% y 90% a salinidades de 10 y 5‰, respectivamente (p < 0.05) (Fig. 1). En el ensayo 2 (la prueba se terminó en 3x24 h), la supervivencia de las postlarvas no fue significativamente diferente a 35 y 25‰, luego se redujo significativamente a 83% y 80% a salinidades de 15 y 5‰, respectivamente (p < 0.05) (Fig. 1). En el ensayo 3 (la prueba se completó en 2x24 h), la supervivencia de las postlarvas se redujo significativamente al 82% y al 58% con una salinidad del 20% y el 5%, respectivamente (p < 0.05) (Fig. 1). La aclimatación con una reducción de la salinidad de 15‰/24 h resultó en el menor porcentaje de supervivencia en comparación con la aclimatación con una reducción de
Fig. 3. Nivel de Na+ en postlarvas (PL12) de Litopenaeus vannamei aclimatadas a diferentes intervalos de reducción de salinidad. Las letras diferentes indican una diferencia significativa (p < 0.05).

Fig. 4. Nivel de Cl- en postlarvas (PL12) de Litopenaeus vannamei aclimatadas a diferentes intervalos de reducción de salinidad. Las letras diferentes indican una diferencia significativa (p < 0.05). salinidad de 10‰/24 h y 5‰/24 h.
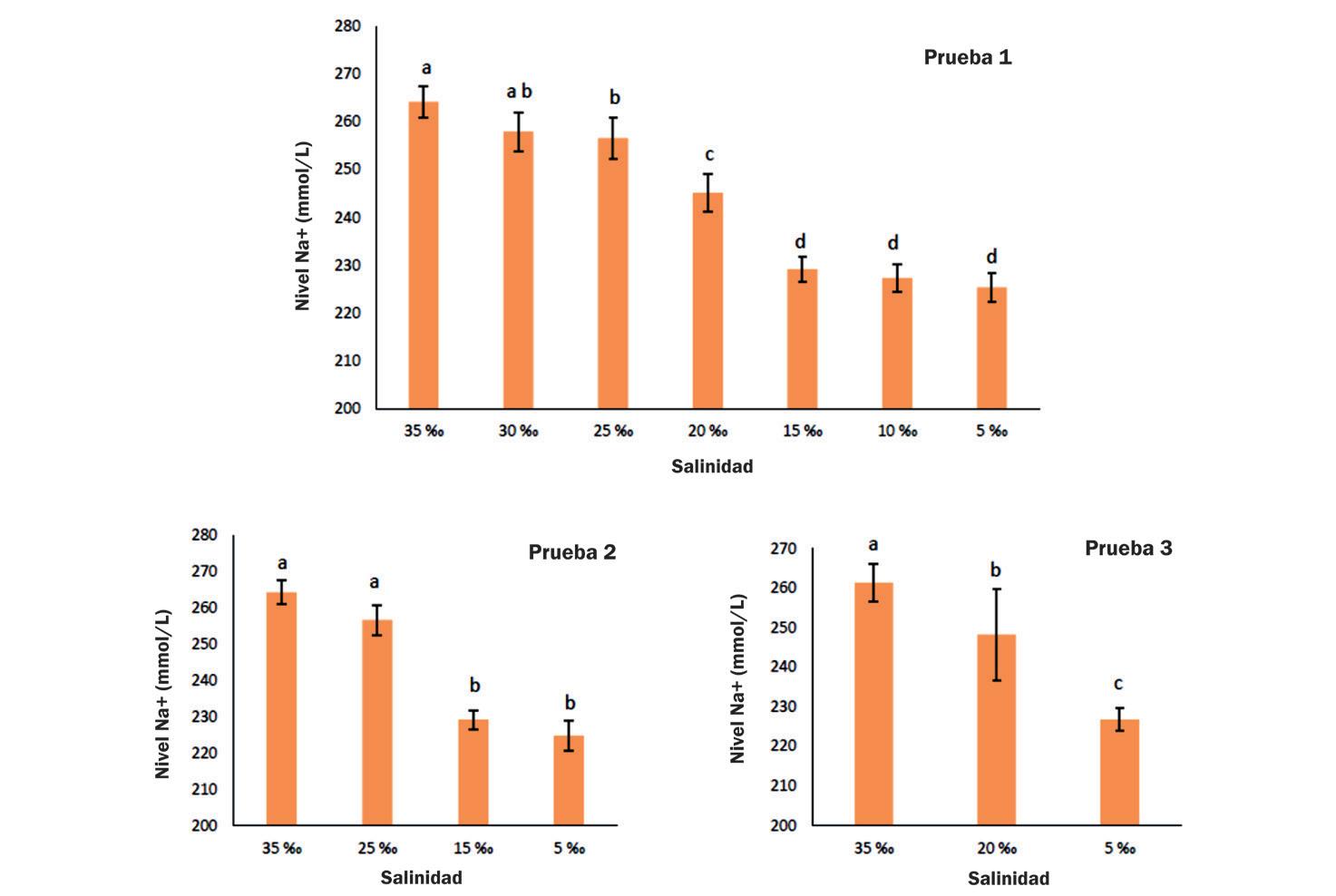
En la Prueba 1, a 35‰, la osmolaridad del medio fue de 1107 mOsm/kg H2O, la hemolinfa fue de 1100 mOsm/kg H2O y las PL mostraron una ligera condición hipoosmótica. Cuando las PL se transfirieron a salinidades más bajas, la osmolaridad de la hemolinfa disminuyó significativamente (p < 0.05) con salinidades decrecientes. A 30‰, las PL estaban en condición hipoosmótica.
Sin embargo, a salinidades entre 20‰ y 5‰, las PL demostraron una condición hiperosmótica. El rango de osmolaridad en la hemolinfa fue más estrecho (1107 – 450 mOsm/kg) que en medios (1100 –165 mOsm/kg) con salinidades variadas de 35–5‰. El punto isosmótico estimado a partir de la osmolaridad del medio y la hemolinfa fue de alrededor de 752 mOsm/ kg H2O, lo que corresponde a una salinidad de 25‰ (Fig. 2). En la Prueba 2, el punto
- OCTUBRE 2022 95 PRODUCCIÓN
isosmótico parece ser de aproximadamente 25‰, los camarones exhiben un estado osmoconformador entre 35 y 25‰ y una condición hiperosmótica entre 15 y 5‰ (Fig. 2). En la Prueba 3, el punto isosmótico se movió a una salinidad de alrededor del 30‰, mientras que los camarones eran hiperosmóticos a una salinidad de 20 a 5‰ (Fig. 2). Vale la pena señalar que al final de cada prueba, que llegó a 5‰, la osmolaridad de las PL en la Prueba 3 (696 mOsm/kg) fue mucho mayor que en la Prueba 1 (450 mOsm/kg) y la Prueba 2 (546 mOsm/kg). kg).
Los niveles de hemolinfa Na+, Cl y K+ de las PL disminuyeron significativamente cuando la salinidad externa disminuyó en todos los ensayos (Figs. 3, 4 y 5). En el Ensayo 1, el nivel de Na+ de la hemolinfa disminuyó a partir del 30‰, pero no fue significativamente diferente a 25‰ y 20‰, luego disminuyó nuevamente de 15‰ a 5‰. Los niveles de Na+ se redujeron gradualmente de 35‰ a 5‰ en los Ensayos 2 y Ensayo 3 (Fig. 3).
En el Ensayo 1, el nivel de Cl en la hemolinfa de PL no cambió entre 35‰ y 30‰, disminuyó significativamente de 25‰ a 15‰ y permaneció estable de 15‰ a 5‰. En el Ensayo 2, el nivel de Cl no cambió entre 35‰ y 25‰, disminuyó significativamente a 15‰ y se mantuvo estable entre 15‰ y 5‰. El nivel de Cl disminuyó significativamente de 35‰ a 5‰ en el Ensayo 3 (Fig. 4).
En el Ensayo 1, los niveles de K+ en la hemolinfa no fueron sustancialmente diferente a 35‰, 30‰ y 25‰, disminuyó significativamente al 20 ‰ y se mantuvo constante desde 20‰ a 5‰. En el ensayo 2, el nivel de K+ no cambió entre 35‰ y 25‰, disminuyó significativamente a 15‰ y se mantuvo constante entre 15‰ y 5‰. En el Ensayo 3, el nivel de K+ no cambió sustancialmente entre 20‰ y 5‰, aunque fue inferior a 35‰ (Fig. 5).
Para todos los ensayos, los niveles de NKA en las PL se asociaron inversamente con la salinidad ambiental (Fig. 6). En el Ensayo 1, los niveles de NKA no fueron significativamente diferentes desde 35‰ a 20‰, luego aumentaron a 15‰ pero permanecieron constantes hasta 5‰. En el Ensayo 2, los niveles de NKA permanecieron
Fig. 5. Nivel de K+ en postlarvas (PL12) de Litopenaeus vannamei aclimatadas a diferentes intervalos de reducción de salinidad. Las letras diferentes indican una diferencia significativa (p < 0.05).

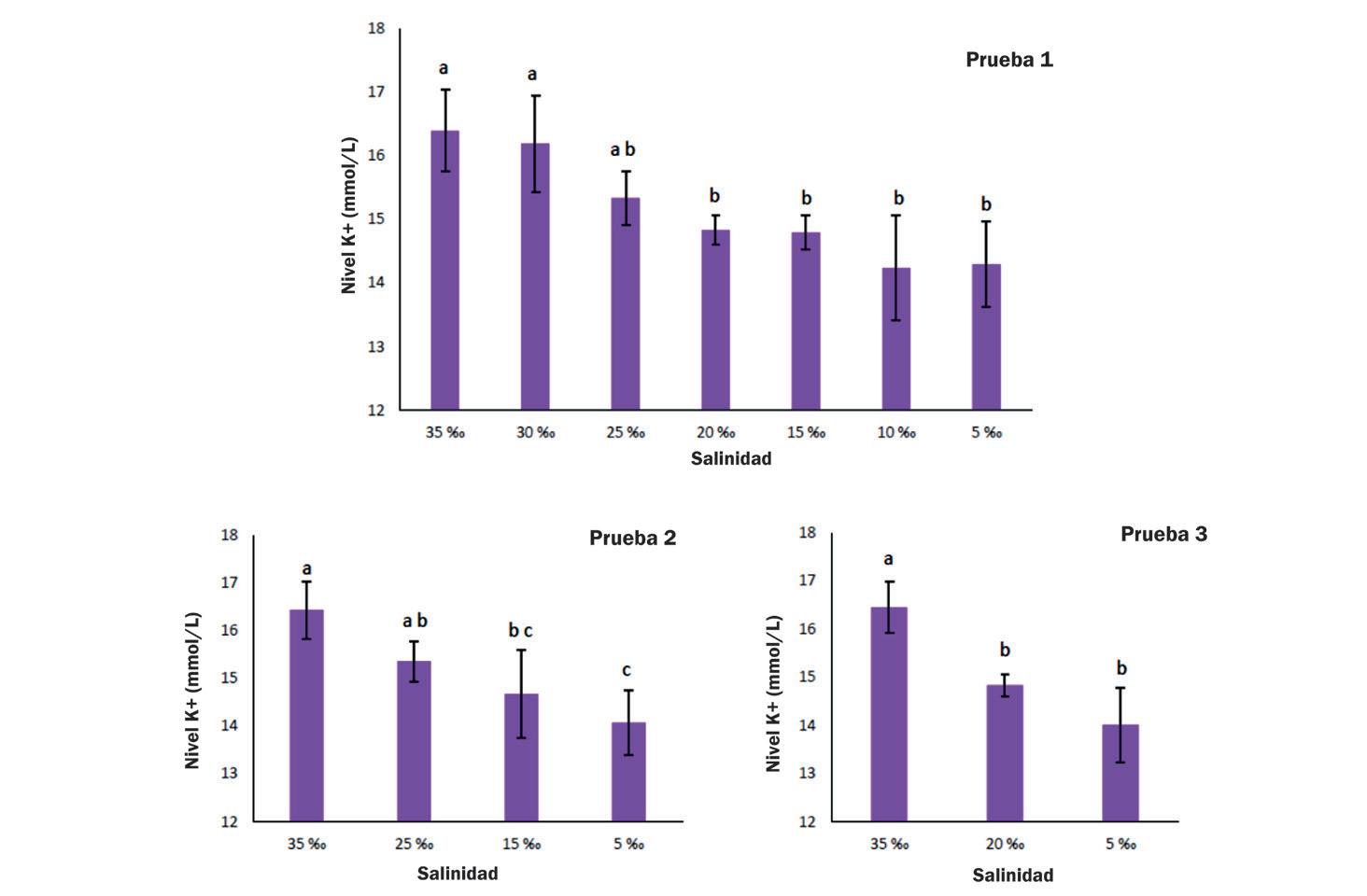
Fig. 6. Nivel de NKA en postlarvas (PL12) de Litopenaeus vannamei aclimatadas a diferentes intervalos de reducción de salinidad. Las letras diferentes indican una diferencia significativa (p < 0.05).
constantes entre 35‰ y 25‰, aumentaron a 15‰ y luego se mantuvieron constantes hasta 5‰. En el Ensayo 3, los niveles de NKA a 20‰ y a 5‰ no fueron significativamente diferentes, pero fueron mayores que los de 35‰ (Fig. 6).
El recuento total de hemocitos (THC) de PL disminuyó significativamente con la disminución de la salinidad en todos los ensayos (Fig. 7). El THC no fue significativamente diferente en el Ensayo 1
a 35‰ y a 30‰, luego disminuyó a 25‰ pero permaneció constante hasta 5‰. El THC se redujo en la Prueba 2 a 25‰ y luego se mantuvo constante en 15‰ y 5‰. El THC disminuyó significativamente de 35‰ a 5‰ en el Ensayo 3. Al final del ensayo, el THC de PL en el Ensayo 1 (2 104 células/ml) fue mayor que en el Ensayo 2 (1.3 104 células/ ml) y el Ensayo 3 (1.3 104 células/ml) (Fig. 7).
Discusión
La supervivencia de crustáceos depende de
- OCTUBRE 2022 96 PRODUCCIÓN
Fig. 7. Recuento total de hemocitos de postlarvas (PL12) de Litopenaeus vannamei aclimatadas a diferentes intervalos de reducción de salinidad. Las letras diferentes indican una diferencia significativa (p < 0.05).
su capacidad para mantener la composición de sus fluidos corporales cuando se trasladan a un entorno que difiere de su entorno normal (Lignot et al., 2000; ChongRobles et al., 2014). En nuestro estudio, descubrimos que entre 35 y 25‰, las postlarvas del Ensayo 1 demostraron una estrategia hipoosmoconformadora.
En el Ensayo 2, las postlarvas desarrollaron una estrategia iso-osmoconformadora cuando se mantuvieron a 35–25‰. Cuando las postlarvas se mantuvieron a una salinidad de 35 a 25‰ en el Ensayo 3, tendieron a adoptar una estrategia hiperosmoconformadora (Fig. 2). Las postlarvas de L. vannamei pueden mantener la osmolaridad de suero por encima de la osmolaridad del agua ambiental a una salinidad más baja (20–5‰), lo que demuestra una estrategia hiperosmorreguladora (Fig. 2).
Aunque las postlarvas tienen la capacidad de regular con éxito la osmolaridad de la hemolinfa en respuesta a variaciones de salinidad, sin embargo, las postlarvas de L. vannamei adaptadas a una aclimatación gradual de 5‰ tuvieron una supervivencia mucho mayor (con un SP del 90%) que aquellas adaptadas a una aclimatación gradual de salinidad de 10‰ (SP=80%) y 15‰ (SP=58%). Un período de aclimatación más largo puede ser responsable de la mayor supervivencia durante la aclimatación
gradual de 5‰, ya que probablemente permite el equilibrio iónico entre la hemolinfa del camarón y el ambiente circundante, reduciendo el estrés osmorregulatorio en el animal y aumentando la supervivencia (McGraw y Scarpa, 2002, 2004). Esto es consistente con los hallazgos de Van Wyk et al. (1999), quienes descubrieron que la aclimatación a bajas salinidades durante un período prolongado de tiempo aumentaba la supervivencia de las postlarvas de L. vannamei. McGraw y Scarpa (2004) encontraron que un período de aclimatación de 72 horas a baja salinidad resultó en una mayor supervivencia de PL15 que un período de aclimatación de 48 horas.
Según Jayasankar et al. (2009), cuando los camarones se transfirieron directamente de 25‰ a 1‰, la tasa de supervivencia se redujo al 20% después de 5 h y ninguno sobrevivió después de 24 h. Esto podría deberse al gran cambio en el perfil iónico del medio ambiente y la hemolinfa, y el animal fue incapaz de hacer frente a un cambio tan grande (Lignot et al., 2000; McGraw y Scarpa, 2004; Huong et al., 2010).
Los iones monovalentes, particularmente Na+, K+ y Cl , representan el 90% de iones de hemolinfa totales en crustáceos (Freire et al., 2008; Charmantier et al., 2009). Estos iones tendían a aumentar en una proporción constante a medida que aumentaba la
Referencias
Bai, H., Tatar, M., 2012. Hemolymph collection from adult flies. (5/24/2012).
Charmantier, G., 1998. Ontogeny of osmoregulation in crustaceans: a review. Invertebr. Reprod. Dev. 33, 177–190. https://doi.org/10.1080/07924259. 1998.9652630.
Charmantier, G., Charmantier-Daures, M., Towle, D., 2009. Osmotic and ionic regulation in aquatic arthropods. In: Evans, D.H. (Ed.), Osmotic and Ionic Regulation. Cells and Animals. CRC Press, pp. 165–230.
Chen, J.C., Lin, J.N., Chen, C.T., Lin, M.N., 1996. Survival, growth and intermolt period of juvenile Penaeus chinensis (Osbeck) reared at different combinations of salinity and temperature. J. Exp. Mar. Biol. Ecol. 204, 169–178.
Chong-Robles, J., Charmantier, G., Boulo, V., Liz´arraga-Vald´ez, J., Enríquez-Paredesa, L. M., Giffard-Menaa, I., 2014. Osmoregulation pattern and salinity tolerance of the white shrimp Litopenaeus vannamei (Boone, 1931) during post-embryonic development. Aquaculture 422–423, 261–267. https://doi. org/10.1016/j.aquaculture.2013.11.034.
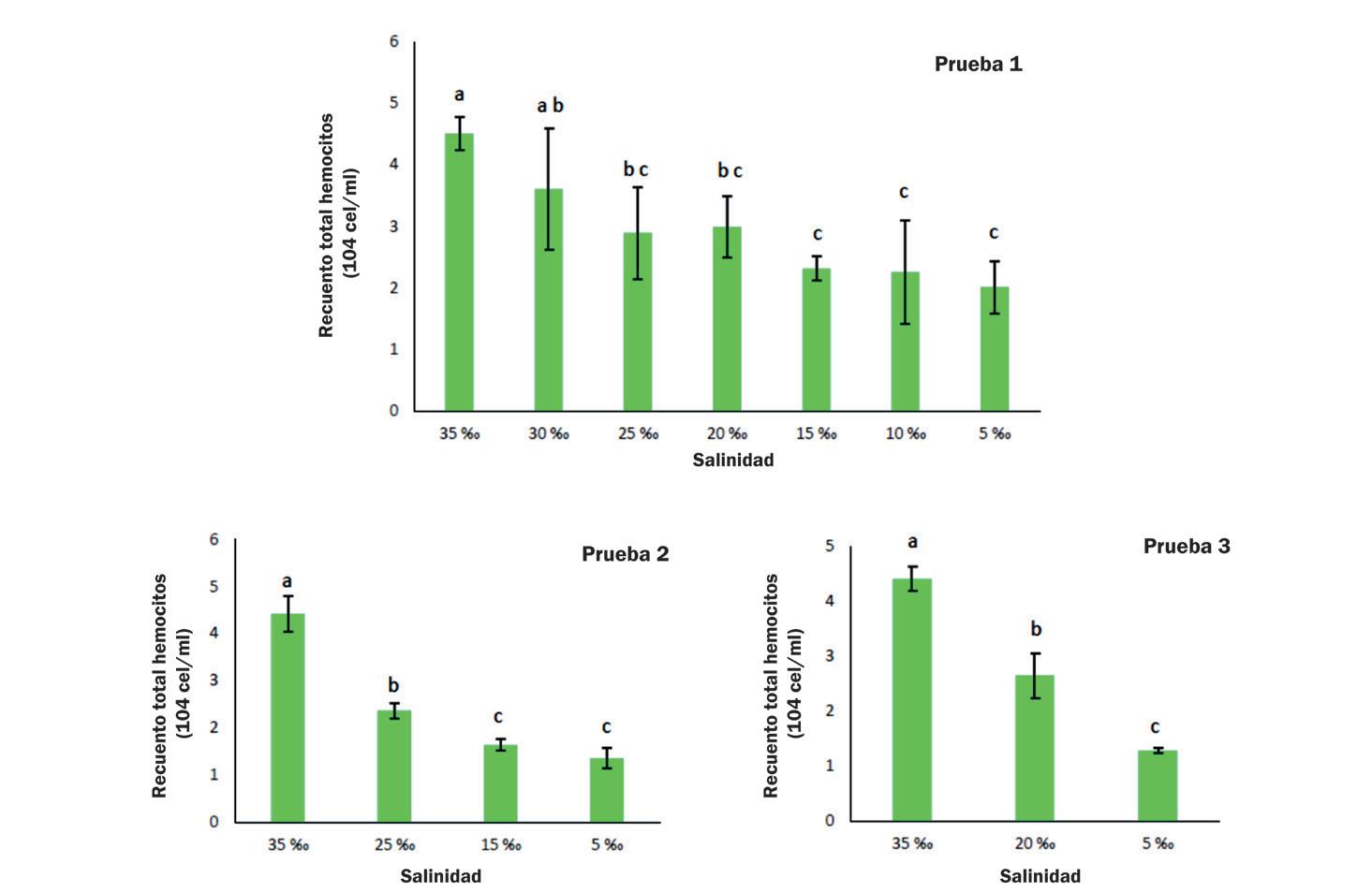
Ednoff, M., 2001. Fish Farming News 9, 45–55.
Feng, C., Tian, X., Dong, S., Su, Y., Wang, F., Ma, S., 2008. Effects of frequency and amplitude of salinity fluctuation on the growth and energy budget of juvenile Litopenaeus vannamei (Boone). Aquac. Res. 39, 1639–1646.
Freire, C.A., Onken, H., McNamara, J.C., 2008. A structure–function analysis of ion transport in crustacean gills and excretory organs. Comp. Biochem. Physiol. 151A, 272–304. https://doi. org/10.1016/j.cbpa.2007.05.008.
Freire, C.A., Maraschi, A.C., Lara, A.F., Amado, E.M., Prodocimo, V., 2018. Late rise in hemolymph osmolality in Macrobrachium acanthurus (diadromous freshwater shrimp) exposed to brackish water: early reduction in branchial Na+/K+ pump activity but stable muscle HSP70 expression. Comp. Biochem. Physiol. 216B, 69–74.
https://doi.org/10.1016/j.cbpb.2017.12.003.
Handayani, K.S., Irawan, B., Soegianto, A., 2020. Short-term mercury exposure in tilapia (Oreochromis niloticus) at different salinities: impact on serum osmoregulation, hematological parameters, and Na+/K+-ATPase level. Heliyon 6 (2020), e04404. https://doi.org/10.1016/j.heliyon.2020.e04404.
Huang, C.-W., Wang, H.-D., Bai, H., Wu, M.-S., Yen, J.-H., Tatar, M., Fu, T.-F., Wang, P.-Y., 2015. Tequila regulates insulin-like signaling and extends life span in Drosophila melanogaster. J. Gerontol. A Biol. Sci. Med. Sci. 70 (12), 1461–1469. https://doi.org/ 10.1093/gerona/glv094.
Huong, D.T.T., Jasmani, S., Jayasankar, V., Wilder, W., 2010. Na/ KATPase activity and osmo-ionic regulation in adult whiteleg shrimp Litopenaeu vannamei exposed to low salinities. Aquaculture 304, 88–94. https://doi.org/10.1016/j.aquaculture.2010.03.025.
Jayasankar, V., Jasmani, S., Nomura, T., Nohara, S., Huong, D.T.T., Wilder, M.N., 2009.
Low salinity rearing of the Pacific white shrimp Litopenaeus vannamei: acclimation, survival and growth og postlarvae and juvenile. JARQ 43 (4), 345–350. http://www.jircas.affrc.go.jp.
Jia, X., Wang, F., Lu, Y., Zhang, D., Dong, S., 2014. Immune responses of Litopenaeus vannamei to thermal stress: a comparative study of shrimp in freshwater and seawater conditions. Mar. Freshw. Behav. Physiol. 47, 79–92.
Keiser, R.K., Aldrich, D.V., 1976. Salinity preference of postlarval brown and white shrimp (Penaeus aztecus and P. setiferus) in gradient tanks. Dept. Wildl. Fish. Sci. Publ. 208, 1–260.
Kolbadinezhad, S.M., Hajimoradloo, A., Ghorbani, R., Joshaghani, H., Wilson, J.M., 2012. Effects of gradual salinity increase on osmoregulation in Caspian roach Rutilus caspicus. J. Fish Biol. 81, 125–134. https://doi.org/10.1111/j.1095-8649.2012.03317.x.
Laiz-Carrion, R., Guerreiro, P.M., Fuentes, J., Canario, A.V.M., Martin del Rio, M.P.,
Mancera, J.M., 2005. Branchial osmoregulatory response to salinity in the gilthead sea bream, Sparus auratus. J. Exp. Zool. 303A, 563–576. https://doi.org/10.1002/ jez.a.183.
Laramore, S., Laramore, C.R., Scarpa, J., 2001. Effect of low salinity on growth and survival of postlarvae and juvenile Litopenaeus vannamei. J. World Aquac. Soc. 32, 385–392.
Lignot, J.-H., Spanings-Pierrot, C., Charmantier, G., 2000. Osmoregulatory capacity as a tool in monitoring the physiological condition and the effect of stress in crustaceans. Aquaculture 191, 209–245. Lu-Qing, P., Ling-Xu, J., Jing-Jing, M., 2005. Effects of salinity and pH on immune parameters of the white shrimp
- OCTUBRE 2022 97 PRODUCCIÓN
osmolaridad de la hemolinfa (Van Wyk et al., 1999; McGraw y Scarpa, 2003, 2004). La osmorregulación, o el mantenimiento de una osmolaridad sérica constante, depende en gran medida de la actividad de la NKA y de la concentración iónica del agua. Cuando los animales se trasladan de aguas de alta a baja salinidad, la principal función osmorreguladora la realizan las branquias (Charmantier, 1998; P´equeuX et al., 2006; Pham et al., 2012).
La disminución de niveles de Na+, K+ y Cl en la hemolinfa de PL con salinidad decreciente en los tres ensayos, podría atribuirse a un aumento en la actividad de NKA y una disminución de la permeabilidad branquial causada por la aclimatación al agua dulce (Siebers et al., 1982; Pan et al., 2007; Saraswathy et al., 2020). Esto es consistente con nuestros hallazgos, que muestran que los niveles de NKA de las PL aumentan a medida que disminuye la salinidad. El aumento de la actividad enzimática puede haber contribuido a la tasa de supervivencia en nuestra investigación con tres ensayos de reducción progresiva de la salinidad.
Los crustáceos son bien reconocidos por su capacidad para regular con éxito la osmolaridad de la hemolinfa en respuesta a variaciones de salinidad, lo que les permite aclimatarse rápidamente a su entorno (Freire et al., 2018; Rahi et al., 2021a; Rahi et al., 2021b).
Nuestro estudio demostró que al final del período de aclimatación (a 5‰) las PL12 se adaptaron a una aclimatación gradual de 15‰ (Ensayo 3), demostraron una osmolaridad de la hemolinfa mucho más alta (696 mOsm/kg H2O) que las que se aclimataron gradualmente a 10‰ (546 mOsm/kg H2O, Prueba 2) y 5‰ (450 mOsm/ kg H2O, Prueba 1), aunque los niveles de iones de hemolinfa (Na+, Cl y K+) fueron relativamente iguales en los tres ensayos. Una mayor osmolaridad en PL aclimatadas a baja salinidad, pero con nivel constante de iones, sugiere que se trata de una condición transitoria de desequilibrio iónico, o que los procesos osmorreguladores aún no han sido regulados a la baja (Wilson y Laurent, 2002; Laiz-Carrion et al., 2005; Kolbadinezhad et al., 2012).
El estrés ambiental, incluida la salinidad, puede alterar la supervivencia, el crecimiento, la fisiología y la inmunología del camarón (Lu-Qing et al., 2005; Wang y Chen, 2006; Jia et al., 2014). El estrés por salinidad puede reducir el sistema inmunitario en los camarones, lo que puede estar relacionado con la disminución de los niveles de THC durante el estrés (Jia et al., 2014).
La disminución de THC puede hacer que los camarones sean más susceptibles a las infecciones y se reduzca su resistencia a enfermedades. Lu-Qing et al. (2005) observaron una disminución en el recuento total de hemocitos en el camarón Marsupenaeus janponicus al pasar de 30‰ a 5‰ de salinidad durante 6 días. Wang y Chen (2006) reportaron que L. vannamei fue más susceptible a Vibrio alginolyticus cuando se transfirieron de 25‰ a 5‰ de salinidad durante 24 h. Nuestro estudio observó que, en los tres ensayos, los niveles de THC disminuyeron cuando la salinidad disminuyó de 35 ‰ a 5 ‰. Este valor bajo de THC indica una reducción en la resistencia de los camarones contra infecciones.
Según los resultados de nuestro estudio, aunque las PL12 pudieron soportar salinidades de 5‰ en tres ensayos, la tasa de supervivencia máxima de casi el 90% se alcanzó en PL12 adaptadas a una aclimatación gradual de 5‰ (Ensayo 1).
Los niveles de THC también fueron mayores en el Ensayo 1 en comparación con otros ensayos. Como resultado, se recomienda utilizar una aclimatación gradual de 5‰ para lograr un porcentaje de supervivencia óptimo con una posibilidad mínima de infección de enfermedad en el animal•
Litopenaeus vannamei. J. Shellfish Res. 24, 1223–1227.
McGraw, W.J., Scarpa, J., 2002. Marine shrimp (Litopenaeus vannamei) culture in freshwater: determining minimum ion concentrations. Glob. Aquac. Advocate 5 (3),36–38.
McGraw, W.J., Scarpa, J., 2003. Minimum environmental potassium for survival of Pacific white shrimp Litopenaeus vannamei (Boone) in freshwater. J. Shellfish Res. 22, 263–267.
McGraw, W.J., Scarpa, J., 2004. Mortality of freshwater-acclimated Litopenaeus vannamei associated with acclimation rate, habituation period, and ionic challenge.
Aquaculture 236, 285–296. https://doi.org/10.1016/j. aquaculture.2004.01.037.
McGraw, W.J., Davis, D.A., Teichert-Coddingtaon, D., Rouse, D.B., 2002. Acclimation of Litopenaeus vannamei postlarvae to low salinity: influence of age, salinity endpoint, and rate of salinity reduction. J. World Aquac. Soc. 33, 78–84.
Pan, L.-Q., Zhang, L.-L., Liu, H.-Y., 2007. Effects of salinity and pH on ion-transport enzyme activities, survival and growth of Litopenaeus vannamei postlarvae.
Aquaculture 273, 711–720. https://doi.org/10.1016/j. aquaculture.2007.07.218.
P´equeux, A., Dandrifosse, G., Loret, S., Charmantier, G., Charmantier-Daures, M., Spanings-Pierrot, C., Schoffeniels, E., 2006. Osmoregulation: morphological, physiological, bio-chemical, hormonal, and developmental aspects. In: Forest, J., Klein, J.Cv.V. (Eds.), The Crustacea. Brill, Leiden, Boston, p. 205.
Pham, D., Charmantier, G., Boulo, V., Wabete, N., Grousset, E., Charmantier-Daures, M.,2012. Osmoregulation in the penaeid shrimp Litopenaeus stylirostris: ontogeny and localization of transporters, SICB Annual Meeting, Charleston, SC, USA.
Rahi, M.L., Azad, K.N., Tabassum, M., Irin, H.H., Hossain, K.S., Aziz, D., Moshtaghi, A., Hurwood, D.A., 2021a. Effects of salinity on physiological, biochemical and gene expression parameters of black tiger shrimp (Penaeus monodon): potential for farming in low-salinity environments. Biology 2021 (10), 1220. https://doi. org/ 10.3390/biology10121220.
Rahi, M.L., Mather, P.B., Hurwood, D.A., 2021b. Do plasticity in gene expression and physiological responses in Palaemonid prawns facilitate adaptive response to different osmotic challenges? Comp. Biochem. Physiol. 251A, 110810 https://doi. org/10.1016/j.cbpa.2020.110810.
Samocha, T.M., Guarjardo, H., Lawrence, A.L., Castille, F.L., Speed, M., McKee, D.A.,Page, K.I., 1998. A simple stress test for Penueus vunnamei postlarvae. Aquaculture 165, 233–242.
Samocha, T.M., Hamper, L., Emberson, C.R., Davis, D.A., McIntosh, D., Lawrence, A.L.,Van Wyk, P.M., 2002. Review of some recent developments in sustainable shrimp farming practices in Texas, Arizona and Florida. J. Appl. Aquac. 12 (1), 1–42.
Saraswathy, R., Muralidhar, M., Balasubramanian, C.P., Rajesh, R., Sukumaran, S.,Kumararaja, P., Dayal, J.S., Avunje, S., Nagavel, A., Vijayan, K.K., 2020. Osmo-ionic regulation in whiteleg shrimp, Penaeus vannamei, exposed to climate change-induced low salinities. Aquac. Res. 2020 (00), 1–12. https://doi.org/10.1111/ are.14933.
Siebers, D., Leweek, K., Markus, H., Winkler, A., 1982. Sodium regulation in the shore crab Carcinus maenas as related to ambient salinity. Mar. Biol. 69, 37–43.
Su, X., Shen, C.C., Yang, Z.W., Zheng, Y.Y., 2005. Effect on low salinity on the survival of postlarvae of the blue shrimp, Litopenaeus stylirostris, at different stages. Isr. J. Aquac. 57, 271–277.
Supamattaya, K., Kiriratnikom, S., Boonyaratopalin, M., Borowitzka, L., 2005. Effect of a Dunaliella extract on growth performance, health condition, immune response and disease resistance in Black Tiger Shrimp (Penaeus monodon). Aquaculture 248, 207–216.
Para más información sobre este este artículo escriba a: abrori2727@gmail.com
Tahe, S., Nawang, A., Suwoyo, H.S., 2011. Counting technology of shrimp (Litopenaeus vannamei) polyculture system with milk fish (Chanos chanos) in low salinity pounds.
Pros. Forum Inov. Teknol. Akuakultur 2011, 425–434.
Van Wyk, P., Davis-Hodgkins, M., Laramore, C.R., Main, K., Moutain, J., Scarpa, J., 1999.
Farming marine shrimp in recirculating freshwater production systems: a practical manual. FDACS Contract #4520. Florida Department of Agriculture Consumer Services, Tallahassee, FL. Wang, F.I., Chen, J.-C., 2006. Effect of salinity on the immune response of tiger shrimp Penaeus monodon and its susceptibility to Photobacterium damselae subsp. Damselae.
Fish Shellfish Immunol. 20, 671–681. https://doi.org/10.1016/j. fsi.2005.08.003.
Wilson, J.M., Laurent, P., 2002. Fish gill morphology: inside out. J. Exp. Zool. 293, 192–213. https://doi.org/10.1002/jez.10124.
- OCTUBRE 2022 98 PRODUCCIÓN

Restauración de manglar, importancia y recomendaciones para su ejecución
El presente trabajo, es el reflejo de la experiencia del autor, en lo que a restauración de manglar respecta, la ecología de esta formación vegetal y sus interacciones entre factores ambientales como el suelo, calidad de agua y vegetación.
Autor: Leonardo S. Maridueña Director de Ambiente Cámara Nacional de Acuacultura lmariduena@cna-ecuador.com
Los manglares son formaciones vegetales halófitas (tolerantes a la salinidad), habitan la región intertropical debido a que los manglares son sensibles a las bajas temperaturas su distribución se ve limitada por este factor. Existen más de 50 especies a nivel global. Tienden a ser una comunidad de plantas de diferentes géneros y de especies dominantes en la zona intermareal asociada con deltas y estuarios, donde el oleaje es mínimo.
La estructura y distribución del bosque de manglar es una consecuencia de la diferencia en la forma del relieve costero, reconociéndose cinco tipos estructurales de bosque: de borde, de cuenca, rivereño, de sobreinundación y enano (Fig.1)
Los manglares exhiben relativamente altas tasas de productividad primaria bruta, la productividad más alta se alcanza en condiciones de salinidad moderada, temperaturas cálidas todo el año, reflujo regular de las aguas superficiales y exposición a escorrentías de agua terrestre.
Las formaciones vegetales de manglar juegan una gran variedad de papeles en el ecosistema general, entre los cuales se destacan la captación de CO2, capta tres veces más CO2 que cualquier otra formación vegetal, (Hamilton 2020) producción de hojarasca y detritos, cuya descomposición microbiana produce alimento para una gran variedad y poblaciones de organismos. Además, existen otros roles mundialmente conocidos como evitar la erosión en las zonas costeras, preservación de la calidad del agua por su papel regulador de la eutroficación (contaminación por enriquecimiento excesivo de nutrientes de las aguas), habilidad para aislar o absorber contaminantes antropogénicos, entre otros beneficios.
El medio intermareal tropical, no es favorable para otras especies de árboles o matorrales, debido a la salinidad del agua, pues los

- OCTUBRE 2022
suelos son hipersalinos y muy ácidos. Los manglares presentan su máximo desarrollo y crecimiento en esas condiciones siempre que exista un patrón continuo de mareas y circulación de aguas superficiales que generan el intercambio y reemplazo de agua por sedimentos. El flujo de las mareas suministra el oxígeno y los nutrientes requeridos.
En general, los manglares son relativamente resistentes a muchas clases de perturbaciones y tensiones ambientales, pero la depredación de este recurso forestal es sumamente negativo para el equilibrio ambiental que generan, algunos de los más importantes se describen arriba.
La necesidad de optar por nuevas formas de producción para la alimentación y crecimiento poblacional, hizo necesario que estas formaciones vegetales sean alteradas convirtiendo el uso de suelo para producción acuícola, especialmente de camarones, ampliación de frontera agrícola, pecuaria y también ha sido afectado por el incremento poblacional de ciudades. Específicamente en Ecuador, antes del inicio de la producción camaronera existían 203.600 ha de manglar según CLIRSEN 2007, cincuenta años más tarde encontramos 162.000 ha. Alrededor de 40.000 ha, equivalentes al 20% aproximadamente, han desaparecido en los últimos 50 años.

La necesidad de restauración de los manglares en el país, es imperante la restauración parcial de los manglares con la finalidad de tratar de restablecer las condiciones naturales del ecosistema estuarino y obtener las ventajas que brindan los bosques de manglar, las cuales a mas de beneficiar a las poblaciones de organismos asociados, los beneficios que presta especialmente al sector acuicultor se infieren en la Introducción del presente artículo.

Con ese objetivo, hay la necesidad de entender los límites tolerables de la intervención para mantener las características particulares del ecosistema estuarino. Sin embargo hay varias razones primordiales para la restauración del manglar: mantener el equilibrio del ecosistema estuarino, mantener la biodiversidad y sus poblaciones, la restauración para beneficiarse de sus
propiedades naturales, y la protección de las zonas costeras, incremento de la masa forestal para la mitigación del calentamiento global, previniendo además la protección de las costas que serían alteradas por la erosión provocada por el incremento del nivel del mar a causa del cambio climático.
La reforestacion del manglar
El presente articulo no pretende ser una guía para reforestar manglar, lo que se pretende es dar a conocer al lector, factores importantes a considerar para la toma de decisiones en caso de pretender restaurar o forestar áreas con manglar.
En el país, se ha logrado con bastante éxito la reforestación de manglar, especialmente el manglar de borde, denominado mangle rojo (Rhizophora mangle), principalmente la que es una especie de relativo fácil manejo y adaptación, siempre y cuando exista el flujo regular de mareas. Los factores a considerar para la forestación o reforestación son los siguientes:
A pesar de que el mangle, especialmente el rojo, es altamente colonizador, lo que implica que, si las condiciones del suelo y los regímenes de mareas no son alterados, esta es la manera mas fácil y económica de reforestación. Teniendo en cuenta que en algunas ocasiones la intervención de la mano del hombre puede ayudar a que las condiciones favorables para la reforestación natural tengan lugar.
Manglar y Biodiversidad.
Suelo, el tipo de suelo es determinado por procesos geogénicos y pedogénicos, este último incluye la naturaleza del movimiento de mareas, el clima y la hidrología, en áreas aptas para la siembra del manglar la textura predominante es la arcillosa y no debe existir partículas sedimentarias gruesas.
Nivel del manto freático. La importancia del nivel subterráneo del manto freático ha recibido poca atención, debido a que las mareas son el factor más importante pues influyen en la hidrología y hace que el mangle de borde no se vea afectado por un nivel freático profundo.
Salinidad del agua en el suelo, este factor ha sido reconocido como regulador del crecimiento, la altura, la supervivencia y la zonificación de los manglares. Al respecto son limitados o escasos los datos disponibles con respecto a la salinidad del suelo, pero la experiencia nos demuestra que las salinidades medias (caso de los estuarios) son las ideales para el desarrollo del manglar, no siendo así en salinidades extremas, marinas (donde el manglar es escaso) o en agua dulce, donde no existe manglar.
Drenaje y aireación, la aireación del suelo es importante en los ambientes de manglar porque permite el suministro de oxígeno para la respiración de las raíces la aireación está relacionada directamente con el drenaje del suelo y por lo tanto es altamente variable por cuanto depende de la elevación, la topografía y las características físicas del sustrato, en particular su textura.
- OCTUBRE 2022 101 MANEJO AMBIENTAL
Semilla de Mangle rojo.
Estacionalidad y estrategias de crecimiento, las especies de mangle evidencian patrones marcadamente estacionales de actividad vegetativa y reproductiva. Mientras que una porción de esta estacionalidad es inducida por ambiente, es necesario conocer ciertas características inherentes a la especie, tales como el período de producción de frutos y flores, la duración de vida de las hojas y el tiempo que toma desde la floración hasta ser un propágulo maduro.
Otros factores a considerar: Existen comunidades de pescadores artesanales que dominan la recolección y siembra directa del manglar, especialmente del borde, pero la asistencia técnica profesional es necesaria, pues hay detalles técnicos como los aquí indicados, que se necesita la dirección profesional para que la reforestación tenga éxito.
Existe de acuerdo a la legislación ambiental, que estos proyectos sean presentados y aprobados por la Dirección Provincial de Ambiente, así mismo una vez terminado el tiempo en que las plantas tengan la edad que proponga el proyecto, este debe ser comunicado a la Dirección Provincial para obtener la certificación correspondiente.
Plagas y enfermedades. El manglar como cualquier otro sistema forestal no está libre de plagas y al adquirir o escoger las semillas, incluso al estar sembradas debe considerarse que los propágulos son fácil presa de la depredación de los cangrejos, los escarabajos atacan las plántulas, especialmente durante los 4 primeros meses, los perforadores del tallo (Teredo) además de la oruga de la hoja y las termitas, son afectadores de las plantas en desarrollo. Por este motivo, toda reforestación debe tener una supervisión permanente y tener su vivero de donde puedan obtener plántulas para replantar las plantas enfermas.
Algunos interesados en la reforestación, piensan que como hay un mercado internacional de la venta de bonos por captación de CO2, pueden reforestar o forestar con este fin, esto no aplica en el país, pues los manglares son propiedad del Estado Ecuatoriano, según el Art, 103: “ El manglar es un bien del Estado, el mismo que está fuera de todo comercio, no susceptible
Figura 1. Estructuras de las formaciones de manglar. Fuente: Pautas para el manejo de recursos costeros - Snedaker, S. y Charles Getter. Costas 1985
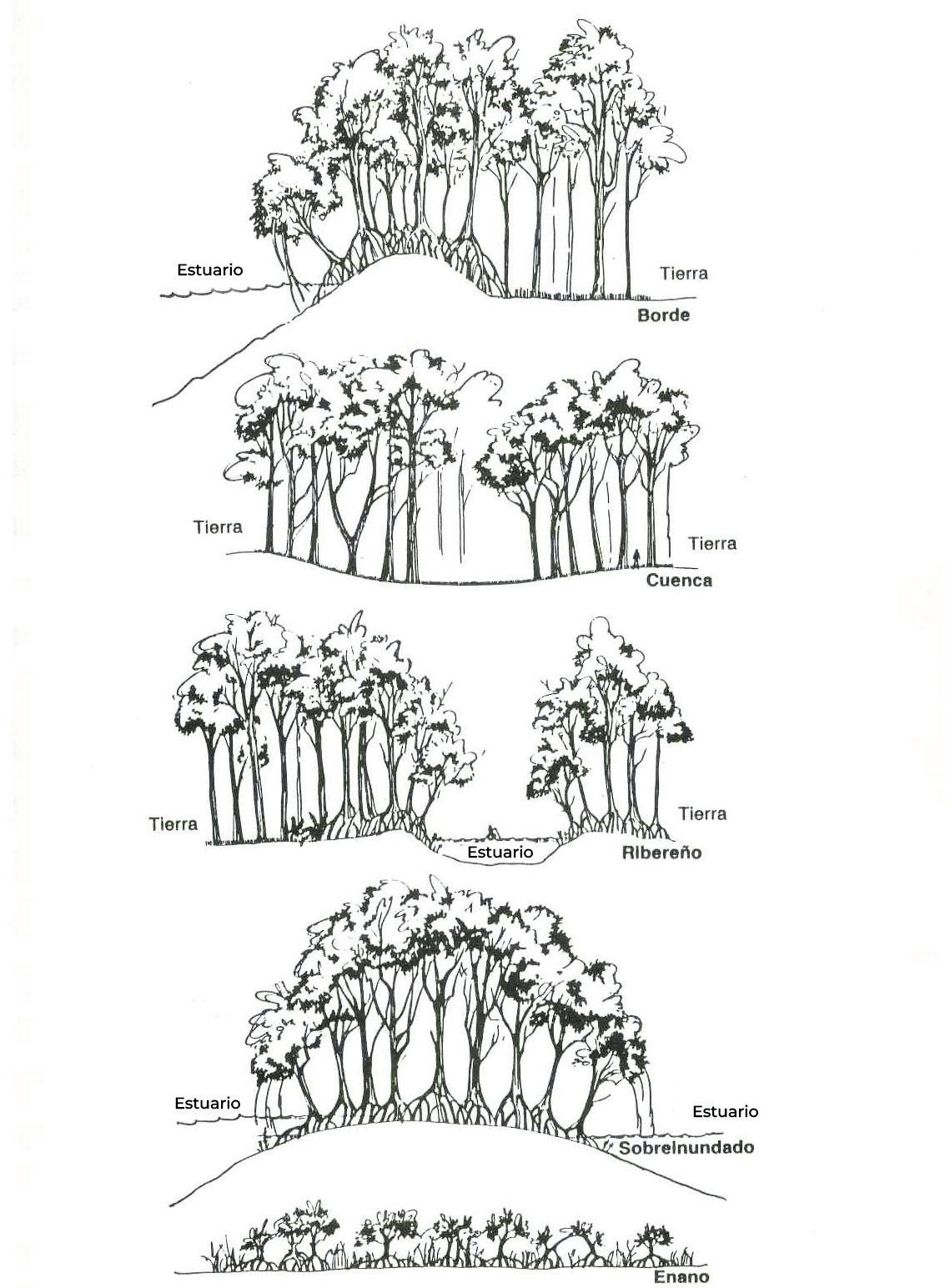
de posesión o cualquier otro modo de apropiación y sobre él no puede adquirirse dominio ninguno ni ningún otro derecho real por prescripción…”
El real propósito para la reforestación o restauración de los manglares para el sector acuicultor ecuatoriano, debe hacérselo pensando en los beneficios ambientales que estas formaciones forestales generan en beneficio del país y en la sostenibilidad de la producción acuícola.
La única manera de que quienes reforesten/
mantengan manglar, puedan acceder al mercado de bonos por captación de CO2, es que el se apruebe la pregunta 8 del Referéndum que el Presidente de la República planteará para aprobación de los ecuatorianos•
Referencias Bibliográficas:
Hamilton Stuart E. Mangroves and Aquaculture 2020
- OCTUBRE 2022 102 MANEJO AMBIENTAL



COMERCIO EXTERIOR
CAMARÓN: EVOLUCIÓN DE EXPORTACIONES

-2021
Fuente: Banco Central del Ecuador Elaborado por: Cámara Nacional de Acuacultura
CAMARÓN: COMPARATIVO MENSUAL (Millones de Libras) 2020 - 2022
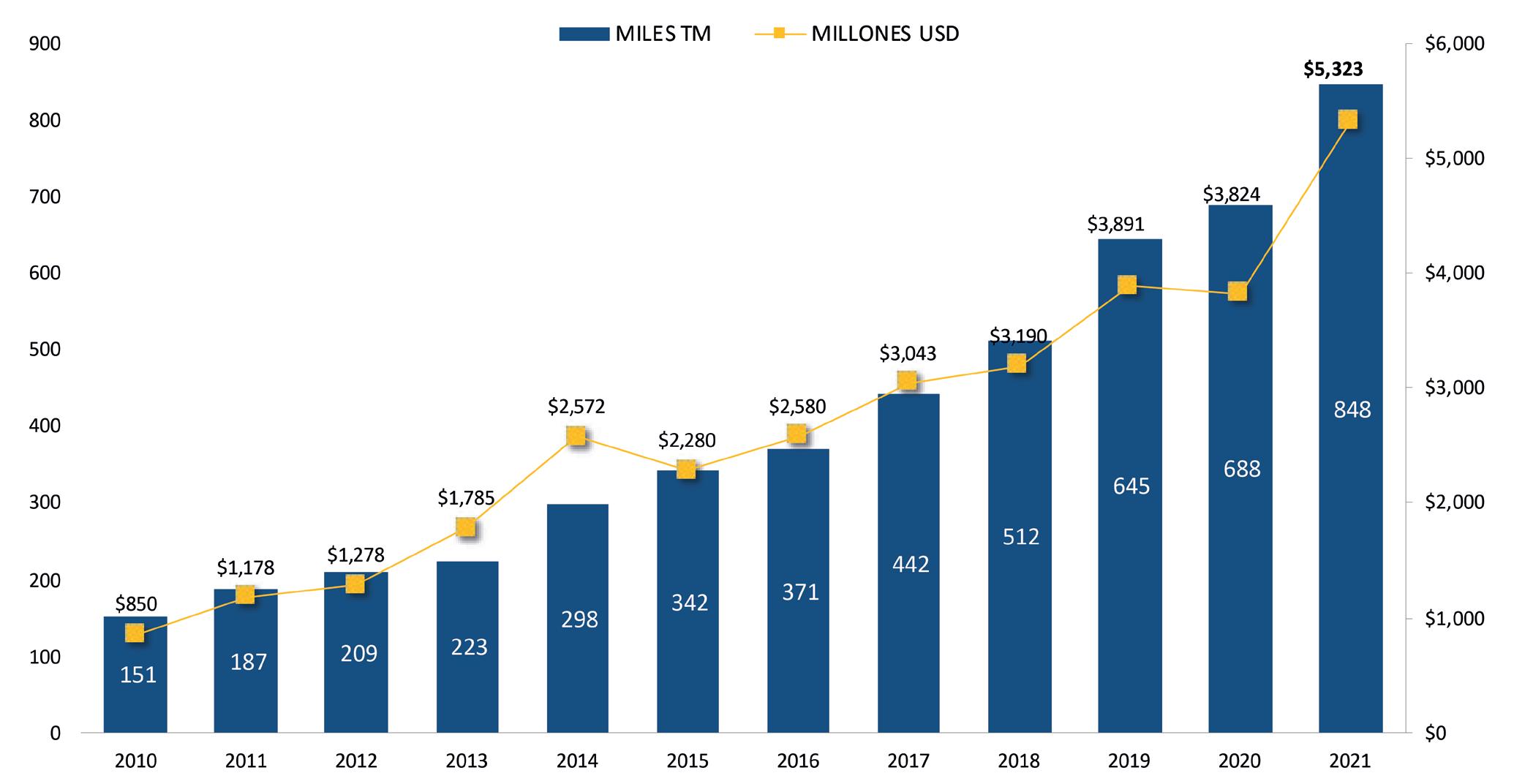
Fuente: Estadistic S.A.
Elaborado por: Cámara Nacional de Acuacultura
- OCTUBRE 2022 106 ESTADÍSTICAS
2010

COMERCIO EXTERIOR CAMARÓN: PARTICIPACIÓN POR DESTINO (Libras)


Fuente: Estadistic S.A.
Elaborado por: Cámara Nacional de Acuacultura
CAMARÓN: PRINCIPALES PAÍSES DESTINOS DE EXPORTACIÓN (Millones de Libras)
Fuente: Estadistic S.A.
Elaborado por: Cámara Nacional de Acuacultura
- OCTUBRE 2022 108 ESTADÍSTICAS

COMERCIO EXTERIOR
CAMARÓN: EXPORTACIONES POR PARTIDA ARANCELARIA Enero – Julio 2022
Fuente: Banco Central del Ecuador
Elaborado por: Cámara Nacional de Acuacultura
CAMARÓN: EVOLUCIÓN DEL PRECIO PROMEDIO ANUAL DE EXPORTACIÓN (Libras)
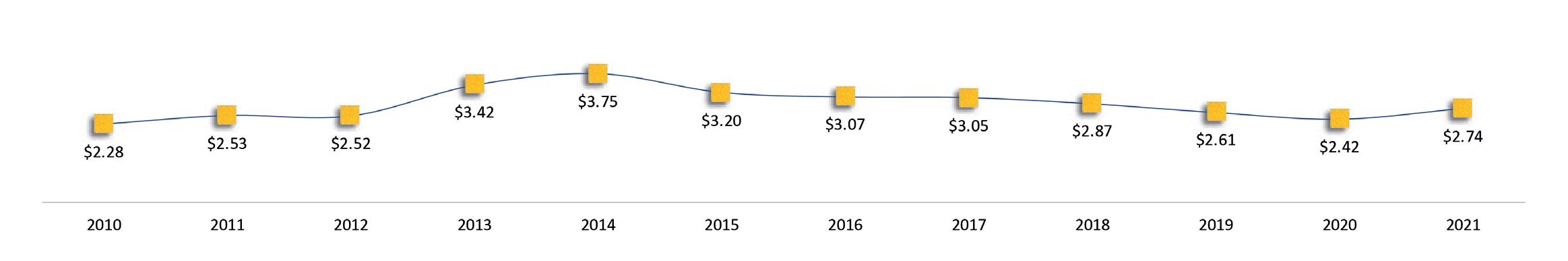

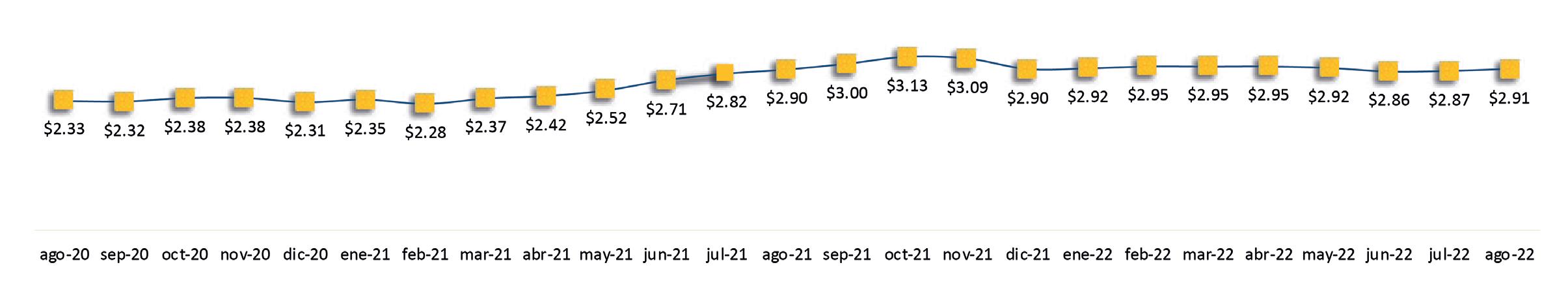
Fuente: Estadistic S.A.
Elaborado por: Cámara Nacional de Acuacultura
CAMARÓN: EVOLUCIÓN DEL PRECIO PROMEDIO MENSUAL DE EXPORTACIÓN (Libras)
Fuente: Estadistic S.A.
Elaborado por: Cámara Nacional de Acuacultura
- OCTUBRE 2022 110 ESTADÍSTICAS

COMERCIO EXTERIOR
TILAPIA: EVOLUCIÓN DE EXPORTACIONES MENSUALES A EE. UU.

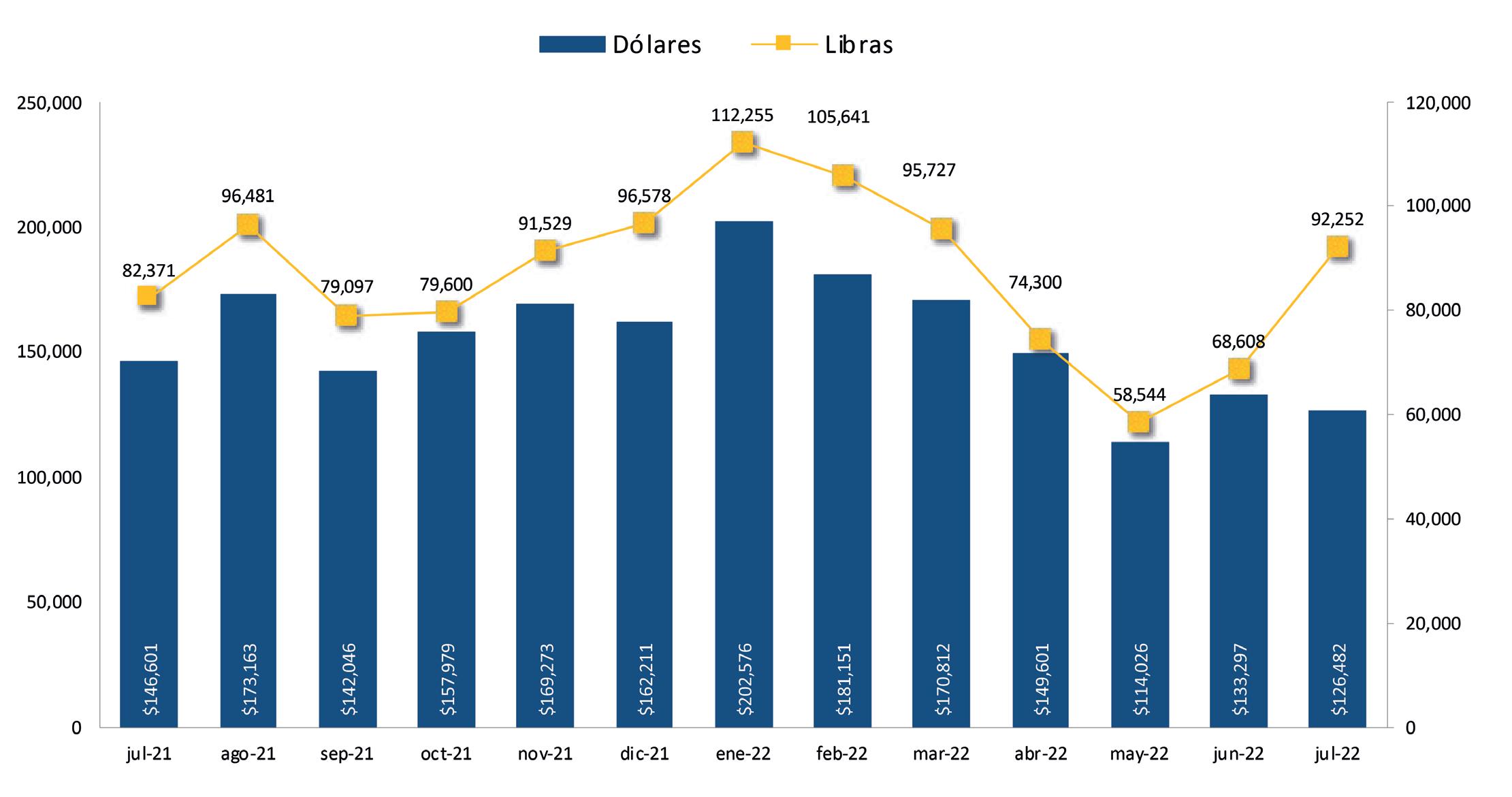
Fuente: National Oceanic and Atmospheric Administration - NOAA Elaborado por: Cámara Nacional de Acuacultura
Fuente: National Oceanic and Atmospheric Administration - NOAA Elaborado por: Cámara Nacional de Acuacultura
- OCTUBRE 2022 112 ESTADÍSTICAS
TILAPIA: EVOLUCIÓN DEL PRECIO PROMEDIO MENSUAL DE EXPORTACIÓN A EE.UU. (Libras)

Importación de camarón de Estados Unidos
Autores: Jim Kenny jkenny@urnerbarry.com
Gary Morrison gmorrison@urnerbarry.com Urner Barry


Importaciones de todos los tipos, por tipo La data comercial de junio indica una ligera ganancia en comparación con el año pasado; los 169.422 millones de libras importadas fueron un 0.8 por ciento más altas que en junio de 2021. La ganancia, aunque solo marginalmente más alta, restableció la tendencia de importación de ganancias mensuales, año tras año.

El paso lento de ganancias continúa reduciendo las ganancias descomunales de principios de año, con un aumento de las importaciones del año hasta la fecha del 9.2 por ciento a casi mil millones de libras (968.329 millones de libras). Casi todos nuestros 10 principales socios comerciales han visto ganancias de dos dígitos durante la primera mitad del año.
En el mes de junio, nuevamente fue una bolsa mixta para nuestros principales socios comerciales. India (+23.7%) y Tailandia (+27.9%) enviaron más; Ecuador (-13.0%), Indonesia (-22.9%) y Vietnam (-3.9%) enviaron menos. Con la participación de India en un 41 por ciento, la batalla acalorada se mantuvo por ser el número dos. Ecuador casi duplicó a Indonesia en junio, colocando al primero por encima del segundo durante la primera mitad del año.
Argentina (+9.6%), México (+144.8%) y Canadá (+484.1%) fueron todos más altos, lo que ayudó en el flujo general.
En cuanto al tipo de producto, hubo nuevamente menos camarón con cáscara (-8.3%) y pelado (-3.5%), pero no lo suficiente como para impedir mayores importaciones de camarón cocido (+38.3%) y empanizado (+1.2%).
Ciclos de importación mensual por país (todos los tipos)
India: El país es el socio comercial número uno de Estados Unidos, responsable del 35 por ciento de todas las importaciones de camarón al país en los primeros seis meses de 2022. En el mes de junio, India envió 69.55 millones de libras de camarón a los EE. UU., un 23.7 por ciento más que en junio pasado. En lo que va del año, los envíos desde la India son un 6.5 por ciento más altos. India aumentó los envíos de camarón con cáscara (+7.9%) en el mes, y también envió más camarón pelado (+11.7%) y cocido (+121.6%).
Indonesia: Indonesia envió considerablemente menos camarón a EE. UU. en junio, un 22.9 % menos, pero sigue siendo un 7.9% más alto en lo que va del año. Las 23.1 millones de libras importadas fueron muy inferiores a las 43.2 millones de libras importadas de Ecuador... por segundo mes consecutivo, Indonesia ha cedido el puesto número dos a Ecuador. En términos de forma de producto, Indonesia envió menos en todas las categorías; menos camarón con cáscara (-30.8%), pelado (-30.1%), cocido (-2.0%) y empanizado (-14.9%).
Ecuador: El país envió más en junio que en cualquier otro mes de este año y registró su segundo total más alto registrado en un solo mes. Los 43.2 millones de libras enviadas en el mes fueron un 13 por ciento menos que en junio de 2021, el récord de un solo mes. Los envíos desde Ecuador son un 13.5 por ciento más altos en lo que va del año. Ecuador es el segundo mayor proveedor de camarón a los Estados Unidos y es el mayor proveedor de camarón con cáscara, lo que representa 128.9
- OCTUBRE 2022
114
millones de libras del total de 298.5 millones YTD. De hecho, Ecuador ha enviado más camarón con cáscara a EE. UU. que India e Indonesia juntos. Las importaciones de camarón pelado disminuyeron un 10.3 por ciento, pero son un 10.4 por ciento más altas YTD.

Vietnam y Tailandia: Completando el top de los cinco primeros, Vietnam también envió menos a los EE. UU., un 3.9 por ciento menos en junio, pero un 15.4 por ciento más hasta la fecha. Tailandia es el único otro país entre los cinco principales que envía más; un 27.9 por ciento más en junio y un 24.4 por ciento más alto YTD.
Importaciones de camarón con cáscara, cíclicos y por tamaño
Las importaciones de camarón con cáscara, que incluye el pelado fácil, disminuyeron un 8.3% en comparación con junio de 2021, y ahora son un 6.6% más altas en lo que va del año. Los dos mayores proveedores de camarón con cáscara del país, Ecuador (-16.2%) e Indonesia (-30.8%), enviaron menos en el mes que el año pasado; mientras tanto, India (+7.9%), México (+113.0%) y Tailandia (+109.9%) enviaron más. La mayoría de los tamaños disminuyeron año a año, pero vimos más U15 y 21-25. Los valores de reemplazo (importación $/lb.) cayeron por tercer mes consecutivo; el precio promedio por libra cayó $0.17 por libra en el mes a $3.89 por libra.
Valor agregado, importación de camarón pelado
Las importaciones de camarón pelado disminuyeron un 3.5% en junio y ahora son un 5.5% más altas en lo que va del año. India se recuperó, enviando un 11.7% más en el mes, pero Ecuador (-10.3%), Indonesia (-30,1 %) y Vietnam (-15.0 %) enviaron menos en junio. Los valores de reemplazo (importación $/lb.) para camarón pelado continuaron disminuyendo, bajando $0.13 por libra a $4.17 por libra; en dos meses, el reemplazo ha bajado $0.19. Las importaciones de camarón cocido (agua tibia) aumentaron un 38.1 por ciento y son un 11.6 por ciento más altas en lo que va del año.
Las importaciones de camarón empanizado fueron un 1.2 por ciento más altas y un 33.3

por ciento más altas en lo que va del año.
Importaciones de camarón cocido, empanizado y otros
El precio del camarón cocido cayó $0.09 por libra, llegando a $5.08 por libra en junio.
Línea de tiempo del precio del camarón; anuncios minoristas
Minoristas: Las oportunidades de compra disminuyeron por segundo mes consecutivo, pero siguen en gran medida en línea con las de hace un año, pero lo que queda claro es que el punto de precio ofrecido está muy por encima de los niveles de hace un año. En comparación con el año anterior, el precio de julio de $8.28 subió $0.59 y el promedio YTD es $0.60 más alto. El camarón es parte de una larga lista de artículos en el comercio
Importaciones de camarón distribuidas por tipo de producto
- OCTUBRE 2022 115 REPORTE DE MERCADO
Importaciones de camarón pelado por año (YTD) e importación promedio $/lb
Fuente: USDOC. Urner Barry
Fuente: USDOC. Urner Barry
REPORTE DE MERCADO

minorista con presiones inflacionarias.
Suministro de camarón a EE. UU. y situación del Golfo
La data de desembarques del Servicio Nacional de Pesca Marina continúa rezagada; la más reciente data disponible es de marzo. El NMFS informó desembarques de marzo de 2022 (todas las especies, sin cabeza) de 2.539 millones de libras en comparación con 3.268 millones de libras en marzo de 2021. Esta disminución del 22 por ciento es el decimotercer mes consecutivo en el que hubo una disminución año tras año en los desembarques. El total de tres meses de 11.983 millones de libras es un 7.4 por ciento superior al total de enero-marzo de 2021 de 12.938 millones de libras. El mercado ha estado bajo una presión considerable desde la primavera y el inicio de la temporada del camarón de costa en Luisiana, y se extendió hasta la apertura de Texas. La temporada de primavera se consideró activa, con desembarques caracterizados como intensos. La temporada de Texas aún se está resolviendo, pero la anticipación ha llevado a debilitar el precio. Además, las preocupaciones sobre la demanda, las importaciones competitivas y las presiones inflacionarias de EE. UU. han pesado mucho en el mercado. La temporada de otoño del

camarón de costa en Luisiana ha comenzado desde entonces.
Exportación de camarón ecuatoriano
El mercado para el amplio espectro de camarón tigre blanco y negro importados, cultivados en fincas, ha permanecido bajo presión durante la mayor parte de este año. En general, los suministros se han considerado consistentes y la demanda un poco por debajo de las expectativas; los especialistas en marketing ahora están comparando las ventas con 2019, y no con los años impulsados por el COVID-19
de 2020 y 2021. El camarón blanco de Ecuador se ha fortalecido en origen, y algo más modestamente en el mercado estadounidense, ya que los vendedores cautelosos buscan evitar cualquier interrupción en la cadencia de ventas. El camarón blanco de origen asiático continúa disminuyendo y sigue siendo susceptible dadas las condiciones actuales del mercado. El camarón tigre negro es puesto a prueba por alternativas de camarón blanco.
La demanda de camarón se ha caracterizado como regular a buena, pero parece estar moderándose estacionalmente•
- OCTUBRE 2022

Importación de camarón de China
Autor: Sander Visch Kontali Shrimp sander@kontali.no www.shrimp.kontali.no
Elvolumen de importación durante los primeros seis meses del año alcanzó las 337,279 toneladas, poco más de 65,000 toneladas que durante el primer semestre de 2021.
Precio
Si bien los precios aumentaron un poco durante mayo, durante junio los precios se redujeron nuevamente a $6.52/kg. Esta fue una diferencia de $0.06 en comparación con los precios de importación en mayo. Mirando el YOY, los precios eran más altos por $0.58. Los valores de las importaciones durante mayo alcanzaron los $365 millones. El valor alcanzó un poco más de $2.1 mil millones, un 45% más alto que el año anterior.
Proveedores
Si bien las importaciones de Ecuador siguieron siendo las más altas entre todos los importadores y alcanzaron las 30,335 toneladas, hubo una disminución de 5,412 toneladas o un 15% con respecto a las importaciones durante abril, la reducción en las importaciones de Ecuador está directamente relacionada con las restricciones aplicadas. Si bien es posible que algunos contenedores aún estén en puerto listos para pasar por la aduana, algunos contenedores rechazados se devolvieron para ser desinfectados y reenviados. A medida que los volúmenes que ingresan al país desde Ecuador se redujeron durante junio, los precios también disminuyeron y llegaron a $6.31/kg. Esto fue $0.12 por debajo de los precios en mayo, pero aún $0.92 por encima de junio de 2021.

Las importaciones desde Ecuador durante los primeros seis meses de 2022 alcanzaron las 222,819 toneladas; un aumento de 48,000 toneladas sobre el volumen importado durante el mismo período en 2021. Mirando la data de exportación de Ecuador
y calculando un tiempo de envío de 4 a 6 semanas desde Ecuador a China, se muestra que entre el período de diciembre de 2021 y mayo de 2022 (6 meses), Ecuador envió un volumen total de 264,000 toneladas a China. Esto significa que China todavía no ha importado unas 40,000 toneladas. No está claro si estos contenedores todavía están en puerto en China, han sido desviados o han sido devueltos.
Durante junio, las importaciones de India se fortalecieron aún más y alcanzaron las 10,627 toneladas, un aumento del 27% con respecto a mayo y del 21% interanual. Esto estuvo relacionado con la cosecha y disponibilidad de materias primas de la India a partir de mayo. La demanda de camarón de la India fue fuerte, mientras el precio se mantuvo alto en $6.96/kg, el punto de precio más alto en los últimos tres años.
Con su proximidad fronteriza directa con China, las importaciones de Vietnam han sido fuertes durante el segundo trimestre en comparación con años anteriores. Las importaciones durante junio aumentaron específicamente a 6,498 toneladas, un crecimiento del 12% y un aumento notable del 186% interanual. Si bien los precios disminuyeron durante mayo, la fuerte demanda de camarón vietnamita se reflejó en junio, alcanzando los $6.54/kg, $0.20 más que en mayo. Como se mencionó anteriormente, la necesidad de camarón en China seguía siendo alta durante este período, y Vietnam ha podido satisfacer esta demanda. Sin embargo, durante junio, la disponibilidad de materia prima en Vietnam estaba disminuyendo y como resultado, los precios volvieron a subir.
Las importaciones de Tailandia se mantuvieron casi estables en 1,524 toneladas durante junio y estuvieron 10 toneladas por debajo de mayo. Sin

- OCTUBRE 2022 118
MERCADO
Importaciones de China en 2020, 2021 y 2022 (volúmenes y precio promedio/kg)
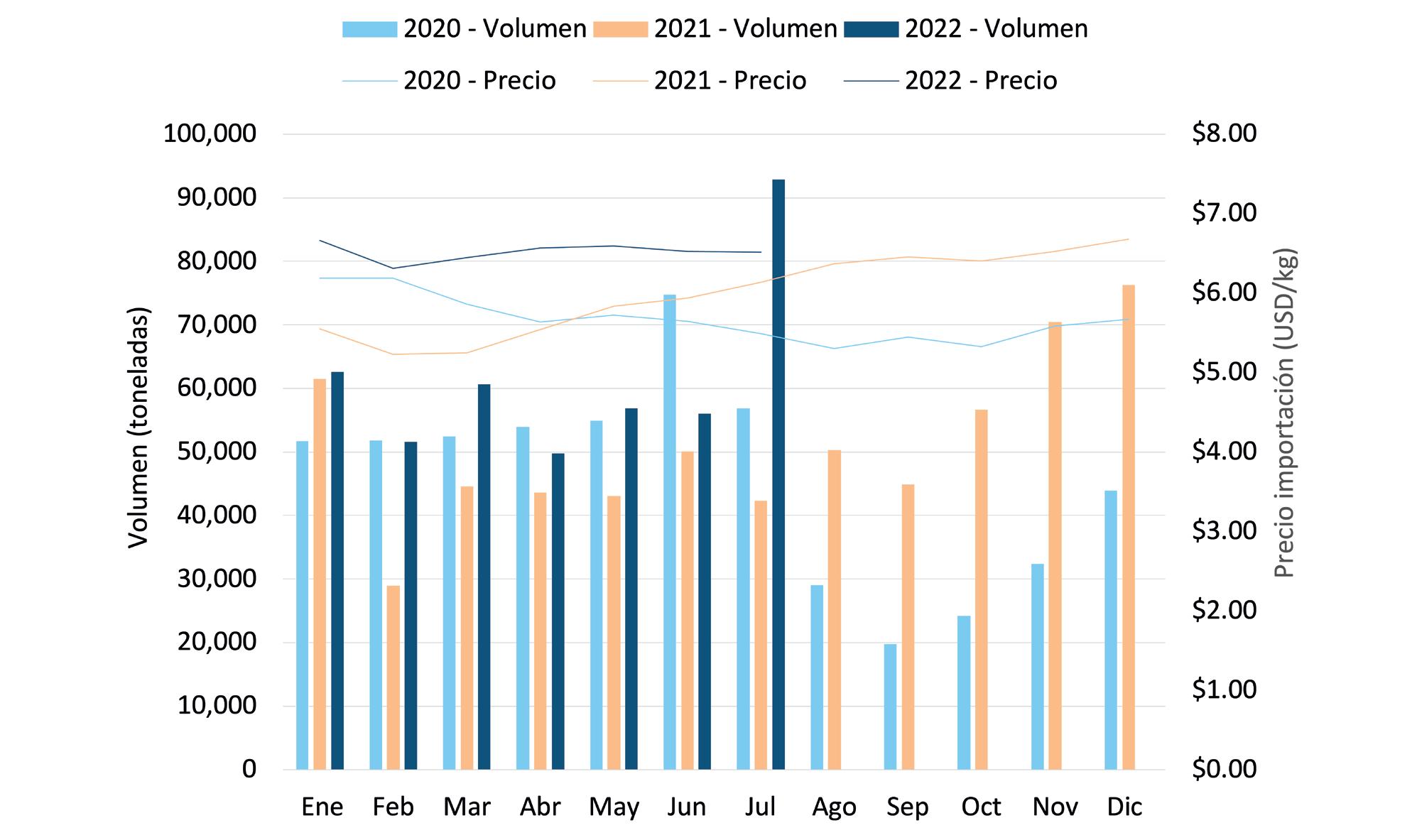
embargo, como durante junio de 2021, las importaciones de Tailandia fueron fuertes con 2,609 toneladas, y junio de 2022 mostró una disminución interanual del 42%.
En junio, los precios de importación de Tailandia disminuyeron aún más a $9.62/ kg, el precio de importación más bajo hasta ahora en 2022, pero aún $0.30 más alto que el año anterior.
Perspectivas
A principios de este mes, se publicaron algunas buenas noticias para los importadores de camarón ecuatoriano; China ha detenido sus estrictas medidas de COVID-19, incluyendo la suspensión de los exportadores cuando los productos o paquetes den positivo para COVID-19. Como se reportó anteriormente, no todo el volumen exportado de Ecuador parece ser importado por China todavía. Por lo tanto, esperamos un repunte en las importaciones durante los próximos meses, ya que incluirá los contenedores que aún están en puerto o han sido desinfectados y reembarcados. Además, al observar el patrón histórico, las importaciones aumentarán durante el final del tercer y cuarto trimestre si no se presenta el COVID-19 u otras circunstancias.
Como reportamos en nuestras actualizaciones anteriores, la demanda de camarón ciertamente está presente entre los consumidores.
En una entrevista con el comerciante chino de mariscos Ocean Treasure, dieron una perspectiva sobre la demanda: “Después de meses de cierre en las principales ciudades de China debido al resurgimiento de COVID-19, la mayoría de estas ciudades ahora han levantado las restricciones, pero las medidas de distanciamiento social todavía están vigentes. Y aunque la mayoría de las personas están ansiosas por ir a restaurantes, este sector todavía se enfrenta a las medidas vigentes, pero también le resulta difícil reiniciar sus negocios después de la larga pausa durante el COVID-19. Esto significa que el sector de restaurantes, un mercado final importante para el camarón ecuatoriano, aún tiene una demanda menor”.
Si bien el sector de restaurantes tiene una demanda más baja, el camarón importado congelado todavía tiene una gran demanda entre los importadores a gran escala. Estos importadores abastecen a plataformas de comercio electrónico, donde la demanda ha experimentado un rápido crecimiento y sigue siendo sólida. Este crecimiento está
impulsado por una generación más joven, que prefiere comprar en línea y ordenar sus compras en línea.
En cuanto a la competencia del camarón producido localmente, mencionan que el precio del camarón fresco y congelado ciertamente importa: "cuando ambos productos alcanzan el mismo nivel de precio, muchos compradores prefieren el camarón fresco sobre el camarón congelado". Esto demuestra que los consumidores tienen más confianza en los mariscos producidos localmente, y que la producción local puede ser un gran competidor del camarón congelado importado, especialmente si los precios aumentan.
En cuanto a la oferta local de camarón y como se reportó en la actualización de nuestro portal de precios, las enfermedades causadas por el clima lluvioso continuaron siendo un problema para los camaroneros en Guangdong y Fujian.
Ahora veamos el lado del proveedor. Ecuador continúa su producción, pero se enfrenta a múltiples desafíos, lo que incluye altos costos de producción y flete. Los precios en finca han aumentado durante las últimas semanas, pero se han desacelerado, lo que demuestra
- OCTUBRE 2022 119 MERCADO
que las procesadoras tienen dificultades para pagar precios más altos en finca, ya que los costos aumentan continuamente.
Vietnam mostró un crecimiento sustancial durante el segundo trimestre hacia China y, a medida que se abrieron las puertas fronterizas, las importaciones de Vietnam podrían seguir siendo fuertes. Sin embargo, debido a las condiciones culturales desfavorables (baja salinidad), la
disponibilidad de materias primas es un reto. En India, los productores de Andhra Pradesh se están preparando para la segunda cosecha. Sin embargo, las fuertes lluvias y las inundaciones dificultan las actividades de siembra. Esto podría significar que la cosecha de la India durante el cuarto trimestre podría retrasarse para las celebraciones de fin de año de EE. UU. y la UE, pero aún podría estar a tiempo para las celebraciones de año nuevo en China a principios de 2023•
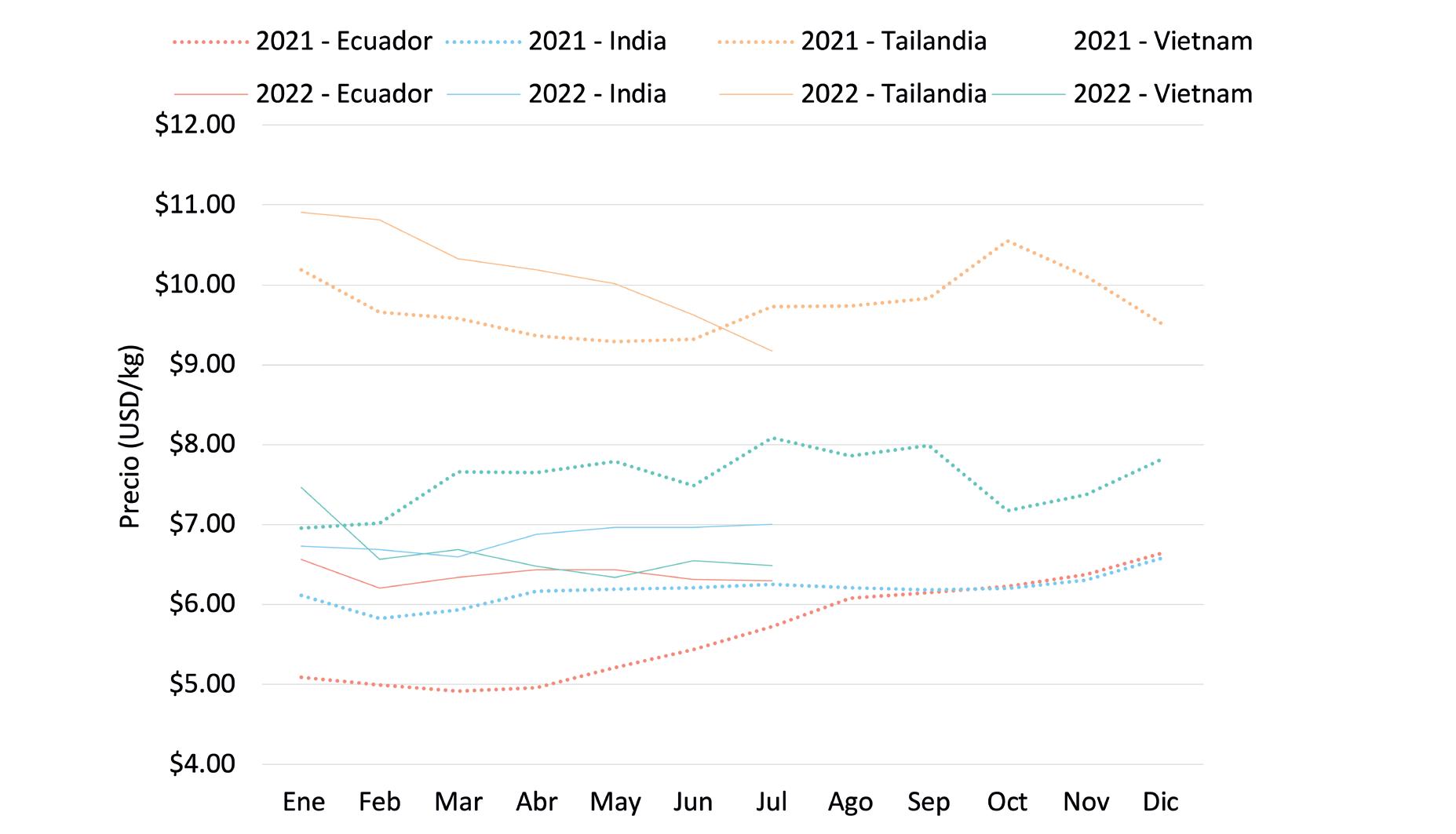

Comparación de volúmenes de importación de los principales países proveedores
Precios promedio de importación de los principales países proveedores (2021 vs. 2022)
- OCTUBRE 2022 120 MERCADO
Este informe fue escrito originalmente en inglés por Seafood TIP. El informe fue traducido por la Cámara Nacional de Acuacultura.
Para más información sobre este artículo escriba a: sander@kontali.no

Capacitación sobre inspección de carga en Puertos
Conformación de la Comisión Técnica del sector camaronero
11 de agosto.- La Cámara Nacional de Acuacultura capacitó a sus afiliados sobre las inspecciones de antinarcóticos en puertos, con el propósito de evitar la contaminación en productos de exportación. Un oficial del Centro Regional de Adiestramiento Canino CRAC dio la charla de forma virtual.
La capacitación se basó en el análisis de los perfiles de riesgo que contempla la Unidad de Análisis de Inteligencia en Puertos y Aeropuertos UAIPA, de la Policía Nacional, para realizar las inspecciones de carga.
Rechazo al cobro de una tarifa adicional por concepto de seguridad en Puertos
19 de agosto.- En la Cámara Nacional de Acuacultura se realizó la conformación de una comisión con expertos de diferentes áreas de las empresas del sector, para revisar temas técnicos que requieren atención, acción o pronunciamiento de la industria. La convocatoria fue liderada por Yahira Piedrahita, Directora Ejecutiva de la Cámara Nacional de Acuacultura.
Participaron de la reunión la Dra. Laurence Massaut (BioMar), Dra. Diva Aldama y MSc. Marita Monserrate (Skretting Ecuador), Dr. Xavier Romero (Grupo Almar), Biol. Iván Cereceda (AquaGen), Ing. Ana María Costa y el Ing. José Fernando Vargas (Songa).
El propósito de la comisión técnica es establecer una agenda de trabajo, conocer y analizar propuestas de normativa sanitaria.
Dragado en el canal de acceso al Puerto de Guayaquil
19 de agosto.- La Cámara Nacional de Acuacultura como entidad socio fundadora de la Corporación de Gremios Exportadores del Ecuador, participó de un conversatorio con representantes de medios de comunicación para dar a conocer públicamente su posición de estar a favor de los controles del narcotráfico en puertos, pero rechazan la imposición de una nueva tarifa por la implementación de escáneres, pues el sector exportador ya está cancelando altos costos por seguridad en las terminales y no puede asumir otra tarifa más por el mismo concepto; lo cual afectaría su competitividad.
José Antonio Hidalgo, Director Ejecutivo de AEBE y Merlyn Casanova, Directora Ejecutiva de ANECACAO también participaron en la mesa de diálogo con la prensa.

26 de agosto.- En la Cámara Nacional de Acuacultura, se realizó el proceso de socialización de los resultados de trabajos y análisis efectuados en el mantenimiento del dragado en el canal de acceso al puerto de Guayaquil. El Director de Ambiente de la CNA, Leonardo Maridueña recibió a los representantes de la empresa GCU S.A. de la Municipalidad de Guayaquil y delegados de la multinacional Jan De Nul , quienes fueron los expositores del proceso. En la reunión se concluyó que los resultados de los análisis de calidad de agua del golfo, muestran que los valores de los parámetros se encuentran dentro de los límites permisibles, que el sitio de depósito de los sedimentos se sigue operando de acuerdo a lo planificado, lo que implica que no hay una sobresedimentación. En el proyecto se está trabajando en llevar la profundización de 15 m a 18 m, y al momento se está analizando la factibilidad económica del mismo. De llevarse a cabo, se realizaría en los próximos dos años.


- OCTUBRE 2022 122 NOTICIAS
Reunión con la SENAE para presentar observaciones a la implementación de escáneres en Puertos

26 de agosto.- En el edificio La Previsora de Guayaquil, José Antonio Camposano, Presidente Ejecutivo de la CNA y Presidente del Directorio de Cordex participó de la reunión convocada por la Secretaría Nacional de Aduanas del Ecuador SENAE para dar a conocer sus observaciones y plantear propuestas a la estrategia de seguridad e implementación de escáneres en puertos, resaltando que la medida no debe afectar la competitividad de las exportaciones.

SSP presente en capacitación a nutricionistas y medios de comunicación de EE. UU.
7 de septiembre.- Pamela Nath Directora de Sustainable Shrimp Partnership fue parte del taller denominado ”Experiencia virtual sobre la inmersión en acuicultura con nutricionistas y medios de Comunicación de EE. UU.”.
El propósito de este evento fue educar a los nutricionistas sobre la acuicultura y sus beneficios, para que puedan tener más confianza al comunicar los beneficios de la acuicultura a sus clientes y pacientes. Todos los asistentes eran expertos en el campo de la nutrición. La importancia se centra en que la población busca en ellos información sobre lo que deben consumir, debido a esto, es importante que ellos tengan información confiable y herramientas necesarias para sentirse seguros acerca de la acuicultura.
Como parte de esta experiencia, los asistentes aprendieron todo sobre la producción camaronera. Carlos Sánchez, de Grupo Almar y Miembro Fundador de SSP, compartió todos los detalles sobre la

- OCTUBRE 2022 123
industria de cultivo de camarón en Ecuador, así como la importancia de seleccionar camarones premium certificados, y saludables.
El reconocido chef estadounidense y defensor de la sustentabilidad Barton Seaver guió a los asistentes a través del proceso de preparación de una pasta de camarones con calabaza, almendras y pasas.
SSP participó en el Global Shrimp Forum

13 exportadoras de camarón ecuatoriano participaron en singapur Seafood Expo Asia la feria de productos del mar más importante de Asia

8 de septiembre.- En Utrecht, Holanda, María Fernanda Vilches, Gerente de Procesos de Sustainable Shrimp Partnership participó en el panel de discusión en “Global Shrimp Forum”.

El objetivo de esta presentación fue compartir experiencias acerca de la importancia de trabajar en colaboraciones precompetitivas, qué tan relevantes son los proyectos de mejora para generar cambios positivos a escala y qué tan importantes son la innovación y la tecnología para la sustentabilidad de la industria. En este evento, varios líderes de la industria global del camarón se reunieron para discutir los retos que enfrentan sus negocios y para desarrollar una visión estratégica a largo plazo hacia una industria resistente y sostenible.
El evento fue organizado por Aquaculture Stewardship Council, Shrimp Insights y Contango.
Entrenamiento para la evaluación sensorial del camarón
El evento se realizó del 14 al 16 de septiembre en el Suntec Singapore Convention & Exhibition Centre. El pabellón de Ecuador con el distintivo “First Class Shrimp” tuvo 144m2. La delegación ecuatoriana estuvo conformada por las siguientes empresas: Crimasa, Edpacif, Excamecor, Expalsa, Exportquilsa, Expotuna, Frigolandia, Nirsa, Omarsa, Procamaronex, Santa Priscila, Songa y Total Seafood. La presencia ecuatoriana fue organizada en su totalidad por la Cámara Nacional de Acuacultura.
Singapur es un importante eje de negocios para el comercio mundial. Es el centro de envío más activo del mundo conectado a 600 puertos en más de 120 países. Su aeropuerto, el Aeropuerto Changi de Singapur, es un centro aéreo regional líder y reconocido como uno de los mejores a nivel internacional.
Reunión para elaborar mapa de riesgo en el Golfo de Guayaquil

19 de septiembre.- En el marco de cooperación entre el Ministerio de Producción, Comercio Exterior, Inversiones y Pesca y la FDA, funcionarios de la Subsecretaría de Calidad e Inocuidad recibieron entrenamiento para la evaluación sensorial de la calidad del camarón.
El taller se desarrolló en las instalaciones de la empresa OMARSA en el cantón Durán. 36 personas participaron, entre ellas representantes de la CNA.
16 de septiembre.- en la CNA se realizó una reunión liderada por el Director de Seguridad de la entidad, Luis Herrera y los jefes de seguridad del sector camaronero, para identificar los sectores que afectan las operaciones de producción y transporte de productos en el Golfo de Guayaquil. El objetivo fue elaborar un mapa de riesgo para insistir ante las autoridades competentes la atención oportuna a los pedidos formulados por la CNA. Las entidades involucradas son: el Ministerio del Ambiente, la Policía Nacional y la Dirección Nacional de Espacios Acuáticos DIRNEA.
- OCTUBRE 2022 124 NOTICIAS
Revisión de avances en el marco de la negociación del Acuerdo Comercial con China
Oportunidades de exportación con la Unión Europea
20 de septiembre.- De forma virtual, se realizó la reunión de revisión de avances de la Mesa de Medidas Sanitarias y Fitosanitarias en el marco de la negociación del Acuerdo Comercial entre Ecuador y China.
Participaron representantes del Ministerio de Producción, Comercio Exterior, Inversiones y Pesca, MPCEIP, miembros del Cuarto Adjunto y la Cámara Nacional de Acuacultura.
Se presentaron los logros obtenidos hasta ese momento y se acordó mantener informado al sector empresarial sobre los avances en la negociación.
Proyecto de dragado Islote el Palmar

22 de septiembre.- En la Prefectura del Guayas se realizó una reunión entre el Presidente Ejecutivo de la CNA, José Antonio Camposano y el Director de Ambiente de la entidad, Leonardo Maridueña, para conocer el estado del proyecto de dragado Islote el Palmar, debido a que la actividad camaronera se encuentra en la zona de influencia directa del mismo.

27 de septiembre.- Daniel Pesantes, Gerente de Comercio Exterior de la CNA participó en el panel de diálogo con el sector empresarial en el marco de la celebración por los cinco años de vigencia del acuerdo comercial entre Ecuador y la UE.

En el encuentro se plantearon nuevas oportunidades para las exportaciones de camarón ecuatoriano a ese importante destino.
Reunión sobre protocolos de seguridad en CONTECON
29 de septiembre.- En las instalaciones de CONTECON, el Director de Seguridad de la CNA, Luis Herrera participó de una reunión para conocer los protocolos y procedimientos de inspecciones preembarque de contenedores por parte de la Policía Antinarcóticos.
En la reunión participaron representantes del CRAC de la Policía de la Zona 8, miembros de las empresas exportadoras de camarón y el Gerente de Seguridad Portuaria CONTECON. El propósito fue determinar los errores de procedimiento y aplicar los correctivos con carácter de urgente.
- OCTUBRE 2022 126 NOTICIAS

La primera empresa de alimento balanceado ECOEFICIENTE con certificación ambiental “Punto Verde" en la industria de alimentos balanceados de Ecuador
Gisis
S.A. (Skretting Ecuador) es la primera planta de fabricación de alimento balanceado en Ecuador que aplica dentro de su proceso de manufactura el crecimiento económico y el bienestar ecológico. Con la certificación Punto Verde, la actividad económica de la empresa gira en torno a la producción e inversión de tecnología ECOAMIGABLE, enfocándose en el uso más eficiente de los recursos con el propósito de mitigar el impacto al medioambiente.
Esta certificación ambiental se suma a las demás certificaciones que la compañía posee actualmente, en el km. 4.5 vía Durán Tambo; como son: ISO 9001, HACCP, Global GAP, BAP, Orgánico, Cumplimiento al Estándar ASC para camarones, así como del programa interno Nutrace que garantiza la calidad e inocuidad del alimento balanceado.
Skretting, con presencia global en el sector acuícola, se encuentra en una posición ideal para contribuir al desarrollo de una producción de alimento más sostenible, por lo que esta nueva certificación avala la elaboración de productos aceptables desde el punto de vista ambiental, a través del uso



De izquierda a derecha: Econ. Carlos Miranda, gerente general de Skretting Ecuador e Ing. Gustavo Manrique, ministro de Ambiente, Agua y Transición Ecológica.
de tecnologías más limpias, a continuación, se detallan los proyectos certificados:
1. Reducción del 30.9% del consumo de combustibles en calderas por mejor eficiencia en secadores.
2. Reducción del 95.6% del consumo de
agua por implementación de un sistema de extrusión más eficiente.
3. Disminución del 17.10% en generación de desechos por uso de Big Bags.
4. Reducción del 7.36% del consumo de energía en calderas por cambio tecnológico en la elaboración de alimentos balanceados con la planta Galápagos.
- OCTUBRE 2022 128 NOTICIAS EMPRESARIALES
Gustavo Manrique, ministro de Ambiente, Agua y Transición Ecológica junto a Karina Briones, gerente de calidad de Skretting LatAm.
Equipo de Skretting Ecuador junto al ministro de Ambiente, Agua y Transición Ecológica

Primer Centro Experimental para el desarrollo de Tecnología Acuícola con implementación de un sistema de producción abierto
Nicovita - Vitapro firmó un convenio para implementar y poner en funcionamiento el primer Centro Experimental para el desarrollo de Tecnología Acuícola de camarón (CEA Tecnológico) del Ecuador.

Se trata de un centro de investigación e innovación con condiciones reales de producción de camarón en campo, que estará 100% dedicado a la validación y mejora continua de tecnologías existentes, pero también al desarrollo de nuevas y propias tecnologías. Será un espacio vivencial y experimental de investigación, que contará con un conjunto de piscinas de cultivo de camarón y un grupo de expertos destinado a la validación de tecnologías existentes, nuevas y propias de Nicovita; así como al desarrollo de nuevas soluciones tecnológicas que contribuyan a mejorar la productividad, los niveles de eficiencia y la rentabilidad en el cultivo de camarón, contribuyendo así al desarrollo sostenible de la industria.
El nuevo Centro Experimental Acuícola para el desarrollo Tecnológico (CEA Tecnológico) cierra el círculo virtuoso en cuanto a investigación, ya que complementa la
generación de conocimiento que se realiza en su laboratorio central y planta piloto, así como en la red 04 de centros experimentales dedicados a la nutrición y desafíos sanitarios que Nicovita ha instalado en Perú (Trujillo, Lima, Tumbes) y México, respectivamente.
En el CEA Tecnológico la investigación se implementará en un sistema de producción abierto, que simulará la realidad de la mayoría de productores en Ecuador y Latinoamérica. Permitirá experimentar y desarrollar soluciones enfrentando las

mismas variables geográficas, climáticas, físicas, de temperatura, entre otras, que viven a diario los productores de camarón.
El CEA Tecnológico es el punto de partida de nuevas y mayores inversiones enfocada en tecnología que pronto Nicovita lanzará al mercado, fortaleciendo la infraestructura de investigación experimental en campo del sector camaronero, y consolidándola -nuevamente- como su principal socio estratégico•
- OCTUBRE 2022NOTICIAS EMPRESARIALES
Alianza para una producción de camarón responsable
Earthworm Foundation, una organización internacional sin fines de lucro que realiza proyectos sociales y ambientales, se asoció con BioMar para impulsar proyectos de camarón sostenible en Ecuador. La colaboración completa de la cadena de valor no solo incluirá alimentos acuícolas libres de deforestación, sino también iniciativas de desarrollo de capacidades para impulsar el cambio social y las mejores prácticas de sostenibilidad en la región.
En Seafood Expo Global en Barcelona, Florie Hovine, Gerente Miembro de Earthworm Foundation, anunció que se han asociado con BioMar para lanzar una iniciativa de sostenibilidad del camarón que impulsará la producción acuícola y las buenas prácticas sociales.

Al asociarse con una organización muy respetada y bien informada que se especializa en iniciativas sociales y ambientales, como Earthworm Foundation, existe la oportunidad de trabajar de cerca con los productores de camarón ecuatorianos para apoyarlos compartiendo prácticas ambientales y sociales mejoradas.
Los consumidores de hoy en día son cada vez más conscientes de sus opciones de productos del mar. Quieren saber de dónde provienen y el impacto que ha tenido en el medio ambiente y las comunidades locales•

131 NOTICIAS EMPRESARIALES
Danny Vélez, Gerente General BioMar Ecuador; Florie Loth Hovine, Gerente Miembro de Earthworm Foundation; Henrik Aarestrup VP LATAM, Shrimp & Hatchery, Grupo BioMar y Karina Marcano, Gerente de Proyecto Andes Earthworm Foundation.
Reutilización de pallets a través de programa de sostenibilidad

Cargill,
promueve la recuperación de material reciclable mediante su programa “AquaPallet”, una iniciativa que busca reutilizar los pallets de madera empleados en los despachos de productos a sus clientes.
El programa consiste en que los clientes entreguen los pallets a partir del segundo despacho para que, de manera cíclica, en vez de terminar como desecho, sean reemplazados y recolectados para ser introducidos nuevamente al ciclo productivo mediante las empresas gestoras de residuos no peligrosos especializadas en el reciclaje de estos materiales.
En el primer año de funcionamiento, el programa “AquaPallet” ha logrado la participación activa de 43 clientes, obteniendo un 15% de pallets recuperados.

En agosto, el equipo de Servicio al Cliente de Cargill entregó reconocimientos a los clientes que tuvieron una participación constante en el programa, permitiendo llegar a las metas alcanzadas.
Cargill espera que más de sus clientes se unan a esta propuesta y convertirse en un referente para que otras empresas ecuatorianas incluyan la sostenibilidad en sus procesos y generen un impacto positivo en las áreas donde operan•
- OCTUBRE 2022 132 NOTICIAS EMPRESARIALES


Las tendencias más importantes en tecnología acuícola fueron presentadas durante ONE 2022
LaConferencia ONE de Alltech recibió a casi dos mil asistentes de todo el mundo para atender el evento en persona, y se conectó con otros cinco mil participantes en línea. Ahora en su 38.º edición, este encuentro de primer nivel presentó a destacados expositores y a más de 100 líderes de los agronegocios; quienes compartieron sus conocimientos a través de talleres presenciales y de sesiones focos; en los que se abordaron los desafíos y las oportunidades en la industria agropecuaria, los negocios, la salud, el bienestar y el desarrollo profesional.
La conferencia tuvo una sesión 100% dedicada a la acuacultura en donde Maud Valkenaars, científica en nutrición de Alltech Coppens, destacó que “La acuacultura se ha ganado el prestigio, entre los consumidores, de ofrecer una de las proteínas más sostenibles del mercado”.
Durante el simposio, Ecuador fue
representado por una gran delegación de acuicultores que pudieron participar de las sesiones focos, de los eventos sociales y de relacionamiento que había en la programación del evento.
Este año, Philip Lyons, director global de investigación acuícola de Alltech, señaló que “La acuacultura es el sector de la proteína
animal con más proyección y para impulsar este crecimiento; se están desarrollando nuevas tecnologías de forma permanente”.

La Conferencia ONE de Alltech volverá a Lexington del 21 al 23 de mayo del 2023•

- OCTUBRE 2022NOTICIAS EMPRESARIALES














 José Antonio Camposano Presidente Ejecutivo de la Cámara Nacional de Acuacultura
José Antonio Camposano Presidente Ejecutivo de la Cámara Nacional de Acuacultura








 Pamela Nath Directora de SSP
Pamela Nath Directora de SSP






 Rodrigo Laniado CEO de SONGA y Miembro Fundador de SSP
Rodrigo Laniado CEO de SONGA y Miembro Fundador de SSP


 Sandro Coglitore Gerente General de Omarsa y Miembro Fundador de SSP
José Antonio Lince
Presidente Ejecutivo del Grupo ALMAR y Miembro Fundador de SSP
Sandro Coglitore Gerente General de Omarsa y Miembro Fundador de SSP
José Antonio Lince
Presidente Ejecutivo del Grupo ALMAR y Miembro Fundador de SSP


















































































































































































