
Editorial RW S. A. A. Gonzalez 1351,Guaymallén. Mendoza Argentina. CP: 5525
Tel. : +54 261 491 3211 - Skype: revista.bioreview
Director General de Medios
Dr. Sergio A. Sainz ssainz@rwgroup.com.ar
Directora de Contenidos
Dra. Griselda Basile gbasile@rwgroup.com.ar
Social Media Manager / Agente Comercial de Cuentas
Cyntia Perez info@rwgroup.com.ar
Directora de Arte y Desarrollo Digital Lucía Zandanel Terán arte@rwgroup.com.ar
Sitios Web www.revistabioreview.com www.cubranews.com.ar www.rwgroup.com.ar
Agradecimientos
Abreu Duarte, Rafael
Acta Médica del Centro (Cuba)
Cámara Argentina de Laboratorios de Análisis Bioquímicos (CALAB) Centro Centroamericano de Población, Revista Electrónica Semestral (Universidad de Costa Rica)
Chávez Villagómez, Norma Susana
Martínez García, Geovedy
Revista Científica Arbitrada Multidisciplinaria PENTACIENCIA
Revista Habamrera de Ciencias Médicas
Vásquez Cerdas, Melissa
Registro de la Propiedad Intelectual Nº: En trámite - Revista Bioreview® es propiedad intelectual de RW S. A. - A. González 1351,Guaymallén. Mendoza Argentina.
Tel.: +54 261 4313686 - Cel.: +54 261 3345353 - La marca Revista Bioreview® es propiedad de RW S. A. Revista Bioreview® en formato impreso es una publicación mensual de suscripción paga. Las ideas u opiniones expresadas en las notas son responsabilidad de sus autores y no representan el pensamiento de RW S.A. y las firmas anunciantes, quienes deslindan cualquier responsabilidad en ese sentido. Se prohíbe la reproducción total o parcial del material incluido en esta revista por cualquier medio conocido o por conocerse. El uso del contenido de esta revista queda bajo exclusiva responsabilidad del usuario. Impreso en Artes Gráficas BUSCHI S.A. Ferré 2250,1437 Buenos Aires, Capital Federal, Argentina.




 Bioquímico Sergio Sainz Director General de Medios ssainz@rwgroup.com.ar
Bioquímica Griselda Basile Directora de Contenidos gbasile@rwgroup.com.ar
Cyntia Perez Social Media Manager info@rwgroup.com.ar
DI Lucía Zandanel Terán Directora de Arte y Desarrollo Digital arte@rwgroup.com.ar
Bioquímico Sergio Sainz Director General de Medios ssainz@rwgroup.com.ar
Bioquímica Griselda Basile Directora de Contenidos gbasile@rwgroup.com.ar
Cyntia Perez Social Media Manager info@rwgroup.com.ar
DI Lucía Zandanel Terán Directora de Arte y Desarrollo Digital arte@rwgroup.com.ar
Sumario
Diagnóstico Clínico Aplicado 28
Estudios genético-moleculares de miotonías hereditarias en la población costarricense
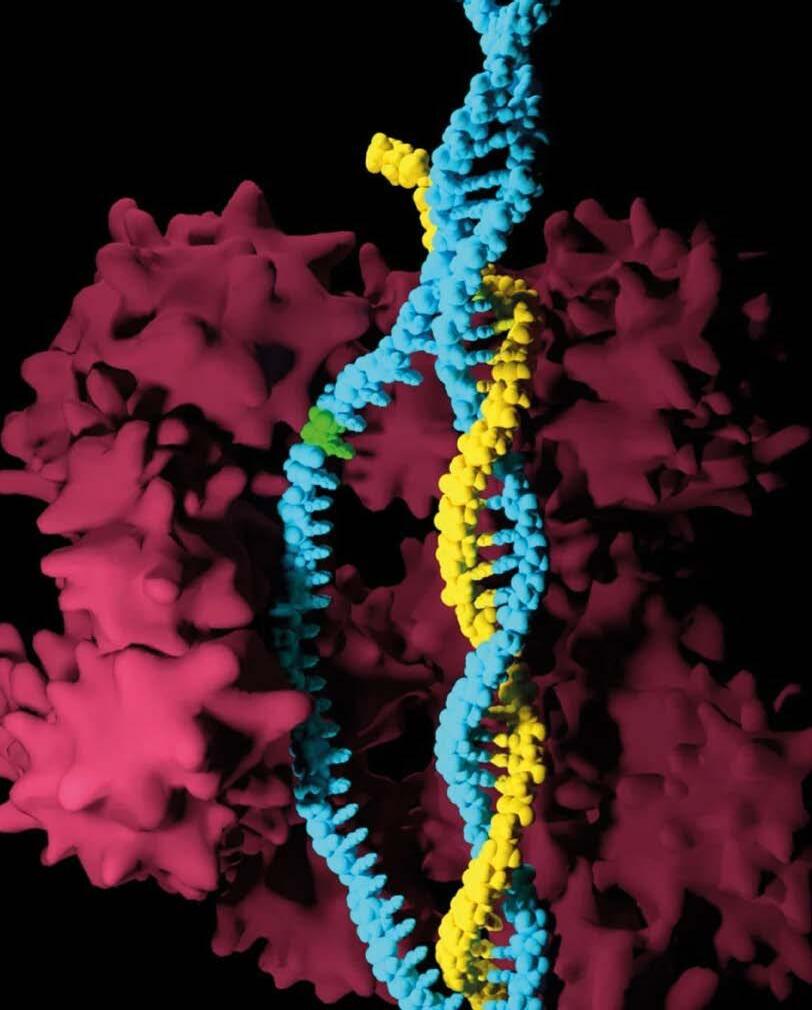
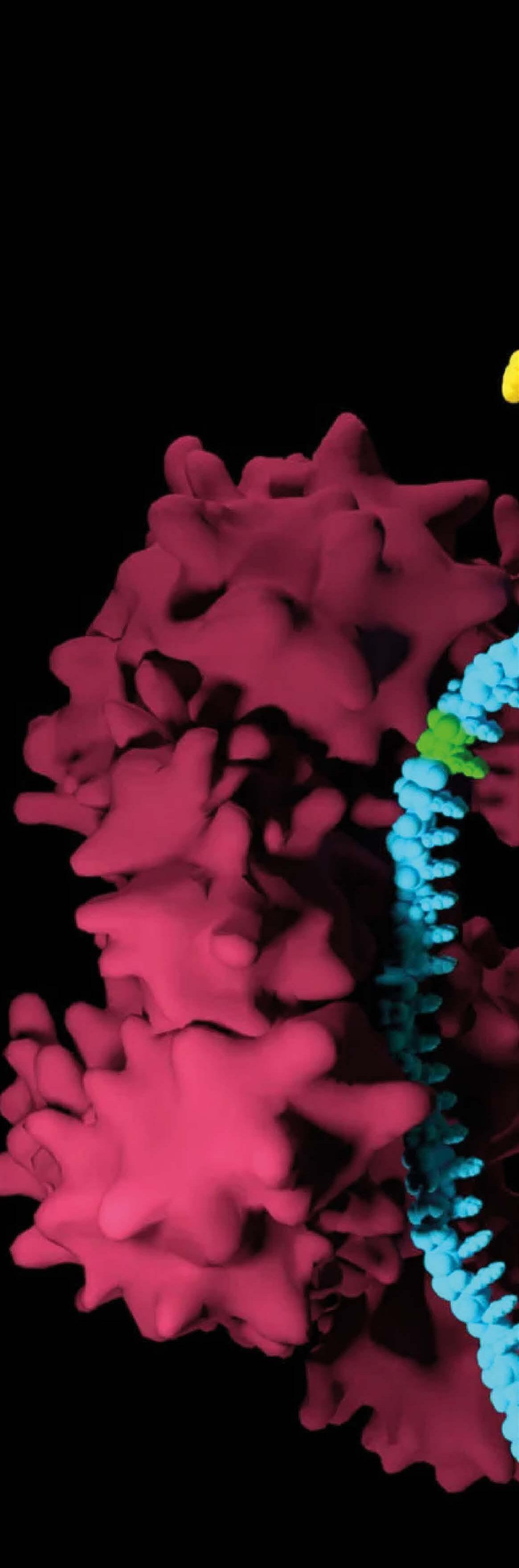
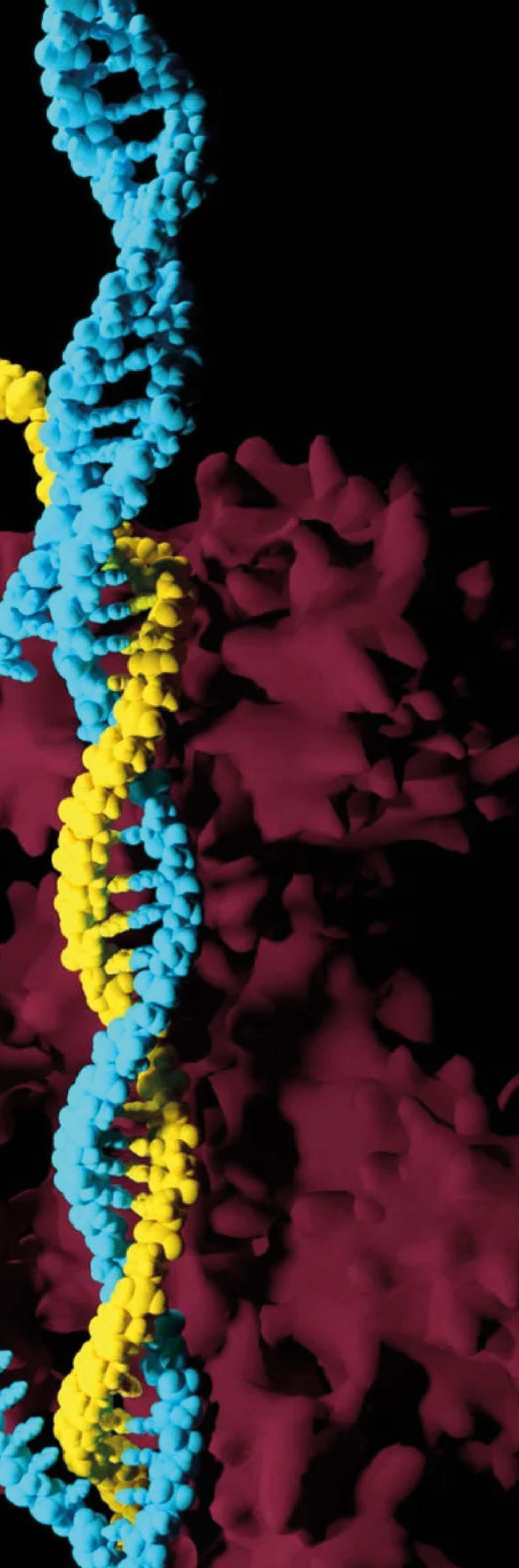
Las miotonías hereditarias son enfermedades genéticas raras, se presentan con muy baja frecuencia en el país. Sin embargo, son altamente discapacitantes, limitan la movilidad y, por tanto, afectan la funcionalidad y la calidad de vida de quienes las padecen; además, por su origen genético cuentan con escasas opciones terapéuticas y de prevención. Así pues, representan un reto para el paciente, su familia y el sistema de salud, ya que, por su poca ocurrencia, se requieren grandes esfuerzos para diagnosticarlas de forma temprana, comprender sus manifestaciones clínicas y encontrar el abordaje apropiado. Debido a su complejidad, gravedad y a que comprometen diferentes órganos y sistemas simultáneamente, explorar las bases genéticas y moleculares de la variabilidad clínica (variación de las manifestaciones clínicas) en cuanto al tipo y severidad de estas patologías entre individuos afectados y familias con la misma alteración genética, así como realizar un diagnóstico certero, resultan claves para brindar la asesoría y el tratamiento más adecuado. ... Página 06
Diagnóstico de infecciones genitales bajas no virales en pacientes procedentes de la consulta de ginecología infantojuvenil
Las infecciones genitales bajas no virales constituyen uno de los motivos más frecuentes de consulta médica en Ginecología y es una importante causa de morbilidad, entre ellas las infecciones de cérvix, vagina, vulva y sus glándulas anexas. Entre los microorganismos más frecuentes de etiología no viral se encuentran Candida spp., causantes de la vaginosis bacteriana, Trichomonas vaginalis, Neisseria gonorrhoeae y Chlamydia trachomatis y algunas especies de Mycoplasma. Página 28

Actualidad
70
CALAB: un esfuerzo constante para mejorar la tarea de los laboratorios. Página 70
CALAB realizó 2° Encuentro de Recursos
Humanos. Página 70
CALAB presentó Testeate.ar. Página 71
Bioquímica Molecular 06
Diagnóstico Clínico Aplicado 40
Gestión de la Calidad 52
Hiperglucemia y leucocitosis como predictores de complicaciones intrahospitalarias en pacientes con Infarto del miocardio agudo
Del conjunto de las enfermedades cardiacas, la cardiopatía isquémica representa el 30 %. Más de siete millones de personas mueren cada año como consecuencia de esta enfermedad, lo que corresponde a un 12,8 % de todas las muertes.(1) En Cuba las enfermedades isquémicas del corazón alcanzaron una tasa de mortalidad en el año 2020 de 165,8 defunciones por cada 100000 habitantes. Dentro de ellas, el Infarto del miocardio agudo ocupa un lugar preponderante, con una tasa de mortalidad de 69,7 fallecidos por 100000 habitantes, superior a las cifras del año precedente.(2) Página 40
Agenda de Formación 70
Formación con modalidad Online y Presencial en todo el mundo. Página 70
Estandarización y control de calidad en centrífugas del área de Uroanálisis
El avance de la tecnología y el desarrollo de los equipos médicos, ha permitido que el diagnóstico de los pacientes sea más acertado y confiable, sin embargo, aún hay falencias en el sistema, que requieren ser atendidas (Galindo & Pérez, 2019). Existen diferentes formas de identificar el estado de salud de una persona, el examen de orina es uno de ellas, forma parte de un conjunto de exámenes rutinarios encargados por los doctores para chequear si hay infecciones en las vías urinarias, diabetes o problemas renales. Para llegar analizar la muestra biológica de orina, se requiere que su recolección y tratamiento sea óptimo, asegurando que el análisis sea lo más preciso posible (Flores y otros, 2022)... Página 52
Índice de Auspiciantes 74
Nuestros Patrocinantes siempre presentes.
Página 74
Estudios genético-moleculares de miotonías hereditarias en la población costarricense

Melissa Vásquez Cerdas1 http://orcid.org/0000-0002-8879-5500
Rebeca Vindas-Smith2 http://orcid.org/0000-0001-6913-0805
Patricia Cuenca Berger3 http://orcid.org/0000-0003-1255-2809
Gerardo Del Valle Carazo 4 http://orcid.org/0000-0001-9450-6405
Fernando Morales Montero5 http://orcid.org/0000-0002-6564-8671
1Instituto de Investigaciones en Salud (INISA), Universidad de Costa Rica, San José, COSTA RICA. Correo electrónico: melissa.vasquez@ucr.ac.cr.
ORCID: https://orcid.org/0000-0002-8879-5500
2Instituto de Investigaciones en Salud (INISA), Universidad de Costa Rica, San José, COSTA RICA. Correo electrónico: rebeca.vindas@ucr.ac.cr
ORCID: https://orcid.org/0000-0001-6913-0805
3Instituto de Investigaciones en Salud (INISA), Universidad de Costa Rica, San José, COSTA RICA. Correo electrónico: patcube03@yahoo.com
ORCID: https://orcid.org/0000-0003-1255-2809
4Laboratorio de Neurofisiologia (Neuro-Lab) San José, COSTA RICA. Correo electrónico: neurolab22@yahoo.com ORCID: https://orcid.org/00000001-9450-6405
5Instituto de Investigaciones en Salud (INISA), Universidad de Costa Rica, San José, COSTA RICA Correo electrónico: fernando.moralesmontero@
6 Revista Bioreview®
ucr.ac.cr ORCID: https://orcid.org/0000-0002-6564-8671
Población y Salud en Mesoamérica
On-line version ISSN 1659-0201
PSM vol.19 n.2 San Pedro Jan./Jun. 2022
http://dx.doi.org/10.15517/psm.v0i19.48067
Centro Centroamericano de Población Ciudad Universitaria Rodrigo Facio, San Pedro de Montes de Oca, San José, CR, 2060, 25111452, 25111450 revista@ccp.ucr.ac.cr
Resumen
Introducción: las miotonías hereditarias son enfermedades del músculo esquelético, clínica y genéticamente heterogéneas, caracterizadas por presentar miotonía (retraso en la relajación muscular). Se dividen en distróficas y no distróficas, las cuales son causadas por mutaciones en el ADN.
Objetivo: describir los hallazgos más relevantes sobre algunas miotonías hereditarias en Costa Rica.
Metodología: se realizaron estudios genético-moleculares en individuos afectados con una condición miotónica y sus familiares en riesgo genético.
Resultados: la mutación de la distrofia miotónica tipo 1 (DM1) se encontró en 246 individuos. Nuestros estudios contribuyeron a mejorar la correlación entre el tamaño de la mutación y la edad de inicio de los síntomas, además, se demostró el papel modificador de algunos otros factores genéticos en la DM1. De las familias de 18 pacientes negativos para la mutación DM1, en ocho se logró identificar una mutación en genes que proporcionan la información para formar canales iónicos. Los análisis de función ayudaron a mostrar que esas mutaciones ocasionan cambios estructurales y estos modifican las propiedades de los canales, provocando una pérdida o ganancia de su función.
Conclusiones: este trabajo permitió la clasificación clínica correcta de muchos pacientes, así como explorar las bases genéticas y moleculares de la variabilidad clínica de estas enfermedades, mediante la búsqueda de factores modificadores de la DM1 y los estudios funcionales de mutaciones causantes de canalopatías hereditarias, aspecto clave para asesorar a pacientes y familias y abordar la enfermedad de la forma más adecuada.
Palabras clave: análisis funcionales; diagnóstico molecular; miotonías; mutación
Abstract: Molecular-genetic studies of inherited myotonic conditions in Costa Rica
Introduction: Hereditary myotonias are a clinically and genetically heterogeneous group of skeletal muscle diseases characterized by myotonia (delayed muscle relaxation). Clinically, they are classified as dystrophic and non-dystrophic myotonias, which are caused by mutations in the DNA.
Aim: Describe the most relevant findings on some hereditary myotonias in Costa Rica.
Methodology: Genetic-molecular studies of these diseases were carried out in individuals affected with a myotonic condition and their relatives at genetic risk.
Results: The mutation for myotonic dystrophy type 1 (DM1) was found in 246 individuals. We have seen an improvement in the correlations between the size of the mutation and the age of onset of symptoms, in addition we have demonstrated the modifying role of some genetic factors in DM1. Of 18 patients who were negative for the mutation causing DM1, in eight families, a mutation was identified in genes, that provide the instructions for producing proteins called ion channels. Analyzes at the functional level helped to show that these mutations cause structural changes that modify the properties of these channels, causing a loss or gain of channel function.
Conclusions: Our studies have allowed a correct clinical classification for many patients with these pathologies, in addition to explore the genetic and molecular basis of the clinical variability of these diseases, by searching for DM1 modifying factors and functional studies of new mutations that cause hereditary channelopathies, which is key to provide genetic counseling to patients and families and treating the disease in the most appropriate way.
Keywords: Functional analyses; Molecular diagnosis; Mutation; Myotonias
1. Introducción
Las miotonías hereditarias son enfermedades genéticas raras, se presentan con muy baja frecuencia en el país. Sin embargo, son altamente discapacitantes, limitan la movilidad y, por tanto, afectan la funcionalidad y la calidad de vida de quienes las padecen; además, por su origen genético cuentan con escasas
7 Bioquímica Molecular Año XII · Número 138 · Febrero 2023





























8 Revista Bioreview

























































opciones terapéuticas y de prevención. Así pues, representan un reto para el paciente, su familia y el sistema de salud, ya que, por su poca ocurrencia, se requieren grandes esfuerzos para diagnosticarlas de forma temprana, comprender sus manifestaciones clínicas y encontrar el abordaje apropiado. Debido a su complejidad, gravedad y a que comprometen diferentes órganos y sistemas simultáneamente, explorar las bases genéticas y moleculares de la variabilidad clínica (variación de las manifestaciones clínicas) en cuanto al tipo y severidad de estas patologías entre individuos afectados y familias con la misma alteración genética, así como realizar un diagnóstico certero, resultan claves para brindar la asesoría y el tratamiento más adecuado.
En este artículo presentamos un resumen de los hallazgos de mayor relevancia ya publicados en la investigación sobre las miotonías hereditarias en la población costarricense, la cual venimos desarrollando en el Instituto de Investigaciones en Salud (INISA) de la Universidad de Costa Rica desde el año 1998. Describimos los ensayos dirigidos a lograr la clasificación clínica correcta de muchos pacientes, al lado de estudios que han permitido examinar y entender mejor la variabilidad clínica de estas enfermedades, mediante la búsqueda de elementos modificadores de la distrofia miotónica tipo 1 (DM1) y los análisis funcionales de nuevas mutaciones causantes de canalopatías hereditarias.
Lo anterior ha sido posible gracias al financiamiento otorgado durante todos estos años por la Universidad de Costa Rica (UCR), el Consejo Nacional para Investigaciones Científicas y Tecnológicas (CONICIT) de Costa Rica, la Asociación Americana de Distrofias Musculares (MDA) y la Asociación Francesa contra las Miopatías (AFM-Téléthon), junto con colaboradores nacionales e internacionales.
2. Referente Teórico
Las miotonías hereditarias son un grupo heterogéneo de enfermedades del músculo esquelético caracterizadas por presentar miotonía (relajación muscular retrasada, más lenta de lo normal) como signo principal (Morales y Push, 2020). Se dividen en dos subgrupos, según las características clínicas que presentan los pacientes: las distróficas y las no distróficas. Dentro de las primeras están la distrofia miotónica tipo 1 (DM1) y la distrofia miotónica tipo 2 (DM2), causadas por un daño o mutación en dos segmentos del material genético (ADN), específicamente en los genes DMPK y CNBP1, respectivamente (Brook et al., 1992; Liquori et al., 2001). El grupo de las segundas (NDM) se atribuye a mutaciones en los genes CLCN1 y SCN4A, los cuales proporcionan instrucciones para producir proteínas llamadas canales iónicos (Ptacek et al., 1991; Lorenz et al., 1994), por lo que a las NDM se les ha dado el nombre de canalopatías miotónicas.
La DM1 es la enfermedad muscular hereditaria más común en adultos jóvenes y es causada por una mutación en el gen DMPK. Este gen guía la producción de la proteína quinasa de distrofia miotónica, la cual parece desempeñar un papel importante en las células musculares, cardíacas y cerebrales, asimismo, al interactuar con otras, participa en la comunicación intracelular y en la regulación de la actividad y las funciones de estructuras importantes dentro de las células musculares. Se trata de un trastorno de herencia dominante, o sea, una persona necesita heredar solo una copia del gen defectuoso de cualquiera de los progenitores para desarrollarlo (Harper, 1989), se caracteriza por la presencia de miotonía, debilidad y desgaste muscular progresivo y numerosas manifestaciones sistémicas, tales como alteraciones cardíacas, trastornos del sueño y digestivos, complicaciones respiratorias, problemas endocrinos y aparición de cataratas (Harper, 1989). Tanto la edad de inicio de los síntomas como el cuadro clínico son altamente variables y, de acuerdo con esos dos parámetros, los pacientes se han clasificado en diferentes subtipos clínicos: 1- manifestación tardía; 2- clásico; 3- pediátrico y 4- congénito (Ashizawa et al., 1992; Harper, 1989; Hecht et al., 1993).
La mutación responsable de la DM1 consiste en tres bloques de construcción de ADN repetidos varias veces en el gen DMPK. Esta secuencia corresponde a la tripleta o trinucleótido CTG (citosina, timina, guanina). Los individuos no afectados con la enfermedad tienen de 5 a 37 repeticiones de la tripleta CTG, mientras que, en los pacientes con síntomas de DM1 la recurrencia es mayor y tienen desde aproximadamente 50 hasta varios miles (Brook et al., 1992). El tamaño de la mutación, es decir, el número de unidades de la repetición CTG, correlaciona positivamente con la severidad de la enfermedad: las personas con cantidades pequeñas o grandes manifiestan síntomas leves o graves, respectivamente. Además, correlaciona negativamente con la edad de inicio, esto es, entre mayor sea el número de repeticiones CTG, a menor edad aparecen los síntomas (Morales et al.; 2020; Redman et al.,1993). En los pacientes, la expansión es altamente inestable (i. e. cambia de tamaño) tanto en la línea somática como en la germinal. La inestabilidad somática se refiere a la presencia de diferentes tamaños de la expansión entre distintos tejidos y dentro del mismo tejido y al aumento en el tamaño de la mutación a lo largo de la vida del paciente (Corrales et al., 2019; Lavedan et al., 1993; Morales et al., 2012; Wong et al., 1995).
Las NDM o canalopatías miotónicas son trastornos hereditarios originados por la disfunción de un canal iónico debido a diferentes mutaciones en los genes CLCN1 o SCN4A, dicho en otros términos, son enfermedades con heterogeneidad alélica: diferentes mutaciones en un mismo gen producen la misma enfermedad, en muchos casos con expresión fenotípica variable. El gen CLCN1 aporta instrucciones para producir un tipo
10 Revista Bioreview®

de proteína llamada canal de cloruro, en tanto el gen SCN4A lo hace para crear una parte fundamental (la subunidad alfa) de los canales de sodio. Estos canales transportan, respectivamente, iones cloruro e iones sodio en las células y se encuentran en los músculos utilizados para el movimiento (músculos esqueléticos), ambos son claves en la capacidad de una célula para generar y transmitir señales eléctricas (Cannon 2017; Koch et al., 1992). En el ámbito clínico, los pacientes con una NDM presentan miotonía eléctrica y/o clínica, rigidez muscular e hipertrofia muscular ocasional, pero hay ausencia de debilidad muscular progresiva e histopatología distrófica (Morales y Push, 2020; Stunnenberg et al., 2020).
En línea con lo apuntado, las NDM se dividen en canalopatías de cloruro y canalopatías de sodio. Por un lado, la canalopatía de cloruro o miotonía congénita (MC), provocada por mutaciones en el gen CLCN1 (Koch et al., 1992), es la canalopatía hereditaria del músculo esquelético más común. Se trata de una enfermedad no progresiva con un inicio de los síntomas en la primera o segunda década de vida (Cannon 2015; Heatwole y Moxley, 2007) y se distingue principalmente por conllevar debilidad muscular –disminución de la fuerza de los músculos con limitación del rango de movimientos voluntarios, dificultades para iniciar la movilización, rigidez muscular generalizada y el fenómeno de calentamiento–, remisión o alivio de la rigidez cuando se realizan contracciones musculares repetidas, por ejemplo, al caminar o correr, entre otros síntomas (Cannon 2015; Heatwole y Moxley, 2007; Koch et al., 1992; Lehmann-Horn et al., 2004).
Hasta el momento, se han descrito más de 200 diferentes mutaciones en el gen CLCN1, las cuales se exponen en el siguiente enlace: http://www.hgmd.cf.ac.uk/ac/index.php. La transmisión de la MC puede ser de herencia autosómica dominante (enfermedad de Thomsen) o de herencia autosómica recesiva (miotonía tipo Becker). En este último caso, una herencia recesiva significa que se deben heredar dos copias de un gen defectuoso (una de ambos progenitores) para dar paso a la enfermedad, de hecho, es la más común, con una prevalencia de 1 en 23000 individuos; en cambio, la forma dominante se reporta en 1 de cada 50000 personas en la población caucásica (Lehmann-Horn y Jurkat-Rott, 1999). Ambas enfermedades son clínicamente variables, pero la forma recesiva es más severa y sus síntomas empiezan a una edad más temprana que la dominante (Dupré et al., 2009; Koch et al., 1992; Koch et al., 1993).
Por su lado, las canalopatías de sodio son enfermedades de herencia dominante a raíz de las mutaciones en el gen SCN4A (Cannon, 2017); se han identificado más de 80 mutaciones diversas asociadas con miotonía, las cuales se pueden revisar en el enlace http://www.hgmd.cf.ac.uk/ac/index.php. Con respecto a su prevalencia, se estima en 0.43/ 100000 para el caso
del Reino Unido y en 1.19/ 100000 para el de Francia (Horga et al., 2013). Sus síntomas varían de un paciente a otro y son episódicos, esporádicos (Cannon, 2017) y con diferentes grados de debilidad o rigidez muscular. La miotonía de los músculos del párpado se considera una característica distintiva. La edad de inicio corresponde usualmente a la primera década y la enfermedad podría ser progresiva en algunas personas (Ptacek et al., 1994; Platt y Griggs, 2009). El cuadro clínico muestra un espectro continuo de síntomas que dependerá de la enfermedad asociada, a saber: 1- parálisis periódica hipercalémica con miotonía; 2- miotonías del canal de sodio y 3- paramiotonía congénita (Cannon, 2017).
3. Métodología
3.1 Enfoque
Este es un estudio original, descriptivo, que muestra un resumen de los hallazgos más relevantes sobre los estudios genéticos de las miotonías hereditarias en Costa Rica.
3.2 Población del estudio
La población de estudio estuvo constituida por individuos con diagnóstico clínico presuntivo de una miotonía hereditaria debido a una electromiografía positiva (EMG+) y sus familiares de primer y segundo grado de consanguinidad en riesgo genético, es decir, asintomáticos, pero con probabilidades de haber heredado la mutación responsable y, por lo tanto, de desarrollar la enfermedad. La recolección de las muestras inició en el año 1998 y todos los pacientes firmaron el consentimiento informado. Todos los estudios fueron aprobados por el Comité Ético Científico de la Universidad de Costa Rica. En total, en nuestras investigaciones han participado más de 450 personas entre pacientes y parientes asintomáticos.
3.3 Técnicas de recolección
Los primeros pacientes fueron captados a través de los registros del Hospital Nacional de Niños y en la consulta externa del Hospital San Juan de Dios. Los pacientes (y sus familiares en riesgo) fueron contactados para invitarlos a participar en los estudios y se visitaron en sus casas de habitación. El resto fueron referidos directamente al INISA por un neurólogo. Todos fueron informados en detalle sobre las características de la enfermedad y las particularidades de su herencia; de igual modo, se les realizó una entrevista, con el fin de obtener información personal y antecedentes familiares. Quienes accedieron firmaron una fórmula de consentimiento informado aprobada por el Comité Ético Científico de la Universidad de Costa Rica. A cada persona se le tomó una muestra de sangre para los análisis moleculares.
12 Revista Bioreview®

3.4 Procesamiento de análisis
3.4.1 Extracción de ADN


De la muestra de sangre que se le tomó a cada individuo, se obtuvo el ADN por medio de un método de laboratorio conocido como extracción con proteinasa K-fenol-cloroformo y se siguieron los procedimientos usuales (Sambrook y Russel, 2001).
3.4.2 Diagnóstico molecular DM1

Este es un procedimiento de diagnóstico directo e incluye la aplicación de técnicas de biología molecular para, entre otras cosas, identificar las mutaciones en el ADN responsables de provocar las enfermedades y detectar riesgos. Con el objetivo de confirmar el diagnóstico presuntivo de DM1, se realizó un análisis molecular para determinar el número de tripletas CTG en los pacientes y sus familiares, basado en la técnica de reacción en cadena de la polimerasa (PCR), la cual facilita amplificar o multiplicar copias de un determinado fragmento de ADN y/o hibridación de Southern de digestión de ADN genómico; esto detecta una secuencia específica de ADN en una muestra y es el método estándar de diagnóstico molecular para la DM1, según condiciones ya publicadas (Monckton et al., 1995; Shelbourne et al, 1993; Morales et al., 2001). En estos estudios, el tamaño de la repetición se observa como una mancha de gran tamaño en las personas que tienen la mutación causante de la enfermedad debido a la inestabilidad somática.
3.4.3 Estimación del tamaño del alelo progenitor (PAL) y cuantificación de la inestabilidad somática mediante small pool PCR (SP-PCR)
A través del método SP-PCR es posible medir el tamaño de la mutación DM1 en células individuales, al amplificar un número reducido de moléculas de ADN mediante diluciones en serie que resuelven la mancha heterogénea detectada por experimentos de PCR estándar o por la hibridación de Southern. Así, a partir de la electroforesis en gel de agarosa se resuelven los productos de la SP-PCR y con la hibridación de Southern, se detectan.
Específicamente, el tamaño de la mutación se mide utilizando el borde inferior de la distribución, el cual se asemejaría al tamaño de la mutación heredada de padres a hijos. Por tal razón, a este tamaño de la mutación le hemos denominado como el tamaño estimado del alelo progenitor (ePAL – tamaño estimado de la mutación heredada de padres a hijos). Este método también cuantifica de forma detallada el grado de variación de la longitud de la repetición en una muestra determinada. En ambos casos, los productos de PCR fueron medidos usando el programa Kodak Molecular Imaging Software 3.5.4 (Carestream
Health, Inc.) o el Uvibandmap (UVITEC, UK) (Gomes-Pereira et al., 2004; Morales et al., 2012; Morales et al., 2020).
3.4.4 Análisis de polimorfismos en genes del sistema de reparación de apareamientos erróneos (MMR)
Con el propósito de tratar de estudiar las bases genéticas y moleculares de la variabilidad clínica de estas enfermedades, se analizaron otras regiones del ADN que muestran diferencias de una persona a otra y pueden estar asociadas al riesgo de desarrollar alguna patología. Para ello, se recurrió al ensayo de PCR, seguido por la digestión con enzimas que cortan el ADN, más conocida como PCR-RFLP (del inglés Restriction Fragment Length Polymorphism). De tal manera, en 199 muestras se evaluaron 13 polimorfismos en algunos de los genes del sistema MMR, 9 en MSH3 y 1 en cada uno de los genes MSH2, PMS2, MSH6 y MLH1 (Morales et al., 2016).
3.4.5 Diagnóstico molecular de canalopatías miotónicas
Algunos de los primeros pacientes negativos para la DM1 fueron reevaluados clínicamente, incluyendo exámenes físicos, electromiográficos, oculares y electrocardiogramas a algunos miembros de las familias. Quienes resultaron negativos para la mutación en el gen DMPK y aquellos con un diagnóstico clínico presuntivo de una canalopatía miotónica (tres pacientes), se tamizaron para la búsqueda de mutaciones en los genes CLCN1 y SCN4A, empleando las técnicas de polimorfismo de conformación de hebra sencilla (PCR-SSCP) y secuenciación de Sanger (Lehmann-Horn et al., 1995; Morales et al., 2008; Orita et al., 1989).
La técnica de PCR-SSCP se utiliza cuando se conoce o se sospecha del gen responsable de una enfermedad, pero se desconoce dónde se ubica la mutación, como era el caso de estos pacientes negativos para la mutación causante de la DM1. La región de ADN a analizar se amplifica por PCR y los productos de PCR de doble hebra se desnaturalizan por calor (se separan las hebras), de seguido, se examinan las hebras simples por electroforesis en un gel de poliacrilamida no desnaturalizante. Después, los geles se someten a tinción con nitrato de plata. Un cambio en la secuencia provoca cambios conformacionales en la hebra de ADN y estos se detectan porque alteran la migración electroforética en los geles. Si bien, este método no nos dice de qué tipo de alteración se trata, nos permite descartar rápidamente la presencia de variantes, lo que ahorra tiempo y recursos.

Entonces, usando la PCR, se amplificaron los 23 exones del gen CLCN1 bajo las condiciones previamente reportadas (Lehmann-Horn et al., 1995; Orita et al., 1989) y optimizadas en el laboratorio del INISA con modificaciones menores (Morales et

14 Revista Bioreview®



















15 Bioquímica Molecular Año XII · Número 138 · Febrero 2023
al., 2008). Las secuencias de los iniciadores para los 24 exones del gen SCN4A se diseñaron en el programa Primer3 y Oligo 7 y fueron sintetizados por Macrogen (Corea). Los productos de PCR se purificaron con el kit QIAquick (QIAGEN) y se secuenciaron en un ABI PRISM 377 (Applied Biosystems). Los resultados de las secuenciaciones se evaluaron con el programa 4Peaks (mekentosj.com). La confirmación de las variantes genéticas y su tamizaje en 100 individuos sanos no relacionados o con una enfermedad diferente a las NDM se efectuó por PCR-RFLP. Adicionalmente, a fin de descartar la presencia de inserciones o deleciones exónicas en el ADN genómico de los pacientes con una NDM, se estudió la amplificación de sondas dependiente de ligandos múltiples (MLPA) con la ayuda de los kits SALSA MLPA 350 CLCN-1–KCNJ2 para el gen CLCN1 y SALSA MLPA P397 SCN4A-CACNA15 para el gen SCN4A de MRC-Holland, conforme a las instrucciones del fabricante.
3.4.6 Caracterización funcional
En interés de entender cómo las mutaciones afectan la función de un canal iónico particular, se analizaron las corrientes iónicas de canales mutantes en sistemas de expresión in vitro. Las variantes encontradas se caracterizaron a partir de ensayos de electrofisiología en ovocitos de la rana Xenopus laevis, para determinar las propiedades biofísicas de los canales mutados. Los ovocitos se inyectaron/coinyectaron con ARNc de ClC-1, WT y mutante o fueron coinyectados con ARNc de SCN4A (WT o mutante) y beta1-ARNc y se incubaron de 48 a 72 h a 18 °C. Las corrientes se midieron aplicando la técnica de voltage clamp de dos electrodos a temperatura ambiente, en concordancia con protocolos publicados previamente (Estevez et al., 2003).
4. Resultados
4.1 Diagnóstico molecular de DM1
Hasta el momento, hemos tratado más de 450 muestras de ADN que provienen de 83 diferentes familias (aparentemente no relacionadas), donde hay al menos una persona afectada con un diagnóstico clínico presuntivo de miotonía hereditaria. Todas las muestras recibieron el ensayo de laboratorio para identificar la mutación en el gen DMPK, de esa forma, 246 (130 hombres y 116 mujeres de 65 familias) resultaron positivas a nivel molecular para la mutación DM1 y 150 individuos, parientes de los casos positivos, fueron negativos. La mayoría de los pacientes con la mutación DM1 presentaron la forma clásica de la enfermedad (tabla 1). De las restantes familias, que comprenden un total de 54 personas, 15 se reportaron negativas para la mutación DM1 y 3 tuvieron un diagnóstico clínico presuntivo de una canalopatía miotónica, sin embargo, en estas últimas se buscó la mutación DM1 y también obtuvieron resultados negativos.
4.2 Tamaño del alelo progenitor (PAL) y cuantificación de la inestabilidad somática
El tamaño de la mutación en el gen DMPK encontrado en los pacientes afectados con la DM1 fue de 46 a 1727 repeticiones CTG, lo cual corresponde al estimado del tamaño del PAL mutado en cada uno. Tal y como se esperaba, dichos números se correlacionan positivamente con la severidad de la enfermedad y negativamente con la edad de inicio de los primeros síntomas (Morales et al., 2012; Morales et al., 2016; Morales et al., 2020).
El uso del ePAL explicó entre un 60 % y un 70 % de la variación en la edad de inicio de la enfermedad (Morales et al., 2012; Morales et al., 2016), muy por encima de lo obtenido por medio del método estándar (menos del 50 %) (Ashizawa et al.,1992; Harley, 1993; Lavedan, 1993); además, el estudio detallado de los niveles de inestabilidad demostró la contribución de la inestabilidad somática en la edad de inicio y la severidad clínica en la DM1 (Morales et al., 2012; Morales et al., 2020).
4.3 Análisis de polimorfismos en MMR
Se logró obtener el genotipo de los 13 polimorfismos analizados en un total de 199 muestras de DM1. El examen de los polimorfismos de los genes del sistema MMR con respecto a los niveles de inestabilidad de la repetición CTG reveló un vínculo entre estos últimos y el polimorfismo rs26279 en el gen MSH3. Encontramos que los pacientes con el genotipo AA para ese polimorfismo tenían mayores inestabilidades que aquellos con genotipo AG o GG. En este estudio, no detectamos una correspondencia de los niveles de inestabilidad con la edad de inicio de los síntomas (Morales et al., 2012; Morales et al., 2016).
4.4 Diagnóstico molecular de canalopatías miotónicas
Luego de las reevaluaciones clínicas a algunos de los pacientes negativos para la mutación DM1 (18 individuos de 2 familias), la mayoría fue diagnosticada clínicamente con una canalopatía miotónica o con una condición similar, en concreto, con la enfermedad de Thomsen o con la miotonía tipo Becker (Morales et al., 2003; Morales et al., 2008), por tal motivo, se inició la búsqueda de la mutación en el gen CLCN1.
De acuerdo con lo anterior, de las 18 familias con resultados negativos para la mutación DM1, el probando de cada una de ellas, o sea, el primer familiar afectado que atrajo la atención, fue tamizado para el gen CLCN1. A raíz de esta búsqueda, se encontraron variantes ya reportadas en la literatura para la enfermedad de Becker o Thomsen, así como variantes nuevas (no descritas antes) (Brenes et al., 2021; Morales et al., 2008; Vindas-Smith et al., 2016), las cuales se nombraron con una no-
16 Revista Bioreview®


18 Revista Bioreview®

19 Bioquímica Molecular Año XII · Número 138 · Febrero 2023
Tabla 1. Distribución de pacientes costarricenses con diagóstico molecular de DM1 segun la forma clínica.
Forma clínica de la DM1
NOTA: a Personas para las cuales no se tiene el dato de edad de inicio de la enfermedad y, por lo tanto, no se pueden clasificar dentro de ninguna forma clínica
menclatura estándar, siguiendo las directrices establecidas por la Human Genome Variation Society (HGVS) (http://varnomen. hgvs.org/). El primer hallazgo de una mutación nueva fue la de p.Q412P en el gen CLCN1, esta se encuentra en estado homocigota en los individuos afectados, concordando así con un patrón de herencia recesivo y confirmando el diagnóstico clínico de la miotonía tipo Becker (Morales et al., 2008). En total, hemos logrado determinar seis diferentes mutaciones en el gen CLCN1 en 7 de las 18 familias (tabla 2), a pesar de eso, algunas de ellas no muestran un patrón de herencia claro o muestran un patrón opuesto a lo reportado en otros estudios, así como un fenotipo atípico (Brenes et al., 2021; Morales et al., 2008; Vindas-Smith et al., 2016).
En una de las familias donde se constató una mutación nueva, la p.W322* en CLCN1, identificamos parientes del probando que, pese a estar clínicamente afectados y de haber sido diagnosticados con la enfermedad de Thomsen, no presentaban dicha mutación. En vista de esto y de que los probandos de las otras 11 familias dieron negativo para una mutación en el CLCN1, se tamizó el gen SCN4A en busca de la mutación que explicara su sintomatología, lo que nos permitió distinguir en una familia una mutación en el gen SCN4A, ampliamente conocida y estudiada, la p.T1313M (Brenes et al., 2021). El probando de esta familia tiene un fenotipo típico de la paramiotonía congénita. Asimismo, hallamos otra mutación en el gen SCN4A, la p.R1463H, en la familia donde también se está transmitiendo la mutación p.W322* en el gen CLCN1, pero en un probando distinto (tabla 2) (Brenes et al., 2021). Este es el primer caso de una familia costarricense
afectada por una canalopatía miotónica con la coexistencia de mutaciones en los genes CLCN1 y SCN4A.
En cuanto a las 10 familias restantes, estas resultaron negativas para mutaciones en los genes DMPK, CLCN1 y SCN4A, por ende, es probable que la mutación causante de la enfermedad se encuentre en otro gen. Adicionalmente y debido a que se han descrito duplicaciones o deleciones de estos genes en pacientes con miotonías hereditarias (Raja Rayan et al., 2012), realizamos el ensayo de MLPA, sin embargo, se descartó la presencia de inserciones o deleciones exónicas en el ADN genómico de los 18 probandos libres de la DM1 (datos no mostrados).
4.5
Caracterización funcional y estructural de mutaciones
en los genes CLCN1 y SCN4A
Dados algunos aspectos atípicos, clínicos o genéticos en unas de las familias afectadas por NDM, llevamos a cabo estudios funcionales y estructurales de algunas mutaciones en esos dos genes, con el propósito de brindar evidencia sobre cómo la disfunción del canal (originada por las mutaciones respectivas) podría contribuir a entender ciertas características inusuales en dichas familias. En virtud de estos ejercicios se comprobó que las mutaciones R1463H en SCN4A y p.Q412P, p.W322* y G355R en CLCN1 modifican las propiedades biofísicas de los canales iónicos y/o alteran la expresión eficiente de la proteína (p.Q412P, p.W322*). En la mayoría de los casos, la caracterización funcional de las mutaciones justifica de mejor manera algunos de los rasgos clínicos o genéticos observados (Brenes et al., 2021; Vindas-Smith et al., 2016).
20 Revista Bioreview®
Número de casos Hombres / Mujeres Asintomática Leve Clásica Pediátrica (Juvenil) Congénica Desconocida a TOTAL 25 20 143 28 22 8 246 14/11 14/6 70/73 16/12 13/9 3/5 130/116
Analizador para resolver la Velocidad de Eritrosedimentación de forma fácil, segura y confiable.
Trabaja directamente a partir del tubo de hemograma (EDTA)
Método de Westergren (método de referencia)
32 resultados en sólo 25 minutos
Sin consumibles y libre de mantenimiento


No genera desechos
Pantalla touch screen. Sistema operativo Android









Conexión a LIS (Host Query)


Consulte con su Asesor Comercial.

Más información: ventas@wiener-lab.com

21 Bioquímica Molecular Año XII · Número 138 · Febrero 2023 @Wienerlabgroup Wiener lab Group Wiener lab. @Wiener_lab
marketing@wiener-lab.com
www.wiener-lab.com
5. Discusión
Las miotonías hereditarias son enfermedades del músculo esquelético muy variables clínicamente y con síntomas que se traslapan. En diversas ocasiones, esto dificulta establecer un diagnóstico clínico certero, lo cual es crítico para el manejo y el seguimiento oportunos y adecuados (Heatwole y Moxley, 2007; Morales y Push, 2020). Muchas afecciones requieren con urgencia un método de diagnóstico, en lo posible con alta sensibilidad y especificidad. En ese sentido, en Costa Rica no existía una categoría clínica correcta para tales patologías, todas eran llamadas y consideradas a manera colectiva miotonías hereditarias; de ahí, a finales de los años 90 iniciamos con el estudio molecular, a efecto de confirmar el diagnóstico clínico y facilitar la clasificación de los pacientes. Mediante el análisis de macromoléculas como el ADN, se logra brindar gran cantidad de diagnósticos etiológicos de certeza, acortar el tiempo de estudio, ofrecer un buen asesoramiento genético, establecer correlaciones clínicas más precisas que pauten eventualmente el pronóstico y el tratamiento, identificar y agrupar pacientes para su potencial participación en protocolos clínicos particulares o para recibir tratamientos farmacológicos concretos.
Así, en el año 2001 realizamos el primer reporte enfocado en el diagnóstico molecular de la DM1 (Morales et al., 2001). Desde entonces, hemos ido identificando nuevas familias con la mutación DM1 y, al mismo tiempo, familias diagnosticadas con una miotonía hereditaria en donde esa mutación está ausente. Como consecuencia de esto, entre 2002 y 2003, implementamos el diagnóstico molecular de las canalopatías miotónicas, en especial con las enfermedades causadas por mutaciones en los canales de cloruro y de sodio. El primer reporte al respecto surgió en 2003, con la descripción clínica de la primera familia costarricense afectada con la enfermedad de Thomsen (Morales et al., 2003); más adelante, en 2008, ofrecimos el reporte inicial que incluía no solo la parte clínica, sino también, la confirmación a nivel molecular de la primera familia costarricense afectada por la miotonía tipo Becker (Morales et al., 2008). Así, a través del diagnóstico molecular hemos estado contribuyendo a la clasificación clínica correcta de las miotonías hereditarias en Costa Rica.
Nuestro siguiente objetivo fue elaborar estudios dirigidos a mejorar las correlaciones clínicas genotipo-fenotipo y analizar las bases genético-moleculares de la variabilidad clínica en estas enfermedades. En el caso de la DM1, usamos el ensayo de la SP-PCR para medir el ePAL
y cuantificar los niveles de inestabilidad somática. A diferencia del tamaño de la mutación obtenido por el método estándar de diagnóstico molecular (hibridación de Southern), nuestros estudios demostraron que el tamaño del ePAL es el principal modificador de la edad de inicio y que las correlaciones clínicas mejoran de forma significativa (Morales et al., 2012; Morales et al, 2016); esto, por cuanto se están tomando en cuenta y controlando los factores confusores, como la inestabilidad somática presente en la DM1, no considerada en estudios previos. Más importante aún, el uso del ePAL y estudios detallados sobre los niveles de inestabilidad somática en los pacientes con DM1 han demostrado que la edad de inicio es modificada adicionalmente por variación individual en los niveles de inestabilidad, i. e. en quienes la repetición se expande más rápido desarrollan los síntomas a edades más tempranas (Morales et al., 2012; Morales et al., 2016; Morales et al., 2020).
Por añadidura, hemos identificado otros factores genéticos modificadores de los niveles de inestabilidad en la DM1 (Morales et al., 2016), según esto, se indica lo siguiente: 1- pueden existir otros factores genéticos que contribuyen a modular el fenotipo de la DM1 y aportar más evidencia para explicar por qué las personas con ePALs similares presentan diferencias en la edad de inicio y gravedad de la enfermedad (Morales et al., 2016); 2ahora es posible predecir con mayor grado de certeza la edad de inicio de los síntomas y tener una base acerca de la posible evolución de la enfermedad, de acuerdo con la forma como la mutación va cambiando en el tiempo (Morales et al., 2020) y 3- la inestabilidad somática en la DM1 puede ser una diana terapéutica, pues, si se lograra que sus niveles dejen de aumentar o disminuyan, podría detenerse o reducirse la progresión de la enfermedad e incluso su aparición a edades tardías.
Para el caso de las canalopatías miotónicas, nuestras investigaciones orientadas a mejorar las correlaciones clínicas no han sido tan satisfactorias. La mayoría de las familias carecían de un cuadro clínico claro y definido, por lo que fueron diagnosticadas inicialmente con la DM1 (Morales et al., 2001). El esfuerzo por ejecutar las reevaluaciones clínicas a los primeros pacientes negativos para la DM1 ayudó al diagnóstico correcto de varias de sus familias (Morales et al., 2003; Morales et al., 2008) y a determinar el espectro de síntomas, lo cual también ha facilitado en los últimos años el diagnóstico en otras familias costarricenses.
Con el estudio molecular de los pacientes y la confir-
22 Revista Bioreview®
mación del diagnóstico clínico en algunas familias, se precisaron tanto mutaciones nuevas como ya reportadas (Brenes et al., 2021; Morales et al., 2003; Vindas-Smith et al., 2016). No obstante, el estado homocigota o heterocigota de algunas de ellas no responde al cuadro clínico completo o al patrón de herencia observado en las familias. Con la intención de mejorar estas correlaciones, se condujeron análisis funcionales y estructurales de ciertas mutaciones encontradas en los genes CLCN1 y/o SCN4A y se obtuvo que estas propician el cambio estructural responsable de los datos funcionales que relacionan la mutación con una pérdida o ganancia de función del canal y, a la vez, eso explica algunas de las características observadas en estas familias. Con todo, según los datos de otras mutaciones detectadas, las propiedades biofísicas del canal mutado no difieren del canal silvestre (sin la mutación), lo cual sugiere la presencia de factores genéticos adicionales que podrían influir en el cuadro clínico de estos pacientes (Brenes et al., 2021; Vindas-Smith et al., 2016).
Finalmente, por cuanto en 10 diferentes familias con un cuadro clínico sospechoso de una miotonía hereditaria no se localizó la mutación en los genes DMPK, CLCN1 o SCN4A, se infiere que la mutación causante de los síntomas en los probandos se encuentra en otra región del geno-
ma. Es decir, se abre la posibilidad de que haya (n) otro (s) gen (es) asociado (s) con miotonía, ya sea de manera directa o jugando un papel modificador; su identificación y análisis podrían contribuir a explicar algunos de los rasgos clínicos atípicos observados no solo en personas costarricenses, sino también en otras del mundo, lo cual mejoraría las correlaciones clínicas en las canalopatías miotónicas.
6. Conclusiones
Los primeros estudios sobre las miotonías hereditarias en Costa Rica (Brenes et al., 2021; Morales et al., 2001; Morales et al., 2003; Vindas-Smith et al., 2016) evidenciaron la dificultad que el personal clínico tiene para diagnosticarlas certeramente si no se cuenta con el diagnóstico molecular, a su vez, contribuyeron a identificar pacientes con rasgos clínicos atípicos y esto permitió una descripción más detallada de los síntomas referentes a cada patología.
Aunado a lo anterior, el diagnóstico molecular se convirtió en una herramienta poderosa ante estas enfermedades, pues facilitó su clasificación clínica precisa. El campo del diagnóstico molecular ha crecido considerablemente en los últimos años, transformándose en un

23 Bioquímica Molecular Año XII · Número 138 · Febrero 2023
instrumento clave en beneficio directo de los pacientes y, en este caso concreto, debe considerarse como parte fundamental del abordaje al aumentar las posibilidades de ofrecer un manejo clínico y un asesoramiento genético más apropiado, traducibles en una mejor calidad de vida de los pacientes y sus familiares.
La gran variabilidad clínica presente en estas patologías devela la necesidad de investigar y comprender las bases genéticas y moleculares de cada una, aspectos esenciales para conocer cómo se producen y para desarrollar tratamientos médicos en respuesta. Por eso, nuestra esperanza es que estos estudios motiven a otros colegas latinoamericanos a erigir propuestas similares, inclusive, a establecer colaboraciones estrechas con miras a profundizar la investigación de las miotonías hereditarias en la región.
AGRADECIMIENTOS: A William Araya Hidalgo, Dayana Vargas Sanabria y Jeffrey Roig Fernández del INISA, por su ayuda técnica. A la Universidad de Costa Rica (UCR), el Consejo Nacional para Investigaciones Científicas y Tecnológicas (CONICIT) de Costa Rica, la Asociación Americana de Distrofias Musculares (MDA) y la Asociación Francesa contra las Miopatías (AFM-Téléthon), por el financiamiento para realizar estos estudios.
REFERENCIAS BIBLIOGRÁFICAS
Ashizawa, T., Dunne, C.J., Dubel, J.R., Perryman, M.B., Epstein, H.F., Boerwinkle, E. y Hejtmancik, J.F. (1992). Anticipation In Myotonic Dystrophy .1. Statistical Verification Based On Clinical and Haplotype Findings. Neurology, 42, 1871-77. https://doi. org/10.1212/wnl.42.10.1871
Brenes, O., Barbieri, R., Vásquez, M., Vindas-Smith, R., Roig, J., Romero, A., … Morales, F. (2021). Functional and structural characterization of ClC-1 andNav1.4 channels resulting from CLCN1 and SCN4A mutations identified alone and coexisting in myotonic patients. Cells, 10(2), 374. https://doi.org/10.3390/cells10020374
Brook, J.D., McCurrach, M.E., Harley, H.G., Buckler, A.J., Church, D., Aburatani, H., … Housman, D.E. (1992). Molecular basis of myotonic dystrophy: expansion of a trinucleotide (CTG) repeat at the-3 end of a transcript encoding a protein kinase family member. Cell, 68, 799-808. https://doi.org/10.1016/0092-8674(92)90154-5
Cannon, S.C. (2015). Channelopathies of skeletal muscle excitability. Compr Physiol, 5(2), 761-90. https://doi.org/10.1002/cphy.c140062
Cannon S.C. (2017) Sodium Channelopathies of Skeletal Muscle. In: Chahine M, editor. Voltage-gated Sodium Channels: Structure, Function and Channelopathies. Handbook of Experimental Pharmacology. Springer, Cham, p.309-330. https://doi. org/10.1007/164_2017_52
Corrales, E., Vásquez, M., Zhang, B., Santamaría-Ulloa, C., Cuenca, P., Krahe, R., … Morales, F. (2019). Analysis of mutational dynamics at the DMPK (CTG)n locus identifies saliva as a suitable DNA sample source for genetic analysis in myotonic dystrophy type 1. PLoS ONE, 14(5), e0216407. https://doi.org/10.1371/journal.pone.0216407
Dupre, N., Chrestian, N. y Bouchard, J.P. (2009). Clinical, electrophysiologic, and genetic study of non-dystrophic myotonia in French-canadians. NeuromusculDisord, 19, 33034. https://doi.org/10.1016/j.nmd.2008.01.007
Estevez, R., Schroeder, B., Accardi, A., Jentsch, T. y Pusch, M. (2003). Conservation of chloride channel structure revealed by an inhibitor binding site in ClC-1. Neuron, 38, 47–59. https://doi.org/10.1016/S0896-6273(03)00168-5
Gomes-Pereira, M., Bidichandani, S.I. y Monckton, D.G. (2004). Analysis of unstable triplet repeats using small-pool polymerase chain reaction. Methods Mol Biol, 277, 6176. https://doi.org/10.1385/1-59259-804-8:061
Harley, H.G., Rundle, S.A., MacMillan, J.C., Myring, J., Brook, J.D., Crow, S.,… Harper, P,S. (1993). Size of the unstable CTG repeat sequence in relation to phenotype and parental transmission in myotonic dystrophy. Am J Hum Genet, 52, 1164-1174.
Harper, P.S. (1989). Myotonic Dystrophy. 2nd ed. London: WB Saunders Company.
Heatwole, C. y Moxley, R. (2007). The nondystrophic myotonias. Neurotherapeutics, 4, 238-51. https://doi.org/10.1016/j.nurt.2007.01.012.
Hecht, B.K., Donnelly, A., Gedeon, A.K., Byard, R.W., Haan, E.A. y Mulley, J.G. (1993). Direct molecular diagnosis of the myotonic dystrophy. Clin Genet, 43, 276-85. https:// doi.org/10.1111/j.1399-0004.1993.tb03819.x
Horga, A., Raja, R.D.L., Matthews, E., Sud, R., Fialho, D., Durran, S., … Hanna, M.G. (2013). Prevalence study of genetically defined skeletal muscle channelopathies in England. Neurology, 80, 1472–75. https://doi.org/10.1212/ wnl.0b013e31828cf8d0 [ Links ]
Koch, M.C., Steinmeyer, K., Lorenz, C, Ricker, K., Wolf, F., Otto, M., … Jentsch, T.J. (1992). The skeletal muscle chloride channel in dominant and recessive human myotonia. Science, 257, 797-800. https://doi.org/10.1126/science.1379744 [ Links ]
Koch, M.C., Ricker, K., Otto, M.,Wolf, F., Zoll, B., Lorenz, C., … Jentsch, T.J. (1993). Evidence for genetic homogeneity in autosomal recessive generalised myotonia (Becker). Journal of Medical Genetics, 30, 914-917. http://dx.doi.org/10.1136/ jmg.30.11.914
Lavedan, C., Hofmann-Radvanyi, H., Shelbourne, P., Rabes, J.P., Duros, C., Savoy, D., … Junien, C. (1993). Myotonic dystrophy: size and sex dependent dynamics of CTG meiotic instability, and somatic mosaicism. Am J Hum Genet, 52, 875-83.
Lehmann-Horn, F., Mailänder, V., Heine, R. y George, A.L. (1995). Myotonia levior is a chloride channel disorder. Hum Mol Genet, 4(8), 1397-1402. https://doi.org/10.1093/ hmg/4.8.1397
24 Revista Bioreview®






















































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































25 Bioquímica Molecular Año XII · Número 138 · Febrero 2023
Lehmann-Horn, F. y Jurkat-Rott, K. (1999). Voltage-gated ion channel and hereditary disease. Physiol Rev, 79, 1317-72. https://doi.org/10.1152/physrev.1999.79.4.1317
Lehmann-Horn, R., Ruedel, K., y Jurkat-Rot,t K. (2004). Nondystrophic myotonias and periodic paralysis. In: Engel AG, Franzini-Armstrong C, editors. Myology (3rd ed.) New York: McGraw-Hill, p. 1257-300.
Liquori, C.L., Ricker, K., Moseley, M.L., Jacobsen, J.F., Kress, W. y Naylor, S.L. (2001). Myotonic dystrophy type 2 caused by a CCTG expansion in intron 1 of ZNF9. Science, 293, 864-67. https://doi.org/10.1126/science.1062125
Lorenz, C., Meyer-Kleine, C., Steinmeyer, K., Koch, M.C. y Jentsch, T.J. (1994). Genomic organization of the human muscle chloride channel CIC-1 and analysis of novel mutations leading to Becker-type myotonia. Human Molecular Genetics, 3(6), 941–946. https://doi. org/10.1093/hmg/3.6.941
Monckton, D.G., Wong, L.J., Ashizawa T. y Caskey, C.T. (1995). Somatic mosaicism, germline expansions, germline reversions and intergenerational reductions in myotonic dystrophy males: small pool PCR analyses. Hum Mol Genet,4, 1–8. https://doi. org/10.1093/hmg/4.1.1
Morales, F., Cuenca, P., Brian, R., Sittenfeld, M y del Valle, G. (2001). Diagnóstico molecular de la distrofia miotónica en Costa Rica. AMC, 43, 159-67.
Morales, F., Cuenca, P., del Valle, G., Brian, R., Sittenfeld, M., Montoya, O., … Keith, J. (2003).Miotonía congénita: caracterización clínica de una familia costarricense afectada por la enfermedad de Thomsen. Neuroeje, 17, 82-86.
Morales, F., Cuenca, P., del Valle, G, Vásquez, M., Brian, R., Sittenfeld, M., … Ashizawa, T. (2008).Clinical and molecular diagnosis of a Costa Rican family with autosomal recessive myotonia congenita (Becker disease) carrying a new mutation in the CLCN1 gene. Rev Biol Trop, 56, 1-11. https://doi.org/10.15517/rbt.v56i1.5505
Morales, F., Couto, J., Highman, C., Hogg, G., Cuenca, P., Braida, C., … Monckton, D.G. (2012).Somatic instability of the expanded CTG triplet repeat in myotonic dystrophy type 1 is a heritable quantitative trait and modifier of disease severity. Hum Mol Genet, 21(16), 3558-67. https://doi.org/10.1093/hmg/dds185
Morales, F., Vásquez, M., Santamaría, C., Cuenca, P., Corrales, E. y Monckton, D.G. (2016). A polymorphism in the MSH3 mismatch repair gene is associated with the levels of somatic instability of the expanded CTG repeat in the blood DNA of myotonic dystrophy type 1 patients. DNA rep, 40, 57-66. https://doi.org/10.1016/j.dnarep.2016.01.001
Morales, F., Vásquez, M., Corrales, E., Vindas-Smith, R., Santamaría-Ulloa, C., Zhang, B., … Monckton, D.G. (2020). Longitudinal increases in somatic mosaicism of the expanded CTG repeat in myotonic dystrophy type 1 are associated with variation in age-atonset. Human Mol Genet, 29(15), 2496-2507. https://doi.org/10.1093/hmg/ddaa123
Morales, F. y Push, M. (2020). An Up-to-Date Overview of the Complexity of GenotypePhenotype Relationships in Myotonic Channelopathies. Front Neurol, 10, 1404. https:// doi.org/10.3389/fneur.2019.01404
Orita, M., Iwahana, H., Kanazawa, H., Hayashi, K. y Sekiya, T. (1989). Detection of polymorphisms of human DNA by gel electrophoresis as single-strand conformation polymorphisms. Proc Natl Acad Sci USA, 86(8), 2766-70. https://doi.org/10.1073/ pnas.86.8.2766
Platt, D. y Griggs, R. (2009). Skeletal muscle channelopathies: new insights into the periodic paralyses and nondystrophic myotonias. Curr Opin Neurol, 22, 524-31. https:// doi.org/10.1097/wco.0b013e32832efa8f
Ptacek, L.J, Trimmer, J.S., Agnew, W.S., Roberts, J.W., Petajan, J.H., Leppert, M. (1991). Paramyotonia congenita and hyperkalemic periodic paralysis map to the same sodiumchannel gene locus. Am J Hum Genet, 49, 851–4.
Ptacek, L.J., Tawil, R., Griggs, R., Meola,. G, McManis, P., Barohn, R.J., … Leppert M.F. (1994). Sodium channel mutations in acetazolamide-responsive myotonia congenita, paramyotonia congenita, and hyperkalemic periodic paralysis. Neurology, 44, 1500503. https://doi.org/10.1212/wnl.44.8.1500
Raja Rayan, D.L., Haworth, A., Sud, R., Matthews, E., Fialho, D., Burge, J., … Hanna, M.G. (2012). A new explanation for recessive myotonia congenital. Exon deletions and duplications in CLCN1. Neurology, 78, 1953-58. https://doi.org/10.1212/ wnl.0b013e318259e19c
Redman, J.B., Fenwick, R.G., Fu, Y.H., Pizzuti, A. y Caskey, C.T. (1993). Relationship between parental trinucleotide GCT repeat length and severity of myotonic dystrophy in offspring. JAMA, 269, 1960-65. https://doi:10.1001/jama.1993.03500150072029
Sambrook, J. y Russel, l.D.W. (2001). Molecular Cloning: a laboratory manual. New York: Cold Spring Harbor Laboratory Press.
Shelbourne, P., Davies, J., Buxton, J., Anvret, M., Blennow, E., Bonduelle, M., … Johnson, K. (1993).Direct diagnosis of myotonic dystrophy with a disease-specific DNA marker. N Engl J Med, 328(7), 471-75. https://doi.org/10.1056/nejm199302183280704
Stunnenberg, B.C., LoRusso, S., Arnold, W.D., Barohn R., Cannon, S.C., Fontaine B., … Statland, J.M. (2020). Guidelines on clinical presentation and management of nondystrophic myotonias. Muscle Nerve, 62, 430– 444. https://doi.org/10.1002/mus.26887
Vindas-Smith, R., Fiore, M., Vásquez, M., Cuenca, P., Del Valle, G., Lagostena, L., … Morales, F. (2016).Identification and functional characterization of CLCN1 mutations found in nondystrophic myotonia patients. Hum Mutat, 37(1), 74-83. https://doi. org/10.1002/humu.22916
Wong, L.J., Ashizawa, T., Monckton, D.G., Caskey, C.T. y Richards, C.S. (1995). Somatic heterogeneity of the CTG repeat in myotonic dystrophy is age and size dependent. Am J Hum Genet, 56(1), 114-22.
2022Población y Salud en Mesoamérica
Creative Commons License Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
26 Revista Bioreview®






27 Bioquímica Molecular
Diagnóstico de infecciones genitales bajas no virales en pacientes procedentes de la consulta de ginecología infantojuvenil
ARTÍCULO ORIGINAL
1Centro Provincial de Higiene, Epidemiología y Microbiología, Santa Clara, Villa Clara, Cuba
2Hospital Provincial Ginecoobstétrico Universitario “Mariana Grajales”, Santa Clara, Villa Clara, Cuba
3Hospital Provincial Pediátrico Universitario “José Luis Miranda”, Santa Clara, Villa Clara, Cuba
*Rafael Abreu Duarte. rabreud@nauta.cu
Acta Médica del Centro / Vol. 17 No. 1 Enero-Marzo 2023
Resumen
Introducción: las infecciones genitales bajas no virales constituyen uno de los motivos más frecuentes de consulta médica en Ginecología. La juventud constituye un período vulnerable para el padecimiento de este tipo de
infecciones. El diagnóstico microbiológico por las variadas técnicas existentes garantiza precisar la etiología específica que causa la infección genital.
Objetivo: caracterizar las infecciones genitales bajas no virales en jóvenes femeninas procedentes de la Consulta

28 Revista Bioreview®
Rafael Abreu Duarte1*, Maida López Pérez2, Enma Truffin Truffin2, Noira Durán Morera2, Anisbel Ruíz Ramos3
de Ginecología infantojuvenil.
Métodos: se realizó una investigación descriptiva longitudinal prospectiva en el Laboratorio de Microbiología del Hospital “Mariana Grajales” en el período de enero a diciembre de 2019. La muestra quedó constituida por las 91 pacientes que cumplieron con los requisitos de inclusión. Su diagnóstico se realizó según el algoritmo establecido en la sección de infección del tracto reproductor.
Resultados: la vulvovaginitis estuvo presente en el 41,8% de las pacientes, en el 63,2% de las jóvenes con vulvovaginitis se aisló Candida spp., se diagnosticó Ureaplasma spp. en el 22% de los casos, en el 76,9% de las pacientes no se aislaron bacterias patógenas y en el estuche diagnóstico de reacción de la cadena polimerasa el microorganismo más detectado fue el Mycoplasma genitalium en el 16,5% de los casos.
Conclusiones: la vulvovaginitis por Candida spp. fue la forma clínica más frecuente de presentación de las infecciones genitales bajas no virales entre las jóvenes. Ureaplasma spp. fue el microorganismo más detectado mediante el estuche comercial Myco Well D One. En la mayoría de las pacientes no se aislaron bacterias patógenas. El microorganismo más detectado por reacción de la cadena polimerasa fue Mycoplasma genitalium.
Keywords: infecciones genitales bajas no virales; jóvenes femeninas; diagnósticas microbiológicas
Abstract
Introduction: non-viral lower genital infections are one of the most frequent reasons for medical consultation in Gynecology. Youth is a vulnerable period for the development of this type of infections. The microbiological diagnosis by the various existing techniques guarantees to determine the specific etiology causing the genital infection.
Objective: to characterize non-viral lower genital infections in young females from the infantile and juvenile Gynecology Clinic.
Methods: a prospective longitudinal descriptive research was carried out in the Microbiology Laboratory of the “Mariana Grajales” Hospital from January to December 2019. The sample consisted of 91 patients who met the inclusion requirements. Their diagnosis was made according to the algorithm established in the reproductive tract infection section.
Results: vulvovaginitis was present in 41.8% of patients, Candida spp. was isolated in 63.2% of young women with vulvovaginitis, Ureaplasma spp. was diagnosed in 22% of cases, pathogenic bacteria were not isolated in 76.9% of patients and in the polymerase chain reaction diagnostic kit the most
detected microorganism was Mycoplasma genitalium in 16.5% of cases.
Conclusions: vulvovaginitis due to Candida spp. was the most frequent clinical presentation of non-viral lower genital infections among young women. Ureaplasma spp. was the most frequently detected microorganism using the Myco Well D One commercial kit. No pathogenic bacteria were isolated in the majority of patients. The most detected microorganism by polymerase chain reaction was Mycoplasma genitalium.
Keywords: non-viral lower genital infections; young females; microbiological diagnostics
Introducción
Las infecciones genitales bajas no virales constituyen uno de los motivos más frecuentes de consulta médica en Ginecología y es una importante causa de morbilidad, entre ellas las infecciones de cérvix, vagina, vulva y sus glándulas anexas. Entre los microorganismos más frecuentes de etiología no viral se encuentran Candida spp., causantes de la vaginosis bacteriana, Trichomonas vaginalis, Neisseria gonorrhoeae y Chlamydia trachomatis y algunas especies de Mycoplasma.(1)
La juventud es el período en el que se consolidan los caracteres psicológicos, sociales y biológicos de cada persona; es una etapa de la vida en que se carece de los conocimientos necesarios para la realización de prácticas sexuales organizadas, además se desarrollan los caracteres sexuales en ambos sexos, lo que les hace sentir la necesidad de experimentar nuevas formas de relacionarse. Estas condiciones hacen de esta etapa un período vulnerable para el contagio y el padecimiento de las infecciones genitales.(2)
Según la Organización Mundial de la Salud en 2016 cada día más de un millón de personas contraen una infección de transmisión sexual (ITS). Se estima que, anualmente, unos 376 millones de personas contraen alguna de las cuatro siguientes: clamidiasis (127 millones), gonorrea (87 millones), sífilis (seis millones) o tricomoniasis (156 millones).(3)
La infección por Chlamydia trachomatis es la segunda infección genital más frecuente en el mundo y la más común en mujeres jóvenes.(4)
En Cuba se notifican, anualmente, aproximadamente 50000 casos de ITS, con una tendencia ascendente en los últimos años. Entre las más frecuentes se encuentran la blenorragia, la sífilis, la uretritis no gonocócica, el condiloma acuminado, la tricomoniasis, el herpes simple geni-
29 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
tal y el virus de inmunodeficiencia humana (VIH).(2)
No existen en Cuba, ni en la Provincia de Villa Clara, estudios precedentes que aborden esta temática de forma específica en este grupo de edades, solo se refiere el estudio realizado en Villa Clara por López Pérez y colaboradores en mujeres atendidas en la Consulta externa de Ginecología, en el que se analizan 222 pacientes: en el 18,9% se observaron células levaduriformes, el 16,2% presentaban vaginosis bacteriana y cuatro pacientes tuvieron diagnóstico de Trichomonas vaginalis.(4)
Las infecciones genitales en la Provincia de Villa Clara representan un problema de salud por la alta incidencia con que se informan, por la cantidad de recursos que se emplean en su diagnóstico y su tratamiento y por la repercusión que tienen en la salud sexual y reproductiva de las jóvenes que las padecen.
Las jóvenes constituyen un grupo sensible por la inmadurez psicológica y biológica en este período de la vida, a su vez también constituye una etapa en la que el diagnóstico adecuado, así como el tratamiento oportuno, pueden dar un giro en la evolución de la enfermedad. Conocer cuáles son las principales características clínicas y microbiológicas de las infecciones genitales en las jóvenes de la provincia constituye una herramienta valiosa para un mejor abordaje diagnóstico, terapéutico y en la prevención de futuras complicaciones. Este trabajo caracteriza las infecciones genitales bajas no virales en jóvenes femeninas procedentes de la Consulta de Ginecología infantojuvenil.
Métodos
Se realizó una investigación descriptiva longitudinal prospectiva en el Laboratorio de Microbiología del Hospital Provincial Ginecoobstétrico Universitario “Mariana Grajales” de la Ciudad de Santa Clara, Provincia de Villa Clara, en el período de enero a diciembre de 2019.
La muestra se seleccionó mediante un muestreo no probabilístico intencional por criterios y quedó constituida por las 91 pacientes que cumplieron con los criterios de inclusión:
• Tener entre 12 y 20 años de edad
• Diagnóstico clínico de infecciones genitales bajas no virales
• Mantener relaciones sexuales

• Aceptar ser incluidas en el estudio
Las pacientes con sospecha de infecciones genitales bajas referidas desde la Consulta de Ginecología infantojuvenil, una vez confirmado el diagnóstico clínico, fueron remitidas al Laboratorio de Microbio -
30 Revista Bioreview®
logía para la toma de muestras. Estas fueron recogidas, conservadas y procesadas según el algoritmo diagnóstico establecido en la sección de infecciones del tracto reproductor del Laboratorio: se les realizó exudado vaginal para evaluar criterios de Amsel (leucorrea mal oliente, presencia de células guía en el exudado vaginal, prueba de aminas positivo y pH mayor de 4,5), que permitió el diagnóstico de vaginosis bacteriana; cultivo vaginal bacteriológico en Agar Sangre y Agar Mac Conkey, empleado para diagnóstico de otras bacterias patógenas; cultivo micológico en Agar Dextrosa Saboureaud para diagnóstico de especies de Candida; exudado endocervical para emplear el estuche comercial Myco Well D One en el diagnóstico de Mycoplasma hominis, Mycoplasma spp. y Ureaplasma spp. y, por último, se utilizó el exudado vaginal autorecolectable coleccionado junto con 20 mL de orina, muestra que se empleó para realizar reacción de la cadena polimerasa con reverso transcripción (RT-PCR, por sus siglas en inglés, reverse transcription-polymerase chain reaction) múltiple en el Laboratorio de Biología Molecular del Centro Provincial de Higiene, Epidemiología y Microbiología de Villa Clara para diagnóstico de Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium y Trichomonas vaginalis.
Se confeccionó una Guía de observación para la recolección de los datos necesarios en el estudio a partir de la solicitud de examen microbiológico y del Libro de registro
del Laboratorio. La información obtenida fue llevada a una base de datos.
Las variables empleadas en la investigación fueron las formas clínicas de presentación (vulvovaginitis, vaginosis, cervicitis y cervicovaginitis) y el diagnóstico de Candida spp., de vaginosis bacteriana, de Mycoplasmas urogenitales, de otras bacterias patógenas y de infecciones genitales por RT-PCR múltiple.

Los datos correspondientes a las variables de estudio fueron llevados a ficheros y procesados a través de los programas Microsoft Excel 2016 y SPSS versión 22.
Se hizo uso de la estadística descriptiva como medida de resumen para variables cualitativas, frecuencias absolutas y relativas (números y por ciento).
Se aplicó la prueba de independencia basada en la distribución Chi cuadrado; por limitaciones en esta se tomó el resultado de la prueba exacta de Fisher. Los resultados fueron presentados en tablas.
Se tuvieron presente las normas éticas establecidas en el contexto y los principios bioéticos de autonomía, beneficencia, no maleficencia y justicia. Se obtuvo por escrito el consentimiento informado de las pacientes o en casos de
31 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
menores de 18 años de sus tutores legales.
Resultados
La vulvovaginitis se diagnosticó en 38 pacientes (41,8%), seguida de la cervicitis (24, 26,3%) y de la vaginosis (17, 18,7%). Solo en 12 (13,2%) de los casos estudiados se realizó diagnóstico clínico de cervicovaginitis.
Al evaluar los resultados de los diferentes diagnósticos aplicados se observó que el 37,4% de las pacientes tuvo Candida spp., la vaginosis bacteriana se diagnosticó en el 24,2%, los Micoplasmas urogenitales en el 25,3% y otras bacterias patógenas en el 23,1% de los casos. También se detectó un 39,6% de positividad mediante la técnica de PCR-multiplex en tiem-
po real para infecciones genitales.
En la Tabla 1 se reflejó el diagnóstico de Candida spp. con las formas clínicas de presentación y se encontró que, de forma significativa, existe una relación de dependencia entre estas dos variables, y se apreció que el 63,2% de las pacientes con vulvovaginitis tenía diagnóstico de Candida spp.; este microorganismo también se aisló en el 33,3% de las pacientes con cervicovaginitis y, en menor proporción, entre las pacientes con cervicitis y vaginosis.
El diagnóstico de vaginosis bacteriana según las formas clínicas de presentación de las infecciones genitales bajas aparece en la Tabla 2. Se apreció, significativamente, que el 94,1% de las pacientes con síntomas de vaginosis tuvieron diagnós-
32 Revista Bioreview®
Diagnóstico de Candida spp. Positivo Negativo Total Formas clínicas Cervicitis Vulvovaginitis Vaginosis Cervicovaginitis Total N° % N° % N° % N° % N° % χ²=20,040; p=0,000 4 20 24 16,7 83,3 100 24 14 38 63,2 36,8 100 2 15 17 11,8 88,2 100 4 8 12 33,3 66,7 100 34 57 91 37,4 62,6 100
Tabla 1. Diagnóstico de Candida spp. según las formas clínicas de las infecciones genitales bajas no virales
Diagnóstico vaginosis bacteriana Positivo Negativo Total Formas clínicas Cervicitis Vulvovaginitis Vaginosis Cervicovaginitis Total N° % N° % N° % N° % N° % χ²=49,474; p=0,000 1 23 24 4,2 95,8 100 3 35 38 7,9 92,1 100 16 1 17 94,1 5,9 100 2 10 12 16,7 83,3 100 22 69 91 24,2 75,8 100
Tabla 2. Diagnóstico de vaginosis bacteriana según las formas clínicas de las infecciones genitales bajas no virales
Tabla 3. Diagnóstico de Mycoplasmas urogenitales según las formas clínicas de las infecciones genitales bajas no virales
tico de vaginosis bacteriana basado en los criterios de Amsel.
La Tabla 3 mostró la relación entre el diagnóstico de
Mycoplasmas urogenitales y las formas clínicas de presentación y se observó que la especie que se detectó con más frecuencia fue Ureaplasma spp., presente en el






33 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
Diagnóstico de Mycoplasmas urogenitales Mycoplasma hominis Mycoplasma spp. Ureaplasma spp. Negativo Total Formas clínicas Cervicitis Vulvovaginitis Vaginosis Cervicovaginitis Total N° % N° % N° % N° % N° % X2= 9,078; p=0,360 1 0 8 15 24 4,2 0,00 33,3 62,5 100 1 1 4 32 38 2,6 2,6 10,5 84,2 100 0 0 5 12 17 0,00 0,00 29,4 70,6 100 0 0 3 9 12 0,00 0,00 25 75 100 2 1 20 68 91 2,2 1,1 22 74,7 100
Tabla 4. Diagnóstico de otras bacterias patógenas según las formas clínicas de las infecciones genitales bajas no virales
de otras bacterias patógenas
Tabla 5. Diagnóstico de infecciones genitales por PCR según las formas clínicas de las infecciones genitales bajas no virales
de infecciones genitales por PCR
34 Revista Bioreview®
Diagnóstico
No bacterias patógenas Cocos grampositivos Enterobacterias Bacilos gramnegativos no fermentadores Total Formas clínicas Cervicitis Vulvovaginitis Vaginosis Cervicovaginitis Total N° % N° % N° % N° % N° % χ²=8,430; p=0,416 18 3 3 0 24 75 12,5 12,5 0,00 100 29 2 6 1 38 76,3 5,3 15,8 2,6 100 15 0 1 1 17 88,2 0,00 5,9 5,9 100 8 3 1 0 12 66,7 25 8,3 0,00 100 70 8 11 2 91 76,9 8,8 12,1 2,2 100
Diagnóstico
Mycoplasma genitalium Chlamydia trachomatis Trichomonas vaginalis Neisseria gonorroehae Chlamydia trachomatis+Trichomonas vaginalis Micoplasma genitalium+Chlamydia trachomatis Negativo Total Formas clínicas Cervicitis Vulvovaginitis Vaginosis Cervicovaginitis Total N° % N° % N° % N° % N° % χ²=18,960; p=0,240 4 3 1 0 0 1 15 24 16,7 12,5 4,2 0,00 0,00 4,2 62,5 100 3 5 0 1 1 2 26 38 7,9 13,2 0,00 2,6 2,6 5,3 68,4 100 4 1 0 0 0 1 11 17 23,5 5,9 0,00 0,00 0,00 5,9 64,7 100 4 3 1 0 1 0 3 12 33,3 25 8,3 0,00 8,3 0,00 25 100 15 12 2 1 2 4 55 91 16,5 13,2 2,2 1,1 2,2 4,4 60,4 100


35 Año XII · Número 138 · Febrero 2023
33,3% de los casos, seguida de Mycoplasma hominis y de solo un caso diagnosticado con Mycoplasma spp. No hubo una relación significativa entre las formas clínicas de las infecciones genitales bajas y la detección de estos microorganismos.
El diagnóstico de otras bacterias patógenas relacionado con las formas clínicas de presentación se mostró en la Tabla 4, en la que se apreció que en el 76,9% de las pacientes no se aíslan bacterias patógenas. No existe relación significativa entre estos aislamientos y las formas clínicas de presentación. A pesar de esto, del total de casos positivos el primer tipo de bacteria, en orden de frecuencia, fueron las enterobacterias, seguidas de los cocos grampositivos y de solo dos casos en los que se aislaron bacilos gramnegativos no fermentadores.
La Tabla 5 mostró la relación entre las formas clínicas de presentación y el diagnóstico de infecciones genitales por RT-PCR múltiple. Se observó que no existe una relación significativa entre estas dos variables; no obstante, el microorganismo más detectado fue el Mycoplasma genitalium (16,5%), seguido de Chlamydia trachomatis (13,2%) y de la coinfección de Mycoplasma genitalium-Chlamydia trachomatis.
Discusión
El diagnóstico de las infecciones genitales entre las jóvenes requiere de un análisis clínico y microbiológico que permita realizar un mejor abordaje terapéutico. Conocer las principales formas clínicas y los microorganismos que las producen representa una herramienta de gran valor en la práctica médica.
En la investigación se observó que la vulvovaginitis es la forma clínica más frecuente de presentación entre las jóvenes. Al realizar el diagnóstico microbiológico se pudo apreciar que la mayor positividad se obtuvo mediante la técnica de PCR múltiple para la detección de infecciones genitales, esta prueba diagnóstica presenta una elevada sensibilidad y permite la detección de Mycoplasma genitalium, Chlamydia trachomatis, Neisseria gonorrhoeae y Trichomona vaginalis; sin embargo, al particularizar en el diagnóstico de cada microorganismo por separado es realmente Candida spp. y la vaginosis bacteriana los que más frecuencia tienen en la población estudiada.
La vulvovaginitis por Candida spp. es la causa infecciosa más frecuente en la adolescencia y un problema común asociado a altos índices de morbilidad.(5,6) Estos resultados coinciden con los de la presente investigación en
la que la Candida spp. se encontraba como microorganismo causante de vulvovaginitis en más de la mitad de las jóvenes.
Es válido aclarar que se puede aislar a Candida spp. en paciente con otras formas clínicas de presentación porque puede encontrarse asociada a otros microorganismos e, incluso, formar parte de la flora normal sin provocar los síntomas que comúnmente causan cuando está asociada a vulvovaginitis.
La vaginosis bacteriana también es una enfermedad frecuente en la mujer sexualmente activa, por lo que las jóvenes que ya mantienen relaciones sexuales no están exentas de ese grupo. En la presente investigación se realizó el diagnóstico de esta enfermedad basado en los criterios de Amsel, que relaciona diferentes aspectos clínicos, aunque la mayoría de ellos en la práctica se evalúan en el laboratorio.
La vaginosis bacteriana es la primera causa de infección genital en la mujer sexualmente activa,(7,8,9) lo que no coincide con los resultados de la presente investigación, en la que la vaginosis ocupa el segundo lugar en orden de frecuencia. Este estudio presenta resultados que demuestran la gran variabilidad que puede tener el diagnóstico de la vaginosis bacteriana a nivel mundial y refiere el problema de sobrediagnóstico por el empleo de los criterios de Amsel que, aunque presenta menor sensibilidad y especificidad que otros métodos utilizados para el diagnóstico de vaginosis bacteriana, constituye una herramienta útil a emplear por su bajo costo, su accesibilidad y su fácil implementación en los Laboratorios de Microbiología de las áreas de salud.
Mycoplasma hominis, Ureaplasma spp. y Mycoplasma genitalium se han asociado definitivamente con la enfermedad y con la potencial implicación en la enfermedad del tracto urogenital. La colonización del tracto urogenital por Mycoplasma hominis y Ureaplasma spp. plantea dificultades en la valoración de su aislamiento a partir de muestras procedentes del tracto genitourinario inferior, son necesarios el empleo de métodos de cultivo cuantitativos y el establecimiento de puntos de corte que permitan diferenciar colonización de infección.(10)
Para su diagnóstico se han creado un gran número de métodos basados en cultivos con medios selectivos para la detección de Mycoplasma genitales, como lo es el estuche diagnóstico Myco Well D One. Este estuche comercial permite la detección de Mycoplasma hominis, Ureaplas -
36 Revista Bioreview®




























ma spp. y Mycoplasma spp.
Tres estudios muestran que Ureaplasma spp. es el Mycoplasma más frecuentemente aislado en un 70%, un 56,4% y un 15,3% respectivamente de las pacientes estudiadas en cada uno, resultados que coinciden con los de la presente investigación.(4,10,11)
Existen otras bacterias patógenas específicas que presentan mayor valor en el caso de las niñas pre púber en las que la contaminación ocurre con mayor frecuencia por la cercanía del ano al introito vaginal y la contaminación, en muchos casos, con las secreciones respiratorias. En el caso de la presente investigación, en la que se estudian jóvenes y adolescentes, estos aislamientos deben ser interpretados como etiología de vulvovaginitis cuando el crecimiento es confluyente y está causado, generalmente, por aseo inadecuado de los genitales, desequilibrios de la microbiota normal de la vagina o ante algún procedimiento o intervención quirúrgica previa.
Según el artículo “Flora vaginal en pacientes que asisten a consulta ginecológica” los cocos grampositivos (Enterococcus sp, Streptococcus grupo B, Staphylococcus aureus y Staphylococcus coagulasa negativa) y Escherichia coli fueron los microorganismos aislados de las pacientes con vaginitis aeróbicas: de un total de 18 pacientes el 27,7% tuvo aislamiento de enterobacterias y el resto, un 72,2%, fueron cocos grampositivos,(12) lo que no coincide con los resultados de la presente investigación en la que, en orden de frecuencia, las enterobacterias ocupan el primer lugar, seguidas de los cocos grampositivos.
En un estudio de 440 mujeres se aislaron 75 pacientes con vaginitis por Escherichia coli, que representaron el 17% de las estudiadas.(13) Este resultado coincide con la presente investigación en las que las enterobacterias están en primer lugar entre este grupo de bacterias patógenas.
El estuche diagnóstico de PCR múltiple de infecciones genitales que se empleó en este estudio permite la detección de cuatro microorganismos (Mycoplasma genitalium, Chlamydia trachomatis, Trichomona vaginalis y Neisseria gonorrhoeae). Su utilización en las jóvenes y adolescentes constituye una herramienta valiosa porque permite la detección de cuatro de los microorganismos patógenos más importantes de transmisión sexual, con consecuencias muchas veces irreversibles en la salud sexual y reproductiva de la mujer. Mycoplasma genitalium, Chlamydia trachomatis y Neisseria gonorrhoeae se colo -
can actualmente como las principales causas de cervicitis, de enfermedad inflamatoria pélvica y de infertilidad.
Mycoplasma genitalium se asocia significativamente con la cervicitis y es detectada por PCR en el 25% de las mujeres con este diagnóstico, aunque son frecuentes las coinfecciones en un análisis de regresión logística.(14) Esta afirmación difiere, en parte, de la presente investigación en la que, a pesar de que la mayoría de los aislamientos de M. genitalium ocurrió en pacientes con cervicitis, no existe relación significativa entre el diagnóstico por PCR y las formas clínicas de presentación.
El 9% de las mujeres sexualmente activas menores de 25 años padecen Chlamydia trachomatis; el cribado con auto-toma de la muestra y la detección mediante amplificación de ácidos nucleicos son las formas más eficaces de control sanitario.(15) Coincide con la presente investigación en el empleo de la auto-toma de muestra para el diagnóstico de Chlamydia trachomatis por PCR, así como en la frecuencia de su detección, porque no dista mucho de la encontrada.
Conclusiones
La vulvovaginitis por Candida. spp es la forma clínica más frecuente de presentación de las infecciones genitales bajas no virales entre las jóvenes, seguida del diagnóstico de vaginosis bacteriana. Ureaplasma spp. fue el microorganismo más detectado mediante el estuche comercial Myco Well D One. En la mayoría de las pacientes no se aíslan bacterias patógenas. El microorganismo más detectado por PCR fue Mycoplasma genitalium, seguido de Chlamydia trachomatis, ambos de difícil diagnóstico y relacionados con afectación a la salud sexual y reproductiva de la joven.
REFERENCIAS BIBLIOGRÁFICAS
1. Vidart Aragón JA, Escudero Fernández M, Coronado Martín PJ. Infecciones del tracto genital inferior: I. Agentes bacterianos y otros. En: Cabero Roura Ll, Cabrillo Rodríguez E, Bajo Arenas JM, Calaf Alsina J, Cararach Ramoneda V, Davi Armengol E, et al. Tratado de ginecología y obstetricia. 2da ed. Madrid: Médica Panamericana; 2014. p 340-346.
2. García-Vázquez J, Quintó
L, Nas-
M, AgülloTomás E. Evolución de la salud sexual de la población adolescente española y asturiana. Rev Esp Salud Pública [Internet]. 2019 [citado 15/04/2020];93:e1-14. Disponible en: https://scielosp.org/article/ resp/2019.v93/e201909071/
38 Revista Bioreview®
Domech
cimento
3. Centro Nacional de Información de Ciencias Médicas. Biblioteca Médica Nacional. Infecciones de transmisión sexual. Estadísticas Mundiales. Factográfico salud [Internet]. 2020 [citado 15/04/2020];6(2):1-16. Disponible en: http://files.sld.cu/bmn/files/2020/02/factografico-de-saludfebrero-2020.pdf
4. López Pérez M, Palma Mora S, García Gómez D. Infecciones cervicovaginales en pacientes sintomáticas atendidas en la consulta externa de ginecología. Acta Méd Centro [Internet]. 2020 [citado 20/11/2020];14(1):53-59. Disponible en: http://scielo.sld.cu/pdf/amdc/v14n1/2709-7927-amdc-14-01-53.pdf
5. Domingo PA. Alteraciones vulvovaginales (bartolinitis, leucorreas, traumatismos, vaginosis e infecciones de transmisión sexual). Adolescere [Internet]. 2019 [citado 21/05/2020];VII(1):26-38. Disponible en:https:// www.adolescenciasema.org/ficheros/REVISTA%20ADOLESCERE/ vol7num1-2019/26-38%20Tema%20de%20Revision%20-%20Alteraciones%20 vulvovaginales.pdf
6. Pineda-Murillo J, Cortés-Figueroa AA, Uribarren-Berrueta TNJ, Castañón Olivares LR. Candidosis vaginal. Revisión de la literatura y situación de México y otros países latinoamericanos. Rev Méd Risaralda [Internet]. 2017 [citado 13/12/2020];23(1):38-44. Disponible en: http://www.scielo.org.co/ pdf/rmri/v23n1/v23n1a09.pdf
7. Vazquez F, Fernández-Blázquez A, García B. Vaginosis. Microbiota vaginal. Enferm Infecc Microbiol Clin [Internet]. 2019 [citado 21/05/2020];37(9):592601. Disponible en: https://www.clinicalkey.es/#!/content/journal/1-s2.0S0213005X1830380X.https://doi.org/10.1016/j.eimc.2018.11.009
8. Jiménez-Flores G, Flores-Tlalpa J, Ruiz-Tagle AC, Villagrán-Padilla CL. Evaluación de los métodos utilizados para el diagnóstico de vaginosis bacteriana en el Hospital Regional ISSSTE Puebla. CienciaUAT [Internet]. 2020 [citado 12/07/2022];14(2):62-71. Disponible en: http://www.scielo.org.mx/scielo. php?script=sci_arttext&pid=S2007-78582020000100062&lng=es. https://doi. org/10.29059/cienciauat.v14i2.1296
9. Redelinghuys MJ, Geldenhuys J, Jung H, Kock MM. Bacterial Vaginosis: Current Diagnostic Avenues and Future Opportunities. Front Cell Infect Microbiol [Internet]. 2020 [citado 12/07/2022];10:354. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7431474/. https://doi. org/10.3389%2Ffcimb.2020.00354
10. Borrel Martínez JM, Díaz Franco A, Herrera Puente A, Sánchez Burson L, Sanmartín Sánchez E. Guía de buena práctica clínica en infecciones de transmisión sexual [Internet]. Madrid: OMC, IMC; 2018 [citado 13/12/2020]. Disponible en: https://www.cgcom.es/sites/default/files/gbpc_infecciones_ transmision_sexual.pdf
11. Arnold Rodríguez M. Micoplasmas urogenitales como causa de
infertilidad femenina. Hospital Ginecobstétrico Provincial de Matanzas. 2014-2015. Rev Med Electrón [Internet]. 2016 [citado 13/12/2020];38(3):370382. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_ arttext&pid=S1684-18242016000300007
12. González C, Moreno MA, Nieves B, Flores A, Chille A, Carrero S, et al. Flora vaginal en pacientes que asisten a consulta ginecológica. Rev Soc Ven Microbiol [Internet]. 2006 [citado 26/11/2020];26(1):19-26. Disponible en: http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S131525562006000100005&lng=es
13. González-Pedraza Avilés A, Ortiz Zaragoza C, Dávila Mendoza R, Valencia Gómez CM. Infecciones cervicovaginales más frecuentes; prevalencia y factores de riesgo. Rev Cubana Obstet Ginecol [Internet]. 2007 [citado 26/11/2020];33(2):1-12. Disponible en: http://scielo.sld.cu/scielo. php?script=sci_arttext&pid=S0138-600X2007000200007&lng=es
14. Martín-Saco G, Tristancho A, Arias A, Ferrer I, Milagro A, García-Lechuz JM. Mycoplasma genitalium and sexually transmitted infections: evidences and figures in a tertiary hospital. Rev Esp Quimioter [Internet]. 2022 [citado 15/04/2022];35(1):76-79. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC8790635/. https://doi.org/10.37201%2Freq%2F091.2021
15. Huneeus-Vergara A, Soriano-Brücher H, Pommer-Tellez H, DelpianoMéndez L, Salas-Pacheco F, Céspedes-Pino P, et al. Chlamydia trachomatis: fundamentos de la importancia del cribado en el sistema público de salud. Rev Chil Infectol [Internet]. 2018 [citado 13/12/2020];35(5):498500. Disponible en: https://scielo.conicyt.cl/pdf/rci/v35n5/0716-1018rci-35-05-0498.pdf
CONFLICTO DE INTERESES: No existe conflicto de intereses en relación al artículo presentado.
CONTRIBUCIÓN DE LOS AUTORES
RAD: conceptualización, curación de datos, investigación, metodología, administración del proyecto, recursos, supervisión, redacción del borrador original, redacción (revisión y edición).
MLP: conceptualización, investigación, redacción del borrador original, redacción (revisión y edición).
ETT: investigación, recursos, redacción del borrador original, redacción (revisión y edición).
NDM: análisis formal, metodología, redacción (revisión y edición).
ARR: investigación, redacción del borrador original, redacción (revisión y edición).
39 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
Hiperglucemia y leucocitosis como predictores de complicaciones intrahospitalarias en pacientes con Infarto del miocardio agudo
CIENCIAS CLÍNICAS Y PATOLÓGICAS
Geovedy Martínez García1,2*
1Hospital General Docente “Enrique Cabrera”, Servicio de Cardiología. La Habana, Cuba.
2Universidad de Ciencias Médicas de La Habana. La Habana, Cuba.
*Autor para la correspondencia: geovedymg@infomed.sld.cu
Cómo citar este artículo: Martínez García G. Hiperglucemia y leucocitosis como predictores de complicaciones intrahospitalarias en pacientes con Infarto del miocardio agudo. Rev haban cienc méd [Internet]. 2021 [citado ]; 20(6):e4174. Disponible en: http://www.revhabanera.sld.cu/ index.php/rhab/article/view/4174
Resumen
Introducción: A pesar de las nuevas técnicas para la reperfusión del vaso en el infarto agudo de miocardio, las complicaciones y la mortalidad en estos pacientes es elevada. La hiperglucemia y la leucocitosis se han
descrito como factores de riesgo y de peor pronóstico.
Objetivo: Evaluar la capacidad predictiva de la hiperglucemia y la leucocitosis de complicaciones intrahospitalarias en pacientes con infarto de miocardio agudo con elevación del segmento ST.
40 Revista Bioreview®
Material y Método: Estudio prospectivo de cohorte desde 2013 hasta 2020 que incluyó a 507 pacientes consecutivos que ingresaron en la Unidad de Cuidados Coronarios del Hospital Militar Central “Dr. Carlos J. Finlay” y el Hospital General Docente “Enrique Cabrera” con el diagnóstico de infarto del miocardio agudo con elevación del segmento ST. Se dividieron los pacientes de acuerdo con la ocurrencia de complicaciones intrahospitalarias.
Resultados: Los valores de glucemia y leucograma presentaron diferencias significativas entre los grupos de pacientes (p = 0,002 y p = 0,005; respectivamente). La capacidad discriminativa de ambos exámenes se clasificó como mala. El análisis univariado de regresión logística reveló que la glucemia y el leucograma eran factores de riesgo para la aparición de complicaciones, pero solo el leucograma se consideró un predictor independiente del evento final del estudio. Al asociar los valores de leucograma al modelo multivariado, se elevó su capacidad predictiva (área bajo la curva: 0,735; p < 0,001).
Conclusiones: La leucocitosis es un predictor independiente de complicaciones intrahospitalarias en pacientes con Infarto del miocardio agudo con elevación del segmento ST.
Palabras clave: infarto del miocardio, hiperglucemia, leucocitosis, complicaciones intrahospitalarias.
Abstract: Hyperglycemia and leukocytosis as predictive factors of in-hospital complications in patients with Acute myocardial infarction
Introduction: Despite the use of novel techniques for reperfusion of the vessel in acute myocardial infarction, complications and mortality in these patients are high. Hyperglycemia and leukocytosis have been described as risk factors and worse prognosis.
Objective: To evaluate the predictive capacity of hyperglycemia and leukocytosis for in-hospital complications of myocardial infarction with ST-segment elevation patients.
Material and Methods: Prospective cohort study conducted from 2013 to 2020 that included 507 consecutive patients admitted to the Intensive Coronary Care Unit of the “Dr. Carlos J. Finlay” Central Military Hospital and the “Enrique Cabrera” General Teaching Hospital with the diagnosis of acute myocardial infarction with ST- segment elevation. The patients were divided into groups according to the occurrence of in-hospital complications.
Results: The values of glycemia and leukocyteswere significantly different among the groups of patients (p = 0.002 and p = 0.005; respectively). The discriminative capability of both tests was classified as bad. The univariate analysis of logistic regression revealed that glycemia and leukocytes were risk factors for the appearance of complications, but only the leukocyte test was considered as an independent predictor of the final event of the study. When the values of the leukocyte test were associated with the multivariate model, its predictive capacity increased (area under curve: 0.735; p < 0.001).
Conclusions: Leukocytosis is an independent predictor of in-hospital complications of acute myocardial infarction with ST-segment elevation.
Keywords: myocardial infarction, hyperglycemia, leukocytosis, in-hospital complications.
Introducción
Del conjunto de las enfermedades cardiacas, la cardiopatía isquémica representa el 30 %. Más de siete millones de personas mueren cada año como consecuencia de esta enfermedad, lo que corresponde a un 12,8 % de todas las muertes.(1)
En Cuba las enfermedades isquémicas del corazón alcanzaron una tasa de mortalidad en el año 2020 de 165,8 defunciones por cada 100000 habitantes. Dentro de ellas, el Infarto del miocardio agudo ocupa un lugar preponderante, con una tasa de mortalidad de 69,7 fallecidos por 100000 habitantes, superior a las cifras del año precedente.(2)
A pesar del enorme avance en el conocimiento de la fisiopatología y tratamiento del Infarto agudo del miocardio (IMA), esta es una enfermedad que presenta aún una elevada mortalidad intrahospitalaria, dada por las diversas complicaciones que pueden presentarse durante su curso clínico. Estas complicaciones pueden dividirse, de acuerdo con su cronología, en agudas, subagudas y crónicas; esta clasificación es ambigua y muchas veces no se logra definir cuándo aparecen. Por tal motivo, se prefiere dividirlas en derivadas de la necrosis miocárdica en sí mismas o directas, y complicaciones que se relacionan con el tratamiento empleado o indirectas.
La aterosclerosis es una enfermedad multifactorial, que incluye dislipidemia, hiperglucemia, tabaquismo, HTA y otras causas de lesión endotelial en su patogénesis.(3,4) La aterogénesis representa un proceso inflamatorio activo desencadenado por esa lesión endotelial, y no una infiltración pasiva de lípidos en la pared arterial, como se había descrito inicialmente.(5)
41 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
Por tratarse de una enfermedad inflamatoria, algunos marcadores reactantes de la fase aguda han sido propuestos para predecir el riesgo de complicaciones de un evento agudo isquémico. Uno de estos marcadores es el conteo total de leucocitos, pero su resultado, a pesar de la alta disponibilidad y bajo costo, no ha sido explorado a su máximo valor predictivo.(6) Aunque el mecanismo por el cual se eleva no es claro, en forma directa podría atribuirse a un estado de hipercoagulabilidad o un fenómeno de no reflujo, y en forma indirecta a cardiotoxicidad por citocinas proinflamatorias: interleucinas (6, 8 y CD40) y moléculas de adhesión celular–1.
La cardiotoxicidad, clínicamente expresada por disfunción ventricular, se ha atribuido a incremento en la tensión oxidativa, factor de necrosis tumoral, citocinas proinflamatorias, radicales libres y activación del complemento.
(6,7,8)
En la última década, numerosos estudios han centrado su atención en el valor pronóstico de la hiperglucemia en el síndrome coronario agudo, independientemente de que los pacientes tuvieran diabetes conocida o no. La hiperglucemia aguda o de estrés tiene un papel facilitador en el desarrollo del síndrome coronario agudo y acentúa las consecuencias del daño celular producido por la isquemia miocárdica aguda.(9)
Por lo antes expuesto, se decidió realizar el siguiente estudio, con el objetivo de evaluar la capacidad predictiva de la hiperglucemia y la leucocitosis de complicaciones intrahospitalarias en pacientes con Infarto del miocardio agudo con elevación del segmento ST (IAMCEST).
Material y Métodos
Se realizó un estudio analítico observacional, multicéntrico, prospectivo de cohorte, que incluyó a todos los pacientes ingresados con el diagnóstico de IAMCEST en el Servicio de Cardiología del Hospital Militar Central “Dr. Carlos J. Finlay” en el período comprendido entre septiembre de 2013 a enero de 2017; y en el Hospital General Docente “Enrique Cabrera” en el período comprendido entre junio de 2018 a marzo de 2020; divididos de la siguiente forma: 307 casos atendidos en el Hospital Militar Central “Dr. Carlos Juan Finlay”, y 200 pacientes atendidos en el Hospital General Docente “Enrique Cabrera”. Los pacientes cumplieron los siguientes criterios:
• Diagnóstico de infarto del miocardio agudo con eleva-
ción del segmento ST, según la Cuarta Definición Universal del Infarto del Miocardio.(10)
• Realización durante el ingreso de leucograma y glucemia en ayunas.
• Ausencia de enfermedad inflamatoria sistémica, infecciosa o hematológica conocida.
• No hayan sido trasladados a otras instituciones antes del alta hospitalaria.
En una ficha digital se registró de forma prospectiva, para cada paciente, distintas variables clínicas y epidemiológicas: edad, sexo, antecedentes personales (Diabetes mellitus, hipertensión, dislipidemia, tabaquismo, infarto cardiaco y accidente cerebrovascular), y la clase Killip-Kimball al ingreso (de clase I a clase IV).
Se registró también la localización electrocardiográfica del infarto (anteroseptal, anterolateral, anterior extenso, lateral, inferior, inferolateral o posterior), la terapia de reperfusión empleada (fibrinólisis o intervención coronaria percutánea), la estadía hospitalaria (días), la ocurrencia de complicaciones intrahospitalarias, y el estado al egreso (vivo o fallecido), así como las cifras de la primera glucemia en ayunas (PGA, mmol//L) y el conteo total de leucocitos (10 9/L).
La información fue procesada por el paquete estadístico IBM® SPSS® (Statistical Product and Service Solutions) versión 19.0.0. Las variables continuas fueron presentadas como media ± desviación estándar; las comparaciones entre los grupos se analizaron con la prueba de t de Student. Las variables categóricas se presentaron como frecuencia y porcentaje, para su asociación se utilizó el test de chi cuadrado de Pearson o la prueba exacta de Fisher.
Se realizó un análisis de regresión logística multivariada para determinar si la glucemia y la leucocitosis eran predictores independientes de complicaciones intrahospitalarias, así como identificar otros predictores. Las variables iniciales con buena correlación en el análisis univariado con el evento final fueron incluidas en el modelo multivariado. La discriminación se evaluó con el estadístico C, también denominado área bajo la curva ROC (receiver operating characteristic). El nivel de significación estadística utilizado fue de p < 0,05 con un Intervalo de Confianza del 95 %. Los resultados se expresaron en porcentajes y valores medios ± desviación estándar en forma de tablas y gráficos.
42 Revista Bioreview®
La investigación se ejecutó bajo los principios establecidos en la Declaración de Helsinki. Se informó al paciente que formaba parte del estudio y que los exámenes realizados se encontraban dentro de los practicados a todos los pacientes cuando ingresan en la Unidad de Cuidados Coronarios.
Se recogió el consentimiento informado por escrito de cada paciente en un modelo elaborado a tal efecto. En todo momento se mantuvo la confidencialidad respecto a la identidad de los pacientes. Los resultados obtenidos no se utilizaron con otros fines fuera del marco de la investigación, respetando en todo momento los postulados éticos.
El estudio fue aprobado por los comités de ética de la investigación de los hospitales General Docente “Enrique Cabrera” y el del Militar Central “Dr. Carlos J. Finlay”.
Resultados
Características de los pacientes en el estudio
Se incluyeron en el estudio 507 pacientes, con una edad media de 62,9 ± 11,7 años. Las características clínicas y de laboratorio del total de los participantes y de los grupos estratificados por la ocurrencia del evento primario son presentadas en la Tabla 1. Los pacientes afectados por
complicaciones intrahospitalarias mostraron mayor edad, tabaquismo, IAMCEST con localización anterior en el electrocardiograma y una clasificación funcional Killip-Kimbal ≥ II en el momento del ingreso.
En relación con los exámenes de laboratorio, los sujetos que presentaron el evento primario tenían mayores niveles de glucemia y leucograma. Se observó diferencias significativas entre ambos grupos de pacientes al tener en cuenta la no realización de intervención coronaria percutánea (ICP) y la estadía hospitalaria.

Se calcularon las curvas ROC de la glucemia y del leucograma relacionado con la ocurrencia de complicaciones intrahospitalarias, obteniéndose un área bajo la curva para la glucemia de 0,581 (95 % IC 0,530 – 0,632; p = 0,002), y una curva ROC para el leucograma de 0,576 (95 % IC 0,525 – 0,627; p = 0,004). A pesar de que ambas curvas son estadísticamente significativas, la capacidad discriminativa de ambos exámenes se puede clasificar como mala. (Fig. 1)
Factores de riesgo para complicaciones intrahospitalarias en el SCACEST
Los resultados de los análisis univariado y multivariado y los predictores de complicaciones intrahospitalarias en
43 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
Tabla 1. Características clínicas y de laboratorio de los pacientes estratificada con el estado al egreso.
Los valores son presentados como media ± desviación estándar, o número (%). Los porcientos se calcularon de acuerdo con la columna donde se encuentran.
IMA- infarto agudo del miocardio; AVE- accidente cerebrovascular; KK- clasificación Killip-Kimball; ICP- intervención coronaria percutánea.
44 Revista Bioreview®
clínicas Total (n = 507) p Variable Presente (n = 198) Ausente (n = 309)
Formas

45 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
Figura 1. Curva ROC que relaciona a la glucemia y al leucograma con las complicaciones intrahospitalarias en el IAMCEST
el IAMCEST se presenta en la Tabla 2. El análisis univariado reveló que la edad, los antecedentes de tabaquismo, una clase funcional ≥ II de Killip- Kimball, la localización anterior del IAMCEST, la glucemia, el leucograma, la no
realización de ICP y la estadía hospitalaria, eran factores de riesgo de aparición de complicaciones durante el ingreso (todos con p < 0,05). Después de ajustar potenciales factores confusores, el análisis multivariado encontró
46 Revista Bioreview®
OR- Odds ratio; IC- intervalo de confianza.
IMA- infarto agudo del miocardio; AVE- accidente cerebrovascular; KK- clasificación Killip-Kimball; ICP- intervención coronaria percutánea.
Análisis univariado Variable β (95 % IC) Análisis multivariado p OR (95 % IC) p
Tabla 2. Resultados del análisis de regresión logística univariado y multivariado para predecir complicaciones intrahospitalarias en los pacientes con IAMCEST

47 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
Figura 2. Curva ROC del modelo multivariado predictivo de complicaciones intrahospitalarias en el IAMCEST.
que el antecedente de tabaquismo, la clase funcional Killip-Kimball ≥ II, el IAMCEST de cara anterior, los valores del leucograma, la no realización de ICP y la estadía eran predictores independientes de complicaciones intrahospitalarias en el IAMCEST.
Este modelo tuvo una discriminación evaluada mediante el área bajo la curva ROC de 0,735 (95 % IC 0,691 – 0,779; p < 0,001) de predecir complicaciones intrahospitalarias en el IMACEST, lo cual se puede clasificar como buena, lo que se muestra en la Fig. 2.
Discusión
A pesar de los avances en el diagnóstico y el tratamiento, el IAMCEST sigue siendo un importante problema de salud pública en los países industrializados, y está aumentando también en los países en vías de desarrollo. (11,12) Por tal motivo, la mayoría de los países desarrollados cuentan con registros nacionales y/o regionales que sirven de base para el análisis y la realización de estudios clínicos y epidemiológicos, así como para la toma de decisiones en materia de salud.
(13,14,15,16,17,18)
Cuba no está ajena a esta situación. En el XX Congreso Cubano de Cardiología se adoptó la decisión de crear un registro multicéntrico, con el objetivo de almacenar, organizar y manipular datos de forma homogénea en unidades coronarias u otras unidades asistenciales del sistema nacional de salud que atienden pacientes ingresados con Infarto del miocardio agudo. A este proyecto se le denominó registro cubano de infarto (RECUIMA), y los datos de sus primeros 1 000 casos fueron publicados en 2019.(19)
En la mayoría de los registros y estudios publicados se describen las complicaciones intrahospitalarias, pero no se expone el por ciento total de pacientes que las padecen. Este cálculo es difícil de realizar a partir de las tablas presentadas, porque un mismo paciente puede tener varias complicaciones en el periodo de internamiento. Sin embargo, en varias publicaciones que comparan un mismo registro en varios momentos, se ha observado una disminución en la presentación de complicaciones intrahospitalarias.(12,15) Ello se debe a los avances en los cuidados críticos y de apoyo vital y al desarrollo, introducción y generalización de la intervención coronaria percutánea (ICP) como terapia de reperfusión coronaria.
Chen et al.(20) estudiaron a 715 pacientes con IAMCEST que fueron considerados para ICP en las primeras 72 horas del inicio del evento agudo, y a los cuales se les extrajo muestra de sangre para medir conteo total de leucocitos e interleuquina-10; se excluyeron aquellos que presentaban inflamación aguda o crónica intercurrente conocida, y se calculó la razón neutrófilo-linfocito (NLR). El NLR se correlacionó positivamente con el daño miocárdico (NLR vs. CK-MB: p < 0,001), y negativamente con la función miocárdica (NLR vs. fracción de eyección: p < 0,001; NLR vs. fracción acortamiento: p < 0,001). Estos resultados sugieren la participación de los leucocitos como expresión de la inflamación en la génesis de la aterotrombosis y en la evolución de la enfermedad coronaria.
En un estudio realizado en Corea del Sur, Hong et al.(21) evaluaron el pronóstico de NLR relacionado con ICP en pacientes con infarto agudo del miocardio. Para ello se incluyó a 309 participantes, a quienes se les realizó un estudio de resonancia magnética cardiaca y conteo celular completo 24 horas antes y después del procedimiento percutáneo. Se estimó valor de corte de NLR de 3,88, y se dividió a los pacientes en dos grupos teniendo en cuenta ese valor. El tamaño del infarto resultó significativamente mayor en el grupo con elevado NLR (24,1 ± 11,0 vs. 16,7 ± 9,1, p < 0,001). NRL post-ICP ≥ 3,88 se asoció con mayor riesgo de IMA de gran tamaño (≥ 20 %) (OR 2,91, 95 % CI 1,73–4,88, p < 0,001). El riesgo de eventos cardiacos adversos mayores resultó también significativamente mayor en el grupo de alto NLR (15,8 % vs. 7,4 %, HR 2,60, 95 % CI 1,21– 5,60, p = 0,015). Como conclusión, los autores plantean que la relación linfocitaria utilizada, antes y después de ICP, es un marcador de fácil medición y de disponibilidad universal y puede ser una herramienta útil para la predicción de riesgo y pronóstico en pacientes con infarto que se someten a intervención percutánea.
Se han realizado varios estudios que comparan la capacidad de la leucocitosis como predictor de eventos adversos en el síndrome coronario agudo con otros marcadores inflamatorios, como el extremo aminoterminal del péptido natriurético cerebral (NT-proBNP) y la proteína C reactiva ultrasensible. Akhtar et al.(22) estudiaron el significado pronóstico del conteo de leucocitos, así como su correlación con los niveles de NT-proBNP en pacientes con síndrome coronario agudo. Se encontró asociación significativa entre los niveles aumentados de NT-proBNP y la leucocitosis, y a pesar de ser un estudio con pocos casos, reafirma que
48 Revista Bioreview®
los niveles de leucocitos constituyen un predictor de eventos adversos semejante a otros marcadores.
En la última década, numerosos estudios han centrado su atención en el valor pronóstico de la hiperglucemia en el síndrome coronario agudo, independientemente de que los pacientes tuvieran diabetes conocida o no. La hiperglucemia aguda o de estrés tiene un papel facilitador en el desarrollo del síndrome coronario agudo y acentúa las consecuencias del daño celular producido por la isquemia miocárdica aguda. En este sentido, Gómez-Arbeláez et al.(23) estudiaron 439 pacientes con diagnóstico confirmado de IAMCEST internados en ocho hospitales de Colombia y Ecuador y mostraron que la hiperglucemia al ingreso (glucemia ≥ 140 mg/dl) es un factor de riesgo de mortalidad intrahospitalaria y a largo plazo.
Isaa et al.(24) investigaron el papel de la descompensación de la Diabetes mellitus en la ocurrencia de complicaciones tras un IAMCEST. Para eso incluyó a 73 722 pacientes diabéticos con IMA y se definió como diabetes descompensada la presencia de cetoacidosis diabética o estado de hiperglucemia hiperosmolar. Como re -
sultado, observaron la presencia de descompensación endocrina en el 1,5 % de los diabéticos admitidos con IAMCEST; estos pacientes tuvieron una alta incidencia de shock cardiogénico (23,9 % vs. 9,3 %, p < 0,001), parada cardiorrespiratoria (11,8 % vs. 5,6 %) y mortalidad intrahospitalaria (25,6 % vs. 19,4 %, p = 0 ,001), y fueron menos sometidos a coronariografía (51,5 % vs. 55,5 %, p = 0,023) e ICP (26,1 % vs. 34,8 %, p < 0,001).
Incluso, en pacientes con síndrome coronario agudo sometidos a intervencionismo percutáneo, la hiperglucemia tiene también un peor significado pronóstico a corto plazo, independientemente de que tengan antecedentes de Diabetes mellitus.(25) En consecuencia, recientemente se ha considerado a la hiperglucemia como factor de riesgo independiente en la valoración pronóstica de los pacientes con síndrome coronario agudo.(25,26)
Los datos obtenidos en este estudio concuerdan con algunas de las conclusiones de los trabajos anteriores. Las comparaciones de los grupos en cuanto a las complicaciones presentadas y sus valores de leucograma y glucemia presentaron diferencias significativas. Sin
49 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
embargo, la capacidad discriminativa de ambos parámetros para predecir la ocurrencia de complicaciones intrahospitalarias no es buena, lo cual limita su uso de forma aislada. Por otro lado, solamente el leucograma se consideró como un predictor independiente de complicaciones en el análisis multivariado, lo cual excluye a la hiperglucemia como factor de riesgo independiente.
El estudio tiene limitaciones que deben tenerse en cuenta. Primero, aunque se realizó en instituciones de nivel secundario, solo hubo dos centros participantes, y en la misma provincia, lo que podría limitar la generalización de los resultados a los otros centros del país. Segundo, los participantes en el estudio fueron pacientes que se ingresaron en las unidades de cuidados coronarios, por lo cual se excluyeron aquellos que fueron admitidos en otras unidades de cuidados intensivos, o aquellos que fallecieron en los centros de urgencia y no lograron ingresarse.
Conclusiones
La leucocitosis es un predictor independiente de complicaciones intrahospitalarias del infarto agudo de miocardio con elevación del segmento ST. La hiperglucemia se puede considerar un factor de riesgo para la aparición de complicaciones intrahospitalarias.
REFERENCIAS BIBLIOGRÁFICAS
1. Mozaffarian D, Benjamin EJ, Go AS. Heart disease and stroke statistics−2016 update: a report from the American Heart Association. Circulation [Internet]. 2016;133(4):e38-360. Disponible en: https://doi.org/10.1161/ CIR.0000000000000350
2. Ministerio de Salud Pública Cuba. Anuario Estadístico de Salud 2020 [Internet]. La Habana: MINSAP; 2021 [Citado 20/08/2021]. Disponible en: http://bvscuba.sld.cu/anuario-estadisticodecuba//2020
3. Montecucco F, Carbone F, Schindler TH. Pathophysiology of ST-segment elevation myocardial infarction: novel mechanisms and treatments. Eur Heart J [Internet]. 2016;37(16):1268-83. Disponible en: https://doi.org/10.1093/ eurheart/ehv592
4. Frangogiannis NG. Inflammation in cardiac injury, repair and regeneration. Curr Opinion in Cardiol [Internet]. 2015 [Citado 15/04/2021];30(3):240-5. Disponible en: https://pubmed.ncbi.
nlm.nih.gov/25807226/
5. De Berge M, Yeap XY, Dehn S. MerTK cleavage on resident cardiac macrophages compromises repair after myocardial ischemia reperfusion injury. Circulation Research [Internet]. 2017;121(8):930-40. Disponible en: https:// doi.org/10.1161/ CIRCRESAHA.117.311327
6. Bajpai G, Bredemeyer A, Li W, Zaitsev K, Koening AL, Lokshina I, et al. Tissue resident CCR2− and CCR2+ cardiac macrophages differentially orchestrate monocyte recruitment and fate specification following myocardial injury. Circulation Research [Internet]. 2019;124(2):263-78. Disponible en: https://doi. org/10.1161/CIRCRESAHA.118.314028
7. Ruparelia N, Chai JT, Fisher EA, Choudhury RP. Inflammatory processes in cardiovascular disease: a route to targeted therapies. Nat Rev Cardiol [Internet]. 2017;14:133-44. Disponible en: https://doi.org/10.1038/nrcardio.2016.185
8. Duncan SE, Gao S, Sarhene M, Coffie JW, Linhua D, Bao X, et al. Macrophage Activities in Myocardial Infarction and Heart Failure. Cardiology Research and Practice [Internet]. 2020;2020:[Aprox. 16 p.] Disponible en: https://doi. org/10.1155/2020/4375127.
9. Mi Sh, Su G, Yang H, Zhou Y, Tian L, Zhang T, et al. Comparison of in-hospital glycemic variability and admission blood glucose in predicting short-term outcomes in non-diabetes patients with ST elevation myocardial infarction underwent percutaneous coronary intervention. Diabetol Metab Syndr [Internet]. 2017;9:[Aprox. 8 p.]. Disponible en: https://doi. org/10.1186/ s13098-017-0217-1
10. Pesaro AEP, Nicolau JC, Serrano CV, Truffa R, Gaz MVB, Karbstein R, et al. Influencia de Leucocitos y Glucemia en el Pronóstico de Pacientes con Infarto Agudo de Miocardio. Arq Bras Cardiol [Internet]. 2009 [Citado 09/07/2021];92(2):84- 9. Disponible en: https://www.scielo.br/j/abc/a/QHcPzmWnNb5vqTLHvY5TzpQ/ abstract/?lang=es
11. ChacónDíaz M, Vega A, Araoz O, Ríos P, Baltodano R, Villanueva F, et al. Características epidemiológicas del infarto de miocardio con elevación del segmento ST en Perú: resultados del P Eruvian Registry of ST-segment Elevation Myocardial Infarction (PERSTEMI). Arch Cardiol Mex [Internet]. 2018 [Citado 23/08/2021];88(5):403-12. Disponible en: http://www.scielo.org. mx/pdf/acm/v88n5/1665-1731-acm-88-05-403.pdf
12. García Aurelio MJ, Cohen Arazi H, Higa C, Gómez HR, Mauro V, Fernández H, et al. Infarto agudo de miocardio con supradesnivel persistente del segmento ST. Registro multicéntrico SCAR
50 Revista Bioreview®
(Síndromes Coronarios Agudos en Argentina) de la Sociedad Argentina de Cardiología. Rev Argent Cardiol [Internet]. 2014 [Citado 14/07/2021];82:275- 84. Disponible:http://www.old2. sac.org.ar/wp-content/uploads/2014/08/v82n4a04-es.pdf
13. Gagliardi JA, Charask A, Perna E, D´Imperio H, Bono H, Castillo Y, et al. Encuesta nacional de infarto agudo de miocardio con elevación del ST en la República Argentina (ARGEN-IAM-ST). Rev Argent Cardiol [Internet]. 2016 [Citado 12/07/2021];84:548-57. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_ arttext&pid=S1850-37482016000600006
14. Lee KH, Jeong MH, Ahn Y, Cho MC, Kim CJ, Kim YJ. New Horizons of Acute Myocardial Infarction: From the Korea Acute Myocardial Infarction Registry (KAMIR). J Korean Med Sci [Internet]. 2013;28:173-80. Disponible en: http:// dx.doi. org/10.3346/jkms.2013.28.2.173
15. Hoedemaker NPG, ten Haaf ME, Maas JC, Damman P, Appelman Y, Tijssen JGP, et al. Practice of ST-segment elevation myocardial infarction care in the Netherlands during four snapshot weeks with the National Cardiovascular Database Registry for Acute Coronary Syndrome. Neth Heart J [Internet]. 2017;25:264-70. Disponible en: http://doi. org/10.1007/s12471-017-0947-6
16. Melo de Barros PGS, Berwanger O, Silva ES, Sobral ACS, Assad MC, Beraldo PA, et al. Avaliação do Seguimento de um Ano dos Pacientes Incluídos no Registro Brasileiro de Síndromes Coronárias Agudas (ACCEPT). Arq Bras Cardiol [Internet]. 2020;114(6):995-1003. Disponible en: https://doi.org/10.36660/ abc.20190879
17. García García C, Oliveras T, Serra J, Vila J, Rueda F, Cediel G, et al. Trends in Short- and Long-Term ST-Segment– Elevation Myocardial Infarction Prognosis Over 3 Decades: A Mediterranean Population-Based ST-Segment–Elevation Myocardial Infarction Registry. J Am Heart Assoc [Internet]. 2020;9:e017159. Disponible en: http://doi.org/10.1161/ JAHA.120.017159
18. Alhabib KF, Kinsara AJ, Alghamdi S, Al Murayeh M, Hussein GA, Al Saif S, et al. The first survey of the Saudi Acute Myocardial Infarction Registry Program: Main results and long-term outcomes (STARS-1 Program). PLoS ONE [Internet]. 2019;14(5):e0216551. Disponible en: https://doi.org/10.1371/journal.pone.0216551
19. Santos MM, Rodríguez MR, Prohias JM, Mata LAC, Martínez GG, Sellen ES, et al. Registro Cubano de Infarto de Miocardio Agudo (RECUIMA), los primeros 1000 casos. Rev Cub Cardiol Cir Cardiovasc [Internet]. 2019 [Citado 21/08/2021];25(3 Suppl 1):419-35. Disponible en: http://www.revcardiologia.sld.cu/ index.php/revcardiologia/article/view/895
20. Chen C, Cong BL, Wang M, Abdullah M, Long XW, Hua YZ, et al. Neutrophil to lymphocyte ratio as a predictor of myocardial damage and cardiac dysfunction in acute coronary syndrome patients. IntegrMed Res [Internet]. 2018:7(2):192-9. Disponible en: https://doi.org/10.1016/j.imr.2018.02.006
21. Hong D, Hong KC, Bin YS, Myung JL, Kyu TP, Hoon JY, et al. Prognostic implications of post-percutaneous coronary intervention neutrophil-to-lymphocyte ratio on infarct size and clinical outcomes in patients with acute myocardial infarction. Scien Rep [Internet]. 2019;9(1):9646 [Aprox. 9 p.]. Disponible en: https://doi.org/10.1038/s41598-019-46117-8
22. Akhtar N, Adil MM, Ahmed W, Habib-ur-Rehman, Shahs MA. The role of leukocyte counts in patients with unstable angina pectoris or myocardial infarction: prognostic significance and correlation with plasma brain natriuretic peptide (BNP) levels. J Pak Med Assoc [Internet]. 2011 Jan [Citado 14/05/2021];61(1):51-
4. Disponible en:https://pubmed. ncbi.nlm.nih.gov/22368903/
23. Gomez Arbelaez D, Sánchez Vallejo G, Perez M, Garcia RG, Freddy JA, Peñaherrera E, et al. Hiperglucemia se asocia a mayor número de desenlaces adversos en individuos latinoamericanos con infarto agudo de miocardio. Clin Investig Arterioscl [Internet]. 2016;28(1):9-18. Disponible en: http://dx.doi. org/10.1016/j.arteri.2015.09.003
24. Issa M, Alqahtani F, Berzingi C, AlHajji M, Busu T, Alkhouli M. Impact of acute diabetes decompensation on outcomes of diabetic patients admitted with ST-elevation myocardial infarction. Diabetol Metab Syndr [Internet]. 2018 [Citado 17/06/2021];10:[Aprox. 8p.]. Disponible en: https://doi. org/10.1186/s13098-018-0357-y
25. Kalińczuk Ł, Zieliński K, Pręgowski J, Przyłuski J, Karcz M, Bekta P, et al. Higher admission glycaemia independently of diagnosed or unrecognized diabetes mellitus is a risk factor for failed myocardial tissue reperfusion and higher mortality after primary angioplasty. Kardiologia Polska [Internet]. 2018 [Citado21/07/2021];76(3):594-601. Disponible en: www. kardiologiapolska.pl
26. Karetnikova V, Gruzdeva O, Uchasova E, Osokina A, Barbarash O. Glucose levels as a prognostic marker in patients with ST-segment elevation myocardial infarction: a case–control study. BMC Endocrine Disorders [Internet]. 2016 [Citado 21/07/2021];16(1):31. Disponible en: https://doi.org/10.1186/ s12902-016-0108-8
Conflictos de intereses. El autor declara no tener ningún conflicto de intereses.
51 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
Estandarización y control de calidad en centrífugas del área de Uroanálisis
Norma Susana Chávez Villagómez 1*
Alberto Darío Díaz Parra 2
Vilma Karina Moyano Arias 3
Yoiler Batista Garcet 4
1 Técnico Docente Universidad Nacional de Chimborazo. Licenciada en Laboratorio Clínico. Tecnóloga Médica. Institución de procedencia. Universidad Estatal del Sur de Manabí, Jipijapa, Manabí, Ecuador. ORCID: https://orcid.org/0000-0002-6538-7491. Correo: normachavezvillagomez@gmail.com
2 Docente Universidad Nacional de Chimborazo. Magister en Ciencias de la Educación Mención Biología. Licenciado en Laboratorio Clínico. Tecnólogo Médico. Universidad Estatal del Sur de Manabí, Jipijapa, Manabí, Ecuador. ORCID: https://orcid.org/0000-0001-8327-6018. Correo: adiaz@unach.edu.ec
3 Licenciada en laboratorio Clínico. Institución de procedencia. Universidad Estatal del Sur de Manabí, Jipijapa, Manabí, Ecuador. ORCID: https://orcid. org/0000-0002-2708-6495. Correo: vilmamoyano@hotmail.com
4 Licenciado en Química, Máster en Ciencias, Profesor Titular Bioquímica Médica. Carrera de Medicina Universidad San Gregorio de Portoviejo, Manabí, Ecuador. Doctorando en Ciencias de la Salud Universidad Nacional de Tumbes, Perú. ORCID: https://orcid.org/0000-0002-7851-5763.
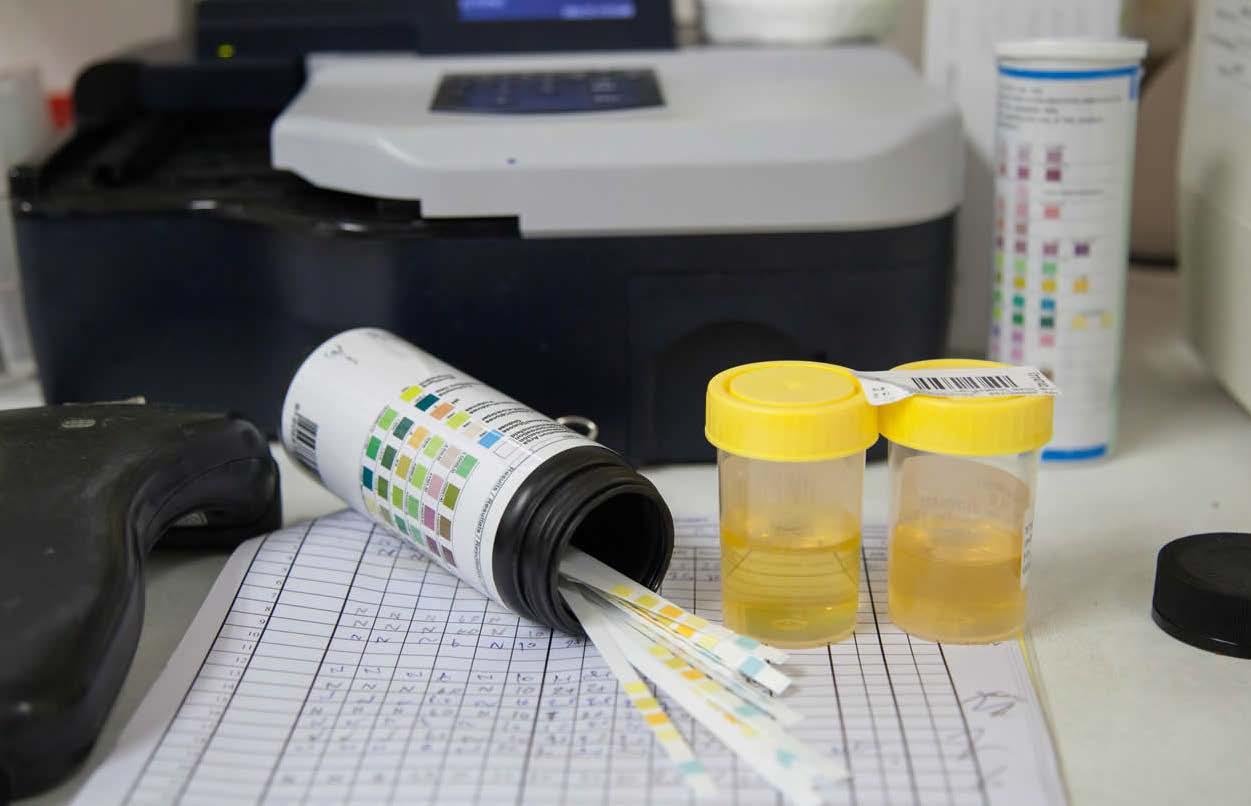
* Autor para correspondencia: normachavezvillagomez@gmail.com
Revista Científica Arbitrada Multidisciplinaria PENTACIENCIAS. Vol. 4, Núm. 5. (Edición Especial 2022.) Pág 389-407. ISSN:2806-5794
Esta obra está bajo una licencia Creative Commons de tipo (CC-BY-NC-SA). Grupo Editorial “ALEMA-Pentaciencias” E-mail: alema.pentaciencias@gmail.com
52 Revista Bioreview®
Resumen
Los exámenes urológicos, datan su aplicación desde el tiempo del imperio de Egipto, donde se usaba la orina para identificar enfermedades en los cuerpos, con el paso del tiempo y de la mano de la tecnología, el análisis de orina sigue siendo importante en la detección de patologías, con cambios en su metodología de análisis. Donde se usan equipos biomédicos, como la centrífuga, que usa un motor para someter a las muestras a grandes velocidades, y lograr separar sus componentes. El presente trabajo recopila las instrucciones y recomendaciones para el uso, mantenimiento y control del equipo de centrifugación, con el fin de prevenir desgaste, accidentes o daño total del equipo, estos lineamientos evitarán incurrir en gastos innecesario para el laboratorio y disminuir al mínimo los errores en el tratamiento de la muestra previo su análisis. Al tener en cuenta y respetar los estándares de calidad, se aumenta la eficiencia y fiabilidad de los procesos al usar máquinas centrífugas, mejorando la identificación de problemas en la salud, para la prevención y tratamiento de enfermedades.
Abstract: Standardization and quality control in centrifuges in the Urinalysis area
Urological examinations date their application from the time of the Egyptian empire, where urine was used to identify diseases in the bodies, with the passage of time and hand in hand with technology, urinalysis continues to be important in the detection of pathologies, with changes in its analysis methodology. Where biomedical equipment is used, such as the centrifuge, which uses a motor to subject the samples to high speeds, and manage to separate their components. The present work compiles the instructions and recommendations for the use, maintenance and control of the centrifuge equipment, in order to prevent wear, accidents or total damage to the equipment, these guidelines will avoid incurring unnecessary expenses for the laboratory and minimize errors. In the treatment of the sample prior to its analysis. By taking into account and respecting quality standards, the efficiency and reliability of the processes are increased, improving the identification of health problems, for the prevention and treatment of diseases.)
Key words: Control; quality; urinalysis; centrifuge; laboratory.
Introducción
El avance de la tecnología y el desarrollo de los equipos médicos, ha permitido que el diagnóstico de los pacientes sea más acertado y confiable, sin embargo, aún hay falencias en el sistema, que requieren ser atendidas (Galindo
& Pérez, 2019). Existen diferentes formas de identificar el estado de salud de una persona, el examen de orina es uno de ellas, forma parte de un conjunto de exámenes rutinarios encargados por los doctores para chequear si hay infecciones en las vías urinarias, diabetes o problemas renales. Para llegar analizar la muestra biológica de orina, se requiere que su recolección y tratamiento sea óptimo, asegurando que el análisis sea lo más preciso posible (Flores y otros, 2022).
Diagnosticar problemas de salud, analizando la orina, es una práctica antigua del pueblo egipcio. El proceso de uroanálisis, es de los más antiguos exámenes de laboratorio ejecutados desde el pasado hasta la actualidad.
El análisis consiste en una serie de pruebas físico-químicas, realizadas a la muestra de orina del paciente, siguiendo los lineamientos del Comité Nacional de Normas de Laboratorio Clínico, que son recomendaciones útiles para mejorar el proceso y aumentar la confiabilidad de los procesos analíticos (Huamanyauri & Ramos, 2022). La importancia de la ejecución correcta de los procedimientos, por medio de tiras reactivas y su observación en microscopio, reside en su importancia diagnóstica de varias patologías asociadas a los riñones, el análisis se dirige para la prevención o el tratamiento (Nicolás, 2022). El centrifugado es el tratado físico que recibe la muestra, para su análisis en el microscopio, este proceso se hace en una centrífuga, que suple el proceso ejecutado por la gravedad, al hacer decantar el sólido o la parte más densa de un sólido, de su disolvente (Muñoz, 2018). La centrífuga consiste en un motor que gira a gran velocidad, y al ser un equipo eléctrico, requiere seguimiento, control y mantenimiento, para mantener en óptimas condiciones su funcionamiento.
Al ejecutar un buen examen, se dejan al descubierto afecciones del tracto urinario, de los riñones, además de trastornos del metabolismo (Meza & Pineda, 2022). Aunque la utilidad de los análisis de orina es demostrada, es una herramienta con poco prestigio y rezagada, que no posee una metodología propia de control de calidad, cuya estandarización es un problema sin corregir a nivel nacional (Sacaca, 2021). Aunque existen criterios internacionales, estos no están bien establecidos, con la realización adecuada del uroanálisis, puede ser el más valioso examen en la prevención y tratamiento del paciente. La estandarización y control, debe aplicarse a cada proceso del análisis, incluido el tratado de los equipos, como la centrífuga, que está inmerso en el proceso, y del cual depende la exactitud y precisión de los resultados.
53 Gestión de la Calidad Año XII · Número 138 · Febrero 2023
Palabras clave: Control; calidad; uroanálisis; centrífuga; laboratorio.
Materiales y métodos
El presente trabajo escrito es una investigación de nivel exploratorio, con diseño no experimental, de corte longitudinal, analizando los eventos e información relevante en un lapso de tiempo no menor al 2018, cuyo alcance es descriptivo de los comportamientos observados en retrospectiva del conocimiento técnico y demás experiencias de otros profesionales, que consentirá realizar una construcción de conocimientos, con el apoyo teórico, por medio de la revisión de información académica, encontrada en la base de datos de plataformas científicas. La investigación forjó los conocimientos de resultado de las experiencias, con el apoyo teórico de los autores consultados.
Resultados y discusión
Para el control de calidad del uso de las centrífugas en exámenes de uroanálisis, se debe tener en cuenta los demás factores que intervienen en la calidad de la muestra a ser centrifugada. Es por eso que haremos un recorrido por el contenido, que consideramos necesario explorar.
Control de calidad en laboratorios
Iniciaremos hablando del control de calidad del laboratorio clínico, que es el espacio físico donde analizan las muestras. De forma general se entiende que los laboratorios clínicos ayudan en el diagnóstico, pronóstico y tratamiento de una patología, para este proceso se requiere la intervención de personal de diferentes áreas de los centros clínicos, como personal de los centros de apoyo, enfermeras, técnicos y doctores especialistas de las áreas (Saldaña, 2021). Establecer los lineamientos de calidad en los laboratorios clínicos tiene el objeto de reducir al máximo los riesgos de cometer errores mejorando la calidad de las muestras, además de reducir los riesgos laborales inmersos (Yapur, 2018). Este control busca optimizar los procesos, recursos, prácticas, etc. de forma eficiente e inteligente, aplicada a cada una de las fases de análisis de muestras.
Control en uroanálisis
El área de uroanálisis, no está librada de necesitar protocolos de control de calidad, los exámenes de laboratorio, incluidos los de esta área, son importantes y necesitan ser precisos, por lo que el personal debe tener el conocimiento requerido y estar capacitado para el manejo, control y análisis de las muestras, el equipo y los materiales (Universidad Continental, 2022). A continuación, describi-
remos las fases que intervienen en el proceso de calidad del laboratorio de uroanálisis.
La primera fase es de importancia para asegurar que las muestras que lleguen a la fase de análisis, sean útiles y cumplan los estándares de calidad (Montalvo y otros, 2019). A continuación, se muestra de forma breve el esquema del proceso a seguir.
En la fase pre-analítica, se dan factores que influyen en la calidad del resultado, a continuación, se describen los más comunes a tener en cuenta:
• Recolectar la muestra, siguiendo las instrucciones escritas del profesional.
• Los recipientes de toma de muestra deben ser de plástico, transparente con sellado hermético para evitar el riego del material biológico.
• La etiqueta debe estar llena correctamente, con el nombre completo del paciente, fecha de la recolección de la muestra.
• La solicitud de análisis debe ser clara y precisa, debe incluir los nombres completos del paciente, número de identidad y nombre del médico que realiza la petición.
• Contar con la cantidad suficiente de muestra biológica para el análisis.
• Registro de la muestra que cumple los requisitos en la hoja de ingreso diario (Sanz y otros, 2019).
El control de calidad de la fase analítica igual tiene su proceso técnico para la cuantificación biológica de las muestras, donde es necesario el control de los elementos necesarios para llevar a cabo la acción, tales como reactivos, equipo, instrumentos, agua, etc. (Montalvo y otros, 2019). Para centrarnos en el control de calidad de los equipos, trataremos algunos aspectos importantes de esta fase para conseguir resultados fiables. A continuación, el esquema del proceso a seguir en esta fase.
Fase analítica
En el laboratorio se ejecutan análisis de orina de rutina, que examinan características físicas de color, densidad, turbidez, además de químicas como el pH, glucosa, presencia de sangre, leucitas, proteínas, cetonas, etc. Incluyendo la identificación de estructuras microscópicas,
54 Revista Bioreview®
ANÁLISIS DE MUESTRAS CLÍNICAS
DESCRIPCIÓN FASE
PRE-ANALÍTICA
Esta fase es el tiempo de ejecución previo al análisis, que ocurre entre este proceso y la solicitud del análisis. Los análisis tienen el fin de proporcionar información fiable con la más alta exactitud posible, y para esto es necesaria la preparación del paciente, la recolección de la muestra y el tratado adecuado de ella son los pasos iniciales para garantizar resultados fiables, que permitan sacar conclusiones y tomar decisiones en base a ellos.
Es usual que se descuide esta fase, y existan errores, no solo en la toma de muestra, si no en la preparación del paciente, quien debe cumplir las indicaciones para asegurar cumplir con las condiciones de muestreo.
ANALÍTICA
Es la fase de análisis, conformada por procesos y actividades secuenciales que cuantifican parámetros biológicos de las muestras. Los pasos ordenados ayudan a reducir los errores al mantener un control de las actividades según se realicen, además estos procesos son aplicables a cualquier área que cubra el laboratorio.
Cada proceso de análisis describe las mediciones y observaciones aplicadas en el laboratorio, además de verificar los estándares, características y protocolos de los procedimientos, técnicas e instrumentos aplicados. La verificación es punto de partida para esta investigación, donde desarrollaremos el control de calidad del equipo de centrifugas.
POST-ANALÍTICA
Consiste en las actividades conjuntas, desde la cuantificación de la muestra, procesamiento de resultados y entrega al usuario. Los pasos desarrollados en esta fase, son independientes del cuidado o atención que se tuviera en las otras fases. Para verificar la utilidad y calidad de los resultados obtenidos, se debe considerar.
• Intervalos de variabilidad biológica que sirvan de referencia
• Puntualidad
• Reporte de resultados
• Confidencialidad
Nota: Adaptado de (Aduviri, 2022).
55 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
Tabla 1. Fases del análisis de las muestras clínicas.
EFEMÉRIDES FEBRERO
04 | Día Mundial contra el Cáncer 08 | Día Argentino del Genetista 11 | Día Internacional de la mujer y la niña en la Ciencia 15 | Día Mundial de la lucha contra el Cáncer Infantil 21 | Día Mundial de la Lengua Materna
| Día Internacional de las Enfermedades Raras
28
• Verificación de datos del paciente
• Control de las condiciones
CONTROL DE CALIDAD FASE PRE-ANÁLISIS
Ingreso del paciente al registro
Medidas de reducción de las variaciones del preanálisis
Obtención, manipulación, transporte, conservación de la muestra
Variaciones intrínsecas y extrínsecas Toma de muestra.
Procedimientos de recolección, etiquetado correcto.
Manejo de la muestra.
Control.
CONTROL DE CALIDAD FASE DE ANÁLISIS
Control de elementos Chequeo de equipos Control interno Evaluación externa indirecta del desempeño
Control de agua y reactivos
Elementos del gráfico de Levey-Jennings
Errores analíticos:
* Sistemáticos
* Aleatorios
Reglas de Westgard
Control de calidad de:
* Hematología
* Inmunología
* Uro-análisis
* Microbiología
* Equipos biomédicos
*Calidad de lavado
57 Diagnóstico Clínico Aplicado Año XII · Número 138 · Febrero 2023
Figura 2. Procedimiento de control de calidad de la fase de análisis. Fuente: Adaptado de (Bermeo & Gallego, 2022).
Figura 1. Procedimiento de control de calidad de la fase pre-análisis. Fuente: Adaptado de (Saldaña, 2021).
Tabla 2.Reglas de Westgard.
REGLA
1-2S
Un resultado control fuera de dos desviaciones estándar.
1-3S
Un resultado control fuera de tres desviaciones estándar.
R-4S
Desviación estándar de cuatro, entre un control y otro del mismo nivel o entre niveles.
2-2S
Dos resultados controles (del mismo o diferente nivel) fuera de dos desviaciones estándar del mismo lado de la media.
4-1S
Cuatro resultado control (del mismo o diferente nivel) por fuera de una desviación estándar del mismo lado de la media.
10X
Diez resultados controles (del mismo o diferente nivel) del mismo lado de la media.
2 de 3-2S
Dos resultados de tres niveles de control por fuera de dos desviaciones estándar del mismo lado de la media.
Fuente:Adaptado de (Díaz y otros, 2018).
observables en el sedimento de la orina, este último requiere de un examen más detallado (Litardo, 2020).
Teniendo en cuenta el proceso que conlleva la fase pre-análisis de la muestra, tendremos en cuenta los parámetros de control que son necesarios para emplear los protocolos o procedimientos de muestreo para cualquier área del laboratorio (Huamanyauri & Ramos, 2022).
Aspectos a tener en cuenta en el control de calidad
Para el control de la calidad interna del procesamiento de la muestra, se debe tener en cuenta el control de sustan-
SENSIBILIDAD DE ERROR ACCIÓN A EJECUTAR
Alarma Aleatorio Aleatorio Sistemático Sistemático Sistemático Sistemático
Seguimiento por siete días.
Impugne, vuelva a procesar el control, evalúe minuciosamente las causas posibles.
Impugne, vuelva a procesar el control, evalúe minuciosamente las causas posibles.
Impugne la muestra y proceda con la verificación de calibración.
Impugne la muestra y proceda con la verificación de calibración.
Impugne la muestra y proceda con la verificación de calibración.
Impugne la muestra y proceda con la verificación de calibración.
cias, control interno de errores, revisión de la calidad de equipos biomédicos y el proceso de análisis.
El control sustancias: Agua
• Es la sustancia de reacción más importante y de mayor empleo en los procedimientos del laboratorio.
• La verificación de su calidad debe ser tan estricta como la de otros reactivos, debido a su uso en diferentes presentaciones, como la ionizada para la limpieza interna
58 Revista Bioreview®
de equipos y materiales; y el análisis de analitos químicos.
• Se debe considerar las características del agua para cada proceso, a fin de mantener los estándares de calidad. El control de calidad del agua ionizada debe ejecutarse por el proveedor de la sustancia y el equipo de laboratorio debe verificar las características físico químicas antes del proceso de mantenimiento de los equipos con el agua (Huamani, 2019).
Reactivos
• Verificar fechas de caducidad y paquete de origen, antes de usar en el proceso.
• En caso de usar reactivos de diferente paquete o lote, es necesario calibrar los controles y blancos para el análisis.
• Tener en cuenta aspectos de dilución, como la linealidad y el diluyente para el reactivo, para preparar las diluciones.
• Verificar que la temperatura de conservación se mantenga en las recomendaciones del proveedor o dentro de
los 2 a 8 grados Celsius, para garantizar la calidad de los reactivos (Giron, 2019).
Control interno de errores
La sumatoria de los errores que ocurren en el procesamiento de las muestras, se conoce como la desviación estándar. Para su valoración se usa un control interno de errores, o de calidad, donde se intercambian alícuotas de plasma (con características similares a la muestra de paciente, que poseen estabilidad y repetitividad), entre las muestras de los pacientes para evaluar la desviación de los resultados que se obtienen (Galindo & Pérez, 2019).
La evaluación se hace por diferentes métodos, siendo el más común el método de Levey Jennings, que consiste en anotar el índice de desviación estándar de las ordenadas, donde el límite es de más menos 2. Para proceder con el método, se debe analizar mínimo 20 alícuotas controles en cada nivel, estableciendo la media y la desviación estándar (Flores y otros, 2022).
Los errores se clasifican en analíticos, sistemáticos y aleatorios:
Marcadores Cardíacos
IF 1001-Troponina Cardiaca I (cTnI)

IF 1002 CK-MB
IF 1003 CK-MB/cTnI/Mioglobina
IF 1004-CK-MB/cTnI/H-FABP
IF 1005-CK-MB/cTnI
IF 1006-hs-cTnI-Alta sensibilidad

IF 1007-NT-proBNP (péptido natriurético B)
IF 1008-H-FABP
IF 1009-TnT
Analizador Point of Care Resultados cuantitativos en minutos MARCADORES CARDÍACOS-HEMATOLÓGICOS E INFLAMATORIOS
Inmunocromatografía lateral fluorescente
IF 1101-IL-6 Fast
IF 1102-PCT/CRP
IF 1103-hs-CRP+CRP
IF 1104-PCT
Marcadores Inflamación Hemostasia
IF 1201-D-Dimer
Función renal
IF1301-CysC
59 Gestión de la Calidad Año XII · Número 138 · Febrero 2023
(0223) 4783900 • +54 9 22 3540 4766 • ventas@iacinternacional.com.ar • iacinternacional.com.ar
Tabla 3. Fórmulas
Ac: Aceleración centrípeta
V: Velocidad tangencial
R: Radio de giro
V: Velocidad tangencial
w: Velocidad angular (radianes/segundo)
R: Radio
Fcf: Fuerza centrífuga (Newton)
m: movimiento
w: Velocidad angular
R: Radio
Errores sistemáticos: Son el cambio en la media de los valores de control y se divide en desplazamiento y tendencia. Donde el desplazamiento son cambios bruscos del medio de control, que pueden ser positivos o negativos, significando fallas de luz, cambio del paquete de reactivo, de la fórmula del reactivo, de temperatura, necesidad de mantenimiento del equipo, calibración, fallas de sistema, etc. Por otra parte, la tendencia son los cambios paulatinos en la fiabilidad del sistema de análisis y se deben al desgaste de la fuente de luz del instrumento, acopio paulatino de desechos en superficies del electrodo o de la tubería de la muestra o reactivo, vejez de los reactivos, avería paulatina de los materiales de control, la temperatura d la cámara de incubación, o la integridad del filtro de luz (Díaz & Santoyo, 2019).
Errores aleatorios: Causan desviación considerable, aceptable o no aceptable.
Para evaluar la calidad de las secuencias analíticas, se puede usar de forma grupal o individual las reglas de Westgard, que consiste en seis reglas.
Teniendo en cuenta de forma general los aspectos, continuamos con el control de calidad, donde nos centraremos en el control de equipos biomédicos.
Control de equipos biomédicos
Para cumplir con esta función es necesario que el laboratorio y las áreas cuenten con un plan preventivo para el mantenimiento de los equipos, manteniendo los estándares de calidad, la exactitud, durabilidad y fiabili-
dad (Chinga y otros, 2020). En el plan se deben incluir un cronograma para la revisión periódica para minimizar el riesgo de deterioro del equipo. De igual forma se debe tener en cuenta la calibración de los equipos, asegurando la alineación de los estándares de exactitud necesarios. La calibración debe llevarse de igual forma en un cronograma o informe donde se incluya la frecuencia, fechas y observaciones (Camarillo & Camarillo, 2018).
Para el control interno de los equipos, se tiene en cuenta el plan preventivo de mantenimiento y la calibración que se debe ejecutar en todos los equipos de cada área.
Centrífugas
Son equipos médicos, utilizados frecuentemente en los laboratorios clínicos y centro de atención médica como clínicas, hospitales y centros de investigación (Bárcenas & Fagundo, 2020). Estos equipos se usan para separar
componentes dentro de una solución, por lo que se usa para separar de componentes de fluidos como la orina y sangre.
Aplicaciones
• Una aplicación característica reside en acelerar el proceso de sedimentación, deshaciendo la unión entre el plasma sanguíneo y el suero sanguíneo, durante el proceso de análisis de sangre. Además, es usado en los laboratorios para el análisis de muestras de orina, de pacientes femeninos o masculinos, donde se centrifuga la muestra por 10 minutos, previo al análisis con el microscopio.
60 Revista Bioreview®
V
Ac = V2 /R
= w*R Fcf = mw2*R
• Igualmente es usada para determinar el hematocrito a través de una muestra capilar. Para estos casos se usa una micro-centrifugadora.
• De igual forma es bastante usada en laboratorios de control de calidad para fábricas de elaboración de alimentos y bebidas de zumo de frutas cítricas, donde se controla la cantidad de los componentes de zumo, como si fuera una solución, controlando el nivel de pulpa en la separación del zumo del agua. Esto aplica para otras industrias como la del aceite de oliva, donde el proceso de decantación natural es muy tardado, aquí la centrifugadora se usa para separar el extracto de la pulpa y posteriormente el aceite de ella.
• Por otra parte, son usados en el campo de la investigación química, al participar en la separación de uranio 235 del uranio 238 (Aduviri, 2022).
Funcionamiento
Para separar componentes de una solución de forma natural, se toma mucho tiempo, el principio del funcionamiento de la centrifugadora es una sedimentación acelerada, al sustituir la aceleración de la gravedad por la fuerza centrífuga, que se somete durante los giros a gran velocidad de un objeto (Amar, 2018). Para calcular la aceleración en el giro, es necesario conocer la masa exacta de la muestra y el radio del círculo que compone la cabina de la centrífuga.
Como resultado, la velocidad de la centrífuga puede alcanzar niveles elevados de revoluciones por minuto, llegando a alcanzar una fuerza superior que la producida por la gravedad (Sanz y otros, 2019)
El fenómeno de la centrifugación, es explicado por la ley de Stokes, de igual forma que el fenómeno de la sedimentación. La ley nos explica que las partículas presentes en un medio físico, se sedimentan más rápido y fácil, cuando la viscosidad del medio es menor, y si las partículas tienen mayor peso y volumen en comparación al fluido (Montalvo y otros, 2019). Las características del fluido son importantes de considerar, con niveles bajos de viscosidad las partículas presentes en el fluido decantan a mayor velocidad. Durante la centrifugación la fuerza centrífuga acelera el proceso de decantación por gravedad, donde se reconocen dos tipos de movimiento:
1. Los sólidos de mayor peso atraviesan el líquido y se acumulan en la pared del charol-bol.
2. En líquidos inmiscibles, el líquido de menor densidad, se mueve al eje de rotación del charol-bol.
Partes de la centrífuga
Las partes y el diseño de la centrífuga, depende del fabricante y el modelo, en los laboratorios se encuentran de diferentes características, según su necesidad,

61 Gestión de la Calidad Año XII · Número 138 · Febrero 2023
Figura 3.Movimiento centrífugo.
Figura 4.Partes de la centrífuga.
Fuente: Tomado de (Amar, 2018).
1. Tapa
2. Gabinete
3. Rotor
4. Plataforma
5. Botón de encendido
6. Temporizador
7. Tacómetro
8. Frenado
9. Control de velocidad
10. Tubo portador de muestra
TIPO DESCRIPCIÓN
Centrífugas clínicas
Son conocidas como centrífugas médicas, de baja velocidad o de sobremesa, su tamaño es compacto pues fueron diseñadas inicialmente para laboratorios con el espacio reducido. Por su diseño pequeño, no cuentan con sistema de refrigeración. Es usada para decantar o separar partículas de gran tamaño.
• Velocidad 4000-5000 revoluciones por minuto
• Tubo de centrífuga de 16 mx 100 mm-15 mililitros de capacidad
Mini-centrífuga
Proceden del modelo anterior de las centrífugas de baja velocidad, son usadas en el campo de la biología molecular
• Velocidad de mayor o igual a 10000 revoluciones por minuto
Centrífugas de alta velocidad
• Usa microtubos de 1,5 milímetros, 0,5 mL, 0,2 mL Cuentan con sistema de vacío, que permite evitar calentamiento del rotor por fricción de la cavidad con el aire. Su sistema brinda control exacto de la temperatura a diferencia de otras si el sistema de vacío. Son usadas en la microbiología para separación de macromoléculas, para separación de fracciones de células, división de ribosomas, virus, etc.
• Velocidad de 18000 y 25000 revoluciones por minuto
• Sistema de refrigeración en forma de condensadores y compresores




Ultracentrífugas
Cuenta con sistema óptico de visualización de sedimentación en tiempo real, permite recolectar datos precisos sobre las características o propiedades de sedimentación. El diseño del tipo preparativa permite la purificación de las muestras para su uso a futuro, donde aísla las partículas de bajo coeficiente de sedimentación. Se usa para separar proteínas pequeñas, virus y macromoléculas.
• Velocidad de 20000, 50000 0 75000 revoluciones por minuto
• Sistema Auxiliar de refrigeración de rotor y motor
• Niveles de vacío de hasta 600000 G
• Dos tipos de Ultracentrífugas: analíticas y preparativas
62 Revista Bioreview®
Tabla 4. Tipos de centrífuga.
por lo que la siguiente lista puede variar (Amar, 2018).
Tapa: Su función es impedir el acceso a las muestras y la protección mientras se está centrifugando. En muchos de los modelos la tapa es automática, manteniendo cerrado el acceso durante el movimiento.
Gabinete: Es el compartimiento donde se introducen las muestras para el proceso de centrifugación, en su interior se encuentra el rotor y tiene espacios para colocar los tubos.
Rotor: Es la parte donde se colocan los portadores de muestras, por su forma se suele llamar araña, y gira completamente con la fuerza del motor.
Plataforma: Es la base que sirve para fijar el equipo y evitar que se mueva, está fabricada con materiales densos para aportar estabilidad. Usualmente se pueden encontrar los controles eléctricos en esta sección (Amar, 2018).
Botón de encendido: al ser un equipo eléctrico, tiene un interruptor que permite el paso de corriente eléctrica para encenderlo o apagarlo.
Temporizador: Permite controlar el tiempo de centrifugación, además de permitir visualizar el tiempo restante para que termine el proceso.
Tacómetro: cumple la función de mostrar la velocidad de centrifugación, mide el movimiento del rotor en RPM, es decir revoluciones por minuto.
Frenado: cumple la función de un freno, la cual se presenta en algunos modelos, permite tener el control para acabar el proceso y se usa para situaciones de emergencia donde se requiere detener el rotor (Nicolás, 2022).
Tipos de centrifugadoras
Existen diferentes tipos de centrífugas en el mercado, los modelos varían según la necesidad, existiendo equipos de baja velocidad como las de micro-hematocritos y las de gran velocidad, usadas para la separación de proteínas (Saldaña, 2021). Si las clasificamos por su velocidad obtenemos la división de la tabla 4 en la siguiente página.
Su función dependerá del tipo de centrífuga y sus ca-
racterísticas, según su modelo, velocidad, rotor, tubo portador de muestra. Dentro de sus características, se dispone del control eléctrico, que incluye el control de tiempo, temperatura, refrigeración y velocidad de rotación y de más.
Proceso de centrifugado
Es necesario cargar el rotor de una forma adecuada, permitiendo que el giro se dé correctamente y permitiendo el correcto uso. En caso de que se proceda de forma incorrecta, el equipo genera vibraciones durante el proceso, indicando que existen problemas, estas vibraciones pueden ocasionar deterioro y daño irreparable del rotor (Sanz y otros, 2019). A continuación, se describen algunas consideraciones durante el proceso de llenado de la centrífuga:
• Según el bloque de análisis, se debe elegir tubos o recipientes de igual características, peso y material para el ingreso en conjunto en el rotor.
• Antes de ingresar las muestras se debe pesar el material, para colocar muestras de igual peso en el rotor.
• Al colocar las muestras, se debe tener números iguales de tubos, es decir no se debe cargar el rotor con números impares de muestras para evitar desequilibrio en el giro. Las mismas deben estar colocadas en partes iguales a cada lado del rotor.
• Antes de encender el mecanismo, se debe verificar que todas las piezas estén en su lugar y no se debe omitir el uso de una pieza-accesorio de la centrífuga, ya que están incluidas en el diseño con un objetivo.
• Una vez cargada la centrifuga, asegurar que la tapa esté sellada y accione el interruptor de encendido, después de fijar la velocidad y tiempo de centrifugado.
• Estar pendiente del proceso para observar anomalías en el movimiento, si no existen inconvenientes se puede seguir en la labor.
• Es recomendable que para usar la centrífuga, se mantenga las partes y accesorios originales, pues al ser de otra marca generarían desequilibrio y reducción del tiempo de vida y utilidad del equipo.
• A parte de estas indicaciones, se debe seguir el instructivo particular del equipo, que incluye las especi-
63 Gestión de la Calidad Año XII · Número 138 · Febrero 2023
Tabla 5. Tipos de control según la centrífuga. Fuente: Adaptado de (Ticona, 2017).
EQUIPO
Centrífugas
CONTROL DIARIO
• Limpieza externa e interna de tubos- en caso de manchas o riego de las muestras, usar solución de hipoclorito de sodio al 0.5% o glutaraldehído al 2%
• Control de presencia de tapón de tubos metálicos.
Micro-centrífugas
• Limpieza externa e interna con paño de microfibra humedecido con agua y detergente ligero.
• Control de empaquetado-llenar dos capilares con la misma muestra de sangre y centrifugar 3 minutos, leer el resultado de hematocrito, repetir el proceso por un minuto y comparar el resultado con el primero, continuar hasta lograr que los dos últimos resultados sean similares.
CONTROL ANUAL
• Reemplazo de escobillas con desgaste de 75%
• Revisión de balinera del motor
• Revisión de revoluciones del motor con un tacómetro.
• Revisión de la escobilla al sobrepasar los 2300 ciclos, con 8 horas de uso continuo al día por un año.
CONTROL DE CALIDAD FASE POST ANALÍTICA
Validación analítica Validación clínica
ficaciones del fabricante (Ticona, 2017).
Es importante recordar que las centrífugas son equipos técnicos usados en los laboratorios, para el análisis de las muestras biológicas, su uso frecuente requiere atención en su instalación y mantenimiento, acciones
incorrectas o poco precisas en su tratamiento, pueden generar ruptura de tubos y en ocasiones pérdida definitiva de las muestras (Villacrés, 2020). Además, son equipos de precisión, su correcto funcionamiento influye en los resultados que se obtendrán en el uroanálisis. Al ser equipos que funcionan con fuerza
64 Revista Bioreview®
Figura 5. Procedimiento de control de calidad de la fase de post-análisis. Fuente: Adaptado de (Aduviri, 2022).
Validación de resultados Configuración Emisión de resultados
centrífuga, es decir su función es someter a la muestra a giro de gran velocidad para separar los componentes inmersos en ella, la calidad de su giro se centra en dos factores, el motor y la carga (Aduviri, 2022). A mayor carga, menor fuerza de giro, por lo que no debe sobrecargarse la cabina, además se debe tener en cuenta, la continuidad eléctrica y no se debe conectar la centrífuga en la misma línea eléctrica, que otros equipos que usen bastante energía como: estufas, neveras, baños serológicos, a fin de evitar reducción en la potencia (Universidad Continental, 2022).
Adicional a las indicaciones anteriores, se deben tener en cuenta las siguientes pautas.
Precauciones de uso
• Mantener limpio el equipo, la limpieza debe ser diaria incluido los tubos metálicos, esto para evitar acumulación de polvo o residuos. Incluyendo el estado y limpieza adecuado de las escobillas de motor.
• Verificar el ajuste del cabezal.



• Usar envases idénticos, balanceados para obtener
cargas opuestas, con igual centro de gravedad.
• Reemplazar los envases metálicos dañados, con deformaciones para evitar presiones desiguales en el tubo de muestra.


• No usar tubos de muestra que tengan fallas, ralladuras o fisuras. Es necesario desechar el material en mal estado que perjudique la labor del equipo y los profesionales.

• Mantener el equilibrio entre peso de los tubos, asegurando el mismo peso en todos los lados.
• Tapar los tubos durante el centrifugado, para evitar crear el efecto de aerosoles. Los envases metálicos también deben tener tapón.


• Cambiar el material en mal estado, incluido los tapones amortiguadores.
• Cerrar la tapa de la centrífuga cuando se inicie el proceso para mantener la velocidad.
• Abrir la tapa al terminar el proceso, en caso de ruptura
65 Gestión de la Calidad Año XII · Número 138 · Febrero 2023
Conocé
ediciones!
la agenda de cursos 2023 Y revisa nuestras
de los tubos, se debe esperar a que finalice el giro.
• Limpiar bien el interior, a fin de evitar que queden restos de vidrio o material infeccioso (Yapur, 2018).
En caso de tener problemas o limitaciones con las vibraciones o con el adecuado funcionamiento de la centrífuga, se recomienda lo siguiente:
• Revisar que el balance de masa y peso de los tubos sea apropiado.
• Revisar el tamaño de los tubos y que no sean diferentes entre ellos.
• Revisar que la superficie usada para implantar el equipo, sea totalmente plana y esté nivelada.
• De igual forma, si se rompen-fracturan los tubos, se debe verificar su tamaño, balanceo, limpieza a fin de descartar problemas (Amar, 2018).
A parte de la toma de precauciones durante el uso de la centrífuga, se debe tener un mantenimiento preventivo por parte del operador, quien recibió la guía del equipo técnico, en caso de no ser así, este proceso se ejecutará por el técnico, el cual consiste en:
• Después del uso con muestras de orina, se debe limpiar el equipo pues las manchas de orina son corrosivas, se debe limpiar el área con un pañuelo de fibra, humedecido con agua, limpiando el área de la cámara y la superficie de la plataforma para quitar el polvo y manchas, después se debe repasar la zona con un pañuelo seco. En caso de notar que las manchas no salen, se debe reportar para el mantenimiento correctivo (Ticona, 2017).
• Verificar que el mecanismo de cerrado funcione correctamente.
• Verificar el funcionamiento correcto de los controles eléctricos, temporizador, velocímetro, en caso de estar incluidos en el modelo.
• Verificar las condiciones y la respuesta del botón de frenado, en caso de estar incluido en el modelo
• Verificar el estado de los paquetes de caucho, que suele perforarse por el tubo capilar, se debe revisar el estado retirando suavemente, si está en buen estado
se debe volver a colocar con pegamento para el tipo de material. En caso de estar deteriorado se debe cambiar por otra pieza nueva.
• Verificar el estado del sistema eléctrico, incluido el cableado, observando que no existan contactos eléctricos, cortes, quemaduras, desgastes.
• Verificar el estado de los carbones, que son piezas pequeñas, su acceso suele ser sencillo, ubicándose en la parte baja de la base, donde se retira la tapa y se verifica su desgaste, si el tamaño está reducido del 75%, están agrietados, o rotos, se debe cambiar la pieza. Las piezas se deben cambiar todas por igual, pues su desgaste suele ser igual.
• Verificar la nivelación para evitar vibraciones, si estas son recurrentes y no cesan, aún niveladas las cargas y la superficie, es necesario notificar al técnico (Díaz & Santoyo, 2019).
Para obtener resultados óptimos en el funcionamiento y el tiempo de vida útil del equipo, se recomienda hacer mantenimiento preventivo de rutina diario y anual, que permita reducir el deterioro, además identificar daños o fallas que puedan afectar la fiabilidad del proceso.
Fase post-analítica:
La fase forma también parte del proceso de control de calidad del laboratorio de uro-análisis, los resultados plasmados en el informe deben ser revisados por el profesional, para constatar los resultados, datos personales del paciente, firma y sello del área y el profesional a cargo.
Discusiones
Los laboratorios clínicos y su área de urología, se ven expuestos al igual que otras áreas, a cometer errores, en cualquier fase del proceso. Estos errores pueden ser provocados por el técnico o por los equipos, por lo que es necesario que se controlen todos los factores participantes, a fin de reducir al mínimo su incidencia, lo que da paso a los protocolos, procedimientos, recomendaciones de las acciones a implementar, que suelen ser de orden internacional, nacional e interno del centro.
Controlar el cumplimiento de estos protocolos, es obli-
66 Revista Bioreview®
gación de las entidades de salud, sin embargo, esta responsabilidad también recae en los técnicos a cargo del área, ellos deben velar por el cumplimiento de estas recomendaciones, a fin de mantener la calidad de sus análisis y proporcionar resultados con la mayor precisión posible.

Mejorar los procedimientos, los controles de calidad de los equipos, es una parte fundamental para la estandarización de los niveles de calidad, este proceso de mejora va de la mano de la preparación constante del equipo técnico y la comunicación entre las áreas, para fortalecer el sistema desde su ingreso hasta la salida de las muestras en el laboratorio.
Conclusiones
El análisis urológico, es una herramienta útil para los profesionales de salud, que se ha usado desde el pasado, al momento de diagnosticar enfermedades. Aunque no tenga el reconocimiento que merece, el trabajo con calidad, mejora la percepción de la utilidad y aumenta los estándares de calidad implantados para este tipo de análisis.

La centrífuga es una herramienta de utilidad en los la-
boratorios, de igual forma en el uroanálisis, este equipo permite acelerar el proceso de decantación de las partículas de una solución, como la orina, que contiene sólidos en su interior. Si no fuera por la centrífuga, este proceso sería más tardado y poco preciso.
La centrífuga al ser un equipo electrónico, que genera movimientos a gran velocidad, requiere de especial cuidado en su limpieza y mantenimiento preventivo, evitando accidentes y fallas en el proceso. Implementar de forma correcta las indicaciones para el control de la calidad de los equipos, influye en la eficiencia del laboratorio y de las muestras que procesa, donde a mayor precaución, menor los errores.
REFERENCIAS BIBLIOGRÁFICAS


Aduviri, M. (2022). Repositorio Institucional de la UNSA . Obtenido de Trabajo Académico realizado en el laboratorio de análisis clínicos del centro de salud San Francisco - Tacna2017: http://hdl.handle.net/20.500.12773/14194

Amar, P. (01 de julio de 2018). Salud mental. Obtenido de Actualización seguimiento y gestión de resultados de controles: https://cribsaludmental.gov.co/attachments/ category/284/AD-L-M10%20MANUAL%20DE%20CONTROL%20DE%20CALIDAD.pdf

67 Gestión de la Calidad Año XII · Número 138 · Febrero 2023
Bárcenas, P., & Fagundo, S. (2020). Evaluación de una mejora preanalítica en urianálisis. Revista Bioanálisis, 58-64. Obtenido de Evaluación de una mejora preanalítica en urianálisis: http://revistabioanalisis.com/images/flippingbook/Rev%2097n/nota%206.pdf
Bermeo, M., & Gallego, M. (2022). Universidad Central del Ecuador. Obtenido de Plan de Inversión para un Laboratorio Clínico en la Parroquia de Calderón que cumpla la norma ISO 9001: 2015.: http://www.dspace.uce.edu.ec/handle/25000/26856
Camarillo, E., & Camarillo, M. (12 de febrero de 2018). Universidad Autónoma del Estado de México. Obtenido de Guía pedagógica: http://ri.uaemex.mx/bitstream/ handle/20.500.11799/103783/secme-19382_1.pdf?sequence=1
Chinga, J., Vargas, H., & Mendoza, A. (2020). Eficiencia de pruebas de laboratorio en los servicios de emergencia hospitalaria. Dominio de las Ciencias, 6(4), 564-580. doi:https:// dx.doi.org/10.23857/dc.v6i4.1487
Díaz, A., Angulo Yánez, J., & Moncayo Hurtado, J. (2018). Repositorio Digital UNACH. Obtenido de Homologación de resultados del análisis de orina manual y automatizado en el laboratorio clínico del Hospital Provincial General Docente de Riobamba: FUNDACION SANTA FE DE BOGOTA
Díaz, D., & Santoyo, M. (2019). El Laboratorio Clínico en la mejoría continúa de la calidad. Ciencias Médicas, 23(3). Obtenido de http://scielo.sld.cu/scielo.php?pid=S156131942019000300357&script=sci_arttext&tlng=pt
Flores, K., Chancafe, J., & Diaz, H. (2022). Marcadores patológicos en el uroanálisis de pacientes de emergencia de un hospital de Jaén, 2019-2020. Experiencia en Medicina del Hospital Regional Lambayeque , 8(1). doi:https://doi.org/10.37065/rem.v8i1.594
Galindo, L., & Pérez, J. (30 de julio de 2019). FUNDACION SANTA FE DE BOGOTA. Obtenido de Rendimiento del uroanálisis en pacientes con sospecha diagnóstica de cólico renoureteral en el servicio de urgencias: https://repository.urosario.edu.co/handle/10336/20172
Giron, D. (2019). Universidad Técnica de Babahoyo. Obtenido de Desarrollo del proceso de atención de enfermería en paciente pediátrico con diagnóstico de infección de vías urinarias.: http://dspace.utb.edu.ec/handle/49000/5736
Huamani, C. (2019). Repositorio Institucional de la UNSA . Obtenido de rabajo académico realizado en el Laboratorio de Análisis Clínicos y Biológicos del Centro de Salud Acarí, Microred Acarí durante mayo 2015 - mayo 2016.: http://repositorio.unsa.edu.pe/handle/ UNSA/9117
Huamanyauri, G., & Ramos, M. (27 de enero de 2022). Repositorio Institucional - UNID. doi:http://repositorio.unid.edu.pe/handle/unid/193
Litardo, Y. (2020). Universidad Estatal del Sur de Manabí. obtenido de “Lineamientos y estandares de calidad segun Normativas ISO 15189 para la acreditacion de los laboratorios clinicos: una actualizacion: http://repositorio.unesum.edu.ec/bitstream/53000/3154/1/ LITARDO%20MACIAS%20YORDY%20FERNANDO%20LINEAMIENTOS%20Y%20ESTANDARES%20 DE%20CALIDAD%20SEGUN%20NORMATIVAS%20ISO%2015189%20PARA%20LA%20 ACREDITACION%20DE%20LOS%20LABORATORIOS%20CLINICOS%20UNA%20ACTUALIZA
Meza, E., & Pineda, E. (27 de enero de 2022). Repositorio Institucional - UNID . Obtenido de Aplicativos móviles para el diagnóstico y prevención de la ictericia usando uroanálisis con tiras reactivas determinando urobilinógeno en Lima Metropolitana 2021: http:// repositorio.unid.edu.pe/handle/unid/197
Montalvo, M., Peralta, M., Robalino, S., & Ordoñez, M. (2019). Comparación del análisis de orina por el método manual y el automatizado. Ciencia Digital, 3(3.3), 177-186. doi:https:// doi.org/10.33262/cienciadigital.v3i3.3.791
Muñoz, A. (30 de mayo de 2018). UCUNDINAMARCA. Obtenido de Diagnóstico, mantenimiento y repotenciación en equipos biomédicos de centrifugación de laboratorio de la clínica belén de fusagasuga: https://repositorio.ucundinamarca.edu.co/ handle/20.500.12558/1377
Nicolás, R. (2022). Pediatría práctica. Universidad El Bosque. Obtenido de https:// repositorio.unbosque.edu.co/bitstream/handle/20.500.12495/7509/9789587392340. pdf?sequence=1#page=1028
Quinteros, H. (5 de diciembre de 2020). Publicacion de Documentacion Digital - UMSS . Obtenido de Evaluacion del hematocrito y de los niveles de proteina plasmatica en pollos parrillleros de la granja “Condori” departamento de Cochabamba: http://hdl.handle. net/123456789/20757
Sacaca, S. (01 de octubre de 2021). Universidad Autonoma Juan Misael Saracho. Obtenido de Implementacion del control de calidad interno en la fase analitica en el servicio de laboratorio del Hospital Municipal los Andes de enero a junio de la gestion 2018: https:// repo.uajms.edu.bo/index.php/tesisdegrado/article/view/36
Saldaña, I. (2021). Errores preanalíticos en la recolección de orina de 24 horas. Anales de la Facultad de Medicina, 82(3), 199-205. doi:http://dx.doi.org/10.15381/anales.v82i3.19818
Sanz, t., Escuer, M., & LLopis, M. (2019). Recomendaciones para el diseño e implementación de un programa de aseguramiento de la calidad de la fase preanalítica. Revista del Laboratorio Clínico, 12(4), 54-65. doi:https://doi. org/10.1016/j.labcli.2019.01.003
Ticona, E. (2017). Universidad Mayor De San Andres. Obtenido de Mantenimiento de equipos de laboratorio: https://repositorio.umsa.bo/bitstream/ handle/123456789/13426/P-1877-Ticona%20Ordo%c3%b1ez%2c%20Eynar%20 Julio.pdf?sequence=1&isAllowed=y
Universidad Continental. (22 de marzo de 2022). Repositorio Continental . Obtenido de Sílabo de Laboratorio: https://hdl.handle.net/20.500.12394/8665
Villacrés, A. (12 de marzo de 2020). Repositorio Digital UCSG . Obtenido de La calidad del servicio y satisfacción del cliente externo en el laboratorio clínico de la Fundación Santa Isabel Madre del Precursor: http://201.159.223.180/handle/3317/14704
Yapur, M. (19 de diciembre de 2018). DSpace en ESPOL. Obtenido de Instalación y calibración de una unidad de análisis automático de orina: https://www.dspace.espol.edu. ec/bitstream/123456789/45935/1/D-83350.pdf
68 Revista Bioreview®

CALAB: un esfuerzo constante para mejorar la tarea de los laboratorios
las asociaciones gremiales o colegios o en forma particular según la realidad de cada región.
La Cámara Argentina de Laboratorios de Análisis Bioquímicos (CALAB) representa a los laboratorios de análisis clínicos, no importa en qué parte del país se encuentren y tampoco el tamaño de su infraestructura.
Desde CALAB, trabamos de manera constante para que bioquímicos y profesionales de las organizaciones cuenten con la información y el respaldo necesarios para fortalecerlas, y además de consolidar la posición de los laboratorios en el sector salud.
Compartimos con ustedes algunas de las actividades que se realizaron este año:
• Encuentro virtual donde se abordaron los Indicadores Clave (KPI’s) del negocio de los laboratorios de análisis clínicos, que contó con más de 160 inscriptos;
• Reunión con profesionales de Recursos Humanos de distintos laboratorios asociados, para intercambiar los diferentes aspectos legales que regulan el área;
Al igual que en 2021, durante este año la Cámara realizó la Encuesta de Valores de Determinación, una herramienta que refleja la realidad que vive cada socio en cada región del país y que fue de gran utilidad a la hora de negociar acuerdos con los financiadores, sea a través de
CALAB también llevó adelante una tarea incesante durante la pandemia por Covid-19. Se centró en la difusión de información relacionada con los distintos programas de alivio para el sector y las cuestiones técnicas vinculadas a los test de detección de SarsCov-2 que se desarrollaron en ese contexto.
Fue en ese marco que la Cámara puso en marcha la plataforma Testeate.ar que tiene por objetivo orientar a colegas y pacientes a la hora de hacerse un estudio para la detección de Covid, o qué pasos seguir si ya se realizó alguno de los distintos test existentes.
Asimismo, CALAB lleva adelante reuniones con autoridades del área sanitaria y también con otras organizaciones de la salud, con el fin de sortear las dificultades que se interponen en la prestación de los análisis clínicos.
CALAB es un lugar donde se pueden canalizar todas las problemáticas, conflictos o contrariedades que presenta cada laboratorio. Es por ello que instamos a todos a sumarse a la Cámara para así tener mayor legitimidad y sustento a la hora de posicionarse ante los distintos aspectos que afectan a los colegas.
Para quienes estén interesados pueden contactarse con la cámara a través de la Página Web o por correo electrónico a info@calab.org.ar. Sino, a través de las redes sociales Facebook, Twitter o Linkedin.
CALAB realizó 2° Encuentro de Recursos
Humanos
La Cámara Argentina de Laboratorios de Análisis Bioquímicos (CALAB) llevó adelante un nuevo encuentro destinado a gerentes y responsables del área de Recursos Humanos, a través de Meet. Se abordó el Sistema de Crédito Fis-
cal aplicado a planes de capacitación y otras herramientas de desarrollo, presentado por consultora Ges-PRO, donde se brindó información útil para las organizaciones que cuenten con certificado SEPYME.
Además, se presentó “Labor Positiva”, una iniciativa global creada en 2019 por IBM y SAP,. Fundación Huésped
70 Revista Bioreview®
presentó los detalles de este programa que se desarrolla en toda Latinoamérica.
Para quienes no pudieron presenciar el encuentro, compartimos el video, en la página de CALAB, en el espacio exclusivo para socios (CALAB realizó 2° Encuentro de Recursos Humanos – CALAB)legales que regulan el área;
Al igual que en 2021, durante este año la Cámara realizó la Encuesta de Valores de Determinación, una herramienta que refleja la realidad que vive cada socio en cada región del país y que fue de gran utilidad a la hora de negociar acuerdos con los financiadores, sea a través de las asociaciones gremiales o colegios o en forma particular según la realidad de cada región.
CALAB también llevó adelante una tarea incesante durante la pandemia por Covid-19. Se centró en la difusión de información relacionada con los distintos programas de alivio para el sector y las cuestiones técnicas vinculadas a los test de detección de SarsCov-2 que se desarrollaron en ese contexto.
Fue en ese marco que la Cámara puso en marcha la plataforma Testeate.ar que tiene por objetivo orientar a colegas y pacientes a la hora de hacerse un estudio para la detección de Covid, o qué pasos seguir si ya se realizó alguno de los distintos test existentes.
Asimismo, CALAB lleva adelante reuniones con autoridades del área sanitaria y también con otras organizaciones de la salud, con el fin de sortear las dificultades que se interponen en la prestación de los análisis clínicos.
CALAB es un lugar donde se pueden canalizar todas las problemáticas, conflictos o contrariedades que presenta cada laboratorio. Es por ello que instamos a todos a sumarse a la Cámara para así tener mayor legitimidad y sustento a la hora de posicionarse ante los distintos aspectos que afectan a los colegas.
Para quienes estén interesados pueden contactarse con la cámara a través de la Página Web o por correo electrónico a info@calab.org.ar. Sino, a través de las redes sociales Facebook, Twitter o Linkedin.
CALAB presentó Testeate.ar
Revisión: Dres. Osvaldo Elbarcha, Fabián Fay, y Matías Molina.
Se realizó a través de la plataforma Meet. Compartimos las piezas gráficas para publicar y el video del encuentro.
La Cámara Argentina de Laboratorios de Análisis Bioquímicos (CALAB) presentó la plataforma Testeate.ar, una iniciativa para ofrecer a la comunidad información calificada, y que a partir de ella se visibilice a los laboratorios de análisis clínicos y sus bioquímicos.
El encuentro contó con 81 inscriptos y estuvo encabezado por el presidente de la Cámara, Dr. Luis Mónaco; y coordinado por el vicepresidente, Dr. Andrés Albrecht, se presentaron los algoritmos para la detección de Covid-19, HIV, tiroides y tiroides en el embarazo. El desarrollo y su revisión es realizada por equipos de bioquímicos, especialistas de cada tema, pertenecientes a laboratorios de CALAB.
EQUIPO COVID: Desarrollo: Dres. Mariano Iglesias, Luis Mónaco, Andrés Albrecht y Santiago Fares Taie
EQUIPO TIROIDES: Desarrollo: Dres. María Belén Azpiroz, Lucía Liceaga, Paola Assenza y Santiago Fares Taie
Supervisión: Dres. Adriana Oneto y Claudio Aranda
EQUIPO TIROIDES EN EL EMBARAZO: Desarrollo: Dres. Alejandra Lombardo, Mariana Benzi, Omar Cáceres
Revisión: Dres. Graciela Alcaraz y Claudio Aranda
EQUIPO HIV: Desarrollo: Dres. Ariel Suárez, Gerardo Ford, Mariana Pretell y Maribel Martínez Wassaf.
Revisión: Dres. Osvaldo Elbarcha y Edgardo Sturba.
Las presentaciones estuvieron a cargo de Santiago Fares Taie, para COVID-19 y tiroides; Maribel Martínez para HIV; y Alejandra Lombardo, tiroides en el embarazo.
Compartimos el link de la grabación de la presentación Presentación de TesteateAr - YouTube
71 Actualidad Año XII · Número 138 · Febrero 2023
Conforme los hechos de público conocimiento y de acuerdo a las recomendaciones de organismos internacionales en referencia al COVID-19, las fechas previstas para los eventos se encuentran sujetas a confirmación por parte de los organizadores. Se sugiere chequearlas previamente.
FORMACIÓN CON MODALIDAD A DISTANCIA
Western Blot
On demand - Organiza Biocealab cursos@biocealab.com - www.biocealab.com
Curso de Actualización en Psicofarmacología
Consultar fecha de inicio (cada módulo prevé una dedicación de 120 horas distribuidas en 3 meses)
Organiza COFyBCF
(Colegio Oficial de Farmacéuticos y Bioquímicos de la Capital Federal) bioquimicos@cofybcf.org.ar; educacioncontinua@cofybcf. org.ar, www.cofybcf.org.ar
Actualización en Hemostasia y Coagulación
Inscripción permanente
Organiza UNL - (Universidad Nacional del Litoral) formacioncontinua@fbcb.unl.edu.ar http://www.fbcb.unl.edu.ar/app/cursos.php
Monitoreo Terapéutico de Drogas
Inscripción permanente
Organiza UNL (Universidad Nacional del Litoral) formacioncontinua@fbcb.unl.edu.ar http://www.fbcb.unl.edu.ar/app/cursos.php
Curso sobre Micología Médica
Inscripciones abiertas Organiza Fundación Química Argentina info@fundacionquimica.org.ar
Manejo Práctico de las Alteraciones del Ciclo y Amenorreas
Contarán con 120 días para completar el curso administracion@saegre.org.ar; saegre@saegre.org.ar www.saegre.org.ar/curso_online_amenorreas.asp
El laboratorio en Endocrinología Ginecológica y Reproductiva (Curso Online) Contarán con 90 días para completar el curso. administracion@saegre.org.ar saegre@saegre.org.ar www.saegre.org.ar/curso_online_laboratorio.asp
Diagnóstico y manejo práctico de la Osteoporosis (Curso Online) Contarán con 90 días para completar el curso. administracion@saegre.org.ar saegre@saegre.org.ar www.saegre.org.ar/curso_online_osteoporosis.asp#
Panorama General de la Hematología (Curso Online)
Organiza Colegio Mexicano de Ciencias de Laboratorio Clínico A.C. (CMCLabC) y grupo HematoLab Diagnostic. cursosydiplomadoshd@hematolabdiagnostic.com.mx http://hematolabdiagnostic.com.mx/curso-i-panorama-general-de-la-hematologiacutea-hematopoyesis.html
Clasificación de las Anemias con Base en los Índices Eritrocitarios y Cambios Morfológicos de la Serie Roja (parte I) (Curso Online)
Organiza Colegio Mexicano de Ciencias de Laboratorio Clínico A.C. (CMCLabC) y grupo HematoLab Diagnostic. cursosydiplomadoshd@hematolabdiagnostic.com.mx http://hematolabdiagnostic.com.mx/curso-ii-clasificacioacuten-de-las-anemias-con-base-en-los-iacutendices-eritrocitarios-y-cambios-morfoloacutegicos-de-la-serie-roja-parte-i.html
Taller de Comprensión lectora en Inglés
Consultar fecha de inicio
Cobico (Colegio Bioquímico de Córdoba) cobico@cobico.com.ar www.cobico.com.ar
72 Revista Bioreview®
Curso de Inglés para Profesionales de la Salud Consultar fecha de inicio Cobico (Colegio Bioquímico de Córdoba) cobico@cobico.com.ar www.cobico.com.ar
Organizan OPS (Organización Panamericana de la Salud), FIU (Florida International University) y ReAct Latinoamérica
info@reactlat.org
https://reactlat.org/encuentro-latinoamericano-comunidades-empoderadas/
The International Laboratory Diagnostics Congress
15 al 18 de febrero de 2023 info@ldcongress.com https://www.ldcongress.com/?lang=en
La Nefrología desde el Laboratorio y la Clínica I: Fisiopatología renal y bioquímica de los líquidos y electrolitos. (Cuatrimestral)
13 de marzo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Biología Molecular: aplicaciones Clínicas (Anual)
13 de marzo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Estadísticas Prácticas: “Herramientas básicas para la investigación clínica” (Anual)
13 de marzo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Curso Anual de Microbiología Clínica
20 de marzo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Tópicos de actualización en Bioquímica Clínica en la práctica diaria 2023
20 de marzo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Control de Calidad Interno. Fundamentos y estrategias para el laboratorio clínico
27 de marzo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Gases en Sangre, Oximetría, Electrolitos y Metabolitos
27 de marzo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Hemostasia: Principios Básicos teóricos y Prácticos
3 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Diagnóstico Bacteriológico, de la Clínica la Laboratorio
3 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Evaluación de la Pareja Infertil. “Rol e importancia del Laboratorio”
3 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Diagnóstico de las Hemoglobinopatías y Talasemias: “A partir de casos clínicos”
10 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
73 Agenda de Formación Continua y de Posgrado Año XII · Número 138 · Febrero 2023
Genómica y Bioinformática aplicadas a la Medicina de Precisión
10 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
La Bioquímica en el Banco de Sangre
10 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Patologías Endocrinológicas: “El laboratorio clínico herramienta indispensable en el diagnóstico”
10 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Calidad Analítica: Implementación de un Sistema de Gestión de Calidad: Herramientas prácticas para el Laboratorio Bioquímico.
17 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Tópicos de Bioquímica Clínica y Patología en Pediatría 2023
17 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Herramientas para el Reconocimiento Citomorfológico de los Linfocitos en Trastornos Benignos y Malignos: ¿Linfocitos Reactivos o Sospecha de Neoplasia?
24 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Toxicología Legal y Forense
27 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
El Laboratorio frente a las Enfermedades Cardiovasculares: evaluación de factores de riesgo lipídico, no lipídico y de marcadores del evento agudo
27 de abril de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Bases Moleculares y Celulares del Funcionamiento del Sistema Inmune
1 de mayo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Enfoque Multidisciplinario en el Diagnóstico de la Patología Oncológica
1 de mayo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Curso Integral sobre Líquidos de Punción con Tópicos de Urgencia
8 de mayo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Hallazgos Inusuales en el Extendido de Sangre Periférica que Orientan a la Sospecha de Diferentes Enfermedades
8 de mayo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Utilidad de los Biomarcadores En Sepsis
8 de mayo de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Actualización en el Estudio de las Disproteinemias
12 de junio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
74 Revista Bioreview®
Claves para la interpretación y validación del hemograma automatizado. Detección de interferencias
12 de junio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Rol de la Morfología de las Células Hemáticas en el Laboratorio de Urgencias
26 de junio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Microbiología de los Alimentos (teórico – práctico)
Segundo semestre
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Plasma Rico en Plaquetas: Aplicaciones, Alcances y Limitaciones
Segundo semestre
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Médicos y Bioquímicos en el Diagnóstico de la Patología Oncológica
Segundo semestre
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Aspectos Citológicos y Microbiológicos del Exámen de Orina
Segundo semestre Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Aplicaciones de la Citometría de Flujo en la Práctica Clínica. - Curso por Convenio: ABA- GRCF.
3 de julio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Evaluación del Semen Humano. Teórico-Práctico
3 de julio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Hemostasia en Pediatría
3 de julio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Examen de Orina. Aspectos Citológicos y Microbiológicos
10 de julio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Curso de Neuroinmunología
10 de julio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Curso de Histocompatibilidad
17 de julio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
El Microscopio como Aliado en el Diagnóstico (Nuevo)
17 de julio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Curso de Autoinmunidad – Clínica y Laboratorio
24 de julio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Inmunología Celular- El Laboratorio en el Estudio de las Células del Sistema Inmune y sus Patologías
31 de julio de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
75 Agenda de Formación Continua y de Posgrado Año XII · Número 138 · Febrero 2023
Inhibidores Adquiridos de la Coagulación
7 de agosto de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Dilemas en la identificación Morfológica de las Células de la Serie Mieloide en Sangre periférica
7 de agosto de 2023
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
FORMACIÓN CON MODALIDAD PRESENCIAL
ARGENTINA
VI Curso Bianual de Especialización en Endocrinología
Ginecológica y Reproductiva. Buenos Aires 2019 – 2020
Consultar fecha de inicio
CABA
Argentina
Organiza SAEGRE saegre@saegre.org.ar www.saegre.org.ar/cursos_bs_as_2019-2020.asp
Evaluación del Semen Humano y Factor Inmunológico en Fertilidad
8 al 29 de mayo de 2023
CABA, Argentina
Organiza UBA (Universidad de Buenos Aires) posgrado@ffyb.uba.ar
74° Congreso Argentino de Bioquímica 2023
13 al 16 de junio de 2023
CABA
Argentina
cursos@aba-online.org.ar
https://aba-online.org.ar/74o-congreso-argentino-de-bioquimica-2023/
AUSTRALIA
Congreso Argentino de Microbiología 2023
27 al 29 de septiembre del 2023
Organiza AAM
(Asociación Argentina de Microbiología) https://www.aam.org.ar/actividades/714
APFCB Congress 2024. Asia-Pacific Federation for Clinical Biochemistry and Laboratory Medicine
19 al 22 de octubre de 2024
Sydney
Australia
https://apfcbcongress2022.org/
COLOMBIA
XXVI COLABIOCLI 2024
Abril 2024
Cartagena
Colombia
EMIRATOS ÁRABES
XXVI IFCC WORLDLAB DUBAI 2024
26 al 30 de mayo de 2024
Dubai
Emiratos Árabes Unidos info@dubai2024.org
https://dubai2024.org/
FINLANDIA
International Congress on Quality in Laboratory Medicine and Health Technology
9 y 10 de febrero de 2023
Helsinki
Finlandia info@labquality.fi
https://www.labqualitydays.fi/en/
76 Revista Bioreview®
FRANCIA
CIM2023 - International Metrology Congress
7 al 10 de marzo de 2023
Lyon
Francia
info@cfmetrologie.com
https://www.cim2023.com/en/
BIOMEDJ 2023
9 al 10 de marzo de 2023
París
Francia
a.bartholemot@comnco.com
https://www.congres-biomedj.fr/
9th International Symposium on Critical Care Testing and Blood Gases
20 al 21 de junio de 2024
Saint-Malo
Francia
contact@criticalcaretesting-saintmalo2024.eu
https://criticalcaretesting-saintmalo2024.eu/
ITALIA
Clinical Mass Spectrometry: Validation and Accreditation of IVD and Laboratory Developed Test (LDT) in the new “Regulation EU 2017/746” ERA
20 y 21 de mayo de 2023
Roma, Italia
https://www.ifcc.org/ifcc-congresses-and-conferences/
XXV IFCC – EFLM Worldlab-Euromedlab Rome 2023
21 al 25 de mayo de 2023
Roma, Italia
www.ifcc.org/ifcc-congresses-and-conferences
REPÚBLICA CHECA
5th Symposium – Cutting Edge of Laboratory Medicine in Europe – CELME 2023
12 y 13 de octubre de 2023
Praga, República Checa zimatom@cesnet.cz
http://www.celme2023.cz/
POSTGRADO
DOCTORADOS
Doctorado en Bioquímica y Biología Aplicada
Inscripción abierta Organiza UNL (Universidad Nacional del Litoral) cytbioq@fbcb.unl.edu.ar posgrado@fbcb.unl.edu.ar www.unl.edu.ar/blog/carreras/doctorado-en-bioquimica-y-biologia-aplicada
Doctor en Ciencias Biológicas
Inscripción abierta Organiza UNL (Universidad Nacional del Litoral) cytbioq@fbcb.unl.edu.ar - posgrado@fbcb.unl.edu.ar www.unl.edu.ar/blog/carreras/doctorado-en-ciencias-biologicas
Doctorado en Educación en Ciencias Experimentales
Inscripción abierta Organiza UNL (Universidad Nacional del Litoral) cytbioq@fbcb.unl.edu.ar posgrado@fbcb.unl.edu.ar www.unl.edu.ar/blog/carreras/doctorado-en-educacion-en-ciencias-experimentales
Doctorado en Ciencias Biológicas
Pre inscripciones abiertas Mendoza, Argentina
Organiza Universidad Nacional de Cuyo posgrado@fcm.uncu.edu.ar www.probiol.uncu.edu.ar
Doctor en Física
Inscripciones abiertas Organiza UNL (Universidad Nacional del Litoral)
77 Agenda de Formación Continua y de Posgrado Año XII · Número 138 · Febrero 2023
cytbioq@fbcb.unl.edu.ar posgrado@fbcb.unl.edu.ar
www.unl.edu.ar/carreras/doctorado-en-fisica/
MAESTRÍAS
Maestría en Ciencias Biomédicas
Maestría binacional compartida entre la Universidad de Buenos Aires (UBA), Argentina (Facultad de Medicina y Facultad de Farmacia y Bioquímica) y la Universidad Albert Ludwig de Friburgo (ALU), Alemania (Facultad de Medicina).
http://www.ffyb.uba.ar/maestrias-89/maestria-en-ciencias-biomedicas--imbs-programa-argentino-aleman?es
Magíster en Física
Inscripciones abierWtas
Organiza UNL (universidad Nacional del Litoral) cytbioq@fbcb.unl.edu.ar posgrado@fbcb.unl.edu.ar
https://www.unl.edu.ar/carreras/maestria-en-fisica
ESPECIALIZACIONES
Especialización en Vinculación y Gestión Tecnológica
Inscripción abierta
Organiza UNL - (Universidad Nacional del Litoral) gtec@unl.edu.ar
www.unl.edu.ar/blog/carreras/especializacion-en-vinculacion-y-gestion-tecnologica
Especialización en Bioquímica Clínica en el área de Microbiología Clínica
Preinscripción abierta
Organiza Universidad Nacional de La Rioja posgrado.dacefyn@unlar.edu.ar
https://posgrado.unlar.edu.ar/depto-exactas/
BECAS Y CONVOCATORIAS
Búsqueda de candidato a beca postdoctoral CONICET (IIB-FIUBA)
Tema: Desarrollo de dispositivos de microfluídica Lab On a Chip de gran tamaño para la producción y purificación de anticuerpos monoclonales de forma integrada.
Requisitos del becario: tener título de doctor/a en biología, bioquímica, farmacia, química, biotecnología o carreras afines o tesis aprobada antes del 31/7/2022 con interés en desarrollar trabajos en equipos interdisciplinarios. Enviar CV
Lugar de trabajo: Grupo de Microfluídica
Instituto de Ingeniería Biomédica
Facultad de ingeniería, UBA.
Contactos:
Dr. Maximiliano Pérez: max@fullgen.com.ar,
Dra. María Camila Martínez Ceron: mc4camila@gmail.com, camartinez@ffyb.uba.ar
Dra. Natalia Bourguignon: nataliabourguignon@gmail.com
Estudio de la asociación de Flavonas con Actividad Antitumoral con Inhibidores del EGFR y su adecuada vehiculización para el Tratamiento del Cáncer de Mama.
Requisitos: Graduado en Bioquímica, Farmacia, Biotecnología, Biología o carreras afines. Buen nivel de inglés
Duración de la beca: 3 años a partir de 01/04/2023.
Lugar de Trabajo: IQUIFIB (UBA – CONICET), Depto de Química Biológica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires.
Contacto: Dra. Johanna Gabriela Miquet. Enviar CV (que incluya calificaciones y promedios considerando aplazos) al siguiente e-mail miquetig@yahoo.com.ar
78 Revista Bioreview®

79 Agenda de Formación Continua y de Posgrado Año XII · Número 138 · Febrero 2023
AVAN TECNOLOGÍAS IVD
Padre M. Ashkar 688 (Ex Monteagudo) CP 1672 -
Gral. San Martín, Buenos Aires, Argentina - +54 11 4754 2168 http://avan.com.ar - ventas@avan.com.ar
LABORATORIOS BACON S. A. I. C.
AP BIOTECH
Félix de Azara 757, Lomas de Zamora, Buenos Aires. +54 11 5352 3820 - info@apbiotech.com.ar https://apbiotech.com.ar/news/labs/ Aviso en pág. 18 y 19
BERNARDO LEW E HIJOS S.R.L
Perú 150,Bahía Blanca, Argentina
+54 291 455 1794 - info@bernardolew.com.ar www.bernardolew.com.ar
Aviso en pág. 11-13
DICONEX S. A.
Torcuato de Alvear 46 (1878), Quilmes, Argentina - Líneas Rotativas: +54 11 4252 2626 - info@diconex.com www.diconex.com
Aviso en pág. 15 JS MEDICINA ELECTRÓNICA S.R.L
Bolivia 462 (B1603CFJ) Villa Martelli, Buenos Aires - +54 11 4709 7707 marketing@jsweb.com.ar - www.jsweb.com.ar
Aviso en pág. 23
BIOARS
Estomba 961, CABA, Argentina
+54 11 4555-4601 ventas@bioars.com.ar
Aviso en pág. 25/37
GEMATEC EQUIPAMIENTO PARA MEDICINA
Avalos 3651, (1605) Munro, Buenos Aires, Argentina. +54 11 4512-5666 y líneas rotativas. info@gematec.com.ar
Aviso en pág. 43/45
GLYMS INFORMACIÓN EN TIEMPO REAL
Piedras 519 8-A, Capital Federal, República Argentina +54 011 4331 4512 - administracion@glyms.com.
Aviso en pág. 21
80 Revista Bioreview®
IAC INTERNACIONAL
Av. P. Luro 7113 - Mar del Plata - Argentina
+ 54 223 4783900
ventas@iacinternacional.com.ar
https://iacinternacional.com.ar
Aviso en pág. 59
Instrumental Bioquímico SA
Tel. +54 11 4709 7700
instrumental-b.com.ar
Aviso en pág. 47/49
MANLAB - Diagnóstico Bioquímico y Genómico
Tel. +54 11 6842 1200
manlab.com.ar
Aviso en pág. 17
MERCK S.A.
Ed. Panamericana Plaza, Tronador 4890, Buenos Aires (1430)
https://www.merckgroup.com/ar-es - Cel. +54 11 4546 8100
Aviso en pág. 8-9
Año XII · Número 138 · Febrero 2023
MONTEBIO
Oficina y depósito: Vera 575 CABA Tel. +54 11 4858 0636.rotativas. www.montebio.com.ar/info@montebio.com.ar
Aviso en pág. 35
NextLAB by Genetrics S.A.
Av. del Libertador 8630 6º Piso - Tel. +54 11 5263 0275
info@nextlab.com.ar - www.nextlab.com.ar - Aviso en pág. 30/33
WIENER LAB
Wiener Lab Switzerland S. A. ventas@wiener-lab.com
Horario de Atención: Lunes a Viernes 9 a 18Hs. (-3 GMT)
Aviso en pág. 21
81 Índice de Auspiciantes

































82 Revista Bioreview®

Y MÁS DE 11 AÑOS JUNTOS


















VISITANOS EN ISSUU.COM
SOMOS
135 EDICIONES
PIONEROS






 Bioquímico Sergio Sainz Director General de Medios ssainz@rwgroup.com.ar
Bioquímica Griselda Basile Directora de Contenidos gbasile@rwgroup.com.ar
Cyntia Perez Social Media Manager info@rwgroup.com.ar
DI Lucía Zandanel Terán Directora de Arte y Desarrollo Digital arte@rwgroup.com.ar
Bioquímico Sergio Sainz Director General de Medios ssainz@rwgroup.com.ar
Bioquímica Griselda Basile Directora de Contenidos gbasile@rwgroup.com.ar
Cyntia Perez Social Media Manager info@rwgroup.com.ar
DI Lucía Zandanel Terán Directora de Arte y Desarrollo Digital arte@rwgroup.com.ar






































































































































































































































































































































































































































































































































































































































