Sumario
Diagnóstico Clínico Aplicado 06
Uso de hierro intravenoso en el tratamiento de la anemia ferropénica en niños. A propósito de un caso
El déficit de hierro es la causa más común de anemia debido a carencia nutricional. Su máxima prevalencia ocurre en niños pequeños, adolescentes de sexo femenino y mujeres embarazadas1-3. Muchos factores predisponen a la anemia por deficiencia de hierro, incluida la privación nutricional, la malabsorción intestinal y pérdidas de sangre. Durante los primeros dos años de vida existe un riesgo elevado de ferropenia, debido fundamentalmente a las limitadas fuentes dietéticas de hierro y a las necesidades incrementadas por el crecimiento1-3. El tratamiento de la anemia por deficiencia de hierro consiste en mejorar la nutrición, seleccionando alimentos ricos en hierro biodisponible junto con la administración de hierro por vía oral, intramuscular o intravenosa4-8. En pediatría, se prefiere el uso de hierro oral, dado que es conveniente, económico y eficaz cuando la absorción intestinal no está comprometida. Uno de sus principales inconvenientes es la falta de adherencia. Página 06
Diagnóstico Clínico Aplicado 22
Inmunoensayos lineales (LIA): simplicidad y rapidez en el diagnóstico de la diabetes autoinmune
La patogenia de la diabetes tipo 1 se asocia fuertemente con alteraciones inmunológicas, teniendo un rol fundamental los autoanticuerpos contra los islotes pancreáticos. En algunos casos, pueden coexistir otras enfermedades autoinmunes específicas de órgano, como la enfermedad tiroidea y la enfermedad celíaca1. Los autoanticuerpos anti insulina (IAA), anti descarboxilasa del ácido glutámico (GADA),... Página 22
Actualidad 58
Diestro en CALILAB 2024: Un Compromiso con la Excelencia
En esta nueva edición del evento más relevante de calidad en laboratorios clínicos de América Latina, CALILAB,... Página 58
Bioquímica
Elección de la metodología adecuada para el diagnóstico de dengue
Los virus transmitidos por artrópodos (arbovirus) infectan a los seres humanos principalmente a través de la picadura de artrópodos hematófagos, por ejemplo, mosquitos, garrapatas, entre otros. Hay más de 100 arbovirus que causan infección y enfermedad en los seres humanos. Estas infecciones pueden ser desde asintomáticas hasta poner en riesgo la vida. Estos virus constituyen un grupo amplio de varias familias y géneros, siendo los más importantes en las Américas, los flavivirus (familia Flaviviridae), como los virus del dengue (DENV), del Zika (ZIKV), de la fiebre amarilla (YFV), del Nilo occidental (WNV, por su sigla en inglés)... Página 28
Consenso latinoamericano sobre la importancia de un sistema de gestión de datos microbiológicos para apoyar el programa de optimización de uso de antimicrobianos (PROA)
La resistencia antimicrobiana es una amenaza para los logros de la medicina moderna y una de las medidas más efectivas para contrarrestarla son los programas de optimización del uso de antimicrobianos (PROA), en el cual el laboratorio de microbiología es uno de los principales componentes. La aplicación efectiva de tecnología de la información en los procesos es fundamental, pero existe poca información en Latinoamérica sobre el desarrollo... Página 36
Formación con modalidad Online y Presencial en todo el mundo. Página 60
Nuestros Patrocinantes siempre presentes. Página 64
Uso de hierro intravenoso en el tratamiento de la anemia ferropénica en niños. A propósito de un caso
Mikaela de Agrela1
Manuela Arce2
Martín Notejane3
Felipe Lemos 4
Loreley García5
1 Residente. Pediatría. Facultad de Medicina. UDELAR.
2 Asist. Unidad Académica Pediatría B. Facultad de Medicina. UDELAR.
3 Prof. Adj. Unidad Académica Pediatría B. Facultad de Medicina. UDELAR.
4 Ex. Prof. Adj. Cátedra Medicina Transfusional. Docente colaborador calificado. Unidad Académica Pediatría C. Facultad de Medicina. UDELAR.
5 Prof. Unidad Académica Pediatría B. Facultad de Medicina. UDELAR. Unidad Académica Pediatría B. Facultad de Medicina. UDELAR
Trabajo inédito. Declaramos no tener conflictos de intereses.
Se contó con el consentimiento de la familia para el reporte del caso.
Este trabajo ha sido aprobado unánimemente por el Comité Editorial.
Fecha recibido: 8 marzo 2023.
Fecha aprobado: 12 junio 2023.
Resumen
Introducción: el déficit de hierro es la causa más común de anemia debido a carencia nutricional. Su tratamiento consiste en proporcionar alimentos ricos en hierro biodisponible junto con la administración de hierro oral. En circunstancias definidas puede utilizarse el hierro intravenoso.
Objetivo: describir el abordaje diagnóstico y terapéutico de un niño portador de anemia ferropénica severa secundaria a mala adherencia al hierro oral en el que se utilizó hierro intravenoso.
Caso clínico: niño de 21 meses, raza blanca. Antecedente de anemia ferropénica severa, con repercusión hemodinámica que a los 14 meses requirió transfusión de sangre desplasmatizada. Sin controles de hemoglobina posteriores. Sin adherencia a profilaxis con hierro vía oral. Alto consumo de leche de vaca y bajo consumo de alimentos ricos en hierro. En el contexto de infección respiratoria aguda baja se constata anemia clínica con marcado decaimiento y anorexia, sin repercusión hemodinámica. Se confirma la anemia microcítica, hipocrómica severa, con ancho de distribución eritrocitaria elevado, con metabolismo de hierro alterado. Recibe hierro sacarato, intravenoso, por seis días con buena tolerancia y evolución.
Discusión: se identificaron múltiples factores de riesgo para anemia ferropénica. La pobre respuesta al tratamiento con hierro oral debido a efectos adversos y olvidos de administración, junto al antecedente de anemia ferropénica severa, que requirió transfusión de sangre desplasmatizada, motivaron la indicación de hierro intravenoso. Su administración fue programada y monitorizada, sin complicaciones. Es necesario fortalecer la prevención en todos los controles pediátricos y abordar este problema de salud desde una mirada interdisciplinaria.
Descriptores: Anemia Ferropénica Deficiencia de Hierro Niño.
Abstract: Use of intravenous iron for the treatment of iron deficiency anemia in children. Clinical case study
Introduction: iron deficiency is the most common cause of anemia due to nutritional deficiency. Its treatment consists of providing bioavailable iron rich food together with oral iron. In specific circumstances, intravenous iron may be used.
Objective: of this study is to describe the diagnostic and therapeutic approach used with a child with severe iron deficiency anemia secondary to poor adherence to oral iron, in which intravenous iron was used.
Clinical case: 21 month-old white patient. History of severe iron deficiency anemia, with hemodynamic repercussions that at 14 months of age required transfusion of deplasmatized blood. Without subsequent hemoglobin controls. No adherence to oral iron prophylaxis. High consumption of cow’s milk and low of iron-rich foods. Within the context of acute lower respiratory infection, a clinical anemia with marked decline and anorexia were observed, without hemodynamic repercussions. Severe hypochromic microcytic anemia was confirmed, with an elevated erythrocyte distribution width and altered iron metabolism. He received iron saccharate, intravenously for 6 days with good tolerance and evolution.
Discussion: multiple risk factors for iron deficiency anemia were identified. The poor response to treatment with oral iron resulting from adverse effects and lack of proper administration, together with a history of severe iron deficiency anemia, which required transfusion of deplasmatized blood, led to the prescription of intravenous iron. This administration was scheduled and monitored, occurring without complications. It is necessary to strengthen prevention of this condition in all pediatric check-ups and address this health problem from an interdisciplinary perspective.
Keywords: Iron Deficiency Anemia; Lack of Iron; Child
Resumo: Uso de ferro intravenoso no tratamento da anemia ferropriva em crianças. Relato de caso
Introdução: a deficiência de ferro é a causa mais comum de anemia por deficiência nutricional. Seu tratamento consiste no fornecimento de alimentos ricos em ferro biodisponível, juntamente com a administração de ferro por via oral. Em circunstâncias especificas, pode ser utilizado ferro intravenoso.
Objetivo: descrever a abordagem diagnóstica e terapêutica de uma criança com anemia ferropriva grave secundária a sua má adesão ao ferro oral, e o uso de ferro intravenoso.
Caso clínico: 21 meses, raça branca. História de anemia ferropriva grave, com repercussão hemodinâmica que requiriu de transfusão de sangue desplasmatizada aos 14 meses. Não houve nenhum controle de hemoglobina subsequente. Nenhuma adesão à profilaxia oral com ferro. Alto consumo de leite de vaca e baixo consumo de alimentos ricos em ferro. No contexto de infecção respiratória inferior aguda, observa-se anemia clínica com acentuado emagrecimento e anorexia, sem repercussões hemodinâmicas. É confirmada anemia microcítica e hipocrômica grave, com largura de distribuição eritrocitária elevada e metabolismo alterado do ferro. Recebeu sacarose férrica intravenosa por 6 dias com boa tolerância e evolução.
Discussão: foram identificados múltiplos fatores de risco para anemia
Si estás desde el celular, toca el código y te redirigiremos hacia el formulario
ferropriva. A má resposta ao tratamento com ferro oral devido aos efeitos adversos e ao esquecimento da administração, aliás da história de anemia ferropriva grave, que exigiu transfusão de sangue desplasmatizada, motivaram a indicação do ferro intravenoso. Sua administração foi programada e monitorada, e aconteceu sem intercorrências. É preciso fortalecer a prevenção em todos os controles pediátricos e abordar este problema de saúde numa persectiva interdisciplinar.
Palavras-chave: Anemia Ferropriva; Falta de Ferro; Criança
Introducción
El déficit de hierro es la causa más común de anemia debido a carencia nutricional. Su máxima prevalencia ocurre en niños pequeños, adolescentes de sexo femenino y mujeres embarazadas 1-3.
Muchos factores predisponen a la anemia por deficiencia de hierro, incluida la privación nutricional, la malabsorción intestinal y pérdidas de sangre. Durante los primeros dos años de vida existe un riesgo elevado de ferropenia, debido fundamentalmente a las limitadas fuentes dietéticas de hierro y a las necesidades incrementadas por el crecimiento 1-3.
El tratamiento de la anemia por deficiencia de hierro consiste en mejorar la nutrición, seleccionando alimentos ricos en hierro biodisponible junto con la administración de hierro por vía oral, intramuscular o intravenosa 4-8. En pediatría, se prefiere el uso de hierro oral, dado que es conveniente, económico y eficaz cuando la absorción intestinal no está comprometida. Uno de sus principales inconvenientes es la falta de adherencia al tratamiento, ya sea por intolerancia o incumplimiento 4-8.
En casos bien establecidos debe recurrirse al tratamiento con hierro intravenoso. Actualmente se lo considera un método seguro y efectivo para tratar la deficiencia de hierro en niños que no pueden recibir o no responden adecuadamente al tratamiento con este fármaco por vía oral 5-11.
El objetivo de esta comunicación es describir el abordaje diagnóstico y terapéutico de un niño en edad preescolar portador de anemia ferropénica severa secundaria a mala adherencia al tratamiento con hierro oral en el que se utilizó hierro intravenoso.
Caso clínico
Veintiún meses, sexo masculino, raza blanca, procedente de zona urbana de Montevideo. Sin antecedentes perina-
tales patológicos ni familiares a destacar. Medio socioeconómico y cultural deficitario. Buen crecimiento y desarrollo. Inmunizaciones vigentes.
Alimentado con pecho directo exclusivo hasta los 3 meses. Inicia alimentación complementaria a los 6 meses, actualmente consume leche de vaca entera, dos litros al día, dieta pobre en carne y en alimentos ricos en hierro biodisponible. Profilaxis con hierro oral de cumplimiento irregular, refieren intolerancia digestiva y olvidos en la administración por parte de los cuidadores.
Portador de anemia ferropénica, diagnosticada a los 14 meses, requirió hospitalización y transfusión de sangre desplasmatizada por cifras de severidad (hemoglobina 5 g/dL) y por presentarse con repercusión hemodinámica (taquicardia y soplo). Al alta se indicó tratamiento con hierro oral, presentando falta de adherencia y cumplimiento.
Consulta por rinorrea serosa, tos catarral y fiebre de 24 horas de evolución, acompañada de decaimiento marcado, apatía y anorexia.
Examen físico actual. Constantes vitales: FC 104 lpm, FR 46 rpm, TAX 36,5 °C, saturación de oxígeno 97% ventilando espontáneamente al aire. Intensa palidez cutáneo mucosa. Panículo adiposo hipoturgente en abdomen y muslos, masas musculares conservadas. Punta cardíaca normoposicionada. Ritmo regular, sin soplos. Extremidades cálidas, pulsos periféricos presentes, tiempo de recoloración menor a dos segundos. Tiraje subcostal, subcrepitantes y sibilancias espiratorias bilaterales. No adenopatías, ni visceromegalias. Resto del examen físico normal.
Los planteos clínicos iniciales fueron: infección respiratoria aguda baja con insuficiencia respiratoria, anemia y desnutrición aguda. Conducta: oxigenoterapia por cánula nasal de bajo flujo a 1 L/min, broncodilatadores inhalados, se solicitan estudios de laboratorio e ingreso a sala de cuidados moderados.
Estudios complementarios de laboratorio evidencian hemograma: hemoglobina (Hb) 5,7 g/dL, Hct 23%, volumen corpuscular medio (VCM) 52 fL, hemoglobina corpuscular media (HCM) 12,9 pg, ancho de distribucción eritrocitaria (ADE) 24,7%, reticulocitosis 1%. Lámina periférica: hipocromía, microcitosis, anisocitosis, poiquilocitosis. Serie blanca y plaquetaria normal. Estudio del metabolismo del hierro: sideremia 11 ug/dL, transferrina 256 unidades, índice de saturación de transferrina 3%, ferritina 5 ng/mL. Se confirma la presencia de anemia severa microcítica hipocrómica arregenerativa con ADE elevado de etiología
carencial, ferropénica. Radiografía de tórax anteroposterior: índice cardiopericárdico normal, no imágenes patológicas a nivel del parénquima pulmonar.
Si bien el paciente presentaba factores de riesgo para ferropenia, dada la severidad de la anemia y la recaída, se solicitaron estudios para pesquisar otras etiologías. Anticuerpos para enfermedad celíaca (negativos), dosificación de IgA (normal), virus de la inmunodeficiencia humana (VIH) no reactivo, funcional y enzimograma hepático normal.
Se realizó interconsulta con médico hemoterapeuta, y, en conjunto, se indicó hierro sacarato parenteral con el objetivo de alcanzar una cifra de Hb inicial de al menos 9 g/dL. Se calculó el déficit de hierro según fórmula de Ganzoni (300 mg de hierro elemental). Se administraron 50 mg/día de hierro elemental diluidos en 100 mL de suero fisiológico (4 mg/kg/día), requiriendo en total seis días de tratamiento intravenoso. Se realizó la primera dosis de prueba, monitorizando la respuesta, mediante infusión intravenosa lenta de 25 mg en 30 minutos. Los días posteriores se administraron 50 mg en 30 minutos. No se detectaron reacciones adversas. Buena evolución. Previo al alta, se realizaron recomendaciones nutricionales y se indicó tratamiento con hierro oral polimaltosado una semana posterior a la última dosis de hierro intravenoso. En la (Tabla 1) se evidencia la evolución de los índices hematimétricos.
Discusión
En este caso se identificaron múltiples factores de riesgo para padecer anemia ferropénica. La duración de la lactancia materna fue escasa y precoz la introducción de leche de vaca. El niño recibía escasos alimentos ricos en hierro biodisponible y alto consumo lácteo. Este último factor es reconocido por inhibir la absorción de hierro y producir microsangrados intestinales con las consiguientes pérdidas digestivas2-5.
Además, se trataba de una familia que manifestaba dificultades en el cumplimiento de la profilaxis con hierro oral. Estas dificultades en la adherencia pueden deberse a su palatabilidad, efectos adversos gastrointestinales como náuseas, vómitos, dolor abdominal, diarrea, estreñimiento o a olvidos por parte de los cuidadores8,9,12-19. Este último punto resulta importante en el abordaje etiológico inicial, ya que ante el antecedente de anemia ferropénica es crucial identificar si el paciente no responde al hierro administrado por vía oral o simplemente no lo recibe.
Frente a un niño pequeño que se presenta con anemia severa de perfil ferropénico, suele ser necesario descartar diagnósticos etiológicos diferenciales, con otras entidades que cursan con anemia microcítica hipocrómica, como las talasemias y la anemia de las enfermedades crónicas. En este contexto se pesquisó la posibilidad de enfermedad celíaca o la infección por VIH que fueron descartadas,
Tecnología adaptable y accesible para laboratorios de baja a alta complejidad
Muy bajo costo por determinación
Conoce más escaneando el QR
Elección de la metodología adecuada para el diagnóstico de dengue
Laboratorio Práctico
Bioq. Luciana Suárez luciana.suarez@wiener-lab.com
Marketing Corporativo - Wiener lab. - Rosario – Argentina
Los virus transmitidos por artrópodos (arbovirus) infectan a los seres humanos principalmente a través de la picadura de artrópodos hematófagos, por ejemplo, mosquitos, garrapatas, entre otros. Hay más de 100 arbovirus que cau-
san infección y enfermedad en los seres humanos. Estas infecciones pueden ser desde asintomáticas hasta poner en riesgo la vida. Estos virus constituyen un grupo amplio de varias familias y géneros, siendo los más importantes
en las Américas, los flavivirus (familia Flaviviridae), como los virus del dengue (DENV), del Zika (ZIKV), de la fiebre amarilla (YFV), del Nilo occidental (WNV, por su sigla en inglés) y de la encefalitis de San Luis (SLEV, por su sigla en inglés). También son frecuentes los alfavirus (familia Togaviridae), entre los que se encuentran los virus del chikunguña (CHIKV), Mayaro (MAYV) y los de las encefalitis equinas, y el virus Oropouche (OROV), del género Orthobunyavirus (familia Peribunyaviridae). En este artículo nos centraremos en el DENV.
En las Américas, el vector principal responsable de la trasmisión urbana del DENV es el mosquito Aedes aegypti y, según la Organización Mundial de la Salud (OMS), actualmente cerca de 500 millones de personas viven en riesgo de contraer el dengue. En esta región el número de casos de dengue se ha incrementado en las últimas cuatro décadas, pasando de 1,5 millones de casos acumulados en la década del 1980-1989, a 16,2 millones en la década del 2010-2019. Estas cifras siguen en aumento, ya que, de acuerdo con el último reporte de la OMS, hasta la semana epidemiológica 28 (julio 2024) se reportó un aumento de más del 220% de casos con respecto al mismo período del año anterior. Debido a que entre el 65% y 80% de las infecciones son subclínicas, se estima que los números reales de casos son mayores. Los cuatro serotipos del DENV circulan a lo largo del continente y en algunos países circulan simultáneamente, y con esto el aumento de riesgo de las personas de desarrollar dengue grave (0,2% de los casos), y posiblemente mortal (0,05% de los casos), si ocurre una infección por dos serotipos diferentes.
Todos los años se registran brotes de infecciones por DENV y se observa que se incorporan más zonas con dengue autóctono. Las causas por lo que esto ocurre son por cambio climático, movimiento poblacional de viajes y migraciones y problemas socioeconómicos con urbanizaciones desorganizadas. Además, se observa que cada vez son más cortos los tiempos inter epidémicos.
Diagnóstico
Todo paciente con sospecha de infección por DENV debe ser tratado y monitoreado los signos de alarma, por lo menos hasta obtener el diagnóstico por laboratorio, el
cual confirma o descarta la infección. Por esta razón es importante contar con una metodología rápida con alta sensibilidad y especificidad.
En áreas sin circulación autóctona del virus todo caso sospechoso se debe confirmar por laboratorio. Para regiones donde ya está confirmado el brote o en presencia de una epidemia se diagnostican por laboratorio los casos graves, es decir personas internadas y/o con comorbilidades que presenten signos de alarma, como por ejemplo aumento del 20% del hematocrito, disminución del recuento de plaquetas, dolor abdominal intenso, sangrado de mucosas, dificultad respiratoria entre otros, y/o fallecidos. Además de estos casos, se debe realizar diagnóstico por laboratorio a un porcentaje de muestras para el estudio de duración temporal del brote, a un porcentaje de muestras para evaluación epidemiológica del serotipo circulante y cuando se produce una expansión a nuevas áreas.
La definición del serotipo (DENV-1, DENV-2, DENV-3 o DENV-4) tiene solamente objetivos epidemiológicos, no está establecida la relación entre serotipo y gravedad en las manifestaciones clínica, mayor o menor incidencia en la tasa de contagio o tratamiento diferencial. Todos los serotipos generan anticuerpos serotipos específicos de por vida y una inmunidad transitoria contra los otros serotipos.
Muestras
Los tipos de muestras son suero, plasma, líquido cefalorraquídeo (LCR) en caso de afectación neurológica y tejido en caso de fallecido. Ocasionalmente se puede utilizar orina. Las muestras se deben mantener refrigeradas (2-8 °C) y si es necesario conservarla por más de 48hs se recomienda congelar (-10 a -20 °C), pero evitar ciclos de congelamiento y descongelamiento. Si debe ser transportada a un centro de referencia es necesario que sea en triple envase. Las condiciones de bioseguridad son de clase II, no solo por el dengue y su posible trasmisión por aerosoles, sino también por las infecciones de diagnóstico diferencial. Por lo tanto, se recomienda trabajar en cabinas de bioseguridad la extracción de ARN y pruebas serológicas. Las muestras obtenidas de la extracción de ARN se consideran material
no infeccioso, al igual que las muestras de tejido.
Metodología de elección
La metodología de elección que se debe utilizar para el diagnóstico por laboratorio de dengue depende del tiempo de evolución del paciente. Por lo tanto, es muy importante contar con la fecha de inicio de síntomas que lo determina el primer episodio de fiebre en el paciente. Si la toma de muestra es dentro de los primeros 3 días de inicio de los síntomas se deben realizar métodos directos para detectar la viremia en fase aguda: detección de antígeno de la proteína no estructural 1 (NS1), detección del genoma viral mediante la técnica de transcriptasa reversa en reacción en cadena de la polimerasa en tiempo real (qRT-PCR) o aislamiento celular; siendo este período el de mayor eficiencia
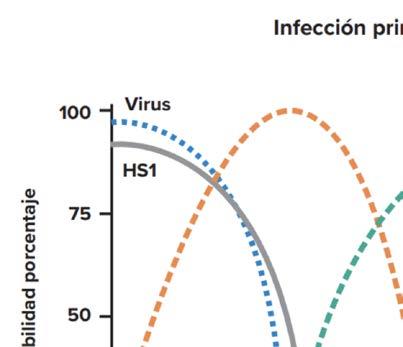
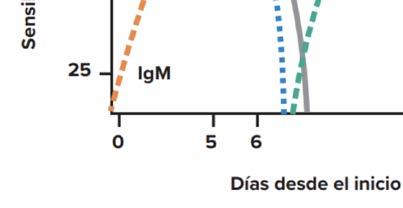
de diagnóstico. Si la muestra es tomada entre los días 4-6 de evolución nos encontramos que la viremia está disminuyendo y están aumentando los anticuerpos, así que, se recomienda combinar metodología directa con metodología indirecta. Si la toma de muestra es a los 7 días o posterior se deben implementar métodos indirectos y de seroconversión, es decir, búsqueda de IgM y/o IgG en suero (ver gráfico 1).
Métodos directos
Detección de genoma viral por qRT-PCR: si por medio de la técnica de qRT-PCR se detecta el genoma viral de DENV es suficiente para la confirmación del diagnóstico. Por otro lado, si el resultado es no detectable se debe solicitar una nueva muestra del paciente con más días de evolución. Otro motivo por el cual puede dar falsos negativos es por
Gráfico 1: cinética de marcadores en infección primaria de dengue. Fuente OPS
























la posible contaminación en el procedimiento, ya que es un virus de ARN y lo puede afectar cualquier ARNasa que esté presente. Por esta razón es muy importante la utilización de los controles interno, positivo y negativo para corroborar que no existan inhibidores o que la muestra esté contaminada. Si bien el pico máximo de viremia ocurre al tercer día y luego desciende, con esta metodología es posible detectar el genoma hasta el quinto día con una sensibilidad adecuada. También es posible detectar DENV en orinas en pacientes con más de 7 días de evolución de la infección. Hay disponibles varios formatos de multiplex que detectan diferentes targets, como, por ejemplo, detección de DENV, identificación de los distintos serotipos o detección de DENV más CHIKV y ZIKV, entre otros. Para la elección de un reactivo adecuado es importante evaluar la sensibilidad y especificidad de detección para los 4 serotipos, aun así, no los diferencie. Se pueden procesar muestras de LCR con esta metodología en casos de compromiso neurológico.
Detección de antígeno NS1 por ELISA: el resultado positivo de la detección del antígeno viral NS1 por metodología de ELISA es confirmatorio para el diagnóstico de la infección por DENV. Es muy importante verificar la sensibilidad a los distintos serotipos, ya que, por lo general algunos kits comerciales pueden presentar menor sensibilidad para los serotipos DEN-2 y DENV-4 por el diseño de los anticuerpos monoclonales que utilizan, los cuales tienen menor afinidad por estos serotipos. No es posible distinguir serotipos con este tipo de determinación. La detección de NS1 por metodología inmunocromatográfica o test rápido (TR) no es suficiente para confirmar diagnóstico. En pacientes recientemente vacunados no se detecta antígeno NS1, manteniendo su utilidad diagnóstica para aquellos vacunados y con síntomas de infección por DENV.
Genoma viral vs. NS1: si bien ambos métodos son directos y se utilizan en el mismo momento de evolución del paciente hay algunos puntos a diferenciar entre ellos. Si la qRT-PCR no está disponible por su complejidad, se puede considerar la detección del antígeno NS1 por ELISA teniendo en cuenta que su sensibilidad es menor que qRT-PCR. En el estudio publicado por Nishat Hussain Ahmed, donde compara ambos métodos vs. los días de evolución de la patología en pacientes del Hospital and
Research Institute (India), se observa una mayor sensibilidad en la detección del genoma del DENV por metodología qRT-PCR que la determinación del antígeno NS1 por ELISA. Esta última presenta una sensibilidad del 50% al día 1, llegando al pico máximo de 100% al día 2 y luego disminuye gradualmente al día 5 con una sensibilidad del 50%. Por otro lado, la metodología de biología molecular comienza en el día 1 con una sensibilidad mayor, siendo del 75%, pasado al 83% en el día 2 y su máxima sensibilidad al día 3 con 93%, para luego disminuir de la misma forma que la técnica de ELISA (Tabla 1).
Métodos indirectos
Detección de anticuerpo IgM: a partir del día 3 de inicio de la fiebre un resultado positivo es un diagnóstico probable y si es negativo se debe solicitar otra muestra con más días de evolución. No es diagnóstico confirmatorio porque se ha demostrado que pueden permanecer en circulación hasta por un año. Por lo tanto, la IgM es un marcador de infección reciente y no de infección aguda. Esto se agrava en épocas de brote, limitando su utilidad por la persistencia de su detección en suero. Además, puede presentar reacción cruzada con otros flavovirus, como por ejemplo un paciente vacunado por fiebre amarilla. Por lo tanto, se debe confirmar el resultado positivo con una prueba de neutralización por reducción de placas (PRNT, por su sigla en inglés) y es considerada el ensayo de referencia para la detección serológica de infecciones arbovirales. La prueba se basa en la capacidad de los anticuerpos séricos de las personas infectadas de neutralizar la infección viral en cultivos celulares, realizándose en centros de referencia.
Un resultado negativo en una muestra de 5 días de evolución o posterior descarta el diagnóstico de dengue.
Cuando se presentan complicaciones neurológicas, la detección de IgM se realiza en suero y en LCR simultáneamente. El LCR puede analizarse tanto en su forma pura como diluida (dilución máxima de 1:5). La presencia de IgM en el LCR confirma una infección reciente del sistema nervioso central, aunque se debe considerar la posible persistencia de los anticuerpos IgM y la posible reactividad
Tabla 1: Sensibilidad de detección antígeno NS1 por ELISA y Genoma viral por qRT-PCR en pacientes del Hospital and Research Institute (India).
cruzada entre virus del mismo género.
La reactividad cruzada se observa con mayor frecuencia en las reinfecciones que en las primoinfecciones. Por ende, en regiones donde diversos flavovirus circulan simultáneamente o han circulado anteriormente, tal como ocurre en gran parte de las Américas, la probabilidad de reactividad cruzada es elevada.
Detección de anticuerpo IgG: es un marcador de menor utilidad. Presenta una persistencia de años en sangre. Por otro lado, la seroconversión si es funcional al diagnóstico, procesando 2 muestras con una semana de diferencia entre ellas. En casos de reinfección también se puede evidenciar con el aumento de títulos 4 veces de su valor, para lo cual es necesario utilizar una metodología cuantitativa. En esta determinación también se presenta la limitación de la reactividad cruzada con otro virus.
En paciente recientemente vacunados se puede detectar anticuerpos IgM e IgG durante el plazo de 30 días por lo menos, disminuyendo su utilidad diagnóstica en este tipo de población.
A pesar presentar limitaciones, la detección de anticuerpos por serología forman parte de los métodos de diagnóstico de las infecciones por arbovirus, ya que, el uso de los métodos directos depende de la buena calidad de las muestras y la obtención de la misma debe ser dentro de los días donde la viremia sea detectable. También aumentan su utilidad en laboratorios donde no se dispongan de tecnología de cultivo celular ni de biología molecular y su costo es notablemente menor.
Tener en cuenta que la combinación de métodos directos e indirectos puede mejorar la sensibilidad y especificidad del diagnóstico por laboratorio de esta patología.
Metodología por inmunocromatografía o TR
No se recomienda el uso de TR en áreas sin circulación autóctona del virus, como tampoco en períodos interepidémicos. Los TR que detecten antígeno NS1 y/o anticuerpos IgM e IgG se recomiendan utilizar en épocas de epidemia como refuerzo de respuesta laboratorial con circulación comprobada, siendo una prueba confirmatoria de diagnóstico. Si el resultado es negativo para los 3 parámetros con una muestra de menos de 5 días de evolución se debe pedir nueva muestra, pero si es con más de 5 días de evolución se puede descartar el diagnóstico. Si solo es positivo la detección de anticuerpos tipo IgG puede tratarse de un caso de infección pasada o si solamente se detecta el antígeno NS1 es un caso probable de dengue. También este tipo de pruebas son de utilidad como vigilancia epidemiológica en los laboratorios públicos.
Conclusión
Se sabe que el tratamiento del dengue tiende a ser conservador y se inicia en el momento de la sospecha clínica. No obstante, es fundamental realizar un seguimiento riguroso del estado clínico y de los parámetros hematológicos para evitar complicaciones, lo que hace relevante la importancia del diagnóstico
temprano. Este diagnóstico precoz también es crucial para diferenciar los síntomas del dengue con otras enfermedades febriles que pueden presentarse durante los brotes de dengue.
REFERENCIAS BIBLIOGRÁFICAS
• Vigilancia epidemiológica y laboratorial – Ministerio de salud de la nación (Argentina), 2024.
• Dengue en niños y en adultos: Diagnóstico, manejo clínico y vacunas- SAV, 2023.
• Nota técnica: Algoritmo para la confirmación por laboratorio de casos de dengue. OPS, 2023.
• Comparison of NS1 antigen detection ELISA, real time RT-PCR and virus isolation for rapid diagnosis of dengue infection in acute phase. Nishat Hussain Ahmed & Sho-bha Broor - Hospital and Research Institute, Gurgaon, India, 2014.
Recomendaciones para la detección y el diagnóstico por laboratorio de infecciones por arbovirus en la Región de las Américas - OPS, 2022.
Informe de situación No 28. Situación epidemiológica del dengue en las Américas – OPS, semana epidemiológica 28, 2024.
Consenso latinoamericano sobre la importancia de un sistema de gestión de datos microbiológicos para apoyar el programa de optimización de uso de antimicrobianos (PROA): Recomendaciones basadas en la evidencia. Parte 1
Christian José Pallares Gutiérrez1, 2, 3, Germán Esparza4, 5, 6, 7, Rodolfo Ernesto Quirós8, 9, Gabriel Levy10, Paola Lichtenberger11, 12, 13 , Dona Benadof14, 15, Patricia Angeleri16, 17, 18, Mónica Thorman19, Pedro F. del Peloso20, 21, 22, Flavia Rossi23, 24, 25, David de Luna26, 27, 28, Luis Enrique Hercilla29, 30, Paulo Francisco Castañeda31, 32, Jorge Aníbal Reyes Chacón33, 34, 35, 36, Joaquín Rincón37, 38, 39, 40, María Virginia Villegas41
1Jefe del Comité de Infecciones de la Clínica Imbanaco, grupo Quironsalud. Cali. Colombia.
2Profesor de la Vicerrectoría de Investigación Universidad El Bosque, grupo Resistencia Antimicrobiana y Epidemiología Hospitalaria (RAEH). Universidad El Bosque. Bogotá, Colombia.
3Profesor del Departamento de Salud Pública y Epidemiología de la Universidad Javeriana. Bogotá, Colombia.
4Profesor de Microbiología Médica y Antimicrobianos de la Pontificia Universidad Javeriana. Bogotá, Colombia.
5Profesor de Infectología de la Universidad del Rosario. Bogotá, Colombia.
6Consultor internacional en resistencia antimicrobiana de OPS/OMS, Washington, D. C, Estados Unidos de América.
7Programa de Proeficiencia en Microbiología de PROASECAL. Bogotá, Colombia.
8Coordinador de la plataforma PROAnet. Chone, Ecuador.
9Director médico del Sanatorio Las Lomas. Buenos Aires, Argentina.
10Jefe de Infectología, Hospital Carlos G. Durand, Buenos Aires, Argentina.
11Profesora de Medicina de la Universidad de Miami, Miller School of Medicine. Miami, Estados Unidos de América.
12Directora del posgrado de Infectología del Jackson Memorial Hospital/University of Miami. Miami, Estados Unidos de América.
13Directora del PROA y jefe del Departamento de Infectología del Hospital de Veteranos de Miami, Florida, Estados Unidos.
14Jefa del Laboratorio Clínico del Hospital de Niños Roberto del Río. Santiago de Chile, Chile.
15Profesora agregada del Departamento de Pediatría y Cirugía Norte, Facultad de Medicina, Universidad de Chile.
16Ex directora nacional de Epidemiología y Análisis de Situación de Salud. Argentina.
17Jefa de la División del Promoción y Protección de la Salud del Hospital General de Agudos «Dra. Cecilia Grierson». Ciudad de Buenos Aires, Argentina.
18Consultora internacional del Programa Especial de Resistencia a los Antimicrobianos de OPS/OMS. Washington, D. C, Estados Unidos de America.
19Coordinadora del Programa de Prevención de ITS, VIH y Hepatitis en el Ministerio de Salud Pública y Asistencia Social de la República Dominicana.
20Gerente de Microbiología Clínica y Biología Molecular de la Rede D’Or São Luiz. Brasil.
21Miembro de BrCAST en el Subcomité de Microorganismos sin punto de corte, actuando en laboratorios de análisis clínicos, con énfasis en diagnóstico microbiológico, mecanismos de resistencia bacteriana, identificación bacteriana por espectrometría de masa (MALDI-TOF). Rio de Janeiro, Brasil.
22Miembro de la Comisión de Control de Infecciones Hospitalarias y consultor en el área de Microbiología Clínica.
23Directora del Laboratorio Central de Microbiología del Hospital das Clínicas de la Universidad de São Paulo, HCFMUSP. Brasil.
24Miembro del grupo de Stewardship y del grupo de Infecciones Hospitalarias (HCFMUSP), Brasil.
25Miembro editorial de AAC y ASM.
26Coordinador de las asignaturas Microbiología e Infectología de la Pontificia Universidad Católica Madre y Maestra, PUCMM. República Dominicana.
27Presidente del Comité de Bioseguridad de la Pontificia Universidad Católica Madre y Maestra, PUCMM. República Dominicana.
28Jefe del Servicio de Infectología del Hospital Metropolitano de Santiago, HOMS. República Dominicana.
29Jefe de Departamento y responsable del Comité de Infecciones y PROA del Hospital Nacional Alberto Sabogal. Peru.
30Tutor de Infectología de la Universidad Nacional Mayor de San Marcos. Peru.
31Profesor del curso de Medicina Interna del Hospital Médica Sur (por la UNAM). Mexico.
32Coordinador del Programa de Control de Antibióticos del Hospital Médica Sur. Mexico.
33Coordinador de Epidemiología e Infectología del Hospital Quito Sur, Ecuador.
34Líder del Laboratorio de Microbiología y Biología Molecular del Hospital Quito Sur, Ecuador.
35Profesor principal de Microbiología y Virología de la Universidad Central del Ecuador.
36Investigador adjunto del Centro de Investigación para la Salud en América Latina (CISeAL) de la Pontificia Universidad Católica del Ecuador.
37Jefe del Departamento de Infectología del Hospital para el Niño IMIEM. México.
38Jefe del Departamento de Epidemiologia de Centro Médico Toluca. México.
39Presidente Fundador del Colegio Mexiquense de Infectologia y Microbiología Clínica A. C. México.
40Fundador de la Sub_Especialidad de Infectología Pediátrica en el Hospital para el Niño IMIEM. México.
41Profesora de la Vicerrectoría de Investigación de la Universidad El Bosque, grupo Resistencia Anti-microbiana y Epidemiología Hospitalaria (RAEH), Colombia.
Resumen
La resistencia antimicrobiana es una amenaza para los logros de la medicina moderna y una de las medidas más efectivas para contrarrestarla son los programas de optimización del uso de antimicrobianos (PROA), en el cual el laboratorio de microbiología es uno de los principales componentes. La aplicación efectiva de tecnología de la información en los procesos es fundamental, pero existe poca información en Latinoamérica sobre el desarrollo y la articulación de las herramientas tecnológicas para apoyar los PROA. Este consenso hace recomendaciones sobre la gestión de los datos microbiológicos para la toma de decisiones. En la Parte I, se presentan las reco-
mendaciones en cuanto al uso de un sistema informatizado de gestión de datos microbiológicos en la práctica clínica, los requerimientos de datos y de reporte en el laboratorio de microbiología, y los contenidos del sistema de gestión de calidad avanzado en el laboratorio. En la Parte II, se discuten los requerimientos de información para la gestión de PROA en estadios intermedios, iniciales y avanzados por el laboratorio y la farmacia; así como la integración del equipo de PROA con el Comité de Prevención y Control de Infecciones y la información para la gestión de PROA a nivel gerencial.
Palabras clave: PROA, tecnología, informática, antibiograma, informática médica.
Abstract: Latin American consensus on the importance of a microbiological data management system to support antimicrobial use optimization program (PROA): Evidence-based recommendations. Part 1
Antimicrobial resistance is a threat to the achievements of modern medicine and one of the most effective measures to counteract it is antimicrobial use optimization programs (AMS), in which the microbiology laboratory is one of the main components. The effective application of information technology in the processes is fundamental, but there is little information in Latin America on the development and articulation of technological tools to support AMSs. This consensus makes recommendations on the management of microbiological data for decision making. In Part I, recommendations on the use of a computerized microbiological data management system in clinical practice, data and reporting requirements in the microbiology laboratory, as well as the contents of the advanced quality management system in the laboratory are presented. In Part II, the information requirements for AMS management in intermediate, initial, and advanced stages by the laboratory and pharmacy are discussed; as well as the integration of the AMS team with the Infection Prevention and Control Committee and the information for AMS management at the management level.
Keywords: Antimicrobial Stewardship Programs; AMS; technology; informatics; antibiogram; medical informatics.
Introducción
La resistencia antimicrobiana (RAM) es una amenaza para los logros de la medicina moderna, mencionando la era “posantibiótica” como una posibilidad real para el siglo XXI1. Se ha estimado que 30 a 50% de los antimicrobianos son prescritos en forma inapropiada, siendo evidente el abuso de antimicrobianos de amplio espectro y su uso por tiempos prolongados. Todo esto conlleva a un incremento en la RAM, que tiene impacto en mortalidad, eventos adversos, costos sanitarios y pérdida de la productividad2–4. Una de las medidas para contrarrestar y manejar este problema es los Programas de Optimización del uso de Antimicrobianos (PROA), conocidos en inglés como A ntimicrobial Stewardship Programs (AMS), cuyo objetivo general es mejorar los resultados clínicos de la prescripción de antimicrobianos, lograr prescripciones adecuadas para disminuir el surgimiento de microorganismos multidrogorresistentes (MDR) por presión selectiva y minimizar los efectos adversos, la estancia hospitalaria y los costos asociados5,6.
El laboratorio de microbiología es uno de los principales componentes del PROA, ya que no solo participa en la caracterización del agente causal de la infección de manera individual, sino que además genera la información necesaria para la construcción de los perfiles epidemiológicos institucionales y detecta cambios en la incidencia de aparición de microorganismos específicos, no solo dentro de las instituciones, también de muestras extrahospitalarias, y aporta así información a los laboratorios de referencia en cada país6. Estos procesos están cada vez más relacionados con la aplicación efectiva de tecnología de la información, que permite mejorar la precisión y tener certeza de los datos, disminuir los tiempos de espera y mejorar la integralidad de las pruebas de microbiología, optimizando al mismo tiempo el flujo de trabajo del laboratorio y reduciendo costos7–11. Por estas razones, la tecnología de la información es cada vez más relevante en microbiología clínica, con el advenimiento de la automatización del laboratorio, las historias clínicas electrónicas y la existencia de herramientas de apoyo a la decisión microbiológica de la secuenciación del genoma completo. Todo lo anterior genera diagnósticos oportunos en el paciente y mejora la calidad y seguridad en la atención.
Debido a la poca información disponible en Latinoamérica sobre el desarrollo y la articulación de las herramientas tecnológicas para apoyar los PROA, el presente documento tiene como objetivo hacer recomendaciones sobre la gestión de los datos microbiológicos para la toma de decisiones.
Este proyecto es una iniciativa del grupo de Resistencia Antimicrobiana y Epidemiología Hospitalaria (RAEH) de la Universidad El Bosque, en Bogotá, Colombia y cuenta con el auspicio de la Asociación Panamericana de Infectología. Para la selección de los integrantes del consenso, RAEH encargó a tres especialistas (MVV, MT y CJPG) convocar a un grupo de expertos basándose en varios criterios: conocimiento en PROA y/o diagnóstico microbiológico, publicaciones realizadas en el tema, experiencia en la implementación de PROA en los hospitales donde laboran, grado intermedio o avanzado de sus PROAS, charlas dictadas en este tema y diferente formación académica (infectología, epidemiología, microbiología). Esto garantizó un equipo multidisciplinario y una discusión desde diferentes perspectivas de conocimiento, logrando recomendaciones con alto nivel de experiencia que fueron sometidas a consenso. Cada integrante del grupo votó a título personal y en forma individual usando la metodología propuesta (Delphi). (Anexo 1) Creemos que a pesar de
que no se pudo incluir más profesionales por limitación de tiempo y recursos, los que votaron representan un grupo de expertos en PROA y Diagnóstico. La búsqueda de información fue efectuada por cada experto en forma individual en trabajo virtual y, en una etapa final, fueron convocados a una reunión presencial en agosto de 2022 en la ciudad de Bogotá para llegar a los acuerdos de consenso que se presentan en este documento. BioMérieux financió esta reunión presencial sin haber participado en la génesis de esta iniciativa, en la selección de los participantes ni en la definición de su metodología o tampoco en el proceso de votación durante el consenso.
Métodos
Composición del panel
Para la realización de este consenso se convocó un panel multidisciplinario de 16 especialistas (enfermedades infecciosas, microbiología clínica y epidemiología) de Latinoamérica, incluyendo profesionales de Argentina, Brasil, Chile, Colombia, Ecuador, Estados Unidos de Norteamérica, México, Perú, y la República Dominicana, así como representantes de la Organización Panamericana de la Salud (OPS). Todos los miembros del panel fueron seleccionados teniendo en cuenta su experiencia y cono-
cimiento del tema.
Descripción general del proceso
El plan de trabajo del consenso se realizó bajo el método RAND/UCLA, basado en la evidencia científica y en el juicio colectivo de un panel de expertos12. Se realizó una búsqueda bibliográfica de la información disponible en la evidencia científica publicada sobre el tema, usando fuentes de organismos recopiladores (National Guideline Clearinghouse –NGC– y Guideline International Network –GIN–), productores de guías de práctica clínica (New Zealand Guidelines Group –NZGG–, National Institute for Health and Care Excellence –NICE–, Scottish Intercollegiate Guidelines Network –SIGN–) y guías de práctica clínica y bases de datos generales (PubMed, Medline, EMBASE). Se usaron los siguientes términos MESH (Medical Subject Headings): a utomation, laboratory clinical, laboratory information systems, disease notification, humans, medical informatics, microbiological techniques, microbiological methods, microbiology. Con los artículos seleccionados partiendo de la búsqueda bibliográfica inicial, se elaboró un documento en el que se emitieron recomendaciones. Para evaluar la calidad de la evidencia y la fuerza de las recomendaciones se usó la metodología

*En la fuerza de la recomendación.
GRADE (Grade of Recommendation, Assessment, Development, and Evaluation) modificada13–14, que asigna cada recomendación con clasificaciones separadas para la calidad subyacente de la evidencia que respalda la recomendación y para la fortaleza con la que se hace la recomendación, estableciendo los siguientes niveles de evidencia: b ajo (III): los resultados definitivamente pueden cambiar en el tiempo; m oderado (II): los resultados pueden cambiar en el tiempo, pero no lo harán de forma drástica; alto (I): la probabilidad de que los resultados cambien es mínima.
La fuerza de la recomendación (fuerte o débil) se evaluó con base en el balance entre los beneficios y los riesgos, la calidad de la evidencia, los valores y las preferencias de los pacientes, así como el costo o la utilización de recursos15–19.
El panel se reunió una vez y estableció puntuaciones para las recomendaciones efectuadas de forma indivi-
Tabla 1. Votaciones de las recomendaciones del consenso (método Delphi)
dual, mediante la metodología Delphi modificada20, con rondas de votación (incógnita y abierta). Se estableció un consenso mediante un nivel de aceptación de la recomendación con una mediana ≥ 7 y una fuerza de recomendación igual o mayor a 65% (Anexo 1). El panel revisó y discutió todas las recomendaciones, su fortaleza y la calidad de la evidencia. Una vez que la recomendación fue aceptada, se realizaron ajustes en la redacción y contenido, de acuerdo con la opinión de los participantes. En caso de tener que realizar ajustes mayores, la votación se realizó nuevamente. Las discrepancias asociadas a la presentación de la evidencia se discutieron y resolvieron en conjunto, y todas las recomendaciones finales representan la opinión consensuada de todo el panel.
Conflictos de interés
Declaración detallada al final de la Parte I del documento.
El panel de expertos cumplió con la política internacional sobre conflictos de interés, que requiere la divulgación de cualquier interés financiero o de otro tipo, que pueda interpretarse como un conflicto real, potencial o aparente. Todos los miembros del panel recibieron la declaración de divulgación de conflictos de interés y se les
solicitó que identificaran los vínculos con compañías que desarrollan productos que pueden verse afectados por la promulgación del consenso. Adicionalmente, se solicitó información sobre empleo, consultorías, propiedad de acciones, honorarios, financiamiento de investigación, testimonio de expertos y membresía en comités asesores de estas compañías. Aunque los investigadores (excepto Rodolfo Quirós) recibieron honorarios de BioMérieux por su participación en el consenso, BioMérieux no tuvo interferencia alguna con la votación de los participantes ni con la elaboración de este manuscrito. Las afiliaciones de los autores y sus posibles conflictos de interés se enumeran en los anexos 2 y 3.
Futuras revisiones del consenso
Cada tres años se pedirá a los líderes del panel su opinión sobre la necesidad de actualizar el consenso, con base en una revisión de la literatura actual. Si está justificado, todo el panel de expertos o un subconjunto de este se convocará a analizar posibles cambios.
Recomendaciones
Recomendación 1
Se recomienda disponer de un sistema informatizado de gestión de datos microbiológicos para uso clínico, con una periodicidad definida por cada institución, de acuerdo con el nivel institucional del PROA y el desarrollo del laboratorio de microbiología.
Nivel de evidencia: Moderado (II)
Fuerza de la recomendación: Fuerte
Justificación
La vigilancia del comportamiento de la susceptibilidad in vitro de las bacterias a los antimicrobianos es fundamental para determinar las tendencias en el tiempo, el impacto de las intervenciones y la estimación de la magnitud del problema de la RAM21, además de que los datos de la vigilancia de RAM son útiles para establecer los tratamientos empíricos de los pacientes con sospecha de infección22. Sin embargo, la gestión de la información es un gran reto para los hospitales, especialmente aquellos ubicados en países de bajos y medianos ingresos, donde se estima que la carga de la RAM es alta23 y el acceso a cualquier software/sistema de gestión de datos en microbiología es limitado. Antes de agrupar y almacenar los datos en forma estandarizada (distribución por tipo de muestra, porcentajes de susceptibilidad antimicrobiana
por género y especie, incidencia de fenotipos o genotipos que marcan perfiles de resistencia específicos), el área de microbiología (a diferencia de otras secciones del laboratorio) requiere reportar múltiples rangos en los datos de susceptibilidad dependiendo del microorganismo, adicionar pruebas fenotípicas o genotípicas especiales y actualizar la nomenclatura bacteriana en forma periódica. Estas tareas, sumadas a la falta de experticia (educación, capacitación), ausencia de controles de calidad de los datos, incapacidad para adquirir tecnología por su costo, carencia de equipos automatizados (infraestructura) y software (sistemas de información), y escasez de experiencia del recurso humano, son barreras que obstaculizan el mejoramiento continuo en el laboratorio24.
Los costos de la gestión de los datos en microbiología son una limitante común, pero existen algunos sistemas informáticos disponibles de forma gratuita como el desarrollado por la Organización Mundial de la Salud (OMS) llamado WHONET®25, que permite capturar, analizar y compartir los datos de RAM en formatos estandarizados desde diferentes fuentes/ archivos de datos, como archivos de texto o aquellos exportados directamente de los sistemas automatizados comerciales de microbiología26. Las limitaciones más importantes de este tipo de s oftware r adi-






can en la incapacidad de generar datos individuales prácticos (a nivel de paciente) para el enlace, que integren variables clínicas, y hacer análisis (comparaciones) con otros hospitales, debido a la dificultad en la estandarización y la configuración de la información en c lusters. Solo 50% de los países de bajos y medianos ingresos usan WHONET®27, incluyendo países de Latinoamérica, donde a pesar de que 78% de las instituciones generan informes acumulados de susceptibilidad i n vitro a l os antimicrobianos, solo 55% los socializa a los prescriptores28. Además, muchos hospitales almacenan la información en papel y la entrada de datos es manual. Aunque WHONET® e s un sistema útil como repositorio de datos microbiológicos que produce archivos compartibles estandarizados, no proporciona la funcionalidad completa de un s oftware d e manejo de la información, como controles de auditoría clínica y validación electrónica de resultados, antes de la elaboración de informes. Es así como un sistema de gestión de datos debe integrarse con la tecnología (infraestructura) del laboratorio en forma armoniosa, tener manuales específicos para su implementación y uso, o disponer de un plan para el desarrollo y soporte continuo, que permita su implementación en distintos entornos y que cuente con módulos o funciones que incluyan gestión de
diferentes usuarios, identificación y seguimiento de pacientes en forma individualizada, captura de datos de las muestras, cultivos, antibiogramas, validación y exportación de datos, presentación de informes y gestión de la calidad.
Recomendación 2
Se recomienda que los datos mínimos del laboratorio de microbiología para gestionar un PROA y ejercer vigilancia epidemiológica en una institución sean:
• E studio de susceptibilidad in vitro acumulado.
• D etección de MDR (Microorganismos Multidrogorresistentes).
• Microorganismos relacionados con las Infecciones Asociadas a la Atención de la Salud (IAAS).
Nivel de evidencia: Moderado (II) Fuerza de la recomendación: Fuerte
Justificación
El aumento de la RAM y la poca innovación en nuevos


antimicrobianos hace que los PROA se constituyan en una prioridad, pero se requieren elementos mínimos para su puesta en marcha. El antibiograma, útil para facilitar la selección de un tratamiento específico para un microorganismo, organiza los datos de susceptibilidad i n vitro reportados por el laboratorio y contribuye a la decisión terapéutica, donde también intervienen otras variables como el sitio y gravedad de la infección, costo de la terapia, alergias del paciente, vía de administración y la política de administración antimicrobiana del hospital7. Aunque existen s oftwares e xpertos para generar antibiogramas29, son necesarios los controles de calidad de los datos en bruto, que muchas veces pueden estar limitados por este s oftware30. Situaciones como incorporar resultados para el análisis únicamente para el primer aislado por paciente de una determinada especie en el período evaluado –para evitar la incorporación repetida de un microrganismo del mismo paciente–, el cálculo del antibiograma o reportes acumulados de susceptibilidad i n vitro (semestral o anual) por sitio de infección o por fenotipo único, deben ser tenidos en cuenta. Al crear un reporte acumulado de susceptibilidad i n vitro p uede ser necesaria la estratificación de datos para algunas bacterias en algunas poblaciones de pacientes. Por ejemplo, los bacilos gramnegativos no fermentadores, como P seudomonas aeruginosa, aislados de pacientes en Unidad de Cuidado Intensivo (UCI) podrían ser más resistentes que los aislados provenientes de pacientes ubicados en otras áreas del hospital. Cuando los hallazgos de la estratificación son significativamente diferentes, es necesario enumerar la susceptibilidad i n vitro p ara cada subpoblación por ubicación, tipo de muestra o incluso tipo de patología infecciosa. Los reportes acumulados de susceptibilidad i n vitro p ueden incluir, además de los porcentajes de susceptibilidad, sus intervalos de confianza de 95% respectivos para facilitar la interpretación de los datos30. Estos reportes deberían analizarse y presentarse al menos una vez al año. También es importante tener en cuenta que solo se deberían incluir: aislados de diagnóstico (no de vigilancia epidemiológica), resultados finales y verificados de las pruebas, un número mínimo de 30 por especie y período de análisis, solo agentes antimicrobianos probados rutinariamente contra la población de aislados que se analizarán y el porcentaje de susceptibilidad i n vitro calculado a partir de los resultados informados. Para disminuir sesgos en las estimaciones de susceptibilidad, se deben excluir resultados para antimicrobianos complementarios probados selectivamente o para la detección de algunos mecanismos de resisten -
cia (ej. cefotaxima/ácido clavulánico) solo en aislados resistentes, y únicamente informar el porcentaje de susceptibilidad i n vitro, excluyendo el porcentaje de intermedios (I) o la susceptibilidad dosis dependiente (SDD)31.
La detección de los MDR es crucial para determinar incidencias, tendencias y descartar brotes intrahospitalarios, pero también apoya decisiones terapéuticas en pacientes de difícil manejo. Para lograr este objetivo, el laboratorio debe disponer de un sistema de reglas de experto para el informe de resultados, tomando en cuenta el origen de la muestra, la resistencia intrínseca, la edición del reporte con base en el fenotipo de resistencia y comentarios al pie de página explicando este fenotipo con alertas de prescripción. Igualmente, se debe disponer de pruebas específicas para detección de mecanismos de resistencia de interés clínico y epidemiológico. Identificar los mecanismos de resistencia no es sencillo debido a la variabilidad en la expresión de mecanismos de resistencia (principalmente los enzimáticos), la variabilidad inherente a las pruebas de susceptibilidad antimicrobiana o la presencia de múltiples mecanismos de resistencia en un mismo aislado32.
Las reglas de experto se pueden incorporar en los sistemas automatizados para publicar resultados de forma selectiva, logrando algoritmos útiles en la práctica. Un sistema de reglas de experto es una forma de inteligencia artificial que contiene una base de datos con información plausible, una inferencia motor (las reglas) y una interfaz de usuario para llegar a una conclusión sobre una entrada específica32; el beneficio radica en que aunque la regla de reporte puede ser aplicada por el operador, el sistema experto “recuerda” siempre todas las reglas incorporadas para el reporte de resultados, con lo cual se asegura una respuesta rápida, objetiva y coherente. En el laboratorio de microbiología clínica los sistemas de reglas de experto pueden alertar al usuario sobre un patrón inusual para un microorganismo identificado, editar la interpretación de un antimicrobiano basado en los resultados de un antimicrobiano marcador, suprimir el informe de un antimicrobiano, añadir una nota al pie de página para una mejor interpretación y permitir que los laboratorios personalicen las reglas que son utilizadas por el sistema7. Los sistemas de reglas de experto pueden alertar sobre la necesidad de hacer pruebas adicionales a un determinado microorganismo, agregar y reportar métricas de interés (tasas de infec-
ción intrahospitalaria asociadas a ciertos microorganismos, porcentajes de contaminación de hemocultivos) o notificar la necesidad de instaurar precauciones de contacto para evitar la diseminación de MDR29. Es importante mencionar que los sistemas de reglas de experto funcionan muy bien si se articulan con los sistemas informáticos, ya que está demostrado que la entrada manual de los resultados de microbiología es una fuente importante de errores de laboratorio33–34.
Las pruebas específicas son aquellas utilizadas para la detección de mecanismos de resistencia de importancia clínica y epidemiológica (ej. pruebas para la detección de β-lactamasas de espectro extendido (BLEE) como doble disco combinado con ácido clavulánico, difusión en gradiente, métodos colorimétricos como el test ESBL NDP, agares cromogénicos para BLEE, inmunoensayo de flujo lateral para las CTX-M o pruebas de RPC (“PCR”) multiplex automatizadas)35. Para la detección de carbapenemasas en E nterobacterales o bacilos gramnegativos no fermentadores de glucosa, pueden usarse pruebas fenotípicas de captura, por ej.: mCIM/eCIM [Método modificado de inactivación de carbapenems/Método modificado de inactivación de carbapenems con el agregado de EDTA (ácido etilen-


diaminotetraacético)] o carba NP o de diferenciación de la enzima (ej. sinergia con ácido borónico o EDTA), y también pruebas de inmunoensayo de flujo lateral o pruebas moleculares para la detección de carbapenemasas por RPC multiplex automatizada36.
Las pruebas de diagnóstico sindrómico permiten la detección en conglomerado de múltiples microorganismos y genes de resistencia asociados para las infecciones más comunes, como sepsis, neumonía viral y bacteriana, meningitis/encefalitis, infección articular e infección gastrointestinal, disminuyendo tiempos de espera para un diagnóstico oportuno y permitiendo la terapia dirigida precoz37–39.
Recomendación 3
Se recomienda que el reporte microbiológico del paciente contenga:
• Reporte selectivo de estudio de susceptibilidad antimicrobiana in vitro (consistente en reportar el resultado de las pruebas de susceptibilidad con base en la identificación del microorganismo, sus resistencias naturales y el origen del aislado o tipo de muestra). Antimicrobianos
suplementarios solo deben ser reportados si ofrecen ventajas clínicas o si el microorganismo es resistente a los agentes primarios.
• Alertas predefinidas.
• N otas personalizadas al equipo PROA o de control de infecciones.
Nivel de evidencia: Moderado (II)
Fuerza de la recomendación: Fuerte
Justificación
El uso de antimicrobianos debe estar enfocado en la siguiente secuencia de acciones:
• S elección antimicrobiana temprana y adecuada, siguiendo los principios del PROA: antimicrobiano, dosis y duración de tratamiento correcto40.
• Lectura interpretada de los antibiogramas41.
• D esescalamiento42.
Bajo esta premisa, la lectura interpretada de los antibiogramas es fundamental en la toma de la decisión terapéutica. La interpretación y la lectura interpretada del antibiograma son dos conceptos diferentes. La interpretación se define como la asociación con una categoría interpretativa del resultado de un antimicrobiano en particular respecto a un punto de corte (CIM [μg/mL]) así:
• Susceptible (S): El microorganismo es inhibido cuando se usan concentraciones del antimicrobiano recomendado de acuerdo con el sitio de infección.
• Intermedio (I): Respuesta impredecible que puede depender de las concentraciones del antimicrobiano en el sitio de infección y una zona buffer para errores de precisión de la prueba.
• Resistente (R): Aislados que no son inhibidos por las concentraciones del antimicrobiano que se alcanzan habitualmente en el organismo43.
La lectura interpretada exige la caracterización del fenotipo bacteriano a través del conocimiento de su perfil de susceptibilidad in vitro, deducción del mecanismo de resistencia implicado a partir del fenotipo de resistencia e inferencia y modificación del fenotipo, si es
necesario41,44. Para una correcta lectura interpretada del antibiograma es necesario conocer las resistencias intrínsecas o naturales (aquellas expresadas por los fenotipos salvajes, propias de cada familia, especie o grupo bacteriano) y adquiridas (un microorganismo que en principio es sensible a un antimicrobiano y adquiere resistencia mediante mutación o transferencia horizontal de elementos genéticos móviles como secuencias de inserción, integrones, transposones), así como los antimicrobianos marcadores de resistencia, con el objetivo de procesar la información en función del fenotipo, detectando el mecanismo de resistencia y generando así alertas predefinidas o notas personalizadas. Las alertas predefinidas se basan en la configuración manual o del sistema de reglas de experto automatizado, para que cuando se haya identificado a un determinado fenotipo (infrecuente, atípico, no reportado previamente o un posible error en la prueba) se genere una alarma desde el sistema, que contribuya a la puesta en marcha de alguna acción (confirmación del perfil de susceptibilidad o la necesidad de pruebas especiales para confirmación de los hallazgos). Las notas personalizadas dependerán de la situación epidemiológica de cada hospital y son una recomendación escrita en el reporte del antibiograma que indica alguna acción o decisión basada en los hallazgos (uso o no de un determinado antimicrobiano, instauración de precauciones de contacto, reporte al PROA o Comité de Prevención y Control de Infecciones, entre otras).
Recomendación 4
Se recomienda que los laboratorios de microbiología cuenten con un sistema de gestión de calidad con los siguientes atributos:
• Actualización periódica de los puntos de corte.
• Sistema de alertas frente a discordancias.
• Control de calidad interno y externo.
• S oftware actualizado de equipos automatizados, si así lo requiere.
Nivel de evidencia: Moderado (II) Fuerza de la recomendación: Fuerte
Justificación
Los puntos de corte categorizan una bacteria como
sensible, intermedia, sensible dosis/dependiente o resistente a la acción de un antimicrobiano específico. Se analizan teniendo en cuenta la aparición de nuevos mecanismos de resistencia y las necesidades de mejorar la respuesta terapéutica45. Son establecidos, entre otros, por el Instituto Americano de Estándares Clínicos y de Laboratorio (CLSI, por sus siglas en inglés) y por el Comité Europeo de Pruebas de Susceptibilidad Antimicrobiana (EUCAST, por sus siglas en inglés). Aunque el desenlace terapéutico no está determinado exclusivamente por los puntos de corte, y en ocasiones hay variabilidad en los puntos de corte entre los sistemas automatizados y los métodos manuales, es necesario actualizarlos periódicamente debido a la generación de nueva evidencia sobre fallas terapéuticas por mecanismos emergentes de resistencia antimicrobiana, además de cambios en el comportamiento de los parámetros farmacocinéticos y farmacodinámicos (FC/FD), lo cual hace necesario modificar las dosificaciones para optimizar la exposición del microorganismo a un antimicrobiano en particular. Los cambios en los puntos de corte afectan el rango de la concentración inhibitoria mínima (CIM) y/o los halos de inhibición en milímetros para la disco difusión, así como su categoría interpretativa, de acuerdo con la magnitud de estos cambios.
Los profesionales del laboratorio de microbiología deben estar entrenados para identificar resultados inusuales o discordantes. Estas discordancias pueden ser resultados no esperados como susceptibilidades i n vitro o r esistencias inusuales para una especie en particular o, por ejemplo, la resistencia a un antimicrobiano de amplio espectro con susceptibilidad a uno de espectro reducido. Sin embargo, deben existir s oftwares ca paces de generar alertas frente a discordancias y de suprimir los resultados de pruebas de susceptibilidad antimicrobiana con baja probabilidad de éxito terapéutico. Estos s oftwares t ambién se pueden incorporar como herramientas al flujo de trabajo para identificar y caracterizar otros problemas como la contaminación potencial en las pruebas moleculares46, aumentando la eficiencia y mejorando la calidad de los resultados.
El programa de aseguramiento de calidad en el laboratorio de microbiología se compone del control de calidad interno, la evaluación externa de la calidad, los procedimientos operativos estándar y la evaluación de la competencia. Todos estos procesos son regulados por la norma ISO 15189. El control de calidad en microbiología clínica genera resultados válidos, pre -

cisos y exactos que permiten la toma de decisiones terapéuticas acertadas. El control de calidad interno monitoriza la precisión de los resultados del laboratorio y permite aceptar o rechazar los análisis, detectando desviaciones y variabilidad47. El laboratorio debe contar con materiales de control que reaccionen con el sistema analítico de la forma más parecida a la muestra del paciente. Los materiales de control se deben analizar periódicamente, con una frecuencia que se debe basar en la estabilidad del procedimiento y el riesgo de peligro para el paciente derivado de un resultado errado. Los datos de control de calidad se deben revisar a intervalos regulares para detectar tendencias en el desempeño del análisis que pudieran indicar problemas en el sistema analítico.
El control externo de la calidad o ensayo de aptitud es la evaluación del desempeño (exactitud) mediante la comparación interlaboratorios utilizando un material de control trazable. Puede estar centrado en análisis específicos (ej. antibiograma) o en todas las fases del laboratorio48. A la luz de la evidencia científica actualizada disponible y las buenas prácticas del laboratorio, el control de calidad interno no es el control de la calidad externo ni lo sustituye49. La OMS recomienda que los países tengan programas de evaluación externa de la calidad de ámbito nacional que permitan asesorar, entrenar y facilitar la formación continua, así como evaluar la fase analítica, la interpretación de las pruebas, el asesoramiento a los prescriptores sobre peticiones de laboratorio, el valor diagnóstico de las pruebas y la vigilancia de los equipos de diagnóstico i n vitro d isponibles en el mercado47.
Recomendación 5
Se recomienda disponer de un sistema de gestión de datos de prescripción de antimicrobianos a nivel de farmacia para apoyar la gestión del PROA, que incluya la siguiente información:
• Datos de prescripción.
• Datos de prescripción por patología infecciosa.
• Indicadores de consumo de antimicrobianos en forma periódica.
• Información sobre el inventario de antimicrobianos para la compra.
Nivel de evidencia: Moderado (II) Fuerza de la recomendación: Fuerte
Justificación
Los antimicrobianos representan más de 30% de los presupuestos de la farmacias hospitalarias50. La medición rutinaria y la visualización de información sobre el consumo de estos medicamentos por parte de prescriptores y tomadores de decisiones es una estrategia fundamental para generar conciencia sobre la importancia de su uso adecuado51.
Contar con información sobre el consumo permite determinar tendencias y evaluar causas de posibles desviaciones. Las magnitudes esperadas de consumo generan información útil para planear la compra de antimicrobianos. Así mismo, al retroalimentar a los prescriptores acerca de las magnitudes de consumo de antimicrobianos de amplio espectro o de mayor presión selectiva, se puede incidir de manera indirecta en los hábitos de prescripción, siendo una forma potencial de intervención.
La prescripción y el consumo de antimicrobianos permite evaluar la dinámica en la formulación hospitalaria por parte de los prescriptores, correlacionar el consumo con la adherencia a guías, determinar tendencias de uso y su posible relación con la selección de microorganismos resistentes, y establecer planes de compra a mediano y largo plazo52–54. Siempre que sea posible, todos los PROA deberían medir el consumo de antimicrobianos de alguna forma, usando indicadores. Algunos de ellos son las dosis diarias definidas (DDD), los días de terapia (days of therapy, DOT por sus siglas en inglés) y el tiempo de terapia (length of therapy, LOT por sus siglas en inglés).
La DDD se usa para medir el consumo de antimicrobianos tomando como numerador la suma total de gramos o miligramos de un antimicrobiano comprado, dispensado o administrado y como denominador la multiplicación de la constante DDD según la define la OMS (= dosis diaria media prevista para un fármaco, utilizada para su indicación principal en un adulto con función renal normal), por la ocupación, por el número de camas y por el tiempo en el que se generó el consumo del antimicrobiano (a partir de un mes o más, generalmente).
La mayoría de los departamentos de farmacia de los hospitales tienen un método para calcular la cantidad de cada uno de los antimicrobianos que se recetan o dispensan, y la OMS publica los valores de DDD de los anti-
microbianos (www.whocc.no/tc_ddd_index). El consumo en DDD es una medida útil para ver el impacto del PROA en consumo de antimicrobianos a corto y mediano plazo, a pesar de tener algunas limitaciones como ser menos precisa que los DOT y no ser conveniente en pacientes pediátricos, y que puede variar según la vía de administración sistémica de un fármaco, sea oral o parenteral.
Los DOT son la cantidad de días en los que un paciente recibe al menos una dosis de un antimicrobiano, y se suman los días de cada antimicrobiano en una terapia combinada, sobre el total de días de estancia hospitalaria de todos los pacientes, independientemente de si tienen o no antimicrobianos formulados. Es el indicador escogido por muchos hospitales para medir el consumo55. Sin embargo, muchos hospitales no pueden calcular los DOT fácilmente, porque necesitan los datos de los pacientes organizados en registros médicos electrónicos, siendo su recolección manual más difícil y con mayor inversión de tiempo del talento humano.
La LOT es la cantidad de días en los que un paciente recibe tratamiento antimicrobiano, independientemente de la cantidad de antimicrobianos que se administran. Este indicador de tipo razón brinda una evaluación precisa
de la duración real de la terapia antimicrobiana. LOT y DOT no son iguales, ya que en la primera es irrelevante cuántos antimicrobianos reciba un paciente y registra intervalos de dosis mayores a las 24 horas56.
Recomendación 6
Se recomienda disponer de un sistema de gestión de datos de prescripción de antimicrobianos a nivel de farmacia, que incluya la siguiente información, para dirigir la terapia clínica:
• Alertas de seguridad.
• D osis.
• Ajuste de dosis.
• M omento de administración.
• Forma/vía de administración.
• Interacciones medicamentosas.
• Reacciones adversas a medicamentos y problemas re-
lacionados con el uso de medicamentos.
• Duración de la administración del antimicrobiano.
• Gestión de los antimicrobianos con la herramienta AWaRe [Access (acceso) - Watch (vigilancia) - Reserve (último recurso)] de la OMS, o gestión de los antimicrobianos, de acuerdo con las resistencias y necesidades de cada hospital.
Nivel de evidencia: Moderado (II)
Fuerza de la recomendación: Fuerte
Justificación
Se estima que 56% de los errores en la formulación ocurren durante la prescripción de un medicamento, 34% en la administración, 6% en la transcripción y 4% en la dispensación del mismo57. Un porcentaje importante de estos errores son evitables o prevenibles. Contar con un sistema de gestión de datos en farmacia puede identificar todos los errores y su frecuencia, para desarrollar estrategias de mejoramiento continuo en el uso seguro de medicamentos.
Existen algunos aspectos importantes bajo la perspectiva clínica que deben ser tenidos en cuenta para la vigilancia/reporte de la información. El retraso en la administración de la primera dosis está relacionado con un incremento en la mortalidad, especialmente en infecciones graves, y por esta razón se deben implementar medidas para garantizar un rápido acceso al antimicrobiano adecuado58–60. También es necesario garantizar la sostenibilidad en la administración del antimicrobiano y en el horario pertinente, teniendo en cuenta la naturaleza del mismo, la vía de administración, la posibilidad de infusión prolongada extendida y las posibles interacciones medicamentosas que puedan ocurrir en los pacientes, teniendo en cuenta las dosis de carga (si son requeridas), la presentación/concentración del antimicrobiano, la vida media del medicamento y los requerimientos para su transporte y almacenamiento. La farmacia desempeña un papel fundamental desde el PROA en la identificación sistemática precoz de problemas relacionados con el uso de medicamentos, reacciones adversas e interacciones farmacológicas.
Por otra parte, en el año 2019 la OMS lanzó una campaña global para animar a los gobiernos a adoptar la herramienta AWaRe (https://adoptaware.org/), que tiene como objetivo general reducir la resistencia a los anti-
microbianos, los costos y los eventos adversos asociados, así como el uso inapropiado de antimicrobianos, logrando un uso más seguro y efectivo. AWaRe clasifica los antimicrobianos en tres grupos: acceso, vigilancia y reserva; además, especifica cuáles deben usarse para las infecciones más comunes y graves. La herramienta contiene información de los llamados “antimicrobianos de acceso”, aquellos que deberían estar disponibles en cualquier momento en todos los sistemas de atención médica. Adicionalmente define “antimicrobianos bajo vigilancia” (los que deberían usarse con moderación) y los de “último recurso” (de reserva por su potencial daño colateral por selección de microorganismos resistentes). Al clasificar a los antimicrobianos en tres grupos distintos y sugerir cuándo usarlos, AWaRe facilita que los prescriptores, el personal de salud y las entidades reguladoras del uso de medicamentos en los países tengan una orientación para seleccionar el antimicrobiano correcto, en el momento adecuado y con el menor daño colateral posible.
Recomendación 7
Se recomienda que bajo el concepto “Gestión de datos avanzados” queden incluidos los siguientes ítems:
• D esarrollo, implementación y actualización de herramientas informáticas para integrar datos microbiológicos y de prescripción con la historia clínica.
• Interoperabilidad de herramientas informáticas que gestionen las distintas estrategias de PROA.
• Uso de herramientas informáticas para investigación, educación, evaluación comparativa y difusión de la información.
Nivel de evidencia: Moderado (II) Fuerza de la recomendación: Fuerte
Justificación
Los datos en una institución de salud derivan de un conjunto de unidades y registros dentro del sistema hospitalario como el laboratorio clínico, la historia clínica electrónica, la farmacia y el servicio de imágenes diagnósticas7.
Diariamente, el laboratorio de microbiología clínica produce, analiza e interpreta una cantidad importante y generalmente creciente de información. Incorporar herramientas informáticas para mejorar la calidad del trabajo
y los procesos del laboratorio es primordial para que los datos sean evaluados y comunicados de manera eficiente, mejorando la calidad del flujo de trabajo y optimizando los sistemas operativos7,61. La implementación y el correcto uso de herramientas informáticas permite que los laboratorios puedan producir, interpretar y comunicar la información, colaborando con el médico prescriptor en la selección de la terapia antimicrobiana apropiada, impactando en la seguridad del paciente y en la salud pública. Estudios han demostrado que el uso adecuado de herramientas informáticas puede mejorar la eficiencia, exactitud, precisión y oportunidad del diagnóstico microbiológico7,25. Adicionalmente, un sistema de gestión de datos microbiológicos permite el seguimiento en el tiempo de la información, generando datos consolidados, vigilancia microbiológica, informes acumulados de susceptibilidad in vitro a los antimicrobianos, tendencias, alertas de microorganismos multirresistentes y, a largo plazo, permite determinar tendencias regionales y nacionales del estado de la resistencia antimicrobiana en patógenos de importancia en salud pública25.
Cada hospital debería tener una asignación presupuestal aprobada por la gerencia para garantizar la inclusión de herramientas informáticas y soluciones que permitan, desde el laboratorio de microbiología, integrar la infor-
mación para una interpretación y análisis pertinente de los datos.
41 Universidad El Bosque, Colombia.
Glosario
• CIM: Concentración Inhibitoria Mínima.
• CLSI (por sus siglas en inglés): Instituto Americano de Estándares Clínicos y de Laboratorio.
• D DD: Dosis Diaria Definida.
• D OT (por sus siglas en inglés): Días de Terapia.
• EUCAST (por sus siglas en inglés): Comité Europeo de Pruebas de Susceptibilidad Antimicrobiana.
• FC (PK): Farmacocinética.
• F D (PD): Farmacodinamia.
• IAAS: Infecciones Asociadas a la Atención de la Salud.
• LOT (por sus siglas en inglés): Tiempo de Terapia.
• M DR: Microorganismos Multidrogorresistentes.
• OMS: Organización Mundial de la Salud.
• O PS: Organización Panamericana de la Salud.
• PROA: Programas de Optimización del Uso de Antimicrobianos.
• R AM: Resistencia Antimicrobiana.
• R PC (PCR): Reacción de la Polimerasa en Cadena.
• SDD: Susceptibilidad Dosis Dependiente.
• T DM (por sus siglas en inglés): Monitoreo Terapéutico de los Antimicrobianos.
• UCI: Unidad de Cuidado Intensivo.
Agradecimientos: Los autores agradecen a API y bioMérieux por su colaboración.
REFERENCIAS BIBLIOGRÁFICAS
1 Fair R J, Tor Y. Antibiotics and bacterial resistance in the 21st Century. Perspect Medicin Chem. 2014; 6: 25-64. doi: 10.4137/PMC.S1445_9.
2 Graber C J, Jones M M, Goetz M B, Madaras-Kelly K, Zhang, Butler J M, et al. Decreases in antimicrobial use associated with multihospital implementation of electronic antimicrobial stewardship tools. Clin Infect Dis. 2020; 71(5): 1168-76.doi:10.1093/cid/ciz941.
3 Fleming-Dutra K E, Hersh A L, Shapiro D J, Bartoces M, Enns E A, File Jr T M, et al. Prevalence of inappropriate antibiotic prescriptions among US ambulatory care visits, 2010-2011. J Emerg Med. 2016; 51(3): 337. doi:10.1001/jama.2016.4151.
4 Falagas M E, Tansarli G S, Karageorgopoulos D E, Vardakas KZ. Deaths attributable to carbapenem-resistant Enterobacteriaceae infections. Emerg Infect Dis. 2014 (July); 20(7): 1170-75. doi: 10.3201/eid2007.121004.
5 Gerding, D N. The search for good antimicrobial stewardship. JT Comm J Qual Improv. 2001; 27: 403-4. doi: 10.1016/s1070-3241(01)27034-5.
6 Wagner B, Filice G A, Drekonja D, Greer N, MacDonald R, Rutks I, et al. Antimicrobial stewardship programs in inpatient hospital settings: a systematic review. Infect Control Hosp Epidemiol. 2014 (October);35(10): 1209-28. doi: 10.1086/678057.
7 Rhoads D D, Sintchenko V, Rauch C A, Pantanowitz L. Clinical microbiology informatics. Clin Microbiol Rev. 2014; 27(4): 1025-47. doi: 10.1128/CMR.00049-14.
8 Yu V L, Fagan L M, Wraith S M, Clancey W J, Scott A C, Hannigan J, et al. Antimicrobial selection by a computer. a blinded evaluation by infectious diseases experts. JAMA. 1979 (September); 242(12): 1279-82. PMID: 480542.
9 Lau A F, Drake S K, Calhoun L B, Henderson C M, Zelazny AM. Development of a clinically comprehensive database and a simple procedure for identification of molds from solid media by Matrix-assisted Laser Desorption Ionization-time of Flight mass spectrometry. J Clin Microbiol. 2013; 51(3): 828-34. doi: 10.1128/JCM.02852-12.
10 Shaw R, Coia J E, Michie J. Use of bar code readers and programmable keypads to improve the speed and accuracy of manual data entry in the clinical microbiology laboratory: experience of two laboratories. J Clin Pathol. 1999; 52(1): 54-60. doi: 10.1136/jcp.52.1.54.
11 Scheid P, Lam D M, Thömmes A, Zöller L. Telemicrobiology: A novel telemedicine capability for mission support in the field of infectious medicine. Telemed J e-Health [Internet]. 1.° de abril del 2007; 13(2): 108-17. doi: 10.1089/tmj.2007.0043.
12 Martínez Sahuquillo A M, Echevarría Ruiz de Vargas M C. Métodos de consenso. Uso adecuado de la evidencia en la toma de decisiones. «Método RAND/UCLA». Rehabilitación (Madrid). 2001; 35(6): 388-92. ID:ibc-566. https://doi.org/10.1016/S0048-7120(01)73220-3.
13 Andrews J C, Schünemann H J, Oxman A D, Pottie K, Meerpohl J J, Coello P A, et al. GRADE Guidelines: 15. Going from evidence to recommendation-determinants of a recommendation’s direction and strength. J Clin Epidemiol, 66 (2013): 726-35. doi: 10.1016/j.jclinepi.2013.02.003.
14 Coello P A, Rigaua D, Sanabria A J, Plazac V, Miravitlles M, Martinez L. Quality and strength: The GRADE system for formulating recommendations in clinical practice guidelines. Arch Bronconeumol. 2013;(49): 261-7. doi: 10.1016/j.arbres.2012.12.001.
15 Guyatt G H, Oxman A D, Kunz R, FalckYtter Y, Vist G E, Liberati A, et al. GRADE Working Group. Going from evidence to recommendations. Br Med J. 2008; 336: 1049-51. doi:10.1136/ bmj.39493.646875.AE.
16 AGREE Collaboration. Development and validation of an international appraisal instrument for assessing the quality of clinical practice guidelines: The AGREE Project. Qual Saf Health Care. 2003; 12: 18-23. doi: 10.1136/qhc.12.1.18.
17 Brouwers M, Kho M E, Browman G P, Burgers J S, Cluzeau F, Feder G., Graham I D, et al. Development of the AGREE II. Part 1: Performance, usefulness and areas for improvement. Can Med Assoc J. 2010; 182: 1045-52. doi: 10.1503/cmaj.091714.
18 Brouwers M, Kho M E, Browman G P, Burgers J S, Cluzeau F, Feder G, et al. Development of the AGREE II. Part 2: Assessment of validity of items and tools to support application. Can Med Assoc J. 2010; 182: E472- E478. doi: 10.1503/cmaj.091716.
19 Brouwers M, Kho M E, Browman G P, Burgers J S, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. J Clin Epidemiol. 2010; 63: 130811. doi: 10.1016/j.jclinepi.2010.07.001.
20 Varela-Ruiz M, Diaz-Bravo L, García-Durán R. Descripción y usos del método Delphi en investigaciones del área de la salud. Inv Ed Med. 2012; 1(2): 90-5. Disponible en: http://riem.facmed.unam.
mx/index.php/riem/article/view/467
21 Tacconelli E, Sifakis F, Harbarth S, Schrijver R, Mourik M V, Voss A, et al. Surveillance for control of antimicrobial resistance. Lancet Infect Dis. 2018; 18: e99-e106. doi: 10.1016/S14733099(17)30485-1.
22 Bielicki J A, Sharland M, Johnson A P, Henderson K L, Cromwell D A. Selecting appropriate empirical antibiotic regimens for pædiatric bloodstream infections: application of a Bayesian decision model to local and pooled antimicrobial resistance surveillance data. J Antimicrob Chemother. 2016; 71: 794-802. doi: 10.1093/jac/dkv397.
23 World Health Organization (WHO). Global Antimicrobial Resistance Surveillance System (GLASS) Report: Early Implementation 2017-2018. Ginebra: World Health Organization, 2018.ISBN 978-924-151506-1
24 Sayed S, Cherniak W, Lawler M, Tan S Y Sadr W E, Wolf N, et al. Improving pathology and laboratory medicine in low-income and middle-income countries: roadmap to solutions. Lancet. 2018; 391: 1939-52. doi: 10.1016/S0140-6736(18)30459-8.
25 Stelling J, O’Brien T. Surveillance of antimicrobial resistance: The WHONET Program. Clin Infect Dis. 1997; 19: 24(Suppl. 1):157-68. doi: 10.1093/clinids/24.supplement_1.s157.
26 O’Brien T F, Clark A, Peters R, Stelling J. Why surveillance of antimicrobial resistance needs to be automated and comprehensive. J Glob Antimicrob Resist. 2019; 17: 8-15. doi: 10.1016/j. jgar.2018.10.011.
27 Turner P, Rupali P, Opintan J A, Jaoko W, Feasey N A, Peacock S J, et al. Laboratory informatics capacity for effective antimicrobial resistance surveillance in resource-limited settings. Lancet Infect Dis. 2021 (June); 21(6): e170-e174. doi: 10.1016/S1473-3099(20)30835-5.
28 Muñoz J S, Motoa G, Escandón-Vargas K, Bavestrello L, Quirós R, Hernández C, et al. Current antimicrobial stewardship practices in Latin America: where are we? Open Forum Infect Dis. 2015 (December); 2: Suppl. 1: 192. doi: 10.1093/ofid/ofv133.69.
29 Paxton, A. Finally, microbiology labs getting a lift from it. CAP Today. 2012; 26: 32-40. http:// www.captodayonline.com/Archives/0512/0512f_finally.html
30 Hindler, J F, Stelling J. Analysis and presentation of cumulative antibiograms: a new consensus guideline from the Clinical and Laboratory Standards Institute. Clin Infect Dis. 2007; 44: 867-73. doi: 10.1086/511864.
31 Simner P J, Hindler J A, Bhowmick T, Das S, Johnson J K, Lubers B V, et al. What’s new in antibiograms? Updating CLSI M39 guidance with current trends. J Clin Microbiol. 2022 (October 19); 60(10): e0221021. doi: 10.1128/jcm.02210-21. Epub 2 de agosto del 2022. PMID: 35916520; PMCID: PMC9580356.
32 Winstanley T, Courvalin P. Expert systems in clinical microbiology. Clin Microbiol Rev. 2011; 24: 515-56. http://dx.doi.org/10.1128/CMR.00061-10.
33 Paterson, D L, Bonomo RA. Extended-spectrum beta-lactamases: a clinical update. Clin Microbiol Rev. 2005; 18: 657-86. doi: 10.1128/CMR.18.4.657.686.2005.
34 Astion M L, Shojania K G, Hamill T R, Kim S, Ng VL. Classifying laboratory incident reports to identify problems that jeopardize patient safety. Am J Clin Pathol. 2003; 120: 18-26. doi: 10.1309/8U5D0MA6MFH2FG19.
35 Morris A J, Haremza E, Walker D A. The frequency and potential clinical impact of non-analytical errors in the RCPA microbiology QAP 1987-2008. Pathology. 2011; 43: 346-9. doi: 10.1097/PAT. 0b013e32834634f4.
36 Castanheira M, Simner P J, Bradford PA. Extended-spectrum β-lactamases: an update on their characteristics, epidemiology and detection. JAC. Antimicrob Resist. 2021 (July 16); 3(3): dlab092. doi: 10.1093/jacamr/dlab092. PMID: 34286272; PMCID: PMC8284625.
37 Villegas M V, Jiménez A, Esparza G, Appel TM. Carbapenemase-producing Enterobacteriaceae: a diagnostic, epidemiological and therapeutic challenge. Infectio 2019; 23(4): 388-97. https://doi. org/10.22354/in.v23i4.808.
38 Messacar K, Hurst A l, Child J, Campbell K, Palmer C, Hamilton S, et al. Clinical impact and provider acceptability of real-time antimicrobial stewardship decision support for rapid diagnostics in children with positive blood culture results. J Ped Infect Dis Soc. 2017; 6(3): 267-74. doi: 10.1093/ jpids/piw047.
39 Barlam T F, Cosgrove S E, Abbo L M, MacDougall C, Schuetz A N, Septimus E J, et al. Implementing an antibiotic stewardship program: Guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America. Clin Infect Dis. 2016; 62(10): e51-e77. doi: 10.1093/cid/ciw118.
40 Pardo J, Klinker K P, Borgert S J, Butler B M, Giglio P G, Rand K H. Clinical and economic impact of antimicrobial stewardship interventions with the FilmArray® blood culture identification panel. Diagn Microbiol Infect Dis. 2016; 84(2): 159-64. doi: 10.1016/j.diagmicrobio.2015.10.023.
41 Levy M M, Evans L E, Rhodes A. The surviving sepsis campaign bundle: 2018 Update. Intensive Care Med 2018; 44: 925-8. doi: 10.1007/s00134-018-5085-09.
42 Cantón R. Lectura interpretada del antibiograma: Una necesidad clínica. Enferm Infecc Microbiol Clin. 2010; 28(6): 375-85. doi: 10.1016/j.eimc.2010.01.001.
43 Cuesta D, Blanco V, Vallejo M, HernándezGómez C, Maya J, Motoa G, et al. Impacto clínico del desescalamiento a ertapenem en pacientes críticos con infecciones por Enterobacteriaceæ. Rev Chilena Infectol. 2019; 36(1): 9-15. doi: 10.4067/S0716-10182019000100009.
44 Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing: Nineteenth Informational Supplement. Wayne, PA: CLSI, 2018. ISBN: 978-1-68440009-6.
45 Navarro F, Calvo J, Cantón R, Fernández F, Mirelis B. Detección fenotípica de mecanismos de resistencia en Gram-negativos. Enferm Infecc. Microbiol Clin. 2011; 29 (7): 524-34. doi: 10.1016/j. eimc.2011.03.011.
46 Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Approved Standard. Twenty-second informational supplement. Wayne, PA: CLSI, 2012.
47 Ebbert M T, Mallory M A, Wilson A R, Dooley S K, Hillyard D R. Application of a new informatics tool for contamination screening in the HIV sequencing laboratory. J Clin Virol. 2013; 57: 249-53. doi: 10.1016/j.jcv.2013.03.013
48 World Health Organization (WHO). External quality assessment of health laboratories. Regional Office for Europe. Euro Reports and Studies 36. Copenhagen, 1979. https://books.google.cl/books/ about/External_Quality_Assessment_of_Health_La.html?id=GQsmAQAAMAAJ&redir_esc=y
49 Asociación Española de Normalización y Acreditación (AENOR). Utilización de programas de evaluación externa de la calidad en la evaluación del desempeño de los procedimientos de diagnóstico in vitro. Madrid: AENOR, 2004. UNE-EN 14136: 2004. https://www.en-standard.eu/ bs-en-14136-2004-useof-external-quality-assessment-schemes-inthe-assessment-of-the-performance-of-in-vitro-diagnostic-examination-procedures/
50 Perich C, Álvarez A I, Blázquez R, Calafell R, Cobo M J, Cuadrado M A, et al. Aplicación práctica del control interno de la calidad en los procedimientos de medida cuantitativos. Rev Lab Clin. 2014; 7: 25-32. doi: 10.1016/j.labcli.2013.12.001.
51 Álvarez C A, Osorio L, Correa C, González M. Impact of a program of rational use of antibiotics in a teaching hospital. 42th Annual Meeting of the Infectious Diseases Society of America. Boston: IDSA, octubre del 2004. doi: 10.1186/s12879-022-07410-6.
52 Hutchinson J, Patrick D, Marra F, Helen N, Bowie W, Heule L, et al. Measurement of antibiotic consumption: a practical guide to the use of the anatomical therapeutic chemical classification and defined daily dose system methodology in Canada. Can J Infect Dis. 2004;15(1): 29-35. doi: 10.1155/2004/389092.
53 Doron S, Davidson LE. Antimicrobial stewardship. Mayo Clin Proc. 2011; 86(11): 1113-23. doi: 10.4065/mcp.2011.0358.
54 Patel D, Macdougall C. How to make antimicrobial stewardship work: practical considerations for hospitals of all sizes. Hosp Pharm. 2010; 45(Suppl.11): 10-21. doi: 10.131/hpj4511-s10.
55 Akpan M R, Ahmad R, Shebl, N A, AshiruOredope D. A review of quality measures for assessing the impact of antimicrobial stewardship programs in hospitals. Antibiotics (Basilea, Suiza). 2016; 5(1): 5. doi: 10.3390/antibiotics5010005.
56 Public Health Ontario. Antimicrobial Stewardship Programs (ASPs) - Metrics Examples. Disponible en: https://www.publichealthontario.ca/-/media/Documents/A/2017/asp-metrics-examples. pdf?rev=3ffae02421fd44f4882dbe36fcaa10af&sc_lang=en, consultado en febrero del 2023.
57 Polk R E, Hohmann S F, Medvedev S, Ibrahim O. Risk-adjusted adult antibacterial drug use in 70 US academic medical center hospitals. Clin Infect Dis. 2011; 53(11): 1100-10. doi: 10.1093/cid/ cir672.
58 Bates D W, Cullen D J, Laird N, Petersen L A, Small S D, Servi D, et al. Incidence of adverse drug events and potential drug events. Implications for prevention. JAMA. 1995; 274: 29-34. PMID: 7791255.
59 Kollef M H, Sherman G, Ward S, Fraseet VJ. Inadequate antimicrobial treatment of infections: a risk factor for hospital mortality among critically ill patients. Chest. 1999;115: 462-74. doi: 10.1378/ chest.115.2.462.
60 Kumar A, Roberts D, Wood K E, Light B E, Parrillo J E, Sharmaet S. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006; 34: 1589-96. doi: 10.1097/01.CCM.0000217961.75225.E9.
61 Paul M, Shani V, Muchtar E, Kariv G, Robenshtok E, Leibovici L. Systematic review and meta-analysis of the efficacy of appropriate empirical antibiotic therapy for sepsis. Antimicrob Agents Chemother. 2010; 54: 4851-63. doi: 10.1128/AAC.00627-10.
Bremmer D N, Trienski T L, Walsh T L, Moffa M A. Role of technology in antimicrobial stewardship. Med Clin North Am [Internet]. 2018; 102(5): 955-63. doi: 10.1016/j.mcna.2018.05.007.
Correspondencia a: Christian José Pallares Gutiérrez icako@hotmail.com
Coordinación editorial: Integralis HGS (doctores Daniel Rodríguez y María Stella Salazar), Colombia.
Conflictos de interés: C. J. P. G. ha actuado como consultor, conferencista y ha recibido apoyo financiero como patrocinio de investigación y asistencia científica de Pfizer, S. A. S., Merck Sharp and Dohme, Westquimica, BioMérieux y 3M durante los años 2020 al 2023. M. V. V. B. ha actuado como consultor y conferencista, y ha recibido apoyo financiero para patrocinio de investigación y asistencia científica, y patrocinio para actividades educativas por parte de Pfizer S. A. S, Merck Sharp and Dohme (MSD), Westquímica y BioMérieux durante los años 2020 al 2023. G. E. ha actuado como consultor y conferencista, y ha recibido apoyo financiero para patrocinio de investigación, asistencia científica y actividades educativas por parte de Pfizer, S. A. S., Merck Sharp and Dohme (MSD), BioMérieux, Stendhal y Becton Dickinson (BD) durante los años 2020 al 2023. D. de L. ha recibido patrocinio para actividades educativas y honorarios como ponente por parte de Pfizer, S. A. S. durante los años 2020 al 2023. P. F. de P. ha actuado como consultor y conferencista, y ha recibido apoyo financiero para patrocinio de investigación, asistencia científica y actividades educativas de Pfizer, S. A. S., Merck Sharp and Dohme (MSD), Becton Dickinson (BD), BioMérieux, Cepheid y Beckman Coulter durante los años 2019 al 2023. L. E. H. ha recibido patrocinio para actividades educativas y honorarios como ponente de BioMérieux durante los años 2020 al 2023. P. F. C. ha actuado como conferencista para Pfizer, S. A. S. durante los años 2020 al 2023. J. A. R. C. ha actuado como consultor para BioMérieux durante los años 2020 al 2023. D. B. ha actuado como consultor y conferencista, y ha recibido apoyo financiero como patrocinio de investigación, asistencia científica y actividades educativas de BioMérieux durante los años 2020 al 2023. G. L. ha sido conferencista para BioMérieux durante los años 2020 al 2023. P. A. ha recibido apoyo financiero para patrocinio de actividades educativas por parte de BioMérieux durante los años 2020 al 2023. R. E. Q. ha actuado como consultor y conferencista, y ha recibido apoyo financiero para patrocinio de investigación y asistencia científica por parte de Merck Sharp and Dohme (MSD) y BioMérieux durante los años 2020 al 2023. P. L. ha actuado como consultor para la Organización Panamericana de Salud (OPS) durante los años 2020 al 2023. M. T. ha actuado como consultor para la Asociación Panamericana de Infectología (API) durante los años 2020 al 2023. F. R. ha actuado como consultor y conferencista para Merck Sharp and Dohme (MSD), BioMérieux y Snibe durante los años 2020 al 2023.
Creative Commons License This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License, which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Diestro en CALILAB 2024: Un Compromiso con la Excelencia
En esta nueva edición del evento más relevante de calidad en laboratorios clínicos de América Latina, CALILAB, que tendrá lugar del 6 al 8 de noviembre en Buenos Aires, Diestro exhibirá su familia de analizadores de electrolitos Versión 4, incluyendo el nuevo modelo V4r recientemente presentado en el mercado. Y reafirmando su compromiso con la comunidad bioquímica, será auspiciante de una conferencia clave en el Simposio de la Industria que impacta directamente
en la práctica clínica.
Nos llena de orgullo poder invitar a todos los bioquímicos a participar de este evento y de la conferencia “Calcio iónico vs calcio total: desafíos analíticos y relevancia clínica”.
El 7 de noviembre a las 13:30, en la sala VIP 1 del Simposio de la Industria de CALILAB 2024, contaremos con
la presencia de la Dra. Andrea Bocassi, Jefa del Laboratorio de Bioquímica del Hospital Muñiz, Secretaria del Capítulo Bioquímico de la Sociedad Argentina de Terapia Intensiva y reconocida por su experiencia en Bioquímica Clínica, especialmente en el área de Química Clínica.
La conferencia se centrará en un tema crucial para la toma de decisiones en la rutina diaria de los laboratorios clínicos. La concentración de calcio en el líquido extracelular y en los tejidos blandos del organismo se mantiene en un estrecho rango que está regulado por mecanismos homeostáticos, un desbalance en los niveles sanguíneos tales como hipercalcemias o hipocalcemias pueden constituir una verdadera emergencia.
En la rutina, la valoración de este ion suele llevarse a cabo a través de la determinación del calcio total, sin embargo, esto puede conducir a conclusiones y decisiones inadecuadas para el paciente ya que es la fracción libre la fisiológicamente activa.
La participación en la conferencia es totalmente gratuita para todos los asistentes de CALILAB 2024, aunque los cupos son limitados. La duración será de aproximadamente 1 hora, lo que permitirá compartir un servicio de lunch box de dos pasos acompañado de una bebida.
Para asegurarse un lugar en este evento exclusivo, lo invitamos a registrarse de manera anticipada a través del siguiente enlace: https://bit.ly/calilab-2024
Innovación tecnológica al servicio del análisis preciso
Los analizadores de electrolitos de Diestro han sido diseñados con el objetivo de proporcionar mediciones confiables y consistentes, con una interfaz intuitiva que se adapta a las necesidades de los usuarios. Desde pequeños laboratorios independientes hasta grandes hos-
pitales, la familia V4 ha demostrado ser una solución versátil que permiten obtener resultados de alta calidad, optimizando los tiempos de trabajo y mejorando la precisión de los diagnósticos.
Únase a la comunidad Diestro en CALILAB
En CALILAB 2024, Diestro estará presente como lo hace desde las primeras ediciones, en el stand 4 ubicado en el nivel 2, donde podrá conocer de cerca sus instrumentos, conversar con los expertos y conocer de primera mano las soluciones que pueden transformar su laboratorio.
Pero más allá de la tecnología, el enfoque está en los profesionales, que cada día enfrenta el reto de ofrecer diagnósticos más precisos y eficaces. Por eso, la conferencia de la Dra. Bocassi será una gran oportunidad para profundizar en un tema relevante en su práctica profesional.
No solo tendrá la oportunidad de actualizarse sobre los avances más recientes en la medición del calcio iónico, sino que también podrá intercambiar ideas y experiencias con colegas que comparten su compromiso con la calidad diagnóstica.
Una comunidad. Dos ferias. El mismo compromiso.
Con este lema, Diestro se complace de anunciar su participación en CALILAB 2024 y MEDICA Trade Faire.
El compromiso con la comunidad bioquímica trasciende fronteras, por eso además de su participación en CALILAB 2024, también estará presente en la Medica Trade Fair 2024 en Düsseldorf, Alemania, del 12 al 15 de noviembre. En este evento, que es la feria médica más importante del mundo, Diestro continuará afianzando su posición como un jugador global en el diagnóstico clínico.
FORMACIÓN CON MODALIDAD A DISTANCIA
Western Blot
On demand - Organiza Biocealab cursos@biocealab.com www.biocealab.com
Curso de Actualización en Psicofarmacología
Consultar fecha de inicio (cada módulo prevé una dedicación de 120 horas distribuidas en 3 meses)
Organiza COFyBCF (Colegio Oficial de Farmacéuticos y Bioquímicos de la Capital Federal) bioquimicos@cofybcf.org.ar educacioncontinua@cofybcf.org.ar www.cofybcf.org.ar
Curso sobre Micología Médica Inscripciones abiertas
Organiza Fundación Química Argentina info@fundacionquimica.org.ar
Manejo Práctico de las Alteraciones del Ciclo y Amenorreas
Contarán con 120 días para completar el curso administracion@saegre.org.ar saegre@saegre.org.ar www.saegre.org.ar/curso_online_amenorreas.asp
El laboratorio en Endocrinología Ginecológica y Reproductiva
Contarán con 90 días para completar el curso. administracion@saegre.org.ar saegre@saegre.org.ar www.saegre.org.ar/curso_online_laboratorio.asp
Taller de Comprensión lectora en Inglés
Consultar fecha de inicio Cobico (Colegio Bioquímico de Córdoba) cobico@cobico.com.ar www.cobico.com.ar
Curso de Inglés para Profesionales de la Salud
Consultar fecha de inicio Cobico (Colegio Bioquímico de Córdoba) cobico@cobico.com.ar www.cobico.com.ar
Curso de PCR Intensivo
On - demand +54 911 3399-5049 https://biocealab.com/courses/curso-de-pcr-intensivo/
Climaterio. Abordaje integral en Prevención y tratamiento
Contarán con 120 días para completar el curso
Organiza SAEGRE (Sociedad Argentina de Endocrinología Ginecológica y Reproductiva) congresosaegre@gmail.com http://saegre.org.ar/curso_online_climaterio.asp
Disruptores endócrinos. Impactos en la Salud
Contarán con 120 días para completar el curso
Organiza SAEGRE (Sociedad Argentina de Endocrinología Ginecológica y Reproductiva) congresosaegre@gmail.com http://saegre.org.ar/curso_online_disruptores.asp
Endocrinopatías y Embarazo
Contarán con 120 días para completar el curso
Organiza SAEGRE
(Sociedad Argentina de Endocrinología Ginecológica y Reproductiva) congresosaegre@gmail.com http://saegre.org.ar/curso_online_endocrinopatias.asp
Nuevos enfoques en el manejo del dolor pelviano crónico y endometriosis
Contarán con 120 días para completar el curso
Organiza SAEGRE
(Sociedad Argentina de Endocrinología Ginecológica y Reproductiva) congresosaegre@gmail.com http://saegre.org.ar/curso_online_endometriosis.asp
Diagnóstico y manejo práctico de la Osteoporosis
Contarán con 90 días para completar el curso
Organiza SAEGRE
(Sociedad Argentina de Endocrinología Ginecológica y Reproductiva) congresosaegre@gmail.com http://saegre.org.ar/curso_online_osteoporosis.asp
Sexualidad en la mujer
Contarán con 120 días para completar el curso
Organiza SAEGRE (Sociedad Argentina de Endocrinología Ginecológica y Reproductiva) congresosaegre@gmail.com http://saegre.org.ar/curso_online_sexualidad.asp
SOP. Síndrome de ovario poliquístico. Diagnóstico y tratamiento
Contarán con 120 días para completar el curso
Organiza SAEGRE (Sociedad Argentina de Endocrinología Ginecológica y Reproductiva) congresosaegre@gmail.com http://saegre.org.ar/curso_online_sop.asp
Las enfermedades tiroideas en el ciclo de la vida de la mujer
Contarán con 90 días para completar el curso
Organiza SAEGRE (Sociedad Argentina de Endocrinología Ginecológica y Reproductiva) congresosaegre@gmail.com http://saegre.org.ar/curso_online_tiroides.asp
Programa de Capacitación en Inglés para profesionales de la Salud (Nivel básico, intermedio y avanzado)
Inscripciones abiertas cursos@mednet.com.ar https://campus.mednet.com.ar/mod/page/view. php?id=5688
Actualización en Salud Reproductiva Masculina
On demand Organiza SAEGRE (Sociedad Argentina de Endocrinología Ginecológica y Reproductiva) congresosaegre@gmail.com https://saegre.org.ar/curso_online_repro_masculina.asp
Curso Online de Formación Avanzada en Atención de Medicina Transgénero
Curso autoadministrado, 90 días para completar el curso.
Organiza SAEGRE (Sociedad Argentina de Endocrinología Ginecológica y Reproductiva) congresosaegre@gmail.com https://www.saegre.org.ar/curso_online_transgenero.asp
Anticoncepción. “Lo que necesitás saber”
Curso autoadministrado, 90 días para completar el curso. Organiza SAEGRE (Sociedad Argentina de Endocrinología Ginecológica y Reproductiva) congresosaegre@gmail.com https://www.saegre.org.ar/curso_online_anticoncepcion.asp
Reedición 2024 - Curso Virtual Investigación de las Desviaciones de los Resultados Microbiológicos.
Segundo semestre de 2024
Organiza Subcomisión de Buenas Prácticas, perteneciente a la División Microbiología de Alimentos, Medicamentos y Cosméticos (DAMyC) info@aam.org.ar https://www.aam.org.ar/actividades/818
El Rol del Laboratorio en la Seguridad del Paciente. Totalmente Actualizado
Segundo cuatrimestre
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Nefrología II. Rol del Laboratorio en los Criterios Diagnósticos. (Nuevo)
Segundo cuatrimestre
Organiza ABA (Asociación Bioquímica Argentina) cursos@aba-online.org.ar
Análisis Filodinámico de Virus: Datación, Dinámica Poblacional y Filogeografía
5 al 26 de noviembre de 2024
Organiza UBA (Universidad de Buenos Aires) posgrado@ffyb.uba.ar https://docs.google.com/forms/d/e/1FAIpQLSfOMr1mNbYKcNrVGjMywQro5ho8GyGzoFgz1vBWZu-eFbsJtA/viewform
Biodegradación de Efluentes Industriales
6 de noviembre al 4 de diciembre de 2024
Organiza UBA (Universidad de Buenos Aires) posgrado@ffyb.uba.ar
https://www.ffyb.uba.ar/cursos-departamento-de-sanidad-nutricion-bromatologia-y-toxicologia/
Diagnóstico de proteína M: análisis e interpretación de electroforesis de proteínas en suero, orina y líquido cefalorraquídeo
7 de noviembre de 2024
Organiza EFLM
(European Federation of Clinical Chemistry and Laboratory Medicine)
eflm@eflm.eu
https://www.eflm-elearning.eu/site/live-webinar
FORMACIÓN CON MODALIDAD PRESENCIAL
ARGENTINA
VI Curso Bianual de Especialización en Endocrinología
Ginecológica y Reproductiva. Buenos Aires 2019 – 2020
Consultar fecha de inicio
CABA, Argentina
Organiza SAEGRE saegre@saegre.org.ar
Conocimientos Actuales y Perspectivas en el Estudio de la Interfase. Materno-Fetal: hacia una Mejor Comprensión de la Placenta Humana
11 al 15 de noviembre de 2024
CABA, Argentina
Organiza UBA (Universidad de Buenos Aires) posgrado@ffyb.uba.ar
https://www.ffyb.uba.ar/cursos-departamento-de-ciencias-biologicas/
Aplicaciones de la espectrometría de masas maldi-tof en la microbiología clínica.
18 al 22 de noviembre de 2024
Organiza UBA
(Universidad de Buenos Aires) posgrado@ffyb.uba.ar
https://www.ffyb.uba.ar/cursos-departamento-de-microbiologia-inmunologia-biotecnologia-y-genetica/
Curso Básico Teórico Práctico De HPLC-PDA. Aplicaciones En Toxicología
25 al 29 de noviembre de 2024 CABA, Argentina
Organiza UBA (Universidad de Buenos Aires) posgrado@ffyb.uba.ar
https://www.ffyb.uba.ar/cursos-departamento-de-sanidad-nutricion-bromatologia-y-toxicologia/
BÉLGICA
XXVI IFCC-EFLM EUROMEDLAB 2025
18 al 22 de mayo de 2025
Bruselas, Bélgica https://www.ifcc.org/ifcc-congresses-and-conferences/
POSTGRADO
DOCTORADOS
Doctorado en Bioquímica y Biología Aplicada
Inscripción abierta
Organiza UNL (Universidad Nacional del Litoral) cytbioq@fbcb.unl.edu.ar posgrado@fbcb.unl.edu.ar
Doctor en Ciencias Biológicas
Inscripción abierta
Organiza UNL (Universidad Nacional del Litoral) cytbioq@fbcb.unl.edu.ar posgrado@fbcb.unl.edu.ar
Doctorado en Educación en Ciencias Experimentales
Inscripción abierta
Organiza UNL (Universidad Nacional del Litoral)
cytbioq@fbcb.unl.edu.ar posgrado@fbcb.unl.edu.ar
Doctorado en Ciencias Biológicas
Pre inscripciones abiertas
Mendoza
Argentina
Organiza Universidad Nacional de Cuyo posgrado@fcm.uncu.edu.ar www.probiol.uncu.edu.ar
Doctor en Física
Inscripciones abiertas
Organiza UNL
(Universidad Nacional del Litoral) cytbioq@fbcb.unl.edu.ar posgrado@fbcb.unl.edu.ar www.unl.edu.ar/carreras/doctorado-en-fisica/
Doctorado en Ciencias de la Salud
Inicio 2024
CABA, Argentina
Organiza Hospital Universitario Italiano de Buenos Aires maestriasydoctorados@hospitalitaliano.org.ar https://doctorado.hospitalitaliano.edu.ar/cienciasdelasalud
MAESTRÍAS
Maestría en Ciencias Biomédicas
Maestría binacional compartida entre la Universidad de Buenos Aires (UBA) Argentina, (Facultad de Medicina y Facultad de Farmacia y Bioquímica), Universidad Albert Ludwig de Friburgo (ALU), Alemania, (Facultad de Medicina)
Magíster en Física
Inscripciones abiertas
Organiza UNL (Universidad Nacional del Litoral) cytbioq@fbcb.unl.edu.ar posgrado@fbcb.unl.edu.ar https://www.unl.edu.ar/carreras/maestria-en-fisica
ESPECIALIZACIONES
Especialización en Vinculación y Gestión Tecnológica
Inscripción abierta Organiza UNL (Universidad Nacional del Litoral) gtec@unl.edu.ar
Especialización en Bioquímica Clínica en el área de Microbiología Clínica
Preinscripción abierta
Organiza Universidad Nacional de La Rioja posgrado.dacefyn@unlar.edu.ar https://posgrado.unlar.edu.ar/depto-exactas/
Especialización en Ciencias Ambientales y Desarrollo Sostenible
Pre-inscripción hasta el 24/04/24
Inscripción hasta el 26/04/24
Organiza UNR (Universidad Nacional de Rosario) especializacion@fbioyf.unr.edu.ar https://www.fbioyf.unr.edu.ar/?page_id=4353
Especialización en Hematología
Pre inscripción desde 1/03/24 hasta el 31/05/24
Inscripción desde el 01/06/2024 hasta el 20/06/2024
Organiza UNR (Universidad Nacional de Rosario) especializacion@fbioyf.unr.edu.ar https://www.fbioyf.unr.edu.ar/?page_id=4353
DIPLOMATURAS
Diplomado Internacional en Microbiología Clínica
29 de marzo de 2024
Modalidad virtual WhatsApp: 229 245 3927 – 229 907 9270 cquimicaclinica@gmail.com https://docs.google.com/forms/d/e/1FAIpQLScs_4ln1UWngymViA5rgVtDMUkG-6QU5vLn0xqo2ByIsWY1Ng/viewform
AVAN TECNOLOGÍAS IVD
LABORATORIOS BACON S. A. I. C.
Uruguay 136, Vicente López, B1603DFD. Buenos Aires. Argentina.
Tel: +54 11 4709 0171. Interno: 232 - Fax: +54 11 4709 2636. www.bacon.com.ar - marketing@bacon.com.ar.
Aviso en pág. 13
BERNARDO LEW E HIJOS S.R.L
Perú 150, Bahía Blanca, Argentina
+54 291 455 1794 - info@bernardolew.com.ar www.bernardolew.com.ar
Aviso en pág. 14-15
DIAGNOSTIKA. Distribuidora de Insumos Biomédicos
Whatsapp: +54 351 816 7471 - diagnostika.com.ar
Aviso en pág. 35
DICONEX S. A.
Torcuato de Alvear 46 (1878), Quilmes, ArgentinaLíneas Rotativas: +54 11 4252 2626 - info@diconex.com www.diconex.com
Aviso en pág. 17
JS MEDICINA ELECTRÓNICA S.R.L
Bolivia 462 (B1603CFJ) Villa Martelli, Buenos Aires - +54 11 4709 7707 marketing@jsweb.com.ar - www.jsweb.com.ar
Aviso en pág. 45
BIOARS
Estomba 961, CABA, Argentina
+54 11 4555-4601 - ventas@bioars.com.ar
Aviso en pág. 25-27
Av. Ingeniero Huergo 1437 P.B. “I” (1107) Buenos Aires - Argentina
Tel/Fax: (+54-11) 4300-9090 info@bio diagnóstico.com.ar
GEMATEC EQUIPAMIENTO PARA MEDICINA
Avalos 3651, (1605) Munro, Buenos Aires, Argentina. +54 11 4512-5666 y líneas rotativas. info@gematec.com.ar
Aviso en pág. 39 -49
GLYMS INFORMACIÓN EN TIEMPO REAL
Piedras 519 8-A, Capital Federal, República Argentina
+54 011 4331 4512 - administracion@glyms.com.
Aviso en pág. 51
GT LAB
Necochea 3274, Rosario, Santa Fe, Argentina
+54 0341 481 1002 - infocomercial@gtlab.com.ar. Aviso en pág. 33
NextLAB by Genetrics S.A.
Av. del Libertador 8630 6º Piso - Tel. +54 11 5263 0275 info@nextlab.com.ar - www.nextlab.com.ar
Aviso en pág. 12-41
Instrumental Bioquímico SA
Tel. +54 11 4709 7700 - instrumental-b.com.ar
Aviso en pág. 43-47
SIEMENS Healthineers
Oficinas Centrales Buenos Aires: Edificio Lumina Olivos
Blas Parera 3551 - P. 2 (B1636CSE) Olivos - Buenos Aires - Argentina siemens.ar@siemens.com - +54 911 5432 6000
MANLAB - Diagnóstico Bioquímico y Genómico
Tel. +54 11 6842 1200 - manlab.com.ar
Aviso en pág. 19
MERCK S.A.
Ed. Panamericana Plaza, Tronador 4890, Buenos Aires (1430) https://www.merckgroup.com/ar-es - Cel. +54 11 4546 8100
Aviso en pág. 8-9
MONTEBIO
Oficina y depósito: Vera 575 CABA
Tel. +54 11 4858 0636.rotativas. www.montebio.com.ar/info@montebio.com.ar
Aviso en pág. 11
Año XIV · Número 159 · Noviembre 2024
TUBLOOD S.A.
Av. Colonia 449, CABA - (011) 2082-7181/2081-5715 - Cel: (11) 4158-0909
https://www.tublood.com/
Wiener lab
Wiener laboratorios S.A.I.C - marketing@wiener-lab.com
Horario de Atención: Lunes a Viernes 9 a 18Hs. (-3 GMT)
Aviso en pág. 31
Somos bioquímicos.
Conocemos las necesidades del sector
¿Quiénes somos?
Somos un equipo de profesionales de la bioquímica, de la comercialización y de la comunicación, con amplia experiencia en medios gráficos tradicionales y digitales.
Desarrollamos productos dinámicos, con contenidos de interés para el público target de nuestros patrocinantes, que aseguran la llegada de las marcas, productos y servicios a sus consumidores.
La integración complementaria de nuestros tres medios garantizan el impacto de las campañas publicitarias difundidas a través nuestro.
Bioquímico Sergio Sainz
Director General de Medios
Bioquímico y Farmacéutico | Esp. en Gestión de Entidades de Nivel Superior | Esp. en Gestión de PyMEs | Mag. en Endocrinología | Sección de Endocrinología y Enf. Metabólicas en RedBio Laboratorios | Prof. Tit. de Grado. Univ. Juan A. Maza | Docente Investigador
Bioquímica Griselda Basile
Directora de Contenidos
Bioquímica y Farmacéutica | Maestrando en Ingeniería en Calidad | Especialización en Gestión de PyMES | Directora de Gestión de la Calidad en RedBio Laboratorios
Micaela Nahir Castro
Agente Comercial de Cuentas Comercialización y Marketing Digital
Cyntia Perez
13 años y más de 150 ediciones junto a nuestros clientes
Social Media Manager
Especializada en RRPP y Protocolo
DI Lucía Zandanel Terán
Directora de Arte y Desarrollo Digital
Diseñadora Gráfica e Industrial de Productos | Diplomada en Innovation Management, Metodologías Ágiles, Project Management | Magister en Project Management y CX M anagement