6 minute read
CIDP: Vorteile der Erhaltungstherapie mit subkutanem Immunglobulin
Bei der chronischen inflammatorischen demyelinisierenden Polyneuropathie (CIDP)
handelt es sich um eine Autoimmunerkrankung, bei der primär die Myelinscheiden im peripheren Nervensystem von Antikörpern,
Advertisement
Zytokinen oder Lymphozyten oder Lymphozyten und Makrophagen angegriffen werden [1]. Folgen der entzündlichen Reaktion sind
eine segmentale Demyelinisierung sensibler und motorischer Nerven sowie eine axonale Degeneration. Die Erkrankung verläuft progres
siv oder schubförmig und ist klinisch durch proximale und distale symmetrische Paresen der Arme und Beine sowie Sensibilitätsstö
rungen charakterisiert [2]. Die Prä
valenz liegt bei bis zu 9 Fällen pro 100.000 Einwohner [3]. Die CIDP sollte so früh wie mög
lich diagnostiziert werden, um
rechtzeitig eine adäquate Behandlung einleiten zu können. Nur so lassen sich irreversible Schädigungen der Axone verhindern. Zur Er
haltungstherapie steht CIDP-Patienten, die bereits auf intravenöses Immunglobulin (IVIg) angesprochen haben, seit März 2018 mit Hizentra ®
alternativ das erste und einzige subkutane Immunglobulin (SCIg) zur Verfügung [4].
Therapie so früh wie möglich beginnen
Die aktuelle DGN-Leitlinie zu immunvermittelten Neuropathien empfiehlt für die Akuttherapie 3 ähnlich wirksame Optionen: intravenöse Immunglobuline (IVIg), Glukokortikosteroide und Plasmapherese [5]. In der Langzeittherapie sind Steroide allerdings meist keine Option und gerade bei Begleiterkrankungen wie Diabetes oder Osteoporose problematisch.
Die Plasmapherese ist für die Langzeitanwendung nicht geeignet
– bleibt also die Therapie mit Immunglobulinen. Alternativ zu IVIg kann eine wirksame Symptomkontrolle auch durch eine subkutane
Ig-Applikation erzielt werden. Der Vorteil: Das SCIg Hizentra ® kann – nach einer entsprechenden Schulung – zuhause vom Patienten
selbst appliziert werden [4].
Überzeugende Daten zur Wirksamkeit des SCIg
Die Zulassung des 20%igen SCIg Hizentra ®
basiert auf den Ergeb
nissen der PATH-Studie [6]. Mit
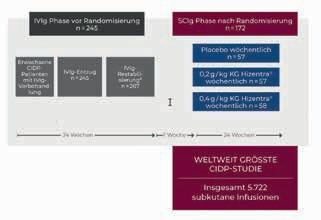
172 eingeschlossenen Patienten ist sie die bisher größte internationale, doppelblinde Phase-III-Studie
zur Therapie der CIDP. Untersucht wurden 2 verschiedene Hizentra ® - Dosierungen (0,2g/kg und 0,4g/ kg KG pro Woche subkutan). Nach
Stabilisierung mit IVIg erhielten
die Patienten über einen Behandlungszeitraum von 24 Wochen die Erhaltungstherapie mit Hizentra ® oder Placebo (Abb. 1). Primä
rer Endpunkt war der prozentuale Anteil der Patienten, die eine Verschlechterung im adjustierten INCAT (Inflammatory Neuropathy Cause and Treatment) Disability Score erfuhren oder aus anderen Gründen aus der Studie ausschie
den. Sekundäre Endpunkte waren die Zeit bis zum Erreichen des primären Endpunkts, der INCATScore, die mittlere Griffstärke der Hände sowie der MRC-Score (MRC = Medical Research Council). Nach 24 Wochen waren beide SCIg-Dosierungen der Placebogabe in Bezug auf den primären Endpunkt signifikant überlegen: Die absolute Risikoreduktion betrug 30% in der 0,4g/kg-Dosisgruppe und 25% in der 0,2g/kg-Dosisgruppe). Umgekehrt war der Anteil der Patienten, bei denen sich der INCAT-Score nicht verschlechterte, im Vergleich zu Placebo hochsignifikant höher und betrug unter 0,2g/kg/Woche 67%, unter 0,4g/ kg/Woche 81 % und 44% in der Placebogruppe (Abb. 2). Auch bei den sekundären Endpunkten (I-RODS, Griffstärke der Hände und MRC-Summen-Score) waren beide SCIg-Dosierungen dem Placebo deutlich überlegen. Dazu passend zeigte der QoL-Fragebogen EQ-5D eine Steigerung der Lebensqualität der Patienten unter SCIg in den Dimensionen Mobilität, Selbstfürsorge, Angst/ Depression, Alltagsaktivitäten und Schmerzen/Unwohlsein im Vergleich zur Placebogruppe (Abb. 3). Die SCIg-Therapie wurde gut vertragen. 24% der SCIg-Patienten entwickelten lokale, überwiegend
Ausschluss, falls nach 12 Wochen keine Verschlechterung Ausschluss, falls nach 13 Wochen nicht restabilisiert
*2 g/kg KG Anfangsdosis, 1 g/kg KG Erhaltungsdosis
Abbildung 1: Design der PATH-Studie [6].
CDIP-Patienten ohne Verschlechterung des INCAT-Scores in % Placebo 0,2 g/kg KG Hizentra ® wöchentlich p=0,012 (vs. Placebo)
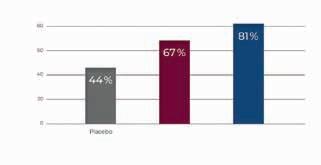
0,4 g/kg KG Hizentra ® wöchentlich p=0,001 (vs. Placebo)
Abbildung2: Ergebnis der PATH-Studie: Unter der Therapie mit Hizentra ®
war mit beiden Dosierungen eine signifikante Zunahme der Patienten ohne Verschlechterung des INCAT-Scores zu verzeichnen [6].

Abbildung 3: Die große Mehrheit der Patienten konnte unter der Behandlung mit Hizentra ® hinsichtlich der Lebensqualität profitieren (gemessen mittels EQ-5D im Vergleich zum Ausgangswert und Placebo) [6].
geringgradig ausgeprägte Reaktionen an der Infusionsstelle (95% leicht, 5% mäßig), die im Verlauf
der Studie zurückgingen [6]. Die Studiendaten zeigen, dass das SCIg Hizentra ®
zur Stabilisierung der Erkrankung beiträgt
und als wirksame und gut verträgliche Erhaltungstherapie zur Schub-Prophylaxe bei Patienten mit CIDP eingesetzt werden kann.
Während IVIg alle 3–4 Wochen in einer Dosis von 1 g/kg KG stationär oder ambulant in einem Therapiezentrum intravenös infundiert wird, kann Hizentra ® in der Regel wöchentlich und dann in niedrigerer Dosierung bei gleichbleibender monatlicher Ge
samtdosis zuhause vom Patienten selbst appliziert werden [4]. Die wöchentliche SCIg-Gabe führt zu gleichmäßigeren IgG-Spiegeln, wodurch der unter IVIg am Ende des Dosierungsintervalls mögliche Wear-off-Effekt (Nachlass-Effekt) vermieden werden kann [7].
Umstellung von IVIg auf SCIg
Eine Umstellung von IVIg auf SCIg
empfiehlt sich z.B. bei Patienten mit Wear-off-Effekt, ausgeprägten Nebenwirkungen unter IVIg-Gabe
oder schlechtem Venenstatus [7].
Neben medizinischen können auch persönliche Gründe des Patienten für eine Umstellung sprechen, so vor allem „Krankenhausaufenthal
te und lange Anreise vermeiden“. Die Therapie mit Hizentra ®
wird 1 Woche nach der letzten IVIgInfusion begonnen. Die emp
fohlene subkutane Dosis beträgt 0,2–0,4g/kg KG einmal pro Woche. Abhängig vom erreichten IgG-Spiegel und dem klinischen Ansprechen kann das Dosierungsintervall aber auch von den Patienten individuell z.B. mehrmals wö
chentlich oder zweiwöchentlich, gewählt werden. Wichtig ist dabei, dass die kumulative Gesamtdo
sis pro Woche gleich bleibt [8]. Hizentra ®
kann an verschiedenen Stellen wie Bauch, Oberschenkel, Oberarm und lateraler Hüfte
verabreicht werden. Bei höheren Dosen (mehr als 25ml) ist es ratsam, die Applikation auf mehrere Stellen zu verteilen. Dabei sollte zwischen den Injektionsstellen ein Mindestabstand von 5cm eingehalten werden [4].
Brigitte Söllner, Erlangen
Literatur
1 Mäurer M. Immunneuropathien. In: Stangel M, Mäurer M (Hrsg.): Autoimmunerkrankungen in der Neurologie: Diagnostik und Therapie. Berlin: Springer, 2018 2 Grimm A et al. Fortsch Neurol Psychiatr 2018;86:439-452 3 Hughes RA, J Clin Immunol 2010;30 (Suppl 1):70-73 4 Fachinformation Hizentra ®
; Stand: Februar 2019 5 Sommer C. et al. Therapie akuter und chronischer immunvermittelter Neuropathien und Neuritiden, S2e-Leitlinie, 2018. In: Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie. Online: www.dgn.org/leitlinien 6 van Schaik IN et al. Lancet Neurol 2018; 17:35-46 7 Aktuelle Neurologie, Blickpunkt Medizin: Therapie mit Immunglobulinen bei CIDP. Empfehlung zum Vorgehen bei der Umstellung von IVIg auf SCIg in der klinischen Praxis, Heft 8, Oktober 2018 8 Sidhu J et al. Biol Ther 2014;4:41-55
Fortgeschrittenes Leberzellkarzinom: Für die Zweitlinientherapie ist jetzt auch Ramucirumab zugelassen
Das Leberzellkarzinom (hepatozelluläres Karzinom, HCC) ist die häufigste primäre maligne Erkrankung der Leber und entwickelt sich wahrscheinlich aus hepatischen Stammzellen. Die Ausbreitung des aggressiven Tumors kann über die lokale Expansion, eine intrahepatische Ausbreitung sowie über Fernmetastasen erfolgen [1]. Das HCC ist eine der wenigen Krebsarten mit steigender Inzidenz und Mortalität, die relativen 5-Jahres-Überlebensraten liegen bei Männern bei etwa 14% und bei Frauen bei etwa 11% [2]. Neue Perspektiven für Patienten mit fortgeschrittenem oder inoperablem HCC ergeben sich aus der Zulassungserweiterung für Ramucirumab (Cyramza ®
), die die
Europäische Kommission dem monoklonalen Antikörper 2019 erteilt hat: Ramucirumab ist nun – zusätzlich zur Behandlung des Magen-, Kolorektal- und nicht kleinzelligen Lungenkarzinoms – auch als Monotherapie zur Behandlung von erwachsenen Patienten mit fortgeschrittenem oder inoperablem HCC indiziert, die ein Serum-Alpha-Fetoprotein (AFP) von ≥400ng/ml aufweisen und die zuvor mit Sorafenib behandelt wurden [3]. Basis für die Zulassungserweiterung waren die Ergebnisse der REACH-Studien [4, 5].
Ramucirumab
Ramucirumab (Cyramza ® ) ist ein humaner, monoklonaler Immunglobulin (Ig)G 1 -Antikörper, der spezifisch an die extrazelluläre Domäne des VEGF (Vascular Endothelial Growth Factor)-Rezeptors 2 bindet und so die die Andockstelle für die Signalmoleküle VEGF-A, VEGF-C und VEGF-D blockiert. Dadurch verhindert Ramucirumab die Aktivierung des VEGF-Rezeptor-2 und der nachgeordneten Signalkaskaden, die für die Bildung neuer Blutgefäße und damit für die Versorgung des Tumors, das Tumorwachstum und die Metastasierung eine wichtige Rolle spielen. Dass dies funktioniert, hat der VEGFR-2-Antagonist Ramucirumab bereits bei der Behandlung des Adenokarzinoms des Magens, des Kolorektalkarzinoms und des fortgeschrittenen nicht kleinzelligen Lungenkarzinoms (NSCLC) unter Beweis gestellt. Mit der Zulassung für die Behandlung des HCC steht Ramucirumab nun als Behandlungsoption für die Zweitlinientherapie bei 4 Tumorentitäten zur Verfügung.