
9 minute read
Le défi du traitement des patients cancéreux
régénération osseuse guidée le défi du traitement des patients cancéreux
prof. rogerio Belle de Oliveira, Brésil université catholique pontificale du Rio Grande do Sul Département de chirurgie orale et maxillo-faciale Porto Alegre, brésil
Lorsque le cabinet dentaire traite des patients néoplasiques, les taux de risques et d'échecs augmentent. Une formation et une information appropriées sont des alliées utiles pour la réussite du traitement. Y a-t-il cependant autre chose que nous devrions savoir ? Aperçu des facteurs déterminants et des traitements adaptés.
Le cancer est une maladie mondiale associée à des taux de mortalité élevés. Le centre international de recherche sur le cancer (CIRC) œuvre en permanence à la mise à jour des informations sur les agents cancérigènes, les principaux facteurs d'origine et les stratégies de prévention. La formation et la connaissance sont essentielles pour éviter les principaux facteurs de risque et améliorer le dépistage précoce du cancer. Les campagnes internationales, comme Octobre Rose (campagne pour la prévention du cancer du sein) et Novembre Bleu (prévention du cancer de la prostate), ainsi que les campagnes contre le tabac augmentent la sensibilisation. L'accès au diagnostic et aux traitements a un impact sur la possibilité d'améliorer la connaissance. Cependant, un diagnostic précoce est l'élément le plus important car il augmente les taux de réussite du traitement et de survie1 .
Facteurs déterminants La combinaison vieillissement et cancer est un facteur significatif, avec une augmentation de la prévalence du cancer chez les personnes âgées. Il y a, par exemple, des modifications fonctionnelles et structurelles dans les tissus mous et l'os, des troubles métaboliques et des limitations physiques liés à l'âge et au sexe. Les femmes sont sujettes à une perte minérale osseuse en vieillissant et des soins particuliers sont nécessaires après un traitement anticancéreux, notamment dans les cas de cancer du sein. Les hommes, quant à eux, sont plus vulnérables aux métastases osseuses consécutives au cancer de la prostate ou du poumon2-4. Les patients plus jeunes ont des taux de réussite supérieurs après un traitement anticancéreux. Par conséquent, une régénération osseuse guidée (ROG) réalisée après un traitement anticancéreux chez les patients jeunes donnera des taux supérieurs d'efficacité de la greffe et de réussite de l'implantation5, 6 . Les patients doivent impérativement subir des examens de santé bucco-dentaire et radiographiques globaux. Avant l'initiation du traitement anticancéreux, le clinicien doit impérativement être attentif au retrait des prothèses mal ajustées, à la plaque et aux caries, à la gingivite ou la parodontite et à l'extraction des dents condamnées. Le traitement de ces problèmes peut prévenir les complications bucco-dentaires indésirables pendant le traitement anticancéreux. Pendant cette phase du traitement, un comblement alvéolaire réussi est possible avec Geistlich Bio-Oss® et Geistlich Bio-Gide® dans les alvéoles 90 jours avant la radiothérapie et 45 jours avant la chimiothérapie, avec une cicatrisation définitive à six mois6-8 .
choix de traitement anticancéreux Le traitement anticancéreux dépend de plusieurs facteurs, dont la relation cellule-cause, la localisation et le délai. Les meilleures options sont les traitements, séparés ou associés, par chirurgie, chimiothérapie et/ou radiothérapie. Au cabinet
FiG. 1 : rOG CHEZ Un pATiEnT AYAnT Un lYMpHOME MAlin nOn HODGKiniEn - ÉTUDE DE CAS CliniQUE Patient de 38 ans traité par chimiothérapie lésion apicale inflammatoire sur la canine dentaire et une greffe alvéolaire pour la pour un lymphome malin non hodgkinien. maxillaire droite. Les examens clinique et préservation de l'os alvéolaire et le traiteCinq mois après la dernière session de biologique étaient normaux et le plan de ment consécutif avec implant dentaire. chimiothérapie, le patient a développé une traitement établi incluait une extraction
A
dentaire, les patients qui gagnent la bataille contre le cancer nécessitent le plan de traitement le plus délicat pour un traitement reconstructeur. Les procédures chirurgicales, la chimiothérapie et la radiothérapie entraînent des comorbidités qui ont un impact durable sur la fonction et la structure de l'os et des tissus mous. L'ostéopénie et l'ostéoporose sont des complications possibles pouvant compromettre le traitement après un traitement anticancéreux2,3,5,9,10 .
C D E énergie ciblant le site de la tumeur qui endommage la synthèse de l'ADN des cellules hautement mitotiques, mais aussi celle des cellules saines et diminue la vascularisation des tissus mous et des os autour des sites primaire et secondaire. Les doses de radiation thérapeutiques dans les régions de la tête et du cou dépendront de la localisation, de la taille de la tumeur et de la chaîne lymphatique associée. L'énergie du rayonnement B
G H
Photos : Rogerio b elle
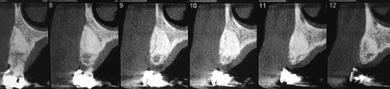
| A CbCT initiale montrant la canine maxillaire droite avec une zone ostéolytique apicale. | B CbCT axiale initiale montrant la perte osseuse. | c Situation clinique avant le début du traitement. vue de la lésion inflammatoire apicale. | D vue clinique de l'alvéole d'extraction. Après extraction et énucléation de la lésion inflammatoire, l'alvéole a été rincée avec une solution à base de tétracycline 500 mg dans 20 ml de solution saline stérile. | e Matériau Geistlich bio-Oss® appliqué dans l'alvéole. | F utilisation de Geistlich bio-Gide® pour recouvrir l'alvéole remplie avec Geistlich bio-Oss® . | G CbCT axiale à 6 mois montrant l'os nouvellement formé. | h CbCT montrant le résultat clinique à 6 mois.
La radiothérapie est une radiation de haute F varie de 30 à 70 Gy en 20 à 40 irradiations. Les conséquences cliniques prévisibles liées à la dose sont la régression de la tumeur, la xérostomie, la mucosite buccale, la possibilité d'un trismus grave, la fibrose induite par l'irradiation et le risque de développer une ostéoradionécrose. Le risque d'ostéoradionécrose dépend de l'âge, du temps et de l'énergie de radiation. Par conséquent, des doses plus faibles et des intervalles d'irradiation moins nombreux diminuent le
risque de développement d'une ostéoradionécrose. L'ostéoradionécrose est un problème bien décrit caractérisé par une détérioration de l'os médullaire par diminution de la vascularisation, l'impossibilité de réparation osseuse et un processus inflammatoire primaire entraînant une perte osseuse grave. Les effets résiduels de l'irradiation sur l'os sont irréversibles et même à 24 mois post-irradiation, des niveaux de vascularisation plus faibles sont observés, notamment dans la mandibule et dans le maxillaire postérieur4,5,8,11-13. L'oxygénothérapie hyperbare est une option pour prévenir l'ostéoradionécrose et améliorer la réussite de la greffe osseuse et de la pose de l'implant dentaire ; les preuves scientifiques concernant son utilisation sont toutefois limitées14 .
La chimiothérapie a un effet cytotoxique systémique sur les cellules néoplasiques cibles comme sur les cellules normales. Les pires effets secondaires incluent l'aplasie médullaire, la thrombocytopénie et un risque accru d'infection. Il y a également une diminution du nombre de cellules souches et une limitation de la fonction de la moelle osseuse, mais la récupération cellulaire intervient 180 jours après la dernière dose de chimiothérapie. Les protocoles thérapeutiques de certains patients peuvent inclure un anticorps monoclonal qui cible le RANKL, avec ou sans bisphosphonates systémiques ; ces patients nécessitent donc plus d'attention en raison du risque accru de nécrose osseuse4,8,10,14-16 .
le patient au centre des décisions Lorsque la quantité et la qualité de l'os sont cruciales pour la réussite de l'implantation et la reconstruction, la ROG est une technique de greffe bien documentée qui donne de bons résultats3 (Fig. 1). La ROG chez les patients cancéreux est une technique qui dépend du temps. Des approches minimalement invasives sont possibles avec des résultats convenables après 180 jours de chimiothérapie et après 360 jours de radiothérapie. Lorsque des anticorps monoclonaux ciblant le RANKL et/ou des bisphosphonates systémiques sont utilisés, pendant le traitement actif ou pour l'entretien, il est impératif de reporter la ROG de 24 mois. De plus, dans ces cas-là, il est préférable d'avoir recours à des approches chirurgicales minimalement invasives et d'utiliser des implants courts, mais une évaluation spécifique du cas du patient est vivement recommandée8,13,15-17 .
Avant l'intervention chirurgicale, le patient doit subir une évaluation clinique et radiographique globale. L'évaluation de la densité minérale osseuse et les analyses biologiques sont des outils diagnostiques essentiels pour la planification des greffes osseuses minimalement invasives. D'après la dernière revue systématique, le télopeptide C-terminal réticulé du collagène de type 1 (b-CTx) n'a aucune valeur prédictive pour la détermination du risque d'ostéonécrose chez les patients recevant un bisphosphonate14, et il en va de même pour le traitement anticancéreux. La meilleure option est l'évaluation des taux sériques : calcium (Ca), phosphatase alcaline, parathormone (PTH), 25-hydroxy vitamine D3 (vitamine OHD), albumine (Alb), ainsi que l'évaluation de la densité minérale osseuse (g/cm2) au niveau du rachis lombaire (L1-L4) et du col du fémur. Un autre examen diagnostique significatif au moyen de la radiographie ou la tomographie volumique à faisceau conique de la zone ciblée vise l'évaluation des sites chirurgicaux ou alvéoles antérieures pour vérifier si la cicatrisation osseuse est convenable. Une cicatrisation insuffisante est une indication significative d'un risque plus élevé de nécrose osseuse3,8,10,16,17 .
En raison de sa structure osseuse moins vascularisée, la région maxillaire postérieure est plus sujette à complications et, pour éviter un second site de prélèvement chirurgical, les greffes d'os autologue sont déconseillées chez les patients ayant reçu un traitement anticancéreux11, 16. Les meilleures options pour ce type de patients sont les matériaux d'origine xénogénique et les membranes de collagène. Une approche avec lambeau minimalement invasive aide à corriger les défauts osseux horizontaux et verticaux pour une implantation immédiate ou différée avec une excellente stabilité. En présence d'un os résiduel minime, les implants plus étroits et plus courts peuvent être une bonne solution8,13 . De plus, une manipulation avec précaution du lambeau muco-périosté et la fermeture primaire du lambeau sont essentielles pendant la procédure chirurgicale. Le rinçage du site chirurgical avec une solution à base de tétracycline 500 mg dans 20 ml de solution saline stérile peut améliorer les résultats.
références 1 Torre LA, et al.: CA Cancer J Clin 2015; 65(2): 87-108. 2 Purton LE, et al.: Journal of Bone and Mineral Research 2015; 30(5):886–897. 3 Sharifian RA, et al.: Caspian J Intern Med 2017; 8(2): 91-98. 4 Sörensen HT, et al.: BMJ Open 2017; 7: e016022. 5 Demian NM, et al.: Oral Maxillofacial Surg Clin N Am 2014; 26: 193–207. 6 Stavropoulos F, et al.: Oral Maxillofacial Surg Clin N
Am 2002; 14: 15–27. 7 Jansisyanont P, et al.: Int J Oral Maxillo Fac Implants 2017; 32: 611–616. 8 Edher F, Nguyen CT: J Prosthet Dent 2017; pii:
S0022-3913(17)30426-2. 9 Martin TJ, Seeman E: Best Practice & Research
Clinical Endocrinology & Metabolism 2008; 22(5): 701–722. 10 Pérez MGS, et al.: J Clin Exp Dent 2011; 3(1): e31-42. 11 Romanos GE, et al.: Clinical Implant Dentistry and
Related Research 2015; 17(3): 598-609. 12 Nooh N: Int J Oral Maxillo Fac Implants 2013; 28: 1233–1242. 13 Grötz KA, et al.: Clin Oral Investig 2014; 18(3): 687-98. 14 Esposito M, Worthington HV: Cochrane Database of
Systematic Reviews 2013; 9. 15 Kovács AF: Int. J. Oral Maxillofac Surg 2001; 30: 144–147. 16 Romanos GE, et al.: Oral Oncology 2010; 46: 854–859. 17 Claudy MP, et al.: Clin Implant Dent Relat Res 2015; 17(2): 402-11.








