
38 minute read
Compara ión de la asimila ión del
Comparación de la asimilación del nitrógeno dietético suministrado por ingredientes derivados de animales, plantas y microbios en el camarón blanco del Pacífico Litopenaeus vannamei: un estudio de isótopos estables
Para convertirse en una industria más rentable y sostenible, el sector de la acuicultura está constante- mente explorando fuentes alterna- tivas de nutrientes. En el presente estudio, se determinaron las firmas de isótopos estables naturales de diferentes ingredientes derivados de animales, plantas y microbios para evaluar la asimilación de nitrógeno dietético en el camarón blanco del Pacífico. Las dietas experimenta- les se fabricaron para reemplazar la harina de pescado y la harina de calamar con ingredientes deri- vados de microbios y plantas (48 y 66% de inclusión en la dieta) y también se usaron como aditivos (4%). Los ingredientes también se usaron como aditivos para estudiar sus efectos sobre el rendimiento del crecimiento y la asimilación. Glu- ten de maíz, aislado de proteína de soja, Arthrospira ( Spirulina) se uti- lizaron biomasa y una comida bac- teriana (ProFloc ™) para formular seis dietas de control isotópico que contienen una fuente de nitrógeno dietético, mientras que seis dietas combinadas tenían proporciones variables de ingredientes. Al final del ensayo, las tasas de superviven- cia fueron similares entre los trata- mientos (88 ± 9%) pero hubo dife- rencias significativas en el peso final medio. Las proteínas microbianas y animales promovieron un peso final similar cuando se combinaron (1080-1537 mg), mientras que los ingredientes vegetales y Arthros- piracausó un menor crecimiento cuando se usó solo (420-970 mg). Los valores isotópicos indicaron diferencias significativas en las pro- porciones de asimilación de nitró- geno en la dieta, atribuidas princi- palmente a los diferentes perfiles de aminoácidos de los ingredientes. El nitrógeno dietético contenido en los ingredientes derivados de mi- crobios se asimiló en proporciones similares o incluso más altas que la harina de pescado y la harina de ca- lamar. Dieta formulada con 33% de harina de pescado, Arthrospiray el gluten de maíz, contribuyeron con 31, 36 y 33% de nitrógeno dietético al crecimiento muscular, respecti- vamente. La segunda combinación
Advertisement
Destaca • Se requerirán ingredientes alternativos para fabricar mayores cantidades de ali- mentos para el sector acuícola de rápido crecimiento.
• Se utilizaron como biomarcadores las firmas isotópicas de ingredientes deriva- dos de animales marinos, plantas terrestres y microorganismos.
• Se evaluaron las tasas de crecimiento y las proporciones de asimilación de nitró- geno en la dieta en el camarón blanco del Pacífico Litopenaeus vannamei. • Las dietas que contienen biomasa microbiana en combinación con otros ingre- dientes produjeron altas tasas de crecimiento.
• El nitrógeno dietético de las microalgas y la biomasa bacteriana se asimiló en proporciones relativamente altas en el músculo del camarón. del 33% suministró 42, 34 y 24% de harina de calamar, harina bac- teriana y proteína de soja. Cuando los ingredientes se usaron al 4%, los niveles de aditivos, también contri- buyeron con nitrógeno estructural al tejido muscular del camarón a pesar de las bajas inclusiones dieté- ticas. Los resultados demostraron el uso viable de isótopos estables para evaluar la asimilación del nitrógeno dietético suministrado por ingre- dientes alternativos emergentes.
Palabras clave:
Litopenaeus vannamei
Comida de pescado Proteínas vegetales Biomasa microbiana
Isótopos estables Asimilación de nutrientes
1. Introducción
En 2015, el pescado proporcionó a aproximadamente 3.200 millo- nes de personas con el 20% de su ingesta promedio per cápita de proteína animal ( FAO, 2018 ). En los últimos 40 años, la industria de la acuicultura se ha convertido en uno de los sectores económicos más importantes y estimó que en los años siguientes, la producción acuícola superará los desembar- ques de la pesca industrial. La tasa de crecimiento de la acuicultura, a su vez, ha alentado el desarrollo de otras actividades subsidiarias que la apoyan, como la producción de piensos y aditivos. Durante el período de 1995 a 2015, la pro- ducción de especies acuáticas de cultivo aumentó de 12 a 51 millo- nes de toneladas, en gran medida mediante la intensificación de los métodos de producción de cama- rones, tilapia, carpas y salmónidos (Hasan, 2017) Hoy, el 66% de la producción acuícola mundial total (excluidas las macroalgas) requie- re el uso de alimentos exógenos ( FAO, 2018 ). Para fabricar estos alimentos para la acuicultura, la harina de pescado se usa como uno de los ingredientes principales y se estima que alrede- dor del 70% de la producción mun- dial de harina de pescado se puede utilizar para tal fin ( Tacon y Metian, 2008) Incluso los peces pelágicos pequeños están actualmente bajo presión, ya que son capturados y utilizados para fabricar harina de pescado, lo que exacerba la sobre- explotación de las especies mari- nas. Como las proteínas de origen animal contribuyen en gran medida a los costos de producción de la acuicultura, este sector industrial ha acogido con satisfacción el uso de ingredientes alternativos para alimentos compuestos. Las proteí- nas vegetales pueden ser econó- micamente viables y nutricional- mente adecuadas para organismos acuáticos cuando se usan como reemplazo parcial de la harina de pescado. Sin embargo, podrían no ser adecuados para especies car- nívoras (Romarheim et al., 2011 ) y, por otro lado, la disponibilidad
limitada de agua y tierra cultivable impondrá restricciones futuras pa- ra satisfacer la creciente demanda de harinas vegetales (Malcorps et al., 2019) En vista de esto, ha habi- do un creciente interés en explo- rar nutrientes alternativos, como los derivados de diferentes tipos de microorganismos. El término "proteína unicelular" se refiere a la biomasa extraída de microor- ganismos o a productos aislados específicos. Existen claras ventajas en el uso de microorganismos para producir biomasa, y estas inclu- yen tasas de crecimiento rápidas, adaptabilidad a diferentes medios de cultivo y uso eficiente del espa- cio. Por otro lado, se ha informado que las propiedades nutricionales de muchos tipos de biomasa micro- biana son muy adecuadas cuando se usan como sustitutos de la harina de pescado en las dietas para ani- males terrestres y acuáticos. Estos impactos positivos van desde efec- tos que promueven el crecimiento hasta mejoras en la supervivencia, la pigmentación, el estado inmuni- tario y el rendimiento reproductivo (Gamboa-Delgado y Márquez-Re- yes, 2018) Por lo tanto, los esfuer- zos para aumentar la producción de microalgas, bacterias y levadu- ras se centran en métodos innova- dores y energéticamente eficientes (Acién et al., 2012 ; Duong et al., 2015 ). Algunos de estos procesos patentados reciclan los residuos agrícolas e industriales para gene- rar de forma sostenible biomasa microbiana (Lee y Kim, 2011 ; WEF, 2015 ). Se han considerado diferen- tes tipos de biomasa microbiana (o sus productos purificados) como fuentes de nutrientes prometedoras para la nutrición animal. El camarón blanco del Pacífico ( Litopenaeus vannamei ) es la especie de camarón dominante producida a través de prácticas de acuicultura, y la producción agrí- cola ha superado la producción derivada de las capturas silvestres (FAO, 2007) Además de su impor- tancia económica, esta especie re- presenta un excelente organismo modelo de invertebrados no solo por su disponibilidad y domesti- cación, sino también por sus ca- racterísticas fisiológicas como los hábitos omnívoros, la tolerancia a la salinidad y las rápidas tasas de crecimiento. La evaluación de la idoneidad de los nuevos ingredien- tes de alimentos para la acuicultura se realiza típicamente mediante bioensayos que comparan pará- metros fisiológicos y químicos. Las observaciones sobre los procesos de ingestión-digestión-asimilación son útiles para caracterizar aún más los piensos específicos. La asimi- lación biológica se puede definir como la absorción de nutrientes en el tracto gastrointestinal, seguida de una modificación química y un uso fisiológico final (metabolismo, biosíntesis de tejidos). Los métodos indirectos para medir la asimila- ción incluyen el uso de marcadores no digeribles en alimentos y he- ces (Goodman-Lowe et al., 1999 ) y la evaluación de la pérdida de energía como productos excreto- res (Drazen et al., 2007). Estudios recientes han aplicado mediciones de isótopos estables (a niveles de abundancia natural) para hacer in- ferencias sobre la asignación fisio- lógica de nutrientes disponibles en ingredientes alternativos. Debido a su abundancia natural en materia orgánica, el carbono y el nitrógeno se han utilizado para determinar sus relaciones de isótopos estables (13 C /12 C y 15 N /14 N, respectiva- mente expresados como notación delta, δ 13 C y δ 15NORTE). Tales valores pueden usarse como mar- cadores dietéticos y representan una poderosa herramienta comple- mentaria en estudios nutricionales.
Los organismos adquieren diferen- tes firmas isotópicas de sus entornos específicos y elementos de alimen- tación (silvestres, de cultivo). En el caso específico de los sistemas de acuicultura, los organismos se cul- tivan en entornos confinados don- de reciben pocos alimentos. Tales sistemas son, por lo tanto, muy susceptibles de realizar estudios nutricionales que empleen técnicas isotópicas. La relación cambiante de isótopos estables en tejidos de animales mantenidos bajo condi- ciones controladas puede usarse para determinar la contribución de las fuentes dietéticas al creci- miento ( Phillips, 2012 ). Al integrar dichos cambios isotópicos con da- tos de crecimiento y tiempo, tam- bién se pueden estimar las tasas de rotación de carbono y nitrógeno ( deVries et al., 2015) El objetivo principal del presente estudio fue utilizar el camarón blanco del Pa- cífico como organismo modelo para comparar las proporciones relativas de asimilación del nitró- geno dietético derivado de fuentes animales, vegetales y microbia- nas. Además, se evaluaron las tasas de renovación de nitrógeno y los factores de discriminación isotópi- ca entre las dietas experimentales y el tejido muscular para indicar di- ferentes condiciones nutricionales.
2. Materiales y métodos 2.1. Diseño experimental y siste- ma de crianza
Se obtuvieron postlarvas de cama- rones blancos del Pacífico ( Litope- naeus vannamei ) de un criadero comercial (AcuaMar, Baja Califor- nia Sur, México). Después del trans- porte, los animales se aclimataron a las condiciones ambientales del bioensayo (temperatura del agua de mar 29.2 ± 1.5 ° C, salinidad 32.4 ± 0.6 gl −1 , pH 8.3 ± 0.1 y oxígeno di- suelto saturado). Estos parámetros y los niveles de compuestos nitro- genados se mantuvieron dentro de los rangos recomendados para los camarones Penaeid durante todo el bioensayo. A los camarones se les ofreció una dieta compuesta comercial (37% de proteína cruda, Grupo Costamar, Hermosillo, México) previamente analizada para valores elementales e isotópicos (δ 15 N y δ 13C). Después de 15 días, esta dieta permite establecer valores isotópicos de referencia conocidos en los camarones an- tes del inicio del experimento. Al comienzo del bioensayo, se co- locaron veinte camarones (peso húmedo medio inicial 360 ± 36 mg) en tanques triples de fibra de vidrio de 60 L. Se tuvo cuidado de distri- buir animales con el mismo patrón de distribución de tamaño en cada unidad. Los tanques individuales fueron equipados con elevadores de aire y agua y se interconectaron para permitir la circulación de agua de mar artificial (Instant Ocean® Blacksburg, VA, EE. UU.). El agua de mar fluyó a través de cartuchos y filtros UV, espumadores de pro- teínas y un filtro biológico de bolas de burbujas.
2.2 . Dietas experimentales y procedimiento de muestreo.
Se formularon doce dietas expe- rimentales isonitrógenas (35% de proteína cruda) e isoenergéticas (4.7 kcal / g) con seis ingredientes principales. La harina de pesca- do (sardina) y la harina de calamar ( Dosidicus gigas ) representaron dos fuentes de proteínas de origen animal bien referenciadas. El gluten de maíz y el aislado de proteína de soja se usaron como ingredientes vegetales debido a su rendimiento nutricional comprobado cuando se usa en dietas para esta espe- cie. Los ingredientes microbianos consistieron en Arthrospira ( Spi- rulina) biomasa recolectada de cultivos comerciales intensivos (Pronat, Iztapalapa, México) y una comida derivada de bacterias pro- ducida utilizando una tecnología patentada que aumenta los ciclos de nutrientes de las plantas de tra- tamiento de aguas residuales de alimentos y bebidas (ProFloc ™, Nutrinsic Corporation, Boulder, CO). Este ingrediente tiene un alto contenido de proteínas (> 60%) y un perfil favorable de aminoáci- dos. También se ha demostrado que proporciona una alta digestibi- lidad y palatabilidad a los animales terrestres y acuáticos ( Wen, 2018 ). El proceso de producción modifi- ca las condiciones biológicas en los sistemas de aguas residuales para favorecer el crecimiento de bacterias específicas que producen proteínas. La biomasa producida se cosecha, concentra, seca y es- teriliza para producir una proteína de una sola célula destinada a la alimentación animal ( WEF, 2015) A partir de los datos de análisis proxi- males de ingredientes individuales, las dietas experimentales se formu- laron utilizando el software Nu- trion® (Nutrion, Chapala, México). Las dietas experimentales se for- mularon utilizando ingredientes que tienen valores isotópicos con- trastantes para carbono y nitróge- no. Los valores isotópicos especí- ficos de los ingredientes se definen
por su origen (marino, terrestre) y / o metabolismo (tipo de fotosínte- sis). Dicha selección permitió esti- mar las contribuciones nutriciona- les del nitrógeno dietético al creci- miento muscular del camarón. Se formularon seis dietas con solo un ingrediente que proporciona pro- teínas (Dietas 1-6) y representaron controles isotópicos. Se fabricaron seis dietas más con diferentes pro- porciones de nitrógeno dietético suministrado por biomasa deriva- da de animales, plantas y micro- bios. La dieta 7 fue formulada con proporciones equivalentes (33% de nitrógeno dietético) de harina de pescado, Arthrospira ( Spiru- lina) y gluten de maíz, mientras que la dieta 8 contenía harina de calamar, harina bacteriana y ais- lado de proteína de soja (33%). Las dietas 9–12 se fabricaron con bajas inclusiones dietéticas (a base de nitrógeno dietético) de ingre- dientes microbianos y derivados de plantas (4%) y altas proporcio- nes (96%) de combinaciones de proteína animal / planta o animal / microbiana. Los micronutrientes se pesaron y se mezclaron y luego se agregaron a los macronutrientes molidos (<200 um). La mezcla re- sultante se homogeneizó durante 15 minutos usando un mezclador. Se añadió agua lentamente para for- mar masa y se presionó a través de una placa de matriz (orificios de 1,6 mm) para formar hebras. Los hilos se recogieron y secaron durante la noche (40 ° C) en un horno de con- vección y finalmente se trituraron para formar pequeños gránulos. Los análisis proximales de las dietas experimentales se realizaron como se describe en Gamboa-Delgado et al. (2016) . Las dietas experi- mentales se entregaron en exceso a las 8:00, 12:00, 16:00 y 20:00 h durante 21 días. El alimento no alimentado y los restos de heces se extrajeron diariamente antes de la primera alimentación. Las racio- nes de alimentación se ajustaron progresivamente en relación con el aumento de peso observado y el número de animales muestreados.
Los puntos experimentales de muestreo se definieron de acuerdo con la tasa exponencial de cambio isotópico frecuentemente observa- do en los crustáceos decápodos de rápido crecimiento ( Gamboa-Del- gado et al., 2011) El peso húmedo individual de todos los animales se registró durante todo el período de alimentación para estimar las tasas de crecimiento específicas (SGR) dependientes del tratamiento. En los días experimentales 0, 4, 8 y 15, se recogieron uno o dos camarones (dependiendo del tamaño) de ca- da réplica para medir los cambios isotópicos. Al final de la prueba de alimentación, los animales se sa- crificaron en suspensión de hielo / agua, se pesaron y se diseccionaron para extraer tejido muscular. Todas las muestras se mantuvieron con- geladas a -80 ° C hasta el análisis.
2.3. Pretratamiento de muestras, análisis de aminoácidos y de isóto- pos estables.
Se deshidrataron muestras de mús- culo e ingredientes de camarones en un horno de convección (60 ° C hasta peso constante). Las muestras secas se molieron manualmente para obtener un polvo fino y homo- geneizado. El perfil de aminoácidos de los ingredientes principales se determinó en la Estación Experi- mental Agrícola de la Universidad de Missouri ( Asociación de Quí- micos Analíticos Oficiales (AOAC, 2006).) Para el análisis de isótopos estables, se envasaron muestras de dieta y camarones de 1 mg en vasos de estaño (Elemental Microa- nalysis Ltd., Okehampton, Reino Unido). El análisis dual (carbono y nitrógeno) se realizó en la instala- ción de isótopos estables de la Uni- versidad de California (Davis, CA, EE. UU.) Utilizando un analizador elemental Micro Cube (Elementar Analysensysteme GmbH, Alema- nia) conectado a una masa de rela- ción isotópica PDZ Europa 20-20 espectrómetro (Sercon Ltd., Reino Unido). El ácido glutámico, nylon y el hígado bovino se utilizaron como patrones de calibración internos, mientras enriquecido l de ácido glutámico (USGS-41, δ 15 N AIR = 47.6 ‰, delta 13 C VPDB = 37,6 ‰) se utilizó como estándar interna- cional para calibrar los estándares internos. La precisión del instru- mento (DE) fue de 0.09 ‰ para los valores de δ 15 N y 0.13 ‰ para los valores de δ 13 C. Los resultados isotópicos se expresan en notación delta ( δ ), que se define como des- viaciones por molino (‰) de los valores isotópicos de los materiales de referencia estándar (N en el aire y C en la belemnita). El último ma- terial de referencia está altamente enriquecido en 13 C, por lo tanto, la comparación con la mayoría de las muestras orgánicas (agotadas en 13 C) da como resultado valo- res negativos. El término "factor de discriminación" se utiliza en este es- tudio para describir las diferencias en los valores isotópicos entre el músculo del camarón y sus respec- tivas dietas / ingredientes (Δ15 N y Δ 13 C) después de alcanzar o aproximarse el equilibrio isotópico (± 0.5 ‰).
2.4. Estimación del aporte dietéti- co de nitrógeno
Las proporciones relativas de asi- milación de nitrógeno (proteína) en la dieta suministrado por los tres tipos de ingredientes se estimaron utilizando un modelo de mezcla de isótopos de equilibrio de masa, de- pendiente de la concentración ele- mental ( Phillips y Koch, 2002 ). Los supuestos fundamentales reque- ridos por los modelos ( Martínez del Rio et al., 2009a , 2009b ; Post, 2002 ) se cumplieron o se consi- deraron para los cálculos ( p . Ej. equilibrio isotópico entre dieta y consumidor, conocimiento de concentraciones elementales en ingredientes experimentales). Los factores de discriminación isotó- pica se obtuvieron de las diferen- cias isotópicas observadas entre las dietas de control y los camarones de control, la integración de tales correcciones isotópicas en los mo- delos de mezcla tiende a aumentar la precisión de los resultados ( Phi- llips, 2012 ). Se obtuvo un indica- dor de la variabilidad específica del tratamiento de las contribuciones nutricionales mediante la intro- ducción en el modelo de valores isotópicos medidos en animales individuales (no valores medios).
2.5. Tiempos de residencia de ni- trógeno en cuerpos de camarones.
Los valores de δ 15 N y δ 13 C se determinaron en diferentes mo- mentos del período experimental y se introdujeron en un modelo exponencial (Ec. 1) ( Hesslein et al., 1993 ) que permite separar el cambio isotópico causado por el crecimiento ( k ) o recambio meta- bólico ( m ).(1)Csample=Cn+Co− Cne−k+mtdonde C muestra es el valor de isótopo en el tejido de ca- marón en el tiempo t, Co es el valor de isótopo del tejido de camarón en equilibrio con la dieta inicial (ba- sal), Cn es el valor de isótopo alcan- zado cuando los animales están en equilibrio con la (s) nueva (s) dieta (s) . La tasa de crecimiento, k, se es- timó ajustando un modelo de creci- miento exponencial a los datos de peso observados, k = log (peso final / peso inicial) / tiempo (d). Utilizan- do datos de crecimiento, tiempo e isótopos, el parámetro m se calculó mediante regresión no lineal itera- tiva. Los coeficientes k y m propor- cionan un indicador del período de tiempo necesario para que la mitad del nitrógeno constituyente sea reemplazado en el tejido mus- cular después de que los animales consuman una nueva dieta (medio tiempo, t50) (Ec. 2) ( MacAvoy et al., 2005 ).(2)t50=In2/m+kdonde In 2 representa el logaritmo natural de 2.
2.6. análisis estadístico .
El peso medio final y la superviven- cia, y los efectos dietéticos sobre los valores isotópicos en el músculo del camarón se analizaron mediante ANOVA unidireccional seguido de comparaciones por pares después de confirmar la distribución normal y la homocedasticidad. Para com- parar las proporciones esperadas de nitrógeno dietético (disponible en las diferentes dietas) y las pro- porciones observadas de nitrógeno dietético realmente asimiladas en el tejido muscular del camarón, se aplicaron pruebas de bondad de ajuste Chi-cuadrado ( X 2 ). Todas las pruebas se realizaron con el software SPSS 17.0 (SPSS Inc.) a un nivel de significancia de P <0.05.
3. Resultados 3.1. Efectos dietéticos sobre tasas específicas de crecimiento y su- pervivencia.
Durante el período de alimentación experimental, los parámetros de calidad del agua en el tanque expe-
rimental se mantuvieron dentro de los valores óptimos recomendados para esta especie. Al final del ensa- yo de alimentación, no se observa- ron diferencias significativas en las tasas de supervivencia (p = 0.078), pero hubo diferencias significativas en las tasas de crecimiento especí- ficas dependientes del tratamiento (p <0.001). Si bien la mayoría de las dietas pro- dujeron una SGR alta y similar, las dietas de control que contenían gluten de maíz y Arthrospira causa- ron un peso significativamente me- nor. La SGR fue mayor en animales alimentados con dietas que tienen ingredientes combinados, excepto aquellos alimentados con una dieta que contiene 48% de harina de pescado, 48% de gluten de maíz y 4% de Arthrospira. La comida bac- teriana, como único ingrediente, provocó SGR similares a la mayoría de los tratamientos, que también fue el caso cuando se usó como aditivo (4%) o en niveles altos de reemplazo de proteínas animales (33-48%). Las dietas que contienen gluten de maíz y proteína de soya a niveles de aditivos también pro- movieron SGR similares a los ob- servados en animales alimentados con dietas que contienen harina de pescado o harina de calamar. 3.2. Influencia isotópica de las die- tas y los tiempos de residencia del nitrógeno en el tejido muscular. La dieta de acondicionamiento per- mitió establecer valores isotópicos basales de δ 15 N = 9.7 ‰ y δ 13 C = -20.5 ‰ en el tejido muscular del camarón. Durante los primeros días de la prueba nutricional, hu- bo una rápida influencia isotópica en el tejido muscular del camarón ejercido por las dietas experimen- tales respectivas (Fig. 1 a – d). Los diferentes valores de δ 15 N y δ 13 C de los ingredientes experimentales causaron cambios isotópicos rápi- dos y contrastantes en los cama- rones bajo diferentes tratamien- tos. Dichas diferencias otorgaron una mejor resolución al modelo de mezcla isotópica y permitieron es- timar las contribuciones dietéticas de los tres tipos de ingredientes. El equilibrio isotópico entre los cuer- pos de camarones y las dietas res- pectivas se alcanzó entre los días 15 y 21 (Fig. 1 ). Cuando las ten- dencias isotópicas no alcanzaron completamente el estado estacio- nario (p . Ej., Valores de δ 15 N en la dieta 100Sq), se usaron valores asintóticos generados por regresión no lineal para estimar las contribu- ciones nutricionales. Los factores de discriminación isotópica entre el músculo del camarón y sus diferen- tes dietas oscilaron entre -0.2–6.0 ‰ para el nitrógeno (Δ 15 N) y entre 0.0–4.4 ‰ para el carbono (Δ 13 C). Superior Δ 15 N se observaron entre los camarones y dietas que
Fig.1 . Cambios en los valores de isótopos estables (‰) de nitrógeno (1a y 1b) y carbono (1c y 1d) en el tejido muscular del camarón después de un cambio en la dieta de una dieta de acondicionamiento a seis dietas de control y dos dietas combinadas que tienen proporciones similares de nitrógeno en la dieta (33% ) derivados de animales, plantas y microorganismos. Las líneas representan los valores pronosticados y muestran el mejor ajuste a los datos observados. Las flechas indican factores de discriminación isotópica entre las dietas de control y los camarones. n = 3 individuos, 9 en el día final. Los valores de las dietas que contienen ingredientes a nivel aditivo no se mues- tran, ya que se parecen mucho a los valores isotópicos de los ingredientes principales. contienen proteínas vegetales (5.1 y 6.0 ‰), seguido por valores más bajos causadas por las fuentes mi- crobianas (1.4 y 3.4 ‰) y muy pe- queños para las comidas de origen animal (-0,2 y 0,3 ‰). Tal tenden- cia no se observó para los valores de Δ 13 C. Las tasas estimadas de renovación de nitrógeno en cama- rones bajo los diferentes tratamien- tos mostraron una alta variabilidad (0.020 - 0.062 d −1, Tabla 4) Estos valores no se correlacionaron con el tipo de ingrediente o combinación utilizada. La tasa de renovación de nitrógeno más baja se determinó en tejido muscular de camarones alimentados con dieta 100 P (harina bacteriana). No fue posible estimar la tasa de renovación de nitrógeno para las dietas que tienen 33% de combinaciones porque el cambio en la dieta de la dieta basal a es- tas dietas no provocó tendencias exponenciales en los cambios iso- tópicos. Nitrógeno medio tiempo ( t 50) en el músculo del camarón osciló entre 6,3 y 10,0 días. Los va- lores más altos correspondieron a animales alimentados con dieta 100 G y 4AFG, que contenían 100% y 48% de gluten de maíz, respecti- vamente. La dieta anterior causó la menor SGR observada. Los ingre- dientes derivados de animales, la comida bacteriana y la mayoría de las dietas combinadas provocaron tiempos de residencia bajos en los tejidos (nitrógeno), lo que se asocia a altas tasas de crecimiento. En gene- ral, los tiempos medios de carbono fueron más cortos que los deter- minados para nitrógeno, y oscila- ron entre 3,3 y 4,6 días ( Tabla 1 ).

Tabla 1. Composición de aminoácidos próxima, isotópica y esencial (gr 100 gr de proteína -1 ) de ingredientes derivados de animales, plantas y microorganismos. Las dietas experimentales se formularon para comparar tasas de crecimiento específicas, proporciones de supervivencia y asimilación utilizando valores de isótopos estables como biomarcadores. n = 3.
NFE (extracto libre de nitrógeno) incluye fibra para este ingrediente. ** Los niveles promedio de aminoácidos esenciales recomendados para los camarones Penaeid que usan lisina como referencia al 100% ( NRC, 2011 ). El requerimiento estimado de lisina ha sido reportado como 4.93% de proteína en la dieta ( Xie et al., 2012 ).


3.3. Estimación de proporciones relativas de asimilación.
Los datos isotópicos de los ingredien- tes y las muestras de camarones y la consiguiente integración en el mode- lo de mezcla de isótopos indicaron que, en la mayoría de los casos, la contribución del nitrógeno dietético asimilado no fue estadísticamente si- milar a las proporciones de nitrógeno dietético establecidas en las dietas experimentales ( Tabla 2 y Fig. 2 ) La dieta 33SqSP, formulada con 33% de nitrógeno dietético de harina de calamar, proteína de soya y harina bacteriana, suministró 42, 24 y 34% al crecimiento.
En contraste, se observaron contri- buciones similares de nitrógeno en la dieta en animales alimentados con la dieta 33FGA, que suminis- tró 31, 33 y 36% de nitrógeno en la dieta de harina de pescado, gluten de maíz y Arthrospira. Cuando se usaron ingredientes de origen vegetal o microbiano a niveles aditivos en dietas que contenían combinacio- nes de harina de pescado y proteínas vegetales o harina de pescado e in- gredientes microbianos, se observó que tales niveles bajos de inclusiones dietéticas todavía promovían pro- porciones de asimilación que eran superiores al 4% establecido valores dietéticos. Las proporciones relati- vas de asimilación fueron del 10,5% para el gluten de maíz, del 11,6% para Arthrospira y del 9,5% para la comida bacteriana, en comparación con el nivel de inclusión establecido en las dietas (4% en base a nitrógeno dietético). La única excepción fue el aislado de proteína de soja, que proporcionó una proporción ligera- mente menor de nitrógeno en la dieta al crecimiento (3.6%) cuando se usó como aditivo, mientras que los otros ingredientes en esta combinación, harina de pescado y harina bacteria- na, proporcionaron 44 y 53%, res- pectivamente (Tabla 3). Alimentos Costamar (Sonora, Méxi- co). b Trow Nutrition International (Putten, Países Bajos). c Asociación Americana de Soya (St. Louis, MO, EE. UU.). d ProNat (Iztapalapa, Mé- xico) e Nutrinsic Corporation (Glen- dale, CO, EE. UU.). f Almidones y gluten SA (Monterrey, México). g Sol- vay Pharmaceuticals (Houston, TX, EE. UU.). h Sigma-Aldrich (St. Louis, MO, EE. UU.). i Ingredientes cons- tantes: alginato 20 kg dieta −1 . Las mezclas de minerales y vitaminas, cada 2.5 kg de dieta -1 fueron for- muladas de acuerdo con los requi- sitos estimados reportados por NRC (2011) ., Vitamina C 1 kg de dieta -1, Agente antifúngico 0.5 g kg die- ta −1 , antioxidante 0.5 g kg dieta −1 .
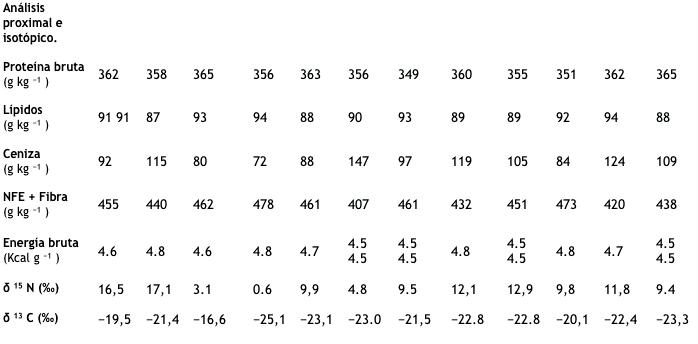
Tabla 2. Composición nutricional e isotópica de dietas formuladas alimentadas con camarones blancos del Pacífico ( Litopenaeus vannamei ) para estimar la contribución nu- tricional de la harina de pescado (F), harina de calamar (Sq), gluten de maíz (C), aislado de proteína de soja (S), Arthrospira ( Spirulina ) biomasa (A) y un producto derivado de bacterias (ProFloc ™) (P) para el tejido muscular del camarón.
Fig.2. Proporciones relativas estimadas de nitrógeno de la dieta suministrada desde animal- planta y de ingredientes-microbianos derivada y sus respectivas proporciones asimilados en el tejido muscular de camarón blanco del Pacífico L . vannamei (valores medios ± DE, n = 9 por dieta). Las columnas con asterisco indican diferencias significativas (pruebas de Chi-cuadrado, p <0.05) entre las proporciones dietéticas (esperadas) y asimiladas (observadas).
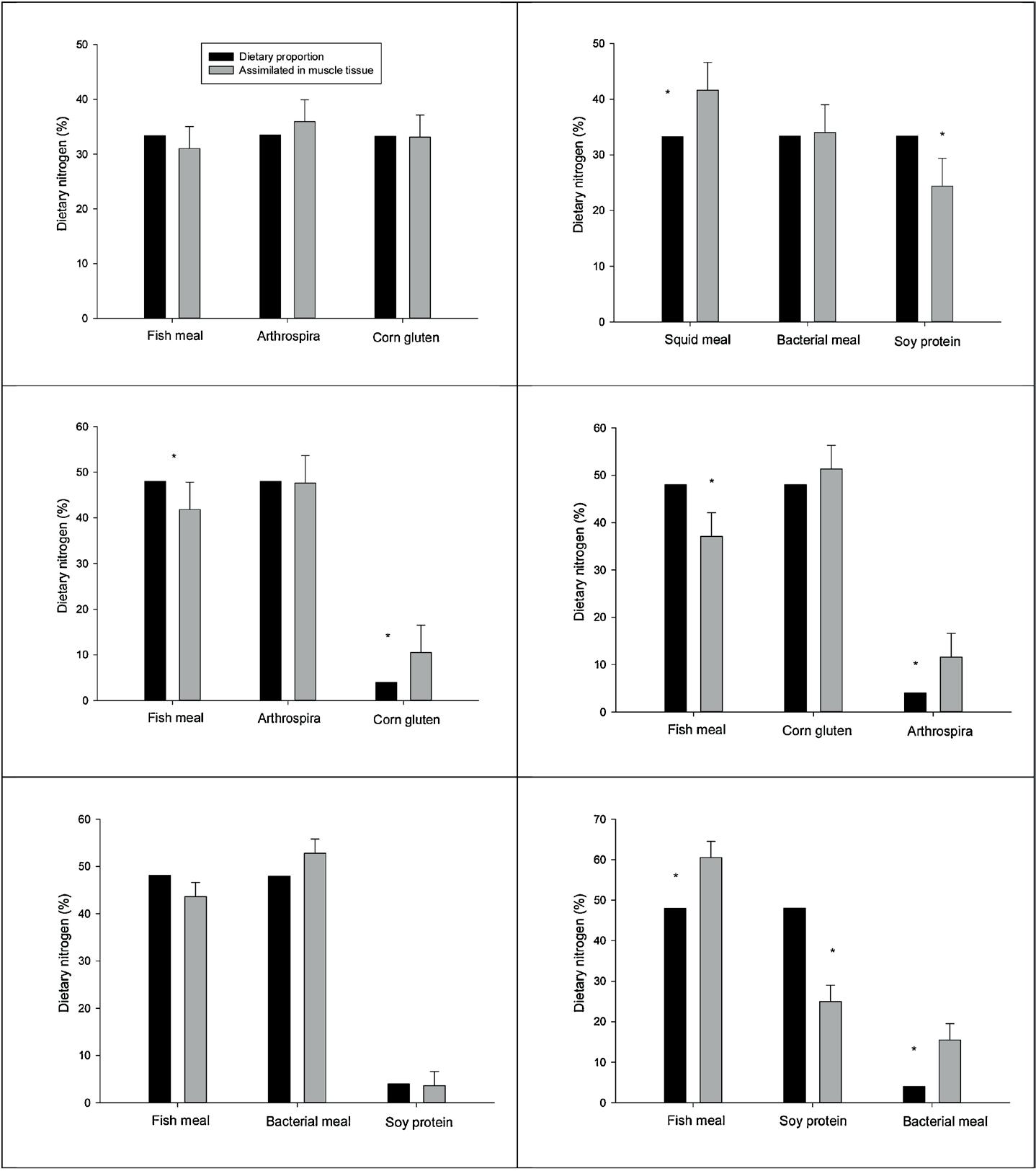
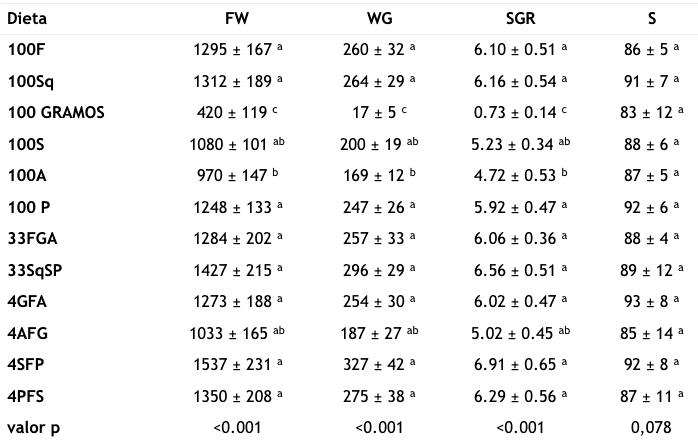
Tabla 3. Peso húmedo final (FW, mg), aumento de peso (WG,%), tasa de creci- miento específico (SGR) y tasa de supervivencia (S,%) del camarón blanco del Pacífico L. vannamei criado en dietas que tienen diferentes proporciones dieté- ticas de harina de pescado, calamar harina, proteínas vegetales e ingredientes derivados de microbios.Peso húmedo inicial medio, 360 mg Valores medios ± DE
Los diferentes superíndices indican diferencias significativas (p <0.05) para esa columna en particular 4. Discusión 4.1. Tasas específicas de crecimiento y supervivencia del camarón
Las tendencias observadas en el peso final de los camarones entre los tratamientos indicaron que la mayoría de los tratamientos dietéticos se realizaron tan bien como los formulados con harina de pescado o de cala- mar. Como las dietas experimentales eran isonitrógenas e isocalóricas, las tasas de crecimiento específicas más bajas promovidas por las dietas que contienen gluten de maíz o bioma- sa de Arthrospira podrían atribuirse a perfiles de aminoácidos menos favorables que los encontrados en ingredientes derivados de animales. En el presente estudio, todas las die- tas combinadas causaron un alto SGR en los camarones, excepto la dieta 4AFG, que contenía 48% de harina de pescado, 48% de gluten y 4% de biomasa de Arthrospira . Ni- veles más bajos de lisina, metioni- na y arginina están presentes en el gluten de maíz que los valores reco- mendados para esta especie ( NRC, 2011 ). Por otro lado, ArthrospiraLa biomasa contiene niveles de histidina más bajos que los reportados como óptimos. Se ha informado que Ar- throspira es un sustituto eficaz de la harina de pescado para animales acuáticos (Gamboa-Delgado y Már- quez-Reyes, 2018) debido a su buen perfil proximal y al hecho de que las paredes de las células de Arthrospi- ra no contienen celulosa y se digie- re fácilmente ( Dillon et al. ., 1995 ). En contraste, otras especies de mi- croalgas requieren la interrupción de la pared celular para mejorar la biodisponibilidad de nutrientes ( Agboola et al., 2019 ; Teuling et al., 2019) La comida bacteriana fun- cionó bien como aditivo dietético y como reemplazo de comida de cala- mar. Aunque el perfil de aminoácidos de la harina bacteriana indica niveles más bajos de histidina y lisina que la harina de pescado y de calamar, ta- les niveles son aún más altos que los recomendados para los camarones Penaeid. Estudios anteriores han apli- cado otros tipos de productos bacte- rianos como ingredientes en dietas para animales terrestres y acuáticos. Por ejemplo, se ha demostrado que la biomasa obtenida de la bacteria metanotrófica Methylococcus cap- sulatus es una fuente nutritiva prome- tedora de proteínas debido a su com- posición de aminoácidos, digestibili- dad cruda de proteínas (79–85%) y parámetros de producción animal observados en aves de corral, cerdos y salmón del Atlántico ( Øverland et al., 2010) El perfil de aminoáci- dos de la última comida bacteriana y el utilizado en el presente estudio se asemejan al de la harina de pes- cado. Tal similitud sugiere además que los ingredientes derivados de bacterias se pueden usar como fu- turos reemplazos de harina de pes- cado para las dietas de acuicultura. 4.2 . Influencia isotópica de las die- tas y los tiempos de residencia del nitrógeno en el tejido muscular. Estudios anteriores han demostrado que los valores de δ 15 N y δ 13 C en el tejido muscular reflejan bien los medidos en cuerpos de cama- rones enteros ( Gamboa-Delgado et al., 2011) El tejido muscular se seleccionó para el análisis porque representa el principal reservorio de nitrógeno y como contiene niveles muy bajos de lípidos, por lo tanto,
Los diferentes superíndices indican diferencias significativas (p <0.05) para esa columna en particular.
Tabla 4. Tasas de crecimiento específicas medias (k, d −1 ) y medias veces estimadas (d) de nitrógeno y carbono en el tejido muscular del camarón blanco del Pacífico L. vannamei criado bajo dietas que tienen diferentes proporciones dietéticas de ingredientes derivados de animales, plantas y microbios. Δ 15 N y Δ 13 C (‰) re- presentan la diferencia isotópica entre los ingredientes de la dieta y los valores del tejido muscular (factores de discriminación isotópica).
no fue necesaria la extracción de lípidos para estandarizar las com- paraciones. Además, el músculo es un tejido metabólicamente activo y tiene una alta tasa de renovación en comparación con otros tejidos. La última característica es ideal pa- ra rastrear los cambios isotópicos causados por la dieta. Debido a sus diferentes orígenes, los ingre- dientes tenían valores isotópicos muy contrastantes. Por ejemplo, la harina de pescado y la harina de calamar se enriquecen isotópica- mente ya que se fabrican a partir de especies pelágicas marinas que ocupan posiciones tróficas inter- medias en las redes alimentarias.

Como los isótopos más pesados (15 N, 13C) tienden a acumularse en los tejidos debido a la discri- minación metabólica, los anima- les muestran valores isotópicos más altos que las plantas y los mi- croorganismos ( De Niro y Epstein, 1978). Los valores isotópicos de las plantas y sus productos están fuer- temente influenciados por el tipo de fotosíntesis (carbono) ( O’Leary, 1988) y el uso de fertilizantes in- orgánicos (nitrógeno). De manera similar, los valores isotópicos de la biomasa microbiana (microalgas, bacterias y levaduras) dependen en gran medida de las característi- cas de los medios de cultivo y del tipo metabólico intrínseco de cada microorganismo. Las transferencias isotópicas y nutricionales de nitrógeno dietético de los ingre- dientes experimentales fueron rela- tivamente rápidas y los camarones alcanzaron el equilibrio isotópico con sus respectivas dietas. El tejido muscular reflejó claramente los va- lores isotópicos de los ingredientes principales después del día expe- rimental 15; por lo tanto, se pue- de argumentar que los nutrientes suministrados por los ingredientes principales fueron ingeridos, di- geridos y asimilados rápidamente. El modelo exponencial de cambio isotópico indicó que la mayoría del cambio isotópico observado en el tejido muscular (nitrógeno) se atribuyó a la acumulación de tejido (50-90%, parámetro k) y, en menor medida, por las tasas de re- cambio metabólico (10–50%, pa- rámetro m ). La única excepción se observó en la dieta alimentada con camarones de 100 G, donde la baja SGR causó una mayor atribución de m al cambio isotópico (90%). A medida que el carbono elemen- tal se convierte más rápido que el nitrógeno, se observó la tendencia opuesta para el carbono (es de- cir, cambios isotópicos) en el teji- do se atribuyeron principalmente a la tasa de renovación metabó- lica). La combinación de los pa- rámetros k y m permitió estimar los tiempos de residencia para el nitrógeno y el carbono en el tejido muscular ( t 50 ). T 50 estimado- para el nitrógeno varió de 6.3 a 10.0 días y de 3.3 a 4.6 días para el carbono. Tales valores bastan- te cortos son consistentes con los datos reportados en estudios simi- lares donde las postlarvas de esta especie han sido alimentadas con dietas óptimas ( Gamboa-Delgado et al., 2014 , 2016 ). Se considera que una t 50 baja en organismos juveniles indica una SGR alta, que se asocia frecuentemente a dietas que tienen un buen valor bioló- gico y, por lo tanto, promueven una reducción en el recambio de proteínas (mayor anabolismo que catabolismo) ( Mente et al., 2017 ). Los factores de discriminación iso- tópica para el nitrógeno (Δ 15 N) mostraron una tendencia a aumen- tar de los animales alimentados con proteínas derivadas de animales a los alimentados con proteínas mi- crobianas y vegetales (5.1 ‰ para la proteína de soja y 6.0 ‰ para el gluten de maíz). Los últimos valores fueron significativamente más altos que los supuestos, literatura Δ 15 N valores (3–4 ‰) (Minagawa y Wa- da, 1984 ) comúnmente adopta- dos por los ecologistas y utilizados para inferir interacciones tróficas. El uso de valores de Δ 15 N espe- cíficos de especies y tejidos es im- portante para aumentar la preci- sión de los modelos de mezcla de isótopos (Martínez del Rio et al., 2009a , 2009b). Δ 15 corregidoLos valores de N implican el uso de valores isotópicos de organismos alimentados con dietas específi- cas y no el valor isotópico de las dietas per se. En estudios anterio- res sobre la dinámica de isótopos, algunos autores han sugerido que los altos Δ 15 N valores se obser- varon en los animales alimenta- dos con dietas nutricionalmente incompletos. Estudios recientes realizados en organismos terrestres y acuáticos también han reporta- do una disminución de los valores de Δ 15 N en función de una ma- yor cantidad y calidad de proteí- nas en la dieta (Caut et al., 2009 ). La suposición general de estos estudios es que la reducción de delta 15 N valores indican un uso fisiológico más directa de nutrien- tes. Por el contrario, las restriccio- nes de nutrientes podrían provo- car un mayor ciclo metabólico de los nutrientes, aumentando así el Δ 15Valores de N debido a la acu- mulación adicional de isótopos más pesados en los tejidos. En el presente estudio, se puede afirmar que entre todas las dietas experi- mentales suministradas, solo las dietas que contienen gluten de maíz provocan importantes restric- ciones nutricionales (tres aminoá- cidos esenciales limitados) como lo indican los valores más bajos de SGR, t 50 y Δ 15 N. También inte- resante subrayar la observación de que delta 15 N valores mostraron
una tendencia a aumentar a partir de ingredientes que tienen cerca de óptima amino ácidos perfiles a los ingredientes de plantas que tie- nen grupos amino restricciones de ácido. Factores de discriminación para el carbono (Δ 13C) observado en este estudio fue mayor (2.2–4.4 ‰) que el valor promedio reporta- do en la literatura (1.0 ‰). La única excepción se observó entre el te- jido muscular y el gluten de maíz (0.0 ‰). Aunque no tenemos una cierta explicación para tales enri- quecimientos isotópicos, podrían atribuirse a los valores de δ 13 C de aminoácidos individuales que comprenden los diferentes tipos de proteínas. Se ha informado que tanto los aminoácidos dietéticos esenciales como los no esenciales muestran un enriquecimiento iso- tópico después del depósito en los tejidos (Whiteman et al., 2019 ).
El nitrógeno dietético disponible en las dietas experimentales fue, en la mayoría de los casos, asimila- do rápidamente y en proporciones significativamente diferentes a las establecidas en las formulaciones dietéticas. Se ha informado previa- mente que la mayoría de los ingre- dientes utilizados en el presente estudio muestran altos coeficientes de digestibilidad aparente para la proteína cruda cuando se alimen- ta a camarones blancos (78-96%) (Cruz-Suárez et al., 2009 ; Terrazas et al., 2010) Se puede afirmar que ambos tipos de biomasa microbia - na (conformada por células indi- viduales y sus productos) ofrecen una mayor relación superficie-vo- lumen para el ataque enzimático que las partículas molidas relati- vamente más grandes obtenidas de las comidas de animales y plantas. Este último podría desempeñar un papel importante en la mejora de la digestión y la consiguiente asi- milación de la biomasa microbia- na. Además, dado que la transfe- rencia y la absorción de nutrientes dependen de la biodisponibilidad y el valor biológico de los alimentos, es muy probable que las contri- buciones nutricionales desiguales se puedan explicar aún más por las diferencias en los perfiles de aminoácidos de los ingredien- tes. Aunque las proteínas de ori- gen animal contienen niveles más altos de metionina y lisina que los ingredientes derivados de plantas (Galili y Amir, 2013), cabe desta- car que el gluten de maíz contiene un 100% más de leucina que los niveles disponibles en la harina de pescado y de calamar. Se ha demostrado que este aminoácido de cadena ramificada es el único aminoácido dietético que estimu- la la síntesis de proteínas y, por lo tanto, disminuye la degradación del tejido muscular (Etzel, 2004) El gluten de maíz también contenía el nivel más alto de fenilalanina entre los ingredientes probados, lo que podría haber contribuido a una mayor asimilación de nitrógeno en la dieta de esta fuente. Aunque el gluten de maíz causó una menor SGR cuando se usó como la úni- ca fuente de proteína, los resulta- dos indican que este ingrediente derivado de plantas proporciona un buen efecto complementario cuando se usa en combinación con otros ingredientes. Después de comparar las contribuciones esperadas y observadas de nitró- geno en la dieta para la dieta FGA, con una proporción del 33% de harina de pescado, Arthrospiray gluten de maíz, se observó que los ingredientes suministraban can- tidades similares de nitrógeno. Por otro lado, la segunda combina- ción del 33% (harina de calamar, harina bacteriana y proteína de so- ja; dieta SqSP), promovió diferentes proporciones de asimilación. Las proporciones relativas de asimila- ción fueron más altas para la harina de calamar (42%) y más bajas para la proteína de soja (24%). Del mis - mo modo, el perfil de aminoáci- dos menos favorable de la proteína de soja (restricción de metionina y arginina) podría haber llevado a una menor asimilación, mien- tras que la harina de calamar y la comida bacteriana, a pesar de su alto contenido de cenizas, contri- buyeron a una mayor asimilación. La comida bacteriana contenía ni - veles más altos de arginina, treoni- na y fenilalanina que la harina de calamar y su perfil de aminoácidos esenciales excede los valores die- téticos sugeridos para el camarón Penaeid (NRC, 2011) Cuando se usa en niveles aditivos, la biomasa de Arthrospira , el gluten de maíz y la harina bacteriana, suministraron mayores proporciones de nitróge- no en la dieta que su respectivo ni- vel dietético del 4%. Los resultados son consistentes con los resultados anteriores que informan una asimi- lación detectable de nitrógeno en la dieta (1.6–5.8%) incluso cuando se agregan ingredientes a niveles de 5% en las dietas para camaro- nes, en el estudio mencionado, la biomasa de dos microalgas marinas ( Grammatophora y Schizochy- trium ) (Pacheco-Vega et al., 2018). Un análisis isotópico más fino po- dría indicar el origen y el destino de los diferentes aminoácidos de la dieta, ya que se ha demostra- do a través del análisis isotópico específico del compuesto (CSIA) que los valores isotópicos (δ 15 N y δ 13C) de aminoácidos individua- les (dentro de la misma proteína) puede ser significativamente dife- rente (Boecklen et al., 2011). Por lo tanto, los estudios futuros ofre- cen la posibilidad de utilizar di- cho etiquetado isotópico natural para explorar la transferencia de aminoácidos dietéticos individua- les aportados por proteínas ani- males, vegetales y microbianas.
5 . Conclusiones
Después de comparar el rendi- miento nutricional de ingredientes seleccionados de origen animal, vegetal y microbiano, se descubrió que Arthrospirala biomasa y la co- mida bacteriana produjeron un alto SGR cuando se usaron en combi- nación con otros ingredientes. Los ingredientes microbianos también promovieron una asignación fi- siológica de nutrientes en propor- ciones similares o superiores a las observadas en camarones alimen - tados con dietas formuladas con ingredientes derivados de plantas y animales. Las mediciones isotópi- cas ayudaron enormemente a eva- luar el rendimiento nutricional de los ingredientes experimentales. El presente estudio también propor- ciona factores de discriminación isotópicos específicos de especies y tejidos, que pueden utilizarse en futuros estudios destinados a determinar las contribuciones nu- tricionales. Aunque el uso de mu- chos tipos de biomasa microbiana como ingredientes sigue siendo económicamente prohibitivo, Se están desarrollando técnicas de producción mejoradas para me- jorar el valor nutricional de los productos microbianos y explorar sustratos alternativos para reducir los costos de producción y aumen- tar la rentabilidad. Por lo tanto, se pronostica que en el futuro cer- cano, la biomasa microbiana se utilizará cada vez más como un ingrediente alimenticio sostenible.
Declaración de interés en com- petencia
Los coautores no han informa- do sobre conflictos de intereses.
Agradecimientos:
Reconocemos a Nutrinsic Cor- poration (Boulder, CO) por do- nar amablemente la comida derivada de bacterias (ProFloc ™). Agradecemos a dos revi - sores anónimos que ayudaron a mejorar y aclarar el estudio. Esta investigación no recibió ninguna subvención especí - fica de agencias de financia- ción en los sectores público, comercial o sin fines de lucro.
Autores:
Julián Gamboa-DelgadoMartha G. Nieto-LópezMaribel Maldo - nado-MuñizDavid VillarrealCavazosMireya Tapia-Salazar - Lucía Elizabeth Cruz-Suárez. Programa Maricultura, Departa- mento de Ecología, Facultad de Ciencias Biológicas Universidad Autónoma de Nuevo León, UANL. San Nicolás de los Garza, Nuevo León,Mexico. Tel.: 81 8329 4110 E-mail: adriana.garciaf@uanl.mx Artículo publicado en © 2020 Los Autores. Publicado por Elsevier BV https://www.sciencedi - rect.com/science/article/pii/ S2352513419303643?via%3Dihub








