
11 minute read
E s t u d i o r e e m p l a z a a e i t e d e
Estudio reemplaza aceite de pescado en la dieta con aceite de microalgas.
Los resultados de este estudio de alimentación con camarones blancos del Pacífico muestran claramente que los camarones, y probablemente muchas otras especies, se pueden cultivar sin harina y aceite de pescado. Foto de Fernando Huerta.
Advertisement
Los consumidores informados y los cabilderos ambientales han arrojado un guante a la industria de alimentos acuícolas. Este desafío, familiar para todos, se refiere a la reducción, o preferiblemente, a la eliminación de la harina de pescado (FM) y el aceite de pescado (FO) de los alimentos para acuicultura. La principal motivación detrás de este desafío es el deseo de garantizar la viabilidad futura de las poblaciones mundiales de peces y, por extensión, los ecosistemas de los que se cosechan. Muchas pesquerías han alcanzado un rendimiento sostenible o están sobreexplotadas; algunos están en recuperación, otros se han derrumbado y algunos se han extinguido. Con el aumento de la población mundial en aproximadamente el 1 por ciento o 75 millones de personas por año, todas las fuentes de proteínas de calidad alimentaria son preciosas y deben defenderse enérgicamente.
Se ha sugerido que la mayoría de los peces utilizados para la reducción a FM / FO son aptos para el consumo humano y, por lo tanto, deben desviarse para ese propósito; si no de inmediato, ciertamente en un futuro cercano. La sustitución de FM / FO de alimentos acuícolas representa un imperativo moral / ético. Los acuicultores han estudiado los alimentos y los hábitos alimenticios de los animales cultivados durante siglos, pero la posibilidad de sustituir los recursos marinos por alimentos fabricados tiene una historia más reciente (por ejemplo, Grassl, EF 1957. Raciones secas granuladas para propagación de truchas en criaderos de Michigan. Trans. Am. Fish. Soc., 86, 307-322). Ahora hay muchos ejemplos de la eli- minación completa del componente FM de los alimentos para peces, incluso para especies carnívoras. También se han hecho observaciones similares con camarones cultivados [Reid, B., McLean, E., Craig, SR 2004. Características de rendimiento del camarón (Litopenaeus vannamei) alimentado con un alimento orgánico certificado versus un alimento acuático orgánico en investigación. En: Actas de la 5ª Conferencia Internacional sobre Recirculación de la Acuicultura, Roanoke, VA, EE. UU., Del 22 al 25 de julio, págs. 539-542]. Sin embargo, más difícil ha sido el reemplazo de FO dietético. Muchas especies cultivadas pueden sintetizar algunos ácidos grasos, pero otros, como el ácido docosahexaenoico (DHA; 22: 6 omega-3) de ácidos grasos poliinsaturados de cadena larga omega-3 (omega-3 LC-PUFA), deben derivarse de la dieta. Los AG- PI-omega-3 LC están íntimamente in- volucrados en numerosas funciones biológicas en organismos acuícolas y humanos (Fig. 1). Hace medio siglo, investigadores del Hospital Aalborg North, Dinamarca, informaron que una dieta rica en omega-3 LC-PUFA redujo sustancialmente el colesterol sérico, los triglicéridos, la lipoproteína β y la lipoproteína pre-β en inuit. Los niveles bajos de estos diferentes tipos de lípidos se asociaron con una reducción de las enfermedades cardíacas y la diabetes mellitus, un efecto que estimuló el interés en examinar los beneficios para la salud del aceite de pescado en la dieta.
Fig. 1: Las ventajas de una mayor ingesta dietética de omega-3 LC-PUFA son amplias. DHA-EPA, generalmente considerado como un elemento nutricional único, influye en los procesos de control que regulan el crecimiento, el desarrollo y el metabolismo normales. Los metabolitos bioactivos del omega-3 LC-PUFA influyen espe cialmente en el estado de salud, incluido el bienestar cardiovascular, la inmunidad y los procesos de inflamación. A nivel celular, modulan la estructura y función de la membrana celular y de los orgánulos, la electrofisiología celular y regulan los receptores nucleares y los factores de transcripción.
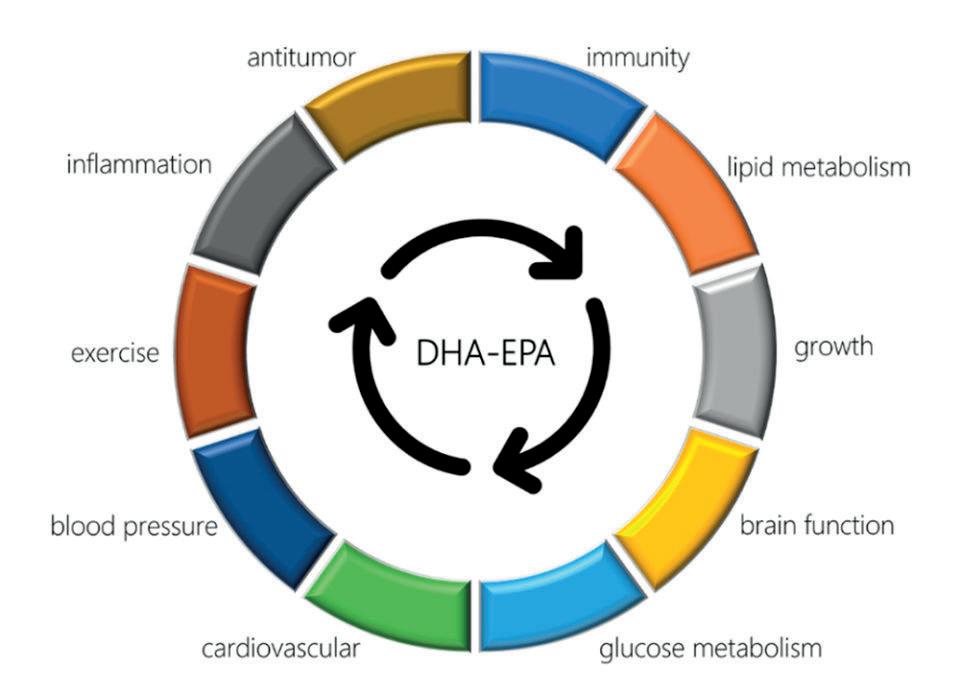
Más de 8,000 ensayos clínicos más tarde, ahora está bien establecido que el ácido eicosapentaenoico (EPA; 20: 5 omega-3) y DHA son condicionalmente esenciales en el hombre y modifican positivamente un rango de funciones fisiológicas (Fig. 1) en la medida en que Las pautas aconsejan el consumo regular de fuentes ricas en mariscos de EPA y DHA. Para mantener los beneficios para la salud de los mariscos, la sustitución de FO en alimentos acuícolas debe preservar los niveles de AGPIomega-3 condicionalmente esenciales en la carne del producto final (https://abdn.pure.elsevier.com/en / publicaciones / el-impacto-potencial-de-cambios-de-composiciónen-peces-de-cultivo-en-i ). Además, el reemplazo de FO en los alimentos acuícolas no debe tener efectos negativos sobre la salud o el rendimiento del crecimiento del animal de granja. Nuestro estudio examinó la funcionalidad del aceite de microalgas rico en DHA y EPA (Veramaris® Vera Oil®), y los beneficios de MrFeed® Pro50®, un ingrediente sostenible y funcional capaz de reemplazar la FM. El producto oleoso se derivó del protista heterotrófico Schizochytrium limacinum (Familia Thraustochytriaceae). Específicamente, el ensayo comparó la respuesta del camarón blanco del Pacífico, Litopenaeus vannamei , alimentado con dietas a base de aceite de algas contra alimentos experimentales y comerciales y evaluó su capacidad para resistir el desafío con la bacteria Vibrio parahaemolyticus , agente causante del síndrome de mortalidad temprana / síndrome de necrosis hepatopancreática aguda (EMS / AHPNS), que ha sido responsable de pérdidas significativas en la producción de camarones a nivel mundial. Configuración del estudio Los camarones SPF evaluados por PCR de ~ 3 gramos se colocaron aleatoriamente en tanques de plástico de 120 litros llenos de agua salobre de 20 litros por 100 litros y atendidos por un biofiltro basado en un puente aéreo (28.14 ± 0.75 grados-C, pH 7.87 ± 0.05, y OD 2 6.82 ± 0.01 mg por litro, y un ciclo de luz / oscuridad de 12:12 horas). El ensayo de 40 días comprendió un período de adaptación de un día, un período de alimentación de 28 días, un desafío de inmersión EMS / AHPND de un día y un estudio de mortalidad posterior al desafío de 10 días. Se utilizó una densidad de población de 20 camarones por tanque (200 camarones por metro cúbico) y el experimento comprendió ocho grupos con cuatro réplicas. El aislado bacteriano utilizado se re- colectó de Penaeus vannamei infec- tado con EMS / AHPND de una granja de camarones en Loc An, provincia de Vung Tau, Vietnam. El caldo de
Tabla 1. Formulación de ingredientes (kg / MT) y composición próxima de las dietas utilizadas para alimentar a L. vannamei.

soja tríptico + cloruro de sodio al 2 por ciento (TSB +) se inoculó con una cepa virulenta constante de V. parahaemolyticus , se incubó durante 24 horas y se añadió directamente a los tanques para lograr una densidad de 7,5 × 10 5 UFC / ml, que se esperaba matar el 90 por ciento de camarones de control positivo dentro de los 10 días posteriores al desafío Los controles positivos y los tanques de tratamiento fueron sometidos a un desafío de inmersión, mientras que los controles negativos no inoculados se trataron con TSB + estéril, lo que significa que los camarones no fueron desafiados con la bacteria. Los camarones fueron alimentados con su dieta respectiva hasta saciedad 4 veces al día (5-10 por ciento de peso corporal) durante la duración de la prueba. La cantidad de alimento se ajustó en función de la biomasa del tanque y el comportamiento de alimentación de los camarones. El consumo de alimento, el comportamiento general y la supervivencia durante todo el ensayo se registraron diariamente a las 08.30, 11.00, 14.30 y 20.00 h. Los camarones fueron ali- mentados con una de las 6 dietas ex- perimentales o una dieta comercial positiva y negativa (Grobest Feed # 2; Tabla 1). Las fórmulas completas están disponibles bajo petición.
Resultados y discusión
Los camarones sobrevivientes dupli- caron su peso durante el período de prueba. Los grupos de control negativo alimentados con la dieta comercial arrojaron una supervivencia de 97.1 ± 3.42 por ciento durante la duración del ensayo. Sin embargo, la infección con el inóculo de V. pa- rahaemolyticus resultó en mortalidad en todos los grupos expuestos (Fig. 2). Las tasas de supervivencia más bajas las experimentaron los camarones alimentados con dieta 3> dieta 2> dieta 1> dieta 4> Grob +> dieta 5> dieta 6 (Fig. 2). La supervivencia del camarón para aquellos alimentados con la dieta Veramaris® / Menon® 6 fue significativamente (P <0.01) mayor que todos los otros grupos desafiados. Todos los demás grupos experimentales y la alimentación comercial positiva arrojaron tasas de mortalidad similares (P> 0.05; Fig. 2).
FO y FM son recursos finitos. Su oferta puede fluctuar debido a eventos naturales como El Niño, que, a su vez, puede verse afectado por el cambio climático global. Además, existe una competencia cada vez mayor por el FO por parte de sectores como el farmacéutico, el cosmético y el de la alimentación animal, y se ejerce presión para utilizar el pescado forrajero para la alimentación humana. Los usuarios tradicionales de FO incluyen fabricantes de pinturas, lubricantes y recubrimientos, y las industrias de curtido, caucho, aceite comestible, jabón y cera sintética. Por lo tanto, es poco probable que los suministros de FO puedan satisfacer las necesidades actuales cuando se combinen con un sector de acuicultura en rá-
Fig. 2: Porcentaje de supervivencia de diferentes grupos de camarones blancos del Pacífico alimentados con diversas dietas e inmersión desafiada por V. parahaemolyticus, la causa de EMS / AHPNS. Com - / + = control comercial negativo / positivo. Diferentes superíndices significan diferencias significativas (P <0.05) entre tratamientos.
pido crecimiento. Incluso en el caso poco probable de que otros consumidores reduzcan el uso de FO, su costo inevitablemente aumentará. Por lo tanto, una reducción / elimina- ción de FO de los alimentos acuíco- las es fundamental para respaldar las trayectorias de crecimiento proyectadas y al mismo tiempo proporcionar al negocio una orientación más ecológica. Las observaciones aquí determinan que el 100 por ciento de FO se puede reemplazar con éxito en alimentos acuícolas por aceite derivado del thraustochytrid S. limacinum . Este protista se caracteriza por un alto contenido de lípidos y es particularmente rico en DHA.

Además, la dieta que contiene Veramaris® / Menon® MrFeed® - dieta 6 - arrojó niveles de supervivencia estadísticamente más altos que la alimentación comercial de control positivo o la dieta experimental. Estos resultados respaldan los beneficios asociados con la inclusión de MrFeed® Pro50®, reflejados como una tasa de supervivencia de camarones más alta relacionada con una capacidad inmune mejorada. Según lo informado por Zendejas Hernández (Desafíos en la nutrición y sostenibilidad del camarón. Aquaculture America, Honolulu, Hawai, EE. UU. Del 9 al 12 de febrero de 2020. 727.), el alto contenido de nucleótidos y péptidos de cadena pequeña de MrFeed® Pro50® mejora los camarones estado nutricional y respuesta inmune.
Disparos a la luna de Aquafeed en el ‘show de talentos’ F3 Otros estudios que han agregado microalgas a las dietas de crustáceos informan un efecto inmunoestimu- lador. Por ejemplo, la adición de las algas verdes de células individuales Chlorella, que reemplaza del 6 al 8 por ciento del componente FM de la alimentación, aumentó el recuento de hemocitos y la actividad de la pro- fenol oxidasa (PO) en las postlarvas del langostino gigante de agua dulce. PO es un importante mecanismo de defensa innato similar a la cascada del complemento de los mamíferos. Al igual que nuestros hallazgos con el desafío V. parahaemolyticus y Ve- ramaris® / Menon®, las dietas basadas en Chlorella parecieron mejorar la resistencia a la infección por Aeromonas hydrophila. La incorporación de la microalga Dunaliella salina halófita (tolerante a la sal) al 2 por ciento de la dieta del camarón tigre negro mejoró el estado antioxidante y aumentó la tasa de supervivencia del virus del síndrome de la mancha blanca . Los estudios futuros con dietas y camarones basados en Veramaris® / Menon® investigarán la dinámica del sistema inmunitario para mejorar nuestra comprensión actual de los beneficios de este sustituto de FO / FM para camarones y peces. Otro tema que se ha vuelto más prominente en general se relaciona con la seguridad alimentaria.
Ahora está claro que algunos peces forrajeros utilizados en la reducción de FM / FO pueden estar contaminados con toxinas orgánicas persistentes como dioxinas y furanos, metales pesados y otros contaminantes que pueden bioacumularse en animales de granja. Estos tóxicos tienen el potencial de tener impactos negativos en una variedad de procesos de control fisiológico en organismos cultivados y usuarios finales. Si bien las nuevas tecnologías reducen y eliminan algunos de estos contaminantes durante la fabricación de FO, se incurre en gastos adicionales.
Perspectivas
Debido a su entorno de producción controlado, S. limacinum evita to- dos los problemas asociados con los contaminantes ambientales y, por lo tanto, representa un ingrediente no contaminado. La tecnología de cultivo en masa para Schizochy- trium ya está bien desarrollada y se anticipa que grandes cantidades de Vermaris® se producirán inminentemente como un sustituto de FO para alimentos acuícolas. El presente estudio demuestra categóricamente que los camarones, y probablemente muchas otras especies, se pueden cultivar sin FM y FO, lo que permite que la expansión de la acuicultura continúe sin cesar, a pesar de las fluc- tuaciones en los recursos de FM / FO Autores: EWEN MCLEAN, PH.D. West Columbia, Carolina del Sur, EE. UU. ewen.mclean@gmail.com FT BARROWS, PH.D. Aquatic Feed Technologies LLC Bozeman, Montana, EE. UU. KELLY ALFREY Instituto Antropoceno Palo Alto, California, EE.UU. LOC TRAN, PH.D. ShrimpVet Laboratory Ciudad Ho Chi Minh, Vietnam JY MÉVEL, PH.D. Verde y azul, República Democrática Popular de Vientiane Lao
Este artículo fue publicado en GAA, abril de 2020. Fuente: https://www.aquaculturealliance. org/advocate/study-replaces-dietaryfish-oil-with-microalgal-oil/








