
58 minute read
Dinámi a de re imiento esta ional
Dinámica de crecimiento estacional y tasas máximas de crecimiento potencial de pargo de Australia (Chrysophrys auratus) y salmonete de ojos amarillos (Aldrichetta forsteri)
La estacionalidad puede tener una gran influencia en la dinámica de crecimiento de los teleósteos tem- plados que alterna entre mantener el máximo rendimiento de creci- miento y limitarlo al mínimo. Sin embargo, los efectos pueden no siempre ser fácilmente discerni- bles, y las especies usan diferentes estrategias para lidiar con la osci- lación anual en variables ambien- tales. En este estudio comparativo realizado en Nueva Zelanda, el pargo (Chrysophrys auratus) y el salmonete de ojos amarillos (Aldri- chetta forsteri) estuvieron expues- tos a condiciones estacionales du- rante 12 meses bajo un régimen de alimentación ad libitum para investigar si una dieta sin restric- ciones puede producir una res- puesta estacional clara en su perfil de crecimiento y, suponiendo que los alimentos sean limitantes en la naturaleza, cuáles serían sus tasas máximas de crecimiento potencial. Los datos mostraron un fuerte efecto estacional sobre los pará- metros de crecimiento y el reparto de energía en el pargo, mientras que no hubo respuestas depen- dientes estacionales en el sal- monete. El pargo mostró un cre- cimiento exponencial durante el período cálido y lo contrario fue evidente en el invierno cuando el crecimiento cesó y se volvió inclu- so negativo. El salmonete creció constantemente durante todo el año con solo una ligera desviación de la trayectoria de crecimiento lineal en invierno. Las tasas de crecimiento máximas de Snapper correspondieron con la tempera
Advertisement
- El potencial de crecimiento del pargo australasiano, una importante pesquería de Nueva Zelanda, aún no se comprende completamente.
- El salmonete de ojos amarillos es un ecotipo diferente, con un perfil econó- mico bajo pero con una estrategia de crecimiento única.
- Los peces fueron alimentados ad libitum durante un año para determinar las tasas máximas de crecimiento potencial (GR) y la estacionalidad en la dinámica de crecimiento.
- El pargo creció estrictamente estacional mientras que el salmonete, debido a la cantidad ilimitada de alimentos, creció linealmente socavando los efectos estacionales.
- El pargo GR máximo puede aumentar con un mayor aumento de la temperatura, mientras que el salmonete creció mejor a 17/18 ° C. tura ambiente más alta en el pi- co del verano. Por lo tanto, este estudio no pudo determinar las tasas máximas de crecimiento potencial para el pargo, ya que posiblemente aumentaría con un mayor aumento de la temperatura. En contraste, el salmonete pare- ció crecer más rápido a ∼17 / 18 ° C. En términos de condición de los peces, los pargos dividieron los recursos para maximizar la su- pervivencia en el invierno al pa- sar de la inversión al crecimien- to a las reservas de energía en la transición entre otoño e invierno, mientras que el salmonete de ojos amarillos se centró en maximizar la acumulación de grasa visceral para alcanzar niveles óptimos de ∼15% del cuerpo masa, que era independiente de la temperatura ambiental. Los resultados de es- te estudio sugieren que las tasas de crecimiento en salmonetes ba- sadas en la talla silvestre pueden ser limitadas para la alimentación, mientras que esto no se puede su- gerir para el pargo silvestre. Mien- tras que el salmonete de ojos ama- rillos se centró en maximizar la acumulación de grasa visceral para alcanzar niveles óptimos de ~ 15% de masa corporal, que era independiente de la temperatura ambiental. Los resultados de es- te estudio sugieren que las tasas de crecimiento en salmonetes ba- sadas en la talla silvestre pueden ser limitadas para la alimentación, mientras que esto no se puede sugerir para el pargo silvestre.
Palabras clave Crecimiento de los peces Estacionalidad Dieta sin restricciones Particionamiento de energía Pargo y Mójol
Los cambios estacionales en la temperatura del agua tipifican la zona templada, y los ectotermos acuáticos se han adaptado a esos cambios, desarrollando estrate-

gias para maximizar su estado fí- sico y supervivencia ( Gotthard, 2001 ). Se sabe que la temperatura afecta el suministro de alimentos, la probabilidad de captura de ali- mentos, la fisiología de la digestión, la absorción y la conversión de nu- trientes, lo que en consecuencia afecta el crecimiento ( Kestemont y Baras, 2001 ; Rountrey et al., 2014 ; Boltaña et al., 2017 ). Las elevaciones del tiempo de prima- vera en la temperatura ambiente coinciden con el alargamiento del fotoperíodo y un aumento en la ac- tividad de alimentación, consumo de alimento y tasas de crecimien- to en muchas especies de peces ( Smith et al., 1993 ; Tveiten et al., 1996 ;Shuter et al., 2012 ). Estas señales estacionales son utiliza- das por peces templados para cronometrar su comportamiento de alimentación, crecimiento y re- producción dentro de ciclos anua- les predecibles ( Houlihan et al., 2001 ). La temperatura y el foto- período son, por lo tanto, factores importantes que rigen el compor- tamiento de alimentación de los peces y el rendimiento del creci- miento ( Karaås, 1990 ; Griffiths y Kirkwood, 1995 ; Jobling, 2002 ; Lohne et al., 2012 ). La abundancia de alimentos es otro importante impulsor del crecimiento en ambientes tem - plados. La disponibilidad de ele- mentos de alimentación puede ser espacialmente impredecible (irre- gular y temporalmente variable) y, por lo tanto, puede influir en los cambios estacionales en la fase en los ritmos de alimentación ( Ma- drid et al., 2001 ; López-Olmeda et al., 2012 ). En consecuencia, la disponibilidad de alimentos puede desempeñar un papel importante en la limitación del crecimien- to máximo en peces templados ( Jones, 1986 ; Jobling, 2002 ; Le Pape y Bonhommeau, 2015 ) La variación estacional en la condi- ción de los peces se ha informado para muchas especies templadas y está altamente correlacionada con la ingesta de alimento y las cantida- des de reservas de energía acumu- ladas ( Blackwell et al., 2000 ; Vo- llenweider et al., 2011 ; Alcaraz et al., 2015 ). Para los peces juveniles, generalmente se cree que la opti- mización de la supervivencia se caracteriza primero por tratar de superar los riesgos de depredación maximizando el crecimiento en longitud, pero en el momento ade- cuado se requiere la asignación de energía para cambiar al pro- ceso de acumulación de reservas de energía para mantener condi- ciones de invernada desafiantes ( Post y Parkinson, 2001 ; Díaz et al., 2009 ; Sim-Smith et al., 2013 ). Como juveniles, dos peces de Nueva Zelanda, el pargo (Spari- dae: Chrysophrys auratus ) y el sal- monete de ojos amarillos / YEM (Mugilidae: Aldrichetta forsteri ) comparten los mismos hábitats costeros y costeros, aunque re- presentan dos ecotipos diferentes cuyo estilo de vida y fisiología co- rrespondiente parecen ser consi- derablemente diferente ( Flikac et al., 2020 ). El pargo es un depre- dador oportunista demersal, k- se- leccionado, de larga vida, con un alto estatus comercial (Hartill et al., 2003; Parsons et al. 2014). Por el contrario, es un YEM r Selec- tos, de corta duración, omnívoro / detritívoro especies de menor importancia económica ( Taylor y Paul, 1998 ; . Coubrough et al, 2004 ; Curtis y Shima, 2005) En términos de rasgos de crecimiento, el pargo, característico de muchos peces templados, posee un patrón de crecimiento estacionalmente dependiente, donde el crecimien- to rápido y la reducción del cre- cimiento representan el verano y el invierno, respectivamente. El crecimiento general a lo largo de la vida tiene una trayectoria asintó- tica ( Francis, 1994 ; Jackson et al., 2010 ), y su crecimiento en la na- turaleza puede estar limitado por los alimentos, al menos durante el invierno ( Bell et al., 1991 ) cuan- do es probable que haya efectos sinérgicos de disminución en El suministro de alimentos y la baja temperatura hacen que el creci- miento cese o incluso se vuelva negativo ( Francis, 1994 ; Cook et al., 2003) YEM es una especie de euryhaline que reside permanen- temente en ambientes costeros / estuarinos menos profundos. Estos hábitats imponen la adaptación fisiológica necesaria a las grandes oscilaciones diarias y estacionales en la temperatura ambiente que en algunas localidades (por ejemplo, Australia Occidental) se combinan con un crecimiento anual esta- ble incluso durante los meses más fríos ( Chubb et al., 1981 ). Ade- más, Curtis y Shima (2005) sugi- rieron que el crecimiento de YEM en algunas áreas alrededor de Nueva Zelanda puede ser atípico ya que la trayectoria parecía más lineal que asintótica. Sin embar- go, la exploración adicional de estos rasgos de crecimiento YEM prácticamente no ha atraído la atención en la literatura primaria. Jobling (1994) recomendó que las directrices para la medición del crecimiento y la energía de pe- ces comercialmente importantes deberían incluir datos sobre las tasas máximas de crecimiento al- canzables en diferentes condicio- nes ambientales. La disponibilidad de alimentos en la naturaleza se considera uno de los principales factores que afectan el rendimien- to del crecimiento de los peces, debido a su irregularidad tempo- ral y espacial e irregularidad en el suministro estacional, por lo que la medición del rendimiento máxi- mo de crecimiento en los peces silvestres es un desafío (Jobling, 1994) Se desconoce el conoci- miento de los perfiles anuales de alimentación y crecimiento, par- ticularmente las tasas máximas de crecimiento potencial para las poblaciones de Nueva Zelanda de las dos especies seleccionadas, y dado que puede ayudar a evaluar sus capacidades y limitaciones de crecimiento como especies impor- tantes en la pesca costera y como acuicultura potencial en Nueva Zelanda / candidatos de mejora de acciones esta información es de particular interés. Por lo tanto, este estudio, al combinar atributos de las condiciones ambientales (agua de mar y luz) y de cultivo (suminis- tro de alimentos controlado / ilimi- tado) fue diseñado para ejecutarse durante 12 meses consecutivos para abordar dos objetivos princi- pales. Primero, para caracterizar el perfil de crecimiento anual de las especies de prueba determi- nando sus tasas máximas de cre- cimiento potencial, y segundo,
2. Material y métodos 2.1. Uso de animales y procedi- mientos de cría
El pargo (Chrysophrys auratus), de origen de cría silvestre, se in- cubó en noviembre de 2013 en las instalaciones de Investigación de Plantas y Alimentos (PFR), Nelson, Nueva Zelanda y se crió durante 11 meses con una dieta de pellets de pescado comerciales (Nova ME de 2,3 y 3 mm) , Skretting pellets, Australia) y un alginato formulado internamente (gel) proporcionado en una ración de ∼2% del tanque de masa de pescado −1 día -1 . A la edad de ~ 11 meses, 2 grupos se- leccionados al azar de 156 pargos se colocaron en dos tanques circu- lares de flujo continuo de 5000 L (T1 y T2), lo que marcó el comien- zo del experimento de crecimiento de 12 meses. Salmonete juvenil de ojos amarillos (YEM, Aldri- chetta forsteri) fueron capturados en febrero de 2015 en el Nelson Haven. Se seleccionaron peces de 120–150 mm de longitud de horquilla (FL) para el estudio y 392 YEM se dividieron entre dos tan- ques de 5000 L y se dejaron acli- matar durante dos meses con una dieta de mantenimiento de gránu- los de pescado comerciales. Se requirieron números iniciales más altos de YEM que el pargo ya que la tasa de mortalidad para el período de aclimatación, como se espe- raba para los peces salvajes, fue mayor para YEM (∼6%) que lo que se observó normalmente para el pargo cultivado de la misma edad (<2%). Se supuso que los peces de este tamaño tenían entre 12 y 18 meses de edad de acuerdo con la talla disponible a las edades ( Cur- tis y Shima, 2005 ). El experimento de crecimiento se inició en abril de 2015 y finalizó en abril de 2016. Todos los peces experimentales fueron criados en condiciones de baja densidad de población donde los niveles iniciales de pargo (1.10 kg m -3) se mantuvieron hasta la finalización del estudio (1,25 kg
Industria Acuicola | Mayo 2020 | 17 Industria Acuícola | Investigación ............................................................................................................................... ............................................................................................................................... ......................... m 3 ). Este no fue el caso para YEM donde la densidad inicial (0.9 kg m -3 ) aumentó al final del experimento de crecimiento (3.35 kg m -3 ). La mortalidad natural para el período experimental fue del 6% para el pargo y del 8% para YEM. El agua de mar para los tanques se suministró direc- tamente desde Nelson Haven, Tasman Bay, Nueva Zelanda (coordenadas de latitud: -41.254412, longi- tud: 173.280118). La capacidad de flujo continuo se mantuvo a 35-50 L minuto- 1 con agua filtrada con arena que logró una química y salinidad estables (34-35 ppt). El pH del agua se mantuvo estable (∼8.2) mediante aireación manteniendo simultáneamente niveles de oxígeno disuelto no menos del 90% de saturación. Los tanques estaban en un área expuesta a condiciones de luz natural a través de una cubierta Duraflex blanca (Redpath Pacific Ltd, Palmerston Nor- th, Nueva Zelanda) que permite un efecto de sombra del 70% y la preservación del perfil espectral casi completo. Para evitar la aparición del efecto de tanque que puede producirse si los tanques experimentales se ubican junto a las pasarelas de uso común ( Speare et al., 1995), los tanques utilizados en los experimentos de crecimiento se eligieron a propósito para no aso- ciarse con los senderos principales. Las condiciones estacionales en Nelson Haven son: luz diurna más larga - 22 de diciembre 15:09:43, luz diurna más cor- ta - 21 de junio 9:11:30 ( https://www.timeanddate. com/sun/new-zealand/nelson ); temperatura más alta del agua de mar - febrero ∼23 ° C, más baja - agosto ∼8.5 ° C (estación de monitoreo PFR, Nelson). 2.2 . Etiquetado de peces experimentales Las pruebas de crecimiento comenzaron con una sesión de marcado y tomar medidas morfométricas de los peces (es decir, masa y FL) por primera vez. El propósito del etiquetado era asegurar una identifica- ción instantánea de los sujetos durante las sesiones mensuales de medición. Aproximadamente la mitad de los peces por tanque fueron marcados. Los peces sin etiquetar se destinaron al muestreo mensual de tejidos y órganos requerido para la determinación de los índices corporales (este estudio) y el posterior análisis bioquímico (en preparación). Para el marcado, se utilizaron etiquetas de transpondedor integrado pasivo (PIT) recubiertas de vidrio de 12 mm (AVID Identification systems Inc, CA, EE. UU.). Los peces fueron anestesiados (25 ppm de AQUI-S ™, AQUI-S New Zealand LTD, Lower Hutt, Nueva Zelanda) y ∼30 min después, cuando la etapa 4 de la anestesia ( Schoettger y Julin, 1967) se alcanzó, el etiquetado comenzó. Las etiquetas PIT se aplicaron con la pistola de aguja hipodérmica suministrada por AVID en la cavidad peritoneal. Tras el marcado, se escanearon los peces (escáner Power Tracker 2, AVID Identification systems Inc, CA, EE. UU.) Y se registraron la masa y el FL. 2.3. Régimen de alimentación semanal y composi- ción de la dieta. Durante el estudio de crecimiento, ambas especies de peces se mantuvieron bajo el mismo régimen de ali- mentación semanal diseñado para mantener las tasas máximas de crecimiento al tiempo que se mantiene la salud y el bienestar de los peces. El régimen de alimentación de 7 días estuvo compuesto por: -Lunes, martes y sábado: dieta de acuicultura co- mercial (gránulos de 4 mm, Nova ME, Skretting, Australia; composición nutricional: proteína cruda 50%, lípidos crudos 17%, carbohidratos 17%, hu- medad 7%, cenizas 9%, fósforo total 1.3% , ener- gía bruta 21.5 MJ, energía digestible 19.0% MJ.) -Miércoles, jueves, viernes: alginato formulado internamente (Composición nutricional: proteí - na cruda 21.3%, grasa total 2.7%, carbohidratos 5.6%, humedad a 105 ° C 62.7%, cenizas 7.7%) -Domingo: sin alimentación.
El régimen de alimentación se basó en una metodología de ali- mentación estándar desarrollada por PFR para fines de investiga- ción y, como tal, se ha adaptado para este estudio con la diferen- cia de que los peces fueron ali- mentados hasta la saciedad en cada evento de alimentación.
2.4. Mantener el protocolo ilimi- tado de alimentos.
El experimento de crecimiento re- quirió un protocolo que aseguró la saciedad de los peces durante todos los días de alimentación. Los peces fueron alimentados 3-4 ve- ces al día de lunes a sábado. Al final de una pelea de alimentación, los tanques fueron inspeccionados visualmente en busca de restos de comida. La confirmación visual no siempre fue posible, por lo tanto, un enfoque, descrito en Booth et al. (2008) se adoptó: el primer día después del marcado, los peces fueron alimentados 3 veces con una ración diaria de 4.5% de la masa combinada de peces en un tanque. A la mañana siguiente, se pesó la alimentación no consumi- da recogida en la cesta de malla (tamaño de malla 3 mm), unida a la tubería de salida. Si se recolec- tó ≤30% del alimento dado el día anterior al día siguiente, la ración se incrementó en un 10%. Cuan- do se recogió ≥50%, la ración se redujo en un 10%. El monitoreo del porcentaje de alimento no consumido se programó para 1–2 veces por semana.−1. Este siste- ma funcionó solo para alginato ya que el alimento granulado se descompuso fácilmente en los re- colectores. Sin embargo, los grá- nulos como alimento seco con un contenido energético y nutricional mucho más alto, en relación con el alginato, se ofrecieron en las mismas cantidades que el algina- to, lo que garantiza que los peces se alimentaron hasta la saciedad independientemente del tipo de alimento proporcionado.
2.5. Toma de medidas y muestreo para el análisis morfométrico.
Las mediciones de crecimiento se tomaron a intervalos mensua- les, excepto el pargo en invierno, cuando la frecuencia de muestreo / mediciones se redujo a aproxima- damente un muestreo por 6 sema- nas para evitar el manejo excesivo a temperaturas frías de invierno que se sabe que aumentan la tasa de mortalidad (observación per- sonal; Ibarz et al., 2010 ). Esto no se implementó para YEM que no exhibió un aumento en la mortali- dad al manejar durante los meses más fríos.
Antes de la medición / muestreo de peces en ayunas durante ∼40 h, lo que se consideró suficiente para la evacuación intestinal completa ( Booth et al., 2008 ; Flikac et al., 2020 ). El muestreo comenzó a las 9-10 am con sedación (20-25 ppm AQUI-S). Después de 20 minutos, los peces ingresaron a la aneste- sia de la etapa 3b ( Schoettger y Julin, 1967 ) permitiendo la iden- tificación del escaneo seguido de pesaje (g, Mettler PE 6000, Mettler-Toledo, LLC, Columbus, OH 43240, EE. UU.) Y medición de FL al milímetro más cercano . Se muestrearon al azar siete u ocho peces sin etiquetar de cada tanque, según se requiera para la generación de conjuntos de datos morfométricos / bioquímicos. El número total de peces sacrifica- dos fue de 186 pargos y 208 YEM.
2.6 . Condición de los peces y pa- rámetros de crecimiento.
La relación masa-longitud (MLR) se determinó con la ecua- ción: M = aLᵇ , donde a y b son constantes (parámetros), M es la masa húmeda de todo el cuerpo (g) y L es FL (mm) ( M y L son va- riables) . El reordenamiento log₁₀ de MLR: log (M) = log (a) + b * log (L) + e (término de error), tiene la forma de un modelo lineal, por lo tanto, adecuado para ajustar log₁₀ (M) y log₁₀ (L) a regresión lineal para estimar los parámetros a (in- tersección) yb (pendiente). La masa relativa en relación con la masa media (Rm) fue el méto- do utilizado para investigar las diferencias de condición relati- va dentro y entre las dos espe- cies de prueba, expresadas co- mo: Rm(%) = 100 M / (amLˆbm) Donde am es la media geomé- trica de a , y bm es la media aritmética de b , en todas las estimaciones de masa-longitud disponibles para una especie co- mo parámetros de la MLR me- dia. Las variables M y L son co- mo se describieron anteriormen- te. Parámetros de MLR a y b se calcularon para todos los puntos de medición, tomadas mensual (YEM) o mensual / bimensual (par- go) según sea necesario para el cálculo de Rm ( Froese, 2006 ). Ganancia de masa anual relativa (longitud), RAM (L) G, expresada como:
RAM (L) G = 100 (M (L) fn – M (L) in) / (M (L) in) Estos son porcentajes del aumen- to total anual de masa y longi- tud, medidos para todos los pe- ces en tanques entre la primera y la última medición. M (L) fn re- presenta los valores medios de masa y talla al final del estudio de crecimiento y M (L) en valo- res promedio de masa y longi- tud iniciales de todos los peces. Ganancia de masa (longitud) anual absoluta, AAM (L ) G es un aumento de masa (o longi - tud) absoluto medido para todos los peces en tanques entre las primeras mediciones y las medi- ciones finales, expresado como: AAM (L) G =M (L) fn - M (L) in Donde M (L) fn – M (L) son los valores medios de masa final y FL medios, y los valores medios de masa inicial y FL medios res- pectivamente de todos los peces. Tasa de crecimiento de la masa específica (longitud) ( SMGR / SL- GR ) , el porcentaje promedio de masa corporal (o longitud) aumenta el día -1 entre dos puntos de mues- treo / medición, expresado como: SM (L) GR = 100 (InM(L) lt – InM (L) ER)/t Donde lnM (L) lt es un logaritmo natural de masa corporal (g) o FL (mm) de la medición posterior de dos puntos de medición consecu- tivos, e lnM (L) er es un logaritmo natural de masa corporal o FL de la anterior medición de dos puntos de medición consecutivos para el pez individual, y t es el número de días transcurridos entre los dos puntos de medición consecutivos. Crecimiento anual de masa / FL: me- diciones sucesivas mensuales / bi- mensuales de masa media (g) y lon- gitud media de la horquilla (mm). Porcentaje diario de consumo de alimento (DFC ) por tanque de masa total de peces estimado −1 : El cálculo de DFC se basó en mediciones de restos de ali - mento, expresados como: DFC (%)=100 Mef /Mtf Donde Mef es la masa total de alimento consumido el día an- terior a la recolección de ali- mentos, Mtf es la masa total es- timada de peces el día anterior a la recolección de alimentos.
2.7. Morfometría suplementaria.
Los índices corporales de interés fueron: índice relativo de masa destripada (índice de masa des- tripada - IMG), índice hepato-so- mático (HSI) y lípido visceral (me- sentérico) (VLI); expresado como: Body Indices (%bodymass) = 100 OM/TM Donde OM representa la masa del hígado, la masa de pescado destripado y la masa de grasa visceral; mientras que TM es la masa corporal total del pez dado tomado después de la eutanasia.
2.8. Métodos de estadística
Para todos los procedimientos es- tadísticos, los datos de ambos tan- ques se agruparon y, cuando fue permitido, el tanque como factor se incluyó en el modelo como un efecto aleatorio o factor de blo- queo. Los análisis estadísticos se llevaron a cabo en SigmaPlot ver- sión 12.5 (Systat Software, Inc., San Jose California, EE. UU., Www. systatsoftware.com ), R ( www.rproject.org ) y Microsoft Win-
dows Excel (2013). Excel se utilizó para explicar los datos de series de tiempo a través de la curva de alisamiento 4 ºfunción polinómi- ca. Este enfoque ayudó a revelar patrones asociados con el cambio estacional de temperatura a través de una prueba de correlación entre los datos de temperatura sin pro- cesar y los datos predichos con la ecuación polinómica ajustada a la variable de respuesta sin proce- sar. Sin embargo, cada vez que el coeficiente de determinación (R²) asociado con la 4ª función polinó- mica era> 0,90, solo se utilizaba el conjunto de datos sin procesar para la prueba de correlación. Se utilizó ANOVA de medidas repetidas (RM) para evaluar las diferencias en los datos relaciona- dos con las series de tiempo, que incluyeron GR y Rm. RM ANO- VA se realizó en SigmaPlot con el tiempo de efecto fijo (es decir, puntos de medición) y los efectos aleatorios peces (sujetos) y tan- que. La normalidad de los resi- duos se probó con la prueba de Shapiro-Wilk y las variaciones de homocedasticidad al comparar los valores absolutos de los residuos con los valores ajustados con una regresión lineal. Cuando se requi- rió, se realizaron transformacio- nes de datos apropiadas. Si eso no resuelve las violaciones de los supuestos, RM ANOVA en las filas estaba justificado. Se detectaron diferencias entre los grupos con Tuckey HSD Pairwise comparacio- nes múltiples de medias o HolmSidak pairwise procedimientos de comparación múltiple. Para pro- bar los efectos de dos factores en múltiples grupos ANOVA de dos vías (índices corporales, tiempo del factor principal - puntos de muestreo, meses; y tanquecomo factor de bloqueo). El ANOVA de dos vías se realizó en R, y las supo- siciones se probaron manualmen- te, de la misma manera que para el ANOVA de RM. Ocasionalmente las transformaciones fallaron, y se empleó el ANOVA de KruskalWallis no paramétrico en los ran- gos. Las diferencias detectadas entre los grupos se identificaron con la prueba de Tukey post-hoc. La prueba de relación (es decir, MLR) a través del modelo de regre- sión lineal se realizó en SigmaPlot. La prueba t de Student se empleó cuando se probó la compara- ción de solo dos grupos (es de- cir, Rm entre especies) y la prueba de suma de rangos de Mann-Whit- ney equivalente no paramétrica se realizó cuando fue necesario.
R se usó donde la manipulación de un modelo era obligatoria, como la investigación de diferencias en MLR entre dos especies. Se con- sideró una diferencia significativa entre dos conceptos o grupos cuan- do el valor de probabilidad P ≤ 0.05. Siempre que la relación entre dos conjuntos de datos de series temporales (p. Ej., Temperatura y una variable de crecimiento) in- dicara fenómenos de retraso, el conjunto de datos en cuestión se ajustó para varios puntos de me- dición (meses) hacia atrás para probar la fuerza de la correlación.
3. Resultados 3.1. Estadística descriptiva de crecimiento
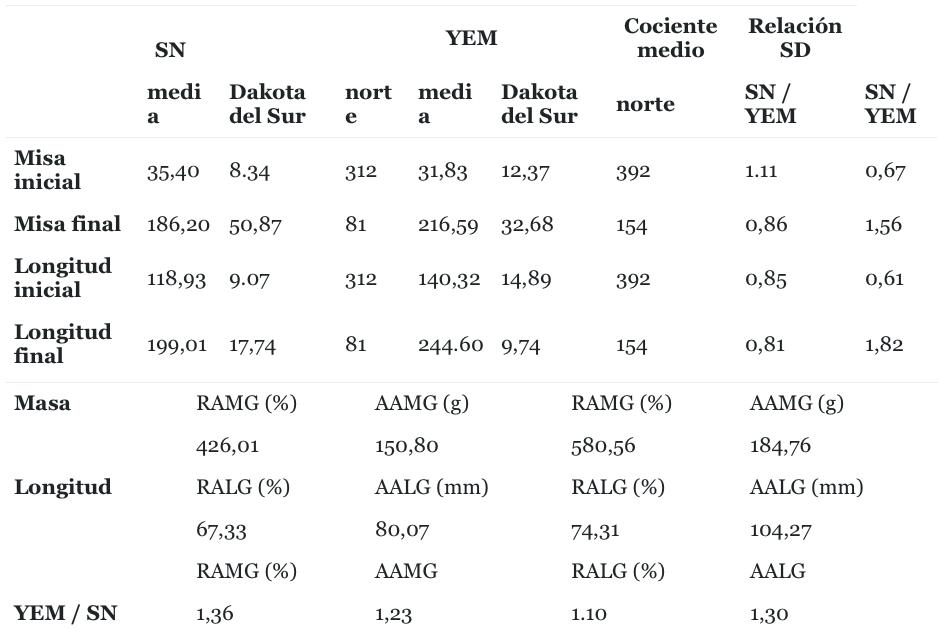
Snapper entró en el experimen- to de crecimiento con una masa media inicial similar, pero esta- dísticamente mayor que la masa inicial de YEM (Mann-Whitney U = 44735.50, p <0.001) cuya varia- bilidad fue 33% más alta ( Tabla 1 ). Sin embargo, al final de los en- sayos, la masa media final de YEM era mayor que la del pargo (U = 3859.50, p <0.001, Tabla 1 ). Ade- más, la variabilidad de masa dentro de la muestra de pargo aumen- tó 6.1 veces, mientras que la de YEM aumentó solo 2.6 veces. Los valores de longitud originales y finales también diferían entre las dos especies, siendo ambas más altas para YEM (U = 12933.00, p <0.001 y U = 78.50, p <0.001 para los valores de longitud ini- cial y final respectivamente, Tabla 1) En términos de variabilidad de longitud, se observó una mayor variación en el pargo a lo largo del tiempo, mientras que se observó una menor variación en YEM. En general, YEM tuvo más "éxito" en los logros de crecimiento, ya que todas las relaciones YEM / pargo derivadas de los cálculos anuales relativos y absolutos estaban por encima de 1 ( Tabla 1 ).
Leyenda: M - masa, L - longitud, SN - pargo, YEM - salmonete de ojos amarillos, RAMG - Ganancia de masa anual relativa, RALG - Ganancia de longitud anual relativa, AAMG - Ganancia de masa anual absoluta, AALG - Ganancia de longitud anual absoluta.
3.2. MLR y condición del pez (Rm)
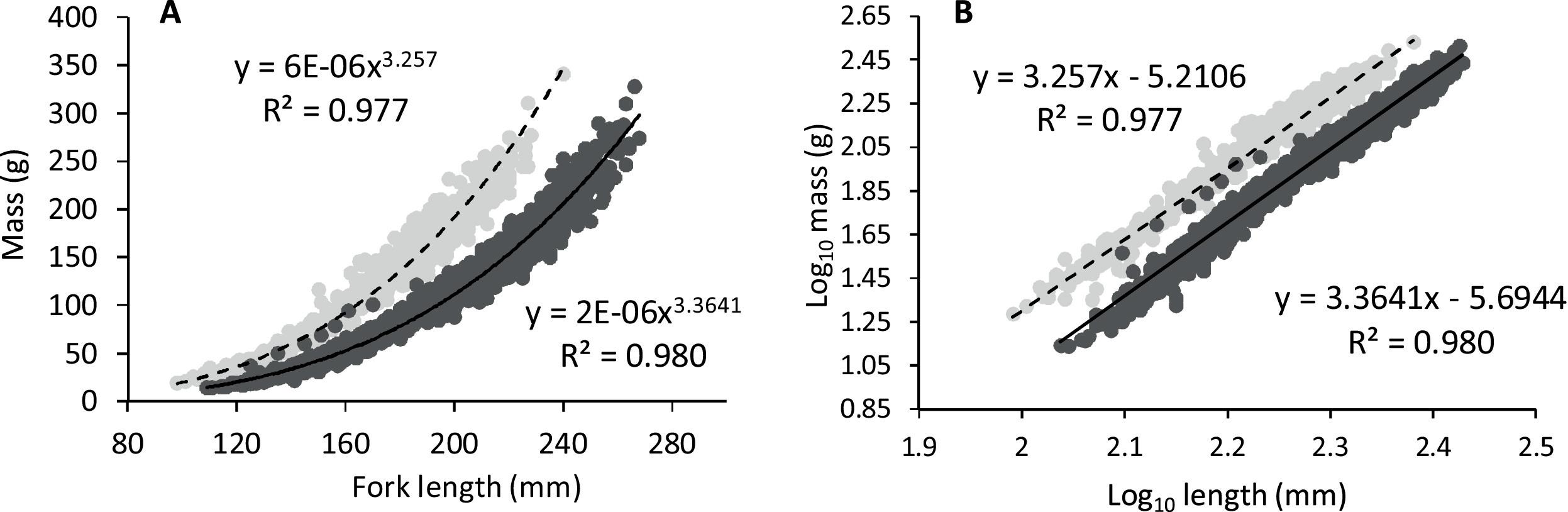
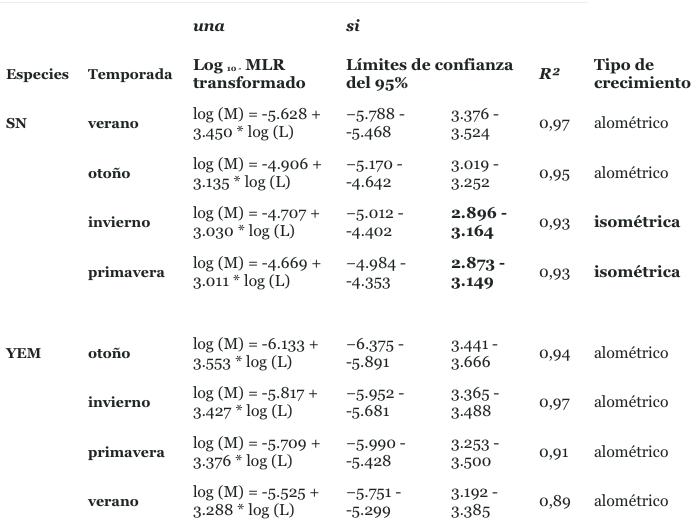
Durante el año del estudio, el pargo mostró crecimiento alométrico ( Fig. 1 A). Los datos transformados de Log 10 pro- dujeron una línea recta con un alto R 2 ( Fig. 1 B). Cuando se calculó la MLR por separado para diferentes estacio- nes, se reveló un tipo de crecimiento isométrico durante el invierno y la primavera ( Tabla 2 ). Además, cuando se compararon las MLR estacionales, era evidente que el único grupo que era estadísticamente diferente era el grupo de verano. Esto se indicó con una interacción significativa entre log₁₀ (L) y la temporada de factores(veranootoño, F₁, ₄₂₈ = 14.25, p <0.001; verano-invierno, F₁, ₄₂₈ = 21.65, p <0.001; verano-primavera, F₁, ₄₂₈ = 24.19, p <0.001). La diferencia fue atribuible al aumento de la masa del pez de verano que fue desproporcionado al aumento de la longitud.
Fig.1. A - pargo (símbolos grises claros y curva discontinua) y YEM (símbolos grises oscuros y curva negra) datos brutos de relación masa-longitud para el período de estudio de crecimiento de 12 meses ajustado al modelo de potencia de dos parámetros (curvas) con ecuaciones asociadas y R²s. B - registrar 10 datos de relación de masa-longitud transformados para pargo (símbolos grises claros y línea discontinua) y YEM (símbolos grises oscuros y línea negra) de la Figura A, ajustados al modelo lineal con ecuaciones asociadas y R²s (líneas).
de Rm de pargo (102.3 ± 6.2 SD, n = 11) no difirió de YEM (100.8 ± 4.8 SD, n = 13). Sin embargo, las respuestas Rm mostraron di- ferentes dinámicas anuales ( Fig. 2 A, Tabla 3 ). Mientras que los datos de YEM se correlaciona- ron de manera moderadamente negativa con la temperatura, los datos del pargo indicaron una afi- liación de temperatura de tiempo de retraso ( Fig. 2 A). Por lo tanto, cuando el conjunto de datos Rm se tomó para 3 puntos de datos hacia atrás, se reveló la conexión entre la temperatura y Rm ( Tabla 3) Dado que la dinámica anual de la tem- peratura del agua de mar se de- termina estacionalmente, esto de- mostró un fuerte efecto estacional en las condiciones de los peces.
Tabla 2. Snapper (SN) y la lisa de ojos amarillos (YEM) log 10 relaciones de masa de longitud transformadas con por cuatro estaciones con intervalos de confianza del 95% para los parámetros a y b con R asociada 2 y los tipos de crecimiento.
El crecimiento alométrico positivo también apareció en el estudio de crecimiento YEM de 12 meses ( Fig. 1 A). A diferencia del par- go, YEM exhibió un crecimiento alométrico positivo durante las cuatro estaciones ( Tabla 2 ). Los modelos de regresión mostraron que en YEM, el cambio relativo de masa fue mayor en otoño (oto- ño-invierno, F₁, ₈₁₇ = 4.68, p = 0.030; otoño-primavera, F₁, ₅₄₄ = 4.18, p = 0.041; otoño-verano, F₁, ₈₂₁ = 13.04, p <0.001). Interes- pecíficamente, un año de intenso crecimiento demostró que el par- go y el YEM tenían características marcadamente diferentes de MLR (F₁, ₂₅₈₂ = 26.18, p <0.001). Las trayectorias MLR en los datos transformados logarítmicamente ( Fig. 1 B) indicaron que YEM en promedio aumentó su masa para cualquier unidad de longitud sig- nificativamente más que el pargo. Rm es una matriz apropiada pa- ra comparar la condición en di- ferentes poblaciones y especies ( Froese, 2006 ). El promedio anual
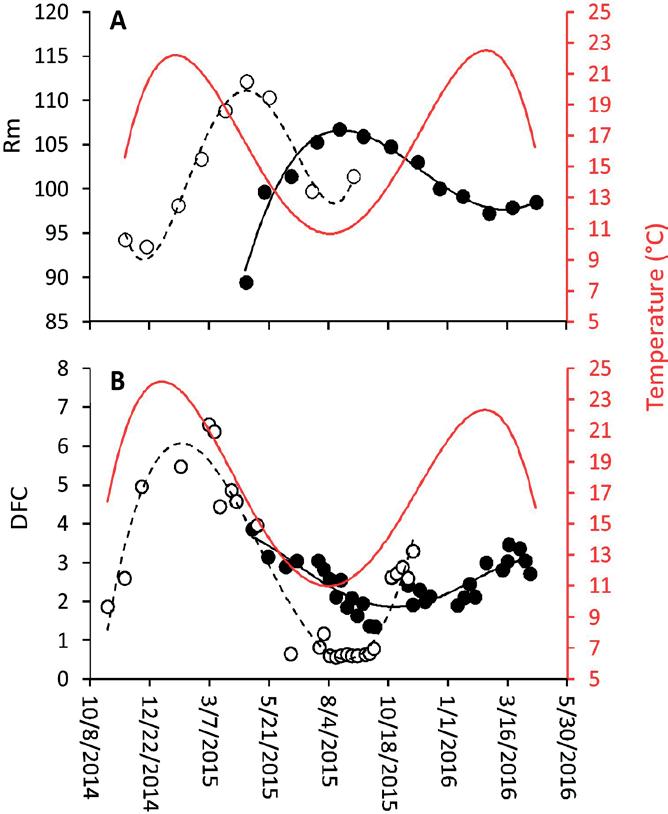
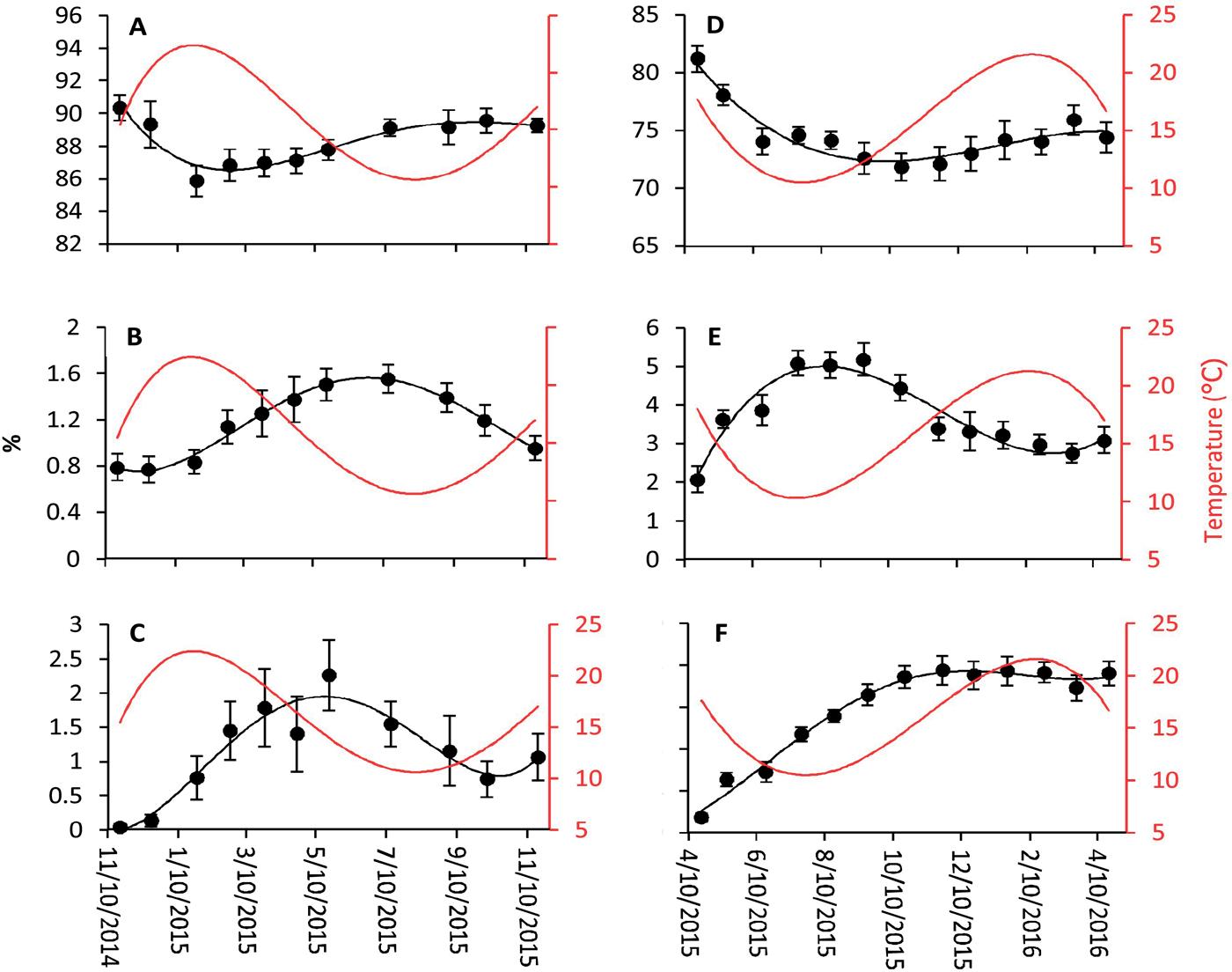
Fig.2. A - Masa relativa ( Rm ,%) y B - Consumo diario de alimento (DFC,% de masa corporal del tanque día −1 ) de pargo (curvas discontinuas y símbolos abiertos) y YEM (curvas y símbolos negros) en la escala de tiempo que abarca los tiempos reales del experimento de crecimiento de ambas especies y superpuesto con la curva de temperatura (rojo). Todas las curvas se derivaron de datos brutos ajustados a la 4ª función polinómica.
Tabla 3. Correlaciones de los parámetros de crecimiento con la temperatura del agua de mar para el pargo (SN) y el salmonete de ojos amarillos (YEM) calculados con datos brutos o sin procesar y el 4 ° polinomio pronosticado con el 4 ° polinomio R² asociado, coeficiente de correlación con sus estadísticas de prueba R², F, valores p, valor de tiempo de retraso (si corresponde, número de puntos de datos de parámetros [meses] que se mueven en la escala de temperatura). El signo negativo (-) delante del coeficiente de correlación indica correlación negativa. La negrita y la cursiva representan los datos con correlación significativa y no significativa con la temperatura, respectivamente.

Leyenda: Rm - masa relativa, SMGR - tasa de crecimiento de masa específica, SLGR - tasa de crecimiento de longitud específica, DFC - consumo diario de alimento.
3.3 . Tasas de crecimiento y temperatura Snapper SMGR parecía seguir estrictamente la temperatura del agua de mar. Esto se enfatizó con la fuerte correlación positiva entre el 4º SMGR polinómico predicho y los datos de temperatura estacional ( Fig. 3 A, Tabla 3 ). SLGR mostró el mismo patrón; sin embargo, durante el invierno, el SLGR promedio no exhibió una fase negativa (es decir, pérdida de longitud) en ningún momento ( Fig. 3 B). En YEM no se observó correlación significativa con la temperatura para ambos SGR ( Tabla 3 ). En general, los SGR de YEM fueron muy altos durante los primeros meses y cayeron sustancialmente después ( Fig. 3A, B). Esto se enfatizó particularmente para SMGR donde el período de crecimiento inicial fue ∼2.5 veces mayor que el promedio de todos los demás datos.


Fig.3 . A - Masa específica (SMGR,% de masa corporal día −1 ) y B - tasa de crecimiento de longitud específica (SLGR,% longitud de horquilla día −1 ); y C - masa anual (g) y D - crecimiento de la longitud de la horquilla (mm) del pargo (curvas discontinuas y símbolos abiertos) y YEM (curvas y símbolos negros). En las líneas C y D se representa el modelo de regresión lineal que explica los datos asociados con la estación cálida (abril a septiembre, líneas negras) y la estación fría (diciembre a marzo, líneas verdes; para más información, ver texto) El resto del título de la figura es el mismo que para la Fig.2 .
Fig.4. Diagrama de dispersión del pargo (A) y YEM (C) SMGR y pargo (B) y YEM (D) SLGR en función de la temperatura para el estudio de crecimiento de 12 meses. Las curvas son la segunda función polinómica ajustada a los datos con ecuaciones asociadas y R²s. Las flechas verticales negras conectan el punto más alto de las curvas (C - la tasa de crecimiento más alta fue de 17.2 ° C; y D - la tasa más alta fue de 18.0 ° C). Tenga en cuenta que los primeros dos puntos de datos que representan los primeros 2 meses en el estudio están excluidos en C y D (para la explicación, consulte la subsección 3.3 ).
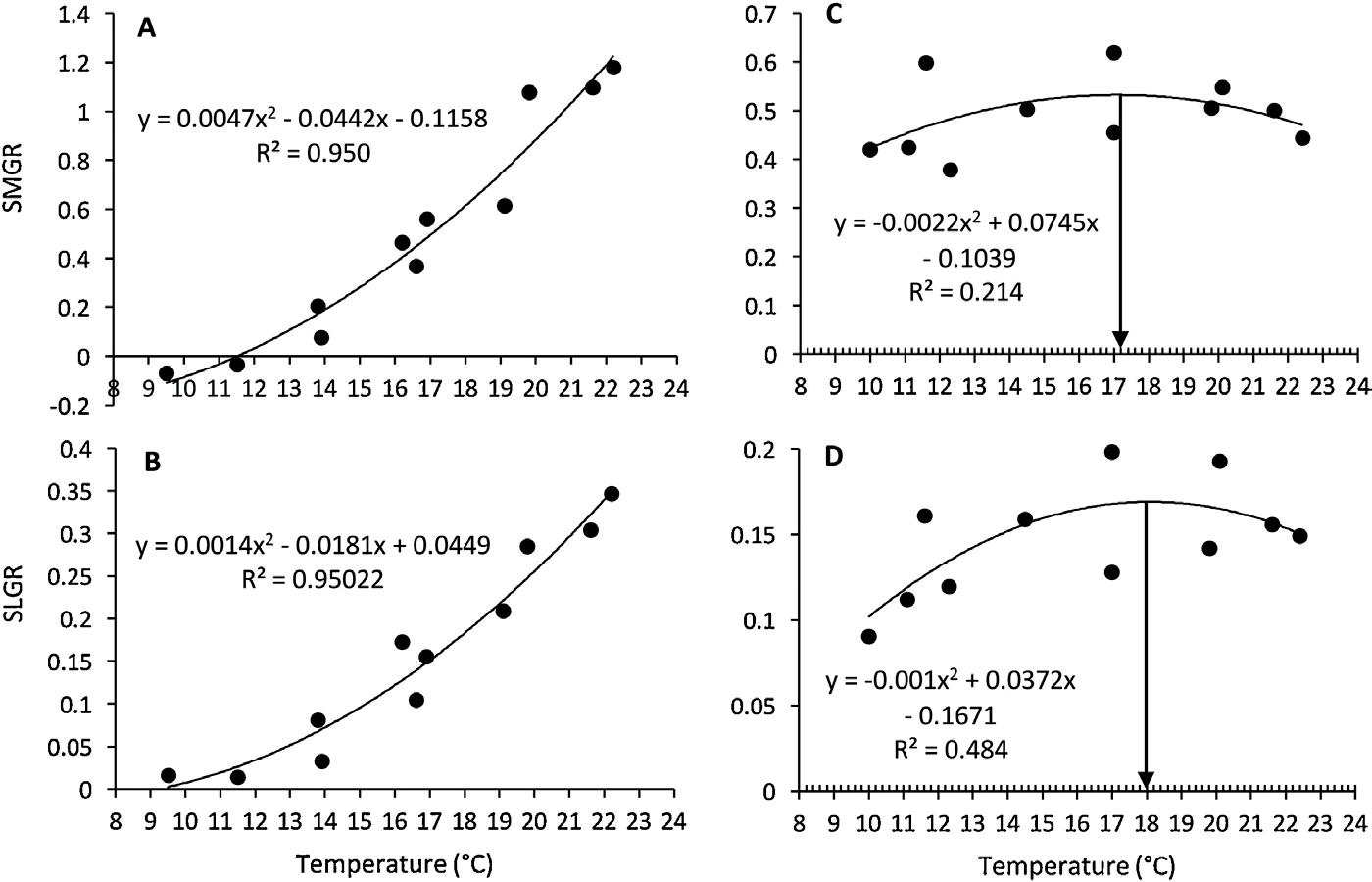
El promedio anual de SMGR y SLGR no difirió estadísticamente entre las dos especies. Sin embargo, el comportamiento del pargo se explicó bien con la trayectoria de la temperatura del agua de mar, mientras que la concordancia de temperatura con los datos de YEM fue aparente solo durante aproximadamente los primeros 6 meses. Además, la diferencia entre los valores más altos y más bajos en los conjuntos de datos fue mayor en snapper en ∼25 y ∼80% para SMGR y SLGR respectivamente. Los SGR máximos del pargo se alcanzaron a la temperatura más alta del agua de mar para los valores de masa y longitud y, por el contrario, se observaron las tasas más bajas a la temperatura más baja. La segunda función polinómica explicaba mejor el carácter de la relación ( Fig. 4 A, B). Al contrario que el pargo, para YEM fue posible determinar la tempe- ratura cuando el crecimiento parecía ser el más sostenido ( Fig. 4 C, D). Se encontraron tasas máximas de crecimiento a 17.2 y 18.0 ° C para SMGR ( Fig. 4 C) y SLGR ( Fig. 4D) respectivamente. Estos valores se determinaron sin incluir los puntos de datos de los primeros 2 meses de las tasas de crecimiento / relación de temperatura, ya que se detectaron valores atípicos por la prueba de desviación extrema estudiantil. En apoyo de la exclusión de valores atípicos, YEM generalmente no parecía estar completamente ajustado al régimen de alimentación de saciedad durante los primeros 2 meses en el estudio. Esto se asumió desde un año después, las tasas fueron notablemente más bajas, aunque a temperaturas similares. El mejor modelo para ajustar los datos fue la 2ª función polinómica, pero la temperatura explicaba solo una variación del 21% en SMGR y una variación del 48% en SLGR, lo que puede implicar que el crecimiento en masa era menos dependiente de la temperatura en relación con el crecimiento en longitud. El inicio del estudio de crecimiento de pargos coincidió con el final de la primavera. Como el verano trae condiciones ambientales óptimas para el crecimiento, durante los primeros 4 meses, el pargo creció exponencialmente (y = 4E-194e 0.0107 * DÍAS, R² = 0.990 e y = 1E-53e 0.003 * DÍAS , R² = 0.993 para crecimiento en masa y FL respectivamente) . La tasa de crecimiento se desaceleró a principios de otoño cuando la temperatura del agua de mar disminuyó a menos de 18 ° C. El crecimiento cesó por completo con el comienzo del invierno y no se reanudó durante aproximadamente 4 meses hasta mediados de la primavera, lo que coincidió con un aumento en la temperatura del agua de mar por encima de los 17 ° C ( Fig. 3DISCOS COMPACTOS). Se observó un patrón diferente para YEM donde un modelo lineal explicaba la mayoría de los datos de crecimiento anual de masa / FL (y = 0.4771x - 20076, R² = 0.955; y = 0.2813x - 11708, R² = 0.990 para crecimiento de masa y FL respectivamente). Sin embargo, se generó un mejor ajuste con un 4to.función polinómica (y = -1E-08 × 4 + 0.0022 × 3–142.48 × 2 + 4E + 06x - 4E + 10, R² = 0.999; y = -2E-08 × 4 + 0.0026 × 3–163.65 × 2 + 5E + 06x - 5E + 10, R² = 0.999 para crecimiento de masa y FL respectivamente). La diferencia entre los dos modelos señala el momento en el año calendario en que el crecimiento se desaceleró durante la temporada de invierno. Una comparación de modelos de regresión, que representan otoño e invierno, detectó una diferencia entre las pendientes (F₁, ₃ = 10.15, p = 0.049 y F₁, ₃ = 30.77, p = 0.016 para el crecimiento de masa y FL respectivamente). Las diferencias entre el otoño, cuando la temperatura disminuyó de ∼20 a 15 ° C, y el invierno, cuando la temperatura se mantuvo a ∼10 / 11 ° C, sugiere efectos de la temperatura en el crecimiento de YEM. El crecimiento anual de masa / FL en- tre las dos especies mostró una desviación importante en sus trayectorias durante el invierno cuando el pargo dejó de crecer y YEM continuó (Fig. 3 C, D). La comparación de los modelos de regresión pertenecientes al período de abril a septiembre de 2015 para el crecimiento de masa / FL de ambas especies reveló diferencias significativas (líneas negras en la Fig. 3 C, F₁, ₆ = 37.12, p <0.001 y Fig. 3 D, F₁, ₆ = 37.25, p <0.001 para crecimiento de masa y FL respectivamente). Una diferencia en las pendientes que representan el crecimiento austral en verano de pargo y YEM (líneas verdes en la Fig. 3C, D) también se observó. El nivel de significación para el crecimiento masivo de los datos de diciembre a marzo no fue lo suficientemente fuerte como para una interpretación clara de la ten- dencia (F₁, ₄ = 6.07, p = 0.069). Sin
embargo, se hizo evidente que el crecimiento del pargo en verano fue superior al YEM cuando se compararon los datos de crecimiento de FL del mis- mo período (F₁, ₄ = 302.84, p <0.001). 3.4 . Consumo diario de alimento (DFC) Snapper DFC estaba altamente correlacionado con la temperatura del agua de mar ( Fig. 2 B, Tabla 3 ). Para YEM, la temperatura parecía solo parcialmente relacionada con la ingesta diaria de alimento, lo que resultó en una co- rrelación no significativa entre los dos conjuntos de datos ( Fig. 2 B, Tabla 3 ).
3.5. Morfometría y temperatura suplementarias
En el pargo se observó una correlación negativa moderada y fuerte con la temperatura del agua de mar para GMI (índice de masa destripada) e HSI (índice hepato-somático) respectivamente ( Tabla 4 , Fig. 5 A, B). La fuerte correlación negativa con la temperatura también fue una característica de YEM HSI ( Tabla 4 , Fig. 5 E), mientras que el IMG exhibió una tendencia decreciente durante aproximadamente los primeros 6 meses y durante el resto del período experimental, el IMG se mantuvo a ese nivel ( Fig. 5 D). Los datos del índice visceral-lípido de Snapper (VLI), como para Rm , se movieron tres puntos de datos (meses) hacia atrás en la escala de temperatura para probar la correlación con la temperatura ( Fig. 5C). Esto resultó con una fuerte corre- lación con la temperatura del agua de mar ( Tabla 4 ), lo que demuestra un fuerte efecto estacional sobre el pargo anual VLI. En YEM, el análisis estadístico del VLI anual ( Fig. 5 F) no reveló una asociación con la temperatura.
4. Discusión 4.1. Observaciones de crecimiento
Durante 12 meses bajo el régimen de alimentación de saciedad, el pargo demostró variaciones en las tasas de crecimiento que se vieron notablemente afectadas por las oscilaciones estacio- nales en las condiciones ambientales, como se observa predominantemente a través de fuertes correlaciones positivas con la temperatura. YEM mostró una estrategia de crecimiento diferente exhibiendo en general una falta de efec- to estacional y / o de temperatura. Los cambios en el crecimiento relacionados con la temperatura en el pargo abarcaron desde un crecimiento negativo (es decir, pérdida de peso) en invierno hasta un pico en verano correspondiente a las temperaturas anuales más altas re- portadas del agua de mar, mientras que en YEM se observó una SGR máxima entre 17 y 18 ° C. En el mismo patrón, el consumo de alimento del pargo se relacionó con las tasas de crecimiento y temperatura anuales, por lo tanto, el comportamiento de alimentación del pargo y la ingesta de alimento resultante parecían depender de la temperatura. El típico patrón de crecimiento anual de transición o gradual observado para el pargo en el pasado ( Francis, 1994 ) y este estudio imita el patrón de crecimiento ontogenético donde poco después de la metamorfosis (en verano) la tasa de crecimiento se acelera sustancialmente ( Foscarini, 1988 ; Francis, 1994 ; Sim
Tabla 4. Las correlaciones de los índices corporales con la temperatura del agua de mar durante la duración del estudio de crecimiento para pargo (SN) y salmonete de ojos amarillos (YEM). El resto del título de la tabla es el mismo que para la tabla 3.

Leyenda: GSI - índice somático destripado, CSI - índice cardio-somático, SSI - índice bazo-somático, HSI - índice hepato-somático, ESI - índice entero-somático, VLI - índice visceral-lípido.
Fig.5 . Índices organosomáticos y morfometría suplementaria (curva negra y símbolos negros) de pargo (A, B, C) y YEM (D, E, F) superpuestos con la curva de temperatura del agua de mar (rojo). A, D - índice de masa destripada (GMI); B, E - índice hepato-somático (HSI); C, F - Índice de lípidos viscerales (VLI). Las barras de error son intervalos de confianza del 95%. Se debe usar el color para las figuras 2, 3 y 5 impresas. Smith et al., 2013 ), mientras que durante su primer invierno, las tasas de crecimiento se suprimen ( Lenanton y Potter, 1987 ; Paul, 1976 ; Bell et al., 1991 ). Este patrón de crecimiento se repite hasta la maduración, cuando la intensidad del crecimiento disminuye ( Francis, 1994) La tendencia de crecimiento anual / estacional exhibida por el pargo en este y otros estudios se compara con la observada generalmente para otros sparids templados, como la dorada roja, Pagrus major ( Foscarini, 1988 ) y dorada, Sparus aurata ( Pérez ‐ Sánchez et al., 1994 ; Kissil et al., 2001 ; Ibarz et al., 2003 , 2010 ). De manera si- milar, P. major encontrado alrededor de Japón puede experimentar un rango de temperatura anual mayor y generalmente mayor que el pargo de Nueva Zelanda (es decir, 9–33 ° C, Oda y Kanda, 2009 ; pero más comúnmente 13−30 ° C, Foscarini, 1988) Aún así, en el ambiente cultivado se informa con frecuencia que existe un umbral de temperatura por debajo del cual la dorada roja suspende la ingesta de alimentos y cesa el crecimiento (es decir, 10-12 ° C; Foscarini, 1988 ; Kim et al., 2000 ). Esto también coincide con C. auratus . S. aurata ; sin embargo, no necesariamente puede dejar de crecer durante los meses más fríos si las temperaturas anuales generales son altas, como se
demostró en Kissil et al. (2001) . Sin embargo, al acercarse el invierno, S. aurata disminuiría la ingesta de alimentos de manera congruente con la caída de la temperatura del agua de mar por debajo del umbral de 12-13 ° C, lo que provocaría una reducción significativa del crecimiento ( Kissil et al., 2001) Este patrón de consumo y crecimiento de alimentos es imitado por el pargo en este estudio, donde el crecimiento y el consumo de alimento disminuyeron notablemente por debajo de 11.5 ° C.
Chubb y col. (1981) informaron patrones de crecimiento anual de YEM del Sistema del Río Swan-Avon en Australia Occidental, donde el crecimiento invernal todavía estaba presente, aunque se redujo en comparación con otras estaciones, y también el crecimiento invernal en el presente estudio. Esto puede sugerir la importancia de la limitación de alimentos para el crecimiento de YEM en la naturaleza y que YEM tiene la capacidad de crecer incluso durante el invierno siempre que se suministre la comida adecuada. La última sugerencia se ve respal- dada por el hecho de que el salmonete gris de cabeza plana, Mugil cephalus , monitoreado en Chubb et al. (1981) , exhibieron la supresión típica del crecimiento en invierno templado, mientras que YEM continuó creciendo. Las ob- servaciones de un notable crecimiento invernal en este estudio generalmente no se observan en otros mugilidos, incluido el salmonete rayado, (Mugil platanus ; González-Castro et al., 2009 ) y salmonetes salmonetes ( Liza saliens , Cardona, 1999a , 1999b ). Se han reportado ejemplos de crecimiento en invierno, aunque a tasas 3–4 veces reducidas en comparación con el verano, para juveniles de M. cephalus en Anderson (1958) para pe- ces de la costa atlántica de EE. UU., Y en Rossberg y Strawn (1980) para estanques criados en estanques peces en policultivo. Los informes que describen el rendimiento del crecimiento del salmonete generalmente provienen del hemisferio norte, donde el salmonete parece experimentar fluctuaciones anuales de temperatura más grandes (es decir, 10 ° C en invierno a 30 ° C en verano), especialmente para especies del Mar Mediterráneo (por ejemplo , Cardona, 1999a, 1999b ), en comparación con YEM en Nueva Zelanda. Este hecho puede contribuir a las pronunciadas diferencias de crecimiento estacional en comparación con los hallazgos asociados con el estudio actual. Por lo tanto, parece que, de acuerdo con el conocimiento de los autores, YEM es el único mugilido con una dinámica de crecimiento anual única caracterizada con un potencial de crecimiento sustancial en invierno.
De acuerdo con Guderley et al. (1996) una irregularidad en la disponibilidad de alimentos, particularmente en regiones templadas, puede tener un carácter estacional. Esta reducción en los recursos alimenticios se asocia principalmente con la temporada de invierno, y los peces generalmente responden a esta disminución prolongada en el suministro de alimentos al reducir el gasto metabólico y alterar las capacidades metabólicas de los tejidos ( Pelletier et al., 1993 ; Yang y Somero, 1993 ). Tal noción se ha informado en muchos otros casos (por ejemplo, Björnsson, 2001; Metcalfe et al., 2002; Bacon et al., 2005) mediante el cual, además de temperaturas reducidas, la disponibilidad de alimentos puede desempeñar un papel fundamental en la depresión del crecimiento. Sin embargo, en el presente estudio, el consumo diario de alimento (DFC) del pargo mostró una fuerte correlación con la temperatura anual del agua de mar a pesar de la disponibilidad de alimentos en exceso durante todo el año, alineándose con la reducción del crecimiento invernal. Una situación similar también se encontró en otros estudios (por ejemplo , Karaås, 1990 ; Griffiths y Kirkwood, 1995 ). Por lo tanto, la ingesta de alimento de invierno de los pargos no puede explicarse solo por la disponibilidad de alimentos, ya que se ha encontrado que el consumo de alimento y la saciedad están regulados posiblemente a través de interacciones entre factores fisiológicos, sociales y ambientales ( Tran-Duy et al., 2008 ) y la presen- cia de un reloj biológico interno (Van Dijk et al., 2005 ; Wellenreuther et al., 2019 ). Evidentemente, este esce- nario no puede adoptarse para YEM, destacando aún más las diferencias en el comportamiento y la fisiología de estas dos especies. Además, YEM consumió en promedio menos cantidad relativa de alimentos día -1 que el pargo, y el nivel de alimentos ingeridos no varió sustancialmente durante los 12 meses experimentales.
En Coubrough et al., Se describieron pruebas adicionales del comportamiento de alimentación contrastante entre pargo y YEM . (2004) , quienes exploraron los cambios estacionales en el patrón de alimentación entre las dos especies. En su experimento anual de alimentación a demanda, el pargo apenas alimentó por debajo de 11 ° C, mientras que la alimentación entre 11 y 18 ° C provocó una actividad de alimentación moderada y superior a 18 ° C. La actividad alimentaria mínima fue en agosto (invierno austral) y la máxima en enero (verano austral) mostrando efectos estacionales. Esto fue consistente con el presente estudio donde SGR fue el más bajo por debajo de 11 ° C y el más alto por encima de 18 ° C. Sin embargo, como se informó en Coubrough et al. (2004), YEM exhibió un comportamiento de alimentación anual ligeramente oscilante pero generalmente consistente que se parece a los hallazgos actuales. Se han observado patrones similares a los de YEM para lucio, Esox lucius ( Johnson, 1966 ) y cola amarilla, Seriola quinqueradiata, pero solo para temperaturas superiores a 18 ° C ( Kohbara et al., 2003 ). Coubrough y col. (2004) sugirió que la tasa de alimentación YEM relativamente constante puede deberse al hecho de que el salmonete es eurytermal, y que la reducción en la alimentación se produjo solo cuando la temperatura cayó por debajo de 11 ° C. El presente estudio demostró que, incluso por debajo de 10 ° C, la ingesta de alimento era relativamente alta, lo que proporciona evidencia del amplio carácter euritérmico de la fisiología YEM. La observación de que el músculo blanco YEM tiene concentraciones significativamente más altas de fosfato inorgánico, creatina y mitocondrias en invierno, en comparación con los peces aclimatados en verano, indica una profunda capacidad para aclimatarse a varias estaciones (Black, 2002).
4.2. Observaciones de partición de recursos
Para maximizar la supervivencia, los peces deben equilibrar dos aspectos ecológicos fundamentales: acelerar el crecimiento somático cuando las condiciones son favorables y reponer las reservas de energía al alterar la dirección de la división de recursos para aumentar sus posibilidades de resistir la temporada de frío ( Post y Parkinson, 2001 ; Díaz et al. al., 2009 ). Para los peces juveniles templados, este principio es más notable en verano, donde a menudo se observa que la mayoría de los recursos disponibles se utilizan para optimizar el crecimiento ( Hurst y Conover, 2003 ; Biro et al., 2005 ; Huss et al., 2008 ). Sin embargo, en otoño la utilización de energía se redirige hacia la maximización de las reservas de energía ( Hurst y Conover, 2003 ; Biro et al., 2005; Huss et al., 2008 ). Al igual que el pargo post larvario salvaje (0+, Sim-Smith et al., 2013 ), el pargo juvenil (1+) utilizado en el presente estudio intensificó la deposi- ción de grasa visceral hacia el final del verano, lo que indica que la asignación de recursos cambió de maximizar el crecimiento en mediados de verano para maximizar el almacenamiento de energía hasta finales de otoño / principios de invierno, cuando este interruptor estaba en su apogeo. Posteriormente se utilizaron depósitos de grasa visceral y se agotaron progresivamente a medida que avanzaba el invierno. Por lo tanto, parece que maximizar las posibilidades para la supervivencia del invierno es potencialmente de mayor prioridad ecológica que crecer. O, en otras palabras, las condiciones invernales desfavorables pueden ser una amenaza mayor para la supervivencia del pargo juvenil que la posible depredación ( SimSmith et al., 2013; presente estudio).
A menudo se pensaba que el estímulo para el cambio metabólico del crecimiento al almacenamiento de energía era un umbral de baja temperatura; sin embargo, Sogard y Spencer (2004) demostraron que otras variables como el tamaño de los peces también pueden jugar un papel importante. Descubrieron que el pequeño pez sable inmaduro, Anoplopoma fimbria , dedicaba más energía al crecimiento que los peces más grandes, independientemente de la temperatura del agua, mientras que los peces aclimatados a un ambiente más frío no necesariamente generaban mayores reservas de energía en comparación con los peces aclimatados a temperaturas ambiente más altas. Sin embargo, desde pargo juvenil en Sim-Smith et al. (2013)se
dividieron los recursos independientemente de su longitud, se ha sugerido que el punto de inflexión para el cambio del crecimiento a las tiendas dependía del tiempo y / o la temperatura. Además, la relación entre el crecimiento y las tiendas de energía puede verse influenciada por la disponibilidad de alimentos. Los peces alimentados con saciedad pueden maximizar ambos aspectos y, a menudo, se encuentra una correlación positiva que describe la relación entre el crecimiento y las reservas de energía, pero el suministro limitado (irregular) de alimentos genera una compensación entre las dos variables con poca o falta de correlación ( Sogard y Spencer, 2004 ; Jacobs et al., 2012) Sin embargo, los resultados del estudio actual son solo parcialmente consistentes con esta observación, ya que el suministro de alimentos sin restricciones produjo una correlación positiva entre los SGR y el índice de lípidos viscerales, con un retraso de aproximadamente 2 meses, que se parecía más a la dinámica descrita en Sim-Smith et al. (2013).
Los cambios en la condición del pargo, que reflejan cambios en el crecimiento y las reservas metabólicas, se han descrito en otros estudios, en los que Francis (1997) y Majed et al. (2002) examinaron los patrones anuales de la condición de pargo silvestre medidos mensualmente / bimensualmente. Ambos estudios se ubicaron en el noroeste del Golfo Hauraki de la Isla Norte (Nueva Zelanda) y sus hallazgos indicaron efectos estacionales sobre el crecimiento y la condición del pargo juvenil. Esto no fue evidente en función del factor de condición de monitoreo (es decir, el factor de condición relati- va, Krel ; Le Cren, 1951 ) sino más bien midiendo las trayectorias anuales del índice hepato-somático (HSI, Francis, 1997 ), o los índices totales de ARN y proteínas (Majed et al. al., 2002) En el presente estudio, la condición de pargo expresada como masa relativa en relación con la masa media (Rm, Froese, 2006 ) tenía un carácter estacional explícito ya que su trayectoria anual seguía la curva de oscilación de temperatura con un tiempo de retraso de aproximadamente 2-3 meses. Los datos de Rm también se correlacionaron positivamente con VLI. Por lo tanto, se detectaron efectos estacionales en la condición del pargo juvenil en los tres estudios de pargo, lo que respalda aún más la importancia de los factores ambientales para su desarrollo y crecimiento. Sin embargo, el patrón de condición anual como se representa utilizando el factor de condición relativa (Krel ) en Francis (1997) y Majed et al. (2002)no se parecía al curso de la condición de pargo como se muestra usando Rm en el presente estudio. ¿Por qué podría ser esto? El estudio actual se llevó a cabo controlando el suministro de alimentos a través de un exceso de alimentación. Esto posiblemente pasó por alto los desafíos que pueden surgir en los datos salvajes donde los patrones fisiológicos o morfométricos pueden confundirse por la falta de regularidad en el suministro de alimentos (Árnason et al., 2009 ). Francis (1997) y Majed et al. (2002) observaron peces salvajes en su investigación y esto puede explicar la razón por la cual la indicación de un ciclo anual en Krel de pargos juveniles e inmaduros no estaba clara. Además, comúnmente se detectan diferencias en los patrones de crecimiento entre los sitios de Nueva Zelanda ( Francis, 1994, 1997 ), por el cual el pargo originario de Tasman / Golden Bay (al norte de la Isla Sur, este estudio) ha demostrado tener un crecimiento más rápido que el pargo del Golfo de Hauraki (centro de la Isla Norte; Francis, 1997 y Majed et al., 2002 estudios). Y finalmente, las diferencias de temperatura entre los dos lugares también pueden ser un factor contribuyente, ya que la temperatura anual más baja en el Golfo de Hauraki generalmente no caería por debajo de 13 ° C ( Majed et al., 2002 ), mientras que en el presente estudio el pargo estuvo expuesto a temperaturas invernales por debajo de 10 ° C.
Al igual que los cambios en los factores de condición, HSI puede identificar cambios en la condición animal, el crecimiento y el estado nutricional ( Jen- sen, 1979 ). Además de Krel , se usó HSI en Francis (1997) , que resultó ser un enfoque adecuado para identificar los efectos estacionales en la condición del pargo juvenil. Alcanzó su punto máximo en otoño / invierno y cayó al nivel más bajo en verano, reflejando el patrón anual de HSI en el presente estudio. El patrón observado indica que el agotamiento de las reservas de energía durante el crecimiento intenso (todos los recursos disponibles se uti- lizan para el crecimiento del cuerpo, incluidos los almacenados en el híga- do) y su reconstrucción / restauración durante el período de crecimiento lento es un rasgo de pargo adaptativo ( Francis, 1997 ). Francis (1997) También se observó que el período primavera-verano se caracterizó por una gran abundancia de pargos en el área estudiada en comparación con el otoño-invierno, cuando la abundancia era baja. Sugirió que esta diferencia estacional en la densidad de pargo puede ser responsable del aumento de la competencia intraespecífica en verano como una explicación alternativa para el ciclo estacional en el HSI observado. Además, el HSI medido en Francis (1997) tuvo una relación inversa con la tasa de crecimiento, como también se observó en el presente estudio. Sin embargo, en ninguno de los estudios (presente y Francis, 1997 ) se encontró una correlación significativa con la tasa de crecimiento, lo que puede sugerir que un mejor estado nutricional no necesariamente respalda un crecimiento más rápido ( Francis, 1997 ). La relación negativa entre HSI y el fenómeno de temperatura ambiente no se ha informado con frecuencia, aunque se ha observado en YEM (presente estudio) y en algunas otras especies, como la dorada S. aurata ( Grigorakis et al., 2002 ); Trucha arcoiris Oncorhynchus mykiss ( Hilton, 1982 ) y cucaracha Rutilus rutilus ( Van Dijk et al., 2005 ). Grigorakis y col. (2002) argumentan que la razón de esta apa- rente anomalía puede deberse al mal funcionamiento metabólico del hígado causado por los efectos adversos de las bajas temperaturas que resultan en altos valores de HSI en invierno ( Hilton, 1982 ). Este podría ser el caso del pargo, ya que la aparición deEl hígado verde era común. Esto puede indicar posibilidades de procesos fisiopatológicos que según Goto et al. (2001) se relacionó con niveles bajos de taurina hepática acompañados de una acumulación del pigmento biliar biliverdina en P. major. Sin embargo, la aparición de hígado verde en los hilachas de invierno puede ser solo el resultado de la retención de bilis en la vesícula biliar debido al consumo de alimento menos frecuente que manchó el hígado, ya que en primavera, después de un aumento en la ingesta de alimentos, el verdefenómeno hepático completamente disperso. En hígado de hibernación YEM; sin embargo, no se observaron signos patológicos organolépticos. Por lo tanto, parece que todavía falta una explicación exhaustiva de la dinámica anual de HSI como se informó en los estudios mencionados anteriormente, incluido el presente, y puede requerir más investigación.
La dinámica de condición anual de YEM, a diferencia del pargo, se correlacionó negativamente con la tem- peratura, aunque VLI no mostró una asociación con los cambios ambientales estacionales, sino que mostró un aumento lineal hasta que se alcanzó una meseta en la primavera, 6 meses después del inicio de la alimentación experimental. La respuesta inicial de YEM al régimen de dieta sin restricciones se manifestó en un rápido aumento tanto de la condición como del VLI, que coincidió con la caída de la temperatura del agua de mar durante el otoño. Esta fuerte correlación nega- tiva inicial con la temperatura que a su vez contribuyó significativamente a la correlación inversa general entre Rmy la temperatura del agua de mar puede ser un artefacto de ajuste al régimen de alimentación ad libitum a través del proceso de crecimiento compensatorio asociado con la transferencia a tanques y la superación de las limitaciones de alimentación experimentadas en la naturaleza, en lugar de una consecuencia de la disminución de la temperatura asociada con el otoño. A diferencia del pargo, YEM Rm se alineó directamente con la masa relativa del hígado; por lo tanto, a pesar de que puede haber una falta general de efectos estacionales en la condición de YEM, YEM Rm y HSI pueden estar vinculados y se podría hacer la siguiente pregunta: ¿se puede utilizar HSI como un predictor de variación en la condición de YEM? Aunque prácticamente no se ha realizado ningún trabajo sobre este tema en relación con YEM, algunas publicaciones sobre especies congéneras ofrecen algunas ideas sobre esta cuestión. Factor de condición deMugil curema del sur de Brasil alcanzó su punto máximo en primavera y fue más bajo en invierno sin correlacionarse con HSI (Albieri et al., 2010 ). Sin embargo, Mugil liza de la misma región brasileña demostró la misma asociación positiva entre la
condición y el HSI que se observó en el presente estudio, pero con la trayectoria estacional inversa (es decir , el factor de condición de M. liza y el HSI fueron más altos en verano y más bajos en invierno-otoño , Albieri et al., 2010) Las diferencias en la asociación entre la condición y el HSI entre los estudios pueden deberse no solo a las posibles diferencias en la capacidad de crecimiento entre las especies dentro de la familia Mugilidae sino también a las diferencias en las condiciones ambientales y su idoneidad para el desove, y el desarrollo de larvas y peces juveniles que pueden considerablemente varían entre sitios (Albieri et al., 2010 ). Por ejemplo, las poblaciones de YEM de Australia Occidental exhiben condiciones anuales que apoyan el verano, mientras que las poblaciones de Australia Oriental y Nueva Zelanda invernan las estaciones de desove ( Chubb et al., 1981) Esto coincidió con el momento en un año en que la mayor condición y HSI se observaron en el presente estudio. Al tener esto en cuenta, parece que YEM HSI se puede utilizar como un predictor para explicar la condición, como sugieren los datos actuales.
Con base en las correlaciones positi- vas entre SGR y DFC y la correlación inversa entre SGR y VLI observada en el presente estudio, se podría argumentar que YEM en una dieta sin restricciones buscó maximizar la acumulación de reservas de grasa (o dedicarle una mayor proporción de ener- gía disponible) hasta se alcanzó un límite superior o niveles óptimos (es decir, ∼15% BM). La relevancia ecológica para tal preferencia por las reservas de lípidos retenidos no se puede discernir fácilmente, pero puede relacionarse con una estrategia que le permite a YEM hacer frente a los suministros de alimentos variables y temporalmente variables, o tal vez una estrategia para mejorar la aptitud gonadal y el potencial reproductivo. Por lo tanto, el crecimiento YEM puede ser una función indirecta del porcentaje de reservas de grasa acumuladas.
La densidad de población puede afectar el crecimiento de los peces, la condición y la bioquímica de los tejidos, ya sea cuando las variables se compararon en las densidades finales o cuando se mantuvieron diferentes densidades durante la duración de un estudio (Sangiao-Alvarellos et al., 2005; Roncarati et al., 2006 ; de las Heras et al., 2015 ). En el estudio actual, la densidad de población de pargos se mantuvo durante todo el experimento, sin embargo, este no fue el caso para YEM, donde se produjo un aumento de 3.7 veces (0.90 - 3.35 kg m −3) entre el inicio y la finalización del estudio. El salmonete gris de labios gruesos juveniles (Chelon labrosus ) no mostró ningún efecto de crianza de densidad de SGR cuando los peces se mantuvieron a 0.7, 2.0 y 6.7 kg m -3 (de las Heras et al., 2015 ). Del mismo modo, Biswas et al. (2012) no encontraron que la SGR de alevines de mújol gris rayado (Mugil cephalus ) criara a 7500 peces ha −1 en comparación con 15,000 peces ha −1 de manera diferente. Por lo tanto, parece que la densidad de población puede afectar a GR cuando las dos densidades comparadas están separadas al menos en un orden de magnitud ( Roncarati et al., 2006 ), por lo tanto, parece que las diferencias en la densidad de población para YEM en el estudio actual pueden no tener importancia efectos sobre el crecimiento anual y la condición.
4.3. Comparaciones con crecimiento salvaje
Al comparar la tasa de crecimiento de la longitud de pargo y YEM en este estudio, con las tasas de crecimiento de estas especies en la naturaleza, se observa una observación sorprendente. Aunque limitado en número, las observaciones de las tasas de crecimiento estacional y anual de juveniles (1+) son ampliamente comparables a las observadas en el Golfo de Hauraki ( Francis, 1994 ) y en Tasman / Golden Bay (Drummond y Kirk, 1986). Por lo que el pargo crece un incremento anual de entre 60-80 mm (es decir, el pargo alcanzó un FL medio de 80-90 mm y 150-160 mm en su primer y segundo inviernos, respectivamente) en el Golfo de Hauraki ( Francis, 1994) o 70 mm por año en Tasman / Golden Bay (desde aproxi- madamente 130 mm - 200 mm de longitud de horquilla, Drummond y Kirk, 1986). Estos valores generalmente se comparan con la tasa de crecimiento de 80 mm observada para el pargo en el presente estudio (FL promedio 119-199 mm, Tabla 1 ). En marcado contraste, se ha determinado que la tasa de crecimiento salvaje de YEM en la misma región geográfica de este estudio es de alrededor de 55 mm por año ( Curtis y Shima, 2005 ). En el presente estudio, YEM creció un promedio de 105 mm por año, identificando una mejora sustancial del crecimiento en animales cautivos que proporcionó una ración de alimentación ilimitada. Estas observaciones plantean la posibilidad de que las limitaciones de alimentación sean evidentes para YEM, pero es menos probable que sean aparentes para el pargo.
5. Observaciones finales
Cuando ambos peces, de edad similar, ingresaron a las pruebas anuales de alimentación y se mantuvieron con una dieta sin restricciones, la estrategia de crecimiento de YEM parecía ser superior a la del pargo. Sin embargo, una inspección más cercana de los datos de crecimiento y los índices morfométricos asociados mostraron que esto puede no ser necesariamente así. El incremento promedio anual de masa para el pargo fue de 150.8 g, mientras que para YEM fue de 184.8 g, o 426.0 y 580.6% para el pargo y YEM respectivamente. Del mismo modo, el crecimiento anual de la longitud fue de 87.4 y 105.1 mm, o 67.3 y 74.3% para pargo y YEM respectivamente. Sin embargo, cuando se considera el índice de lípidos viscerales (VLI), resulta obvio que aproximadamente el 15% de la masa de YEM pertenecía a depósitos de grasa abdominal en comparación con solo el ± 1% para el pargo al final del experimento de crecimiento, lo que indica diferencias mucho menores en el final crecimiento somático de la especie de prueba. Adicionalmente,-1 ) mostrando claramente que ninguna estrategia era superior a otra, sino simplemente diferente.
Declaración ética
Todos los experimentos se realizaron de acuerdo con el Comité de Ética Animal de la Universidad de Canterbury (Ref: 2014 / 29R). Todas las metodologías se llevaron a cabo de conformidad con las directrices aprobadas.
Declaración de contribución de autoría CRediT
Tomislav Flikac: Metodología, Análisis formal, Investigación, Escritura - borrador original, Visualización. Denham G. Cook: Metodología, Investigación, Redacción - revisión y edición, Administración de proyectos. William Davison: conceptualización, supervisión, validación, redacción - revisión y edición, visualización. Alistair Jerrett: conceptualización, supervisión, recursos, adquisición de fondos.
Declaración de interés en competencia Los autores declaran que no tienen conflicto de intereses.
Agradecimientos:
Este trabajo fue apoyado por la subvención especial del Instituto de Investigación de la Corona de Nueva Zelanda para Investigación de Plantas y Alimentos (PFR) “Wildfish 2030” (Contrato # C11X1203). Agradecemos a PFR por proporcionar instalaciones de última generación, incluidos animales experimentales para este trabajo. El trabajo se realizó también en colaboración con la Facultad de Ciencias Biológicas de la Universidad de Canterbury, Nueva Zelanda.
Autores: Tomislav Flikac
Ciencias biológicas, Universi dad de Canterbury, Ilam 8041, Christchurch, Nueva Zelanda Autor correspondiente. tflikac@gmail.com
Denham G. Cook
Seafood Production Group, The New Zealand Institute for Plant & Food Research Limited, 293- 297 Akersten Street, Port Nel son, 7043, Nueva Zelanda
William Davison
Ciencias biológicas, Universi dad de Canterbury, Ilam 8041, Christchurch, Nueva Zelanda
Alistair Jerrett
Seafood Production Group, The New Zealand Institute for Plant & Food Research Limited, 293-297 Akersten Street, Port Nelson, 7043, New Zealand








