Dengue en pediatría
Enfoque integral del paciente con cardiopatía congénita en urgencias pediátricas: estrategias y consideraciones
Inmersión en pediatría
Síndrome antifosfolipídico en pediatría, más que trombosis
Sepsis y choque séptico: cambiando paradigmas
Curso continuo de actualización en Pediatría CCAP
Volumen 23 Número 1
Enero - Abril 2024
ISSN 2145-4590
Curso continuo de actualización en Pediatría CCAP
Volumen 23 Número 1 Enero - Abril 2024
Sociedad Colombiana de Pediatría
Junta Directiva Nacional 2024 - 2026
Presidente
Vicepresidente
Secretario Vocal
Vocal
Vocal
Vocal
Vocal
Vocal
Vocal Fiscal
Vocal Representante de Capítulos Expresidente
Dr. Mauricio Javier Guerrero Román
Dra. Eliana Zemanate Zúñiga
Dr. Alberto José Esmeral Ojeda
Dra. Claudia Patricia Beltrán Arroyave
Dr. Jerónimo Zuluaga Vargas
Dra. Ángela María Giraldo Mejía
Dr. Víctor Manuel Mora Bautista
Dra. Liliam María Macías Lara
Dr. Mauricio Hernández Cadena
Dr. Iván Alejandro Villalobos Cano
Dra. Iliana Francineth Curiel Arizmendi
Dra. Nury Isabel Mancilla Gómez
Dra. Marcela María Fama Pereira
Comité Editorial
Dra. Eliana Zemanate Pediatra Intensivista (Editora)
Dra. Nury Mancilla Pediatra Neuróloga
Dr. Víctor Mora Pediatra
Sociedad Colombiana de Pediatría www.scp.com.co
precop
Subdirección de Programas Dirigidos al Pediatra
Calle 83 n.o 16A-44, Oficina 701
Edificio Cima. Bogotá, D.C.
Teléfonos: (601) 6495352 - 7464706/07 precop@scp.com.co
Dr. Mauricio Fernández Pediatra Intensivista (Editor Ejecutivo)
Dr. Jürg Niederbacher Pediatra Neumólogo
Producción editorial Grupo Distribuna Carrera 9 B # 117 A-05 Barrio Santa Bárbara Central Bogotá, D.C., Colombia
Teléfonos: (571) 6202294 - 2158335 (571) 2132379 www.libreriamedica.com
Dengue en pediatría
Contenido
Juan Diego Galindo Dávila, MD
Natalia del Pilar Delgado Ortiz, MD
Iván José Ardila Gómez, MD
Andrés Felipe Romero Andrade, MD
Enfoque integral del paciente con cardiopatía congénita en urgencias pediátricas: estrategias y consideraciones
Daniel Mainero M., MD
Mónica P. Gutiérrez G., MD
Otto M. González P., MD, PG
Inmersión en pediatría
Paola Andrea Manjarrés Figueredo
Camila Meza Bertel
Jairo De Jesús Jiménez Rodelo
Sady David Roa Valdelamar
Síndrome antifosfolipídico en pediatría, más que trombosis
Camilo Andrés Vargas Rincón, MD
Cindy Daiana Marmolejo Posso, MD
Guiselle Alexandra Cristancho Olaya, MD
Sepsis y choque séptico: cambiando paradigmas
María Andrea García Chaves
Eliana Zemanate Zúñiga
Mauricio Fernández Laverde
Al final de los artículos encontrarán las preguntas del examen consultado sin sus respectivas respuestas, las cuales serán publicadas en el siguiente número.
Cada fascículo PRECOP está disponible de manera online y sus evaluaciones podrán ser resueltas por todos los profesionales de la salud a través de este medio, ingresando por: www.scp.com.co/precop.
Volumen 23 Número 1 Precop SCP 3
17 30
50
4
38
Dengue en pediatría
Juan Diego Galindo Dávila, MD1
Natalia del Pilar Delgado Ortiz, MD2
Iván José Ardila Gómez, MD3
Andrés Felipe Romero Andrade, MD4
INTRODUCCIÓN
El dengue es una infección viral transmitida principalmente por el mosquito Aedes aegypti, aunque también por Aedes albopictus en algunas regiones. Se considera un problema grave de salud pública internacional por la Organización Mundial de la Salud (OMS), y se estima que ocurren aproximadamente 390 millones de infecciones al año en más de 125 países. Además, se espera un aumento en la tasa de infección debido a factores como el cambio climático, factores antropogénicos y condiciones socioeconómicas.
Históricamente, las epidemias de enfermedades similares al dengue se reportaron desde 1779, pero el virus se aisló por primera vez en 1943. En febrero de 2020 se emitió una alerta epidemiológica por un aumento significativo en la tasa de incidencia de dengue. En marzo de 2023, la OMS informó sobre la expansión geográfica de los casos más allá de las áreas históricas de transmisión, con el
80 % de los casos reportados en la región de las Américas. El año 2023 registró la mayor cantidad de casos de dengue en esta región, y la alta transmisión persiste en 2024, con un aumento significativo en la cantidad de casos respecto a años anteriores. Colombia ha sido uno de los países más afectados por el dengue: tiene la tasa de letalidad más alta por casos de dengue en comparación con otras regiones de América, así como la tasa más alta de letalidad por casos graves.
La OMS ha propuesto una clasificación de la enfermedad basada en signos y síntomas clínicos para identificar tempranamente los casos graves. Los signos de alarma incluyen dolor abdominal, vómitos, edemas, sangrado mucoso, hepatomegalia, irritabilidad o hipotensión. Los casos de dengue grave se caracterizan por signos de fuga plasmática, sangrado grave o afectación de órganos como el hígado, cerebro o riñón. En los últimos años se ha reconocido el síndrome hemofagocítico como una complicación potencialmente fatal del dengue, caracterizado por
1. Programa de Pediatría, Facultad de Salud, Universidad Surcolombiana. Neiva, Colombia.
2. Programa de Pediatría, Facultad de Salud, Universidad Surcolombiana. Neiva, Colombia.
3. Programa de Pediatría, Facultad de Salud, Universidad Surcolombiana. Unidad de Cuidado Intensivo Pediátrico, Clínica Uros. Neiva, Colombia.
4. Programa de Pediatría, Facultad de Salud, Universidad Surcolombiana. Infectología pediátrica, Hospital Universitario Hernando Moncaleano Perdomo. Neiva, Colombia.
Volumen 23 Número 1 Precop SCP 4
fiebre persistente, citopenias, hiperferritinemia y disfunción multiorgánica.
INMUNOPATOGENIA
Virus del dengue
Los virus del dengue (DENV) pertenecen al género Flavivirus de la familia Flaviviridae. El genoma es un ácido ribonucleico (ARN) monocatenario de sentido positivo que consta de 11 kilobases de longitud. Este virus se clasifica en 4 serotipos distintos (DENV 1-4), clasificados según sus antígenos de superficie cada serotipo consta además de diferentes genotipos que son filogenéticamente distintos. El genoma está compuesto por un único y largo marco de lectura abierto (ORF) flanqueado por dos regiones no codificantes; dicho genoma codifica tres proteínas estructurales (cápside, membrana y envoltura) y siete proteínas no estructurales
(NS1, NS2A, NS2B, NS3, NS4A, NS4B y NS5). Las proteínas estructurales desempeñan un papel dinámico en la estructura del virión, mientras que las proteínas no estructurales participan en la entrada, replicación, ensamblaje y patogénesis del virus en el huésped ( Tabla 1).
Ciclo replicativo del virus del dengue
Después de la inoculación por parte de un mosquito infectado, el virus inicialmente se replica en las células dendríticas de Langerhans y luego migra a los ganglios linfáticos regionales. La diseminación del virus en el torrente sanguíneo ocurre a través de monocitos y macrófagos circulantes, lo que afecta a órganos sólidos y la médula ósea. Durante la infección, diversas moléculas y receptores en las células del huésped facilitan la unión y entrada del virus, incluidas moléculas como DC-SIGN/LSIGN, glucosaminoglicanos y receptores de manosa. Durante la fase inicial de replicación, el virus
Tabla 1. Funciones de las proteínas estructurales y no estructurales del dengue
Proteína
C Participa en la encapsidación del genoma.
Función
E Media la unión y fusión del virus con la membrana de la célula del huésped y determina el tropismo y virulencia.
M Protege a la proteína E de sufrir una fusión prematura antes de la liberación del virus.
NS1 Participa en la replicación temprana del ARN viral, así como en la defensa viral mediante la inhibición de la activación del complemento.
NS2A Participa en la coordinación del cambio entre el empaquetado y la replicación del ARN y el antagonismo del interferón (IFN).
NS2B Desempeña un papel en la replicación del ARN, se asocia con NS3 para formar el complejo proteasa DENV y es cofactor de la enzima NS3.
NS3 Es multifuncional, realiza actividad enzimática serina proteasa similar a la quimiotripsina, ARN helicasa y ARN trifosfatasa. Participa en la escisión de la poliproteína DENV y en la replicación del ARN.
NS4A Induce alteraciones de la membrana importantes para la replicación del virus.
NS4B Ayuda a la replicación del ARN mediante su interacción directa con NS3 y bloquea la transducción de señales inducida por el interferón.
NS5 Es bifuncional con actividad metiltransferasa y ARN polimerasa dependiente de ARN.
Modificada de: Khan MB, et al. J Infect Public Health. 2023;16(10):1625-42; Harapan H, et al. Viruses. 2020;12(8):829.
Volumen 23 Número 1 Precop SCP 5
Juan Diego Galindo Dávila, Natalia del Pilar Delgado Ortiz, Iván José Ardila Gómez, Andrés Felipe Romero Andrade
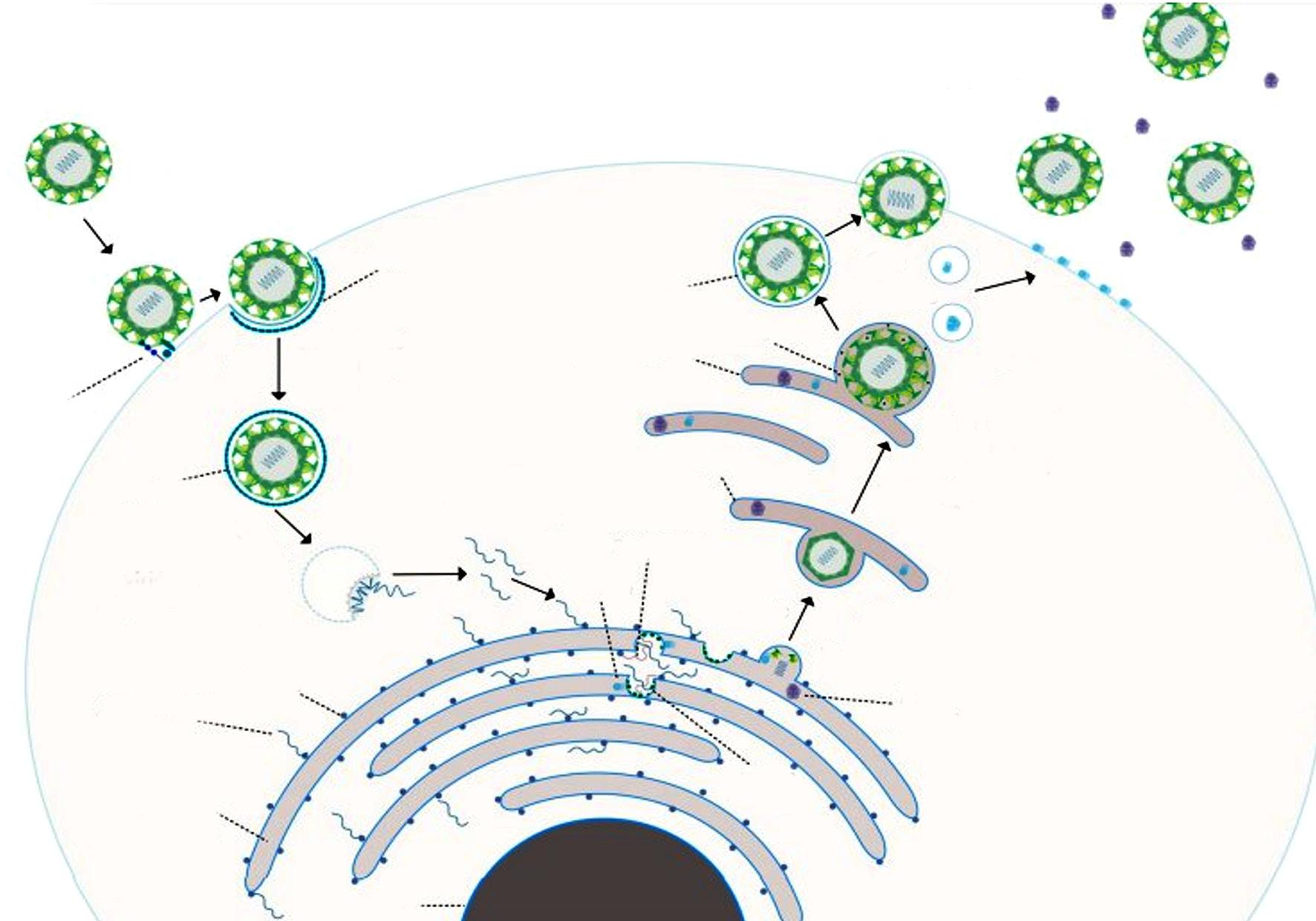
se une a receptores celulares y es internalizado mediante endocitosis mediada por clatrina. La proteína E del virus facilita la fusión con la membrana endosómica, liberando su contenido en el citoplasma. Una vez liberado, el genoma viral se replica y se traduce en proteínas estructurales y no estructurales. El ensamblaje viral ocurre en el retículo endoplásmico y, finalmente, los viriones maduros son liberados por las células del huésped (Figura 1).
Transmisión del virus
El dengue se transmite en áreas urbanas y boscosas a través de ciclos de transmisión humano y selvático, respectivamente. En las áreas urbanas, los vectores principales son el A. aegypti y el A. albopictus, mientras que, en ambientes selváticos, los vectores son el Aedes luteocephalus , Aedes furcifer y Aedes taylori. La transmisión vertical del virus entre mosquitos
es crucial para mantener los ciclos de transmisión. Adicionalmente, se han informado vías de transmisión no vectoriales que incluyen transfusiones de hemoderivados, trasplante de órganos, transmisión intraparto y perinatal.
Serotipos, genotipos y linajes del virus del dengue
El DENV se puede clasificar en cuatro serotipos distintos (DENV-1, DENV-2, DENV-3 y DENV-4), que comparten aproximadamente 65 % de similitud; cada serotipo incluye varios genotipos. Un genotipo se define como un grupo de aislados de DENV que no tienen más del 6 % de divergencia en la secuencia de nucleótidos.
A nivel mundial, DENV-1, DENV-2, DENV-3 y DENV-4 se pueden dividir en cinco (I, II, III, IV y V), seis (Asiático I, Asiático II, Cosmopolita, Americano, Americano/Asiático y Sylvatic), cuatro (I, II, III y V) y cuatro (I, II, III, Sylvatic)
Liberación de los viriones
Endosoma Receptores
Fusión virión-endosoma dependiente de
monocistrónico
Retículo endoplasmático rugoso
Tomada de: Viettri M et al. Universitas Medica. 2022;63(3):1-11.
Ensamblaje
Maduración de los viriones
Dengue en pediatría Volumen 23 Número 1 Precop SCP 6
1 2 3 4 5 6 7 8
Clatrina
Entrada Endocitosis mediada por clatrina
ARN
pH Ribosoma
Núcleo Descapsidación Poliproteína NS1 dimérica Paquetes vesiculares
ERGIC NS1
hexamérica
Golgi
Vía secretoria constitutiva Exocitosis Red trans Golgi Furina Exosoma
Figura 1. Ciclo replicativo del DENV.
genotipos, respectivamente. La variabilidad de serotipos o genotipos puede inducir respuestas inmunes diferentes e incluso diferir en su capacidad para infectar diferentes células diana y, a su vez, para causar dengue grave. Se ha informado de la introducción de nuevos serotipos, genotipos y linajes en diferentes regiones con un posterior reemplazo de virus endémicos, lo que podría explicar una mayor incidencia de dengue grave dependiente de nuevos linajes responsables de brotes.
Respuesta inmunitaria
La infección por cada uno de los serotipos del virus proporciona memoria inmune homotípica contra el serotipo infectante, pero no induce memoria inmune heterotípica contra los otros serotipos del virus. En consecuencia, la infección posterior con un serotipo diferente al inicial podría asociarse con formas graves de la enfermedad.
La patogénesis de la infección por DENV resulta de una compleja interacción entre el virus, los genes del huésped y la respuesta inmunitaria del mismo. Además, la amplificación dependiente de anticuerpos (ADE) también contribuye a la patogénesis y virulencia de la enfermedad. Esta se desarrolla después de que los anticuerpos de una infección heterotípica previa no logran neutralizar una infección secundaria con un subtipo distinto, incluso después de unirse a las proteínas virales. Luego, las células fagocitan el complejo virus-anticuerpo a través de receptores de fragmentos cristalizables gamma (Fc-γ) y dan como resultado un aumento de la viremia y la patología.
Inmunidad innata
Las células de Langerhans, dérmicas y dendríticas intersticiales son los blancos iniciales de la infección por DENV. Además, monocitos, linfocitos, células de Kupffer, macrófagos alveolares y células endoteliales también pueden ser susceptibles. Los receptores de reconocimiento
de patrones del huésped, como los receptores endosómicos tipo Toll (TLR), el gen I inducible por ácido retinoico (RIG-I) y el gen 5 asociado a la diferenciación del melanoma (MDA5), son responsables de identificar antígenos del DENV después de la inoculación. Estos receptores activan factores transcripcionales, incluidos factores reguladores de interferón (IRF) y el factor nuclear kappa B (NF- κB), que a su vez inducen la producción de interferón (IFN)α /β y citocinas inflamatorias, lo que inicia una respuesta antiviral. Sin embargo, estas citocinas y quimiocinas pueden tener efectos protectores o perjudiciales durante la infección por DENV, de modo que desencadenan una “tormenta” de citocinas inflamatorias que afectan al endotelio y provocan una mayor permeabilidad vascular. Por ejemplo, el aumento del IFN-γ se correlaciona con la supervivencia en pacientes con dengue grave, mientras que el aumento de TNF- α se asocia con mayor gravedad de la enfermedad y trombocitopenia. La interleucina-10 (IL-10) está vinculada con la degradación plaquetaria y la modulación de la coagulación, y el factor inhibidor de la migración de macrófagos (MIF) parece tener un papel perjudicial en casos graves de dengue.
Inmunidad celular
Aunque las células T CD8 tienen funciones críticas en la neutralización de virus, también han sido relacionadas con la patogénesis de la infección por DENV. Las manifestaciones graves del dengue ocurren entre 10 y 20 veces más en pacientes con infección secundaria por DENV, lo que sugiere que la preparación del sistema inmunológico adaptativo para un serotipo de DENV aumenta el riesgo de gravedad durante la infección secundaria con diferentes serotipos.
Además, los síntomas graves, como fuga vascular, coagulopatía y tormenta de citocinas, ocurren de manera prominente cuando la viremia disminuye rápidamente. La infección primaria por DENV induce la activación de células T CD8 vírgenes para diferenciarse en
Volumen 23 Número 1 Precop SCP 7
Juan Diego Galindo Dávila, Natalia del Pilar Delgado Ortiz, Iván José Ardila Gómez, Andrés Felipe Romero Andrade
células T efectoras que eliminarán la infección directamente lisando las células infectadas por el virus o produciendo citocinas.
La identificación de las proteínas estructurales y no estructurales del DENV está mediada por las células T CD4 y CD8, respectivamente. Las células T pueden responder a una infección secundaria causada por un serotipo de DENV diferente según el epítopo reconocido. Por lo general, se desarrolla una respuesta inmunitaria celular sólida en individuos que estuvieron previamente expuestos al mismo serotipo, mientras que se desarrolla una respuesta de células T con reacción cruzada después de una infección secundaria por un serotipo diferente. Durante la infección primaria por DENV, se generan células T homotípicas contra el serotipo infectante de DENV que se correlaciona con una protección de por vida contra ese serotipo. Sin embargo, la infección secundaria por DENV con diferentes serotipos conduce al desarrollo de células T no protectoras con reacción cruzada, lo que resulta en un control viral ineficaz durante la infección heteróloga secundaria y favorece la enfermedad grave del dengue mediante la inducción y la producción excesiva de citocinas inflamatorias. De hecho, la tormenta de citocinas se correlaciona con síntomas graves con altos niveles de citocinas proinflamatorias como el factor de necrosis tumoral (TNF), el receptor soluble de TNF 1 (sTNFR1), sTNFR2 e interferón gamma (IFN-γ), y quimiocinas como CXCL8, CXCL9, CXCL10, CXCL11 y CCL5, junto con la citocina antiinflamatoria, la IL-10.
La activación de las respuestas de las células T es uno de los componentes más importantes de la inmunidad específica del DENV. El objetivo principal para las células T CD4 + y CD8 + se encuentra dentro de NS3. Las células T específicas de DENV mejoran la eliminación de DENV al inducir la lisis de las células infectadas y mejorar la producción de una amplia gama de citocinas.
Ahora bien, las células T pueden causar inmunopatología durante la infección por DENV, en un fenómeno llamado pecado antigénico original, que se define como el dominio de las respuestas de las células T montadas contra un serotipo previamente infectante sobre el serotipo infectante actual. Durante una infección primaria se producen células T y células T de memoria con reacción cruzada; tras la infección secundaria con un serotipo heterólogo, las células T CD8 + con alta reactividad cruzada y gran avidez por la infección secundaria por DENV se activan masivamente e inducen una alta producción de citocinas proinflamatorias. Además, se expanden las células T CD8 + con reacción cruzada y baja avidez, y las células T CD8 + con reacción cruzada contra serotipos heterólogos pueden perder su actividad citolítica, lo que puede retrasar la eliminación del DENV, prolongar la activación de las células T CD8 + con reacción cruzada e inducir un alto nivel de citocinas proinflamatorias y otros factores solubles. Juntos, estos factores afectan la permeabilidad vascular, lo que lleva a una mayor incidencia de dengue grave.
Inmunidad humoral
Los principales epítopos de DENV, como objetivos para la respuesta de anticuerpos contra DENV, se encuentran dentro de las proteínas E, NS1 y pre-M. La proteína E induce la producción de anticuerpos que tienen funciones fundamentales en la neutralización del DENV, mientras que la proteína NS1 activa la citotoxicidad celular dependiente de anticuerpos y la lisis dependiente del complemento de las células infectadas. La escisión incompleta de la proteína pre-M también induce el anticuerpo específico de la proteína pre-M que tiene una alta reacción cruzada con el serotipo.
La respuesta de anticuerpos al DENV difiere según el estado inmunológico del huésped. Durante una infección primaria, una respuesta primaria de anticuerpos es detectable en el
Dengue en pediatría Volumen 23 Número 1 Precop SCP 8
50 % de los pacientes hospitalizados entre 3 y 5 días después del inicio de la enfermedad y aumenta al 80 % el día 5 y al 99 % el día 10. Los niveles de inmunoglobulina M (IgM) antidengue alcanzan su punto máximo aproximadamente dos semanas después del inicio de los síntomas y luego disminuyen generalmente a niveles indetectables durante 2 a 3 meses.
La inmunoglobulina G (IgG) sérica antidengue generalmente es detectable en títulos bajos al final de la primera semana de la enfermedad, aumenta lentamente a partir de entonces y puede ser detectable durante toda la vida del paciente. Durante una infección secundaria por dengue, los niveles de anticuerpos aumentan rápidamente y, en general, tienen reactividad cruzada con muchos flavivirus. La IgG es el isotipo de inmunoglobulina dominante, que es detectable en niveles elevados incluso en la fase aguda y persiste durante periodos que duran desde 10 meses hasta toda la vida.
Patogénesis
El dengue grave puede ser desencadenado tanto por factores virales como por características del huésped. Se ha observado que ocurre especialmente en personas con infecciones secundarias por una cepa diferente del virus y en recién nacidos de madres inmunes al dengue, cuyos anticuerpos iniciales pueden no ser efectivos contra el virus.
Este fenómeno, conocido como ADE (amplificación dependiente de anticuerpos), se produce cuando los anticuerpos generados durante una infección previa no neutralizan por completo el virus, lo que permite que este se una a células diana a través de receptores específicos y aumente su replicación. El intervalo de tiempo entre infecciones secuenciales es un factor clave, con intervalos más largos asociados a un mayor riesgo de dengue grave en infecciones secundarias. Los anticuerpos neutralizantes, dirigidos principalmente contra la proteína de envoltura del virus, pueden desencadenar
la entrada viral a través de receptores en monocitos y macrófagos, lo que contribuye al ADE y al desarrollo de formas graves de la enfermedad. Este fenómeno puede ocurrir tanto extrínseca como intrínsecamente, con efectos adversos en la respuesta inmunitaria del huésped, lo que favorece la replicación viral y la liberación del virus.
MANIFESTACIONES CLÍNICAS
El dengue es una enfermedad sistémica con diversas presentaciones clínicas, desde infecciones asintomáticas hasta formas graves con complicaciones como coagulopatía, choque y falla de órganos.
La enfermedad puede dividirse en tres fases: febril, crítica y de recuperación o convalecencia. Durante la fase febril, que dura de 2 a 7 días, los pacientes experimentan fiebre alta acompañada de síntomas como osteomialgias, cefalea y erupciones cutáneas. Las manifestaciones mucocutáneas del dengue son variadas e incluyen eritema facial transitorio, erupción petequial, inyección conjuntival y escleral, y una erupción maculopapular o morbiliforme 3-6 días después del inicio de la fiebre, que puede coalescer, pero con áreas de preservación.
En la fase crítica, que generalmente ocurre entre los días 3 y 7 de la enfermedad, se observa un mayor riesgo de fuga capilar y hemorragias con signos de alarma que pueden indicar progresión a enfermedad grave (dolor o sensibilidad abdominal, vómitos persistentes, acumulación de líquido extravascular clínicamente detectable, sangrado mucoso, letargo o inquietud, agrandamiento del hígado y aumento del hematocrito generalmente concurrente con una disminución rápida del recuento de plaquetas).
El dengue grave, que afecta al 2% - 5 % de los pacientes, se caracteriza por complicaciones como choque, sangrado grave y compromiso de órganos. La tasa de letalidad media es del
Volumen 23 Número 1 Precop SCP 9
Juan Diego Galindo Dávila, Natalia del Pilar Delgado Ortiz, Iván José Ardila Gómez, Andrés Felipe Romero Andrade
5 % (rango de 0,01 %-39 %), razón por la que es importante su temprano reconocimiento y adecuado manejo.
Finalmente, la fase de recuperación se caracteriza por la reabsorción gradual del líquido extravascular y la mejoría de los síntomas, aunque pueden persistir algunas molestias (Figura 2).
DIAGNÓSTICO
El diagnóstico del dengue basado únicamente en los síntomas clínicos no es confiable por su
amplio espectro clínico. Los análisis de laboratorio para confirmar la infección por el virus del dengue pueden incluir la detección del virus, su material genético, antígenos o anticuerpos, o una combinación de estas técnicas. Durante los primeros días de la enfermedad, el virus puede ser detectado en el suero, plasma, células sanguíneas circulantes y otros tejidos durante un periodo de cuatro a cinco días. Durante las etapas iniciales de la enfermedad, se pueden emplear pruebas como el aislamiento viral, la detección de ácido nucleico o antígeno para diagnosticar la infección. Al final de la fase aguda de la enfermedad, los métodos serológicos se convierten en los preferidos para el diagnóstico.
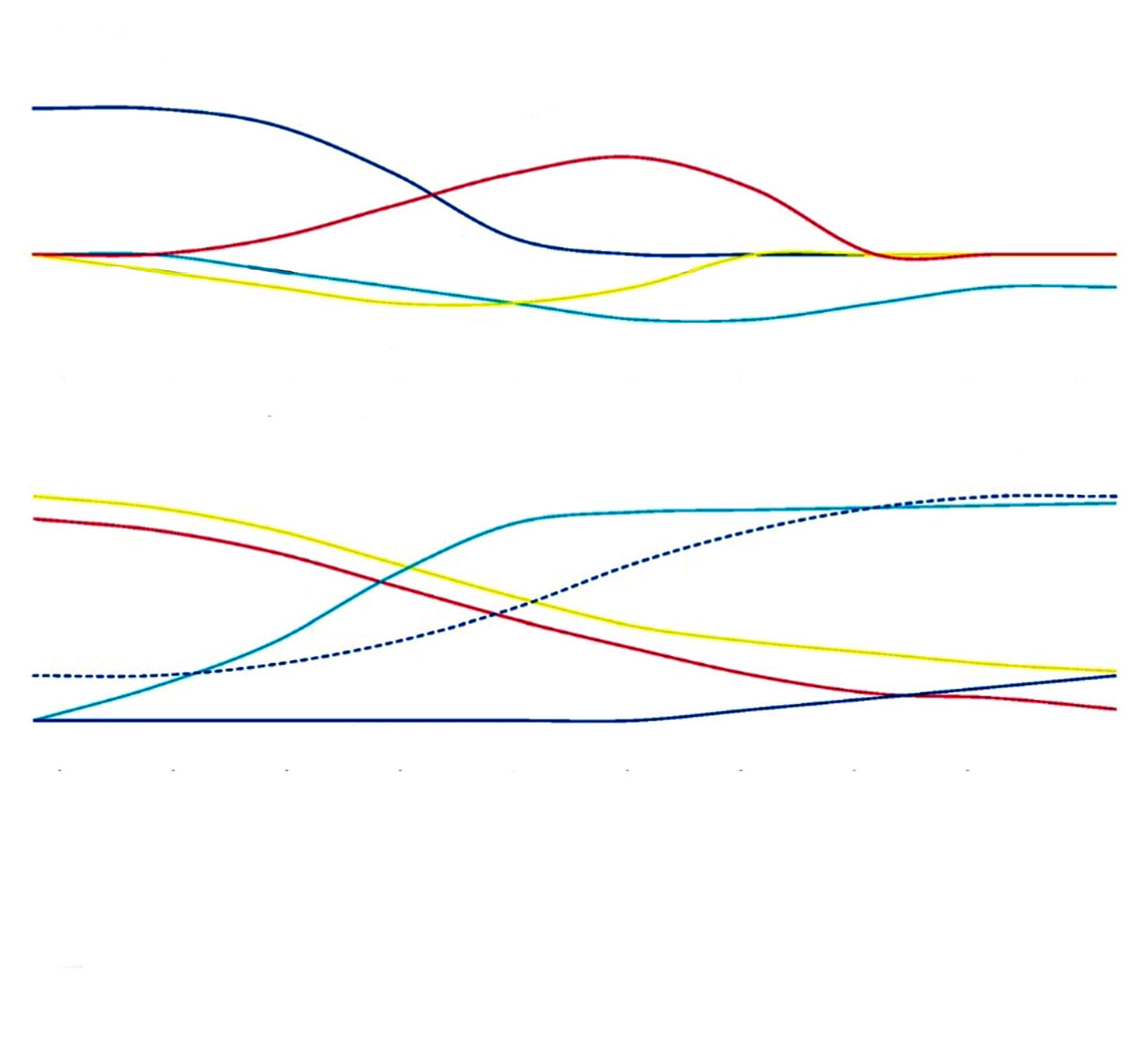
Figura 2. Curso clínico del dengue, hallazgos paraclínicos, detección viral y respuesta inmunitaria.
Fiebre y laboratorios
Temperatura
Hematocrito
Leucocitos
Virus y niveles de anticuerpos
NS1 IgM
Plaquetas
IgG secundaria
IgG primaria
Fase febril (0-7 días)
Fase crítica (1-2 días)
Día de enfermedad
Modificada de: Paz-Bailey G et al. Lancet. 2024;403(10427):667-682.
Fase de recuperación (3-5 días)
Dengue en pediatría Volumen 23 Número 1 Precop SCP 10
1 2 3 4 5 6 7 8 9 10
Durante la etapa temprana de la infección (menos de cinco días), el dengue puede diagnosticarse mediante aislamiento viral, pruebas de amplificación de ácidos nucleicos (NAAT) para detectar ARN, o mediante la detección de antígenos como NS1. Después de este periodo (más de cinco días después de la infección), el ARN del DENV y los antígenos pueden ya no ser detectables, ya que la viremia disminuye y las respuestas de anticuerpos aumentan. En esta etapa, la detección de anticuerpos específicos mediante pruebas serológicas (detección de IgM o IgG) es apropiada. El antígeno NS1 puede ser detectado en algunos pacientes durante varios días después de la defervescencia (Figura 3).
Aislamiento del virus
El aislamiento del virus del dengue (DENV) es un método específico para confirmar el diagnóstico de la enfermedad. Se pueden usar muestras clínicas como sangre completa, suero, plasma o tejido homogeneizado, especialmente en casos fatales. Después de la inoculación y una fase de incubación, se requiere un ensayo de confirmación como la inmunofluorescencia o la reacción en cadena de la polimerasa con
transcriptasa reversa (RT-PCR). Sin embargo, el proceso presenta limitaciones prácticas, como la necesidad de instalaciones de laboratorio especializadas, un periodo de incubación de al menos siete días y la recolección de muestras durante la fase aguda de la infección. Además, un bajo nivel de viremia de DENV puede dificultar el cultivo del virus.
Pruebas de amplificación de ácidos nucleicos
Las pruebas de amplificación de ácidos nucleicos se pueden utilizar para diagnosticar el dengue durante la fase aguda de la infección (< 5 días) y pueden detectar el ARN del DENV en una muestra clínica dentro de las 24 a 48 horas posteriores a la infección. Las técnicas incluyen RT-PCR, RT-PCR en tiempo real o métodos de amplificación isotérmica. La sensibilidad de los métodos de RT-PCR varía del 80 % al 100 % y depende de la región del genoma a la que se dirigen los cebadores, el enfoque utilizado para amplificar o detectar los productos de la PCR y el método empleado para la serotipificación. El ensayo de RT-PCR multiplex en tiempo real es más rápido y puede determinar el título viral en
Figura 3. Niveles de antígeno/anticuerpos durante infección primaria y secundaria por dengue.
Infección primaria
Periodo de incubación
Infección secundaria
Periodo de incubación Fiebre Fiebre
Niveles de antígeno/anticuerpos Niveles de antígeno/anticuerpos
Modificada de: Kok BH et al. Virus Res. 2023;324:199018.
Volumen 23 Número 1 Precop SCP 11
Juan Diego Galindo Dávila, Natalia del Pilar Delgado Ortiz, Iván José Ardila Gómez, Andrés Felipe Romero Andrade
-2
Fase aguda Fase aguda Días Días
-2 0 2 4 6 8 10 12 14 16 50
0 2 4 6 8 10 12 14 16 50
NS1 NS1 IgG IgG IgM IgM
una muestra clínica. Sin embargo, esta prueba requiere equipos y reactivos costosos y debe ser realizada por técnicos experimentados.
Detección de antígenos
Ensayos como el enzimunoanálisis de adsorción (ELISA) e inmunocromográficos rápidos dirigidos a NS1 han podido detectar la infección primaria y secundaria por DENV hasta 9 días después del inicio de la enfermedad. En general, los ensayos basados en NS1 son útiles para el diagnóstico tanto de la detección como de la confirmación de la infección por el virus del dengue (DENV). Sin embargo, surgen algunas consideraciones con respecto a estos ensayos. La sensibilidad de las pruebas basadas en NS1 disminuye durante las infecciones secundarias. Además, se observa una menor sensibilidad para DENV-4 y DENV-2 en comparación con DENV-1.
Pruebas serológicas
Las pruebas serológicas como el ensayo de inhibición de la hemaglutinación (HI) y ELISA para detectar IgM e IgG se utilizan más ampliamente para diagnosticar el dengue en los países en desarrollo, ya que son fáciles de realizar y relativamente económicas, y las muestras requeridas son estables a temperatura ambiente. El ensayo de HI se basa en la capacidad de la proteína E para aglutinar glóbulos rojos (RBC). Los anticuerpos anti-DENV presentes en el suero inhiben esta aglutinación y el alcance de esta inhibición se mide en el ensayo de HI, aunque tiene algunas limitaciones que lo hacen poco práctico, tales como que cada serotipo requiere un pH óptimo diferente de los glóbulos rojos y, por tanto, requiere el uso de múltiples tampones de pH; no puede discriminar infecciones entre DENV y otros flavivirus relacionados o entre isotipos de inmunoglobulinas (IgM frente a IgG), y puede requerir un tratamiento previo químico y térmico para eliminar inhibidores inespecíficos en la muestra clínica. Por tanto, este ensayo se ha reemplazado en gran medida por métodos
basados en ELISA para la detección de IgM e IgG específicas del dengue. La sensibilidad y especificidad del ELISA para la detección de IgM, utilizando sueros recolectados cinco días o más después del inicio de la fiebre, es de 90 % y 98 %, respectivamente. La sensibilidad y especificidad de los ensayos basados en IgM están fuertemente influenciadas por la calidad del antígeno utilizado y pueden variar mucho entre los kits disponibles comercialmente.
Otro ensayo de detección de anticuerpos es la prueba neutralizante por reducción de placas (PRNT). Este ensayo mide los anticuerpos neutralizantes que inhiben la infección por DENV y, por tanto, proporciona una mayor especificidad para distinguir los anticuerpos contra el DENV de otros anticuerpos de flavivirus con reacción cruzada. Sin embargo, este ensayo exige mucha mano de obra, tiene un rendimiento bajo y requiere mucho tiempo, razones por las que el PRNT no se utiliza en diagnósticos de rutina. Para superar estas limitaciones, se ha desarrollado una nueva generación de métodos basados en PRNT, como el ensayo de microneutralización puntual inmunoabsorbente ligado a enzimas y la prueba de microneutralización basada en ELISA.
Diagnósticos diferenciales
Numerosas enfermedades, tanto infecciosas como no infecciosas, pueden presentar síntomas similares al dengue y su forma grave. Los exámenes de laboratorio, la información epidemiológica y las manifestaciones clínicas son cruciales para el diagnóstico diferencial en casos de fiebre aguda sin diagnóstico claro. Condiciones como la influenza, sarampión, chikunguña y la mononucleosis pueden confundirse con el dengue debido a síntomas similares como fiebre, cefalea y síntomas generales como astenia y adinamia. Además, otros diagnósticos diferenciales incluyen infecciones por adenovirus, virus de la inmunodeficiencia humana (VIH), malaria, leptospirosis e infecciones bacterianas, entre otros. Es importante
Dengue en pediatría Volumen 23 Número 1 Precop SCP 12
considerar la secuencia y la naturaleza de los signos y síntomas para un diagnóstico preciso, especialmente durante la fase crítica del dengue, en la que pueden surgir complicaciones como extravasación de plasma y choque. La fiebre amarilla, aunque rara, también debe ser considerada, ya que comparte características clínicas y vector con el dengue. En resumen, un enfoque integral basado en la historia clínica y los hallazgos de laboratorio es esencial para diferenciar el dengue de otras enfermedades con presentaciones similares ( Tabla 2).
CLASIFICACIÓN
La clasificación histórica del dengue de la OMS de 1997 (DF, DHF y DSS) se basó en investigaciones en niños tailandeses de los años 1950-60.
En 2009, la OMS emitió una nueva guía que divide los casos en graves y no graves, para un diagnóstico más preciso. Se deben considerar los signos de alarma que reflejan disfunción endotelial. Los casos graves incluyen signos de fuga plasmática, dificultad respiratoria, sangrado grave o afectación de órganos. La clasificación previa dejaba espacio para casos no clasificables, conocidos como inusuales, en pacientes con manifestaciones graves que no cumplían los criterios de choque o hemorragia ( Tabla 3).
TRATAMIENTO
No hay tratamientos específicos aprobados por la Administración de Alimentos y Medicamentos (FDA) para el dengue. Varios candidatos han sido probados en ensayos clínicos. El diagnóstico
Tabla 2. Manifestaciones diferenciales entre dengue, chikunguña y Zika
Certeza en la evidencia Dengue Chikunguña Zika
Alta (hallazgos que la diferencian)
Moderada (hallazgos que probablemente la diferencian)
Trombocitopenia Artralgias Prurito
Aumento progresivo del hematocrito Erupción
Leucopenia
Anorexia o hiporexia
Vómitos Conjuntivitis Erupción
Dolor abdominal Artritis Conjuntivitis
Escalofríos
Hemorragias
Dolor retroocular
Hepatomegalia
Cefalea
Baja (hallazgos que podrían diferenciarla) Diarrea
Mialgias o dolores óseos
Adenopatías Tos Faringitis/odinofagia
Elevación de transaminasas
Prueba de torniquete positiva
Modificada de: Organización Panamericana de la Salud. Rev Panam Salud Publica. 2022;46:e82.
Volumen 23 Número 1 Precop SCP 13
Juan Diego Galindo Dávila, Natalia del Pilar Delgado Ortiz, Iván José Ardila Gómez, Andrés Felipe Romero Andrade
Tabla 3. Clasificación del dengue
Dengue sin signos de alarma Dengue con signos de alarma Dengue grave
Caso probable de dengue Signos de alarma Criterios de gravedad
- Vive en áreas endémicas de dengue o viajó a ellas.
- Presenta fiebre y dos o más de las siguientes manifestaciones:
- náuseas, vómitos
- exantema
- mialgias y artralgias
- petequias o prueba positiva del torniquete
- leucopenia
Confirmado por laboratorio.
- Dolor abdominal intenso y continuo
- Vómito persistente
- Acumulación de líquidos
- Sangrado de mucosas
- Letargia; irritabilidad
- Hepatomegalia mayor de 2 cm
- Laboratorio: aumento del hematocrito junto con una rápida caída de las plaquetas
Escape importante de plasma que lleva a:
- choque (SCD)
- acumulación de fluidos en el pulmón y disnea
- sangrado grave según la evaluación del clínico
- daño orgánico grave
- hígado: AST o ALT mayor o igual a 1000
- SNC: alteraciones sensitivas en el corazón y otros órganos
ALT: alanina-aminotransferasa; AST: aspartato-aminotransferasa; SCD: síndrome de choque por dengue; SNC: sistema nervioso central. Adaptada de: Organización Panamericana de la Salud (OPS) / Organización Mundial de la Salud (OMS). Dengue. Guías de atención para enfermos en la región de las Américas. La Paz: OPS/OMS; 2010. p. 6
se basa en la historia clínica y el examen físico, y se determina la necesidad de hospitalización. Dependiendo de la gravedad, los pacientes pueden ser tratados en casa (Grupo A), hospitalizados (Grupo B) o necesitar tratamiento de emergencia y referencia (Grupo C).
Tratamiento según la gravedad
Grupo A
Los pacientes aptos para el alta pueden mantener una hidratación adecuada con líquidos orales mientras no manifiesten signos de alarma. Se les debe aconsejar reposo en cama, una ingesta frecuente de líquidos, especialmente soluciones orales de rehidratación, y evitar el consumo de bebidas carbonatadas. Se puede administrar paracetamol para la fiebre alta, pero se deben evitar otros antiinflamatorios. La hospitalización durante la fase febril se reserva para aquellos que no pueden mantener la hidratación oral adecuada, lactantes y pacientes con enfermedades subyacentes o riesgo social.
Grupo B
Los pacientes que requieren hospitalización para una observación cercana incluyen aquellos con signos de alarma, condiciones médicas coexistentes que pueden complicar el dengue y circunstancias sociales que dificultan el acceso al cuidado médico. La reposición rápida de líquidos es esencial para prevenir el choque en pacientes con signos de alarma.
El plan de acción para pacientes hospitalizados es el siguiente:
• Evaluar el hematocrito antes de iniciar la terapia intravenosa.
• Administrar soluciones isotónicas como solución salina al 0,9 % o lactato de Ringer a tasas específicas, y se ajustan según la respuesta clínica y los cambios en el hematocrito.
• Comenzar con 5-7 mL/kg/hora durante 1-2 horas, luego reducir a 3-5 mL/kg/hora durante 2-4 horas, y luego reducir a 2-3 mL/ kg/hora o menos según la respuesta clínica.
Dengue en pediatría Volumen 23 Número 1 Precop SCP 14
• Reevaluar el estado clínico y repetir el hematocrito. Si el hematocrito permanece igual o aumenta solo mínimamente, continuar con la misma tasa (2-3 mL/kg/hora) durante otras 2-4 horas.
• Si los signos vitales empeoran y el hematocrito aumenta rápidamente, aumentar la tasa a 5-10 mL/kg/hora durante 1-2 horas.
• Mantener una buena perfusión y producción de orina con el volumen mínimo de líquido intravenoso necesario.
• Administrar el volumen mínimo de líquido intravenoso necesario para mantener una buena perfusión y un gasto urinario de aproximadamente 0,5 mL/kg/hora.
• Reducir gradualmente los líquidos intravenosos cuando disminuya la pérdida de plasma hacia el final de la fase crítica.
• Los líquidos intravenosos generalmente son necesarios solo durante 24-48 horas
Grupo C
Estos pacientes presentan dengue grave y necesitan atención médica urgente debido a su condición crítica. Se debe reponer rápidamente el plasma perdido con soluciones salinas isotónicas, y reservar la transfusión de sangre solo para casos de hemorragias graves confirmadas o sospechas de hemorragias graves acompañadas de hipotensión inexplicada. Se utiliza una estrategia de administración rápida de líquidos, con volúmenes mayores en un tiempo limitado, bajo estrecha supervisión para evitar el edema pulmonar sin incluir glucosa en los líquidos administrados. Durante el choque por dengue, las pérdidas de líquidos suelen ser mayores que los ingresos, lo que complica la evaluación de las necesidades de reanimación. Los objetivos de esta reanimación son mejorar la circulación y la perfusión de los órganos, reflejados en signos como una presión arterial estable, extremidades cálidas, una producción de orina adecuada y una mejoría en la acidosis metabólica.
Vacunas contra el dengue
Debido a la falta de tratamientos antivirales efectivos, la vacunación es clave para prevenir el dengue grave y la muerte. Sin embargo, el desarrollo de una vacuna ha sido desafiante debido a la complejidad de los serotipos del virus del dengue y a las posibles complicaciones relacionadas con la respuesta inmunitaria. Actualmente, hay tres vacunas principales en desarrollo: Dengvaxia, Qdenga y TV003. Estas vacunas son tetravalentes y difieren en la cantidad de dosis y el tiempo requerido para completar la serie, lo que podría afectar su implementación en diferentes entornos. Además, algunas requieren un cribado previo de dengue para determinar la elegibilidad, lo que plantea desafíos logísticos.
Dengvaxia
Esta vacuna se administra en tres dosis con un intervalo de seis meses. Inicialmente recomendada por la OMS en 2016 para personas de 9 años en adelante en áreas altamente endémicas, su eficacia fue evaluada durante un seguimiento de cinco años en ensayos de fase 3. Los resultados mostraron una protección contra el dengue grave en niños con evidencia previa de infección por DENV. Sin embargo, aumentó el riesgo de hospitalización por dengue en aquellos sin infección previa que posteriormente se infectaron. Por tanto, la OMS ajustó las recomendaciones, limitando la administración de la vacuna a niños con evidencia confirmada de infección previa por DENV.
Para niños de 9 a 16 años con evidencia previa de infección por DENV, Dengvaxia demostró una eficacia de aproximadamente el 80 % contra el dengue sintomático, la hospitalización y el dengue grave. La eficacia varió por serotipo: fue más alta para DENV-4 y DENV-3 y más baja para DENV-1 y DENV-2. La necesidad de pruebas de laboratorio antes de la vacunación
Volumen 23 Número 1 Precop SCP 15
Juan Diego Galindo Dávila, Natalia del Pilar Delgado Ortiz, Iván José Ardila Gómez, Andrés Felipe Romero Andrade
plantea un desafío, con requisitos de alta especificidad y sensibilidad. Actualmente, pocas pruebas comerciales cumplen con estos criterios recomendados.
Qdenga
Es una vacuna desarrollada por Takeda, que requiere dos dosis con tres meses de diferencia entre ellas. En niños de 4 a 16 años, demostró una eficacia del 64 % contra el dengue sintomático confirmado virológicamente en aquellos con evidencia previa de infección, y del 54 % en los que no la tenían tres años después de la vacunación. La eficacia contra la hospitalización por dengue fue del 86 % en los seropositivos y del 79 % en los seronegativos. La protección fue variable según el serotipo, con falta de eficacia contra DENV-3 y DENV-4 en los seronegativos. Aunque hubo un aumento potencial del riesgo de hospitalización después de la infección con DENV-3, esto se observó en una cantidad reducida de casos. La Comisión Europea aprobó Qdenga en diciembre de 2022, independientemente del estado serológico, y Alemania comenzó la vacunación en viajeros. En septiembre de 2023,
LECTURAS RECOMENDADAS
1. Bhatt P, Sabeena SP, Varma M, Arunkumar G. Current Understanding of the Pathogenesis of Dengue Virus Infection. Curr Microbiol. 2021;78(1):17-32.
2. Gutiérrez-Barbosa H, Medina-Moreno S, Zapata JC, Chua JV. Dengue Infections in Colombia: Epidemiological Trends of a Hyperendemic Country. Trop Med Infect Dis. 2020;5(4):156.
3. Khan MB, Yang ZS, Lin CY, Hsu MC, Urbina AN, Assavalapsakul W, et al. Dengue overview: An updated systemic review. J Infect Public Health. 2023;16(10):1625-1642.
4. Kok BH, Lim HT, Lim CP, Lai NS, Leow CY, Leow CH. Dengue virus infection - a review of pathogenesis, vaccines, diagnosis and therapy. Virus Res. 2023;324:199018.
el Grupo Asesor Estratégico de Expertos en Inmunización recomendó su introducción en entornos con alta transmisión, especialmente para niños de 6 a 16 años, con la realización de estudios adicionales para evaluar su efectividad y seguridad.
TV003
Es una vacuna desarrollada por los Institutos Nacionales de Salud, que se creó seleccionando componentes específicos de serotipos para garantizar un perfil equilibrado de seguridad e inmunogenicidad. A diferencia de otras vacunas, TV003 se administra en una sola dosis. Durante el seguimiento de 2 años, la eficacia de la vacuna contra cualquier serotipo fue de 73,6 % en los participantes sin evidencia de exposición previa al dengue y de 89,2 % en aquellos con evidencia de exposición previa al dengue. Una sola dosis demostró ser eficaz en niños, adolescentes y adultos en un rango de edad de 2 a 59 años. Sin embargo, la utilidad de una dosis de refuerzo administrada después de un periodo prolongado (> 12 meses) no se conoce actualmente.
5. Lovera D, Martinez de Cuellar C, Araya S, Amarilla S, Gonzalez N, Aguiar C, et al. Clinical Characteristics and Risk Factors of Dengue Shock Syndrome in Children. Pediatr Infect Dis J. 2016;35(12):1294-1299.
6. Paz-Bailey G, Adams LE, Deen J, Anderson KB, Katzelnick LC. Dengue. Lancet. 2024;403(10427):667-682.
7. Thach TQ, Eisa HG, Hmeda AB, Faraj H, Thuan TM, Abdelrahman MM, et al. Predictive markers for the early prognosis of dengue severity: A systematic review and meta-analysis. PLoS Negl Trop Dis. 2021;15(10):e0009808.
8. Torres-Flores JM, Reyes-Sandoval A, Salazar MI. Dengue Vaccines: An Update. BioDrugs. 2022;36(3):325-336.
Dengue en pediatría Volumen 23 Número 1 Precop SCP 16
Enfoque integral del paciente con cardiopatía congénita en urgencias pediátricas: estrategias
INTRODUCCIÓN
y consideraciones
Daniel Mainero M., MD1
Mónica P. Gutiérrez G., MD2
Otto M. González P., MD, PG3
Las cardiopatías congénitas (CC) consisten en uno o más problemas en la estructura del corazón, que existen desde el nacimiento. Representan la malformación congénita más común, con una incidencia estimada entre 5 y 10 casos por cada 1000 nacidos vivos. Estos pacientes tienen una amplia gama de presentación y demandan atención especializada y rápida. Lo anterior hace que sean de alta complejidad y que su abordaje adecuado represente un reto para los profesionales en pediatría. Estos pacientes se pueden dividir en dos escenarios: en primer lugar, se encuentran aquellos con defectos cardiacos no diagnosticados, quienes pueden exhibir síntomas como insuficiencia cardiaca congestiva, cianosis, síncope, arritmias o choque cardiogénico, y, en segundo
lugar, están aquellos con defectos cardíacos ya conocidos, cuya forma de presentación y manejo dependerá de la patología subyacente.
A pesar de la abundancia de estudios que detallan la fisiopatología y el tratamiento de las CC en la literatura, son escasos los que se centran en la presentación clínica y el abordaje adecuado de estas condiciones en el servicio de urgencias.
FISIOPATOLOGÍA
Se han descrito diversas clasificaciones en la literatura y no existe un consenso internacional sobre cuál es la más adecuada; sin embargo, la que mayor difusión tiene es la que las divide de acuerdo con la presencia o ausencia de tres
1. Residente de Pediatría, Universidad de la Javeriana. Fundación Clínica Shaio.
2. Residente de Pediatría, Universidad de los Andes. Fundación Clínica Shaio.
3. Médico Especialista en Pediatría. Subespecialista en Cuidado Intensivo Pediátrico, Universidad Nacional. Jefe del Departamento de Pediatría, Fundación Clínica Shaio.
Volumen 23 Número 1 Precop SCP 17
características fisiopatológicas significativas: cortocircuito de izquierda a derecha (hiperflujo pulmonar), obstrucción a los tractos de salida y cianosis. Vale la pena mencionar que estas características no son excluyentes, por lo que una CC puede tener una o más de las mismas. A continuación se describe cada una de las características mencionadas.
Cortocircuito de izquierda a derecha
Dentro de esta categoría se incluyen la comunicación interauricular, comunicación interventricular, conducto arterioso persistente, drenaje venoso anómalo parcial y canal auriculoventricular.
El gradiente de presiones entre cavidades izquierdas y derechas produce un cortocircuito de izquierda a derecha, lo que permite una comunicación entre la circulación sistémica y la pulmonar. La magnitud del cortocircuito depende del tamaño de la lesión y de las resistencias pulmonares. El ventrículo derecho experimenta sobrecarga de presión y flujo, mientras que el izquierdo, únicamente de flujo. El hiperflujo pulmonar que experimentan estos pacientes induce cambios estructurales en las paredes de las arteriolas pulmonares que finalmente llevan a hipertensión pulmonar con inversión del cortocircuito de derecha a izquierda (síndrome de Eissenmenger), lo que produce hipoflujo pulmonar, cianosis e hipoperfusión sistémica.
Obstructiva
Dentro de esta categoría se incluyen la estenosis pulmonar, estenosis aórtica y coartación aórtica. La obstrucción del flujo sanguíneo aumenta la carga de trabajo del ventrículo comprometido por la resistencia generada durante la salida del flujo, que varía según su ubicación, ya sea en el lado izquierdo o derecho. Esta situación puede desencadenar hipertrofia de la pared muscular ventricular izquierda como un mecanismo compensatorio para mantener el flujo pulmonar adecuado, o dilatación y eventual falla
del ventrículo derecho en caso de obstrucción en la salida del flujo del lado derecho.
Cianosante
Dentro de esta categoría se incluyen la tetralogía de Fallot, transposición de grandes vasos y atresia tricúspidea. El común denominador de estas cardiopatías es la reducción del flujo sanguíneo a nivel pulmonar, lo que conlleva la salida de sangre desoxigenada hacia la circulación sistémica. Esta condición tiene numerosas implicaciones fisiopatológicas, que afectan tanto la función celular como el metabolismo, así como la capacidad del sistema cardiovascular para mantener un adecuado suministro de oxígeno a los tejidos.
El flujo reducido a nivel pulmonar puede provocar una hipoxemia crónica, lo que lleva a adaptaciones fisiológicas y cambios en la hemodinamia. La disminución del flujo sanguíneo al lecho pulmonar puede alterar el intercambio gaseoso, de modo que reduce la oxigenación tisular y compromete la función de diversos órganos y sistemas. Además, la sobrecarga de trabajo del ventrículo derecho, debido a la persistencia de la circulación pulmonar reducida, puede resultar en una hipertrofia y eventualmente en una insuficiencia cardiaca derecha.
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas en niños con CC son diversas y pueden presentarse de manera variada, desde signos sutiles hasta síntomas graves que requieren atención médica urgente. Estos síntomas pueden sugerir la posible causa cardiaca y ayudar en el diagnóstico de la enfermedad. Por eso es esencial comprender las manifestaciones clínicas asociadas con CC, ya que pueden guiar la evaluación y el enfoque terapéutico adecuado. En la Tabla 1 se describen las principales manifestaciones clínicas relacionadas con CC en niños, destacando su importancia y relación con su posible causa cardiaca.
estrategias
consideraciones Volumen 23 Número 1 Precop SCP 18
Enfoque integral del paciente con cardiopatía congénita en urgencias pediátricas:
y
Signo/síntoma
Choque cardiogénico
Tabla 1. Manifestaciones clínicas en cardiopatías congénitas.
Posible causa cardíaca Comentarios
- Estenosis aórtica
- Coartación de aorta
- ALCAPA (origen anómalo de la arteria coronaria izquierda en la arteria pulmonar) con infarto miocárdico.
- Síndrome de corazón izquierdo hipoplásico.
Cianosis - Dextrotransposición de grandes vasos.
- Tetralogía de Fallot.
- Atresia tricúspidea.
- Tronco arterioso.
Se pueden presentar con taquicardia extrema, bradicardia, arritmia o hipoperfusión tisular. Tomar la presión en las 4 extremidades.
- Drenaje venoso pulmonar anómalo completo. Hipoxia que no mejora con oxígeno suplementario (oximetrías < 80%-85%)
Falla cardiaca - Comunicación interventricular
- Ductus arterioso persistente.
- Canal auriculoventricular.
- ALCAPA con isquemia recurrente.
- Drenaje venoso pulmonar anómalo completo. Taquipnea con signos de dificultad respiratoria. Hepatomegalia. Cianosis grave. Estertores.
Dolor torácico - Cardiomiopatía hipertrófica obstructiva.
- Obstrucción del tracto de salida del ventrículo izquierdo.
Menos del 6% del dolor torácico en pediatría tiene relación con la causa cardíaca.
Palpitaciones - Patología cardíaca estructural. Siempre se debe realizar electrocardiograma, considere tomar un DII largo.
Falla del medro - Anomalías cardíacas genéticas.
Anomalías de la pared torácica
- No hay una relación específica con una cardiopatía.
Síncope - Estenosis aórtica.
- Cardiomiopatía hipertrófica.
- Origen anómalo de la aorta.
Consultar a cardiología al auscultar soplo en paciente con falla del medro.
Modificada de: Judge P, et al. Pediatr Emerg Med Pract. 2016;13(5):1-28; American Family Physician. Am Fam Physician. 2022;105(3):250-61.
DIAGNÓSTICO
En servicios de urgencias pediátricas, el diagnóstico rápido y preciso de cardiopatías congénitas es fundamental para el abordaje adecuado de los pacientes, y representa un gran reto para el profesional de la salud. La historia clínica detallada es de máxima importancia para facilitar este proceso, por lo que
se sugiere emplear una serie de preguntas dirigidas a padres y cuidadores que le pueden ofrecer al profesional una guía inicial en la evaluación del paciente:
• ¿Qué tipo de cardiopatía tiene el paciente?
• ¿Ha tenido cirugías previas?
• ¿Qué cifras de saturación de oxígeno maneja de base?
Volumen 23 Número 1 Precop SCP 19
Daniel Mainero M., Mónica P. Gutiérrez G., Otto M. González P.
• ¿Qué tratamiento farmacológico recibe y hace cuanto se le realizó el último ajuste?
• ¿Ha tenido deterioro de la clase funcional?
Ante la diversidad de presentaciones clínicas y la importancia de un tratamiento temprano, es crucial contar con métodos de diagnóstico efectivos. En este contexto, se usan diferentes herramientas clínicas y paraclínicas para identificar y evaluar la gravedad de las anomalías cardíacas, como el examen físico, la oximetría de pulso y la medición de la presión arterial. A continuación se detallan los métodos diagnósticos más relevantes en la detección precoz de cardiopatías congénitas en el entorno de urgencias.
Auscultación cardiaca
Esta depende de las habilidades sensoriales del profesional. La auscultación cardiaca es una herramienta valiosa que permite una evaluación práctica y amplia del funcionamiento del corazón. Se deben evaluar diferentes aspectos durante la auscultación, como definir el tiempo, duración, localización, tonalidad, intensidad y forma; su irradiación y los efectos de la respiración y modificaciones con maniobras específicas para realizar una adecuada orientación en el servicio de urgencias. La auscultación cardiaca normal debe ser rítmica, con una frecuencia adecuada para la edad y correlacionarla con el estado hemodinámico del paciente (bradicardia patológica en choque y taquicardia patológica en reposo).
Comúnmente se han descrito dos ruidos cardiacos (S1 y S2), correspondientes al cierre de las válvulas auriculoventriculares y semilunares, respectivamente, que producen un sonido descrito como lub dub. En situaciones fisiológicas se podría auscultar un desdoblamiento del segundo ruido durante la inspiración (S3), en cuyo caso se evaluará si es fijo o cambiante con la respiración, y el desdoblamiento fijo, patológico, que podría sugerir crecimiento del ventrículo derecho. La presencia de ritmo de
galope por S4 debe hacer pensar en insuficiencia cardiaca. La disminución en la intensidad de los ruidos cardíacos podría sugerir la presencia de derrame pericárdico o taponamiento cardíaco.
En presencia de CC, puede haber agregados como un sonido de frote, que sugiera la presencia de derrame pericárdico. Los soplos son ruidos silbantes o ásperos que se escuchan durante un latido cardiaco, y no siempre son patológicos, destacando la presencia de los tradicionalmente llamados soplos fisiológicos, funcionales o inocentes, que no se encuentran en todos los casos asociados a patología cardiaca. El soplo inocente más común es el soplo vibratorio de Still, que se puede encontrar hasta en el 60% de los niños de 2 a 6 años, y es un soplo sistólico eyectivo, localizado en el borde esternal izquierdo con un sonido suave y de baja intensidad que se modifica con los cambios de posición. Los soplos patológicos, en su mayoría, están vinculados con cardiopatías estructurales y con frecuencia necesitan intervenciones médicas o procedimientos quirúrgicos. Se estima que alrededor del 37% de los lactantes que presentan soplos, pero no tienen patologías sindrómicas congénitas, son diagnosticados con cardiopatía congénita.
Oximetría de pulso
En el contexto de las CC, la oximetría de pulso es crucial en el diagnóstico precoz y la evaluación de la gravedad de las anomalías cardiacas, en especial en urgencias pediátricas. El valor normal de la oximetría dependerá del tipo de cardiopatía y de la presión atmosférica. Es importante tener en cuenta que los valores de referencia establecidos para la población general pueden no ser aplicables a pacientes con patologías cianosantes; en estos casos, se considerarán valores adecuados de oximetría entre el 75% y el 85%. La recomendación de realizar mediciones de oximetría en el miembro superior derecho y en cualquiera de las extremidades inferiores se basa en la detección de posibles discrepancias en la saturación de
Enfoque integral del paciente con cardiopatía congénita en urgencias pediátricas: estrategias y consideraciones Volumen 23 Número 1 Precop SCP 20
oxígeno entre estos segmentos corporales (preductal y posductal). Esta técnica deriva de las guías de tamizaje neonatal para cardiopatías congénitas, diseñadas para identificar a los recién nacidos con riesgo de padecer una cardiopatía significativa. La detección de una diferencia superior al 3% en la saturación de oxígeno entre el miembro superior derecho y las extremidades inferiores, en tres mediciones consecutivas con intervalos de una hora, puede ser indicativa de una patología cardiaca subyacente, lo que justificaría una evaluación y manejo más detallados. La oximetría de pulso es una herramienta clave en urgencias pediátricas relacionadas con cardiopatías congénitas, ya que permite la detección rápida y no invasiva de posibles anomalías cardíacas que requieren atención inmediata.
Presión arterial
Constituye una medida indirecta de la perfusión de los diversos órganos y puede ser útil para identificar rápidamente cambios significativos en la hemodinamia. Se recomienda tomar la presión arterial en las cuatro extremidades durante el primer contacto, para detectar discrepancias en los valores. Normalmente, la diferencia entre la presión arterial sistólica (PAS) en los brazos y en las piernas es mínima, generalmente inferior a 10 mm Hg. Sin embargo, una discrepancia superior a 20 mm Hg en la PAS a favor de las extremidades superiores podría sugerir la presencia de una coartación de la aorta. En pacientes pediátricos con persistencia de cifras de presión arterial en miembros superiores por encima del percentil 90 para su edad, talla y sexo, se debe considerar una coartación de la aorta y realizar una evaluación adicional. Una disminución en la presión arterial sistémica puede ser un indicador de una perfusión inadecuada de los órganos vitales, lo que puede requerir una intervención médica urgente para restablecer una perfusión adecuada. En el servicio de urgencias, la medición de la presión arterial antes y después de la
intervención médica puede proporcionar información valiosa sobre la eficacia del tratamiento. La presencia de una presión arterial inestable o hipotensión persistente puede indicar una enfermedad cardiovascular grave y un mayor riesgo de complicaciones y mortalidad.
Para estimar el percentil 5 de la PAS para la edad, se pueden tomar en cuenta las recomendaciones de las guías de la Asociación Americana del Corazón (por sus siglas en inglés, AHA). Para recién nacidos, se establece en 60 mm Hg, mientras que para lactantes menores es de 70 mm Hg. Posteriormente, se calcula utilizando la ecuación (edad en años × 2) + 70 mm Hg. Adicionalmente, la ecuación (edad en años × 2) + 90 mm Hg se puede utilizar para estimar el percentil 50 de la PAS. Es importante adaptar estas estimaciones a la situación clínica y hemodinámica específica de cada paciente, tomándolos como una guía y no como valores de manera estricta, y considerando la adecuada perfusión orgánica como la meta principal para el manejo hemodinámico óptimo del niño.
Pulsos arteriales
La evaluación de los pulsos arteriales es fundamental en el diagnóstico de las CC en pacientes pediátricos. Los pulsos arteriales proporcionan información valiosa sobre la función cardiovascular y la perfusión tisular, lo que permite detectar anomalías desde una etapa temprana. En niños con CC, los pulsos varían en amplitud, ritmo y simetría por las alteraciones en la estructura y función del sistema cardiovascular. La ausencia de pulsos en ciertas arterias periféricas o la presencia de pulsos débiles pueden ser indicativos de obstrucción vascular, cortocircuitos arteriovenosos o coartación de la aorta, entre otras. Además, la comparación de los pulsos entre diferentes extremidades puede revelar discrepancias en sus características, lo que debe hacer sospechar de coartación de la aorta u otras anormalidades del sistema cardiovascular.
Volumen 23 Número 1 Precop SCP 21
Daniel Mainero M., Mónica P. Gutiérrez G., Otto M. González P.
Electrocardiograma
Se sugiere realizar este examen a todos los pacientes con sospecha o diagnóstico de CC en urgencias pediátricas y un análisis profundo del mismo porque puede proporcionar información valiosa sobre el funcionamiento y la estructura del corazón. Teniendo en cuenta que los cambios pueden ser sutiles, se sugiere hacer una lectura sistemática, utilizando la nemotecnia FRESITA (frecuencia cardiaca, ritmo, eje, sobrecrecimiento de cavidades, isquemia, onda T y arritmias). Los valores de referencia sugeridos se describen en la Tabla 2 .
Radiografía de tórax
En niños con sospecha de CC en urgencias, es una ayuda diagnóstica clave para evidenciar la presencia concomitante de posibles patologías pulmonares. Adicionalmente, puede revelar hallazgos importantes como la ubicación cardiaca, presencia de cardiomegalia (índice cardiotorácico > 0,6 en niños de menores de un año y > 0,5 en mayores), aumento o disminución del flujo pulmonar, signos de congestión pulmonar y alteraciones en el tamaño o morfología del pedículo vascular. Estos hallazgos sugieren la presencia de una alteración en la anatomía cardiovascular y pueden orientar hacia un diagnóstico específico. Adicionalmente, esta imagen permite observar la presencia de complicaciones asociadas con las CC, como derrame pleural, edema pulmonar o neumonía. Estos hallazgos pueden ayudar en la toma de decisiones de la atención inicial del paciente en el servicio de urgencias. Por otro lado, es importante señalar que esta ayuda diagnóstica tiene limitaciones y no es suficiente por sí sola para confirmar el diagnóstico de una CC. Por tanto, se recomienda usar esta herramienta como parte de una evaluación integral que incluya otras pruebas de imagen para obtener un diagnóstico más específico.
Ecocardiograma
Dirigido por el cardiólogo pediatra, ofrece un diagnóstico especializado que siempre debería realizarse. Es importante destacar que el ecocardiograma pediátrico no solo es útil en el diagnóstico inicial de las cardiopatías congénitas, sino también en el seguimiento y manejo a corto y largo plazo de estos pacientes, que se puede realizar de manera seriada en una hospitalización para evaluar los cambios en la función y estructura del corazón. Este brinda información detallada sobre la progresión de la enfermedad, la respuesta al tratamiento y la evolución de las anomalías cardiacas a lo largo del tiempo; adicionalmente, la experiencia del cardiólogo pediatra permitirá una visualización más precisa de las estructuras cardiacas, la dirección y velocidad del flujo sanguíneo, así como la detección de anomalías estructurales y funcionales de patologías cardiacas en niños. Adicionalmente, la Academia Americana de Pediatría destaca la confiabilidad y la utilidad del ultrasonido al pie de la cama del paciente (POCUS) en manos de un profesional entrenado para el diagnóstico rápido y de niños con CC en el servicio de urgencias pediátricas. En este sentido, el POCUS ha demostrado ser una herramienta valiosa con indicaciones específicas para evaluar los determinantes de la función cardiaca de manera rápida. En el caso de los pacientes con CC, puede evaluar la contractilidad, la presencia de taponamiento cardiaco, distensibilidad de la vena cava inferior, líneas B pulmonares indicativas de edema pulmonar, derrames pleurales y ascitis.
Biomarcadores
Parámetros bioquímicos medibles de manera objetiva que permiten estimar de manera indirecta la función cardiaca. Una elevación significativa de las troponinas o de la fracción N-terminal del propéptido natriurético cerebral
Enfoque integral del paciente con cardiopatía congénita en urgencias pediátricas: estrategias y consideraciones Volumen 23 Número 1 Precop SCP 22
1 a 3 semanas
3 a 5 meses
1 a
3 a 4 años
(141)
Tabla 2. Valores de referencia del electrocardiograma pediátrico
a 11 años
Tomada de: Aly A, et al. University of Texas Medical Branch, Dept. of Pediatrics; 8 de octubre, 2017.
Daniel Mainero M., Mónica P. Gutiérrez G., Otto M. González P. Volumen 23 Número 1 Precop SCP 23
Edad Frecuencia cardíaca (latidos/min) Eje frontal QRS (grados) Intervalo PR (seg) Duración QRS V5 (seg) Q III (mm) Q V6 (mm) RV1 (mm) SV1 (mm) R/ SV1 RV6 (mm) SV6 (mm) R/SV 6 SV1+ RV 6 (mm) R + S V 4 (mm) < 1 día 93-154 (123) +59 a -163 (137) 0,08- 0,1 (,11) 0,03-0,07 (0,05) 4,5 2 5-26 (14) 0-23 (8) 0,1-U (2,2) 0-11 (4) 0-9,5 (3) ,1-U (2,0) 28 52,5 1 a 2 días 90-159 (123) +64 a -161 (134) 0,08-0,14 (,11) 0,03-0,07 (0,05) 6,5 2,5 5-27 (14) 0-21 (9) 0,1-U (2,2) 0-12 (4,5) 0-9,5 (3) ,1-U (2,5) 29 52
91-166 (129) +77 a -163 (132) 0,07-0,14 (,11) 0,03-0,14 (0,05) 5,5 3 3-24 (13) 0-17 (7) 0,1-U (2,2) ,5-12 (5) 0-10 (3,5) ,1-U (2,2) 24,5 49
107-182
+65 a +161
0,07-0,14 (,10) 0,03-0,08 (0,05) 6 3 3-12 (11) 0-11 (4) 0,1-U (2,2) 2,5-16,5 (7,5) 0-10 (3,5) 0,1-U (3,3) 21 49
121-179 (14)9 +31 a +113 (74) 0,07-0,13 (,10) 0,03-0,08 (0,05) 7.5 3 3-8 (10) 0-12 (5) 0,1-U (2,2) 5-21,5 (11,5) 0-6,5 (3) 0,2-U (4,8) 29 53,5
106-186
+7 a +104 (60) 0,07-0,15 (,11) 0,03-0,08 (0,05) 6.5 3 3-20 (10) 0-17 (6) 0,1-U (2,2) 6,5-22,5 (13) 0-10 (3) 0,2-U (6,2) 35 61,5
109-169 (134) +6 a +99 (56) 0,07-0,16 (,11) 0,03-0,08 (0,05) 8.5 3 1,5-20 (9,5) ,5-18 (4) 0,1-U (2,2) 6-22,5 (12,5) 0-7 (2) ,2-U (7,6) 37 53
3 a 6 días
(148)
(110)
1 a 2 meses
6 a 11 meses
2
89-151 (119) +7 a +101 (55) 0,08-0,15 (,11) 0,04-0,08 (0,06) 6 3 2,5-17 (9) ,5-21 (8) 0,1-U (2,2) 6-22,5 (13) 0-6,5 (2) 0,3-U (9,3) 39 49,5
años
73-137
+6 a +104 (155) 0,09-0,16 (,12) 0,04-0,08 (0,06) 5 9.5 1-18 (8) ,2-21 (10 0,1-U (2,2) 8-24,5 (15) 0-5 (1.5) 0,6-U (10,8) 42 53,5
65-133 (100) +11 a +143 (65) 0,09-0,16 (,12) 0,04-0,08 (0,06) 4 4.5 ,5-14 (4) 0,3-24 (12) ,1-U (2,2) 8,5-26,5 (16) 0-4 (1) ,9-U (11,5) 47 54 8
62-130 (91) +9 a +114 (61) 0,08-0,16 (,11) 0,04-0,09 (0,06) 3 3 0-12 (5,5) 0,3-25 (12) ,1-U (2,2) 9-25,5 (16) 0-4 (1) 1,5-U (14,3) 45,5 53
60-119 (85) +11 a -130 (159) 0,08-0,16 (,11) 0,04-0,09 (0,07) 3 3 0-10 (4) 0,3-21 (11) ,1-U (2,2) 6,5-23 (14) 0-4 (1) 1,4-U (14,7) 41 50
(108)
5 a 7 años
12 a 15 años
(NT-proBNP), en ausencia de patología isquémica, debe generar sospechas de una CC. La NT-proBNP se libera por el ventrículo izquierdo en respuesta al estrés y la sobrecarga de volumen. En niños con CC, los niveles elevados de NT-proBNP pueden indicar la presencia de insuficiencia cardiaca, por lo que su medición en el servicio de urgencias puede ayudar a identificar de manera rápida el riesgo de descompensación cardiaca. Adicionalmente, la medición de NT-proBNP en el servicio de urgencias puede ayudar a estratificar el riesgo de eventos cardiovasculares adversos, como insuficiencia cardiaca descompensada, arritmias o choque cardiogénico. Por otro lado, la medición de troponinas puede resultar útil cuando hay lesión o daño en el músculo cardiaco. El aumento de la troponina I podría indicar una patología isquémica y permite realizar un seguimiento que evalúe la extensión de la lesión en el tejido miocárdico. Los valores normales se pueden consultar en las Tablas 3 y 4.
El diagnóstico de cardiopatías congénitas en las urgencias pediátricas requiere una evaluación rápida y precisa, que incluye múltiples aspectos clínicos y paraclínicos. La interpretación hábil de estos es crucial para proporcionar el manejo adecuado y mejorar los resultados clínicos a largo plazo.
DIAGNÓSTICOS DIFERENCIALES
Ante la sospecha de una CC o descompensación aguda de la misma, se deben tener en cuenta los siguientes diagnósticos diferenciales:
• choque no cardiogénico,
• patologías respiratorias,
• infecciones,
• otras causas de acidosis metabólica,
• metahemoglobinemia,
• deshidratación grave.
Tabla 3. Valores normales de troponina I en niños
Edad Valor de troponina I 0-30 días < 4,8 μg/L
31-90 días < 0,4 μg/L
3-6 meses < 0,3 μg/L
7-12 meses < 0,2 μg/L
1-18 años < 0,1 μg/L
Tomada de: McGinn C, et al. Cardiol Young. 2023;33(4):503-13.
TRATAMIENTO
Para realizar un adecuado abordaje terapéutico en niños con CC, es necesario comprender la fisiología única de cada niño asociada a cada grupo de cardiopatías congénitas; por eso, en el presente artículo se brindan recomendaciones
Enfoque integral del paciente con cardiopatía congénita en urgencias pediátricas: estrategias y consideraciones Volumen 23 Número 1 Precop SCP 24
Tomada de: Custer J, et al. Mosby Elsevier; 2009.
Edad (años) Percentil 75 (ng/L) Percentil 97,5 (ng/L) 1 a 3 231 320 4 a 6 113 190 7 a 9 94 145 10 73 112 11 93 317 12 95 186 13 114 370 14 68 363 15 74 217 16 85 206 17 71 135 18 53 115
Tabla 4. Valores normales de NT-ProBNP en niños
para facilitar la toma de decisiones clínicas en el servicio de urgencias adaptadas a las necesidades individuales de cada paciente pediátrico con CC.
El primer paso en el tratamiento es la evaluación y estabilización inicial del paciente. Considere el uso de oxígeno suplementario teniendo en cuenta una meta de acuerdo con la cardiopatía de base; en las de cortocircuito de izquierda a derecha, demasiado oxígeno puede disminuir la resistencia vascular pulmonar y generar sobrecirculación pulmonar con bajo gasto sistémico, mientras que la hipoxemia puede inducir crisis de hipertensión pulmonar, por lo que para estos casos se sugiere tomar como referencia oximetrías de pulso entre 88% y 94%. Para los pacientes con cardiopatías cianosantes se sugiere utilizar metas de oximetría cercanas a los basales del niño, los cuales suelen oscilar entre 75% y 85%. El aumento del trabajo respiratorio o la hipoxemia refractaria pueden ser indicaciones de intubación y ventilación mecánica invasiva o no invasiva. En los pacientes con CC, el aporte de oxígeno mediante cánula de alto flujo permite brindar cierto grado de presión positiva y hacer titulaciones precisas de la fracción inspirada de oxígeno, incluso hasta del 21%.
Si el pediatra tratante considera que el paciente se beneficia de ventilación mecánica, debe considerar la interacción corazón-pulmón, teniendo en cuenta que la ventilación con presión positiva disminuirá la precarga a nivel del corazón derecho y aumentará su poscarga, mientras que en el izquierdo tendrá un efecto directo en la disminución de la poscarga, que es una estrategia terapéutica en situaciones de bajo gasto cardiaco.
Muchos pacientes con CC pueden presentarse en el servicio de urgencias con un cuadro de insuficiencia cardiaca aguda como resultado de su condición subyacente. El tratamiento de la insuficiencia cardiaca en el servicio de urgencias incluirá la administración de diuréticos para
reducir la sobrecarga de volumen, así como la optimización de la función cardiaca con inotrópicos o vasodilatadores.
En las situaciones de choque, puede ser necesario un bolo de cristaloides para aumentar la precarga; sin embargo, en los pacientes con cardiopatías, la capacidad del corazón para manejar volúmenes puede estar afectada y se corre el riesgo de producir edema pulmonar, razón por la cual se recomiendan dosis máximas de 5 a 10 mL/kg en no menos de 30 minutos, haciendo reevaluaciones frecuentes del estado hemodinámico. La mayoría de los pacientes en choque cardiogénico requieren uso de inotrópicos (adrenalina o dopamina), inodilatadores (milrinona o dobutamina) o vasopresores (noradrenalina o vasopresina) dependiendo del perfil hemodinámico (función ventricular, resistencias vasculares sistémicas y pulmonares). Estos medicamentos pueden iniciarse de manera segura por vía periférica (diluidos) mientras se obtiene un acceso venoso central.
Tradicionalmente, se han establecido metas para valores de cifras tensionales en el manejo de pacientes en escenarios de choque y descompensación hemodinámica. No obstante, estas recomendaciones, aunque valiosas, deben considerarse como una guía general y un punto de partida. Es fundamental tener en cuenta que la meta principal es lograr una perfusión tisular adecuada, lo que implica evaluar no solo los valores de presión arterial de referencia, sino también aquellos en los que el paciente alcance una adecuada alostasis hemodinámica. Esto requiere monitorizar signos de perfusión tisular en cada órgano. Las variables hemodinámicas como frecuencia cardiaca, presión arterial, llenado capilar y sus tendencias, sumadas a gasometría sanguínea, sirven para rastrear el tratamiento instaurado y evaluar complicaciones agudas que requieran de manejo inmediato. En la Figura 1 se detalla el abordaje sugerido de pacientes con CC en urgencias pediátricas.
Volumen 23 Número 1 Precop SCP 25
Daniel Mainero M., Mónica P. Gutiérrez G., Otto M. González P.
Figura 1. Abordaje de pacientes con cardiopatía congénita desde el servicio de urgencias.
Sospecha de cardiopatía congénita
Clínica inespecífica:
- Rechazo de las tomas
- Falla del medro
- Dificultad respiratoria
- Dolor torácico
- Palpitaciones
- Síncope
Preguntas a los padres:
- ¿Qué tipo de cardiopatía tiene su hijo/a?
- ¿Ha tenido cirugías previas?
- ¿Tiene una saturación de oxígeno de base?
- ¿Qué tratamiento farmacológico viene recibiendo?
¿Tiene alteración del estado de conciencia?
Tiene inestabilidad hemodinámica?
¿Tiene dificultad respiratoria?
¿Tiene disminución de la diuresis?
Evalúe:
- Saturación preductal y postductal
- Radiografía de tórax
- Electrocardiograma
- Marcadores cardíacos
Sí Sí No
No
Hallazgos positivos: clasifique la cardiopatía
Tomar ecocardiograma
Elaboración propia de los autores.
Hallazgos negativos: descarte diagnósticos diferenciales
La terapia farmacológica específica juega un papel fundamental en el manejo de neonatos críticamente enfermos con lesiones obstructivas derechas (hipoxemia) o izquierdas (bajo gasto). La administración inmediata de prostaglandina E1 (PGE1) es necesaria cuando se sospecha una cardiopatía dependiente del conducto en neonatos con cianosis aguda o hipoperfusión sistémica grave. Se sugiere iniciar una infusión de PGE1 a dosis de 0,05 a 0,1 μg/kg/min y ajustarla gradualmente hasta alcanzar la dosis mínima efectiva para mantener un estado
Sospecha de choque cardiogénico
Hospitalizar Estabilice Valoración por cardiología
hemodinámico adecuado, que puede reducirse a infusiones tan bajas como de 0,015 μg/kg/min. Esta estrategia busca minimizar los principales efectos secundarios dependientes de las dosis, como hipotensión y depresión respiratoria.
CRISIS DE HIPOXIA EN TETRALOGÍA DE FALLOT
La tetralogía de Fallot es una cardiopatía congénita que puede provocar crisis de hipoxia,
Volumen 23 Número 1 Precop SCP 26
Enfoque integral del paciente con cardiopatía congénita en urgencias pediátricas: estrategias y consideraciones
TT
caracterizadas por una disminución aguda en los niveles de oxígeno en sangre secundaria a un espasmo y cierre del infundíbulo. El tratamiento se dirige a mantener niveles adecuados de oxígeno (75% a 85%), mejorando la función cardiaca por medio de mantener una adecuada resistencia vascular sistémica y conseguir la relajación del tracto de salida del ventrículo derecho con mínima depresión miocárdica. La crisis hipóxica es más frecuente en pacientes entre 2 y 4 meses. En situaciones graves refractarias al manejo médico inicial, la cirugía de corrección de la tetralogía de Fallot puede ser necesaria para abordar la causa subyacente de la hipoxia. En la Figura 2 se describe el abordaje sugerido de las crisis hipóxicas en el servicio de urgencias.
CRISIS DE HIPERTENSIÓN PULMONAR
El abordaje de las crisis de hipertensión pulmonar en niños con CC, especialmente en aquellos diagnosticados con el síndrome de Eisenmenger, se fundamenta mayormente en experiencias clínicas debido a la escasez de estudios diseñados específicamente para este grupo de pacientes. En estas situaciones, caracterizadas por una elevada resistencia vascular pulmonar, es esencial que la resistencia vascular sistémica supere a la pulmonar para asegurar un adecuado flujo sanguíneo a través de los pulmones. La disminución súbita de la resistencia vascular sistémica puede provocar un incremento en el cortocircuito
Figura 2. Manejo de crisis hipóxicas en urgencias pediátricas.
Coloque en posición genupectoral
Inicie oxígeno al 100%
Administración de volumen
SSN 0,9% o lactato de Ringer 5-10 mL/kg
Corregir acidosis Paciente con crisis de hipoxia
Bicarbonato de sodio 1-2 mEq/kg
Sedación Vasoconstrictores
Morfina 0,1-0,2 mg/kg o ketamina 0,5-1 mg/kg
Fenilefrina 5-20 mcg/kg o noradrenalina 0,10,5 mcg/kg/min
Ventilación mecánica invasiva ECMO
Intubación orotraqueal
Bloqueadores β
Propanolol
Oral: 0,01-0,15 mg/ kg/dosis IV 0,5-0-1 mg/kg/ dosis
Si la crisis de hipoxia no mejora, avanzar en el diagrama
Intervención quirúrgica
Cateterismo
Cirugía paliativa/ reparadora
ECMO: oxigenación por membrana extracorpórea; SSN: solución salina normal. Elaboración propia de los autores.
Volumen 23 Número 1 Precop SCP 27
Daniel Mainero M., Mónica P. Gutiérrez G., Otto M. González P.
venoarterial, con el consiguiente riesgo de hipoxemia fatal.
En el manejo terapéutico de la hipertensión pulmonar, se emplean diversas estrategias para abordar eficazmente la condición. La administración de oxígeno suplementario es una de las primeras medidas a considerar, aunque su dosificación debe ser precisa. En casos de hiperflujo pulmonar asociado a hipertensión, niveles elevados de oxigenación pueden desencadenar edema pulmonar, mientras que una oxigenación insuficiente puede conducir a vasoconstricción y aumento de las presiones pulmonares. Es fundamental, por tanto, ajustar la dosis de oxígeno de manera cuidadosa para optimizar el balance entre oxigenación adecuada y prevención de complicaciones.
Además, se debe tener precaución con el uso de diuréticos durante la fase crítica, ya que estos pueden comprometer la adecuada hidratación del paciente. En su lugar, se puede optar por garantizar una adecuada hidratación mediante la administración de bolos de cristaloides, lo que contribuirá a mejorar el gasto cardiaco y
LECTURAS RECOMENDADAS
1. Luca AC, P ă dure IA. Emergency Management In Suspected Congenital Heart Disease. SEA - Practical Application of Science. 2022;10 (29):109-112.
2. Bouma BJ, Mulder BJM. Changing Landscape of Congenital Heart Disease. Circ Res. 2017;120(6):908-22.
3. Edelson JB, Rossano JW, Griffis H, Dai D, Faerber J, Ravishankar C, et al. Emergency Department Visits by Children With Congenital Heart Disease. J Am Coll Cardiol. 2018;72(15):1817–25.
4. Ilyas S, Rehman Y, Hussain I, Khan A, Ahmed T, Akbar A. Emergency Department Presentation and Outcome of Children With Cyanotic Congenital Heart Diseases. Cureus. 2021;13(9): e17960.
a mantener la estabilidad hemodinámica. En ciertos casos, se pueden emplear vasopresores como la vasopresina para revertir el cortocircuito y mejorar la perfusión tisular.
La intubación orotraqueal, la sedación profunda, el uso de vasodilatadores pulmonares como el óxido nítrico inhalado, la milrinona y el sildenafilo intravenoso son la opción en pacientes con choque cardiogénico o hipoxemia grave. En algunos casos debe considerarse la oxigenación por membrana extracorpórea (ECMO).
CONCLUSIÓN
El manejo de niños con CC en el servicio de urgencias requiere un enfoque multidisciplinario y una evaluación cuidadosa de cada paciente. La implementación de preguntas dirigidas, junto con un conocimiento de la fisiopatología de cada grupo de cardiopatías y las opciones terapéuticas disponibles, es importante para proporcionar una atención médica adecuada y mejorar los resultados clínicos en esta población.
5. Kabbani N, Kabbani MS, Al Taweel H. Cardiac emergencies in neonates and young infants. Avicenna J Med. 2017;7(1):1-6.
6. Lee YS, Baek JS, Kwon BS, Kim GB, Bae EJ, Noh C Il, et al. Pediatric Emergency Room Presentation of Congenital Heart Disease. Korean Circ J. 2010;40(1):36–41.
7. Marianeschi SM, Albano G, Viola N, Barenghi A, Gusella A. Mission Bambini and the “Children’s Heart Program”: The Challenge of Congenital Heart Disease Among Emergency and Education. Front Pediatr. 2022:9:705607.
8. Singh Y. Evaluation of a child with suspected congenital heart disease. Paediatr Child Health. 2018;28(12):556–61.
paciente
cardiopatía
urgencias pediátricas: estrategias y consideraciones Volumen 23 Número 1 Precop SCP 28
Enfoque integral del
con
congénita en
9. Strobel AM, Lu le N. The Critically Ill Infant with Congenital Heart Disease. Emerg Med Clin North Am. 2015;33(3):501-18.
10. Tibbles CD, Bouton M, Lucas JM, Harper M, Horwitz C, Fisher J. Emergency department management of pediatric patients with cyanotic heart disease and fever. J Emerg Med. 2013;44(3):599-604.
Volumen 23 Número 1 Precop SCP 29
Daniel Mainero M., Mónica P. Gutiérrez G., Otto M. González P.
Inmersión en pediatría
Paola Andrea Manjarrés Figueredo, MD1
Camila Meza Bertel, MD2
Jairo De Jesús Jiménez Rodelo, MD3
Sady David Roa Valdelamar, MD4
INTRODUCCIÓN
Las lesiones no intencionales (LNI) representan un problema importante para la salud pública a nivel mundial. La Organización Mundial de la Salud (OMS) estima que globalmente mueren 100 niños cada hora a causa de lesiones/traumas, de los cuales el 90 % son no intencionales. Se define como accidente a toda lesión no intencional que puede provocar daños físicos o psíquicos y que ocurre de forma repentina, con un antecedente de factores previos que aumentan el riesgo de presentación. Este tipo de lesiones representan una importante causa de morbimortalidad, sobre todo en la población pediátrica, en la cual las consecuencias son generalmente más graves.
Por una parte, el paciente pediátrico reacciona a este tipo de eventos distinto al adulto debido a sus condiciones anatómicas, inmadurez cognitiva, falta de experiencia, imprudencia propia de la infancia y espíritu explorador y temerario. Por otro lado, la frecuencia de presentación
1. Residente de Pediatría, Universidad de Cartagena.
2. Residente de Pediatría, Universidad de Cartagena.
3. Médico General, Universidad de Cartagena.
4. Pediatra, Universidad de Cartagena.
y gravedad de las LNI varía geográficamente, con evidencia de que la pobreza y un bajo nivel socioeconómico aumentan su prevalencia e incidencia.
El ahogamiento o inmersión representa la segunda causa de muerte por accidentes no intencionales, razón por la que es importante para la comunidad médica tener un consenso y actualización de los componentes claves para el manejo de estos pacientes, con el fin de disminuir su morbimortalidad.
EPIDEMIOLOGÍA
Las inmersiones son una causa significativa de muerte por lesiones no intencionales en niños y jóvenes a nivel mundial. Se estima que ocurren alrededor de 500.000 muertes por ahogamiento cada año, y los menores de cinco años son especialmente vulnerables, pues representan el 40 % de estas muertes. En los Estados Unidos, el ahogamiento es la segunda causa principal
Volumen 23 Número 1 Precop SCP 30
de muerte por accidentes no intencionados en niños de 1 a 14 años. En España, la incidencia se sitúa en alrededor de 1,5 casos por cada 100 000 habitantes al año. El riesgo de ahogamiento varía según la edad, el sexo y el entorno, y los menores de 4 años y los adolescentes de 15 a 19 años son los grupos más afectados.
FACTORES DE RIESGO
Ciertas poblaciones, debido a comportamientos, habilidades, entorno o condiciones médicas subyacentes, tienen un mayor riesgo de ahogamiento. La edad se considera uno de los principales factores de riesgo, especialmente para los niños pequeños de 0 a 4 años de edad. El problema principal para este grupo etario es la falta de barreras para prevenir el acceso no supervisado e imprevisto al agua, como piscinas, jacuzzis , spas , bañeras, cuerpos de agua naturales y agua estancada en los hogares. Otro grupo de edad con una alta tasa de ahogamiento es el de los adolescentes de 15 a 17 años. El principal factor de riesgo en estos es la sobreestimación de habilidades, la subestimación de situaciones peligrosas, la participación en comportamientos de alto riesgo e impulsivos, y el consumo de sustancias como el alcohol, que se considera el factor de riesgo principal en esta edad y genera del 30 % a 70 % de las muertes por ahogamiento en aguas recreativas entre adolescentes. Las condiciones médicas subyacentes, como la epilepsia, el autismo y las arritmias cardiacas, también se asocian con episodios de ahogamiento.
Por su parte, se ha logrado identificar que existen disparidades significativas en las tasas de ahogamiento entre niños de diferentes razas y niveles socioeconómicos: los niños afroamericanos y de baja condición socioeconómica sufren más accidentes por inmersión. Algunos grupos culturales, religiosos y étnicos pueden tener creencias y tradiciones que limiten la participación en actividades acuáticas.
Es fundamental considerar estos factores al desarrollar estrategias de prevención del ahogamiento en la población pediátrica. Además, se deben abordar desafíos como la falta de acceso a lecciones de natación y la disminución del financiamiento para piscinas y programas de natación, ya que estos factores contribuyen a las disparidades en las tasas de ahogamiento.
DEFINICIONES
El término ahogamiento fue debatido en el primer Congreso Mundial de Ahogamiento, celebrado en Ámsterdam en 2002, y se definió como el “proceso de sufrir insuficiencia respiratoria tras un episodio de sumersión o inmersión en un medio líquido”. Es un proceso que es continuo, en el cual se desencadenan múltiples mecanismos reflejos y cambios fisiopatológicos secundarios al paso de agua a la vía aérea y al laringoespasmo, que al final llevarán a hipercapnia, hipoxemia y, si se prolonga, a muerte por hipoxia tisular. Los ahogamientos deben clasificarse como fatales o no fatales y eventualmente se debería describir el desenlace del paciente como muerte, morbilidad o ausencia de morbilidad.
Anteriormente existían términos médicos como casi ahogamiento, ahogamiento seco, ahogamiento húmedo y ahogamiento tardío/secundario, los cuales han entrado en desuso y han sido abolidos con el fin de evitar confusiones en el manejo.
• Casi ahogamiento: cuando el paciente sobrevive a la inmersión, al menos de forma temporal.
• Ahogamiento húmedo: el agua es aspirada a los pulmones. Hallazgo en el 80 %-90 % de las necropsias.
• Ahogamiento seco: sin hallazgo importante de líquido en los pulmones, es atribuido al laringoespasmo hasta que acontece la muerte por anoxia. Hallazgo en el 10 %-20 % de las necropsias.
Volumen 23 Número 1 Precop SCP 31
Paola Andrea Manjarrés Figueredo, Camila Meza Bertel, Jairo De Jesús Jiménez Rodelo, Sady David Roa Valdelamar
• Ahogamiento secundario: la víctima, recuperada inicialmente, debuta con insuficiencia respiratoria aguda grave 24 horas después.
Los síntomas respiratorios producidos tras un episodio de ahogamiento son inmediatos en la gran mayoría de los episodios, y todo aquel síntoma que aparezca 8 horas después en un paciente previamente estable y sin dificultad respiratoria deben atribuirse a otra causa, como neumotórax espontáneo, neumonitis química, neumonía (vírica o bacteriana) o traumatismos (torácico o craneoencefálico).
PATOGENIA Y FISIOPATOLOGÍA
Al caer en el agua, las víctimas de ahogamiento tienen una prioridad como medida de supervivencia: mantener la respiración a toda costa, lo que puede limitar su capacidad de pedir ayuda. El adulto, en su esfuerzo por respirar, tiene una respuesta instintiva dada por la extensión de los miembros superiores e inferiores para impulsarse y mantener la cabeza fuera del agua. Sin embargo, en los niños, sus extremidades son más cortas y tienen menos fuerza, por lo que el movimiento y agitación van a ser mínimos y poco visibles para los cuidadores.
A medida que la víctima se sofoca, la agitación va cediendo mientras el sujeto aspira y traga pequeñas cantidades de agua, lo cual se asocia a tos y a laringoespasmo. Durante la aspiración del líquido, va ocurriendo consumo de surfactante y aumento de la permeabilidad capilar pulmonar, con una eventual alteración en la ventilación/perfusión, que desencadena hipercapnia e hipoxemia progresiva; así como también hay colapso de las unidades alveolares y atelectasia, lo cual empeora la dificultad respiratoria. Los reflejos protectores de la vía aérea fallan y el agua penetra de forma pasiva a los pulmones, lo que empeora la hipoxia y lleva a la parada cardiorrespiratoria.
La hipoxia y la hipercapnia van a llevar a un estado de acidosis grave, lo que se asocia a disminución de la contractilidad miocárdica, aumento de las resistencias vasculares pulmonares, arritmias, insuficiencia renal aguda como consecuencia de la hipotensión, hipoxia y rabdomiólisis que puede aparecer debido a la destrucción muscular por el esfuerzo físico durante el accidente, de modo que se produce una necrosis tubular aguda secundaria. Además, pueden ocurrir grados variables de compromiso neurológico y edema cerebral.
Inmediatamente después del accidente, los pacientes pediátricos suelen presentar hipotermia (temperatura central menor de 35 ºC) debido a que las pérdidas de calor en el agua son más elevadas que en el aire; además, los niños tienen una superficie corporal mayor y una capa delgada de tejido celular subcutáneo. Hay evidencia sólida de que la hipotermia tiene un efecto neuroprotector con datos contundentes para el manejo de la asfixia perinatal; sin embargo, en cuanto al paciente ahogado aún existen controversias. En este tipo de pacientes se ha mencionado protección contra la lesión cerebral cuando la temperatura corporal es de 25 ºC, pero la principal desventaja es que, para conseguir la hipotermia, la temperatura del agua debe ser inferior a 5 ºC, valores que son difíciles de alcanzar.
Tradicionalmente se creía que las alteraciones hemodinámicas y electrolíticas entre los pacientes que sufrían episodios de ahogamiento en agua dulce y salada eran diferentes; sin embargo, actualmente se conoce que las diferencias entre el ahogamiento en agua dulce y en agua salada son más teóricas que reales. Bioquímicamente, el agua dulce (piscinas, ríos, lagos), al ser hipotónica, produce en el alveolo un paso de agua a través de la membrana alveolocapilar, lo que lleva a hipervolemia, hemodilución, hemólisis intravascular, hiperpotasemia y muerte por fibrilación ventricular, mientras que el
Inmersión en pediatría Volumen 23 Número 1 Precop SCP 32
ahogamiento en agua salada (mar) genera paso de líquido del espacio intravascular al alveolo, lo que genera hipovolemia, hemoconcentración, hipercalcemia, hipernatremia, hipermagnesemia y muerte por edema pulmonar. A pesar de lo anterior, no hay diferencias clínicas sustanciales en el daño pulmonar resultante en el ahogamiento por agua dulce o salada, ya que existe evidencia que demuestra que, para generar diferencias significativas, la ingesta de agua debe ser mínimo de 11 mL/kg, cuando el promedio es de 3-4 mL/kg.
MANIFESTACIONES CLÍNICAS
Predominan las manifestaciones pulmonares, neurológicas y cardiovasculares, que varían según la gravedad del evento. A nivel pulmonar, la disfunción en la relación ventilación/perfusión secundaria al consumo de surfactante lleva a broncoespasmo, atelectasias, neumonitis química o infecciosa y edema pulmonar hasta llegar al síndrome de dificultad respiratoria aguda.
La inestabilidad cardiovascular que se produce en la escena puede ser consecuencia de la hipoxia o de la disminución de la temperatura corporal por inmersión prolongada; ambas llevan a vasoconstricción periférica intensa con posterior disminución del gasto cardiaco, lo que se manifiesta como hipotensión. Las alteraciones del ritmo cardiaco también son frecuentes; las principales son las arritmias supraventriculares tipo focos ectópicos auriculares, fibrilación y aleteo auricular. En estados de hipotermia, la arritmia típica de inmersión se presenta como taquicardia que evoluciona a bradicardia, actividad eléctrica sin pulso y asistolia.
El grado de lesión hipóxico-isquémica es el principal determinante de las manifestaciones a nivel del sistema nervioso central, el cual a su vez depende del tiempo de inmersión. Las variaciones en el estado de conciencia pueden ir desde un estado de alerta completo con un
Glasgow conservado, pasando por el estado de estupor hasta el estado comatoso con posturas anormales de descerebración. Solo el 10 % de los supervivientes presentará daño cerebral irreversible, el cual suele producirse a los 4-6 minutos de inmersión.
Las principales complicaciones se enumeran en la Tabla 1
EVALUACIÓN
El rescate y reanimación inmediatos mejoran los resultados de las víctimas de ahogamiento; por tanto, la necesidad de reanimación cardiopulmonar (RCP) debe ser reconocida e iniciada lo antes posible, sin comprometer la seguridad de los rescatistas ni retrasar el desplazamiento de la víctima fuera del agua. Al reconocer la necesidad de RCP, se debe iniciar de manera convencional con respiraciones lo más pronto posible debido a que la causa más frecuente de paro cardiaco en víctimas de ahogamiento es la hipoxemia. Antes de iniciar las compresiones, se debe descartar de forma adecuada la ausencia de pulso, ya que por la hipotermia es frecuente la bradicardia sinusal y la fibrilación auricular, y de requerir la utilización del desfibrilador externo automático (DEA) se debe secar muy bien el cuerpo de la víctima antes de la colocación de las almohadillas. Se debe garantizar la oxigenación utilizando sistemas de alto flujo inicialmente, y se titula según la saturación de oxígeno una vez se disponga del recurso, y en pacientes con apnea o incapacidad para proteger su vía aérea se debe realizar intubación orotraqueal idealmente o utilizar un sistema de ventilación con bolsa-mascarilla en la atención temprana hasta el traslado a un centro hospitalario.
En pacientes con respiración espontánea o circulación espontánea luego de RCP, una vez que ingresan a un centro hospitalario se deben adoptar medidas generales y tratar de identificar
Volumen 23 Número 1 Precop SCP 33
Paola Andrea Manjarrés Figueredo, Camila Meza Bertel, Jairo De Jesús Jiménez Rodelo, Sady David Roa Valdelamar
Tipo
Del sistema nervioso central
Pulmonares
Renal y metabólico
Infecciosas y hematológicas
Tabla elaborada por los autores.
Tabla 1. Complicaciones
Complicaciones
- Lesión hipóxico-isquémica del cerebro
- Edema cerebral
- Hipertensión intracraneal
- Hipoxemia
- Edema pulmonar no cardiogénico
- Síndrome de dificultad respiratoria aguda
- Neumonía
- Neumonitis química por aspiración del contenido gástrico
- Acidosis metabólica
- Insuficiencia renal
- Hipotermia
- Síndrome de respuesta inflamatoria sistémica
- Sepsis
- Hemólisis
- Coagulación intravascular diseminada
lesiones específicas de órganos mediante pruebas diagnósticas de imagen y de laboratorio. Estas medidas incluyen el restablecimiento de la temperatura corporal mediante mantas térmicas y la monitorización continua de constantes vitales. No es necesaria la inmovilización cervical a menos que el mecanismo o lesiones encontradas lo sugieran; por ejemplo, zambullirse en aguas poco profundas, hematomas o lesiones en cabeza y cuello, entre otras.
Las pruebas diagnósticas a realizar incluyen radiografía de tórax, gasometría arterial, electrocardiograma y enzimas cardiacas en caso presentar alteraciones electrocardiográficas o compromiso hemodinámico (arritmias, hipotensión, entre otras), hemograma, función renal y hepática, tiempos de coagulación, glucosa en sangre y tomografía de cráneo en aquellos con compromiso neurológico persistente. La
realización de otros estudios será guiada por las lesiones específicas para cada uno de los casos.
TRATAMIENTO
La hipoxemia es el principal objetivo de tratamiento en pacientes con ahogamiento no fatal, es probable que se produzca lesión pulmonar o edema pulmonar; reversible en la mayoría de los casos, que amerite apoyo en la ventilación y oxigenación del paciente. Inicialmente se puede suministrar oxígeno mediante cánulas nasales y máscaras faciales si se logran mantener saturaciones normales. En caso de hipoxemia persistente o signos de insuficiencia respiratoria, se puede recurrir a ventilación no invasiva con presión positiva continua en la vía aérea (CPAP) o presión positiva en la vía respiratoria de dos niveles
Inmersión en pediatría Volumen 23 Número 1 Precop SCP 34
(BiPAP) que permiten mejorar la oxigenación y la relación ventilación/perfusión.
La ventilación mecánica no invasiva es una herramienta muy útil para revertir la hipoxemia en este tipo de pacientes; sin embargo, pueden aumentar la presión intratorácica, lo que disminuye el retorno venoso con aparición de hipotensión, por lo que se debe monitorizar la presión arterial de manera continua. Además, predispone a náuseas y vómitos, lo que podría facilitar la broncoaspiración, por lo que el vaciamiento gástrico mediante una sonda podría ser útil.
En caso de no obtener respuesta a la terapia no invasiva, se hace necesaria la intubación traqueal, cuyas indicaciones incluyen deterioro neurológico con incapacidad de proteger la vía aérea, incapacidad para mantener la presión arterial de oxígeno (PaO2) > 60 mm Hg o saturación de oxígeno (SatO2) > 90 % o > 94 % si se encuentra a nivel del mar a pesar de un sistema de alto flujo o ventilación mecánica no invasiva, o evidencia de insuficiencia respiratoria con acidosis respiratoria a pesar de tener ventilación mecánica no invasiva. La evidencia sugiere que los pacientes con ventilación invasiva podrían beneficiarse de estrategias ventilatorias de protección pulmonar, que incluyen presión positiva al final de la espiración (PEEP), volumen corriente bajo (5-6 mL/kg/peso ideal) y evitar la hipercapnia, sobre todo en pacientes con sospecha de daño cerebral hipóxico/isquémico. En pacientes con síndrome de dificultad respiratoria aguda grave (SDRA) con hipoxemia persistente a pesar de las estrategias previamente indicadas, se hace necesario el inicio de oxigenación por membrana extracorpórea venovenosa (ECMO).
Otro de los objetivos del tratamiento hospitalario radica en la prevención de lesión neurológica hipóxico-isquémica producto de la hipoxemia, edema cerebral, desequilibrio hidroelectrolítico, acidosis y actividad convulsiva. Se debe
favorecer la cabecera a 30° una vez descartada la lesión cervical o de médula espinal. Se debe garantizar normovolemia y normoglicemia, y evitar que se produzca hipertermia durante el recalentamiento del paciente. La actividad convulsiva aumenta el consumo de oxígeno y el flujo sanguíneo cerebral, lo que eleva el riesgo de lesiones hipóxico-isquémicas, y aunque el uso de anticonvulsivante (anticrisis) profiláctico no se encuentra indicado de rutina, su uso no debería retrasarse una vez se presente una convulsión. Se prefieren anticonvulsivantes (anticrisis) no sedantes, como la fenitoína, para no interferir en la evaluación neurológica. En caso de aumento de la presión intracraneal, se indicará solución salina hipertónica o manitol.
Se debe evitar la hipotensión debido a que repercute sobre la presión de perfusión cerebral y, por tanto, aumenta el riesgo de lesiones hipóxico-isquémicas cerebrales. Se prefieren líquidos cristaloides y, en caso de hipotensión refractaria o daño miocárdico, se promueve el inicio de vasopresores, como adrenalina o noradrenalina. Los trastornos electrolíticos derivados de la sumersión no son habituales, independientemente de la salinidad del cuerpo de agua, aunque si se presentan, deben ser corregidos de manera oportuna. Por otro lado, la hipervolemia es infrecuente; en consecuencia, el uso de diuréticos no está indicado rutinariamente porque podría favorecer la depleción de volumen, disminución del gasto cardiaco y de la perfusión cerebral.
Para el manejo del broncoespasmo se utilizan los agonistas adrenérgicos β inhalados. Los antibióticos profilácticos no están indicados de rutina, pero podrían ser considerados en pacientes con sumersión en aguas contaminadas; por ejemplo, en aguas residuales. Los antibióticos deben reservarse para casos de infección pulmonar clínica, en los que se identifica fiebre, leucocitosis y neutrofilia, elevación de reactantes de fase aguda o aparición de infiltrados nuevos en la radiografía de tórax luego de 48-72 horas de
Volumen 23 Número 1 Precop SCP 35
Paola Andrea Manjarrés Figueredo, Camila Meza Bertel, Jairo De Jesús Jiménez Rodelo, Sady David Roa Valdelamar
ocurrido el ahogamiento no fatal, y siempre se deben sospechar de patógenos transmitidos por agua, como Pseudomonas, Aeromonas y Proteus
El uso de otras terapias, como corticoides, surfactante pulmonar y barbitúricos, no cuentan con evidencia científica que avale su uso cotidiano.
PRONÓSTICO
La duración de la inmersión es el factor más determinante en el pronóstico del paciente; las tasas de muerte o lesiones neurológicas graves son inferiores al 10 % en pacientes cuya sumersión es inferior a 5 minutos. Los factores determinantes en el pronóstico del paciente con sumersión se encuentran descritos en la Tabla 2 . En la actualidad no existen escalas ni pruebas a realizar que permitan predecir de forma temprana el daño neurológico grave, por lo que su reconocimiento será establecido en el seguimiento con el tiempo.
Tabla 2. Determinantes de mal pronóstico neurológico en paciente con sumersión
Duración de la inmersión > 5 minutos
Tiempo de inicio de soporte vital > 10 minutos
Duración de la reanimación > 25 minutos
Edad > 14 años
Escala de Glasgow < 5
Apnea persistente o necesidad de reanimación en el servicio de urgencias
pH arterial < 7,1 al ingreso hospitalario
Tabla elaborada por los autores.
PREVENCIÓN
La prevención del ahogamiento en niños requiere un enfoque integral y no existe un único método eficaz para prevenir todos los casos de ahogamiento. La primera estrategia
de prevención es la supervisión adulta cercana, constante, atenta y capaz cuando los niños están en o cerca del agua, un adulto responsable debe estar designado como “vigilante del agua” y mantenerse al alcance de cada niño. Debe evitarse cualquier distracción, como hablar, usar redes sociales o consumir alcohol. Incluso en presencia de socorristas, su papel no reemplaza la supervisión constante de un adulto.
El uso de chalecos salvavidas es recomendado para prevenir el ahogamiento. Se aconseja a los padres que animen a los niños menores de 4 años a usar chalecos salvavidas cerca del agua. Es importante tener en cuenta que los dispositivos inflables, como los manguitos, no reemplazan a los chalecos salvavidas y no están diseñados para garantizar la seguridad en el agua. En este mismo grupo de edad, las lecciones de natación basadas en la competencia acuática, que incluyen conocimientos y actitudes sobre seguridad en el agua, junto con habilidades básicas de natación, son importantes para continuar la cadena de prevención sin aumentar el riesgo.
La instalación de cercas de aislamiento de 4 lados es el método más efectivo para prevenir el ahogamiento en piscinas residenciales y puede reducir las muertes por ahogamiento en el grupo de edad más joven en un 50 %. Las rejillas de drenaje y las cubiertas de piscinas representan un riesgo importante para los nadadores jóvenes. A pesar de las regulaciones que exigen el uso de cubiertas de drenaje en piscinas públicas, los entornos residenciales no tienen esta misma obligación. Algunos tipos de cubiertas de piscinas, como las cubiertas solares de plástico delgado, pueden aumentar el riesgo de ahogamiento y no deben utilizarse como protección.
La RCP realizada por testigos en el lugar del ahogamiento es crucial para mejorar la supervivencia y los resultados. Los padres y propietarios de piscinas deben estar capacitados en RCP y tener equipos de rescate, como boyas y herramientas de alcance, cerca de la piscina.
Inmersión en pediatría Volumen 23 Número 1 Precop SCP 36
Además, los niños mayores y adolescentes también deben recibir capacitación en RCP.
CONCLUSIONES
Los accidentes por inmersión en el paciente pediátrico son el fruto de una cadena de eventos catastróficos que inician con una falla en las estrategias de prevención para padres y cuidadores. La importancia de este problema es visible a través de las estadísticas, no solo de mortalidad sino de morbilidad, así como en los costos en atención médica, el ausentismo escolar y el tiempo laboral perdido de los
LECTURAS RECOMENDADAS
1. Alpïzar NJ, Mora AMC, Aldama OMM, et al. Unintentional injuries in children under eighteen years of age. Rev Cubana Med Gen Integr. 2021;37(1):1-11.
2. Bustos Córdova E, Cabrales Martínez RG, Cerón Rodríguez M, Naranjo López MY. Epidemiología de lesiones no intencionales en niños: revisión de estadísticas internacionales y nacionales. Bol Med Hosp Infant Mex. 2014;71(2):68-75.
3. de Pont AC, de Jager CP, van den Bergh WM, Schultz MJ. Recovery from near drowning and postanoxic status epilepticus with controlled hypothermia. Neth J Med. 2011;69(4):196-7.
4. Dow J, Giesbrecht GG, Danzl DF, Brugger H, Sagalyn EB, Walpoth B, et al. Wilderness Medical Society Clinical Practice Guidelines for the Out-of-Hospital Evaluation and Treatment of Accidental Hypothermia: 2019 Update. Wilderness Environ Med. 2019;30(4S):S47-S69.
5. López Y, Pons M. Ahogamiento. An Pediatr Contin. 2008; 6(2):85-92.
6. McCallin TE, Morgan M, Hart MLI, Yusuf S. Epidemiology, prevention, and sequelae of drowning. Pediatr Rev. 2021;42(3):123–30.
padres. La prevención del ahogamiento en niños implica la supervisión adecuada, lecciones de natación, capacitación en RCP, uso de chalecos salvavidas y la protección de drenajes y cubiertas de piscinas. Estas medidas combinadas pueden ayudar a reducir los casos de ahogamiento y proteger la vida de los niños.
La atención del paciente en el servicio de urgencias es de vital importancia para disminuir su mortalidad y complicaciones, por lo que es fundamental crear capacitaciones y protocolos de manejo actualizados y basados en la evidencia, que sean de conocimiento y cumplimiento por todo el personal de la institución de salud.
7. Michelet P, Bouzana F, Charmensat O, Tiger F, DurandGasselin J, Hraiech S, et al. Acute respiratory failure after drowning: a retrospective multicenter survey. Eur J Emerg Med. 2017;24(4):295-300.
8. Omar HR, Sprenker C, Bosco G, Mangar D, Camporesi EM. Causes of ischemic electrocardiographic changes in near drowning: A literature review. J Crit Care. 2015;30(5):1121-3.
9. Pons Morales S. Lesiones por inmersión. Protoc Diagn TerPpediatr. 2020;1:289-98.
10. Reynolds JC, Hartley T, Michiels EA, Quan L. LongTerm Survival After Drowning-Related Cardiac Arrest. J Emerg Med. 2019;57(2):129-139.
11. Ryan KM, Bui MD, Dugas JN, Zvonar I, Tobin JM. Impact of prehospital airway interventions on outcome in cardiac arrest following drowning: A study from the CARES Surveillance Group. Resuscitation. 2021; 163:130-135.
12. van Beeck E, Branche C. Definition of Drowning: A Progress Report. En: Bierens JJLM. Drowning. Berlín: Springer; 2014. p. 85-89.
Volumen 23 Número 1 Precop SCP 37
Paola Andrea Manjarrés Figueredo, Camila Meza Bertel, Jairo De Jesús Jiménez Rodelo, Sady David Roa Valdelamar
Síndrome antifosfolipídico en pediatría, más que trombosis
Camilo Andrés Vargas Rincón, MD1
Cindy Daiana Marmolejo Posso, MD2
Guiselle Alexandra Cristancho Olaya, MD3
INTRODUCCIÓN
El síndrome antifosfolipídico pediátrico (SAFp) es la principal causa de trombofilia adquirida. Es una enfermedad autoinmune, sistémica y tromboinflamatoria, caracterizada por la presencia de eventos trombóticos arteriales o venosos y morbilidad en el embarazo, en presencia de anticuerpos antifosfolipídicos circulantes. El SAF puede ser primario en ausencia de otra enfermedad autoinmune o secundario cuando está presente con otra autoinmunidad, y el lupus eritematoso sistémico juvenil (LESj) es la enfermedad más frecuentemente asociada. Es una condición poco frecuente en pediatría, pero con una importante morbimortalidad. Se estima que el 2,8 % de los casos de SAF ocurren antes de los 15 años. El registro internacional Ped-APS, que describió a 121 pacientes, reportó un promedio de edad de debut de 10,7 años y
el diagnóstico se realizó en promedio a los 12,5 años. Los casos de SAF primario representan del 38 %-50 % de los casos, y los secundarios, asociados en su mayoría con LESj, del 58 %69 %, y la población asiática es la de mayor asociación con lupus. Los pacientes con SAF primario tienen menor edad de debut, mayor frecuencia de trombosis arterial cerebral y más manifestaciones hematológicas que los casos secundarios.
Hasta un 12 % de los pacientes tienen historia familiar de enfermedades autoinmunes y la poliautoinmunidad es más frecuente en pacientes femeninas. Durante el seguimiento, los pacientes con SAF primario pueden evolucionar a LESj hasta en un 30 %. A pesar del riesgo conocido de trombosis en pacientes con malignidades, el SAF asociado con malignidades en pediatría es raro, menor del 1 %
1. Pediatra reumatólogo, Universidad El Bosque. Profesor Universidad del Valle, Departamento de pediatría. Presidente, Sociedad Colombiana de Pediatría, Regional Valle del Cauca, 2022-2024. Miembro de la Asociación Colombiana de reumatología y Sociedad Europea de Reumatología Pediátrica.
2. Médico y cirujano, Universidad Libre de Cali. Residente de Pediatría, Universidad del Valle.
3. Médica y cirujano, Universidad del Tolima. Residente de Pediatría, Universidad del Valle.
Volumen 23 Número 1 Precop SCP 38
de los casos reportados. Los casos de SAF catastrófico (SAFC) se presentan en un 0,9 %2,5 % de los pacientes.
Las manifestaciones no trombóticas tienen una frecuencia elevada y cada vez son más reconocidas como claves para un diagnóstico acertado; es así como pacientes pediátricos con debut de citopenias autoinmunes, compromiso pulmonar, cutáneo o neurológico pueden ser puerta de entrada para el diagnóstico definitivo de SAF. En esta revisión de SAFp, revisaremos los principales aspectos de esta importante patología autoinmune, las manifestaciones clínicas trombóticas y no trombóticas, las estrategias diagnósticas y las principales terapias usadas en la actualidad.
FISIOPATOGENIA
La presencia de anticuerpos antifosfolípidos (aFL) persistentemente circulantes, anticardiolipinas (aCL) y anti-β2 glicoproteína I (anti-β2GPI), dirigidos contra proteínas portadoras de fosfolípidos, tienen evidencia de ser patológicos y son marcadores para el diagnóstico y clasificación del SAF. Los anticuerpos claves son los dirigidos contra la β 2GPI, una proteína plasmática abundante compuesta de cinco dominios y una secuencia conformacional localizada en el D1, reconocido como el epítopo inmunodominante por la mayoría de los anti- β 2GPI.
Los modelos en animales indican que procesos patológicos de mímica molecular pueden ser los responsables de la pérdida de tolerancia inmunológica contra la β 2GPI, con una predisposición genética de base. Se ha identificado una firma de interferón (IFN) en estos pacientes, similar a la encontrada en otras enfermedades autoinmunes sistémicas caracterizadas por la producción de autoanticuerpos. También se ha identificado la presencia de β 2GPI en las trampas extracelulares de neutrófilos sumando mecanismos inflamatorios y de daño en órganos y sistemas.
Se reconoce que la sola presencia de los aFL circulantes no son suficientes para el desarrollo de las manifestaciones trombóticas de la enfermedad; es así como se considera que la enfermedad puede ser explicada por exponerse a eventos adicionales o “golpes” (hits). Al presentar cambios de oxidación, la β 2GPI altera su forma conformacional y es capaz de unirse a estructuras cargadas negativamente (p. ej., membranas lipídicas de células estresadas o inflamadas) y los aFL reconocen la β 2GPI unida a tejidos o a estructuras cargadas negativamente, mejor que a la forma libre en suero. Los anti- β 2GPI inducen un estado proadhesivo y procoagulante en el endotelio vascular, y luego hay una activación y reclutamiento de células inflamatorias (p. ej., plaquetas, monocitos y neutrófilos) que amplifican el proceso desencadenante con mayor formación de trombos; de este modo se establece un estado trombofílico (Figura 1).
Los eventos finales de trombosis en SAF tienen la participación de múltiples células, receptores y moléculas inflamatorias. Involucra plaquetas activadas, neutrófilos y monocitos con formación de especies reactivas de oxígeno, liberación de citocinas/quimiocinas y generación de trampas extracelulares a través de la NETosis, donde quedan atrapadas moléculas de trombina y factor tisular. Las células del endotelio son unos jugadores claves para ser lesionados por el sistema de complemento activado.
El mecanismo patológico de los aFL sobre el sistema nervioso central, además de los eventos trombóticos, es mediado por un efecto neuroinflamatorio y neuronal tóxico directo, evidenciado por estudios in vitro, que puede explicar las manifestaciones no trombóticas neurológicas. Avcin y colaboradores encontraron que la positividad del anticoagulante lúpico se asocia con corea.
El estudio de la base genética del SAF ha reportado que los haplotipos HLA DR5 y DRw53 fueron encontrados como factores
Camilo Andrés Vargas Rincón, Cindy Daiana Marmolejo Posso, Guiselle Alexandra Cristancho Olaya Volumen 23 Número 1 Precop SCP 39
Primer “HIT”
Segundo “HIT”
Estado trombofílico
Amplificación
por el
Figura 1. Mecanismos fisiopatológicos en SAF.
Predisposición genética

Firma de IFN Mímica molecular. Modificaciones postranscripcionales
Pérdida de la tolerancia inmune
Inflamación, estrés celular, hipoxia, trauma
Proadhesión y procoagulación endotelial
Activación de monocitos, neutrófilos, plaquetas
predisponentes para la producción de aFL, especialmente anticardiolipinas y anticoagulante lúpico. Estas y otras asociaciones, como el HLA-DPB1*0301 con anti- β 2GPI, soportan la hipótesis que la predisposición para el SAF está influenciada por el HLA.
Los mecanismos fisiopatológicos en SAF obstétrico están directamente relacionados con los mecanismos patogénicos de los aFL sobre
Anti-β2GPI circulante
β2GPI unido a tejidos + anti-β2GPl
P. ej., expresión de factor tisular, activación del complemento
la placenta, lo que afecta la placentación más que el desarrollo de eventos trombóticos locales ( Tabla 1).
MANIFESTACIONES CLÍNICAS
Tradicionalmente, el SAF es reconocido por los eventos trombóticos y la morbilidad en el embarazo, pero la importancia de las
Tabla 1. Mecanismos patogénicos en la placentación por los aFL
β2GPI se une a diferentes receptores de membrana en el trofoblasto y la decidua.
aFL dependientes de β2GPI promueven un perfil antiangiogénesis.
aFL unidos al complejo β2GPI/ApoER2 reducen la proliferación y migración celular.
aFL unidos a β2GPI/TLR estimulan la secreción de citocinas y quimiocinas inflamatorias, y activan vías de inflamasoma.
aFL activan el complemento, lo que contribuye a la activación de neutrófilos y monocitos, con liberación de ROS, TNF, factores antiangiogénicos y factor tisular.
Complejos aFL/β2GPI pueden promover la disrupción mitocondrial, la liberación de agregados nucleares dañinos y otras macrovesículas/exosomas.
aFL: antifosfolípidos; ApoER2: apolipoproteína E receptora 2; ROS: especies reactivas de oxígeno; TLR: receptor tipo Toll; TNF: factor de necrosis tumoral. Modificada de: Raschi E, et al. Rheumatology (Oxford). 2024;63(SI):SI4-SI13.
Síndrome antifosfolipídico en pediatría, más que trombosis Volumen 23 Número 1 Precop SCP 40
Elaborado
Dr. Camilo Andrés Vargas Rincón en BioRender.com.
manifestaciones no trombóticas es cada vez mayor y puede facilitar el diagnóstico de la enfermedad. Los esfuerzos realizados por diferentes investigadores llevaron a la inclusión de una serie de manifestaciones no trombóticas en los criterios de clasificación del 2023. El SAF acompaña otras enfermedades autoinmunes sistémicas, especialmente al lupus eritematoso sistémico, en el que uno de cada tres pacientes tiene SAF asociado, además de un mayor daño de órganos acumulado.
El espectro del SAF es amplio. Algunos pacientes pediátricos pueden ser portadores de los anticuerpos sin desarrollar manifestaciones trombóticas o no trombóticas, algo que puede ser explicado en parte por la ausencia de otros factores de riesgo (segundo golpe o hit), como ateroesclerosis, hipertensión, consumo de cigarrillo, vasculitis, entre otros. La presentación más grave de la enfermedad es el SAFC, definida por el compromiso clínico de al menos tres órganos o sistemas, en un corto periodo con evidencia histopatológica de oclusión de vasos de pequeño calibre en presencia de aFL.
El SAF se puede manifestar desde el periodo neonatal en hijos de madres con aFL debido al paso transplacentario de los anticuerpos patológicos, aumentado el riesgo de eventos trombóticos como trombosis de vasos umbilicales y en el sistema nervioso central, y son frecuentemente asociados con un factor de riesgo adicional, segundo hit , como asfixia, sepsis y catéteres intravasculares. Durante la infancia y adolescencia, la producción de anticuerpos de novo, como expresión de la pérdida de la tolerancia inmune frente a lo propio, es la causante de las manifestaciones trombóticas y no trombóticas del SAF. Factores como infección, inmovilidad o trauma se han identificado hasta en el 23 % de los pacientes con trombosis en presencia de aFL.
El 2,5 % de los casos de SAF corresponde al desarrollo de trombos en múltiples órganos y sistemas, o microtrombos que producen un
evento de SAFC. Las manifestaciones clínicas del SAFC son similares a las de los adultos, y son principalmente el compromiso sobre el riñón, pulmón, cerebro, corazón y piel. El paciente se presenta con insuficiencia renal, hipertensión, posible proteinuria y hematuria, insuficiencia adrenal e insuficiencia cardiorrespiratoria con embolismo pulmonar masivo. El SAFC como debut del SAF es más frecuente en pacientes pediátricos que en adultos (86,6 % frente a 45,2 %).
Manifestaciones trombóticas
Vargas Rincón y colaboradores realizaron un estudio con un grupo de 117 pacientes pediátricos colombianos y españoles con aFL positivo, de los cuales 42 % presentaron al menos un evento trombótico, que fue principalmente venoso (53 %), seguido por arterial (40 %) y cerebrovascular (14 %). El SAFC ocurrió en el 2,5 % de los casos y la recurrencia de trombosis fue del 10 %, similar a la reportada por Ma y colaboradores, que fue del 13 % en población asiática. El sexo masculino fue un factor de riesgo para trombosis. El registro Ped-APS reportó una recurrencia del 19 %, con eventos que afectan usualmente el mismo tipo de vaso arterial o venoso. Zamora Ustaran y colaboradores, en población pediátrica mexicana, reportaron una mayor frecuencia de trombosis de pequeño vaso (44 %) comparada con la de Avcin y colaboradores (6 %) ( Tabla 2).
Manifestaciones en el embarazo
Aunque es poco frecuente en población pediátrica poder identificar morbilidad relacionada con aFL en el embarazo, se debe tener en cuenta este criterio clínico como parte de la identificación de SAF en casos específicos. Las complicaciones durante el embarazo incluyen las pérdidas fetales, el nacimiento de un prematuro por preeclampsia o insuficiencia uteroplacentaria (restricción del crecimiento intrauterino, Doppler alterado), aparición temprana de preeclampsia grave o síndrome HELLP.
Camilo
Rincón,
Posso, Guiselle Alexandra Cristancho Olaya Volumen 23 Número 1 Precop SCP 41
Andrés Vargas
Cindy Daiana Marmolejo
Manifestaciones
Estudios
Vargas Rincón y colaboradores (n = 117)
Avcin y colaboradores (n = 121)
Zamora-Ustaran y colaboradores (n = 32)
Recurrencia de trombosis
Valores presentados en porcentaje de pacientes (%). Elaborada por los autores.
Manifestaciones no trombóticas
En pacientes pediátricos colombianos y españoles con aFL persistentemente positivos, el 70 % presentaron manifestaciones no trombóticas. Son más frecuentes en menores de 10 años y el compromiso hematológico es el más reportado, encabezado por trombocitopenia (44 %), anemia hemolítica (25 %) y síndrome de Evans (11 %). Las manifestaciones neurológicas fueron migraña (16 %), convulsiones (6,8 %) y corea (6 %). La presencia de anticardiolipinas inmunoglobulina M (IgM) se asoció con manifestaciones no trombóticas en esta serie de pacientes. El compromiso hematológico domina las manifestaciones no trombóticas del SAF en las diferentes series de pacientes, seguido por el compromiso neurológico. En la Tabla 3 se pueden ver las principales manifestaciones no trombóticas de tres series de pacientes.
Otras manifestaciones no trombóticas son la enfermedad valvular cardiaca (vegetaciones o engrosamiento valvular), nefropatía, pseudovasculitis, fenómeno de Raynaud y livedo reticular (Figura 2). Manifestaciones poco frecuentes, como el síndrome de hipoprotrombinemia asociado con anticoagulante lúpico, deben sospecharse en pacientes con sangrados y niveles de actividad de Factor II bajo.
DIAGNÓSTICO
Para establecer un diagnóstico de SAFp, se debe tener conocimiento de las manifestaciones clínicas que tienen los pacientes al debut y las principales enfermedades autoinmunes que pueden estar asociadas. El diagnóstico de SAF en pediatría es un reto y representa una importante causa de trombofilia en pacientes menores de 18 años. Debe ser considerado en niños con SAF no provocado, mínimamente provocado o trombosis en sitio no frecuente.
No existen criterios diagnósticos para SAF, solo de clasificación, y no están validados para pediatría, por lo que tradicionalmente se han extrapolado los usados en adultos. En los últimos años se han usado dos grupos de criterios clasificatorios: el primero, de la revisión de Sídney realizada en 2004 y publicada en 2006 ( Tabla 4), y el segundo, los criterios de clasificación ACR/EULAR 2023 (Figura 3).
Para la definición de los criterios de clasificación, puede consultar el artículo anotado en las lecturas recomendadas (Barbhaiya M, et al., 2023).
La identificación por laboratorio de los antifosfolípidos se realiza a través de la prueba para anticoagulante lúpico usando técnicas
Síndrome antifosfolipídico en pediatría, más que trombosis Volumen 23 Número 1 Precop SCP 42
Tabla 2. Manifestaciones trombóticas del SAF en pediatría.
Trombosis arterial 40 32 25 Trombosis venosa 53 60 31 Cerebral 14 - 19
44 SAFC 2,5 - -
Pequeño vaso - 6
10 19 -
Tabla 3. Principales manifestaciones no trombóticas del SAF en pediatría
Estudio
Manifestaciones
Vargas Rincón y colaboradores (n = 117)
Avcin y colaboradores (n = 121)
Zamora Ustaran y colaboradores (n = 32)
Valores presentados en porcentajes de pacientes (%). Elaborada por los autores.
Tabla 4. Criterios de clasificación definitivos para SAF, revisión Sídney 2004
El síndrome de aFL está presente si al menos uno de los criterios clínicos y uno de los criterios de laboratorio siguientes están presentes.
Criterio clínico
- Trombosis vascular:
Uno o más episodios clínicos de trombosis arterial, venosa o de pequeños vasos en cualquier tejido u órgano. La trombosis debe ser confirmada por criterios validados objetivos (p. ej., imágenes o histopatología). Para histopatología, la trombosis debe estar presente sin evidencia de inflamación en la pared del vaso.
- Morbilidad en el embarazo:
a. Una o más muertes inexplicables de un feto morfológicamente normal ≥ 10 semanas de gestación.
b. Uno o más nacimientos prematuros de un neonato normal < 34 semanas de gestación, debido a: (i) eclampsia o preeclampsia grave o (ii) identificación de insuficiencia placentaria.
c. Tres o más abortos espontáneos consecutivos inexplicables, < 10 semanas de gestación sin anormalidades anatómicas u hormonales maternas y sin causas cromosómicas maternas o paternas.
Criterios de laboratorio:
a. Anticoagulante lúpico presente en el plasma, en dos o más ocasiones, con al menos 12 semanas de diferencia.
b. Anticuerpos anticardiolipinas isotipo IgG o IgM en suero o plasma, en títulos medianos o altos (p. ej., > 40 GPL o MPL, o mayores que el percentil 99th), presente en dos o más ocasiones, con al menos 12 semanas de diferencia, medidos por ELISA estandarizado.
c. Anticuerpos anti β2GPI isotipo IgG o IgM en suero o plasma, en títulos mayores que el percentil 99th). Presente en dos o más ocasiones, con al menos 12 semanas de diferencia, medidos por ELISA estandarizado.
- La clasificación debe evitarse si menos de 12 semanas o más de 5 años separan las manifestaciones clínicas de las pruebas de laboratorio.
- La trombosis venosa superficial no se incluye entre los criterios clínicos.
Modificada de: Miyakis S, et al. J Thromb Haemost. 2006;4(2):295-306.
Volumen 23 Número 1 Precop SCP 43
Camilo Andrés Vargas Rincón, Cindy Daiana Marmolejo Posso, Guiselle Alexandra Cristancho Olaya
- Trombocitopenia 44 8 9 - Anemia hemolítica 25 7 9 - Síndrome de Evans 11 12 16 Neurológicas - Migraña 16 7- Corea 6 4 3 - Convulsiones 6,8 3 16 - Pseudotumor - 1Dermatológicas - Livedo reticular 11 6- Fenómeno de Raynaud 10 6 3
Hematológicas
Síndrome antifosfolipídico en
Figura 2. Manifestaciones clínicas de SAF. *Principales manifestaciones no trombóticas, estudio Ibero-Americano de SAF pediátrico.
Cardiovascular
- Ateroesclerosis acelerada
- Engrosamiento valvular
- Cardiomiopatía
- Vegetaciones no infecciosas
Pulmonar
- Hemorragia alveolar
- Hipertensión pulmonar
Neurológico
- Corea*/atetosis
- Déficit cognitivo
- Mielitis longitudinal
- Migraña*
- Isquemia retinal
- Convulsiones*
- Hiperintensidades de la sustancia blanca
Hematológico
- Anemia hemolítica autoinmune*
- Hipoprotrombinemia (LAHS)
- Síndrome de Evans*
- Trombocitopenia*
Musculoesquelético
- Artralgias
- Necrosis avascular
Renal
- Insuficiencia adrenal
- Nefropatía por SAF
- Proteinuria
- Estenosis de la arteria renal
Dermatológico
- Isquemia digital
- Lividez racemosa
- Livedo reticular*
- Úlceras livedoides*
- Fenómeno de Raynaud*
- Hemorragias en astilla
Adaptada y modificada de: Knight JS, et al. BMJ. 2023;380:e069717 por el Dr. Camilo Vargas Rincón y colaboradores en BioRender.com.
como tiempo de veneno de víbora de Russell (TVVR) y púrpura trombocitopénica trombótica adquirida (PTTa) sensible, anticuerpos anticardiolipinas (anti-CL) IgM e IgG y anti- β 2GPI IgM e IgG, estas dos últimas por la técnica de enzimunoanálisis de adsorción (ELISA). La positividad del anticoagulante lúpico por las técnicas estandarizadas es el mejor predictor relacionado con eventos trombóticos, comparado con los otros autoanticuerpos de SAF.
Pueden encontrarse resultados falsos negativos para anticoagulante lúpico en pacientes que están usando anticoagulantes, en eventos trombóticos agudos y en pacientes con estados inflamatorios. La evaluación de autoanticuerpos no incluidos entre los criterios de clasificación (antifosfatidilserina, antifosfatidilinositol, antiprotrombina y antianexina V) pueden ayudar a identificar pacientes con sospecha de SAF y que se consideran seronegativos para las
pediatría, más que trombosis Volumen 23 Número 1 Precop SCP 44
Figura 3. Criterios de clasificación ACR/EULAR 2023.
Criterio de entrada
Al menos un criterio clínico documentado (dominios 1-6) +
Una prueba positiva de anticuerpos antifosfolípidos (una prueba de anticoagulante lúpico, o títulos moderados a altos de anti-CL o anti-β2GPI [IgG o IgM]) dentro de los tres años del criterio clínico
Si está ausente, no intente clasificarlo como SAF. Si está presente, aplique los siguientes criterios de manera aditiva
Criterios clínicos y de laboratorios
Descarte un criterio clínico si hay explicación más probable que el SAF. Dentro de cada dominio, tenga en cuenta el criterio con mayor valor para su puntuación total.
Dominios clínicos y criterios
Dl. Macrovascular (tromboembolismo venoso [TEV1)
clínicos y criterios
D2. Macrovascular (trombosis arterial (TA)
Con perfil de alto riesgo de TEV 1 TA con perfil CV de alto riesgo 2
Sin perfil de alto riesgo de TEV
sin perfil CV de alto riesgo
D3. Microvascular D4. Obstétrico
Sospecha (uno o más de los siguientes):
- Livedo racemosa (examen)
- Lesiones de vasculopatía livedoide (examen)
- Nefropatía aguda/crónica por aFL (examen o laboratorio)
- Hemorragia pulmonar (síntomas e imágenes)
Confirmado (uno o más de los siguientes):
- Vasculopatía livedoide (patología)
- Nefropatía aguda/crónica por aFL (patología)
- Hemorragia pulmonar (LBA o patología)
- Enfermedad miocárdica (imágenes o patología)
- Hemorragia adrenal (imágenes o patología)
2 > 3 muertes consecutivas prefetales (< 10 sem) o muerte fetal temprana (10 sem - 15 sem + 6 días) 1
5 Muerte fetal (16 sem - 33 sem 6 días) en ausencia de preeclampsia grave o insuficiencia placentaria grave 1
Preeclampsia grave (< 34 sem) o insuficiencia placentaria (< 34 sem) con o sin muerte fetal 3
Preeclampsia grave (< 34 sem) e insuficiencia placentaria (< 34 sem) con o sin muerte fetal 4
D5. Válvula cardiaca D6. Hematológico
Engrosamiento 2 Trombocitopenia (20-130 x 109/L) 2 Vegetación 4
D7. Prueba funcional de aFL (anticoagulante lúpico AL)
Dominios y criterios de laboratorio
D8. Prueba en fase sólida de aFL (ELISA aCL) o anti-β2GPI) [persistente])
AL positivo (una sola vez) 1 Positivo moderado o alto (IgM) (aCL o β2GPI) 1
AL positivo (persistente) 5 Positivo moderado (IgG) aCL o β2GPI) 4
Positivo alto (IgG) (aCL o β2GPI) 5 5
Positivo alto (IgG) (aCL y β2GPI) 7 7
Puntuación total
Clasificar como síndrome antifosfolipídico para fines de investigación si hay al menos 3 puntos de los dominios clínicos y 3 puntos de los dominios de laboratorios
Modificada de: Barbhaiya M, et al. Ann Rheum Dis. 2023;82(10):1258-1270.
Camilo Andrés Vargas Rincón,
Daiana Marmolejo Posso, Guiselle Alexandra Cristancho Olaya Volumen 23 Número 1 Precop SCP 45
Cindy
Puntuación Dominios
Puntuación
3 TA
4
pruebas convencionales, estudios que se realizan principalmente en escenarios de investigación.
El 33 % de los pacientes pediátricos con SAF pueden tener triple positividad para los tres subtipos de antifosfolípidos (triple marcador).
El SAFC debe ser considerado en pacientes pediátricos en los que no se logra identificar una causa infecciosa o maligna del compromiso orgánico múltiple, y tiene criterios de clasificación que deben ser aplicados en caso de sospecha diagnóstica ( Tabla 5).
Diagnóstico diferencial
La evaluación de aFL debe ser incluida en el diagnóstico diferencial de todo paciente pediátrico que presenta una trombosis. Los eventos trombóticos en pediatría están asociados con defectos congénitos protrombóticos, enfermedad cardiaca congénita, malignidades y antifosfolípidos. El riesgo de trombosis se aumenta ante un segundo evento o hit , entre los que están los estados de sepsis, dispositivos intravasculares, uso de anticonceptivos orales, dislipidemias y trauma. En población pediátrica
con SAF es más frecuente encontrar factores hereditarios protrombóticos (deficiencia de proteína S y C, mutación del factor V Leiden, polimorfismo de la metiltetrahidrofolato reductasa) en comparación con los adultos. Considerando que los aFL pueden ser el segundo hit en niños con trombofilia hereditaria, se debe realizar un perfil trombofílico en todos los pacientes pediátricos con SAF trombótico, y recordar que la existencia de los antifosfolípidos por sí solos no explican todos los eventos trombóticos.
El SAFC debe ser diferenciado de otras patologías que tienen un compromiso microangiopático, como síndrome hemolítico urémico, púrpura trombocitopénica trombótica, sepsis y estados de inflamación sistémica con falla orgánica múltiple, como el síndrome de activación macrofágica.
TRATAMIENTO
La baja prevalencia de la enfermedad no ha permitido la realización de estudios clínicos
Tabla 5. Criterios diagnósticos para SAFC
Criterios diagnósticos para SAFC
- Evidencia de compromiso de 3 o más órganos, sistemas o tejidos
- Desarrollo de manifestaciones simultáneamente o en un periodo de 1 semana
- Confirmación por laboratorio de aFL
- Exclusión de otros diagnósticos
- Todos los 4 criterios están presentes
Definitivo SAFC
Probable SAFC
- Presentes los 4 criterios, pero solo dos órganos, sistemas o tejidos comprometidos
- Presentes los 4 criterios, pero la confirmación por laboratorio no está disponible por muerte temprana o no evaluación de antifosfolípidos previo al inicio del SAFC
- Presencia de los criterios 1, 2 y 4
- Presencia de los criterios 1, 3 y 4, y el desarrollo de un tercer evento tromboembólico a pesar de anticoagulación pasada una semana del inicio, pero menos de un mes del segundo evento
Modificada de: Go EJL, et al. Curr Opin Rheumatol. 2017;29(5):516-522.
Síndrome antifosfolipídico en pediatría, más que trombosis Volumen 23 Número 1 Precop SCP 46
que ayuden a definir la mejor estrategia terapéutica en SAF pediátrico y la mayoría de la información proviene de estudios de adultos. El proyecto Single Hub and Access point for paediatric Rheumatology in Europe (SHARE), diseñado para identificar las mejores prácticas para el diagnóstico y manejo de enfermedades reumáticas en pediatría, incluyó el SAF y generó recomendaciones publicadas en 2017.
El tratamiento de los pacientes con SAF va dirigido a disminuir el riesgo de trombosis, el control de la recurrencia y el manejo de las manifestaciones no trombóticas y del evento agudo potencialmente mortal del SAFC. Para determinar qué intervención realizar, se debe tener en cuenta la actual condición del paciente, el perfil de autoanticuerpos, sitio de trombosis, las enfermedades y los factores de riesgo asociados. En la Tabla 6 se agrupan las recomendaciones para pacientes con aFL positivo.
Los pacientes asintomáticos con antifosfolípidos como hallazgo incidental no requieren uso de
terapia dirigida a la prevención de trombosis primaria como ácido acetilsalicílico (ASA), a menos que exista presencia fuerte de aFL en suero y factores de riesgo asociados para tromboembolismo.
Para los pacientes con enfermedad autoinmune asociada, como el LES, que es la más frecuente y con incremento del riesgo de trombosis, se recomienda adicionar aspirina a dosis de 3-5 mg/kg/día como profilaxis de trombosis e hidroxicloroquina por sus mecanismos antitrombóticos. Los pacientes con un primer evento trombótico venoso y un desencadenante identificado pueden ser manejados con heparina de bajo peso molecular y luego con antagonistas de vitamina K. Para algunos pacientes que desarrollan eventos trombóticos recurrentes a pesar de la anticoagulación con INR de 2-3 se recomienda ajustar la terapia para un INR de 3-4 con adición de antiagregante plaquetario. La falta de estudios en pediatría y la extrapolación de datos de adultos no permite realizar una recomendación para el uso de anticoagulantes orales directos en población menor de 18 años.
Tabla 6. Recomendaciones de manejo para pacientes con antifosfolípidos persistentemente positivos
Condición
Consideraciones de manejo
Asintomático No requiere intervención terapéutica, aunque considere ASA en pacientes con triple marcador y factores de riesgo adicionales (obesidad, inmovilización prolongada)
Enfermedad autoinmune asociada
Trombosis venosa
Trombosis arterial
SAFC
SAF obstétrico
ASA e hidroxicloroquina en pacientes con LES
Heparina de bajo peso molecular para manejo agudo, luego uso de antagonistas de vitamina K con INR de 2-3
Heparina de bajo peso molecular para manejo agudo, luego antagonista de vitamina K con INR 2-3. Para prevención de secundaria de trombosis, considere adicionar ASA
Anticoagulación + esteroides sistémicos + terapia de intercambio de plasma, con o sin, inmunoglobulina. Segunda línea: rituximab y eculizumab
Baja dosis de ASA, heparinas de bajo peso molecular. Profilaxis hasta 6 semanas posparto
ASA: ácido acetilsalicílico; INR: índice internacional normalizado; LES: lupus eritematoso sistémico; SAF: síndrome antifosfolipídico; SAFC: síndrome antifosfolipídico catastrófico. Elaborada por los autores.
Camilo Andrés Vargas Rincón, Cindy Daiana Marmolejo Posso, Guiselle Alexandra Cristancho Olaya Volumen 23 Número 1 Precop SCP 47
El registro de SAFC reportó el uso de anticoagulantes en el 77 %, esteroides sistémicos en el 75 %, terapia de intercambio de plasma en el 40 %, inmunoglobulina intravenosa en el 37 % y ciclofosfamida en el 24 %. La terapia de depleción de células B con rituximab ha sido exitosa en reportes de caso. La recomendación de manejo de esta variante de SAF es el uso de terapia combinada, que incluye usar simultáneamente esteroides sistémicos, anticoagulación plena y terapia de intercambio de plasma seguida o no de inmunoglobulina intravenosa a 0,4 g/ kg/día por 5 días.
El manejo farmacológico de las manifestaciones no trombóticas va más allá del uso de antiplaquetarios y anticoagulantes. Los pacientes con trombocitopenia con recuentos bajos o sangrados requieren el uso de esteroides o inmunoglobulina intravenosa. La esplenectomía no es una estrategia de primera línea. La anemia hemolítica es inicialmente manejada con esteroides. Las terapias de segunda línea incluyen el uso de inmunosupresores como micofenolato de mofetilo, azatioprina y ciclofosfamida. El uso de rituximab como terapia de depleción de células B se ha reportado con respuestas variables en pacientes con manifestaciones “no criterio”.
Además de ser usadas en presencia de dislipidemia, las estatinas en SAF han mostrado beneficio en la prevención de formación de trombos y su uso está recomendado en pacientes con alto riesgo de eventos cardiovasculares y con trombosis recurrente a pesar de tener una anticoagulación adecuada.
Como parte del manejo integral de los pacientes pediátricos con aFL, está la identificación de factores de riesgo adicionales, segundo hit , como el consumo de cigarrillo, uso de anticonceptivos orales con estrógenos, embarazo, obesidad, dislipidemias y lesiones vasculares por deportes, que deben ser limitados en este grupo de pacientes.
PRONÓSTICO
El proyecto Euro-fosfolípido, que evaluó a 1000 pacientes con SAF con un seguimiento de 10 años, incluidos adultos y niños, reportó una mortalidad de 5,3 % en los primeros 5 años de seguimiento y 4 % en los segundos 5 años. La edad promedio fue de 59 años (rango de 19-94) y no hubo diferencia entre los pacientes asociados con LES (6,8 %) y con SAF primario (7,1 %). La principal causa de muerte fueron las infecciones bacterianas. La sobrevida fue del 94 % a los cinco años de ingreso al estudio y 91 % a diez años de seguimiento. En este estudio, la mortalidad de los casos de SAFC del grupo general fue del 55,6 % (5/9 pacientes). La evaluación del grupo de SAFC pediátrico por Berman y colaboradores mostró una menor mortalidad en comparación con la población adulta (26,1 % frente a 40,2 %).
El riesgo de trombosis recurrente en pacientes pediátricos asiáticos al suspender la terapia anticoagulante es del 44 %, con aparición entre 1 semana y 32 meses (promedio 12 meses), similar a lo reportado por Campos y colaboradores en la población de Brasil, con una recurrencia del 37,5 % y con un promedio de 13 meses.
LECTURAS RECOMENDADAS
1. Avcin T, Cimaz R, Silverman ED, Cervera R, Gattorno M, Garay S, et al. Pediatric antiphospholipid syndrome: clinical and immunologic features of 121 patients in an international registry. Pediatrics. 2008;122(5):e1100-7.
2. Barbhaiya M, Zuily S, Naden R, Hendry A, Manneville F, Amigo MC, et al. 2023 ACR/EULAR antiphospholipid syndrome classification criteria. Ann Rheum Dis. 2023;82(10):1258-1270.
Síndrome antifosfolipídico en pediatría, más que trombosis Volumen 23 Número 1 Precop SCP 48
3. Berman H, Rodríguez-Pintó I, Cervera R, Gregory S, de Meis E, Rodrigues CE, et al. Pediatric catastrophic antiphospholipid syndrome: descriptive analysis of 45 patients from the “CAPS Registry”. Autoimmun Rev. 2014;13(2):157-62.
4. Cervera R, Serrano R, Pons-Estel GJ, Ceberio-Hualde L, Shoenfeld Y, de Ramón E, et al. Morbidity and mortality in the antiphospholipid syndrome during a 10-year period: a multicentre prospective study of 1000 patients. Ann Rheum Dis. 2015;74(6):1011-8.
5. Go EJL, O’Neil KM. The catastrophic antiphospholipid syndrome in children. Curr Opin Rheumatol. 2017;29(5):516-522.
6. Groot N, de Graeff N, Avcin T, Bader-Meunier B, Dolezalova P, Feldman B, et al. European evidencebased recommendations for diagnosis and treatment of paediatric antiphospholipid syndrome: the SHARE initiative. Ann Rheum Dis. 2017;76(10):1637-1641.
7. Knight JS, Branch DW, Ortel TL. Antiphospholipid syndrome: advances in diagnosis, pathogenesis, and management. BMJ. 2023;380:e069717.
8. Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, et al. International consensus statement on an update of the classification criteria for definite
antiphospholipid syndrome (APS). J Thromb Haemost. 2006;4(2):295-306.
9. Raschi E, Borghi MO, Tedesco F, Meroni PL. Antiphospholipid syndrome pathogenesis in 2023: an update of new mechanisms or just a reconsideration of the old ones? Rheumatology (Oxford). 2024;63(SI):SI4-SI13.
10. Sloan EE, McCurdy D. The Antiphospholipid Syndrome in the Pediatric Population. Adv Pediatr. 2022;69(1):107-121.
11. Vargas CA, Malagon CN, Anton J, Mosquera AC, Gómez MP, Yepez R, et al. ¿Existen diferencias en la expresión clínica del síndrome antifosfolipídico juvenil en función del género? Medicina. 2018;40(1):158.
12. Vargas-Rincon C, Malagon C, Anton J, Mosquera C, Gomez MP, Yepez R. Antiphospholipid syndrome in pediatrics: morbidity beyond thrombosis, multicenter ibero-american study. Abstract Plenary Session, 20th PANLAR Meeting: Buenos Aires. J Clin Rheumatol 2018;24: S1. J Clin Rheumatol. 2018;24:S1.
13. Zamora-Ustaran A, Escarcega-Alarcón RO, GarciaCarrasco M, Faugier E, Mendieta-Zeron S, MendozaPinto C, et al. Antiphospholipid syndrome in Mexican children. Isr Med Assoc J. 2012;14(5):286-9.
Camilo
Vargas Rincón,
Daiana Marmolejo Posso, Guiselle Alexandra Cristancho Olaya Volumen 23 Número 1 Precop SCP 49
Andrés
Cindy
Sepsis y choque séptico: cambiando paradigmas
María Andrea García Chaves, MD1
Eliana Zemanate Zúñiga , MD 2
Mauricio Fernández Laverde , MD 3
INTRODUCCIÓN
La sepsis y el choque séptico siguen siendo un importante problema de salud pública en todo el mundo. Altas tasas de morbilidad y mortalidad, especialmente en niños de países de bajos y medianos recursos, contribuyen a una preocupación creciente que va más allá de la infección aguda, e incluye secuelas físicas, cognitivas, emocionales y psicológicas continuas en ellos y sus familias. Para el 2017 se estimó que 25 millones de niños presentaron sepsis a nivel global y le provocó la muerte a un poco más del 10 % de los afectados, y los menores de 2 años, procedentes de áreas rurales o estrato socioeconómico bajo, alcanzan hasta dos veces más riesgo de lo esperado.
Debido a su amplio espectro clínico de presentación, los signos de hipoperfusión muchas veces no identificados y los biomarcadores en ocasiones no disponibles llevan consigo un
reconocimiento y manejo tardíos e incluso inadecuados, que resultan en peores desenlaces en estos pacientes. Teniendo como base una historia clínica y examen físico completo con énfasis en signos de perfusión, entre los que se destaca el tiempo de llenado capilar, la sensibilización en la sospecha, diagnóstico y abordaje apropiados permite estar acorde con el propósito de la Organización Mundial de la Salud (OMS) acerca de la sepsis, en la que se establece la necesidad de esfuerzos dedicados a mejorar su diagnóstico, prevención y tratamiento, con criterios que identifiquen de forma precisa a aquellos pacientes pediátricos con infección y alto riesgo de resultados adversos y muerte, contemplado actualmente en los criterios de Phoenix, en los que es claro que estos pacientes cursan con un proceso tanto de naturaleza grave como heterogéneo de la fisiopatología que lleva a una presentación, curso, manejo y desenlace diferentes en cada uno de los pacientes.
1. Médica y Cirujana de la Universidad del Cauca. Residente de Pediatría de la Universidad del Cauca.
2. Pediatra Intensivista, Universidad CES. Vicepresidenta de la Sociedad Colombiana de Pediatría.
3. Pediatra Intensivista, epidemiólogo clínico. Jefe del departamento de Pediatría, Hospital Pablo Tobón Uribe. Coordinador del programa de Pediatría y Cuidado Crítico Pediátrico, Universidad CES, Medellín.
Volumen 23 Número 1 Precop SCP 50
DEFINICIONES Y UN POCO DE HISTORIA
Décadas atrás, la sepsis se ha reconocido como causa importante de morbimortalidad por naturaleza expresa, una respuesta desmedida como resultado de la participación del microorganismo, factores medioambientales, epigenéticos y respuesta del huésped, en la que los mismos intentos por erradicar el patógeno pueden llegar a provocar resultados indeseados.
Teniendo en cuenta lo anterior, desde principios de 1990 se ha intentado llegar a definir la sepsis, que pasa de ser un proceso infeccioso sospechado o confirmado asociado a un síndrome de respuesta inflamatoria sistémica (SIRS), que requiere 2 o más anomalías de temperatura, frecuencia cardiaca, frecuencia respiratoria o recuento de glóbulos blancos según la Conferencia de Consenso del Colegio Americano de Médicos del Tórax y la Sociedad de Medicina de Cuidados Críticos (Sepsis-1), a un proceso que incluye la presencia de reactantes de fase aguda, como proteína C-reactiva (PCR) o procalcitonina (PCT) > 2 desviaciones estándar (DE)
del valor normal (Sepsis-2), hasta un cambio completo en su concepción para el 2016 en la medicina de adultos, en la que desaparece el SIRS y se introduce el concepto de disfunción orgánica como marcador de sepsis en un paciente que responde de forma desregulada a una infección, determinado según la aplicación del puntaje de evaluación de falla orgánica secuencial (SOFA), posteriormente abreviado (qSOFA), como herramienta de evaluación rápida en infecciones, cuya presencia asociada a hipotensión e hipoperfusión constituye un choque séptico (Sepsis-3).
Para pediatría, desde el 2005, los Criterios de Goldstein, establecidos en la Conferencia Internacional de Consenso sobre Sepsis Pediátrica (IPSCC), contemplan la sepsis como la presencia de infección sospechada o confirmada más SIRS, que, en caso de presentar disfunción orgánica o hipoperfusión (acidosis láctica, oliguria o alteración aguda del estado mental), se cataloga como una sepsis grave que puede evolucionar a choque séptico frente a la presencia de anomalías de perfusión o hipotensión a pesar de una adecuada reanimación hídrica (Figura 1).
Sepsis
SDOM muerte
y choque séptico.
Infección confirmada/ sospechada SIRS T° / FC ↑↓ / FRC↑ / Leucocitos
Sepsis grave
Choque séptico
- 1+ Disfunción
- Cardiovascular o síndrome de dificultad respiratoria
- ≥ 2+
- Disfunción de otros órganos O
Hipotensión/hipoperfusión (oliguria, acidosis, hiperlactemia, llenado capilar alterado, gradiente de T°)
SDOM: síndrome de disfunción orgánica múltiple; SIRS: síndrome de respuesta inflamatoria sistémica. Elaborado por los autores de acuerdo con los Criterios de Goldstein establecidos. Luego de haber dado una reanimación hídrica adecuada
Según respuesta Refractario a líquidos o a catecolaminas
Laverde Volumen 23 Número 1 Precop SCP 51
María Andrea García Chaves, Eliana Zemanate Zúñiga, Mauricio Fernández
Figura 1. Criterios de Goldstein: definición sepsis, sepsis grave
Puntajes como el Pediatric Multiple Organ Dysfunction (P-MOD) y Pediatric Logistic Organ Dysfunction (PELOD) surgen con el fin de poder establecer el grado de compromiso sistémico y la gravedad del paciente séptico, con una posterior validación del puntaje qSOFA, el cual establecía la presencia de sepsis ante una puntuación de 3 o más, que se correlaciona con la predicción de morbimortalidad a los 30 días. Sin embargo, por dificultades en su validación de Sepsis-3, Surviving Sepsis Campaign generó sugerencias y recomendaciones con un enfoque pediátrico principalmente en el 2020 con base en el concepto de 2005, y finalmente se llegó a la definición de sepsis como una disfunción orgánica potencialmente mortal causada por una respuesta desregulada del huésped a la infección, que en caso de presentar anomalías circulatorias, celulares y metabólicas particularmente profundas evoluciona a un choque séptico que se correlaciona con un mayor riesgo de mortalidad que la sepsis por sí sola, según lo establecido para el 2022 en el Consenso latinoamericano de manejo de sepsis en niños: Task Force de la Sociedad Latinoamericana de Cuidados Intensivos Pediátricos (SLACIP) ( Tabla 1).
Actualmente, la Sociedad de Medicina de Cuidados Críticos establece los criterios de consenso internacional para la sepsis y el choque séptico pediátrico, con los objetivos de identificar verdaderos casos de sepsis para dirigir terapias y disminuir el uso inapropiado de antibióticos, el ingreso a estudios, la comparación entre unidades y la vigilancia epidemiológica.
Según la puntuación ( Tabla 2):
• ≥ 2 puntos: sepsis: disfunción orgánica potencialmente fatal (desaparece el término ambiguo de sepsis grave).
• ≥ 1 punto: choque séptico: disfunción cardiovascular.
Debido a la carga de mortalidad variable, es preciso establecer la presencia o no de disfunción de órganos limitados o alejados del sitio primario de infección (p. ej., disfunción respiratoria en un niño con meningitis). Los niños en entornos de menores recursos alcanzan una mortalidad de 3,6 % si cursan con sepsis, que aumenta hasta 33,5 % en choque séptico, mientras que en el caso de disfunción de órganos en el sitio primario de infección es del 6,1 % y
Tabla 1. Recomendaciones de SLACIP para la definición de sepsis, fuerza de recomendación y calidad de evidencia
Recomendaciones Definición de sepsis
1.1. La definición de sepsis y sus criterios clínicos (operacionales) deben ser considerados como 2 conceptos diferentes.
1.2. La sepsis es un síndrome clínico caracterizado por una disfunción orgánica potencialmente mortal causada por una respuesta desregulada del huésped a la infección.
1.3. El choque séptico es una sepsis con anomalías circulatorias, celulares y metabólicas particularmente profundas asociadas con un mayor riesgo de mortalidad que la sepsis por sí sola.
Fuerza de recomendación Calidad de la evidencia Porcentaje de acuerdo con votación
Fuerte Bajo nivel de evidencia 91 %
Bajo nivel de evidencia 100 %
Fuerte Bajo nivel de evidencia 100 %
Adaptado de: Consenso Latinoamericano de manejo de Sepsis en niños: Task Force de la Sociedad Latinoamericana de Cuidados Intensivos Pediátricos (SLACIP). Acta pediatr Méx. 2022;43(1):51-69.
Sepsis y choque séptico: cambiando paradigmas Volumen 23 Número 1 Precop SCP 52
Fuerte
María Andrea García Chaves, Eliana Zemanate Zúñiga, Mauricio Fernández Laverde
Tabla 2. Score Phoenix para sepsis: Sociedad de Medicina de Cuidados Críticos
Score Phoenix Sepsis
Variables 0 puntos 1 punto 2 puntos 3 puntos
Respiratorio 0-3 puntos
PaO2:FiO2 ≥ 400 o
SpO2:FiO2 ≥ 292
Cardiovascular 0-6 puntos
PaFi < 400 o SaFi ≥ 292 con cualquier asistencia respiratoria
PaFi 100-200 con VMI o SaFi 148-220 con VMI
PaFi < 100 con VMI o SaFi < 148 con VMI
1 punto cada uno (hasta 3) 2 puntos cada uno (hasta 6)
Sin medicación vasoactiva 1 medicamento vasoactivo ≥ 2 medicamentos vasoactivos
Lactato < 5 mmol/L Lactato 5-10,9 mmol/L Lactato ≥ 11 mmol/L
Basado en la edad:
Presión arterial media – mmHg
< 1 mes > 30 17-30 < 17 1 a 11 meses > 38 25-38 < 25
1 a <
Coagulación 0-2 puntos
Plaquetas ≥ 100.000/uL
Índice internacional normalizado (INR) ≤ 1,3
Dímero D ≤ 2 mg/L FEU
Fibrinógeno ≥ 100 mg/dL
Neurológico 0-2 puntos
Escala de Glasgow > 10; pupilas reactivas
Criterios Phoenix en sepsis
Sepsis Sospecha de infección y Phoenix Sepsis Score ≥ 2 puntos
Choque séptico
Sepsis con ≥ 1 punto cardiovascular
1 punto cada uno (máximo 2 puntos)
Plaquetas < 100.000/uL
Índice internacional normalizado (INR) > 1,3
Dímero D > 2 mg/L FEU
Fibrinógeno < 100 mg/dL
Escala de Glasgow ≤ 10 Pupilas fijas bilateralmente
PaO2:FiO2: presión parcial de oxígeno/fracción inspirada de oxígeno. Adaptada de: Schlapbach LJ, et al. JAMA. 2024;331(8):665-74.
Volumen 23 Número 1 Precop SCP 53
2 años > 43 31-43 < 31 2 a < 5 años < 44 32-44 < 32 5 a < 12 años > 48 36-48 < 36 12 a 17 años
51 38-51 < 38
>
llega hasta el 32,3 % cuando la disfunción llega a órganos más alejados.
EPIDEMIOLOGÍA
En 2017, 25 millones de niños presentaron sepsis a nivel mundial, lo que provocó más de 3 millones de muertes, alcanzando una incidencia global cercana 48,9 millones de casos y el 19,7 % de defunciones globales, afectando en la mitad de los casos a menores de 5 años. De acuerdo con el primer estudio multicéntrico colombiano de epidemiología de la sepsis, del Dr. Jaramillo y colaboradores, la tasa de mortalidad es equiparable (18 %), y presentan mayor riesgo los menores de 2 años, con choque o síndrome de disfunción orgánica múltiple e infección por gramnegativos.
Principalmente las infecciones respiratorias y gastrointestinales contribuyen al desarrollo de sepsis y choque séptico, con el riesgo consecuente de morbimortalidad, el cual incrementa en lactantes menores que superan a cualquier otro grupo de edad, con el efecto más desproporcionado en los niños de entornos de bajos recursos.
Como factores de riesgo para sepsis se establecen la edad menor de 1 mes, lesiones graves (traumas graves, quemaduras o heridas penetrantes), enfermedades crónicas debilitantes (PCI y neumonía aspirativa frecuente, cardiopatía congénita no corregida, síndrome de intestino corto), anomalías del tracto urinario con infección frecuente, inmunosupresión (malignidad, virus de inmunodeficiencia humana [VIH], desnutrición grave, inmunodeficiencia, drepanocitosis), cirugía mayor, uso de catéter venoso u otros dispositivos invasivos (tubo orotraqueal, tubo torácico y sonda vesical). La mortalidad incrementa 1,54 (1,12-2,14) veces en menores de 2 años, 2,01 (1,51-2,84) en estrato socioeconómico 1 y 1,51 (1,09-2,1) en área rural. La presencia de choque séptico aumenta en 12,92 (8,05-20,75) veces, falla orgánica múltiple
en 11,03 (7,25-16,78) e infección por bacterias gramnegativas en 2,32 (1,32-4,06).
ETIOLOGÍA
La mayoría de los niños que cursan con sepsis presentan una infección bacteriana como etiología. La frecuencia relativa de estos microorganismos varía entre distintas publicaciones según condiciones del huésped y variables sociodemográficas. En general, entre los agentes más frecuentes se describen:
• Streptococcus pneumoniae
• Streptococcus pyogenes (aumenta con la edad)
• Staphylococcus aureus
• Escherichia coli (± BLEE) (disminuye con la edad)
• Neisseria meningitidis
• Klebsiella spp
• Estreptococos del grupo B
• Pseudomonas aeruginosa (± MDR)
• Enterococos (± R: vancomicina)
Entre las causas menos frecuentes se destacan los virus, tales como influenza, parainfluenza y virus del dengue. Aunque en pacientes inmunocompetentes pueden ser causa única de sepsis, sobre todo el virus de la influenza H1N1, por una posible simulación de sepsis bacteriana debe sospecharse coinfección principalmente por neumococo, o S. aureus resistente a la meticilina. En neonatos y lactantes menores, se debe sospechar infección por el virus del herpes simple (VHS), enterovirus y adenovirus, y en pacientes inmunodeprimidos, el virus de Epstein-Barr y citomegalovirus ( Tabla 3).
Las infecciones fúngicas, especialmente por Candida, pueden desarrollar también una sepsis en pacientes inmunocomprometidos con dispositivos intravasculares, neutropenia prolongada (> 4 a 7 días) y uso reciente de antibióticos de amplio espectro. Otros microorganismos en función de la prevalencia local, antecedente de viajes recientes y sintomatología de la
Sepsis y choque séptico: cambiando paradigmas Volumen 23 Número 1 Precop SCP 54
Tabla 3. Agentes etiológicos más frecuentes según edad y algunos factores determinantes
0-30 días
1-3 meses
3 meses-5 años
> 5 años
Inmunocomprometidos y hospitalizados
Estreptococo del grupo B, E. coli y otras enterobacterias, S. aureus y L. monocytogenes
S. pneumoniae, N. meningitidis, H. influenzae, E. coli, Listeria y otras enterobacterias
S. pneumoniae, N. meningitidis, H. influenzae y S. aureus
S. pneumoniae, N. meningitidis, estreptococo betahemolítico del grupo A, S. aureus
S. aureus MR, S. epidermidis, Pseudomonas, Enterobacterias (MDR), Candida spp
Elaboración propia de los autores.
enfermedad asociada deben incluirse en el diagnóstico diferencial, además de bacterias menos habituales como las rickettsias o parásitos como el Plasmodium.
FISIOPATOLOGÍA
La sepsis involucra anomalías fisiológicas y bioquímicas extensas asociadas a la disfunción orgánica, que a diferencia de otros procesos infecciosos (localizados y no complicados), implica una respuesta inmunitaria del paciente frente a la infección de forma desregulada y generalizada, a cargo de una variedad de mediadores proinflamatorios (entre los que se destacan el factor de necrosis tumoral alfa [TNF- α] y la interleucina 1 [IL-1]) y antiinflamatorios (citocinas que inhiben la producción de TNF- α , e IL-1, IL-6 e IL-10) que llevan a un desequilibrio en la regulación de esta respuesta, lo que favorece la pérdida de homeóstasis, la cual en algunos individuos puede llegar a un exceso de mediadores proinflamatorios, activación de la coagulación y cascada del complemento, que ocasionan lesiones celulares, endoteliales y de la microcirculación secundarias a vasodilatación, redistribución del volumen intravascular y aumento de la permeabilidad capilar, y que a su vez acaban desencadenando fenómenos apoptóticos y disfunción mitocondrial de forma progresiva, con el subsecuente fallo multiorgánico y un posible choque séptico por profundas anomalías circulatorias, celulares
y metabólicas, que contribuyen a un mayor compromiso y mortalidad.
Diferentes factores influyen en su desarrollo, como efectos directos del microorganismo a través de componentes de la pared bacteriana o toxinas, exceso de liberación de mediadores proinflamatorios, activación del sistema del complemento (que en condiciones inhibitorias disminuye la inflamación y reduce la mortalidad en modelos animales) y susceptibilidad genética del paciente, para lo cual se han descrito polimorfismos en varios genes que codifican proteínas implicadas en la inmunidad (citocinas, receptores de superficie, ligandos de lipopolisacáridos, entre otros) y se relacionan con el aumento en la susceptibilidad a infecciones y un peor pronóstico.
En muchos pacientes, la regulación negativa de moléculas activadoras de la superficie celular, el aumento de apoptosis de las células inmunes y el agotamiento de células T conduce a una inmunosupresión concomitante (inmunoparálisis) en las últimas etapas del curso de la enfermedad, lo que facilita la susceptibilidad a infecciones nosocomiales, patógenos oportunistas y reactivación viral (Figura 2).
Por una parte, para intentar entender la presentación y curso de la enfermedad, se han descrito diversos fenotipos, los cuales, según la evidencia actual, están relacionados con una mayor necesidad de soporte ventilatorio,
Volumen 23 Número 1 Precop SCP 55
María Andrea García Chaves, Eliana Zemanate Zúñiga, Mauricio Fernández Laverde
Respuesta inflamatoria
Inflamación excesiva causa daño colateral (lesión tisular)
Inmunosupresión con mayor susceptibilidad a infecciones secundarias
Sistema inmune innato
Respuesta temprana
- Liberación de IL-1, 6, 8, 12, 18, TNFα, INFγ
- Activación del complemento, coagulación y fagocitosis
Figura 2. Fisiopatología de la sepsis.
TLR PAMP
Sistema inmune adaptativo
Respuesta inmune celular
- Actividad de células B, neutrófilos y células supresoras derivadas de mieloides
Eventos antiinflamatorios
Disminución de la expresión de HLA-DR
- Agotamiento de las células T
- Apoptosis de células inmunes (linfocitos, monocitos y células presentadoras de antígenos)
Respuesta inmune humoral
- Producción de inmunoglobulinas (IgM, IgG)
Factores del huésped
- Ambiente
- Genética
- Edad
- Otras enfermedades
- Medicamentos
Recuperación
Deterioro
Inmunoparálisis
Infecciones nosocomiales
Reactivación viral
Tolerancia a endotoxinas
IL: interleucina; Ig: inmunoglobulina; INF: interferón; TNF: factor de necrosis tumoral. Adaptada de: Jarczak D, et al. Front Med (Lausanne). 2021;8:628302.
Factores patógenos
- Carga
- Virulencia
- Patrones moleculares asociados a patógenos (PAMP)
Sepsis y choque séptico: cambiando paradigmas Volumen 23 Número
Precop SCP 56
1
Tiempo
hemodinámico, estancia en la unidad de cuidados intensivos pediátricos (UCIP) y mortalidad. Por otra parte, responden a terapias específicas, más allá del soporte hídrico, antibioticoterapia y medidas coadyuvantes, que finalmente permiten la recuperación completa de la función de órganos, observada entre 6 y 18 semanas después, cuando se completa la regeneración y reprogramación de las células epiteliales, endoteliales, mitocondriales e inmunitarias en aquellos pacientes que logran superar este proceso.
Los fenotipos en sepsis son:
• Inmunoparálisis asociada a FOM (IPMOF): infección repetida o persistente por la capacidad disminuida para resolver la infección asociada a la disminución del antígeno leucocitario humano-isotipo DR (HLA-DR). Responde al cese de inmunosupresores, quimioterapia o dexametasona en caso de recibirlos previamente, y a la aplicación en dosis bajas de factor estimulante de colonias de granulocitos y macrófagos.
• Trombocitopenia asociada a FOM (TAMOF): Caracterizado por plaquetas < 100 000, lesión renal aguda, aumento de deshidrogenasa láctica y consumo de ADAMTS13 < 57 % debido a la activación endotelial extensa y microangiopatía trombótica. Responde al recambio plasmático diario y al eculizumab para restaurar ADAMTS13.
• Disfunción hepatobiliar asociada a FOM (secuencial): compromiso respiratorio seguido de alteraciones hepáticas por la acción ineficaz de los linfocitos T citotóxicos y las células asesinas naturales (NK), interacciones sFASL-Fas y activación hiperinflamatoria de macrófagos impulsada por una linfoproliferación incontrolada o activación de macrófagos sin linfoproliferación que se manifiesta como disfunción hepatobiliar combinada y coagulación intravascular diseminada. Responde a la aplicación de inmunoglobulina intravenosa (IVIG), antivirales si lo precisa, rituximab o protocolo HLH (síndrome hemofagocítico
o linfohistiocitosis hemofagocítica): IVIG + antivirales + metilprednisolona.
Todos pueden conducir a un síndrome de activación macrofágica (SAM) como vía final común de una inflamación desregulada o incapacidad de eliminar la fuente de inflamación, o por la presencia de otros síndromes hiperinflamatorios pediátricos, en los que la evaluación de hiperferritinemia, disfunción hepatobiliar y coagulación intravascular diseminada son cruciales.
Estudios previos, como el publicado en Pediatric Critical Care en 2019, muestran mayor probabilidad de desarrollar estos síndromes inflamatorios desregulados como el SAM cuando existe uno de los fenotipos (riesgo relativo [RR]: 7,07 [2,72-18,38]), principalmente si se trata de TAMOF (RR: 14,23 [5,46-37,1]) o el fenotipo secuencial (RR: 38,2 [16,08-90,72]), con mayor riesgo de mortalidad (RR: 2,35 [1,36-4,08]).
El reto clínico es poder identificar a niños en riesgo para iniciar un manejo específico temprano cuando estas terapias personalizadas tienen mayores probabilidades de éxito. El estudio publicado en Critical Care en 2022 establece una herramienta en línea (https:// www.pedsepsis.pitt.edu/index.html) que facilita este proceso y tiene como base cuatro fenotipos computables (PedSep-A, B, C y D) que orientan la terapia. Las características clínicas y paraclínicas de estos fenotipos se presentan a continuación:
• PedSep-A: se caracteriza por niños más pequeños, previamente sanos, generalmente con cuadro de insuficiencia respiratoria y menor aumento de marcadores inflamatorios (linfocitos, plaquetas, PCR, ferritina y creatinina). Tiene una tasa de mortalidad del 2 %.
• PedSep-B: se caracteriza por falla orgánica múltiple con mayor probabilidad de intubación por insuficiencia respiratoria más grave, choque y disfunción neurológica, con niveles elevados de PCR. Tiene una tasa de mortalidad del 12 %.
Volumen 23 Número 1 Precop SCP 57
María Andrea García Chaves, Eliana Zemanate Zúñiga, Mauricio Fernández Laverde
• PedSep-C: se distingue por insuficiencia cardiovascular y relativa ausencia de necesidad de intubación (14 %), menor insuficiencia pulmonar (34 %) y necesidad de ventilación mecánica (71 %) en presencia de temperaturas más altas, PCR elevada, ferritina alta y linfopenia. Recuerda al choque tóxico. Tiene una tasa de mortalidad del 10 %.
• PedSep-D: presenta la mayor cantidad de fallas orgánicas, que incluye disfunción cardiovascular, respiratoria, hepática, renal, hematológica y neurológica. Se caracteriza específicamente por insuficiencia multiorgánica hiperferritinémica (ferritina > 500 ng/mL) trombocitopénica (< 100.000). Semeja el fenotipo TAMOF con mayor propensión a disminución de la actividad de ADAMTS13, y mayor probabilidad de desarrollarlo (odds ratio [OR]: 47,51; intervalo de confianza [IC] del 95 %: 18,83–136,83; p < 0,0001), además del SAM (OR: 38,63; IC 95 %: 13,26–137,75; p < 0,0001). Tiene una tasa de mortalidad del 34 %.
Dentro de este proceso de activación descontrolada del sistema inmunitario, la estimulación masiva de linfocitos T y macrófagos que favorecen la secreción de enormes cantidades de citocinas proinflamatorias (interferón gamma [IFN-γ], TNF- α , IL-1, IL-6, IL-18), no solo como complicación potencialmente letal de algunas enfermedades reumáticas, sino también desencadenadas por fármacos, tumores malignos e infecciones, puede contribuir a la producción de ferritina pobre en hierro, que si bien se ha descrito como inmunomodulador, paradójicamente, induce citocinas proinflamatorias, inmunosupresión y, finalmente, daño hepático por macrófagos activados, anergia y linfopoyesis fallida, con una alta probabilidad de disfunción multiorgánica y mortalidad en pacientes críticamente enfermos.
En este sentido, la sepsis hiperferritinémica se diferencia de la sepsis con ferritina normal porque genera mayor compromiso y mortalidad, que puede incrementar en caso de
comorbilidades de base como desnutrición, y alcanza en general tasas hasta del 60 % con una relación directamente proporcional a los niveles de ferritina (sepsis hiperferritinémica: 23 % frente a sepsis no hiperferritinémica: 5,7 %; OR = 4,85; IC 95 %: 2,55-9,60; p < 0,0001); similar al riesgo de desarrollar SAM, que puede presentarse hasta en un 40 % de estos pacientes, que en su mayoría requieren ingreso a la UCIP, soporte de oxigenación por membrana extracorpórea, terapia de reemplazo renal continuo, entre otros. Los diferentes estudios apoyan una terapia dirigida basada en el recambio plasmático, metilprednisolona e inmunoglobulina intravenosa (IGIV) debido a una supervivencia cercana del 100%, además del enfoque antimicrobiano habitual.
EVALUACIÓN DEL PACIENTE CON SOSPECHA CLÍNICA DE SEPSIS
Los niños que cursan con sospecha de sepsis requieren una identificación precoz, estableciendo la presencia o no de choque o falla multiorgánica, con el fin de establecer lo más pronto posible el manejo de soporte e incluso terapia específica si lo precisa. Retrasos en este proceso resultan en un peor pronóstico, por lo que la sensibilización frente a cada uno de los niños de forma independiente es crucial.
SLACIP recomienda la evaluación sistemática inicial de acuerdo con el Triángulo de Evaluación Pediátrica (TEP) sin tener que esperar los resultados de laboratorio para iniciar el tratamiento ( Figura 3). La alteración del TEP, especialmente del lado circulatorio o la apariencia, obliga a una aproximación que incluya la valoración sistemática del ABCDE, común a todo paciente crítico, teniendo en cuenta incluso manifestaciones sutiles debido a que estas pueden ser la única expresión clínica de la enfermedad, especialmente en niños más pequeños o con alguna condición de inmunosupresión.
Sepsis y choque séptico: cambiando paradigmas Volumen 23 Número 1 Precop SCP 58
- Tono
Figura 3. Triángulo de evaluación pediátrica (TEP) y estados fisiológicos según alteración de sus lados.
Aspecto
- Reactividad
- Consolabilidad
- Mirada
- Llanto/Lenguaje
Valora SNC (oxigenación y perfusión cerebral)
Respiración
- Trabajo respiratorio: aleteo, taquipnea, tirajes o retracciones…
- Ruidos respiratorios anormales: estridor, quejido, disfonía, sibilancias, ronquido…
Valora patología respiratoria
Circulación Color de la piel
- Palidez
- Livideces
- Cutis marmorata
- Cianosis
Valora la función cardíaca y perfusión de órganos
Estados fisiológicos según la alteración de los lados del TEP Apariencia Trabajo respiratorio
Circulación cutánea
Estado fisiológico
Normal Normal Normal Normal
Disfunción SNC
Disfunción respiratoria
Fallo respiratorio
descompensado
Fallo cardiopulmonar
SNC: sistema nervioso central. Adaptada de: Silva Higuero N, et al. Pediatr Integral 2019;XXIII(1):25-36.
El aspecto clínico del paciente, los signos vitales dados por temperatura, frecuencia cardiaca (siendo la taquicardia un signo muy sensible, aunque poco específico), frecuencia respiratoria, presión arterial (de afectación más tardía), saturación de oxígeno, llenado capilar y presencia o no de deshidratación deben evaluarse junto con una exploración completa puesto que ciertos hallazgos, como la presencia de lesiones purpúricas, pueden incluso orientar al agente causal, como en el caso de una meningococcemia, o la presencia de eritrodermia por S. pyogenes
El reconocimiento de los signos de inestabilidad hemodinámica o de alteración de la perfusión (presión de pulso, coloración pálida o cianótica de la piel, extremidades frías o moteadas, calidad de pulsos periféricos, llenado capilar prolongado) es clave en la valoración dinámica como estrategia de seguimiento a la cabecera del paciente. Diferentes estudios muestran esta asociación, y el llenado capilar es una herramienta clínica que, en caso de estar prolongado continuamente, representa la disfunción endotelial y degradación del glicocálix, con compromiso del suministro de oxígeno a los
Volumen 23 Número 1 Precop SCP 59
María Andrea García Chaves, Eliana Zemanate Zúñiga, Mauricio Fernández Laverde
A R C
Normal
Normal X Normal
X X Normal
Normal Normal X Shock
X Normal X Shock
X X X
X Normal
compensado
diferentes tejidos, que se traduce finalmente en peores resultados y mayor mortalidad (16,5 % frente a 6,1 %; p < 0,01), tal y como se evidencia en el reciente estudio del Dr. Jaime Fernández Sarmiento.
Es importante conocer el contexto del paciente, su enfermedad actual, antecedentes, revisión por sistemas y examen físico completo que permitan determinar el foco infeccioso, órganos implicados, etiología posible, riesgo de algunas enfermedades virales y parasitarias prevalentes en el área que requieran intervenciones y precauciones especiales, como aislamientos, con el fin de realizar un abordaje completo e individualizado de forma temprana, idealmente dentro de la primera hora, para el reconocimiento, reanimación, estabilización y control de procesos.
Frente a la sospecha diagnóstica, se debe aplicar el puntaje de Phoenix, en el que la presencia de > 2 puntos habla de sepsis como una disfunción orgánica potencialmente fatal y > 1 punto de disfunción cardiovascular determina la presencia de choque séptico. De acuerdo con la evaluación individual se definen los estudios y el manejo.
PRUEBAS DIAGNÓSTICAS
Cabe resaltar que el diagnóstico de sospecha de sepsis y choque séptico es esencialmente clínico y la realización de paraclínicos no debe retrasar el inicio del tratamiento antibiótico empírico y manejo de soporte. Se deben considerar diversas pruebas complementarias que permitan apoyar el diagnóstico clínico, establecer el foco infeccioso e idealmente el agente microbiológico, además de la repercusión sistémica, gravedad y pronóstico.
Se debe considerar según cada paciente:
• Hemograma: puede haber leucocitosis, recuento leucocitario normal o leucopenia,
neutropenia y trombocitopenia, estas últimas relacionadas con peor pronóstico.
• Proteína C-reactiva y procalcitonina: son útiles como marcadores inflamatorios complementarios a la evaluación clínica e incluso para la monitorización de respuesta al tratamiento. La procalcitonina asociada o como alternativa a la PCR se solicita según la disponibilidad de cada centro y permite orientar la etiología bacteriana.
• Ferritina: considerar dentro de los biomarcadores en sepsis probablemente hiperferritinémica teniendo en cuenta el curso de evolución rápido y desfavorable con necesidad de terapia específica.
• Gasometría y lactato: refleja el estado de oxigenación, perfusión o trastornos de ventilación. Permite calcular la presión arterial de oxígeno/fracción inspirada de oxígeno (PaO2 /FiO2) (saturación parcial de oxígeno [SpO2]/FiO2 si no está disponible), puntaje de Phoenix y evaluación de la respuesta al manejo como seguimiento y guía de reanimación.
• Glucemia: puede haber tanto hipoglucemia por aumento en la tasa metabólica e hiporexia, como hiperglucemia por estrés.
• Electrolitos: resalta la evaluación de los niveles de calcio dado que su disminución (calcio iónico < 1,1 mmol/L) puede afectar la función miocárdica y el tono vascular, que requieren corrección.
• Estudio de coagulación: el aumento de los tiempos de coagulación o índice internacional normalizado (INR) sugieren coagulación intravascular diseminada (CID), y este último es uno de los marcadores positivos a tener en cuenta en el puntaje de Phoenix, además del fibrinógeno consumido y aumento de dímero D.
• Función hepática, renal, uroanálisis, entre otros: orientan el compromiso asociado según los hallazgos en cada paciente. Se debe considerar la toma de pruebas serológicas para VHS, enterovirus, influenza, entre otros, además de otras pruebas de diagnóstico
Sepsis y choque séptico: cambiando paradigmas Volumen 23 Número 1 Precop SCP 60
(cultivo viral, PCR, prueba rápida de antígeno de inmunoensayo o tinción directa e inmunofluorescente de anticuerpos).
• Hemocultivos: se debe realizar en todos los pacientes preferiblemente antes de administrar antibióticos. Otros cultivos (líquido cefalorraquídeo [LCR], cultivo de heridas, líquido aspirado de una colección de abscesos o cultivos víricos o fúngicos) dependen de cada paciente.
• Pruebas de imagen: dependen de la sospecha del foco infeccioso específico acorde a la historia clínica y al examen físico.
TRATAMIENTO
El enfoque y manejo precoz de estos pacientes resultan en desenlaces más favorables debido a que, por cada hora en que se mantiene la situación de choque, se duplica la mortalidad de estos pacientes. Sin embargo, es de anotar que, pese a estas medidas, algunos pacientes presentan mayor morbimortalidad probablemente asociada a los diferentes fenotipos de sepsis descritos. Los objetivos son controlar la infección, estabilizar al paciente, revertir anomalías hemodinámicas y preservar la perfusión de órgano, con base en el cumplimiento de metas:
• Normalizar:
- estado del sensorio
- presión arterial
- frecuencia cardiaca
- pulsos distales y centrales
- llenado capilar
- frecuencia respiratoria
- saturación de oxígeno
- dióxido de carbono (CO2) espirado
- temperatura
• Optimizar:
- gasto urinario (> 1 mL/kg/h)
Recomendaciones de manejo
• Reconocimiento: evaluación general del paciente dentro de los 15 minutos de identificado como paciente con foco infeccioso
probable o confirmado, y definir la necesidad de referencia.
• Reanimación: se sugiere considerar la aplicación simultánea del bundle (paquete de medidas) para sepsis y choque séptico en la primera hora de atención. Las primeras intervenciones deben incluir:
- Canalización de accesos venosos periféricos (idealmente en primeros 5 minutos) o intraóseos (si no se logra la vía periférica en 90 segundos).
- Administración de oxígeno o soporte ventilatorio según lo requiera.
- Reanimación hídrica adecuada en los primeros 15-30 minutos, con soluciones cristaloides (balanceadas) tales como lactato de Ringer, Plasmalyte o similares debido a la asociación de solución salina normal con acidosis hiperclorémica, mayor inflamación sistémica, lesión renal aguda, coagulopatía y mortalidad.
Evitar la sobrecarga hídrica es fundamental puesto que conlleva a peores desenlaces dados por estancia hospitalaria prolongada (8 días [rango intercuartílico -RIC-: 6,513,2] frente a 7 días [RIC: 6,1-11,5]; p < 0,01), necesidad de ventilación mecánica (83 % frente a 47 %; OR: 4,78 [IC 95 %: 2,51-9,11]; p < 0,01) y mayor mortalidad (49 % frente a 23,6 %; OR: 5,06 [IC 95 %: 2,78-32,18]; p < 0,01) por su relación con la lesión endotelial del glicocálix evidenciada en anomalías en los biomarcadores, especialmente sindecan-1 y endocan, que contribuyen a un mayor riesgo de insuficiencia respiratoria, falla multiorgánica y muerte.
El volumen a reponer debe establecerse de forma independiente y depende de las condiciones clínicas del paciente. Se recomienda:
• Para pacientes sin hipotensión o signos de hipovolemia grave, iniciar fluidos de mantenimiento sin administrar bolos. En caso de requerirlo, o por presencia de lesión pulmonar o disfunción miocárdica grave, utilizar una tasa baja de
Volumen 23 Número 1 Precop SCP 61
María Andrea García Chaves, Eliana Zemanate Zúñiga, Mauricio Fernández Laverde
reanimación hídrica con bolos de 5 a 10 mL/kg.
• En caso contrario, administrar soluciones a 10 mL/kg en bolo (hasta 40 mL/ kg) durante la primera hora y vigilar los signos clínicos de gasto cardiaco. Si aparecen signos de sobrecarga hídrica, se debe descontinuar.
• Si hay hipovolemia evidente, pérdidas aumentadas o tercer espacio en presencia de hipotensión, considerar reanimación a una tasa más alta (40-60 mL/kg) y ajustar según la respuesta.
- Tomar cultivos (hemocultivos, urocultivo, entre otros) sin retrasar el manejo. Una vez confirmado el agente etiológico, ajustar el tratamiento definitivo al del menor espectro posible y menor toxicidad según el tipo de infección, microorganismo y sensibilidad confirmada. En caso de ser negativo, se debe evaluar el foco de infección y el estado clínico del paciente para decidir en forma conjunta con infectología (si existe disponibilidad) el esquema con menor espectro posible o incluso posible retiro.
En caso de sospecha de infección asociada con un dispositivo intravascular (catéteres de larga permanencia), se recomienda obtener un hemocultivo a través de este, además de los hemocultivos diferenciales. Si se confirma infección, debe retirarse el dispositivo intravascular.
- Iniciar antibiótico empírico de amplio espectro lo antes posible luego del diagnóstico, dentro de primera hora: en todos los casos de choque séptico, y en las primeras tres horas en caso de sepsis sin datos de choque.
Debe escogerse según la epidemiología local, edad, tipo de huésped (enfermedades subyacentes), procedimientos invasivos, sitio de infección, antecedentes de tratamientos antibióticos previos, infección o colonización por microorganismos multirresistentes y patrones de resistencia antimicrobiana.
Considerar:
• En pacientes mayores de 1 mes, con choque séptico sin foco clínico de infección, provenientes de la comunidad: cubrir S. pneumoniae , N. meningitidis , Haemophilus spp y S. aureus resistente a la meticilina.
• En áreas de alta prevalencia de resistencia a la meticilina: considerar cefalosporina de tercera generación y un antibiótico con espectro específico contra la resistencia a la meticilina.
• Niños con choque séptico de origen genitourinario o gastrointestinal: cubrir bacilos gramnegativos.
• Niños con choque séptico y antecedentes de colonización o posible infección fúngica: valorar la agregación de anfotericina B, complejo lipídico o liposomal o equinocandinas, según corresponda.
• Pacientes inmunosuprimidos: ofrecer inicialmente cobertura empírica para enterobacterias BLEE (+), Pseudomonas y S. aureus resistente a meticilina, entre otros.
- Iniciar vasoactivos vía periférica o intraósea si no se tiene acceso central de forma temprana, en los primeros 60 minutos, en aquellos casos en que esté indicado, si después de 40 mL/kg de reanimación con líquidos el paciente aún tiene signos de hipoperfusión, considerando, incluso antes de alcanzar este volumen, si el niño muestra signos de sobrecarga u otras limitaciones para la administración de fluidos.
• SLACIP recomienda la adrenalina como fármaco de primera elección (preferiblemente a dosis bajas 0,05-0,3 µg/kg/min para favorecer el efecto β, titulando según la respuesta) y reservar la noradrenalina (dosis titulable de 0,05 µg/kg/min) para casos con evidencia de baja resistencia vascular periférica.
• En 2023, una revisión crítica de la literatura menciona la noradrenalina como vasopresor de elección en
Sepsis y choque séptico: cambiando paradigmas Volumen 23 Número 1 Precop SCP 62
pacientes con choque séptico, y se considera adicionar vasopresina cuando no se logran las metas de reanimación esperadas con las dosis titulables como estrategia sensata y con alta probabilidad de influir positivamente en los desenlaces clínicos de los pacientes con diagnóstico confirmado de sepsis.
• Aunque la evidencia es contradictoria frente al soporte inotrópico, estudios describen que puede generar efectos positivos sobre la mortalidad en pacientes con sepsis y gasto cardiaco bajo. Las metas de reanimación deben ir más allá de conseguir valores específicos de la presión arterial media, por lo que el estado de perfusión tisular (llenado capilar) constituye una estrategia de seguimiento a la cabecera del paciente. Se recomienda diluir los vasoactivos y evitar la canalización de la zona distal de la extremidad, así la incidencia de eventos adversos asociados (extravasación, tromboflebitis, necrosis e isquemia) sea baja.
• Estabilización: todo paciente amerita monitorización continua (invasiva o no invasiva) junto con el control de líquidos administrados y eliminados, balances y diuresis. Evaluar el control de foco infeccioso.
• Referencia: definir la valoración multidisciplinaria y el manejo en la UCIP o institución de mayor complejidad.
Terapia coadyuvante
Hidrocortisona
Se debe considerar en niños con choque séptico resistente a líquidos y fármacos inotrópicos o vasoactivos, realizando monitorización de los niveles de sodio, glucosa y presencia o no de debilidad muscular. Una vez que los fármacos inotrópicos o vasoactivos no sean necesarios o se hayan reducido a dosis bajas, se debe suspender de forma gradual principalmente en casos de tratamiento prolongado.
No todos los pacientes llegan a responder a la terapia, específicamente aquellos dentro del fenotipo de inmunoparálisis, en el que su uso se ha asociado de forma independiente con mayor duración de la FOM e incremento en los días de hospitalización.
Vitamina C y tiamina
Aunque en general no se emiten recomendaciones a favor o en contra de su administración rutinaria en niños con sepsis o choque séptico, el uso combinado con hidrocortisona como parte de la terapia HAT se ha propuesto como terapia complementaria en adultos, dirigida principalmente al estrés oxidativo observado en el choque séptico. Ahora está en estudio en niños, especialmente quienes están en estado crítico, tienen evolución rápida o no responden al manejo establecido, o tienen hiperlactatemia persistente, pues lleva a una menor mortalidad según la evidencia disponible, pero se espera la finalización de un estudio con mayor poder estadístico.
Soporte nutricional
Desde el ingreso se debe realizar la evaluación nutricional del paciente y posteriormente de forma periódica, si es posible, por parte de nutrición. Debe iniciarse el soporte nutricional enteral de forma temprana, dentro de las primeras 48 horas del ingreso de niños con sepsis hemodinámicamente estables, sin postergar solo con base en la administración de inotrópicos o vasoactivos, y el volumen de residuo gástrico. En caso de no tolerancia o de contraindicación, se debe considerar la nutrición enteral vía transpilórica o nutrición parenteral.
Se debe procurar no utilizar fórmulas hidrolizadas como alimentación enteral inicial, suplementación con ácidos grasos omega 3 ni la administración rutinaria de agentes procinéticos como tratamiento de la intolerancia
Volumen 23 Número 1 Precop SCP 63
María Andrea García Chaves, Eliana Zemanate Zúñiga, Mauricio Fernández Laverde
alimentaria. Se recomienda no realizar modificaciones nutricionales, como cambios de glucosa, aminoácidos o administración de insulina para estimular la síntesis de albúmina. Para la nutrición parenteral deben evitarse emulsiones lipídicas especiales, así como la suplementación rutinaria con glutamina, arginina, selenio, zinc o vitamina D, excepto si se demuestra un déficit de estos elementos.
Aplicación de hemocomponentes
No se debe realizar transfusión liberal o profiláctica de ninguno de estos. En el caso de los glóbulos rojos, una hemoglobina < 7 g/ dL en niños con sepsis hemodinámicamente estables debe hacer considerar su transfusión, valorando el resto de disfunciones orgánicas. En niños críticos, con choque séptico
Estado mental Sueño/vigilia normal, capacidad de respuesta adecuada
Sensorial Audición y visión intactas, sensibles al tacto
Comunicación
Función motora
Alimentación
Vocalización apropiada, sin llanto, expresión facial intacta
Movimientos corporales y control muscular normal, consciente de acciones
Todos los alimentos tomados por vía oral con ayuda apropiada para la edad
Respiración
Aire ambiente y sin apoyo artificial
Somnoliento pero reactivo a estímulos y/o periodos de falta de respuesta social
Sospecha de pérdida de audición o visión
Letárgico y/o irritable
Disfunción de la vocalización, expresión facial y/o respuesta social
1 extremidad funcionalmente deteriorada
No reactivo a estímulos auditivos o visuales
Ausencia de comportamiento para llamar la atención
2 o más extremidades funcionalmente dañadas
Nada por vía oral o necesidad de ayuda por inadecuada alimentación para la edad
Oxigenación y/o succión
Alimentación oral y por sonda
Excitación mínima al estímulo (estuporoso)
No reactivo a estímulos auditivos y visuales
Ninguna manifestación de malestar
Mal control de la cabeza
Insensible y/o coma y/o estado vegetativo
Respuesta anormal al dolor o al tacto
Ausencia de comunicación
Espasticidad difusa, parálisis, descerebración, decorticación
Nutrición parenteral con alimentación oral o por sonda
Traqueotomía CPAP y/o soporte con VM durante todo o parte del día
Nutrición parenteral total
Soporte con VM día y noche
CPAP: presión positiva continua en la vía respiratoria; VM: ventilación mecánica. Adaptada de: Consenso Latinoamericano de manejo de Sepsis en niños: Task Force de la Sociedad Latinoamericana de Cuidados Intensivos Pediátricos (SLACIP). Acta pediatr Méx. 2022;43(1):51-69.
Sepsis y choque séptico: cambiando paradigmas Volumen 23 Número 1 Precop SCP 64
1 2 3 4 5 Normal Disfunción leve Disfunción moderada Disfunción severa Disfunción muy severa
Tabla 4. Escala de estado funcional (FSS)
e inestables hemodinámicamente, el valor mínimo de hemoglobina no puede definirse. Las plaquetas deben transfundirse a consideración en caso de sangrado o trastornos de la coagulación, o bien por un recuento < 10.000 cel/mm3 y riesgo de sangrado en el sistema nervioso central. El plasma fresco no se debe transfundir de forma profiláctica ni como expansor. Su indicación se limita en caso de pruebas de coagulación alteradas y riesgo o sangrado clínico.
Una vez y se logre superar estado séptico o choque asociado, es importante evaluar la morbilidad asociada luego del alta de cuidados intensivos y del hospital aplicando la escala FSS (escala de estado funcional) ( Tabla 4) como parte del abordaje integral y plan de recuperación.
LECTURAS RECOMENDADAS
1. Carcillo JA, Berg RA, Wessel D, Pollack M, Meert K, Hall M, et al. A Multicenter Network Assessment of Three Inflammation Phenotypes in Pediatric Sepsis-Induced Multiple Organ Failure. Pediatr Crit Care Med. 2019;20(12):1137-46. doi: 10.1097/
PCC.0000000000002105
2. Carcillo JA, Kernan KK, Horvat CM, Simon DW, Aneja RK. Why and How Is Hyperferritinemic Sepsis Different From Sepsis Without Hyperferritinemia? Pediatr Crit Care Med. 2020;21(5):509-12. doi: 10.1097/ PCC.0000000000002285
3. Carcillo JA, Podd B, Aneja R, Weiss SL, Hall MW, Cornell TT, et al. Pathophysiology of Pediatric Multiple Organ Dysfunction Syndrome. Pediatr Crit Care Med. 2017;18(3_suppl Suppl 1):S32-S45. doi: 10.1097/ PCC.0000000000001052
CONCLUSIONES
La sepsis y el choque séptico representan un síndrome clínico secundario a una infección grave por una respuesta inmunitaria exagerada que genera alteraciones en la microcirculación y disfunción de órganos diana, por lo que el concepto de inflamación pasa a ser disfunción
El puntaje Phoenix permite “operacionalizar” el diagnóstico de la concepción actual de sepsis, mas no tamizar o definir el tratamiento del paciente con sospecha de sepsis. Herramientas como el TEP o SIRS permiten una aproximación inicial adecuada que puede orientar a una infección grave, que puede ser lo primero que tengamos frente a la clínica. No se debe esperar al diagnóstico de sepsis para iniciar soportes y terapias.
5. Fan Z, Kernan KF, Qin Y, et al. Hyperferritinemic sepsis, macrophage activation syndrome, and mortality in a pediatric research network: a causal inference analysis. Crit Care. 2023 Sep 6;27(1):347. doi: 10.1186/ s13054-023-04628-x
6. Fernández-Sarmiento J, De Souza DC, Martinez A, Nieto V, López-Herce J, Soares Lanziotti V, et al. Latin American Consensus on the Management of Sepsis in Children: Sociedad Latinoamericana de Cuidados Intensivos Pediátricos [Latin American Pediatric Intensive Care Society] (SLACIP) Task Force: Executive Summary. J Intensive Care Med. 2022;37(6):753-763. doi: 10.1177/08850666211054444
4. Carrillo Esper R, Peña Pérez C, Zepeda Mendoza AD, Meza Márquez JM, Neri Maldonado R, Meza Ayala CM, et al. Ferritina y síndrome hiperferritinémico: Su impacto en el enfermo grave; conceptos actuales. Rev. Asoc. Mex. Med. Crít. Ter. Intensiva. 2015;29(3):157-66.
7. Fernández-Sarmiento J, Lamprea S, Barrera S, Acevedo L, Duque C, Trujillo M, et al. The association between prolonged capillary refill time and microcirculation changes in children with sepsis. BMC Pediatr. 2024;24(1):68. doi: 10.1186/s12887-024-04524-5
Volumen 23 Número 1 Precop SCP 65
María Andrea García Chaves, Eliana Zemanate Zúñiga, Mauricio Fernández Laverde
8. Fernández-Sarmiento J, Molina CF, Salazar-Pelaez LM, et al. Biomarkers of Glycocalyx Injury and Endothelial Activation are Associated with Clinical Outcomes in Patients with Sepsis: A Systematic Review and MetaAnalysis. J Intensive Care Med. 2023;38(1):95-105. doi: 10.1177/08850666221109186
9. Fernández-Sarmiento J, Sierra-Zuñiga MF, Salazar González MP, et al. Association between fluid overload and mortality in children with sepsis: a systematic review and meta-analysis. BMJ Paediatr Open. 2023;7(1):e002094. doi: 10.1136/bmjpo-2023-002094
10. Gómez Cortés B. Sepsis. Protoc diagn ter pediatr. 2020;1:153-66.
11. Schlapbach LJ, Watson RS, Sorce LR, Argent AC, Menon K, Hall MW, et al. International Consensus Criteria for Pediatric Sepsis and Septic Shock. JAMA. 2024;331(8):665-74. doi: 10.1001/jama.2024.0179
12. Walker SB, Conlon TW, Zhang B, Mensinger JL, Fitzgerald JC, Himebauch AS, et al. Clinical Signs to Categorize Shock and Target Vasoactive Medications in Warm Versus Cold Pediatric Septic Shock. Pediatr Crit Care Med. 2020;21(12):1051-58. doi: 10.1097/ PCC.0000000000002481
Sepsis y choque séptico: cambiando paradigmas Volumen 23 Número 1 Precop SCP 66
EXAMEN CONSULTADO
1. La función de la proteína E del virus del dengue es:
a. Facilita la fusión del virus con la membrana endosómica y determina virulencia.
b. Ayuda a la replicación de ARN viral.
c. Participa en la encapsidación del genoma.
d. Tiene actividad metiltransferasa para dar mayor replicación al virus.
2. En relación con la respuesta inmunitaria que se da en el dengue, la segunda infección puede ser más grave como consecuencia de:
a. La acción de los receptores tipo Toll que identifican los genes virales.
b. La “tormenta” de citocinas que alteran las células dendríticas y células de Kupffer.
c. El estado inmunitario del huésped.
d. La memoria inmune homotípica, pero no heterotípica que induce la infección por el virus del dengue.
3. Uno de los principales hallazgos clínicos que diferencia el dengue del chicunguña es:
a. En el paciente con chicunguña predomina la artralgia.
b. En el dengue hay más prurito.
c. En el paciente con chicunguña predomina el dolor abdominal.
d. En el paciente con dengue predominan las adenopatías.
4. En relación con el tratamiento, los pacientes del grupo B requieren:
a. Ser hospitalizados en una unidad de cuidados intensivos.
b. Iniciar líquidos isotónicos a razón de 5 a 7 mL/k/h por 2 horas.
c. Iniciar líquidos orales abundantes con monitorización del hematocrito.
d. Iniciar albúmina al 5% a 3 mL/kg/h por 2 horas.
5. ¿Cuál es la incidencia estimada de cardiopatías congénitas en recién nacidos vivos?
a. 1 de cada 1000.
b. 5 a 10 casos por cada 1000.
c. 10 a 15 casos por cada 1000.
d. 20 a 25 casos por cada 1000.
6. ¿Cuál es un criterio para clasificar las cardiopatías congénitas?
a. La presión arterial sistólica.
b. La presencia o ausencia de cianosis.
c. La talla y el peso del paciente.
d. El ritmo cardiaco en reposo.
7. ¿Cuál es el mecanismo fisiopatológico predominante en las cardiopatías cianosantes?
a. Cortocircuito de derecha a izquierda.
b. Hipertrofia ventricular izquierda.
c. Aumento del flujo pulmonar.
d. Disminución del flujo pulmonar.
8. ¿Cuál de las siguientes condiciones se clasifica como cortocircuito de izquierda a derecha?
a. Estenosis pulmonar.
b. Comunicación interventricular.
c. Coartación de aorta.
d. Atresia tricuspídea.
9. El principal factor de riesgo para los accidentes por inmersión es:
a. El sexo.
b. El estrato socioeconómico.
c. La edad.
d. El grado de escolaridad.
10. En relación con la fisiopatología del accidente por inmersión, es cierto que:
a. La muerte se produce por el edema cerebral grave que se produce.
b. En casos de accidentes en agua fría, la hipotermia tiene un efecto protector determinante.
c. La hipercapnia que se produce en pacientes con accidentes por inmersión podría ser neuroprotectora y cardioprotectora.
d. No hay diferencias importantes en el daño pulmonar producido en ahogamientos en agua dulce o en agua salada.
11. La siguientes son complicaciones luego del accidente por inmersión, excepto:
a. Hipoglicemia.
b. Edema cerebral.
c. Acidosis metabólica.
d. Insuficiencia renal.
12. En cuanto al tratamiento de los pacientes con accidente por inmersión, el principal objetivo es:
a. El tratamiento de la hipoxia.
b. El tratamiento del edema cerebral.
c. Evitar la hipertensión arterial.
d. Restaurar el surfactante pulmonar.
13. Es una característica del síndrome antifosfolipídico pediátrico:
a. Se asocia con sangrados frecuentemente.
b. Es una enfermedad autoinmune, sistémica con manifestaciones trombóticas y no trombóticas.
c. Es una enfermedad adquirida caracterizada solo por eventos trombóticos arteriales.
d. Es una enfermedad que afecta solo a los varones.
14. ¿Cuál es la enfermedad más frecuentemente asociada con SAF en pediatría?
a. Artritis idiopática juvenil.
b. Dermatomiositis juvenil.
c. Fibromialgia.
d. Lupus eritematoso sistémico.
15. ¿Cuál es la prevalencia del SAF antes de los 15 años?
a. 2,8 %.
b. 1,0 %.
c. 5 %.
d. 3,8 %.
16. Hacen parte de los anticuerpos antifosfolípido:
a. Anticuerpos antipéptidos citrulinados (antiCCP).
b. Anticuerpos antinucleares (ANA).
c. Anticardiolipina, anti-β2GPI, anticoagulante lúpico.
d. Anticuerpos antinucleares extractables (ENA).
17. Los criterios de Phoenix definen sepsis como:
a. Paciente con infección confirmada o sospechada asociada a signos de respuesta inflamatoria sistémica.
b. Paciente con infección confirmada o sospechada asociada a disfunción orgánica.
c. Paciente con infección confirmada o sospechada asociada a disfunción de órgano (respiratorio, cardiovascular, de coagulación, neurológico) que puntúe 2 o más en el puntaje.
d. Paciente con infección bacteriana confirmada o sospechada asociada a disfunción de órgano (respiratorio, cardiovascular, de coagulación, neurológico) que puntúe 2 o más en el puntaje.
18. La presencia de uno de los criterios cardiovasculares en la puntuación de Phoenix indica choque séptico, y comprende:
a. Sí. Medicamentos vasoactivos, lactato y presión arterial media.
b. No. Medicamentos vasoactivos, lactato, presión arterial media.
c. Sí. Medicamentos vasoactivos o hidrocortisona, lactato, presión arterial media o llenado capilar.
d. No. Medicamentos vasoactivos, lactato, presión arterial media o llenado capilar.
19. Qué factores se asocian con peor pronóstico o mortalidad para sepsis:
a. Edad menor de 2 años, estrato socioeconómico 1, vivienda en área rural, choque séptico, falla orgánica múltiple, infección por gramnegativos.
b. Edad menor de 2 años, estrato socioeconómico 1, vivienda en área rural, hiperferritinemia, choque séptico, falla orgánica múltiple, infección por gramnegativos.
c. Edad menor de 2 años, estrato socioeconómico 1, vivienda en área rural, hiperferritinemia, sobrecarga hídrica, reanimación con soluciones no balanceadas, choque séptico, falla orgánica múltiple, infección por gramnegativos.
d. Edad menor de 2 años, estrato socioeconómico 1, vivienda en área rural, hiperferritinemia, sobrecarga hídrica, choque séptico, falla orgánica múltiple, infección por gramnegativos.
20. El tratamiento del paciente con sepsis y choque séptico implica:
a. Evaluación general, reconocimiento temprano, reanimación hídrica, oxigenación, inicio de antibiótico de amplio espectro, soporte nutricional temprano.
b. Evaluación general, reconocimiento temprano, aseguramiento del acceso venoso o intraóseo, reanimación hídrica, oxigenación o soporte ventilatorio/hemodinámico si es necesario, toma de cultivos, antibiótico de amplio espectro, soporte nutricional temprano; considerar coadyuvantes, monitorización, control de foco infeccioso, apoyo multidisciplinario.
c. Evaluación general, reconocimiento temprano, aseguramiento del acceso, reanimación hídrica, oxigenación o soporte ventilatorio/hemodinámico, toma de cultivos, antibiótico, soporte nutricional temprano; considerar coadyuvantes, monitorización, control de foco infeccioso, apoyo multidisciplinario.
d. Reconocimiento temprano, aseguramiento del acceso venoso o intraóseo, reanimación hídrica, oxigenación, toma de cultivos, antibiótico de amplio espectro, soporte nutricional temprano; considerar coadyuvantes, monitorización, control de foco infeccioso, apoyo multidisciplinario.
Volumen 23 Número 1 Precop SCP 72
1:
2:
3: B 4: B 5:
6: D 7: A 8: C 9: C 10: D 11: B 12: C 13: D 14: E 15: C 16: B 17: B 18: B 19: C 20: B
Volumen 22 Número 3 Clave de respuestas
A
C
E



Ponte al día con PRECEP y Recertifícate.



¿Sabías qué?



Cargamos automáticamente en PRECEP los puntos de todas las actividades académicas realizadas por la SCP en las que participas.
Cada actividad en la que participas suma. Podrías tener puntos en PRECEP y no saberlo.

Evalúate con PRECOP y suma puntos. Cada fascículo PRECOP te otorga 12 puntos PRECEP. Así estás más cerca de recertificarte.
¡Comienza ahora! www.scp.com.co/precep
Sociedad Colombiana de Pediatría www.scp.com.co
precop
Coordinación general e información
Calle 83 n.o 16A-44, Oficina 701 Edificio Cima. Bogotá, D.C. Teléfonos: (1) 6495352 - 7464706/07 precop@scp.com.co
















