
22 minute read
Detección de probióticos intestinales y efectos de la alimentación de probióticos en el crecimiento, actividad enzimática inmune, digestiva y flora intestinal de Litopenaeus vannamei
Autores:
Zhi-han Zuo¹ Bi-jiao Shang¹, Ying-chun Shao, Wen-yue Li, Jin-sheng Sun*
Tianjin Key Laboratory of Animal and Plant Resistance, Facultad de Ciencias de la Vida, Universidad de Tianjin Normal, 393 West Binshui Road, Xiqing District, Tianjin, 300387, República Popular de China
jssun1965@aliyun.com C on el rápido desarrollo del cultivo de camarón, las enfermedades en el cultivo de camarón se han vuelto cada vez más prominentes, y el grave aumento de problemas medioambientales amenazan el cultivo del camarón [1–3]. Varios estudios han demostrado que el uso de una gran cantidad de antibióticos no solo perturba la flora normal del tracto intestinal del camarón y hace que los patógenos sean resistentes a las drogas, sino que también los residuos de medicamentos en el medio ambiente y en el cuerpo del langostino, amenazan en última instancia a la salud y seguridad del ser humano [4,5].
En vista del hecho de que los probióticos no producen residuos o resistencia de drogas en los animales, el uso de probióticos como sustitutos de los antibióticos se ha convertido en un tema tendencia de investigar. Muchos estudios han demostrado que los probióticos complementarios no solo pueden mejorar la supervivencia y la tasa de crecimiento de los animales acuáticos, sino también reducen el brote de enfermedades al mejorar el sistema inmunológico de peces y camarón [6]. Los probióticos han sido ampliamente utilizados en acuicultura como una forma efectiva de controlar enfermedades, mejorar la inmunidad, proporcionar nutrición, promover la digestión y controlar la calidad del agua [7,8]. El aislamiento de cepas con variada actividad enzimática digestiva del tracto intestinal de animales sanos se ha convertido en una forma efectiva de detectar probióticos [9,10]. Se ha demostrado que se deberían usar bacterias beneficiosas seleccionadas en el cuerpo del camarón, que no solo puedan mejorar la tasa de conversión del alimento y favorecer el crecimiento del camarón, algunos probióticos pueden también promover la inmunidad del sistema inmunitario del camarón ante virus y bacterias patógenas y reducir brotes de enfermedades del camarón [11]. En este experimento, los probióticos candidatos fueron detectados del tracto intestinal de camarón sano y el experimento de alimentación fue conducido para intentar evaluar la función biológica de probióticos endógenos del intestino.
Materiales y Métodos Animales experimentales Se obtuvo Litopenaeus vannamei experimental de una granja local en Dagang, Tianjin, China y fue cultivado temporalmente en el laboratorio por dos semanas antes de las pruebas de alimentación.
Reactivos y materiales Se adquirió medio MRS, medio YPD, medio TSB, medio LBs, medio 2216E y medio de aislamiento de bacilo de Luqiao Technology Co., Ltd (China). Se compraron varios kits de actividad enzimática de Suzhou Keming
Biotechnology Co., Ltd (China). Se sintetizaron primers de PCR de Sangon Biological Engineering Co., Ltd (China). Se adquirieron instrumentos de microestaciones biológicas y reactivos para identificación de Guangdong Huayue instruments Co., Ltd (Estados Unidos).
Detección e identificación de probióticos intestinales en L. vannamei sano Detección de cepas con fuerte capacidad de producción de enzimas y actividad antimicrobiana Después de una desinfección de L. vannamei sano con alcohol al 75%, los intestinos fueron molidos en un homogeneizador en condiciones asépticas, y el líquido obtenido se diluyó con NSS [12]. El fluido obtenido de diferentes partes y diferentes diluciones se lo revistió con medio MRS, medio YPD, medio TSB, medio LBs y medio 2216E.
El aislamiento de Bacillus necesita un cultivo enriquecido, y luego una recubierta en el medio de aislamiento de Bacillus, que se cultiva a una temperatura constante de 28 °C durante 24-48 h. Las colonias individuales fueron inoculadas y purificadas en el correspondiente medio de cultivo al menos 3 veces. Se detectó actividad de lipasa, amilasa y proteasa y la prueba común de susceptibilidad a antibióticos de las cepas purificadas, y se realizó un experimento antagónico con patógenos comunes de enfermedades del camarón mediante el método de papel de filtro en el medio de cultivo [13].
Identificación de especies de cepas Las cepas se identificaron mediante análisis molecular, se extrajo el ADN genómico y se amplificó el ADNr 16S con los primers 27F (5’-AGAGTTTGATCCTGGCTCAG-3 ′) y 1492R (5′-GGTTACCTTGTTACGACTT-3 ‘). Las condiciones de reacción de PCR: 94 °C durante 4 min seguido de 30 ciclos de 94 °C por 30 s, 50 °C por 1 min y 72 °C por 2 min, y 72 °C por 10 minutos. Los productos amplificados (aproximadamente 1.5kp) se secuenciaron (a cargo de Beijing Yingweijieji Technology Co.Ltd.) y la secuencia ADNr 16S se comparó e identificó en la base de datos GenBank (http://blast.ncbi.nlm.nih. gov/Blast.cgi). La identificación adicional de especies se llevó a cabo utilizando la identificación de microorganismos con el método Biolog-System.
Características biológicas de las cepas Según los métodos experimentales de Kaynar, la única colonia de probióticos candidatos fue seleccionada para un cultivo nocturno en el medio de cultivo correspondiente, y la solución de suspensión pesada fue cultivada en diferentes condiciones de cultivo [14]. Se investigó las condiciones óptimas de crecimiento de la cepa, incluyendo temperatura, pH, la concentración de NaCl y sal biliar de origen bovina.
Experimento de alimentación Método de alimentación El experimento se dividió en tres grupos, de los cuales el grupo E3 agregó Enterobacter hormaechei y el grupo L3 agregó Lactobacillus en el alimento, mientras que el grupo en blanco era el mismo alimento con igual cantidad de PBS, por triplicado (tres cilindros de acuicultura) en cada grupo. Se colocó un total de 250 camarones con una longitud corporal de 4 cm en cada estanque. Los camarones fueron alimentados con el 5% de su peso corporal dos veces al día. La concentración de bacterias en el alimento fue 10 7 UFC g − 1 , se cambió diariamente la mitad del agua y se alimentó 28 días de esta manera [15-17]. La calidad del agua fue estrictamente controlada para eliminar interferencias: amoníaco, 0.03–0.06 mg mL − 1 ; nitrito, 0.013–0.019 mg mL − 1 ; temperatura, 28–33 °C; pH 8.0–8.5; salinidad, 18–21‰. 2.4.2 Determinación de la enzima inmune y actividad enzimática digestiva relacionada con la sangre
El muestreo se realizó cada 7 días durante la alimentación, fueron seleccionados 20 camarones al azar de cada grupo. Se obtuvieron células sanguíneas y suero por centrifugación en condiciones asépticas a 4 °C, 800 g por 10 min. Las células sanguíneas se almacenaron en 1 mL de Trizol a -80 °C, y el suero se preservó a 4 °C.
Las actividades del superóxido dismutasa, polifenol oxidasa, fosfatasa ácida, lisozima, peroxidasa y catalasa en la sangre se determinaron de acuerdo con los requisitos del kit. Al mismo tiempo, se molió el tracto intestinal de los camarones con solución tampón del kit para preparar la muestra, y las actividades de proteasa, amilasa y lipasa en el tracto intestinal se determinaron de acuerdo a los requisitos del kit.
Determinación del crecimiento de vannamei Antes de que comenzara el experimento, se recolectaron al azar 10 camarones de cada grupo de los estanques, se midió su peso corporal (W 0 ). Durante la alimentación, se seleccionaron al azar 10 camarones de cada grupo para medir su peso corporal (W t ) cada semana. La tasa de aumento de peso de cada grupo se calculó:
FÓRMULA
Determinación de la mortalidad acumulada de L. vannamei después de la infección con WSSV Después de la alimentación, se recolectaron 120 camarones de cada grupo, y cada grupo incluyó tres réplicas. El camarón fue inyectado vía intramuscular con la suspensión de partículas del WSSV preparada y 10 μl fue inyectado en el segundo somita abdominal del camarón. La mortalidad acumulada de los camarones se registró cada 12 h para evaluar el efecto de probióticos sobre la resistencia de los camarones después de la inyección muscular del WSSV.
Observación del intestino de L. vannamei con microscopio electrónico Después de la alimentación, se recolectaron 10 camarones al azar de cada grupo, y los intestinos se cortaron con cuchillas afiladas con una solución glutaraldehído al 2.5%, se enjuagó el contenido varias veces con solución de glutaraldehído al 4%. Las muestras se deshidrataron secuencialmente en alcohol al 60%, 80% y 100% durante 15, 30 y 45 minutos, respectivamente. Las muestras obtenidas fueron observadas bajo un microscopio electrónico de barrido (SEM; Hitachi TM- 1000, Japón) a 15 kV y un microscopio de transmisión (TEM; Hitachi TEM-1200, Japón) a 80 kV.
Detección de la comunidad microbiana intestinal de camarón por método BiologECO
Después de la prueba de alimentación de 28 días, se seleccionaron al azar 20 camarones del grupo experimental y el grupo control al día 1, 5, 10 para probar la comunidad microbiana intestinal. Se limpió la superficie para desinfección con alcohol al 75% y solución salina normal al 0.8%, se diseccionó en estado estéril, se removió el tracto intestinal y se homogeneizó con solución salina fisiológica en un baño de hielo homogeneizador. El volumen final del homogenizado fue de 20 mL. Se agitó el homogenizado en una microplaca BiologECO [18], se agregó 150 μL a cada orificio, por triplicado. La microplaca es cultivada en 30 °C durante 4 h y luego se leyó mediante lectura del sistema Biolog cada 24 h hasta 5 días.
Análisis estadístico Los resultados de los experimentos triplicados se presentan como medias ± desviación estándar. Se analizó la significación de la data con ANOVA unidireccional seguido de pruebas de comparación múltiple de Duncan utilizando Software SPSS versión 11.0. Se consideró un valor de P menor que 0.05 como estadísticamente significante.
Resultados Probióticos candidatos Se detectó un total de 426 cepas del intestino de L.vannamei en 6 tipos de medios de cultivo, entre los cuales 11 cepas producían enzimas y un efecto bacteriostático (Fig. 1). Luego se realizó la prueba hemolítica y pruebas de susceptibilidad a antibióticos en estas 11 cepas para determinar la seguridad de las cepas. Los resultados mostraron que ninguna de las 11 cepas mostró actividad hemolítica y 3 cepas fueron resistentes a antibióticos comunes, las otras fueron sensibles a muchos tipos de antibióticos (Tabla 1). De acuerdo con los resultados de la prueba de actividad bacteriostática, la prueba de actividad enzimática digestiva y prueba de seguridad, se detectaron 2 cepas probiótico-sensibles que tenían una fuerte producción de enzimas y efecto bacteriostático, identificándose como Enterobacter hormaechei (E3) y Lactobacillus (L3) por identificación molecular de ADNr 16S, el índice de homología fue de 100% y 99.9%, respectivamente en la base de datos de GenBank. Luego se usó el sistema Biolog para identificar de nuevo, y confirmar los resultados de identificación.
Características biológicas de los probióticos candidatos Enterobacter hormaechei (E3), bacteria gram-negativas, anaerobia facultativa, de motilidad periflagelada, puede crecer ampliamente. La condición óptima de crecimiento de la cepa E3: temperatura, 30 °C; pH 8.0; NaCl concentración 2.5% y concentración de sal biliar bovina 0.15% (Fig. 2); Lactobacillus (L3), bacteria gram-positiva, anaerobia facultativa, las condiciones óptimas de crecimiento de L3: temperatura, 40 °C; pH 6.0; concentración de NaCl al 0.5% y concentración de sal biliar bovina al 0.0015% (Figura 2).
Actividad enzimática inmune relacionada con la sangre y enzima digestiva intestinal Las actividades de PPO, SOD, ACP, POD y CAT en la sangre de L. vannamei alimentado con probiótico E3 aumentaron significativamente (p < 0.05) durante todo el proceso de alimentación, excepto la actividad de LZM que disminuyó en el día 14. La actividad de las mismas enzimas en la sangre de los probióticos L3 mostró la misma tendencia de E3, excepto un poco más bajo que la del grupo E3.
La actividad PPO del grupo L3 disminuyó en los 7 días (Fig. 3). Las actividades de la proteasa neutral y la lipasa en el tracto intestinal de L. vannamei después de la alimentación con bacterias probióticas aumentaron significativament (p < 0.05), pero en general, la actividad en el grupo L3 fue inferior al del grupo E3, y la actividad de la amilasa mostró signos de diferencia significativa después de alimentar con probióticos durante cuatro semanas, en comparación con el grupo en blanco (Fig. 4).
Tasa de crecimiento de L. vannamei Durante el período de cultivo y alimentación del camarón, no hubo diferencia significativa (p < 0.05) en la primera semana; en la segunda semana, el grupo L3 (8.95%) fue ligeramente más alto que el grupo E3 (7.05%) y el grupo en blanco (6.98%); en la tercera semana, el grupo L3 (10.94%) y el E3 grupo (10.79%) fueron significativamente más altos que el grupo en blanco (8.25%). Después de terminar la alimentación, los grupos de probióticos fueron significativamente mayor que el grupo control (10.05%), y el efecto del grupo E3 (13.75%) fue más significativo.
Tasa de supervivencia acumulada de L. vannamei después de la infección con WSSV Después de una infección con WSSV, la tasa de mortalidad acumulada del grupo control y

Fig. 1. Resultados experimentales positivos de tres enzimas digestivas y manchas antagónicas. (A) proteasa positiva de E3; (B) amilasa positiva; (C) lipasa positiva; (D) mancha antagonista de E3.
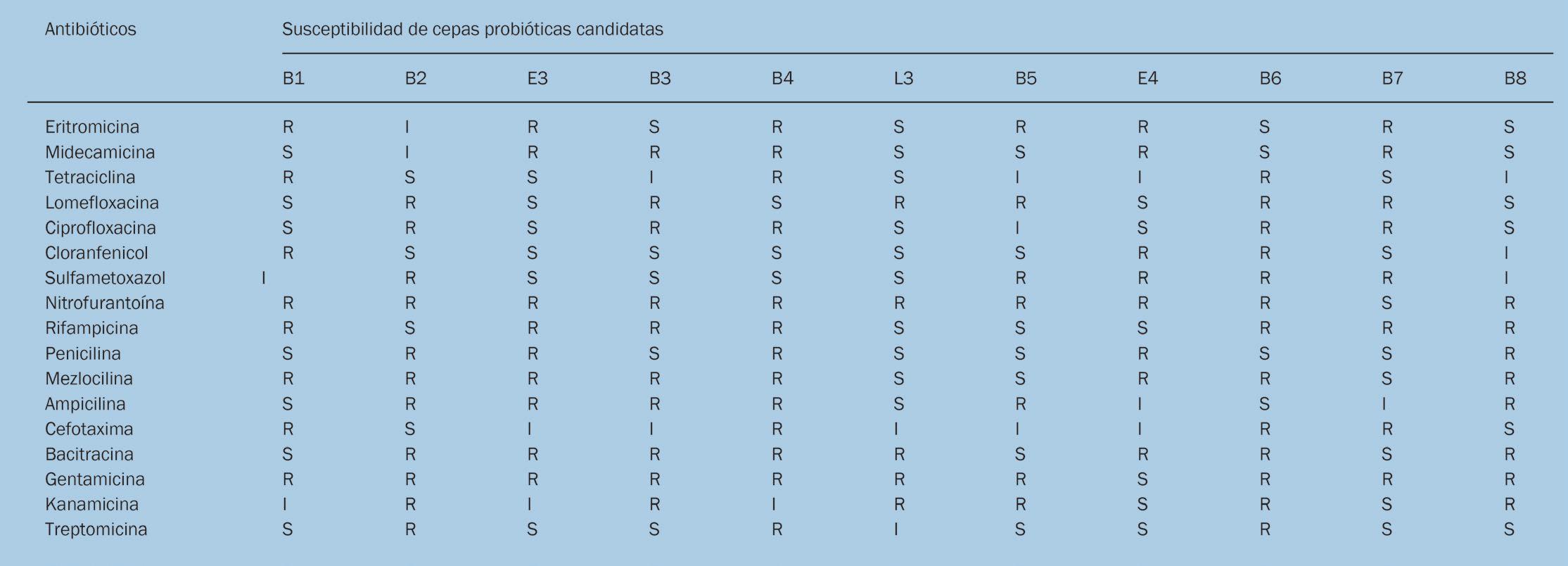
Tabla 1.- Susceptibilidad de 11 cepas a antibióticos comunes (Notas: R. resistencia; I. intermedio; S. sensible.).

Fig. 2. Características biológicas de E3 y L3, incluyendo temperatura, pH, concentración de NaCl y concentración de tolerancia a la sal biliar bovina. Los valores se presentan como medias ± desviación estándar (n = 3), y las diferencias significativas (p < 0.05) se indican con letras diferentes (a, b y c).
grupos de probióticos eran casi iguales a las 24 h, con una diferencia menor a las 36 h. La mortalidad acumulada de camarón en el grupo en blanco fue significativamente mayor que el del grupo experimental a diferentes tiempos después de 48 h, entre los cuales, la mortalidad acumulada la tasa en el grupo E3 siempre fue menor que en el grupo L3 (Fig. 5).
Observación del intestino medio de L. vannamei en microscopio electrónico Los resultados de la exploración con microscopio electrónico mostraron que había diferencias significativas en la superficie interna de los tejidos intestinales en muestras diferentes. La densidad y la profundidad de plegado del grupo de probióticos fue más alto que el del grupo control, y hubo una serie de pequeñas protuberancias en la superficie. Además, la densidad de plegado del grupo E3 fue más alta que la del grupo L3, y había agrupaciones en el grupo L3. Los resultados del microscopio electrónico de transmisión mostraron que la integridad de las células epiteliales y la densidad de la capa mucosa en los probióticos fueron mejores que los del grupo control. Y hubo pocas partículas en células epiteliales en el grupo control, el citoplasma del grupo de probióticos se llenó con gránulos de alta densidad y mostró un estado de secreción activa. Entre los cuales, el efecto reparador de la mucosa intestinal en el grupo E3 fue mejor que en el grupo L3 (Fig. 6).
Comunidad microbiana intestinal de L. vannamei El primer día después del finalizar la alimentación de 28 días con probióticos, la AWCD (tasa de cambio promedio de color por hoyo) del grupo E3 y del grupo L3
Fig. 3. Actividad de enzimas inmunes no específicas relacionadas con la sangre en L. vannamei, incluyendo polifenol oxidasa, superóxido dismutasa, fosfatasa ácida, lisozima, peroxidasa, catalasa. Los valores se presentan como medias ± desviación estándar (n = 3), y las diferencias significativas (p < 0.05) se indican con letras diferentes (a, b y c).


Fig. 4. Actividad de enzimas digestivas en el intestino de L. vannamei, incluyendo proteasa neutra, amilasa, lipasa. Los valores se presentan como medias ± estándar la desviación (n = 3) y las diferencias significativas (p < 0.05) se indican con letras diferentes (a, b y c).
fue significativamente mayor que el grupo control, y la AWCD de microorganismos intestinales en el grupo E3 fue mayor que el del grupo L3. Al quinto día, la AWCD del grupo E3 y el grupo L3 tendieron a ser consistentes, pero aún eran significativamente más altas que los del grupo control, y en el décimo día, la AWCD de microorganismos del camarón en el grupo L3 y E3 y el grupo control eran casi iguales (Fig. 7).
Los resultados sugirieron que la capacidad total de microbios intestinales para utilizar fuentes de carbono de grupos probióticos fue significativamente más alta que el grupo control hasta el décimo día. La tabla del índice de diversidad de la microflora intestinal mostró que, en comparación con el grupo control, el índice de Shannon de la comunidad de microorganismos intestinales del grupo E3 se redujo significativamente en el 1er y 5to día después de la alimentación de 28 días, el índice de Simpson y el índice de Mclntosh aumentaron significativamente y no hubo diferencias significativas en el muestreo del décimo día del grupo E3; el índice de Simpson y el índice de Mclntosh del grupo L3 aumentó significativamente en comparación con el grupo control en el primer y quinto día, pero no hubo diferencias significativas en el muestreo del décimo día (Tabla 2). Los resultados indicaron que los probióticos solo podrían afectar la diversidad metabólica de las células intestinales de comunidades microbianas de L. vannamei a corto plazo, y que las comunidades
microbianas tenderían a ser consistentes con las del grupo control después de este período, y el experimento mostró que la duración de los probióticos en el intestino de L. vannamei fue de al menos 5 días.
Análisis estadístico Los resultados se presentan como medias ± desviación estándar de experimentos triplicados. La data fue analizada por ANOVA unidireccional seguido de pruebas de comparación múltiple de Duncan utilizando el Software SPSS versión 11.0. Un valor de P menor que 0.05 se consideró estadísticamente significante.
Discusión Los agentes microecológicos no solo pueden mejorar la función inmune de animales acuáticos y reducir la incidencia de enfermedades, sino que también purifican el agua del cultivo, promoviendo el desarrollo de la industria acuícola hacia una dirección sostenible, por lo que es cada vez más utilizado [19-21]. Sin embargo, las especies probióticas de algunas materias primas utilizadas en la fabricación de agentes microecológicos son diferentes, lo que resulta en productos complejos y una falta de pertinencia y efectividad en probióticos para animales acuáticos [22].
Por lo tanto, en este experimento, se aisló la microflora intestinal de L. vannamei sano, y además a través de un experimento antagonista, experimento sobre la actividad de la enzima digestiva exocrina y el experimento de seguridad para obtener probióticos candidatos. Los probióticos candidatos con enzimas digestivas antagonistas y exocrinas, se identificaron como Enterobacter hormaechei (E3) y Lactobacillus (L3) respectivamente, luego las características biológicas de E3 y L3 fueron estudiadas para una amplificación mayor para cultivo y aplicación preliminar en experimentos de cultivo. Los probióticos nativos pueden ser direccionados a resolver los problemas de las enfermedades de L. vannamei o para promover el crecimiento del camarón.
Se ha reportado que Enterobacter hormaechei puede causar infecciones en animales y humanos bajo ciertas condiciones. Es un patógeno condicional y puede aislarse
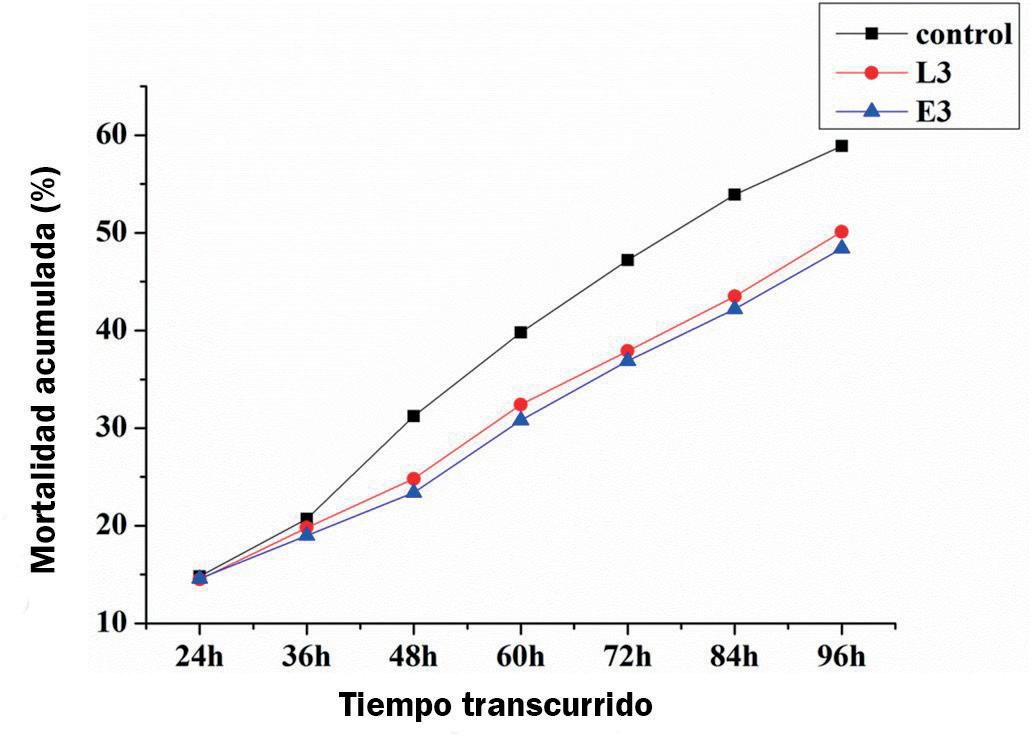
Fig. 5. Mortalidad acumulada de L. vannamei a las 24 h, 36 h, 48 h, 60 h, 72 h, 84 h y 96 h después de la infección con WSSV.
de la infección de la herida de animales y humanos. Además, se ha encontrado que las especies de Enterobacter se encuentran entre los cinco bacilos gram-negativos que causan infecciones hospitalarias [23]. Los aislamientos del complejo Enterobacter cloacae inducen apoptosis en células epiteliales intestinales humanas [24]. Sin embargo, el rol del probiótico Enterobacter hormaechei y su aplicación en la preparación de agentes antimicrobianos se ha reportado en la literatura relevante, que puede prevenir y controlar preparaciones de Vibrio alginolyticus o Vibrio parahaemolyticus, y puede usarse como una preparación microbiana beneficiosa para sustituir medicamentos químicos y para promover el desarrollo de cultivos acuícolas [25,26]. En este experimento, Enterobacter hormaechei (E3), que fue detectado en el intestino de L. vannamei, no mostró actividad hemolítica y patogenicidad, es más, jugó un papel superior en el crecimiento, actividad enzimática inmune y digestiva y flora intestinal después de alimentar a L. vannamei.
Los probióticos tienen muchos efectos sorprendentes, pero estos efectos diferentes dependen mucho de la especificidad de la cepa. Un gran número de estudios clínicos han demostrado que una cepa probiótica específica tiene alguna función definida pero no significa que diferentes cepas del mismo probiótico deba tener las mismas funciones o funciones similares [27]. Nuestros resultados experimentales parecen confirmar la afirmación anterior.
El mecanismo de defensa inmune humoral de L. vannamei maximiza su respuesta inmune no específica, que depende principalmente de enzimas no específicas en la hemolinfa, factores inmunoactivos como el fosfato alcalino fatasa, peroxidasa, etc., en la que la fagocitosis de las células sanguíneas median la aglutinación [28-30]. Solidificación, sustancias bactericidas y otras reacciones en el proceso de apertura del mecanismo de defensa inmune, y luego promover su propio poder de matar virus, mantener el mejor estado de defensa [31- 34]. En este estudio, la enzima inmune (SOD, PPO, ACP, POD, CAT, LZM) la actividad de dos grupos experimentales alimentados con probióticos Enterobacter hormaechei (E3) y Lactobacillus (L3) fue significativamente más alto que el del grupo control, al mismo tiempo, la tasa de mortalidad acumulada en los grupos de probióticos fue significativamente más baja que la del grupo control después de la infección por WSSV, que fue consistente con los resultados experimentales de que los probióticos podrían mejorar la actividad de factores inmunes inespecíficos y hasta cierto punto la capacidad antiviral en L. vannamei.
El crecimiento de los animales acuáticos depende de la digestión, absorción y transformación de diversos nutrientes en el tracto digestivo. Estos procesos complejos y
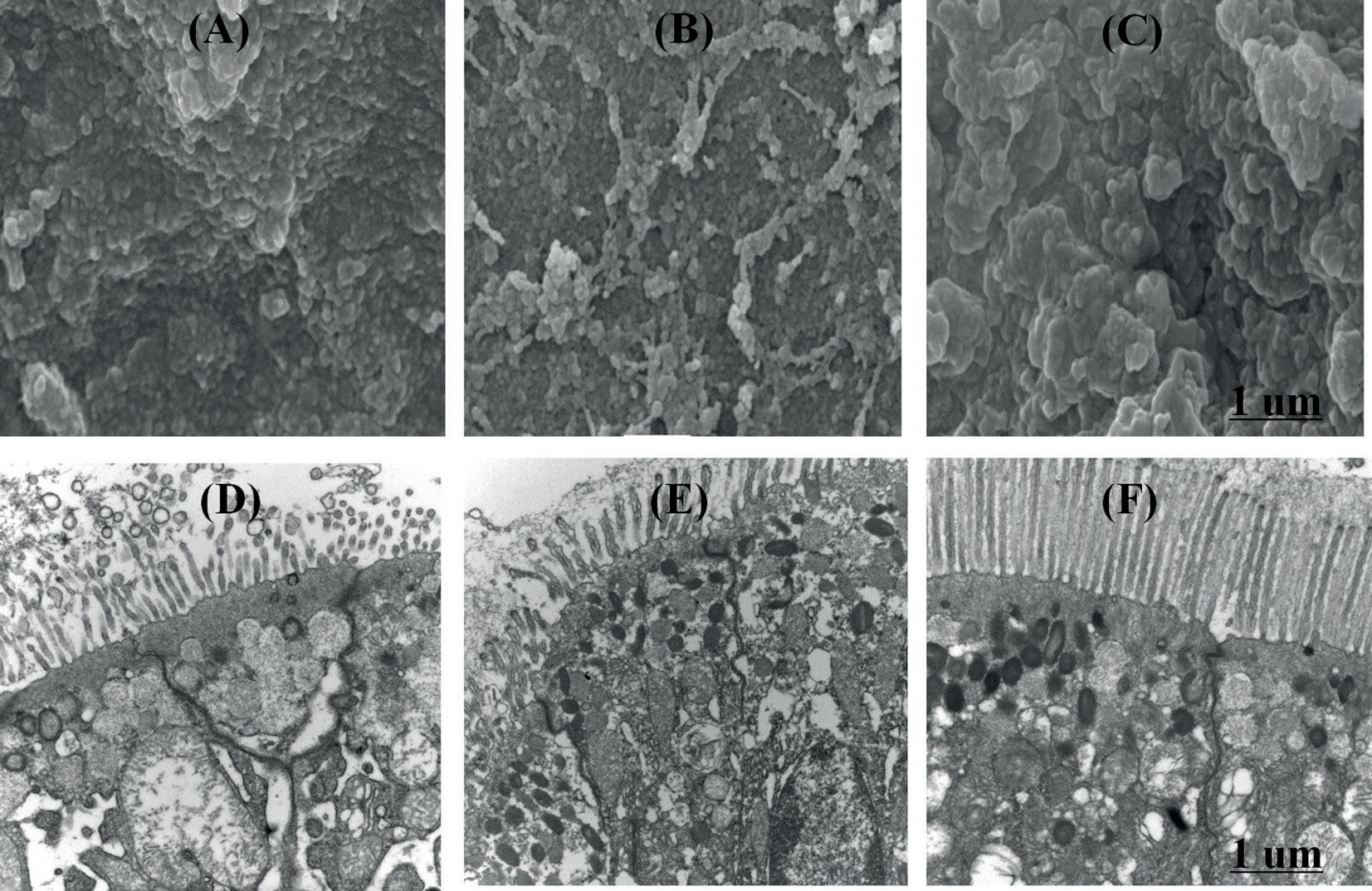
Fig. 6. Resultados de secciones intestinales de L. vannamei con microscopio electrónico (A). Grupo control (SEM); (B). Grupo L3 (SEM); (C). Grupo E3 (SEM); (D). Grupo control (TEM); (E). Grupo L3 (TEM); (F). Grupo E3 (TEM).
diversos se llevan a cabo utilizando enzimas digestivas en el intestino [35]. La actividad de la enzima digestiva se puede usar para medir el nivel digestivo de los animales acuáticos, y luego observar si es consistente con el índice de crecimiento de los animales acuáticos.
La aplicación de probióticos en lugar de los antibióticos en la acuicultura ha hecho que más y más personas estudien las actividades enzimáticas digestivas en el intestino de animales acuáticos de manera más profunda y clara [36-38]. Los resultados de este experimento demostraron que la actividad de la proteasa, amilasa y lipasa en el intestino de los grupos E3 y L3 aumentó significativamente con el paso del cultivo.
Puede ser causada por la secreción de enzimas digestivas de E3 y L3, o por la secreción fortalecida de las células estimuladas por estos dos probióticos, o por la combinación de los dos factores. Y los resultados del microscopio electrónico mostraron que la capa de la mucosa del intestino estaba tensa y el estado endócrino estaba activo en los grupos de probióticos, que es consistente con los resultados de la enzima digestiva. En este estudio, la tasa de aumento de peso fue significativamente mayor entre los camarones alimentados con dietas suplementadas con 10 7 UFC g − 1 E3 y L3. Este resultado sugiere que la digestión y absorción de nutrientes fue más efectiva en el grupo E3 y L3 que en el grupo control, lo que fue consistente con el resultado de determinación de la actividad de la enzima digestiva del tracto intestinal y el resultado del microscopio electrónico. Se puede concluir que el tracto intestinal de L. vannamei es un órgano importante para digerir los alimentos y absorber los nutrientes.
Hay un complejo sistema microbiano en el tracto intestinal de los animales. Hay muchos tipos de microbios y comunidades de estructura compleja [39]. Los diversos grupos no solo dependen unos de otros para vivir juntos, sino también se refrenan mutuamente. La diversidad es un indicador importante utilizado para describir comunidades microbianas. La diversidad en este documento se basa en el análisis de la diversidad de fuentes de carbono en el tracto intestinal de L. vannamei basado en el método Biolog-ECO [40-43]. En este estudio, la tasa de cambio promedio de color por hoyo del grupo experimentado suplementado con E3 y L3, se incrementó significativamente comparado con el grupo control, indicando que E3 y L3 mejoraron la actividad microbiana intestinal.
La capacidad general de usar carbono en la microflora intestinal de L. vannamei mejoró significativamente, indicando que las enzimas digestivas segregadas por E3 y L3 mejoraron la capacidad de digestión y
absorción del tracto intestinal del camarón, y por lo tanto, promovió el crecimiento rápido del camarón, este resultado luego demostró que los resultados de la determinación de la actividad enzimática digestiva y las medidas de crecimiento del camarón previas.
Hubo diferencias significativas en el índice de diversidad microbiana intestinal (incluido el índice de Shannon, Simpson, e índice de Mclntosh) después de terminar la alimentación de 28 días con E3 y L3, en comparación con el grupo control, hasta el quinto día. Sin embargo, no hubo claras diferencias en el muestreo del décimo día entre los grupos del experimento y el grupo control, sugiriendo que el efecto de los probióticos en la microflora intestinal de L. vannamei fue de al menos 5 días, luego la diferencia de diversidad disminuyó gradualmente y tendió a ser consistente en el décimo día después de alimentarse con probióticos. Los resultados muestran que la suplementación de probióticos E3 y L3 en la alimentación puede mejorar la competitividad de la flora intestinal, cambiar el número y la estructura de la flora original del tracto intestinal, y promueve la interacción compleja entre la comunidad de microorganismos en el intestino del camarón, y luego juegan un papel importante en la protección o promoción de aspectos normales de la constitución del camarón. Pero el efecto de agregar probióticos en la flora intestinal es periódica, y cuando excede este ciclo, la composición de la flora volverá a su estado original. Esto proporciona una referencia base para la aplicación de probióticos en acuicultura, y el intervalo entre la alimentación con probióticos no puede exceder su período de duración•
Para más información sobre este artículo escriba a:
jssun1965@aliyun.com

Fig. 7. Los cambios de AWCD en la comunidad de microorganismos intestinales de L. vannamei se detectaron continuamente en el primer día, el quinto día y el décimo día después del muestreo, al final de la alimentación de 28 días con probióticos.
Tabla 2.- Índice de diversidad funcional de la comunidad microbiana
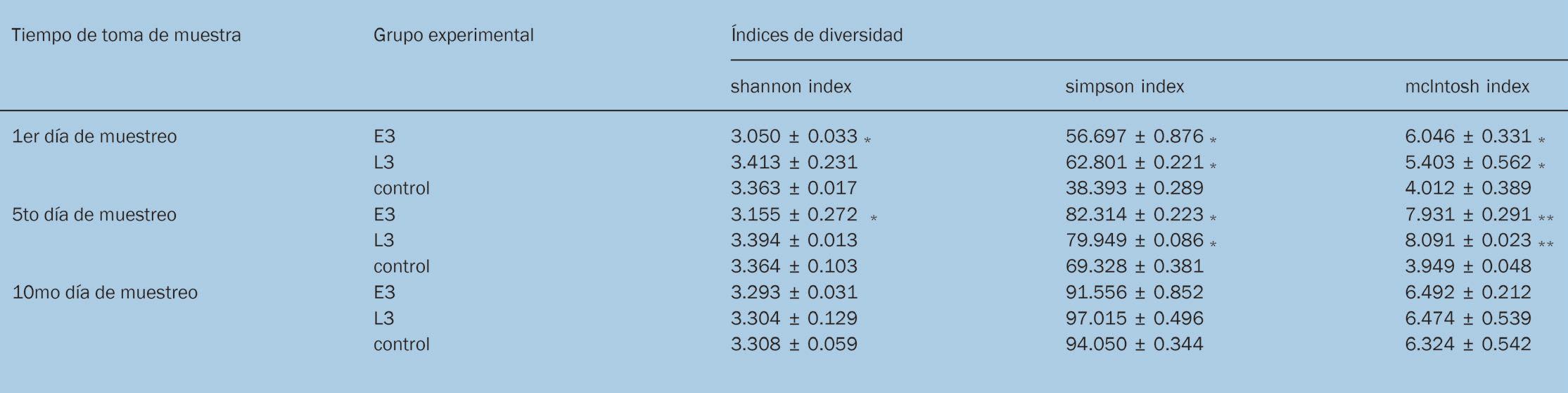
Nota: *la diferencia entre el grupo experimental y el grupo control fue significativa (p < 0.05), los valores se presentan como medias ± desviación estándar (n = 3).









