26 minute read
Efectos interactivos de una dieta de colesterol y fosfolípidos sobre el rendimiento del crecimiento, la expresión de genes relacionados con el sistema inmune, y la resistencia contra el Vibrio alginolyticus en el camarón blanco (Litopenaeus vannamei
Autores:
Minglei Yan a,1 Weilong Wang a,c,1 Xuxiong Huang a,b,c, Xinlei Wang a Yi Wang a
a Centro de Investigación de Ecología y Nutrición de Peces (CREEFN) del Ministerio de Agricultura, Universidad Ocean de Shanghai, Shanghai, China
b Centro de Investigación de Ingeniería de Acuicultura, Shanghai, China
c Centro de Demostración de Educación Experimental de Ciencias Pesqueras (Universidad Ocean de Shangai), Lingang New City, Shanghai, China
xxhuang@shou.edu.cn L itopenaeus vannamei es una de las tres especies de camarón más cultivadas en el mundo [1]. Dado el deterioro del ambiente acuático acuícola, la degradación de recursos de germoplasma, la frecuente aparición de enfermedades y el abuso de drogas para acuicultura [2], la industria acuícola de L. vannamei se enfrenta a graves desafíos. En particular, enfermedades bacterianas primarias y secundarias han causado la mortalidad a gran escala de L. vannamei de cultivo [3]. Por lo tanto, la capacidad de inmunidad de L. vannamei es una preocupación trascendental cuando están sujetos a estresores ambientales [4].
Invertebrados como los crustáceos, no poseen una respuesta inmunitaria adaptativa basada en la inmunoglobulina [5]. Los mecanismos de defensa de los crustáceos dependen completamente del sistema inmune innato, que se activa una vez que los patrones moleculares asociados al patógeno (PAMPs) son reconocidos por los receptores de reconocimiento de patrones del huésped [6].
El sistema inmunitario innato se basa en mecanismos inmunes celulares o humorales para destruir el patógeno invasivo [6]. La respuesta inmune a patógenos extraños se desencadena por el reconocimiento inmune de sustancias extrañas, conduciendo a la transducción de señales reconocidas y a la activación de una serie de reacciones en cascada [4]. Finalmente, el sistema inmune innato genera y libera factores de efecto inmunitario (como lisozimas o péptidos antimicrobianos), identificando y eliminando la sustancia invasiva [7]. Las vías de señalización (por ejemplo, las vías Toll e IMD), que regulan la transducción de señales intracelulares y extracelulares, juegan un papel importante en la transducción de señales inmunes [8].
El receptor Toll es una proteína transmembrana, y la proteína de inmunodeficiencia (IMD) es el primer agente en recibir la señal de la proteína de reconocimiento de glucano. Tanto el receptor Toll, como la proteína IMD, transmiten señales para tipos específicos de invasores extraños, desde el exterior al interior de la célula, activando una serie de reacciones en cascada para producir factores de efecto inmunitario [9].
El superóxido dismutasa (SOD) es una enzima antioxidante en los organismos que forma la primera línea de defensa contra los radicales libres [10]. La lisozima actúa como parte del sistema inmunitario no específico al hidrolizar los enlaces glicosídicos β-1, 4 entre el ácido N-acetilmurámico y la N-acetilglucosamina [11]. Por lo tanto, la expresión génica relacionada con las vías de señalización, el SOD y la actividad de la lisozima, se usan comúnmente como un indicador para evaluar la inmunidad y el estado de salud del huésped [10,12].
El ajuste de nutrientes en el alimento puede no solo mejorar el rendimiento del crecimiento, sino también la resistencia del camarón a enfermedades [13-15]. El colesterol (CHO) es un esterol importante que sirve como precursor de muchos compuestos fisiológicamente activos, como las hormonas sexuales y de muda, los corticoides suprarrenales, ácidos biliares y la vitamina D [16].
Se sabe que los fosfolípidos (PL) comprenden un grupo de lípidos polares como fuente de energía añadida a la dieta de los crustáceos y se cree que juegan un papel vital para facilitar el almacenamiento de lípidos en el hepatopáncreas [17,18]. Tanto el CHO como el PL son componentes de biomembranas que se asocian con el mantenimiento de la estructura y función celular [2,19]. Sin embargo, los crustáceos no pueden sintetizar el CHO de nuevo o sintetizar el PL de manera suficiente [18,20]. Además, pocas investigaciones han examinado las funciones inmunes e antioxidantes relacionadas al colesterol y los fosfolípidos en peces y crustáceos [21,22].
Estudios anteriores han demostrado los efectos de una dieta con CHO y PL (como la lecitina de soya) en el rendimiento del crecimiento [23,24], el contenido de lípidos y fracciones en los tejidos del camarón [25,26]. Sin embargo, aún falta información sobre la influencia de una dieta con estos dos componentes en la respuesta inmune, particularmente para L. vannamei cultivado en agua dulce. Por lo tanto, se realizó un experimento de 8 semanas para determinar (1) los efectos de la dieta de CHO y PL en la supervivencia, crecimiento, en la expresión de genes relacionados con el sistema inmune y la resistencia contra el Vibrio alginolyticus de L. vannamei juvenil en agua dulce; (2) las posibles interacciones entre el CHO y PL en la dieta con estos parámetros.
Materiales y métodos Preparación de la dieta
Se formularon nueve dietas experimentales isonitrogenadas con tres niveles de CHO (0, 0.2% y 0.4%) y tres niveles de PL (0, 2% y 4%) en un diseño experimental 3 × 3, como se muestra en la Tabla 1. Los diferentes niveles de PL en las dietas se lograron agregando lecitina de soya en diferentes niveles obtenidos de aceite de soya. Los ingredientes secos de cada dieta se molieron, tamizaron a través de una malla 80 y se mezclaron completamente. Los ingredientes lipídicos se añadieron gota a gota a la mezcla seca mientras se mezclaban. Después de eso, la mezcla se transformó en una masa al agregar agua. Luego, la masa se extruyó a través de un troquel de orificio de 1.5 mm y se secó a 90 °C durante 20 min. Los pellets secos se almacenaron a -20 °C en un refrigerador hasta su uso.
Prueba con camarón y protocolo de alimentación
Se obtuvo L. vannamei juveniles de un laboratorio local (Shanghai, China), en donde la salinidad se había ya reducido de 20‰ a 2‰ durante la etapa postlarval.
Los juveniles se mantuvieron en una piscina interior de cemento alimentada con una dieta comercial durante 14 días. Después de aclimatarse a las condiciones de laboratorio (1‰), se seleccionaron 1800 camarones sanos con un tamaño similar (0.23 ± 0.01 g de peso húmedo promedio inicial) y se asignaron aleatoriamente a 36 jaulas de PVC (1 m × 1 m × 1.2 m) ubicadas en una piscina de cemento (10 m × 20 m × 1.5 m) correspondiente a cuadruplicar las jaulas de los nueve tratamientos de dietas. Los juveniles fueron alimentados cuatro veces al día (5:30, 10:30, 16:30 y 22:00), con una ración diaria de 5-8% del peso corporal.
Cada mañana se recogía el alimento sin consumir, mientras que las materias fecales se sifoneaban del fondo. Todo el alimento no consumido se liofilizó para calcular la ingesta de alimento y la relación de eficiencia de alimentación. Durante la prueba de alimentación, el agua experimental fue cambiada un 50% cada tres días con agua de un reservorio cercano. Los parámetros de calidad del agua se analizaron todos los días, incluyendo la temperatura, el pH, oxígeno disuelto y nitrógeno amoniacal, se mantuvieron a 30 – 32 °C, 8.0 – 8.5, > 5 mg L − 1 y < 0.05 mg L − 1 , respectivamente.
Recolección de muestras y análisis bioquímico
Al final de la prueba de alimentación de 8 semanas, todos los tratamientos fueron suspendidos durante 24 h antes del muestreo final. La supervivencia y el peso corporal individual de cada jaula se midió usando las siguientes fórmulas:
Supervivencia (%) = (número final de camarones/número inicial de camarones) × 100
Tasa de crecimiento específico (SGR, % día − 1 ) = [(peso final Ln - peso inicial Ln)/ duración] × 100 Factor de conversión alimenticia (FCR) = peso seco del alimento consumido (g)/ ganancia de peso vivo (g)
Las composiciones proximales de las dietas experimentales y las muestras de camarón se midieron según los métodos estándar de la Asociación Oficial de Químicos Analíticos [27]. La humedad se determinó mediante secado en horno a 105 °C hasta un peso constante. La ceniza se determinó por incineración en un horno a 550 °C durante 6 h. Los contenidos de proteína cruda de las dietas y las muestras se determinaron por el método Kjeldahl (2300 - Autoanalyzer, Foss Tecator, Suecia).
El contenido total de lípidos se extrajo individualmente usando cloroformometanol (2:1, v/v) que contenía 0.01% de hidroxitolueno butilado (BHT) como antioxidante [28]. El lípido total se separó en fracciones de lípido neural y lípido polar mediante un cartucho de sílice Sep-pak (Waters Corporation, Milford, Massachusetts, EE. UU.) como se describe en la Ref. [29] Ambas fracciones se analizaron para cuantificar el contenido de CHO y PL de la clase de lípidos según el método [25].
Se obtuvieron cinco juveniles de cada tanque para el análisis inmunológico. Se recolectó hemolinfa del seno ventral del camarón con una jeringa de 1 mL, y luego se centrifugó a 2500 rpm durante 20 minutos a 4 °C para obtener suero. El suero se usó para medir las actividades de lisozima y superóxido dismutasa (SOD). El SOD se midió utilizando kits de reactivos para diagnóstico (Nanjing Jiancheng Bioengineering Institute, China). Se determinó la actividad de la lisozima en el suero a través de un ensayo turbidimétrico [30].
Tabla 1. Composición de las dietas experimentales

a Yuehai Feed Group, Zhejiang, China. b Vidrio químico Shanghai Gaoxin, ≥ 95%. c Premezcla mineral: Co 100 mg kg − 1 ; Cu 1400 mg kg − 1 ; Zn 900 mg kg − 1 ; Mn 450 mg kg − 1 . d Premezcla de vitamina: vitamina A1500000 UI Kg − 1 ; Vitamina B1 5000 mg kg − 1 ; Vitamina B2 2500 mg kg − 1; Vitamina D3 190000 UI Kg − 1 ; Vitamina E 180000000 UI Kg − 1 ; Vitamina B6 8000 mg kg − 1 ; Vitamina K3 2000 mg kg − 1 ; Ácido nicotínico 2600 mg kg − 1 ; Ácido pantoténico 2000 mg kg − 1 ; Ácido fólico 250 mg kg − 1 e Angel Yeast Co., Ltd., China
Susceptibilidad del camarón al alginolyticus Vibrio
Las cepas de V. alginolyticus se obtuvieron del Centro Nacional de Colección de Patógenos de Animales Acuáticos (Shanghai Ocean University, Shanghai, China) y se activaron infectando a L. vannamei. Se inocularon muestras de hemolinfa del camarón enfermo en placas de medio de cultivo de agar con sacarosa de citrato de tiosulfato de sacarosa (TCBS) para obtener clones virulentos para la prueba de infección formal.
Al final de la prueba de alimentación de ocho semanas, se seleccionó de cada tratamiento, treinta juveniles de tamaño similar para usarlos en el ensayo de susceptibilidad a V. alginolyticus por triplicado. La prueba de ensayo fue realizada inyectando 25 μL de V. alginolyticus activado (6.25 × 10 7 CFU mL − 1 ). Los camarones control fueron inyectados con 25 μL de solución salina fisiológica de camarón. Todas las 30 jaulas (50 cm × 30 cm × 80 cm) se suspendieron en una piscina de cemento con aireación continua, con temperatura del agua de 29 – 30 °C, una salinidad de 0 ppt, y oxígeno disuelto > 6 mg L − 1 . El agua se renovó diariamente, y el experimento duró cuatro días.
Extracción total de ARN, transcripción inversa y PCR en tiempo real cuantitativo
Se seleccionaron setenta y cinco juveniles de tamaños similares de cada tratamiento y se inyectó 25 μL de V. alginolyticus inactivo (1.25 × 10 6 UFC mL − 1 ) a cada camarón. El grupo control fue inyectado con solución salina fisiológica de camarón. Todas las jaulas se suspendieron en una piscina de cemento como se describió anteriormente para el ensayo con V. alginolyticus activado. Durante las 48 h después de la inyección, se tomaron muestras de tejidos branquiales de tres camarones de cada jaula cada 6 h. Las muestras se colocaron rápidamente en tubos de centrífuga de 1.5 mL que contenían una solución de conservación de ARN preenfriada (Tiangen Biochemical Technology Co., Ltd., China).
El ARN total se extrajo de los tejidos branquiales con kits de extracción de ARN total (Tiangen, China), de acuerdo con las instrucciones del fabricante. La cantidad y calidad de ARN aislado se determinó mediante un espectrofotómetro ultramicro y en una electroforesis en gel de agarosa al 1%, respectivamente. El ADNc para qRT-PCR se sintetizó mediante transcripción inversa usando kits de reactivos RT PrimeScript ™ (Takara, Japón). Las condiciones de reacción fueron las recomendadas por el fabricante. Los primers genéticos específicos se diseñaron usando el software Primer Premier 5.0 basado en las secuencias de ADNc del GenBank [lisozima (GenBank: AY170126.2); receptor tipo Toll (GenBank: DQ923424.1); IMD (GenBank: FJ592176. 1)] (Tabla 2). La qRT-PCR se realizó utilizando el kit SYBR @ Premix ExTaq ™ (Takara, Japón) en el sistema de tiempo real CFX96 ™ (Bio-Rad, Hercules, CA).
La amplificación se realizó en un volumen total de 20 μL, que contenía 10 μL SYBR Green Premix ExTaq, 0.8 μL de cada primer, 1.6 μL de ADNc y 6.8 μL DEPC-H 2 O. La condición de los ciclos fue: 95 °C durante 30 segundos, seguido de 39 ciclos de 95 °C durante 10 segundos, 60 °C durante 30
segundos y 72 °C durante 20 segundos. El gen de limpieza β-actina se amplificó como una referencia interna. El experimento se repitió tres veces. La expresión relativa del ARNm de genes específicos se calculó utilizando el método 2 -ΔΔCt [31].
Análisis estadístico
Toda la data se presentó como media ± error estándar de la media (S.E.M., n = 3). El análisis estadístico se realizó mediante un análisis de varianza (SPSS 20.0) después de explorar la normalidad y la homogeneidad de la data. Se empleó ANOVA de dos vías para evaluar los efectos de los niveles de CHO y PL en la dieta, así como sus interacciones. Una vez que se encuentra la interacción entre estos dos factores, los seis grupos fueron probados por ANOVA unidireccional para evaluar todos los niveles de los dos factores juntos. Además, la data de cada tratamiento se comparó con el control utilizando la nueva prueba de rango múltiple de Duncan. Las diferencias entre tratamientos se consideraron significativas cuando P < 0.05.
Declaración ética
Los procedimientos experimentales se llevaron a cabo siguiendo estrictamente las recomendaciones de las directrices éticas de la Directiva de la UE 2010/63/UE para experimentos con animales.
Resultados Rendimiento del crecimiento y supervivencia
El rendimiento del crecimiento, la supervivencia y el factor de conversión alimenticia del camarón de prueba alimentado con dietas experimentales durante 56 días, se detalla en la Tabla 3. En el ANOVA de dos vías, no se encontró ningún efecto interactivo en todos los parámetros. La supervivencia no se vio afectada significativamente ni por el CHO ni por PL en la dieta. Mientras tanto, también se pudo encontrar una tendencia similar en el factor de conversión alimenticia (FCR). El CHO en la dieta fue el único factor que afectó significativamente (P < 0.05) al peso corporal final (FBW) y la tasa de crecimiento específica (SGR). El FBW y la SGR mostraron una tendencia creciente con el aumento de CHO en la dieta.
Tabla 2. Primers de PCR cuantitativo en tiempo real para genes inmunes relacionados y β-actina del camarón blanco (Litopenaeus vannamei).

Análisis proximal del músculo del camarón
El análisis proximal muscular de L. vannamei alimentado con dietas experimentales durante 56 días se muestra en la Tabla 4. Los suplementos dietéticos de CHO y PL, y la interacción entre estos dos aditivos no afectó significativamente (P > 0.05) a la humedad. Aunque no se encontró ningún efecto interactivo, los niveles de CHO y PL afectan significativamente (P < 0.05) la ceniza. El CHO en la dieta y la interacción entre el CHO en la dieta y el PL, fueron el único factor significativo en los lípidos totales y las proteínas crudas, respectivamente.
Parámetros inmunes
Las actividades en suero del superóxido dismutasa (SOD) y lisozima de L. vannamei alimentado con dietas experimentales durante 56 días se muestra en la Tabla 5. La dieta con CHO y la interacción entre el CHO en la dieta y el PL, afectó significativamente la actividad del SOD. El CHO en la dieta fue el único factor significativo en la actividad de la lisozima.
Los tres grupos de dietas bajas en CHO (CHO 0 -PL 0 , CHO0-PL2 y CHO 0 -PL 4 ) mostraron una actividad SOD significativamente menor (P < 0.05) que los dos grupos de dieta de CHO intermedia (CHO 0.2 -PL 0 y CHO 0.2 -PL 2 ) y los dos grupos de dieta de alto contenido de CHO (CHO 0.4 -PL 2 y CHO 0.4 -PL 4 ). Además, el CHO 0.4 -PL 4 mostró la mayor actividad del SOD entre todos los grupos.
Expresión génica relacionada a la inmunidad
Las expresiones de genes relacionados a receptores del tipo Toll, la inmunodeficiencia (IMD) y la lisozima de los tejidos branquiales de L. vannamei se muestran en las Tablas 6 – 8, respectivamente.
Para el nivel de expresión del gen del receptor tipo Toll, se observó la interacción entre el CHO y PL en la dieta a las 12 h, 24 h y 36 h. La dieta de CHO afectó significativamente (P < 0.05) la expresión del ARNm a las 24 h y 36 h. Para el nivel de expresión del gen IMD, la dieta de CHO y PL afectó significativamente la expresión del ARNm a las 24 h. Mientras tanto, la interacción entre la dieta de estos dos aditivos no se detectó durante el período de ensayo. Para el gen de la lisozima, se observó la interacción entre el CHO y PL en la dieta durante todo el período de ensayo. Además, la dieta de CHO y PL fueron factores significativos a las 24 h, 36 h y 48 h. Los picos de expresión relativa del ARNm del receptor tipo Toll y los genes de lisozima se detectaron a las 24 h y 36 h, respectivamente. El CHO 0.2 -PL 2 y CHO 0.4 -PL 2 mostraron niveles de expresión significativamente más altos del gen receptor tipo Toll en comparación al grupo control. Y CHO 0.2 -PL 4 y CHO 0.4 -PL 4 mostraron niveles de expresión significativamente más altos del gen de la lisozima, en comparación con el control. Los picos de expresión relativa del ARNm del gen IMD se detectaron todos a las 24 h excepto del grupo control.
Mortalidad acumulativa de L. vannamei durante el ensayo con V. alginolyticus
El monitoreo de la mortalidad del camarón después del ensayo con el patógeno (Fig. 1) reveló que.
La interacción entre la dieta CHO y PL se observó a las 24 h, 48 h, 72 h y 96 h. Además, CHO 0.4 -PL 0 y CHO 0.4 -PL4 mostraron un rendimiento significativamente mejor en comparación al control (CHO 0 -PL 0 ) a las 48 h, 72 h y 96 h.
Tabla 3. Parámetros de crecimiento en Litopenaeus vannamei alimentado con dietas experimentales durante 56 días a
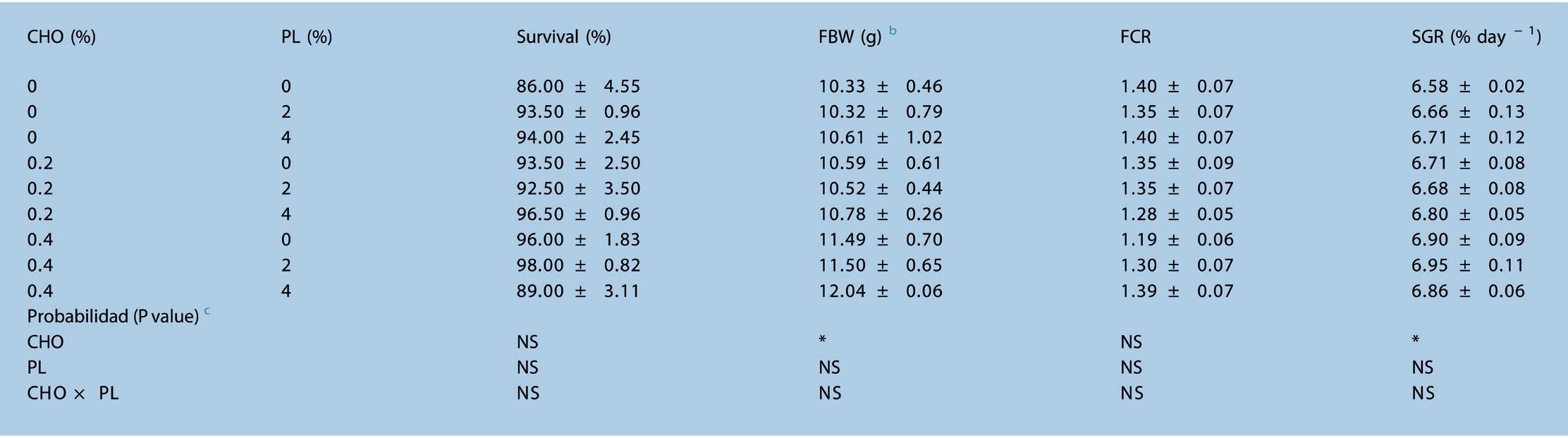
a La data se expresó como media ± S.E.M. de los grupos triplicados. b FBW, peso corporal final; FCR, factor de conversión alimenticia; SGR, tasa de crecimiento específico. ͨ Efectos significativos determinados por ANOVA de dos vías. Los asteriscos indican la significancia (P < 0.05). NS: no significativo, CHO × PL: interacción
Discusión El CHO es un esterol dietético importante y nutricionalmente superior a otros esteroles para camarón [20]. El requerimiento del CHO en dietas se ha establecido generalmente mediante la observación de una respuesta de crecimiento reducida en crustáceos [32]. Estudios previos reportaron que los requisitos del CHO para camarón comúnmente oscilan entre 0.2 y 1% [26,33,34]. Por otro lado, el exceso de colesterol puede causar algunos efectos adversos [25]. [35] sugirió que la incorporación de PL y CHO podría mejorar la capacidad osmorreguladora en L. vannamei, lo que llevaría a una mejor supervivencia y crecimiento en condiciones de baja salinidad [36,37]. Por lo tanto, la suplementación dietética del CHO y PL es crucial para cumplir con los requisitos metabólicos durante etapas tempranas y juveniles, especialmente para el cultivo de camarón al interior [38-40].
Esto fue consistente con los resultados de este estudio en el que se mostró que el CHO en la dieta es un factor significativo en el rendimiento del crecimiento. Aunque se ha encontrado que el PL tiene un efecto beneficioso sobre el crecimiento y la supervivencia del camarón marino en varios estudios [19,38,40], el PL no se detectó como el factor significativo en los resultados de supervivencia o crecimiento en este estudio. Esto indicó que la dieta suplementada sin PL que ya contenía 1% de PL, podría haber satisfecho el requerimiento de L. vannamei en agua dulce. Además, la eficacia del PL en el crecimiento y la supervivencia puede variar según el tipo y fuente de PL utilizado [41]. El principal PL en animales es la fosfatidilcolina (PC), fosfatidiletanolamina (PE), fosfatidilinositol (PI) y la fosfatidilserina (PS) [17]. En la mayoría de las investigaciones, la fuente de PL es proporcionada por la lecitina de soya [25,42]. Se ha demostrado que dietas con PL como la lecitina de soya y la PC son necesarias para el crecimiento y supervivencia de juveniles y larvas de camarón [22]. Dado que la lecitina de soya está disponible en diferente pureza y
Tabla 4. Análisis proximal muscular (% de materia seca, excepto humedad) de Litopenaeus vannamei alimentado con dietas experimentales durante 56 días a
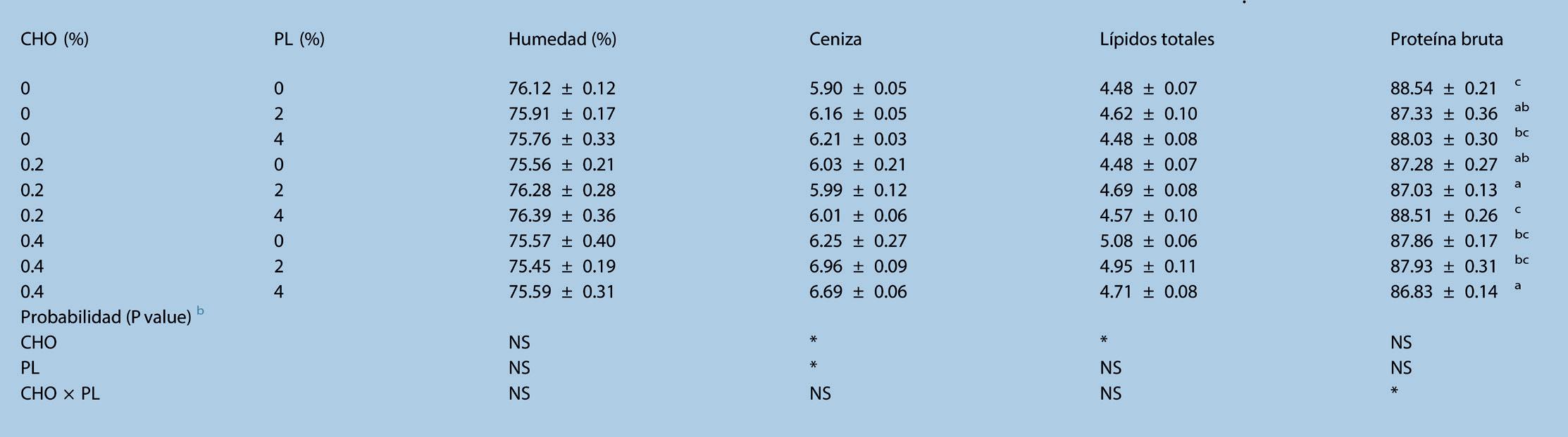
a La data se expresó como media ± S.E.M. de los grupos triplicados. La data con diferentes letras de superíndice en una columna representan una diferencia significativa del grupo control (P < 0.05). b Efectos significativos determinados por ANOVA de dos vías. Los asteriscos indican la significancia (P < 0.05). NS: no significativo, CHO × PL: interacción
composición de PL, la cantidad cuantitativa y cualitativa requerida de lecitina de soya en la dieta es difícil de establecer. Para los requisitos de PC, una estimación relativamente conservadora basada en resultados previos es entre 0.5 y 1.5% [32]. La interacción entre PL y CHO ha sido de gran interés en la nutrición de crustáceos [40].
Tabla 5. Superóxido dismutasa (SOD) y actividades de lisozima en suero de Litopenaeus vannamei alimentado con dietas experimentales durante 56 días a
El PL era bien conocido por facilitar el transporte del CHO, lo que implicaba una interacción entre ellos. Además [26,43], se había reportado que había un efecto sinérgico entre dieta de PL y CHO en L. vannamei marino y Scylla serrata. Sin embargo, no se detectó interacciones en este estudio. Se observaron resultados similares en Penaeus monodon [44], Macrobrachium rosenbergii [45] y Portunus trituberculatus [41]. Por lo tanto, la interacción entre el CHO y PL en la dieta de crustáceos puede no ser universal para mejorar el rendimiento del crecimiento.
Los organismos producen aniones superóxido (O 2 -) para matar o eliminar sustancias nocivas en respuesta a invasiones bacterianas o estrés [21]. Sin embargo, la acumulación excesiva de O 2 - también puede representar una amenaza para el organismo mismo. Al catalizar aniones superóxido por medio de reacciones de desproporción, el superóxido dismutasa (SOD) puede reducir la acumulación de O 2 - [46]. Por lo tanto, los niveles de SOD no solo son un indicador del antioxidante, sino que también ayudan a caracterizar el estado inmune.

a La data se expresó como media ± S.E.M. de los grupos triplicados. La data con diferentes letras de superíndice en una columna representa una diferencia significativa del grupo control (P < 0.05). b Efectos significativos determinados por ANOVA de dos vías. Los asteriscos indican la significancia (P < 0.05). NS: no significativo, CHO × PL: interacción
En este estudio, la suplementación dietética con CHO tuvo efectos significativos en la actividad del suero de SOD en L. vannamei (P < 0.05), al igual que la interacción entre CHO y PL en la dieta.
En los tres grupos con alto contenido de CHO (0.4%), la actividad de SOD aumentó con el incremento de los niveles de PL en la dieta. Además, el nivel más alto de actividad de SOD se observó en el grupo CHO 0.4 -PL 4 [47]. Se esclareció que el cangrejo nadador (Portunus trituberculatus) alimentado con 1.4% de CHO tenía niveles de actividad de SOD significativamente más altos que aquellos alimentados con bajos niveles de CHO (0.2% y 0.6%). Por lo tanto, se podría concluir que hubo un efecto sinérgico entre la dieta de alto nivel de PL y CHO sobre la actividad antioxidante de L. vannamei cultivado en agua dulce en este estudio.
Sin embargo, los mecanismos detallados que subyacen al aumento de la actividad de SOD en respuesta al aumento de los niveles del CHO en la dieta del camarón, sigue sin estar claro. La lisozima es uno de los factores inmunes no específicos más importantes en los organismos [48]. La actividad de la lisozima se ha utilizado con frecuencia como un indicador importante de inmunidad no específica en crustáceos. En este estudio, la actividad de la lisozima en el suero mejoró con el aumento de los niveles del CHO en la
Tabla 6. Efecto del suplemento dietético de colesterol y lecitina de soya en la expresión relativa de ARNm del receptor tipo Toll en Litopenaeus vannamei puesto a prueba con Vibrio alginolyticus a .
a La data se expresó como media ± S.E.M. de los grupos triplicados. La data con diferentes letras minúsculas en superíndice (a, b, c y d) en una columna representan una diferencia significativa del grupo control (P < 0.05). Los valores en la misma línea con diferentes letras mayúsculas en superíndice (A, B, C y D) son significativamente diferentes (P < 0.05). b Efectos significativos determinados por ANOVA de dos vías. Los asteriscos indican la significancia (P < 0.05). NS: no significativo, CHO × PL: interacción.

dieta. Además, los niveles de transcripción de lisozima en las branquias se vieron significativamente afectados no solo por el CHO en la dieta, sino también por el PL y su interacción [49].
Se descubrió que el gen de la lisozima se expresaba en todos los tejidos de camarón sin especificidad de tejido. Por lo tanto, se puede plantear la hipótesis de que el CHO en la dieta alteraría la susceptibilidad de los organismos a la patogenia tanto al nivel de transcripción, como al nivel de proteína. Los mecanismos de defensa en crustáceos dependen completamente del sistema inmune innato para destruir los patógenos invasivos [6]. La señal de invasión del patógeno se transmite desde el exterior al interior de la célula, a través de varias vías de señalización en la membrana celular [10]. Las vías de señalización Toll, IMD y JAK/ STAT regulan la inmunidad no específica del camarón [9]. Un aumento en la transcripción de los efectores inmunes asociados con las vías de señalización de invasión, indica directamente una respuesta inmunitaria suficiente y efectiva ante la invasión de patógenos [50]. Este estudio mostró que la administración del CHO en la dieta afectó significativamente la expresión del receptor tipo Toll y el ARNm de IMD en branquias de camarón experimental 24 h después de la infección por V. alginolyticus. Además, los niveles máximos relativos de expresión del ARNm de IMD aumentaron con el incremento de los niveles de PL en la dieta. Estos resultados implicaron que el PL y CHO de la dieta tuvo diferentes efectos en la expresión del gen del receptor tipo Toll en el camarón, pero los efectos de estos suplementos en
Tabla 7. Efecto del suplemento dietético de colesterol y lecitina de soya en la expresión relativa de ARNm de deficiencia inmunitaria (IMD) en Litopenaeus vannamei puesto a prueba con Vibrio alginolyticus a

a La data se expresó como media ± S.E.M. de los grupos triplicados. Los valores en la misma línea con diferentes letras mayúsculas en superíndice (A, B, C y D) son significativamente diferentes (P < 0.05). b Efectos significativos determinados por ANOVA de dos vías. Los asteriscos indican la significancia (P < 0.05). NS: no significativo, CHO × PL: interacción.
Tabla 8. Efecto del suplemento dietético de colesterol y lecitina de soya en la expresión relativa de ARNm de lisozima en Litopenaeus vannamei puesto a prueba con Vibrio alginolyticus a
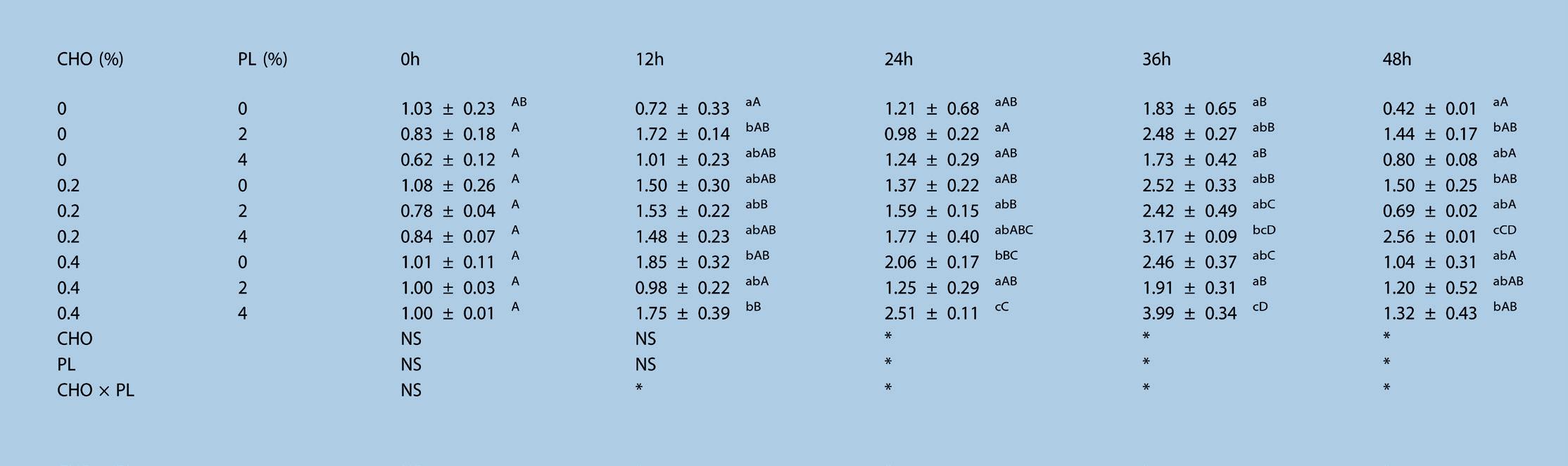
b Efectos significativos determinados por ANOVA de dos vías. Los asteriscos indican la significancia (P < 0.05). NS: no significativo, CHO × PL: interacción. a La data se expresó como media ± S.E.M. de los grupos triplicados. La data con diferentes letras minúsculas en superíndice (a, b, c y d) en una columna representan una diferencia significativa del grupo control (P < 0.05). Los valores en la misma línea con diferentes mayúsculas en superíndice (A, B, C y D) son significativamente diferentes (P < 0.05).

Fig. 1. Efectos interactivos de una dieta de colesterol y fosfolípidos sobre la resistencia contra la inyección de Vibrio alginolyticus en camarón blanco cultivado en agua dulce (Litopenaeus vannamei). La data con diferentes letras minúsculas en superíndice (a, b y c) en una columna representan una diferencia significativa del grupo control (P < 0.05).
la expresión del gen IMD y lisozima fueron positivos y relacionados a la dosis. No obstante, el estudio demostró que el CHO y PL en la dieta, y su interacción, contribuyeron a aumentar la respuesta inmune del camarón, lo que a su vez podría dar lugar a una mejor protección contra la infección por patógenos.
Es bien conocido que el camarón que vive en estanques siempre se ha visto afectado por enfermedades infecciosas, principalmente de etiología bacteriana y viral [51]. V. alginolyticus es un patógeno condicional del camarón [52]: la patogenicidad de esta bacteria está asociada con la presencia de diversos factores de virulencia y la regulación sinérgica de la expresión de estos factores por estímulos ambientales [53].
Este estudio mostró que el camarón alimentado con dietas suplementadas con CHO y PL eran menos susceptibles a la infección por V. alginolyticus. La mayor resistencia del camarón a patógenos está relacionada con su estado inmune [54]. Además, los resultados de mortalidad acumulada fueron consistentes con los cambios en la expresión del gen de lisozima y la actividad de la lisozima, respaldando informes previos que indican que la lisozima es un índice importante de resistencia bacteriana en el camarón.
En conclusión, el CHO y PL en la dieta funcionaron de manera interactiva en el contenido de proteína cruda muscular, SOD, receptor tipo Toll y la expresión de ARNm de lisozima, resistiendo contra la inyección de V. alginolyticus en L. vannamei cultivado en agua dulce. Sin embargo, no se mostró ningún efecto interactivo en los otros parámetros. Además, los niveles mejorados de PL en la dieta no resultaron en un menor gasto de CHO en este estudio.
Declaración de disponibilidad de datos
Los autores declaran que la data que respalda los resultados de este estudio están disponibles en el artículo. Contribución de los autores
Minglei Yan realizó el experimento de alimentación y determinó la composición corporal, la respuesta inmune y la prueba de resistencia al estrés. Weilong Wang redactó el manuscrito, Xinlei Wang y Yi Wang ayudaron a hacer el análisis e interpretación de la data, Xuxiong Huang diseñó la investigación. Todos los autores leyeron y dieron su aprobación final del manuscrito.
Declaración de intereses
Los autores no tienen ningún conflicto de intereses que declarar•
Para más información sobre este artículo escriba a: xxhuang@shou.edu.cn










