TEMA
Utenfor komfortsonen – den knivløse behandlingen


Utenfor komfortsonen – den knivløse behandlingen


ETHICON was the first mass producer of sterile sutures, since the release of our first catalog in 1887. And today, we are the market leader in sutures – globally, 7 out of 10 people who have surgery will receive an Ethicon suture.* ETHICON produces 600 million sutures worldwide annually – enough to circumnavigate the equator 12-15 times. Ethicon is selected time and time again by hospitals all over the world, due to our quality, reliability and wide-ranging portfolio, which deliver consistent and dependable patient outcomes. Always EXPECT MORE from Ethicon.
Vil du vite mer om våre suturer?
Ring oss på 67 51 86 00 eller besøk ortomedic.no.
Please refer always to the Instructions for Use package/insert that comes with the device for the most current and complete instructions. Ethicon Endo-Surgery (Europe) GmbH, Hummelsbütteler Steindamm 71, 22851 Norderstedt, Germany www.jnjmedicaldevices.com © Ethicon Endo-Surgery (Europe) GmbH 2019, 126336-191025 EMEA
Nr. 1 Utenfor komfortsonen – den knivløse behandlingen Nr. 2 Anoproktologi Nr. 3 Kirurgisk behandling av kronisk pankreatitt Nr. 4 Ortopedi (ikke fastsatt ennå)
Kirurgen ønsker å være en nasjonal plattform for kirurgi ved å inspirere til faglig kompetanseheving, bedre utdanning og opplæring av unge kirurger, samt øke interessen for kirurgisk forskning.

Ord fra redaktøren 5 Ord fra lederen 7
TEMA
Til alle kirurger! 8
Traumeresuscitering i 2022 11
Medikamentbruk ved kritisk blødning og reversering av antitrombotiske legemidler – protokoll i traumemottaket ved OUS Ullevål 20
Koagulasjonsboks på Traumestua i Akuttmottaket Oslo Universitetssykehus – Ullevål 22
Norsk Kirurgisk Forening Pb 17 Kjelsås, 0411 Oslo ISSN 1504-88 88
REDAKSJON
Marte Bliksøen (redaktør) OUS Rikshospitalet marte@kirurgen.no
Øyvind Werpen Skoe (webredaktør)
Vestre Viken Drammen sykehus oyvind@kirurgen.no


Saira Mauland Mansoor (redaksjonsmedlem)
OUS Ullevål. saira@kirurgen.no
Uzma Ilyas (redaksjonsmedlem)
Vestre Viken Drammen sykehus uzma@kirurgen.no
OG ANNONSESALG WebPress
Tlf.: 22 76 00 00 john@webpress.no www.webpress.no
Uten mat og drikke … Underernæring i sykehus – praktiske tips for kirurger 26 Smertebehandling etter store skader Reviderte retningslinjer ved Oslo universitetssykehus, Ullevål 36 Revisjon av nasjonal faglig retningslinje for bruk av antibiotika i sykehus: Intraabdominale infeksjoner 40

Sosionomens rolle i somatikken og traumatologien 42
Women in Trauma Surgery: Advancing Our Profession through International Collaboration 46
Zooming out 50
HØSTMØTET
24.-28. oktober 2022 52

AKTUELT
NM i laparoskopi under Høstmøteuken 2022 – meld deg på 53
Forsidebilde: Takk til Hanne Skoglund Heid (modell) og Elin V. Thorsen (fotograf)
* Median MFS: 40.4 months with NUBEQA + ADT vs 18.4 months ADT alone HR: 0.41 (95 % CI, 0.34–0.50) P<0.001.1,2 ** Median OS: NR with NUBEQA + ADT and NR with ADT HR: 0.69 (95 % CI, 0.53–0.88) P=0.003; The final analysis of overall survival was performed after 254 deaths (148 [15 %] in the darolutamide group and 106 [19 %] in the placebo group) had occurred.1,5 *** Discontinuation due to AEs was 8.9 % with NUBEQA + ADT vs. 8.7 % with ADT.1,2
INDICATION : NUBEQA is indicated for the treatment of adult men with non-metastatic castration resistant prostate cancer (nmCRPC) who are at high risk of developing metastatic disease. 1

ADT: androgen deprivation therapy; AR: androgen receptor; MFS: metastasis-free survival; nmCRPC: non-metastatic castration-resistant prostate cancer; OS: overall survival; NR: not reached; AE: adverse event.
References: 1 . NUBEQA (darolutamide) SPC, 10/2020. 2 . Fizazi K, Shore N, Tammela TL et al . N Engl J Med. 2019;380(13):1235–1246. 3 . De Santis M, Steuber T. ESMO Open 2019;4:e000484. doi:10.1136/esmoopen-2018-000484. 4 . Sykehusinnkjop (2021) LIS

OG KOLONISTIMULERENDE LEGEMIDLER. Electronical available at: https://sykehusinnkjop.no/seksjon/avtaler-legemidler/Documents/Onkolo gi/Onkologiske-ogkolonistimulerende%20legemidler.pdf on the 14th September 2021. 5. Fizazi K, Shore N, Tammela T et al N Engl J Med. 2020;383:1040–1049.
▼ NUBEQA® (darolutamid) 300 mg filmdrasjerte tabletter. ATC-nr: L02B B06 Indikasjoner: Til behandling av voksne menn med ikke-metastatisk, kastrasjonsresistent prostatakreft (nmCRPC), som har høy risiko for å utvikle metastatisk sykdom. Dosering: Anbefalt dose er 600 mg (2 tabletter à 300 mg) 2 ganger daglig, tilsv. total daglig dose 1200 mg. Medisinsk kastrasjon med GnRH-analog skal fortsette under behandling hos pasienter som ikke er kirurgisk kastrert. Kontraindikasjoner: Overfølsomhet for virkestoffet eller noen av hjelpestoffene (laktose). Kvinner som er eller kan bli gravide. Forsiktighetsregler: Pasienter med alvorlig nedsatt nyrefunksjon eller moderat/alvorlig nedsatt leverfunksjon skal overvåkes nøye mht. bivirkninger pga. forhøyet eksponering. Hjerte/karl: Sikkerhet er ikke fastslått ved kardiovaskulær sykdom de siste 6 månedene. Ved forskrivning skal pasienter med klinisk signifikant kardiovaskulær sykdom behandles for disse tilstandene iht. fastsatte retningslinjer. Ved risikofaktorer for QT-forlengelse i anamnesen og ved samtidig bruk av legemidler som kan forlenge QT-intervallet, skal nytte-/risikoforholdet vurderes, inkl. potensialet for torsades de pointes, før oppstart med darolutamid. Pasienter skal overvåkes med hensyn til bivirkninger av BCRP-, OATP1B1- og OATP1B3 substrater, fordi samtidig administrering av daroluta mid kan øke plasmakonsentrasjonen av disse substratene. Samtidig administrering av rosuvastatin bør
Bayer AS, Postboks 193, 1325 Lysaker
unngås, med mindre det ikke finnes andre behandlingsalternativer. Bivirkninger: Svært vanlige (≥ 1/10) Fatigue/astenitilstander, redusert antall nøytrofile, økt bilirubin, økt ASAT. Vanlige (≥ 1/100, < 1/10) Iskemisk hjertesykdom og hjertesvikt, utslett, smerte i ekstremitet, muskler og skjelett, fraktur. Basert på SPC godkjent av SLV/EMA: 10/2020. Konsulter preparatomtalen (SPC) for mer informasjon. Pakninger og priser: 112 stk. (blister) AUP 46.636,30 NOK Varenr: 063426. R.gr. C, H-resept For oppdaterte priser se; www.felleskatalogen.no. Kontaktinformasjon: Bayer AS, Drammensveien 288, NO-0283 OSLO, Postboks 193, 1325 Lysaker. Tlf: +47 23 13 05 00, Faks: +47 23 13 05 01, www.bayer.no.
▼ Dette legemiddelet er under spesiell overvåkning for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Du kan bidra ved å melde enhver mistenkt bivirkning via relis.no.
PP-NUB-NO-0013-2 Desember 2020

Det kan ikke være spesielt vågalt å påstå at 2022 startet (om tenkelig) enda verre enn 2021 sluttet. Mens første nummer av Kirurgen 2022 går i trykken står store deler av verdensbefolkningen fortsatt midt oppi covid-sykdom. Dette til tross for håndsprit, munnbind, lock down og fle re vaksinasjonsrunder. Vi skal være takknemlig for at det var omikron-varianten som til slutt løp løpsk og ikke en tidligere variant av viruset.
Så, i løpet av februars siste dager, kastes Europa (og ver den) ut i invasjon, sanksjoner og trussel om bruk av atom våpen. Med det som føles som tåspissene på kanten av en potensiell ny verdenskrig har Norges befolkning støvsugd markedet for jod-tabletter. Vips så var pandemien over og verdens klimautfordringer ble satt på vent. Hvem vet hvordan verden ser ut når dette nummeret endelig ligger
i postkassen. Kanskje dreier «utenfor komfortsonen» seg om noe helt annet enn Kirurgens første utgave i 2022. Men, temaet som presenteres på de kommende sidene ER viktig i den daglige behandlingen av kirurgiske pasien ter. Pasientene helbredes ikke kun ved hjelp av en kniv og litt smertelindring. For best mulig pasientresultat, er det viktig at vi som kirurger også holder oss oppdatert på tilgrensende fagområder. Jeg har derfor sett frem til nettopp dette nummeret. Det omhandler ikke spydspiss teknologi og fantastiske nye behandlingsstrategier, men enkle og praktiske tips om transfusjon, reversering av koagulasjon, ernæring, smertelindring og oppdaterte ret ningslinjer for bruk av antibiotika med mer. Her har dere det viktigste samlet på ett sted. Temaet i dette nummeret er enkelt og greit, og faktisk mulig å huske og ta med seg i hverdagen! God lesing!
Mitomycin medac 40 mg pulver og væske til intravesikaloppløsning
Indikasjoner: Mitomycin medac er indisert for intravesikal administrasjon som profylakse mot tilbakefall hos pasienter med overflatisk blærekarsinom etter transuretral reseksjon. Kontraindikasjoner: Overfølsomhet overfor virkestoffet(ene) eller overfor noen av hjelpestoffene. Amming, Perforasjon av blæreveggen, Cystitt. Advarsler og forsiktighetsregler: Ekstravasasjon etter intravesikal administrasjon: Symptomer på ekstravasasjon etter intravesikal mitomycinadministrasjon kan være til stede rett etter bruk eller uker eller måneder senere. Det kan være uklart om ekstravasasjonen oppsto som følge av uoppdaget perforasjon, en fortynnet muscularis propria eller om legemidlet ikke ble korrekt administrert. På grunn av mitomycins toksiske effekt på benmargen må andre behandlingsmodaliteter som virker hemmende på benmargen (spesielt andre cytostatika og strålingsbehandling) administreres med særlig forsiktighet for å minimere risikoen på ytterligere benmargssuppresjon. Langvarig terapi kan resultere i kumulativ benmargstoksisitet. Benmargssuppresjon blir først synlig etter en forsinkelse, sterkest etter 4 – 6 uker, og akkumuleres etter lengre bruk og krever derfor ofte en individuell dosejustering. Eldre pa sienter har ofte redusert fysiologisk funksjon og benmargssuppresjon, som kan ha et forlenget forløp, og hos denne populasjonen må mitomycin derfor administreres med særlig forsiktighet mens pasientens tilstand overvåkes nøye. Mitomycin er en substans som er mutagent og potensielt karsinogent for mennesker. Kontakt med hud og slimhinner skal unngås. Når det oppstår pulmonale symptomer som ikke kan tilskrives underliggende sykdom skal behandlingen seponeres umiddelbart. Pulmonal toksisitet kan behandles på en god måte med steroider. Behandlingen skal også seponeres umiddelbart ved symptomer på hemolyse eller tegn på ny-resvikt (nefrotoksisitet). Forekomst av hemolytisk-uremisk syndrom (irreversibel nyresvikt [HUS], mikroangiopatisk hemolytisk anemi [MAHA-syndrom] og trombocytopeni) er vanligvis fatalt. Det er observert mikroangiopatisk hemolytisk anemi ved intravenøse doser > 30 mg mitomycin/m² kroppsover-flate. Nøye overvåking av nyrefunksjonen anbefales. Ingen tilfeller av MAHA er observert hittil etter intravesikal bruk av mitomycin. Nye funn tyder på at en terapeutisk prøveperiode kan være hensiktsmessig for å fjerne immunkomplekser, som ser ut til å spille en stor rolle når symptomer oppstår for første gang, ved hjelp av immunadsorpsjon med stafylokokkprotein A-kolonner. Forekomst av akutt leukemi (i noen tilfeller etter en preleukemisk fase) og myelodysplastisk syndrom er rapportert hos pasienter som fikk samtidig intravenøs behandling med mitomycin og andre antineoplastiske midler. Bivirkninger: Bivirkninger er listet opp nedenfor etter organklassesystem og frekvens. Frekvensene er definert på følgende måte: Svært vanlige (>1/10), vanlige (> 1/100 til < 1/10), mindre vanlige (> 1/1000 til < 1/100), sjeldne (> 1/10 000 til < 1/1000), svært sjeldne (< 1/10 000), og ikke kjent (kan ikke anslås ut ifra tilgjengelige data). Mulige bivirkninger under intravesikal behandling: Bivirkninger kan oppstå enten på grunn av oppløsningen til intravesikal instillasjon eller etter dyp reseks-jon. De mest vanlige bivirkningene av intravesikal administrering av mitomycin er allergiske hudreaksjoner i form av lokalt eksantem (f.eks. kontaktdermatitt, også i form av palmar- og plantarerytem) og cystitt. Hud- og underhudssykdommer: Vanlige: Allergisk hudutslett, kontaktdermatitt, palmar-/plantarerytem, pruritus. Sykdommer i nyre og urinveier: Vanlige: Cystitt (muligens hemoragisk), dysuri, nokturi, pollakisuri, hematuri, lokal irritasjon av blæreveggen. De mest vanlige bivirkningene av systemisk administrert mitomycin er gastrointestinale symptomer som kvalme og oppkast, og benmargssuppresjon med leukopeni og vanligvis dominant trombocytopeni. Denne benmargssuppresjonen opptrer hos opptil 65 % av pasientene. Hos opptil 10 % av pasientene må alvorlig organtoksisitet i form av interstitiell pneumoni eller nefrotoksisitet forventes. Mitomycin er potensielt hepatotoksisk. Sykdommer i blod og lymfatiske organer: Svært vanlige: Benmargssuppresjon, leukopeni, trombocytopeni. Vanlige: Interstitiell pneumoni, dyspné, hoste, kortpustethet. Svært vanlige: Kvalme, oppkast. Hud- og underhudssykdommer: Vanlige: Eksantem, allergisk hudutslett, kontaktdermatitt, palmar-/plantarerytem. Mindre vanlige: Alopesi. Sykdommer i nyre og urinveier: Van lige: Ny-resvikt, økt kreatininnivå i serum, glomerulopati, nefrotoksisitet. Generelle lidelser og reaksjoner på administrasjonsstedet: Vanlige: Etter ekstravasasjon: cellulitter, vevsnekrose. Mindre vanlige: Feber. Emballasje (type og innhold): Mitomycin medac leveres i et klart hetteglass (type I-glass) med gummipropp av bromobutyl som er dekket av fluorplast, og et flip-off-lokk med aluminiumsforsegling. Pakninger med 1 hetteglass (50 ml), 1 PVC-pose på 40 ml med natriumklorid 9 mg/ml (0,9 %) oppløsning, med/uten katetre. Pakninger med 4 hetteglass (50 ml), 4 PVC-poser på 40 ml med natriumklorid 9 mg/ml (0,9 %) oppløsning, med/uten katetre. Pakninger med 5 hetteglass (50 ml), 5 PVC-poser på 40 ml med natriumklorid 9 mg/ml (0,9 %) oppløsning, med/uten katetre. Ikke alle pakningsstørrel-ser vil nødvendigvis bli markedsført. Se gjeldende pris på: www.felleskatalogen.no. Utlevering: Reseptpliktig legemiddel, Reseptgruppe C. ATC-Kode: L01DC03. National version, SPC: 19.01.2021.
BCG-medac (Bacillus Calmette-Guérin), pulver og væske til intravesikalsuspensjon
Virkestoff: Tuberkulosebakterier levende Bacillus Calmette-Guerin (BCG) bakterier stamme RIVM fra stamme 1173-P2



Indikasjoner: Behandling av ikke-invasiv urotelial blærekreft (karsinom): kurativ behandling av karsinom in situ, profylaktisk behandling av re-kurrens av: urotelial karsinom begrenset til mucosa: Ta G1G2 hvis multifokal og/eller rekurrent tumor, Ta G3, urotelial karsinom i lamina propria, men ikke i blærens muskulatur (T1), karsinom in situ. Kontraindikasjoner: Overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene. BCG-medac skal ikke brukes av pasienter med immunsuppresjon, eller av personer med kongenitale eller akvirerte immundefekter, enten forårs-aket av sykdom (f. eks. positiv HIV serologi, leukemi, lymfom), kreftbehandling (f. eks. cytostatiske legemidler, strålebehandling) eller immunterapi (f. eks. kortikosteroider). BCG-medac skal ikke administreres til personer med aktiv tuberkulose. Risiko for aktiv tuberkulose må utelukkes ved grundig anamnese og, hvis indisert ved diagnostiske tester, i samsvar med lokale retningslinjer. Tidligere strålebehandling av blæren. Be-handling med BCG-medac er kontraindisert for ammende kvinner. BCG-medac skal ikke instilleres før 2 til 3 uker etter TUR, blærebiopsi eller katetertraumatisering. Blæreperforasjon, akutt urinveisin feksjon. Advarsler og forsiktighetsregler: BCG-medac skal ikke brukes til subkutan, intradermal, intramuskulær eller intravenøs administrasjon eller vaksinasjon. Bivirkninger: Lokale eller systemiske symptomer under behandling med BCG-medac kan påvirke evnen til å kjøre bil eller bruke maskiner. Innenfor hver frekvensgruppering er bivirkninger presentert etter synkende alvorlighetsgrad. Infeksiøse og parasittære sykdommer Svært vanlige: Cystitt og betennelse (granulom) i blæren, asymptomatisk granulomatøs prostatitt. Mindre vanlige: Urinveisinfeksjon, orkitt, epididymitt, symptomatisk granulo matøs prostatitt, alvorlig systemisk BCG-reaksjon/infeksjon, BCG-sepsis, miliær pneumonitt, hudabscess, Reiters syndrom (konjunktivitt, asymmetrisk oligoartritt, og cystitt). Forstyrrelser i immunsystemet Svært vanlige: Forbigående systemisk BCG-reaksjon (feber < 38,5 °C, influensalignende symptomer, inkludert illebefinnende, feber, frysninger, generelt ubehag, myalgi). Mindre vanlige: Pulmonal granu loma. Gastrointestinale sykdommer Svært vanlige: Kvalme. Vanlige: Diaré. Sykdommer i muskler, bindevev og skjelett Vanlige: Myalgi. Mindre vanlige: Artritt, artralgi. Sykdommer i nyre og urinveier Svært vanlige: Hyppig vannlating med ubehag og smerte. Mindre vanlige: Makroskopisk hematuri, blæreretensjon, urinveisobstruksjon, kontraktert blære. Generelle lidelser og reaksjoner på administrasjons stedet Vanlige: Feber > 38,5 °C. Mindre vanlige: Hypotensjon. Bivirkninger ved BCG-behandling er hyppige, men generelt milde og forbigående. Bivirkningene øker vanligvis med antallet BCG-instil lasjoner. Emballasje (type og innhold): Pulver på hetteglass (type I glass) med gummipropp + 50 ml væske i en pose (PVC) med et koblingsstykke og en kateteradapter (konisk eller Luer-Lock adapter). Pakningsstørrelser (konisk adapter): 1, 3, 5 eller 6 med/uten kateter. Pakningsstørrelser (Luer-Lock adapter): 1 eller 3 med/uten kateter. Ikke alle pakningsstørrelser vil nødvendigvis bli markedsført. Se gjeldende pris på: www. felleskatalogen.no. Utlevering: Reseptpliktig legemiddel. Reseptgruppe C. ATC-Kode: L03AX03. National version, SPC: 07.06.2021. For fullstendig produktinformasjon: www.legemiddelverket.no / www.felleskatalogen.no



Torsdag den 24. Februar 2022 skjedde det som for de fles te var utenkelig. Med Russlands angrep på Ukraina fikk vi igjen en storkrig i Europa. Med samme løgner som Hitler brukte mot Polen i 1939 valgte Vladimir Putin å angripe et naboland med mål om å underlegge seg et fritt land og folk. Raskt ble det klart at denne krigen med «presisjons våpen» ikke skulle bli annerledes noen andre kriger. Stadig nye skrekkbilder fra Ukraina bekreftet enorme ødeleggelser og en sivilbefolkning fanget i kryssilden. Skadde, drepte og hundretusenvis på flukt fra sine hjem.
Arnulf Øverlands Du må ikke sove surrer i bakhodet mens verdens ledere diskuterer sanksjoner og støtte. Samtidig går tankene til våre kirurgiske kolleger i Ukraina som i fremste linje på sykehusene står midt oppi krigens bru taliteter.
Norsk Kirurgisk Forening fordømmer Russlands an grep på Ukraina og vi kommer til å tilby bistand til våre Ukrainske kolleger der vi får mulighet. Det har blitt etter spurt, og vi har tilbudt, undervisning via zoom innen alle kirurgiske spesialiteter i NKF. Videre mulighet for bistand vurderes løpende.
Krig er forakt for liv advarte Nordahl Grieg i 1936. Dess verre trenger verden fortsatt denne advarselen i dag.
På vegne av styret i NKF John Christian F. Glent Leder NKF

Selv om Kirurgen ikke er Pubmed-indeksert eller fagfelle vurdert, har bladet stor nytteverdi for kirurger i Norge. Det som publiseres, holder jevnt over høyt faglig nivå og fremstår oftest som praktisk og nyttig. I disse tider, med mye skjermtid, er det dessuten fantastisk å kunne hygge seg med et fysisk tidsskrift med flott layout!
Vel inne i 2022 og med håp om at dette året vil bli godt, både faglig og sosialt! Etter nesten to år med pandemi er det mange tanker som gjør seg gjeldende. Vi skulle selv sagt helst vært Covid-19 foruten, men det har kanskje kommet noe konstruktivt ut av den også? Vi har i hvert fall erfart at fagområder langt unna hverandre til daglig kan påvirke hverandre. Covid-19 har medført endringer i hvordan vi håndterer våre kirurgiske pasienter, både kapasitetsmessig og logistisk. Dette har nok påvirket behandlingen av andre tilstander, samtidig som vi er blitt bedre på smittevern. Vi har tilegnet oss nye måter å kommunisere på og rukket å erkjenne at ikke all kom munikasjon kan erstattes av nettbaserte løsninger. Vi har lært oss å savne den delen av fysiske møter som ikke kan planlegges i detalj, nemlig nettverksdelen. De av oss som var så heldige å være til stede på Ullevål MEET under Høstmøtet eller har rukket å være med på internasjonale kongresser i den korte perioden det var mulig i 2021, er ikke i tvil om at fysiske møter fortsatt er uvurderlige både faglig og sosialt.
Så hva er tanken bak temadelen i dette nummeret av Kirurgen med tittelen «UTENFOR KOMFORTSONEN – den knivløse behandlingen»? Uavhengig av pande mien har kirurgien lenge utviklet seg i retning mer subspesialisering, der teknologisk utvikling, utdannings regler og arbeidstidsbestemmelser i stadig større grad medfører at kirurger jobber med smalere kirurgiske felt. Det blir derfor mindre tid til å tilegne seg kunnskap i randsonen av arbeidet vi utfører til daglig. Vi har valgt ut noen temaer utenfor komfortsonen for mange – der vi foreslår løsninger eller enkle retningslinjer, eller bare tilbyr lesing til ettertanke!
Den kritisk dårlige eller blødende akuttkirurgiske eller traumepasienten utfordrer de fleste av oss. Protokoller og retningslinjer, innøvd teamarbeid og kunnskap om rollene/faget til de andre i teamet er forutsetninger for å optimalisere kvaliteten i behandlingen av denne typen pasienter. ECTES er Europas største traume- og akutt kirurgiske kongress og arrangeres av ESTES (European Society for Trauma and Emergency Surgery) i Oslo 2426/4, 2022. Presidenten i ESTES, professor Inger Schipper, skriver om akuttkirurgien i Europa og nytteverdien av å utveksle kunnskap og erfaringer, der vi alle har erfart at fysiske møter har kvaliteter som det virtuelle ikke kan erstatte. Dere kan ikke gå glipp av denne muligheten til å være med å bygge opp et enda sterkere europeisk nett verk!
Noe av det mest krevende i akuttkirurgien er behandlin gen av den kritisk blødende pasienten. Her er det viktig med kunnskap og godt innarbeidede tverrfaglige proto koller. Kjersti Baksaas-Aasen og Anders Holtan, begge overleger i anestesi og traumatologi, har hjulpet oss med å lage konkrete retningslinjer for resuscitering av dis se pasientene. I tillegg opplever vi at pasientene våre i økende grad behandles med stadig flere antikoagulantia. Når og hvordan man reverserer effekten av slike medi kamenter i en akuttsituasjon er beskrevet i prosedyren utarbeidet av overlege og traumeansvarlig anestesiolog ved OUS, Nils Oddvar Skaga.
Opiatkrisen har fått mye oppmerksomhet i USA, men er til stede i Norge også. Som kirurger behandler vi pasien ter med smerter og ved å operere påfører vi pasienter smerte som potensielt varer utover sykehusoppholdet. Dette er tilstander som vi ikke kan forutsette at fast legene vet hvordan de skal håndtere. Er det mulig at vi kan hjelpe til med å redusere kronisk bruk av sterke analgetika ved å være mer bevisste? Bør vi bruke mer tid på å snakke med pasientene om smerte og toleranse for smerte? Er vi gode nok til å benytte alternativer til opiater i sykehus? Lager vi tydelige planer for nedtrap ping ved utskrivelse og videre håndtering for fastlegen der endelig nedtrapping ikke kan skje i løpet av kort tid? Anestesioverlegen Øyvind Hornstuen og Johan Ræder og traumekoordinator Knut Magne Kolstadbråten har utgitt en praktisk smerteveileder som gjengis for dere i dette nummeret av Kirurgen.
Vi vet at pasienter som er innlagt på sykehus, ikke minst kirurgiske pasienter, ofte ikke får i seg nok eller rik tig næring. Klinisk ernæringsfysiologer er en begren set ressurs ved de fleste sykehus, og dermed må mange av ernæringsspørsmålene besvares av klinikerne selv. Kan du nok om ernæring? Elin V. Thorsen er gastro- og traumekirurg ved OUS og utdannet klinisk ernærings fysiolog. Hun gir deg her de nyttige tommelfingerreglene og den grunnleggende kunnskapen du trenger for å takle de vanligste utfordringene innen dette feltet.
Mange kirurger opplever at riktig valg og varighet av anti biotikabehandling ved bukinfeksjoner er utfordrende og kan medføre stereotype valg som for eksempel Tazocin til alle infeksjoner. Når nøden er størst kan hjelpen være
nær. Et bredt sammensatt fagnettverk, ledet av Bjørn Waagsbø, infeksjonsmedisiner ved St. Olavs hospital, har gjennom de siste 2-3 årene jobbet med revisjon av Nasjo nal faglig antibiotikaretningslinje i regi Helsedirektoratet. Reviderte anbefalinger for intraabdominale infeksjoner er planlagt publisert snart og da dette berører en rekke infeksjoner som normalt ivaretas i kirurgiske avdelinger, tilbyr vi dere et sammendrag i dette nummeret.
Det å bli innlagt akutt i sykehus representerer en krise for pasienten, men også ofte for de rundt. Det er ikke bare tilstanden i seg selv som skaper reaksjoner, men ofte praktiske og økonomiske konsekvenser av tilstanden og behandlingen. I en akutt krise er det ikke gitt at pasienten selv eller nettverket rundt har overskuddet eller evnene til å finne frem i jungelen av trygdelover og andre ret tigheter og muligheter/tilbud. Rachel Jørgensen er klinisk sosionom med bakgrunn fra NAV og familierelasjoner. Hun har de siste årene vært ansatt som traumesosionom ved OUS. Hun deler her sine tanker rundt sosionomens rolle ved akutt sykdom og skade. Erfaringen tilsier at behovet for og nytten av denne typen kunnskap/assistan se er større enn både pasienten og vi som behandlende helsepersonelll er oppmerksomme på.
Pandemien har minnet oss om forskjellene i verden, ikke minst når det gjelder tilgang til ressurser. Globalt er helsevesenet fortsatt preget av betydelig forskjells behandling, både mellom kjønn og ulike etniske bakgrun ner. Mange internasjonale foreninger og organisasjoner som WHO, ACS, IATSIC, ESTES har satt disse temaene på dagsordenen. Vi bor i et svært privilegert hjørne av verden, men det betyr ikke at vi ikke kan bli bedre også her. Innenfor kirurgien er det fortsatt mulighet for forbedring i så måte. Professor Eileen Bulger fra Seattle har ledet ACS COT i flere år, er innkommende president i AAST (American Association for the Surgery of Trauma), og var med å opprette WITS (Women in Trauma Surgery), i begynnelsen av pandemien. Hun meddeler sine tanker til oss som avslutning på det vi håper blir et nyttig num mer av Kirurgen, og ett til ettertanke!
Hvert år dør fem millioner mennesker i verden som følge av skader (1), og i Norge er dette tallet cirka 2000 (2). Traumatiske hodeskader er den vanligste dødsårsaken, men massive blødninger er den viktigste årsaken til død som kunne vært unngått ved forbedret og moderne behandling («preventable death») (3). Forbedrede behandlingsprotokoller og forståelse av traumefysiologien har ført til en betydelig reduksjon i dødeligheten hos alvorlig skadde traumepasienter (4), men mer kan vinnes om protokoller følges i enda større grad.
Veien til moderne traumeresuscitering har vært en naturlig utvikling siden før første verdenskrig, som en følge av økende kunnskap om patofysiologi og biologi hos traumepasienten og tilgjengelige produkter og metoder. Fokuset har vært på å stadig forbedre behandlingen, for å redde sykere pasienter. Fra å kun fokusere på gjenopp rettelse av sirkulerende volum, til senere også på å sikre oksygenbærende kapasitet, har man i dag et helhetlig fokus på gjenopprettelse av sirkulerende volum, oksygen bærende kapasitet og koagulasjonstiltak, som gjør at det livgivende og livreddende blodet holder seg i blodbanen.
En annen utvikling som har forbedret utfallet etter traumer, er konseptet ”Damage Control Surgery” (DCS), beskrevet på 80-tallet (5). DCS var basert på at dødelig het og sykelighet hos alvorlig skadde traumepasien ter, med begrensede fysiologiske reserver, ikke bare var forårsaket av de faktiske skadene, men også av den fysiologiske utmattelsen fra definitiv kirurgi. Målet med
DCS var derfor å forkorte kirurgitiden gjennom kun å fokusere på blødnings- og kontaminasjonskontroll, slik at perifer sirkulasjon så raskt som mulig ble reetablert. DCS ble etterfulgt av overføring til intensivavdeling, hvor fysiologien ble gjenopprettet og pasienten ble varmet opp. Når fysiologien ble ansett som normal, gjennomgikk pasienten definitiv kirurgi (6). DCS ble raskt standar den for massivt blødende traumepasienter. Operasjons prinsippet, sammen med volumresuscitering, førte til økt overlevelse, men også en betydelig økning i multiorgan svikt.
Før det 21. århundre ble koagulasjon hos traume pasienter sett på som iatrogen, forårsaket av forbruk, tap og fortynning av koagulasjonsfaktorer og forverret av hypotermi og acidose. I 2003 ble denne tradisjon elle forståelsen av koagulopati ved traumer endret av to samtidig publiserte, men uavhengige, studier (7,8). Disse studiene beskrev en endogen koagulopati hos 25 30% av de mest alvorlig skadde og blødende pasient ene, uavhengig av resuscitering. Koagulopatien økte med skadens alvorlighetsgrad og medførte betydelig høyere dødelighet. Som en konsekvens av disse studie ne skiftet fokuset i forskningen mot å karakterisere og korrigere den endogene koagulopatien (9). Prinsippene for traumeresuscitering ble dermed endret til balan sert transfusjon med blodprodukt i et forhold tilnærmet likt fullblod, begrenset bruk av krystalloider, permissiv hypotensjon og DCS. Konseptet ble kalt ”Damage Control Resuscitation” (DCR) og er i dag det ledende konseptet for traumeresuscitering (10).
I Norge har vi generelt trygge blodprodukter. Av de vanligste blodproduktene kan man skille mellom erytrocytt- (SAG) og trombocyttkonsentrater (TRC), pro dusert i blodbankene, i motsetning til Octaplasma som er et kommersielt legemiddel. Når blod doneres i blodban ken samles det i en pose hvor det blant annet er tilsatt citrat som hindrer koagulasjon. Dette er oftest den eneste gangen blodet tilsettes citrat. Blodet blir sentrifugert og deles således i en rød og tung del nederst i posen, og en lettere og gul del øverst i posen. Blodfraksjonene tappes videre i andre poser og mesteparten av citratet ender opp i det gule plasmaet. De røde blodlegemene tappes over i en pose med SAGMAN-løsning og har sitt navn herfra. I Norge fryses plasmaet ned og sendes til utlandet for pro duksjon av plasmaprodukter, inkludert Octaplasma. Ved transfusjon må man for alle blodproduktene ta hensyn til blodtype.

I Norge har SAG i mange år vært filtrert for hvite blodlegemer. Man tror at dette medfører færre immunologiske komplikasjoner ved transfusjon. Akutt hemolytisk trans fusjonskomplikasjon på grunn av ABO-uforlikelighet ved transfusjon av SAG er regnet som den alvorligste trans fusjonskomplikasjonen. Dette skyldes ofte menneskelig feil, for eksempel manglende dobbel-id-kontroll, ved at feil blod blir gitt til feil pasient. Slike feil skjer om lag én gang i året i Norge.
I Norge brukes Octaplasma (Octapharma AS) som plasmaprodukt. Octaplasma er et standardisert produkt, fra 600-1500 givere per enhet, og ansees relativt trygt. Octaplasma oppbevares fryst i blodbanken og må tines før bruk. Etter tining kan man oppbevare Octaplasma i kjøleskap i inntil fem døgn. Ferskfrosset plasma (fra én giver) brukes i andre land og er ofte assosiert med trans fusjonsrelatert akutt lungeskade (TRALI). Dette er aldri blitt rapportert ved bruk av Octaplasma. Den vanligste alvorlige transfusjonsreaksjon for Octaplasma er sann synligvis anafylaksi.

TRC er et litt komplisert produkt både med tanke på blod typer, produksjon og oppbevaring. En terapeutisk enhet TRC tilsvarer trombocytter fra cirka fire givere og i alt cirka 240-359 x109 trombocytter. Da det forekommer små mengder erytrocytter i TRC bør det gis Rhesus-Dprofylakse ved transfusjon av TRC fra Rhesus-D-positiv giver til Rhesus-D-negative kvinner/jenter.
En felles utfordring for alle blodprodukter er trans fusjonsrelatert kardiovaskulær overbelastning (TACO) og mer aggressiv bruk av blodprodukter vil sannsynlig vis medføre flere tilfeller. Typiske symptomer på TACO er takykardi, hypertensjon og kliniske tegn på nedsatt sirkulasjon.
SAG og Octaplasma bør oppbevares i kjøleskap etter ut levering, med mindre det skal transfunderes med en gang, mens TRC oppbevares i romtemperatur. Felles for alle produktene er at man ved mistanke om trans fusjonsreaksjon skal stanse transfusjonen umiddelbart, kontakte ansvarlig lege, behandle symptomer og vurde re utredning. På Helsedirektoratet sine nettsider finnes veiledninger for diagnostikk og behandling av trans fusjonsreaksjoner, en definisjonskatalog for transfusjonsreaksjoner, lenke til meldeordning for transfusjons reaksjoner, og de såkalte hemovigilansrapportene (11).
For kirurger er transfusjoner ofte knyttet til det peri operative forløpet. Preoperativ anemi er blant annet assosiert med økt morbiditet og mortalitet. Dette må derfor sees på som en kronisk sykdom som bør utredes og behandles, ikke bare avvikende blodprøver som kan fikses med transfusjon. Postoperativt vil de fleste kirur giske pasienter ikke trenge transfusjoner, og med årene har lavere hemoglobin-verdier blitt akseptert uten behov for transfusjon. Per i dag aksepteres generelt en hemo globin verdi > 7g/l for de fleste pasienter uten pågående blødning, med unntak for enkelte pasientgrupper (som for eksempel pasienter etter hjerneblødning eller med alvorlig hjertesykdom).
Alle pasienter med sjokk må resusciteres for å gjenopp rette normal organperfusjon og oksygenering. Sjokk kan være vrient å diagnostisere og kan skyldes hypovolemi på grunn av en blødning som har stoppet eller en katas trofe under oppseiling hos en nylig skadet pasient. Tidlig identifisering av pågående blødning er uansett en hjørnestein i traumehåndteringen.
Sympatikusaktivering med blant annet perifer vaso konstriksjon kan bevare hjerte-minuttvolum, blodtrykk og makrosirkulasjon, men det har ofte en kostnad med utilstrekkelig oksygenering på cellenivå. Ved traumer er utilstrekkelig hjerteminuttvolum og organperfusjon ikke nødvendigvis assosiert med hypotensjon, kun når blod tap er kritisk eller raskt innsettende er det en sammen heng mellom disse (12).
På grunn av mangelen på objektive parametere foreslår Advanced Trauma Life Support (ATLS) fortsatt bruk av kliniske parameter for å identifisere blødende pasienter og for å estimere blodtap (13). En annen foreslått frem gangsmåte for å identifisere blødende traumepasienter har vært å gi pasienten en volumbolus og vurdere responsen. Dersom pasienten har tegn på blødning og

er en «non-responder» eller «forbigående responder» på volumbolus, bør pasienten forventes å være aktivt blø dende (14). Denne strategien er imidlertid kontroversiell (12). En bolus av krystalloider vil fortynne og potensielt forverre en koagulopati, mens bruk av blodprodukter fra begynnelsen kan forårsake unødvendige transfusjoner hos enkelte pasienter.
Ulike skåringssystemer har blitt utviklet i forsøk på å identifisere blødende pasienter, men fortsatt er ingen av dem tilstrekkelig robuste til å pålitelig forutsi massiv transfusjon (15).
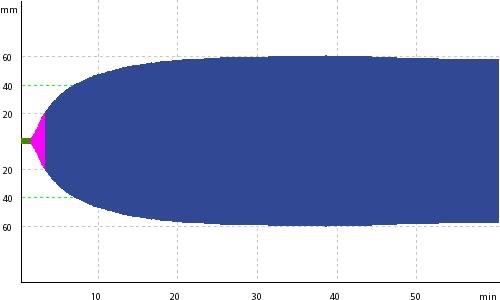
Måling av systemiske parametere for organperfusjon, som laktat og baseoverskudd (BE), kan gi et estimat av alvorlighetsgraden av sjokket. Hos traumepasienter uten eksisterende komorbiditet er det en sterk korrela sjon mellom standardparameterne for laktacidose og prediksjon av utfall (12). Korreksjon av laktat og BE bru kes derfor som et mål på respons på resuscitering. En ulempe er at arterielle blodgasstester ikke gir kontinuer lige målinger. Ulike teknikker for kontinuerlig måling av alvorlighetsgraden av sjokk og organperfusjon er under søkt, men foreløpig eksisterer det ingen pålitelige konti nuerlige målemetoder.

De aller fleste traumepasienter har ikke en massiv pågående blødning, men har blødd eller tapt volum slik at pasienten er relativt hypovolem. En praktisk tilnærming for å identifisere traumepasienter med pågående blød ning er derfor en kombinasjon av fysiologi, skadens alvor

lighetsgrad og respons på initial resuscitering, noe som krever tverrfaglig teamarbeid og kommunikasjon (12).
Ved mistanke om en akutt pågående massiv blødning, skal pasientene behandles i henhold til DCR-protokoller med en balansert transfusjonsratio av SAG, plasma og TRC, samt med Traneksamsyre (TXA) og fibrinogen etter behov. Disse prinsippene vil gjennomgås under.
Pasienter med relativ hypovolemi, uten stor pågående blødning eller der det er oppnådd blødningskontroll, trenger ikke nødvendigvis å behandles etter DCRprinsipper med balanserte transfusjonsratioer. Disse pasientene kan ha behov for målrettede transfusjoner og gjenopprettelse av normovolemi. Dette kan innebære Octaplasma-transfusjoner for å unngå iatrogen koa gulopati og SAG for å opprettholde en adekvat oksygen bærende kapasitet. Man manøvrerer her i et vanskelig landskap mellom vedtatte prinsipper om å ikke bruke blodprodukter som volumerstatning alene og risiko for iatrogen skade. Krystalloidinfusjoner for gjenopprettel se av sirkulerende volum vil ved stor hypovolemi med føre risiko for resusciteringskoagulopati, og det vil kreve betydelig mer volum enn for eksempel bruk av Octa plasma, med de medfølgende risikoer dette innebærer, som ødem med økende diffusjonsavstand, kompartmentsyndrom og multiorgansvikt.
TRC og hemostatika som TXA og fibrinogen har per i dag ingen plass i behandlingen av pasienter uten pågående blødning, uavhengig av laboratorieverdier.

Vasopressorer har blitt antatt å motvirke vasoplegi rela tert til sjokk. Imidlertid har vasopressorer et bredt spek ter av potensielle bivirkninger, og konklusjonen fra pu bliserte studier kan tyde på at bruk av vasopressorer er assosiert med økt dødelighet (12). Foreløpig er det ingen bevis for å inkludere vasopressorer i den første resusci tering av pasienter med pågående blødninger og tilstrek kelig blodtrykk til å opprettholde organperfusjon bør ivaretas med blodprodukter og kirurgiske inngrep. Etter oppnådd blødningskontroll og korrigering av syre-/basestatus kan derimot vasopressor være aktuelt for å unn gå overvæsking, og for å kompensere for vasodilatasjon forårsaket av medikamenter og inflammasjonsprosesser.
DCR retter seg direkte mot å unngå den dødelige triaden av hypotermi, fortynning og acidose. Dette består hoved sakelig av DCS, hemostatisk resuscitering og permis siv hypotensjon (12,14,16). DCS innebærer å kontrol lere blødningen og kontamineringen med rask kirurgi. Hemostatisk resuscitering inkluderer blodprodukter i et balansert forhold tilnærmet fullblod. Fullblod i seg selv brukes i noen grad enkelte steder, men i Norge er bru ken stort sett begrenset til enkelte legebemannede pre hospitale enheter. Permissiv hypotensjon innebærer å akseptere et lavere enn normalt, men antatt tilstrekkelig blodtrykk, mens pasienten aktivt blør. Ved blødnings kontroll gjenopprettes normal perfusjon. De europeiske retningslinjene for behandling av større blødninger og koagulopati etter traumer anbefaler systolisk blodtrykk 80-90 mmHg (MAP 50-60 mmHg) ved pågående blødning,
unntatt ved mistanke om hodeskade hvor det anbefales MAP over 80 mmHg (17).
Massive transfusjonsprotokoller (MTP)
MTP er en integrert del av DCR og inneholder retnings linjer for klinikere om hvordan de best kan gi trans fusjonsterapi til blødende traumepasienter. Siden ut viklingen av MTP har flere studier evaluert forskjellige transfusjonsforhold. Flere observasjonelle studier har vist at høyere plasma- og blodplateforhold tidlig i resusci teringen av traumepasienter kan redusere dødeligheten (18,19). I 2015 ble den til nå eneste randomiserte kontrol lerte studien på transfusjonsratioer publisert. The Prag matic, Randomized Optimal Platelet and Plasma Ratios trial (PROPPR) (20) randomiserte traumepasienter som ble antatt å ha behov for massiv transfusjon (definert som mer enn ti enheter RBC de første 24 timene) til et forhold mellom plasma:trombocytter:røde blodceller på 1:1:1 mot 1:1:2. Ingen signifikante forskjeller mellom de to gruppene ble funnet for 24-timers eller 30-dagers dødelighet, men 1:1:1-gruppen hadde færre tidlige døds fall forårsaket av blodtap og de hadde forbedret hemo stase. Det var ingen forskjeller i uønskede hendelser mellom gruppene. Disse funnene førte til at forholdet 1:1:1 av blodprodukter ble en allment akseptert strategi ved resuscitering av traumepasienter (12,14,16) og 1:1:1 er implementert i både de europeiske retningslinjene for behandling av større blødninger og koagulopati etter traumer (17) og de siste National Institute for Health and Care Excellence (NICE) -retningslinjene (15).
“De europeiske retningslinjene for behandling av større blødninger og koagulopati etter traumer anbefaler systolisk blodtrykk 80-90 mmHg (MAP 50-60 mmHg) ved pågående blødning, unntatt ved mistanke om hodeskade hvor det anbefales MAP over 80 mmHg”
Individuell målrettet terapi Med økende kunnskap om patofysiologien ved koagulo pati hos traumepasienter har det utviklet seg en mer moderne forståelse av den hemostatiske resusciteringen. Målrettet hemostatisk terapi har blitt implementert i traume-resusciteringsprotokoller det siste tiåret. Målet med dette transfusjonsregimet er å opprettholde normal koagulasjon under resusciteringen. Konseptet innebærer at når en pasient blør ukontrollert, startes massiv transfusjon med et balansert forhold mellom blod produkter, mens det tas blodprøver for koagulasjons monitorering, enten konvensjonelle koagulasjonstester (INR, APTT, trombocytt tall og fibrinogen) eller visko elastiske koagulasjonstester (TEG eller ROTEM). Når testresultater er tilgjengelige, justeres resusciteringen med ekstra hemostatisk terapi. Denne strategien tilla ter en tidlig justering mot individualisert hemostatisk målrettet terapi, og er i dag gullstandarden for moderne traume-gjenopplivning (14). Hemostatisk terapi som skal administreres i henhold til testresultater ved traumer består per i dag av fibrinogenkonsentrat, i tillegg til ytter ligere TRC, Octaplasma eller TXA. Avdeling for traumato logi ved OUS-Ullevål anbefaler å monitorere koagulasjon med koagulasjonsmålinger hver time under pågående massiv blødning og resuscitering. Man kunne tenke seg at man også bør justere behandlingen med ekstra SAG dersom man måler lave hemoglobin-verdier, men dersom man følger en moderne massiv transfusjonsprotokoll vil man nær sagt alltid ende opp med adekvate hemoglobinverdier. I OUS er ønsket nivå satt til over 8 g/dl, og praksis er at dette alltid oppnås uten ekstra SAG (28).
Høy andel av plasma ser ut til å være til fordel for traume pasienter. Plasma har vist seg å redusere fortynnings koagulopati og er rik på koagulasjonsfaktorer som er nødvendige for trombingenerering (21). Eksperimentelle gnagerstudier har vist at plasma kan reparere og norma lisere det vaskulære endotelet ved å gjenopprette tight junctions og ved å hemme nedbrytning av og gjennom rette endotelglykokalyx (22). I rotter er det også vist at plasma reduserer betennelse og ødem, og dermed re dusere organsvikt (23). Det er fortsatt begrenset bevis på fordeler ved bruk av plasma hos mennesker, men per i dag er det økende bruk av plasma ved resuscite ring av traumepasienter, både under og etter oppnådd hemostase.
Transfusjon med trombocytter anbefales som en del av MTP. Trombocyttfunksjonen er kjent for å være
kompromittert etter skade, og intuitivt bør trombocytttransfusjon dermed forbedre den hemostatiske evnen til blødende pasienter. Trombocytt-tallet er ofte normalt ved resuscitering av traumepasienter, og kunnskapen om effektene av trombocytt transfusjon er begrenset (24). Trombocytt-transfusjon er ikke uten risiko, og står for en relativt stor andel av de årlige transfusjonsreaksjo nene (24). I tillegg er trombocytter vanskelige å lagre og har kort levetid sammenlignet med andre blodproduk ter, noe som gjør dem til en sårbar ressurs.
Trombocytter en viktig del av dagens MTP, både som en del av et balansert forhold mellom blodprodukter, og når det er nødvendig som et resultat av koagulasjonstester. Ved aktiv pågående blødning anbefales et trombocytt-tall over 100 x 109/l.
TXA
Hyperfibrinolyse er ansett som relativt vanlig etter alvorlig skade, og korrigering er en del av behandlingen av koagulopatiske pasienter (25). TXA er et antifibrinolytikum og det finnes betydelig forskning på bruk av TXA hos traumepasienter. Den største og mest omtalte studi en er CRASH-2, en stor, multisenter, randomisert kontrol lert studie, med mer enn 20 000 pasienter (26). CRASH-2 viste signifikant redusert dødelighet for pasienter som fikk TXA mindre enn tre timer etter skade, uten økning i bivirkninger. Den største effekten på dødeligheten var når TXA ble gitt innen én time etter skade og med potensielt skadelige effekter når det ble gitt senere enn tre timer etter skade (27).
Etter publiseringen av CRASH-2 har TXA pragmatisk blitt gitt til traumepasienter i store deler av verden, og i dag er TXA anbefalt både i de europeiske retningslinjene for behandling av større blødninger og koagulopati etter traumer (17) og NICE-retningslinjene (15). Imidlertid er det fremdeles betydelig usikkerhet rundt effektiviteten, sikkerheten og doseringen av TXA til traumepasienter. Enkelte traumemiljøer, blant annet i USA, gir TXA kun ved påvist hyperfibrinolyse ved viskoelastiske eller andre hemostatiske målinger.
Avdeling for traumatologi ved OUS-Ullevål anbefaler en bolus med 1 gram TXA raskest mulig etter skade (gjerne prehospitalt), for deretter å følge opp med ytterligere 1 gram boluser for hver tiende SAG gitt eller dersom tegn på fibrinolyse.
Fibrinogen er et grunnleggende substrat for hemostase. Koagulopatien hos traumepasienter er assosiert med lave fibrinogennivåer ved innleggelse (29), som igjen er assosiert med økt dødelighet og transfusjonsbehov (30). En ønsket økning av fibrinogennivået nødvendiggjør bruk av en konsentrert form for fibrinogentilskudd, da plasmasubstitusjon ikke vil normalisere et lavt fibrinogennivå hos pasienter med pågående massiv blød ning (29). Basert på eksisterende kunnskap, anbefaler de europeiske retningslinjene for behandling av større blød ninger og koagulopati etter traumer fibrinogennivåer over 1,5-2,0 g/L (17) under pågående blødning. Avdeling for traumatologi ved OUS-Ullevål anbefaler å sikte mot fibrinogennivåer over 2,0 g/L.
Den optimale doseringen av fibrinogentilskudd er fortsatt uklar, og anbefalingene varierer. En dose på 1 g fibrinogen kan øke fibrinogenkonsentrasjonen med cirka 0,25 g/L. Avdeling for traumatologi ved OUS-Ullevål anbefaler derfor doser på minimum 4 g til pasienter med behov for fibrinogensubstitusjon under pågående blød ning ved traume. Per i dag er det ingen bevis for økning i tromboemboliske hendelser ved behandling med fibrinogenkonsentrat.
Kalsium var tidligere omtalt som koagulasjonsfaktor IV, og er en essensiell kofaktor for flere av koagulasjonsfaktorene. I tillegg er kalsium viktig for stabilisering av koagelet. Kalsium er også viktig for adekvat plate funksjon, for kontraktiliteten i hjertet og for systemisk vaskulær motstand. Ved massive blodtransfusjoner oppstår hypokalsemi som et resultat av binding til citrat fra blodproduktene. Normalt vil citrat i blodproduk tene metaboliseres i leveren i løpet av minutter, men ved alvorlig sjokk og massiv transfusjon vil ofte lever
funksjonen være redusert, og citrat-tilførselen vil være større enn nedbrytningen. Det er derfor nødvendig å følge ionisert kalsium ved hjelp av blodgasser og gi kalsiumsubstitusjon for å opprettholde ionisert kalsium over 1,1-1,2 mmol/L (17).
Blødning er en vesentlig bidragsyter til død etter alvorlig skade, men gode behandlingsprotokoller kan bedre over levelsen.
Ved mistanke om en alvorlig pågående blødning som følge av traume skal pasienten behandles etter DCRprinsipper med hemostatisk resuscitering, permissiv hypotensjon og DCS. Hemostatisk resuscitering inne bærer å starte med en balansert transfusjon med 1:1:1 ratio med SAG, Octaplasma og TRC sammen med TXA. Ytterligere hemostatisk terapi må følges opp i form av fibrinogensubstitusjon etter behov, basert på resultater fra koagulasjonsmonitorering.
Ved blødningskontroll, eller dersom pasienten er hypo volem uten pågående blødning, foreslås en målrettet transfusjonsstrategi med SAG for å opprettholde adekvat oksygenbærende kapasitet og Octaplasma for å behandle koagulopati. Octaplasma kan vurderes for å gjenopprette hypovolemi for pasienter med risiko for koagulopati, fortynning og ødem. Ionisert kalsium må monitoreres og eventuelt substitueres ved behov. Vasopressor kan benyttes for å motvirke vasodilasjon etter blødnings kontroll.
KLIKK her for å se referansene på kirurgen.no
“Avdeling for traumatologi ved OUS-Ullevål anbefaler å monitorere koagulasjon med koagulasjonsmålinger hver time under pågående massiv blødning og resuscitering.”






NILS ODDVAR SKAGA 1,2, ANDERS HOLTAN 1,3, INGER HAUG 4, PER MORTEN SANDSET 5,6
1 AVDELING FOR ANESTESI OG INTENSIVMEDISIN, OSLO UNIVERSITETSSYKEHUS ( OUS ) ULLEVÅL, 2 AVDELING FOR FORSKNING OG UTVIKLING, AKUTTKLINIKKEN, OUS ULLEVÅL, 3 AVDELING FOR TRAUMATOLOGI, OUS ULLEVÅL, 4 AVDELING FOR ANESTESISYKEPLEIE, OUS ULLEVÅL, 5 AVDELING FOR BLODSYKDOMMER, OUS, 6 INSTITUTT FOR KLINISK MEDISIN, UNIVERSITETET I OSLO
KORRESPONDANSE: NILS ODDVAR SKAGA FAGANSVARLIG OVERLEGE I TRAUMATOLOGI, AVDELING FOR ANESTESI OG INTENSIVMEDISIN, OSLO UNIVERSITETSSYKEHUS, ULLEVÅL,
OUS Ullevål, er traumesykehus for ca. 700.000 innbyggere i Oslo og regionalt traumesenter i Helse Sør-Øst for halve Norges befolkning.
Traumeteamet i Akuttmottaket ved OUS Ullevål tar imot ca. 2000 pasienter per år med alvorlige eller potensielt alvorlige skader. Omlag 37% av pasientene klassifiseres med alvorlig skade i henhold til den internasjonalt anerkjente definisjonen Injury Severity Score (ISS) ≥ 16, hvor ISS = 1 er minimal skade og ISS = 75 er letal skade. Dette er basert på skadeprotokollen AIS 98 (The Abbreviated Injury Scale 1990, Update 98). Det er en stor andel eldre pasienter i denne gruppen, ca. 23% av de innlagte traumepasientene med kirurgiske skader har alder > 65 år. Det er velkjent at komorbiditeten øker med økende alder, og dermed også legemiddelbruken, bl.a. antitrombotiske legemidler. Antitrombotiske midler kompliserer behandlingen av disse pasientene, og øker risikoen for komplikasjoner, samt fører til økt morbiditet og mortalitet.
Vi utviklet denne behandlingsprotokollen for bruk i traumemottaket på Ullevål. Den ble innført medio juni
2014 og revideres jevnlig. Målet er å bedre behandlingen av traumepasienter med kritisk blødning og/eller traumatisk hodeskade med intrakraniell blødning. Proto kollen presenterer medikamentbruk ved gjennomføring av massiv blødningsprotokoll og/eller ved behandling av pasienter med traumatisk hodeskade, samt fremgangs måte ved behov for akutt reversering av effekten av anti trombotiske legemidler. Alle medikamenter som omtales er umiddelbart tilgjengelige på Traumestua på Ullevål, og de ulike berørte avdelingene er godt kjent med anbefa lingene. Det er anestesilegene i traumeteamet som stiller indikasjonen og iverksetter behandlingen, i samråd med teamleder kirurg.
I utgangspunktet er ikke denne rutinen laget for anti koagulerte, medisinske pasienter som kommer inn med spontan intrakraniell blødning eller andre spontane blødninger (f.eks. gastrointestinale blødninger) med sirkulatorisk påvirkning. Men anbefalingene kan følges også hos disse pasientene, etter individuell vurdering.
ANTITROMBOTISKE LEGEMIDLER OG POTENSIALET FOR REVERSERING AV MEDIKAMENTEFFEKTEN
Med antitrombotiske legemidler forstår vi blodplate hemmere og antikoagulantia. Disse benyttes ved en rekke
kroniske sykdommer, og vi ser økt bruk med økende alder. Blodplatehemmere påvirker aggregering og frisettings reaksjoner i blodplatene og dermed hemmes den vikti ge platepluggdannelsen, mens antikoagulantia hemmer ulike ledd i koagulasjonskaskaden. Den antitrombotiske effekten kan vi stoppe med full reversering eller partiell reversering, avhengig av medikamenttypen pasienten benytter. Eksempelvis kan INR ved bruk av warfarin, normaliseres komplett i løpet av minutter med Protrom binkomplekskonsentrat (PCC). I gruppen direktevirkende orale antikoagulantia (DOAK) kan effekten av trombin hemmeren dabigatraneteksilat (Pradaxa®) reverseres komplett med Idarucizumab (Praxbind®), mens effekten av medikamentene i DOAK-undergruppen Xa-hemmere bare partielt kan reverseres. Effekten av blodplatehem mere og lavmolekylært heparin (LMV heparin) kan også bare partielt reverseres. Det er viktig at legene er kjent med denne forskjellen.
Tall fra Reseptregisteret viser at 7,1% av befolkningen benyttet perorale blodplatehemmere i 2020, og 83% av disse pasientene brukte acetylsalisylsyre (ASA) (1). Bruk av perorale antikoagulantia (3,2% av befolkningen) er omtrent fordoblet fra 2011 til 2020. Forbruket av warfa rin (Marevan®, Warfarin Orion®) går ned, mens forbruket av DOAK øker kraftig. I aldersgruppen > 65 år bruker 11% av kvinner og 17% av menn et peroralt antikoagulasjons middel, i aldersgruppen > 80 år henholdsvis 19% og 28%.
En studie fra OUS Ullevål, publisert i 2021, der man un dersøkte pasienter ≥ 65 år med traumatisk hodeskade og CT verifisert patologi, viste at 55,6% av pasientene bruk te antitrombotiske legemidler, enten blodplatehemmere (31,2%) eller antikoagulantia (24,4%) (2). Det er derfor viktig at det akuttmedisinske miljøet har kunnskap om hvordan effekten av antitrombotiske legemidler kan re verseres på best mulig måte dersom det foreligger slik indikasjon etter en risikoavveining.
Vi anbefaler at følgende generelle prinsipper relatert til
nedenstående protokoll følges ved mottak av en traume pasient i en alvorlig blødningssituasjon (stort blodtap med sirkulatorisk påvirkning) og/eller med alvorlig intrakraniell blødning:
• Hva er indikasjonen for den antitrombotiske behandlingen som pasienten benytter?
• Hvilket antitrombotikum er foreskrevet?
• Når ble siste dose tatt?
• Ta relevante blodprøver inklusive koagulasjons status (INR, APTT, trombocytter, fibrinogen) før intervensjon.
Indikasjonen for antitrombotisk behandling må avvei es mot risiko ved reversering av legemiddeleffekten, og risiko for større blodtap eller hjerneskade ved den fore liggende akutte tilstand dersom reversering unnlates.
Etter vår erfaring, i slike situasjoner, vil nesten alltid re versering av den antitrombotiske effekten veie tyngst og derfor med stor margin rettferdiggjøre intervensjon. Det te gjelder også i situasjoner der pasienten har mekanisk aortaventil. Risiko ved reversering av medikamenteffek ten er høyere ved mekanisk mitralventil (fare for ventil trombose), kardiolog bør da konsulteres. Kardiolog bør også konsulteres om pasienter med nylig gjennomgått stentimplantasjon i et større koronarkar (2).
Vi har behandlet pasientene etter disse prinsippene og etter nedenstående protokoll siden 2014, og har god erfaring med dette. Vi har empirisk ikke registrert økt trombosetendens, men dette har vi ikke undersøkt viten skapelig. I den ovenstående studien fra OUS i gruppen med traumatisk hjerneskade ≥ 65 år, gjennomført peri oden 01.07.2014 t.o.m. 31.12.2019, ble pasientenes anti trombotiske behandling reversert i henhold til vår pro tokoll ved indikasjon. Studien viste ingen assosiasjon mellom bruk av blodplatehemmere eller antikoagulantia før skade og 30-dagers mortalitet. En mulig forklaring kan være aktiv bruk av denne reverseringsprotokollen, men dette må dokumenteres i nye studier før endelig konklusjon kan trekkes.
(Versjon VI, 16.02.2022)
NILS ODDVAR SKAGA, PHD, FAGANSVARLIG OVERLEGE, TRAUMATOLOGI. AVD. FOR ANESTESI OG INTENSIVMEDISIN, OUS ULLEVÅL ANDERS HOLTAN, OVERLEGE. AVDELING FOR ANESTESI OG INTENSIVMEDISIN / AVDELING FOR TRAUMATOLOGI, OUS ULLEVÅL INGER HAUG, FAGANSVARLIG SYKEPLEIER, TRAUMATOLOGI. AVDELING FOR ANESTESISYKEPLEIE, OUS ULLEVÅL PER MORTEN SANDSET, PROF. DR. MED. AVDELING FOR BLODSYKDOMMER, OUS RIKSHOSPITALET
1) Som del av massiv transfusjonsprotokoll (MTP)
Tranexamsyre (Cyklokapron®, Pilexam®, Tranexamic acid®)
Fibrinogenkonsentrat (Riastap®, Fibryga®)
Calciumkonsentrat (Calcium Gluconate®)
2) Til bruk ved isolerte, alvorlige hodeskader
Tranexamsyre (Cyklokapron®)
Calciumkonsentrat (Calcium Gluconate®)
3) Til reversering av høy INR ved warfarinbehandling
Protrombinkomplekskonsentrat – PCC (Octaplex®, Confidex®, Prothromplex®) Vitamin K1 (Konakion®)
4) Til reversering av blodplatehemmere Desmopressin (Octostim®)
Tranexamsyre (Cyklokapron®, Pilexam®, Tranexamic acid®)
5) Til reversering av DOAK Idarusizumab (Praxbind®)
Protrombinkomplekskonsentrat – PCC (Octaplex®, Confidex®, Prothromplex®)
6) Til reversering av LMV (lavmolekylært) heparin Protamin (Protaminsulfat®)
Koagulasjonsboks, versjon VI, 16.02.2022.
Avd. for anestesi og intensivmedisin, Oslo Universitetssykehus, Ullevål.
Tranexamsyre (Cyklokapron®, Pilexam®, Tranexamic acid®)
Fibrinogenkonsentrat (Riastap®, Fibryga®)
Calciumkonsentrat (Calcium Gluconate®)
Tranexamsyre, 100 mg/ml (Cyklokapron®, Pilexam®, Tranexamic acid®)
Indikasjon: Traumepasient innlagt innen 3 timer etter skade, med pågående blødning og aktivert massiv transfusjonsprotokoll.
Utblanding: Gis konsentrert med 1 ml (100 mg) per minutt eller utblandet i NaCl.
Dosering: Voksen: 1 g IV (bolus) og videre 1 g IV som bolus for hver andre traumepakke som blir gitt. Barn: 10 mg/kg IV som bolus, kan gjentas hver gang ett blodvolum har blitt erstattet med transfusjon.
Fibrinogenkonsentrat, 1 g/hetteglass (Riastap®, Fibryga®)
Indikasjon: Hemodynamisk ustabil pasient med pågående ukontrollert blødning OG minst ett av følgende kriterier: a) Gitt > 2000 ml krystalloide væsker prehospitalt b) Plasma ikke tilgjengelig umiddelbart (få minutter) c) Initial fibrinogenkonsentrasjon < 2,0 g/L d) Fibrinogen < 2,0 g/L etter én eller flere MTP
Utblanding: Fibrinogenkonsentrat (1 g/hetteglass) utblandes i 50 ml sterilt vann (står i varmeskapet på Traumestua). Sving hetteglasset (ikke riste) forsiktig inntil alt pulveret er løst og oppløsningen er klar til administrering. Kan gis raskt IV ved kritisk blødning.
Dosering: Voksen: 4 g IV. Barn: 30–40 mg/kg IV.
Kommentar: Rekvirér massiv transfusjonspakke, og start transfusjon med 0 Rh– blod og Octaplasma®. Ta vanlig koagulasjonsstatus (INR, APTT, trombocyttter, fibrinogen) og blodgass. Under pågående massiv transfusjon er behandlingsmålet fibrinogen > 2,0 g/L.
Calciumkonsentrat, 0,23 mmol/ml (Calcium Gluconate®)
Indikasjon: Traumepasient innlagt med pågående blødning og transfusjonsbehov samt påvist ionisert Ca2+ på < 1,2 mmol/L
Utblanding Gis konsentrert med 5 ml (1,15 mmol) per minutt.
Dosering: Voksen: 20 ml (4,6 mmol) IV, kan gjentas.
Barn: 5 ml (1,15 mmol)/10 kg kroppsvekt IV
Tranexamsyre (Cyklokapron®)
Calciumkonsentrat (Calcium Gluconate®)
Tranexamsyre, 100 mg/ml (Cyklokapron®, Pilexam®, Tranexamic acid®)
Indikasjon: Traumepasient (voksen ≥18 år ) innlagt innen 3 timer etter skade, med CT-verifisert intrakraniell blødning uavhengig av GCS.
Utblanding: Gis konsentrert med 1 ml (100 mg) per minutt eller utblandet i NaCl.
Dosering: Voksen: 1 g IV (bolus). Barna: Erfaring mangler, se kommentar.
Kommentar: 1 g Tranexamsyre kan gis av prehospitale anestesileger til voksne pasienter, uten CT-verifisert intrakraniell blødning, i følgende situasjoner; pasienten har kliniske tegn til åpenbar alvorlig hodeskade ved adekvat traume OG lateraliserende tegn OG vedvarende GCS < 9, der annen nevroprotektiv behandling iverksettes (osmoterapi, hyperventilaasjon osv.). CRASH 3-studien inkluderte ikke pasienter < 16 år, men man bør vurdere Tranexamsyre på samme indikasjoner som for voksne og med doser på 10–15 mg/kg IV, inntil maximum 1g.
Calciumkonsentrat, 0,23 mmol/ml (Calcium Gluconate®)
Indikasjon: Traumepasient innlagt med CT-verifisert intrakraniell blødning uavhengig av GCS, samt påvist ionisert Ca2+ på < 1,2 mmol/L
Utblanding: Gis konsentrert med 5 ml (1,15 mmol) per minutt.
Dosering: Voksen: 20 ml (4,6 mmol) IV, kan gjentas. Barn: 5 ml (1,15 mmol)/10 kg kroppsvekt IV.
Kommentar: Enkelte studier kan tyde på at ionisert serum kalsium er prediktor for dårligere utkomme etter hodeskade, og man bør derfor være oppmerksom på hypokalsemi uavhengig av transfunderte blodprodukter. Dokumentasjonen for dette er meget begrenset, men risiko ved å justere serum kalsium til normale verdier ansees som svært liten.
Koagulasjonsboks, versjon VI, 16.02.2022.
Avd. for anestesi og intensivmedisin, Oslo Universitetssykehus, Ullevål.
Protrombinkomplekskonsentrat – PCC (Octaplex®, Confidex®, Prothromplex®)
Vitamin K1 (Konakion®)
Protrombinkomplekskonsentrat (PCC) (Octaplex®, Confidex®, Prothromplex®)
Indikasjon: Traumepasient som innlegges med pågående blødning og transfusjonbehov og/eller intrakraniell blødning under pågående warfarinbehandling og verifisert INR > 1,5.
Utblanding: Pulver blandes i 20 ml medfølgende injeksjonsvæske og administreres IV med hastighet inntil 2 ml/min.
Dosering: Voksen: 30 IE/kg, se nedenstående tabell. Barn: Erfaring mangler. Vekt, kg INR 1,5–2 2 < INR ≤ 3 INR > 3 Gi ytterligere ved utilstrekkelig effekt 40–60 500 IE 1000 IE 1500 IE 500 IE 61–90 1000 IE 1500 IE 2000 IE 1000 IE > 90 1500 IE 2000 IE 2500 IE 1000 IE
Dosering PCC – Protrombinkompleksenheter. (Ref; www.ssth.se ”Hemostas vid allvarlig blödning”, 2019)
Kommentar: INR-kontroll før og etter behandling. Dersom pasienten har mekanisk hjerteventil, må indikasjon for PCC vurderes versus risiko for ventiltrombose, det vil si man må gjøre en risikoavveining. NB: husk at det erfaringsmessig er relativt lav risiko for ventiltrombose ved mekanisk aortaventil, høyere risiko ved mekaniske mitralventil.
Vitamin K1, 10 mg/ml (Konakion®)
Indikasjon: Traumepasient som innlegges med pågående blødning og transfusjonbehov og/eller intrakraniell blødning under pågående warfarinbehandling og verifisert INR > 1,5. Gis som tillegg til dosering av PCC.
Utblanding: Gis IV, konsentrert løsning, på minst 30 sek.
Dosering: Voksen: 5 mg IV.
Barn: Erfaring mangler.
Kommentar: Som for Protrombinkomplekskonsentrat (PCC).
Desmopressin (Octostim®)
Tranexamsyre (Cyklokapron®, Pilexam®, Tranexamic acid®)
Desmopressin, 15 mcg/ml (Octostim®)
Indikasjon: Traumepasient som innlegges med pågående blødning og transfusjonbehov og/eller intrakraniell blødning under pågående bruk av acetylsalisylsyre og/eller andre blodplatehemmere.
Utblanding: Gis som infusjon med hele dosen utblandet i NaCl 0,9 % til 100 ml, infusjon på 15–30 min.
Dosering: Voksen: 0,3 mcg/kg IV. Barn: Erfaring mangler.
Kommentar: Finn ut når siste dose av blodplatehemmere ble tatt. Ta vanlig koagulasjonsstatus (INR, APTT, trombocytter, fibrinogen) og blodgass. Gi først trombocytt-transfusjon (1 til 2 enheter, kan gjentas ved behov), deretter Octostim. Ved behov, kontakt vakthavende hematolog.
Tranexamsyre, 100 mg/ml (Cyklokapron®, Pilexam®, Tranexamic acid®)
Indikasjon: Traumepasient som innlegges med pågående blødning og transfusjonbehov og/eller intrakraniell blødning under pågående bruk av acetylsalisylsyre og/eller andre blodplatehemmere.
Utblanding: Gis konsentrert med 1 ml (100 mg) per minutt eller utblandet i NaCl.
Dosering: Voksen: 10 mg/kg IV.
Barn: Erfaring mangler.
Koagulasjonsboks, versjon VI, 16.02.2022.
Avd. for anestesi og intensivmedisin, Oslo Universitetssykehus, Ullevål.
Trombinhemmer: Pradaxa® (dabigatraneteksilat)
Faktor Xa hemmer: Eliquis® (apixaban), Xarelto® (rivaroxaban), Lixiana® (edoksaban)
Kommentar: Fra 15.09.2021 har Avdeling for medisinsk biokjemi på Ullevål gitt tilbud om analyse av serum konsentrasjon av apiksaban og rivaroksaban på døgnbasis. Telefon 18790 ved spørsmål. Svartid 1–2 timer. Prøveglass; citratrør med lyseblå kork. I en kritisk situasjon må reversering iverksettes straks på empirisk grunnlag (før prøvesvar foreligger, unngå tids tap), men det kan være aktuelt å ta prøver til serumkonsentrasjonsbestemmelse før og eventuelt etter reversering.
For reversering av Pradaxa® (dabigatran):
Praxbind®: 2,5 g/ 50 ml (idarusizumab)
Indikasjon: Antidot til traumepasient som bruker Pradaxa®, med alvorlig hodeskade og/eller pågående blødning. Kan også være aktuelt til andre pasienter som bruker Pradaxa® og som må gjennomgå akutt kirurgi/akutte prosedyrer.
Utblanding: Gis konsentrert med 2 hetteglass á 2,5 g (50 ml) i løpet av 2 x 5 minutter.
Dosering: Voksen: 5 g IV (bolus).
Kommentar: Ta først vanlig koagulasjonsstatus (INR, APTT, trombocytter, fibrinogen) og nyrefunksjonsprøver. Anestesioverlege 862 skal alltid konsulteres før medikamentet blir administrert. Praxbind® har ikke effekt på andre DOAK-preparater enn Pradaxa®. Ytterligere dose á 5 g kan vurderes senere i forløpet ved ny livstruende blødning. Behandling med lavmolekylært heparin startes etter vanlige rutiner. Pradaxa-behandling kan gjenopptas etter 24 timer, forutsatt adekvat hemostase.
For reversering av Eliquis® (apiksaban), Xarelto® (rivaroksaban) og Lixiana® (edoksaban):
Protrombinkomplekskonsentrat (PCC) (Octaplex®, Confidex®, Prothromplex®)
Indikasjon: Traumepasient som innlegges med pågående blødning og transfusjonbehov og/eller intrakraniell blødning under pågående behandling med Eliquis®, Lixiana® eller Xarelto®. Kan også være aktuelt til andre pasienter som bruker disse preparatene og som må gjennomgå akutt kirurgi/akutte prosedyrer.
Utblanding: Pulver blandes i 20 ml medfølgende injeksjonsvæske og administreres IV med hastighet inntil 2 ml/min.
Dosering: Voksen: Hvis < 15 timer siden siste DOAK dose; 50 IE/kg.
Hvis 15–24 timer siden siste DOAK dose; 30 IE/kg.
Kommentar: Ovenstående er et regime for partiell reversering av legemiddeleffekten. Ta først vanlig koagulasjonsstatus (INR, APTT, trombocytter, fibrinogen) og nyrefunksjonsprøver. Gi deretter PCC i henhold til ovenstående. Antidot mot faktor Xa hemmere, Andexanet alfa (Ondexxya®) er godkjent av European Medicines Agency (EMA), men ikke tilgjengelig i Norge.
Til ø-hjelps pasienter (med unntak for kritisk syke pasienter), husk muligheten for serumkonsentrasjonsmålinger av apiksaban og rivaroksaban ved Avdeling for medisinsk biokjemi på Ullevål, telefonnummer 18790, gjelder hele døgnet. I spesielle situasjoner med vedvarende blødning til tross for ovennevnte behandling, snakk med hematolog om eventuell bruk av Feiba® (aPCC).
Indikasjon:
Utblanding: Ferdig injeksjonsvæske, dosen administreres langsomt IV i løpet av ca. 10 min.
Dosering: Voksen: 1 mg Protaminsulfat per 100 IE dalteparin (Fragmin®) eller per mg enoxaparin (Klexane®) gitt siste 12 t. 0,5 mg Protaminsulfat® per 100 IE dalteparin eller per mg enoxaparin gitt 12–24 t før innlegglse.
Kommentar: Ta først vanlig koagulasjonsstatus (INR, APTT, trombocytter, fibrinogen) og blodgass. Protamin reverserer cirka 50% av LMV heparin-effekten. Transfusjonsfusjonsbehandling etter vanlig rutine ved behov. Det kan være aktuelt å gjenta Protamindosen (50% av forrige dose) etter 3 timer hvis stor dose er gitt subkutant, og blødningen fortsetter.
:
KLIKK her for å se referansene på kirurgen.no
Koagulasjonsboks, versjon VI, 16.02.2022.
Avd. for anestesi og intensivmedisin, Oslo Universitetssykehus, Ullevål.

Ernæringsbehandlingen er en del av den medisinske pasientbehandlingen og er behandlings ansvarlig lege sitt ansvarsområde (1). Denne artikkelen vil gi deg som kirurg noen enkle og praktiske tips om ernæring av kirurgiske pasienter.
ELIN V. THORSENAVDELING FOR GASTRO OG BARNEKIRURGI, OSLO UNIVERSITETSSYKEHUS ULLEVÅL
AVDELING FOR TRAUMATOLOGI, OSLO UNIVERSITETSSYKEHUS ULLEVÅL
Underernæring kan defineres som en tilstand der det har oppstått en ubalanse mellom inntak og/eller opptak og forbruk av energi og/eller protein. Tilstanden kan også forekomme hos pasienter som defineres som overvektige!
Siden Hippokrates har man vært klar over at magre pa sienter har redusert mulighet til å komme seg gjennom akutt og kronisk sykdom. I nyere tid har studier bekreftet at underernæring er klart assosiert med økt morbiditet og mortalitet samt økte kostnader for sykehusene (2,3). Myndighetene har økt fokuset på underernæring hos inn lagte pasienter de siste årene. Likevel er det fortsatt for få kliniske ernæringsfysiologer (KEF) i norske sykehus.
Vi vet at kirurgiske pasienter er utsatt for å bli unde rernærte og en rekke studier bekrefter at forekomsten av underernæring i sykehus er høy (30-60%) (4,5,6). En norsk studie viste at det i tillegg til høy forekomst av un derernæring ved innleggelse hos generellkirurgiske og ortopediske pasienter, også var en betydelig risiko for å utvikle en underernæringstilstand mens man var innlagt i sykehus (6). Så mange som 83% av pasientene tapte vekt i løpet av oppholdet. Å ha fokus på forebygging av vekttap og utvikling av underernæring under sykehusinnleggel sen, er derfor noe som berører oss daglig som kirurger.
Autopsistudier har vist at det er samsvar mellom totalt vekttap og vekttap av de spesifikke organer hos unde rernærte pasienter (7). Det er faktisk vist en størrelsesre duksjon på opp til 30% i organer som lever og hjerte (7). Underernæring vil ofte medføre en reduksjon av mus kelmasse og muskelfunksjon per muskelfiber, noe som blant annet kan medføre redusert respirasjonsfunksjon og hostefunksjon samt redusert hjertefunksjon i form av kardial kakeksi (8). Økt infeksjonshyppighet, redusert sårtilheling, økt risiko for trykksår, redusert tarmbarrie re og tarmfunksjon samt økt hyppighet av psykosomatis ke symptomer som depresjon er noen enkeltsymptomer som er assosiert med underernæring (9,10,11,12). I tillegg medfører underernæring økt komplikasjonshyppighet og morbiditet, og mortaliteten er klart forhøyet hos unde rernærte pasienter. Dette fører igjen til økt antall ligge døgn og at forbruk av helsetjenester og de totale kostna dene øker (2,3,12,13).
I litteraturen er det benyttet en rekke metoder for å di agnostisere underernæring, som for eksempel antropo metriske metoder, biokjemiske metoder, bioelektrisk im pedans analyse, funksjonstester og screening metoder. Alle metodene har svakheter og ingen er gode nok til å kunne brukes som gullstandard.
1 Er BMI < 20,5?
2 Har pasienten tapt vekt i løpet av de 3 siste månedene?
3 Har pasienten hatt redusert næringsinntak i den siste uken?
4 Er pasienten alvorlig / kritisk syk? (f.eks får intensivbehandling)
Ja: Nei: Dersom svaret er «Ja» på noen av spørsmålene gjennomføres screening i tabell 2. Dersom svaret er «Nei» på alle spørsmålene skal pasienten rescreenes ukentlig. Dersom pasienten f.eks skal gjennomgå en planlagt stor operasjon, skal en forebyggende ernæringsplan overveies for å unngå den forventede ernæringsrisiko.
Mild Skår = 1
Moderat Skår = 2
Vekttap> 5 % i løpet av 3 måneder eller matinntak 50-75 % av normalt behov i siste uke
Vekttap> 5 % i løpet av 2 måneder eller BMI 18.5-20.5 + nedsatt almenntilstand eller ma tinntak 25-50 % av normalt behov i siste uke
Alvorlig Skår = 3 Vekttap> 5 % i løpet av 1 måned (>15 % siste 3 måneder) eller BMI<18.5 + nedsatt almenntilstand eller matinntak 0-25 % av nor malt behov siste uke
Mild Skår = 1
Moderat Skår = 2
Alvorlig Skår = 3
Lårhalsbrudd*, Kronisk syke pasienter*, spesielt de med akutte komplikasjoner: levercirrose, KOLS* Kronisk hemodialyse, diabetes, kreftsykdommer
Omfattende abdominal kirurgi*, Slag* Alvorlig lungebetennelse, maligne blodsykdommer
Hodeskade*, Benmargstransplantasjon* Intensivpasienter (APACHE skår>10)
Skår + Skår = Total skår Alder Hvis ≥ 70 år: legg til 1 til total skår over = aldersjustert total skår Skår ≥3: Pasienten er i ernæringsmessig risiko og en ernæringsplan skal iverksettes Skår <3: Ukentlig rescreening av pasienten. Hvis pasienten f.eks skal gjennomgå omfattende kirurgi skal en forebyggende ernæringsplan overveies for å unngå den forventede ernæringsrisiko.
Det er ikke uvanlig at albumin målt i serum benyttes for vurdering av underernæring. Dette er ingen god metode fordi albuminverdiene i serum påvirkes av en rekke fak torer som ofte er til stede hos pasienter innlagt i sykehus (tabell 1). En reduksjon i serumkonsentrasjon av albumin er derfor sjelden et resultat av underernæring alene hos pasienter som er innlagt i sykehus.
Vekt og ufrivillig vekttap er den enkeltmetoden som i van lig klinisk praksis viser seg å være mest sensitiv. I littera turen defineres underernæring oftest som ≥10% ufrivillig vekttap på seks måneder eller ≥ 5% på én måned, men >5% ufrivillig vekttap på seks måneder og >10% på ett år regnes også som signifikant (12). Vekt er en enkel, ikke in vasiv og billig målemetode, og alle pasienter bør veies ved innkomst og minimum én gang per uke.
Helsedirektoratet har siden 2009 anbefalt at alle pasienter skal vurderes for ernæringsmessig risiko ved innleggelse og deretter ukentlig ved bruk av et screeningverktøy (12). De mest benyttede verktøyene som er validert og anbe falt i spesialisthelsetjenesten er Nutritional Risk Screeing (NRS 2002) og Mini Underernæring ScreeingnverkTøy (MUST) (se illustrasjon). Screeningmetodene inkluderer opplysninger om vekt, vektendring, kroppsmasse indeks (KMI), evne til næringsinntak og sykdommens alvorlig hetsgrad. Ernæringsmessig risiko omfatter pasienter som er underernærte eller i risiko for å bli underernærte og screeningverktøyene er således viktige hjelpemidler med tanke på å forebygge underernæring.
Halveringstiden av albumin i serum er cirka 20 dager og totalpoolen i kroppen er rundt 4-5 gram/kg. S-albumin egner seg derfor dårlig til å registrere hurtige endringer i proteinstatus og nytteverdien er dermed begrenset når det gjelder å følge hurtige endringer i ernæringsstatus.
Stilling når prøven tas (oppreist, sittende, liggende)
Kompensatoriske mekanismer (som ved for eksempel kronisk ukomplisert sult)
Alvorlig sykdom (for eksempel sepsis) fører til øket vaskulær permeabilitet og proteiner tapes til det ekstracellulære rommet
Akutt fase proteiner (for eksempel CRP og fibrinogen) produseres i lever på bekostning av transportproteiner (som for eksempel albumin og transferrin)
Økt hydrostatiske trykket føre til at konsentrasjonen albumin øker med 5-15% i oppreist stilling (plasmavann går ekstracellulært)
Plasmakonsentrasjonen av albumin kan være bibeholdt gjennom reduksjon i albumin-degenerasjon og redistribusjon fra ekstravaskulært til intravaskulært rom.
Når konsentrasjonen av CRP øker vil ofte konsentrasjonen av albumin synke
Nefrotisk syndrom, brannskader, inflammatorisk tarmsykdom Hydreringsstatus Dehydrering øker albuminkonsentrasjonen
Patologiske proteintap
Det er viktig at vi som leger husker å kode underernæring ved utskrivelse der det er aktuelt. Dette er viktig informa sjon å videreføre til de som skal følge opp pasienten etter sykehusinnleggelsen og underernæringsdiagnosen vil i mange tilfeller høyne taksten på hoveddiagnosen. ICD10 skiller mellom ernæringsmessig risiko (E46), moderat (E44) og alvorlig underernæring (E43).
Det finnes flere metoder for å bergene pasienters ener gi- og proteinbehov. Den mest nøyaktige metoden er in direkte kalorimetri som krever at man blant annet måler pasientens O2-forbruk, CO2-produksjon og nitrogenutskil lelse i urinen. Dette er naturlig nok ikke en metode som kan benyttes på sengepost og selv hos pasienter som lig ger på intensivavdeling på respirator er dette en kreven de metode. Det finnes flere formelbaserte metoder som for eksempel Harris & Benedic formel og Schofields for mel, men disse er mindre nøyaktige (12).
For at vi som leger skal kunne gjøre beregninger i en hek tisk klinisk hverdag er det viktig med enkle tommelfin gerregler. Et energibehov på 30 kcal/kg/døgn er et godt estimat. Man kan eventuelt gjør korreksjon for ulike ak tivitetsnivåer og sykdomstilstander. Når det gjelder pasi enters væskebehov er dette også som en tommelfinger regel 30 ml/kg/døgn. Med andre ord holder det å huske tallet 30! Hos overvektige pasienter bruker man vekten som tilsvarer KMI 25 når man beregner behov og ikke eksakt vekt.
Når det gjelder pasienters proteinbehov er dette noe mer varierende og ligger mellom 1-2 g protein/kg/døgn. Mye tyder på at man har vært for restriktiv i beregningen av proteinbehovet hos akutt syke pasienter. Som en tommel fingerregel kan man hos en kirurgisk pasient, som har gjennomgått kirurgi, bergene 1,5 g protein/kg/døgn.
Personer i ernæringsmessig risiko skal ifølge de nasjona le faglige retningslinjene ha en individuell ernæringsplan med dokumentasjon om ernæringsstatus, -behov, -inntak og tiltak (12). Tiltak kan være alt fra optimalisering av måltidsituasjon, matvarevalg og måltidsrytme (inkludert mellommåltider), til det å tilby næringsdrikker (hjemme laget eller kommersielle), starte sondeernæring eller gi parenteralt tilskudd. Det er svært godt dokumentert at man skal velge enteral ernæring fremfor parenteralt til skudd så langt det overhodet lar seg gjøre og det er svært få kontraindikasjoner for enteral ernæring. Flere studi er har vist at enteral ernæringsbehandling blant annet reduserer komplikasjonsrisiko og dødelighet hos unde rernærte kirurgiske pasienter i sykehus (12,14,15). Det er også vist at tidlig oppstart (det vil si innen 24-48 timer) av enteral ernæring etter blant annet akutt gastrointestinal kirurgi og traumekirurgi, gir reduksjon i mortalitet, mor biditet og antall liggedøgn i sykehus (16,17).
De fleste kirurgiske pasienter kan trygt drikke klare væsker, inkludert ProvideXtra drink, inntil to timer før elektiv kirurgi (15).
BMI-score
Ufrivillig vekttap de siste 3-6 månedene
BMI kg/m 2 Score >20(>30 fedme) = 0 18.5- 20 = 1 <18.5= 2 % Score <5 = 0 5-10 = 1 >10= 2
Hvis pasienten lider av akutt sykdom og ikke har hatt eller sannsynligvis ikke vil ha næringsinntak i fem dager eller mer. Score2
Se i ”MUST” Brosjyren for alternative målemetoder og bruk av subjektive kriteria ved tilfeller der det ikke er mulig å fastslå høyde og vekt.
Samlet risiko for underer næring
Legg sammen scorene for å beregne samlet risiko for underernæring Score 0 Lav risiko Score1 Middels risiko Score 2 eller mer Høy risiko
Trinn 5
Uansett hvilken type ernæringsbehandling man skal starte opp er det viktig å gi underernærte pasienter ti amintilskudd fordi tiamin i liten grad lagres i kroppen og fordi tiaminbehovet hos underernærte kan være økt. Pabrinex i fem dager er en vanlig administrasjon. Alter nativt kan man gi Tiamin 250 mg intramuskulært de to første dagene og deretter 100 mg per os.
T iltak
som leger har et bevisst forhold til denne delen av be handlingen.
0
Lav risiko 1
Middels risiko 2 eller mer Høy risiko
Obser vasjon
• Sykehus/sykehjem – dokumenter næringsinntak i tre dager
Start behandling*
• Gjenta screening
Sykehjem – månedlig Sykehus – hver uke Hjemmesykepleie/allmennpraksis – årlig for bestemte grupper, f.eks. > 75 år
Berikningsprodukter og næringsdrikker: Enkle tiltak som å tilby pasientene hyppige måltider, mellommåltider og ønskekost er viktig og noe alle sen geposter skal ha et tilbud om. Valg av energitett mat og berikning av normalkost likeså. Dette arbeidet ivaretas oftest av pleiepersonell på post, gjerne i samarbeid med matfaglig personell og KEF. Det er imidlertid viktig at vi
• Hvis forbedret eller tilstrekke lig inntak – lite behov for klinisk behandling; hvis ingen forbedring – følg lokale retningslinjer
Berikningsprodukter kan være normale matvarer som olje, smør og fløte. YT og E+ fra Tine er matvarer som kan være gunstige å benytte som mellommåltider. Det samme gjelder for eksempel salte kjeks med smør og ost, egg eller nøtter. På kreftforeningens side finnes mye god informa sjon og blant annet oppskriftshefter på gode smoothies og supper som kan lages på postkjøkkenet.
• Trekk inn klinisk ernærings fysiolog, ernæringsteam eller følg lokale retningslinjer for ernæringsterapi
• Forbedre og øk totalt næringsinntak
• Gjenta screening Sykehus – ukentlig Sykehjem – min. månedlig Hjemmesykepleie/allmennpraksis – min. hver 2.-3. mnd
Det finnes en rekke kommersielt fremstilte produkter for å øke næringsinntaket og Fresenius-kabi, Nutricia og Nestlé er de største leverandørene til norske sykehus.
• Overvåk og gjennomgå ernæringsplanen Sykehus – ukentlig Sykehjem – månedlig Hjemmesykepleie/allmennpraksis – månedlig
“Det
ernæring ved utskrivelse der det er aktuelt. ”
For berikning av normalkost finnes blant annet rene pro tein tilskudd, fullernærings tilskudd og rent fett-tilskudd (Calogen, Fresubin 5 kacl shot) (tabell 2).
Calogen eller Fresubin 5 kcal shot er i noen avdelinger be nyttet som ernæringstiltak. Disse produktene gir tilskudd av energi kun i form av fett og gir ikke tilskudd av andre næringsstoffer og pasientene angir ofte en metthetsfølel se etter inntak. Det vil derfor i mange tilfeller være mer gunstig å velge en energitett næringsdrikk (for eksempel Nutridrink compact protein, Fresubin 2 kcal drink eller Resource 2.0.) (tabell 2).
Næringsdrikker finnes i en rekke smaker og sammen setninger. Generelt smaker næringsdrikker best når de serveres kaldt. Det forventes ikke at leger skal ha over sikt over alt som finnes på markedet. Det er likevel noen viktige prinsipper det er lurt for leger å kjenne til. Noen næringsdrikker er fullverdige/komplette, det vil si at de inneholder alle næringsstoffer man trenger og pasienter kan leve kun på disse. Ofte kalles disse melkebaserte. An dre næringsdrikker er tilskuddsdrikker, det vil si at de mangler noen næringsstoffer eller fett og gir kun et til skudd av energi og protein. Disse kalles ofte juicebaserte. De fleste næringsdrikker finnes i ulik energitetthet (1 2,4 kcal/ml), ulikt proteininnhold samt med og uten fiber. Det er også laget næringsdrikker tilpasset spesielle sykdoms tilstander, blant annet diabetes, redusert gastrointestinal funksjon inkludert malabsorpsjon, nyresvikt, KOLS og trykksår (tabell 2).
Sondeernæring:
Som for næringsdrikker er det en rekke produkter med ulik sammensetning på markedet og Fresenius-kabi (Fre subin), Nutricia (Nutrison) og Nestlé (Isosource) er de største leverandørene til norske sykehus.
Sondeernæringsproduktene har varierende grad av energitetthet (1-2 kcal/ml), ulikt proteininnhold, med og uten fiber og løsninger tilpasset ulike sykdomsgrupper.
Hvilken løsning man skal velge varierer i forhold til pa sientenes behov og toleranse, men ofte er det mest aktu
elt å benytte en løsning med noe høyere energitetthet og proteininnhold hos kirurgiske pasienter. Aktuelle løsnin ger kan være Nutrison protein plus (fiber), Fresubin HP energy (fiber) eller Isosource protein (fiber). Løsninger tilpasset ulike sykdomsgrupper kan også være aktuelt, for eksempel løsninger tilpasset pasienter med diabetes og løsninger tilpasset redusert gastrointestinal funksjon inkludert malabsorbsjon (tabell 3).
Noen praktiske tips ved oppstart av sondeernæring:
• Benytt veltemperert løsning.
• Kontinuerlig infusjon foretrekkes fremfor bolus i startfasen.
• Ikke start med for rask infusjonshastighet. Øk i samsvar med toleranse.
• Tommelfingerregel: Start med 30 ml/time, øk med 30 ml/time hver 6. 12. time.
• Tilstreb bruk av fiberløsning, men forsiktig oppstart hvis det har gått over tre døgn siden sist inntak av fiber.
• Bytt til annen løsning ved intoleranse.
• Ved kvalme/retensjon sørg for hevet hodeende 30-45 grader. Vurder bruk av AfiPran® og EryMax®.
• Immodium® kan være aktuelt ved diare
Parenteral ernæring: Parenteralt ernæringstilskudd skal kun benyttes når ente ral tilførsel ikke lar seg gjennomføre grunnet manglende tarmfunksjon. European Society of Parenteral and Enteral Nutrition (ESPEN) anbefaler også at man skal avstå fra oppstart av parenteral ernæring dersom pasienten for ventes å dekke sitt kaloribehov enteralt i løpet av syv til ti dager (18). Dersom man skal starte parenteralt tilskudd eller total parenteral ernæring, er det i norske sykehus anbefalt å benytte flerkammerposer. Det er flere produ senter på det norske markedet. Fresenus-kabi, B. Braun og Baxter er de største leverandørene. Flerkammerpose ne finnes i varianter som kan gis i perifer venekanyle og varianter som må gis i sentral tilgang. Videre eksisterer det varianter med ekstra nitrogen (protein) og elektrolytt frie varianter (ved for eksempel alvorlige elektrolytt for styrrelser).
“Uansett hvilken type ernæringsbehandling man skal starte opp er det viktig å gi underernærte pasienter tiamintilskudd ”
Berikningsprodukter
Navn
Karbohydrat tilskudd Fantomalt, Resource energipulver Fett tilskudd Calogen, Fresubin 5 kcal shot
Protein tilskudd Protifar, Fresubin protein powder
Komplett/fullverdig tilskudd Nutrison powder/ Resource complete
Næringsdrikk
Komplette/fullverdige næringsdrikker
Navn
Nutridrink (multi fiber) – 150 kcal/ 6 g protein
Nutridrink protein – 150 kcal/ 9 g protein
Nutridrink Compact (fiber) – 240 kcal/ 9,5 g protein
Nutridrink Compakt protein – 240 kcal/ 14.4 g protein
Nutridrink Youghurt Style – 150 kcal/ 6 g protein
Fresubin orginal drink – 100 kcal/ 3,8 g protein
Fresubin energy drink (fiber) – 150 kcal/ 5,6 g protein
Fresubin protein energy drink – 150 kcal/ 10 g protein
Fresubin 2 kcal drink (fiber) – 200 kcal/ 10 g protein
Fresubin YoDrink – 150 kcal/ 7,5 g protein
Resource protein – 125 kcal/ 9,4 g protein
Resource Komplett Næring – 150 kcal/ 5,6 g protein
Resource 2.0 (fiber) – 200 kcal/ 9 g protein
Kommentar
Svært energi tett (4,5-5 kcal/ml), inneholder kun fett og ikke protein eller andre næringsstoffer

Kommentar
«Melkebaserte» drikker. Kan benyttes som eneste næringskilde. Varierer i energitetthet og protein innhold per 100 ml (i parentes).
Alle varianter finnes i flere smaker.
Tilskuddsdrikker
Nutridrink juice style – 150 kcal/ 4 g protein
Fresubin jucy drink – 150 kcal/ 4 g protein
ProvideXtra drink – 150 kcal/ 4 g protein
Resource addera plus – 150 kcal/ 4 g protein
Resource ultra fruit – 150 kcal/ 7 g protein
«Juicebaserte» drikker. Er ikke komplette mtp næringsinnhold, men gir tilskudd av energi og protein.
Mangler ofte fett, fiber og enkelte næringsstoffer. Alle varianter finnes i flere smaker.

For pasienter med diabetes
For pasienter med redusert tarm funksjon/malabsorbsjon

For pasienter med nyresvikt
Diasip – 100 kcal/ 5 g protein
Diben – 150 kcal/ 7,5 g protein
Elemental 028 Extra – 86 kcal/ 2,5 g protein
Survimed OPD – 100 kcal/ 4,65 g protein
Survimed OPD 1,5 kcal – 150 kcal/ 7,5 g protein
Renilon 7.5 – 200 kcal/ 7,3 g protein
Renilon 4,0 – 200 kcal/ 3,9 g protein
Fresubin renal – 200 kcal/ 3 g protein
Komplett
Komplett
Tilskudd Komplett
For pasienter med KOLS
For pasienter med trykksår
For eldre og pasienter med ekstra behov for vitamin D og kalsium
Respifor – 150 kcal/ 7,5 g protein
Supportan drink – 150 kcal/ 10 g protein
Resource Ultra – 225 kcal/ 14 g protein
Cubitan – 124 kcal/ 9 g protein
Fresubin ProDrink – 240 kcal/ 14,4 g protein
Resource activ – 160 kcal/ 10 g protein
Tilskudd
Tilskudd
Tilskudd Komplett
Komplett/fullverdig sondeernæring
Nutrison (multi fiber) – 100 kcal/ 4 g protein
Nutrison energy (multi fiber) – 150 kcal/ 6 g protein
Nutrison low energy multi fiber – 78 kcal/ 3 g protein
Nutrison protein pluss (multifiber) – 128 kcal/ 6,3 g protein
Nutrison protein advance – 128 kcal/ 7,5 g protein
Nutrison protein intense – 126 kcal/ 10 g protein
Nutrison Concentrated – 200 kcal/ 7,5 g protein
Fresubin orginal (fiber) – 100 kcal/ 3,8 g protein
Fresubin energy (fiber) – 150 kcal/ 5,6 g protein
Fresubin HP energy fiber – 150 kcal/ 7,5 g protein
Fresubin 2 kcal HP (fiber) – 200 kcal/ 10 g protein
Isosource standard (fiber) – 100 kcal/ 3,9 g protein
Isosource energy (fiber) – 160 kcal/ 6,1 g protein
Isosource protein (fiber) – 130 kcal/ 6,7 g protein
Isosource Mix – 110 kcal/ 4,4 g protein
Komplette sondeløsninger med dagsbehovet for alle nærings stoffer i en pose
Sondeernæring tiltenkt spesielle pasientgrupper
For pasienter med diabetes
CNutrison 1000 complete multifiber, Nutrison 1200 complete multifiber, Fresubin 1000 complete, Fresubin 1200 complete, Fresubin 1500 complete, Fresubin 1800 complete, Fresubin 2250 complete
Navn
Nutrison advanced diason – 103 kcal/ 4,3 g protein Nutrison advanced diason low energy – 78 kcal/ 3,2 g protein
Diben – 100 kcal/ 4,5 g protein
Diben 1,5 kcal HP – 150 kcal/ 7,5 g protein
Alle sondeernæringsløsninger ansees som fullverdige/komplette. Variere i energi- og protein tetthet.
Hvilken løsning man skal velge varierer i forhold til pasientenes behov og toleranse, men ofte er det mest aktuelt å benytte en løsning med noe høyere energitetthet og proteininnhold hos kirurgiske pasienter. Aktuelle løsninger kan være Nutrison protein plus (fiber), Fresubin HP energy (fiber) eller Isosource protein (fiber).
Isosource Mix har ingredienser fra ekte råvarer og kan være verdt å forsøke ved dårlig toleranse av andre løsninger
Benyttes i liten grad i sykehus
For pasienter med redusert tarmfunksjon/malabsorbsjon
For pasienter med diare
For pasienter med trykksår
Nutrison advanced peptisorb – 100 kcal/ 4 g protein
Survimed OPD – 100 kcal/ 4,5 g protein
Survimed OPD HN – 133 kcal/ 6,7 g protein Peptamen – 100 kcal/ 4 g protein Peptamen HN – 133 kcal/ 6,6 g protein
NovaSource GI Control – 110 kcal/ 4,1 g protein NovaSource GI advance – 155 kcal/ 9,6 g protein
Nutrison advanced cubison – 104 kcal/ 5,5 g protein
For intensiv pasietner/kritisk syke Fresubin Intensive – 120 kcal/ 10 g protein Peptamen Intense – 100 kcal/ 9,3 g protein
For pasienter med kumelkeprotein allergi
Nutrison Soya (multi fiber) – 100 kcal/ 4 g protein Fresubin Soya fiber – 100 kcal/ 3,8 g protein
For pasienter med væskeretensjon Nutrison low sodium – 100 kcal / 4 g protein
Posene leveres i ulik størrelse, men det er viktig å merke seg at kaloriinnhold og proteininnhold er likt per millili ter uavhengig om man velger for eksempel SmofKabiven 1477 ml pose eller SmofKabiven 1970 ml pose. De perife re løsningene er mindre energitette og proteintette enn de sentrale løsningene.
Til alle flerkammerposer må det tilsettes vitaminer (vannløselige og fettløselige) og sporstoffer (tabell 4).
Når man starter ernæringsbehandling (uavhengig av type) hos underernærte pasienter, er det viktig med tett oppfølging initialt. Man må følge væskebalanse og moni torere følgende laboratorieverdier daglig: Elektrolytter (natrium, kalium, klor, kalsium, magnesium, fosfat), le verfunksjonsprøver, nyrefunksjonsprøver, blodsukker og triglyserider. Pasientene bør veies minimum to ganger per uke og følges med ernæringsscreening én gang per
“Husk tallet 30! (30 kcal/kg/døgn, 30 ml væske/kg/døgn, 30 ml/time)”
Parenteral ernæring Navn
Til bruk på perifer venekanyle
Til bruk på sentralt venekateter
SmofKabiven perifer – 70 kcal/ 3,2 g protein
Nutriflex omega peri –76,5 kcal/ 3,2 g protein
Olimel Peri N4E – 70 kcal/ 2, 53 g protein
SmofKabiven (elektrolyttfri) – 110 kcal/ 5,1 g protein
SmofKabiven extra nitrogen – 88,9 kcal/ 6,55 g protein
Olimel N5(E) – 99 kcal/ 3,29 g protein
Olimel N7(E) – 114 kcal/ 4,43 g protein
Olimel N9(E) – 107 kcal/ 5,69 g protein
Olimel N12(E) – 95 kcal/ 7,59 g protein
Nutriflex omega plus – 101 kcal/ 3,8 g protein
Nutriflex omega spesial (elektrolyttfri)- 118 kcal/ 5,6 g protein
Kommentar
3 kammer poser benyttes i hovedsak ved norske sykehus. Disse må alltid tilsettes vitaminer og mineraler for å bli fullverdige (gjelder alle tre-kammer poser både til perifer og sentral administrasjon)
Alle tre-kammer posene produseres i ulik størrelse mtp volum. Næringsinnholdet per 100 ml er likt uavhengig av pose størrelsen (i parentes for de ulike produktene)
Protein tilskudd
Tilsetninger
Vamin 14 g N/ L, Vamin 18 g N/ L
Fettløslige vitaminer
Vannløslige vitaminer
Vannløslig- og fettløslige vitaminer
Vitalipid Adult Soluvit
Viant, Cernevit
Alle tre-kammerposer tilsettes minimum en ampulle med vannløslige/fettløslige vitaminer og minimum en ampulle sporstoffer Sporstoffer Addaven, Nutryelt
uke (12). Det er viktig å være oppmerksom på komplika sjoner som kan oppstå. En av de metabolske komplikasjo nene som kan oppstå er reernæringssyndrom, som blant annet kan gi forstyrrelser i væske og elektrolytt balan sen. Komplikasjonen kan oppstå hos moderat og alvorlig underernærte, vanligvis i løpet av de tre første dagene etter oppstart/øking av ernæring. Endring til hyperkalo risk inntak (karbohydrater) vil blant annet gjøre at pasi enten går fra fettmetabolisme til karbohydratmetabolis me med rask insulinfrigjøring. Dette kan medføre blant annet fall i s-fosfat, s-magnesium og s-kalium, samt økt behov for tiamin. Det er viktig å være klar over at et lett fall i serum fosfat kan ha andre årsaker enn reernærings syndrom, og skal ikke automatisk medføre reduksjon av ernæringsbehandlingen (19,20). Andre komplikasjoner som kan oppstå er hyperglykemi, hypertriglyseridemi, fat overload syndrom, metabolsk acidose, kolestase, post-infusjonshypoglykemi og metabolsk beinsykdom. Ved tegn til metabolske komplikasjoner må man, avhen gig av alvorlighetsgrad, vurdere å utsette opptrapping av ernæringsbehandlingen, trappe ned hastigheten av behandlingen eller i svært sjeldne tilfeller midlertidig stoppe ernæringstilførselen. Videre må man korrige re elektrolyttforstyrrelser og sørge for adekvat tiamin tilskudd.
Underernæring er et vanlig problem i norske sykehus. Alle pasienter skal veies og ernæringsscreenes ved innleggelse.
Husk tallet 30! (30 kcal/kg/døgn, 30 ml væske/kg/døgn, 30 ml/time).
Gi pasientene enteral ernæring tidlig og unngå parenteral ernæring så langt det lar seg gjøre. Monitorer effekten og vær oppmerksom på mulige komplikasjoner.
KLIKK her for å se referansene på kirurgen.no
Monofer
ALLE PASIENTER SOM KAN BEHANDLES MED Monofer® og med kroppsvekt over 50 kg, kan få en enkelt dose som overstiger 1000 mg – med maksdose 2000 mg



EN REKKE pasienter kan dermed få dekket hele sitt individuelle jernbehov ved en enkelt infusjon med Monofer®
UTVALGT SIKKERHETSINFORMASJON
Skal ikke brukes ved: kjent overfølsomhet, anemi uten at det foreligger jernmangel, for høyt jernnivå eller forstyrrelser i kroppens utnyttelse av jern, dekompensert leversykdom. Brukes med forsiktighet ved akutt eller kronisk infeksjon. Bør ikke gis til pasienter med aktiv bakteriemi. Gis kun etter en grundig nytte-/risikovurdering ved nedsatt leverfunksjon. Skal ikke brukes under graviditet hvis ikke absolutt nødvendig. Behandlingen bør begrenses til 2. og 3. trimester. Føtal bradykardi kan oppstå. Vanlige bivirkninger: Kvalme, utslett, reaksjoner på injeksjonsstedet. Pasienten skal overvåkes nøye for tegn og symptomer på overfølsomhetsreaksjoner under og i minst 30 minutter etter hver administrering av Monofer
Jernbehovet kan bestemmes enten ved en forenklet tabell basert på Hb-verdi og kroppsvekt eller ved Ganzoni-formelen (se preparatomtalen). For å vurdere effekten av Monofer skal Hb-nivået revurderes tidligst 4 uker etter siste administrering. Ved ytterligere behov for jern, må dette utregnes på nytt. Ytterligere sikkerhetsinformasjon: Bør ikke brukes til barn og ungdom <18 år. Kan gi overfølsomhetsreaksjoner, inkl. alvorlige og potensielt dødelige anafylaktiske/anafylaktoide reaksjoner. Overfølsomhetsreaksjoner som har utviklet seg til Kounis syndrom er sett. Risikoen er økt ved kjente allergier og ved autoimmune eller inflammatoriske tilstander. Behandlingen må stoppes umiddel bart ved overfølsomhetsreaksjoner eller tegn på intoleranse under administrering. Pakninger og priser: Hetteglass: 5x1 ml kr 1532,40. 5x5 ml kr 7203,10. 2x10 ml kr 5770,60. Reseptgruppe C. Basert på SPC godkjent 26.05.2020. For ytterligere informasjon om Monofer, se SPC. Pharmacosmos A/S, Rørvangsvej 30, 4300 Holbæk, Denmark. www.pharmacosmos.com/nordic
TEMA: UTENFOR KOMFORTSONEN
1 AVDELING FOR TRAUMATOLOGI, OSLO UNIVERSITETSSYKEHUS
2 AVDELING FOR ANESTESIOLOGI, OSLO UNIVERSITETSSYKEHUS
3 AVDELING FOR SMERTEBEHANDLING, OSLO UNIVERSITETSSYKEHUS
4 UNIVERSITETET I OSLO
KORRESPONDANSE:
Årlig tas nesten 10 000 pasienter imot med traumeteam på sykehusene i Norge (1). Fokuset både prehospitalt og inhospitalt er livreddende tiltak. Mange pasienter har sterke smerter og dette behandles vanligvis hovedsakelig med sterke opioider uten strukturerte protokoller (2, 3). Mange pasienter blir utskrevet fra sykehus under pågå ende bruk av opioider, uten at det er lagt planer for vide re smertebehandling og nedtrapping av opioider (4). Ved siden av at langvarig opioidbruk gir utvikling av toleran se og hyperalgesi, er det vist at faren for opioidmisbruk og -avhengighet øker proporsjonalt med varighet av slik behandling (5). Hos pasienter som overlever store trau mer er kroniske smerter også et stort problem. Studier viser at to av tre pasienter med moderat til alvorlig skade har en risiko for å utvikle kroniske smerter (4, 6-8). Allike vel er det uklart hvordan kronisk smerte kan forebygges etter store skader (9).
På bakgrunn av disse forholdene gikk avdelingene for traumatologi, anestesiologi og smertebehandling ved Oslo universitetssykehus (OUS) i 2021 sammen for å utar beide en smerteveileder. Denne gir råd om hvordan man skal smertebehandle traumepasienten, hvordan trappe ned opioider og når man skal involvere smerteteamet.
Veilederen er primært rettet mot leger som er involvert i behandlingen av traumepasienter på ulike avdelinger ved sykehuset, men kan ha interesse utover dette. I den ne artikkelen gir vi en kort oversikt over hovedprinsip pene som er lagt til grunn for konkrete råd om smertebe handling av traumepasienter i sykehus.
GENERELLE PRINSIPPER Smerte etter traume/kirurgi er naturlig og skal ikke nød vendigvis elimineres helt. Et realistisk mål første tiden etter en skade er tolerabel smerte (bruk Numeric Rating Scale (NRS): 0-10) i hvile og under søvn, det vil si 0-3 i NRS. Smerte ved provokasjon kan (og vil!) være sterkere, men bør tillate nødvendig mobilisering og opptrening tilpasset aktuell skade/operasjon og tidspunkt i forløpet. Smerten skal primært behandles med multimodale, ikke-opioide metoder, og medikamenter bør gis peroralt om pasienten kan/har lov til å svelge.
Hos sirkulatorisk stabile og nyrefriske pasienter er NSAID et godt alternativ som basisbehandling i kombinasjon med paracetamol. I tillegg kan epiduralbehandling være aktuelt eller nerveblokader ved sterke, lokaliserte smer ter. Videre kan klonidin, gabapentinoid (pregabalin eller
Morfin Virker noe tregere enn de øvrige opioidene, gir muligens mindre «kick» og akutt rus, og muligens noe mindre fare for misbruk.
Oksykodon Er sammen med kodein de som ved enteral administrasjon absorberes best over i systemsirkulasjonen, henholdsvis 80 % og 60-70 %.
Kodein Er et pro-drug som omdannes til morfin (ca. 10 % på mg basis) for å gi analgesi. 5-10 % av kaukasiere mangler evnen til å omdanne kodein til morfin (dvs. har ingen effekt), mens 1 % har hyperaktiv omdanning og kan få farlig høye konsentrasjoner av morfin i blodet og eventuelt i morsmelken.
Tramadol Inneholder blant annet en serotonin re-opptakshemmer som gir hyppig kvalme generelt og kan gi forvirring hos eldre pasienter.
Tapentadol Er et opioid som også gir noradrenalin reopptak hemming, og derved en dobbel analgesi-mekanisme, hvorav den ikke-opioide komponenten bidrar til mindre kvalme og andre bivirkninger.
gabepentin), intravenøst ketamin, intravenøst lidokain, amitryptilin og engangsbehandling med steroid, være aktuelle alternativer (10).
Av og til er imidlertid ikke-opioide-metoder utilstrekkeli ge og man må supplere med opioider. Opioider vil være førstehåndsvalget ved smertelindring av akutte, sterke smerter. Opioider gir god analgesi uten øvre tak på ef fekt, spesielt i hvile. Opioider gir dårligere analgesi ved bevegelse og provokasjon, ved bruk over tid, ved nevro patiske smerte og ved langvarig smerte. Kjente doseav hengige bivirkninger ved bruk av opioider er: kvalme, tretthet, svimmelhet, konsentrasjonsvansker, kløe, urin retensjon, gastrointestinal retensjon/obstipasjon og redu sert søvnkvalitet. Ved bruk over tid utvikles toleranse for både analgesi og bivirkninger (unntatt for obstipasjon), samt abstinens ved brå seponering eller nedtrapping. Far lige bivirkninger er respirasjonsdepresjon og misbruk/ avhengighet. Opioider har innbyrdes en ganske lik effekt og bivirkningsprofil, men noen spesifikke medikament forskjeller er praktisk nyttige å kjenne til (se tabell 1).
All opioidbruk gir forbigående hyperalgesi når bruken stoppes, det vil si at pasienten får lavere smerteterskel i noen timer (ved kort bruk og/eller lave doser) til dager (ved lengre tids bruk og/eller høye doser).
Opioider skal fortrinnsvis bare brukes ved behov, titrert og individuelt dosert til effekt. Per oral behandling skal foretrekkes der det er mulig. I tidlig fase på sykehuset kan depotpreparater være gunstig å gi der hvor det forventes sterke smerter gjennom hele døgnet. Faren for misbruk av opioider øker ved bruk utover én uke og jo lengre tid man bruker opioider jo større risiko er det for misbruk og avhengighet (5). Pasienter som tidligere har kjent mis bruk av alle typer stimulantia (inkludert nikotin og alko
hol) eller medikamenter, og pasienter som har vanske lig sosioøkonomisk situasjon, pasienter som viser dårlig innsikt i egen helse eller med psykiatriske lidelser (nåvæ rende eller tidligere) står i økt fare for å utvikle misbruk og avhengighet. En annen utfordring med opioider er at ved bruk over én uke utvikler pasientene toleranse og kan få abstinenser ved brå seponering slik at behandling bør trappes ned individuelt etter tilpasset oppskrift (se tabell 2). Det er en fordel, og bør tilstrebes, at pasienten har vært opioid-fri det siste døgnet før utskrivelse, slik at man får vurdert analgesi ved et adekvat ikke-opioid opplegg før pasienten drar.
Hva skal stå i epikrisen ved utskrivelse og hva skal formidles i klartekst til pasienten og fastlegen? Generelt kan råd om smertebehandling i epikrisen deles inn etter hvilken av de tre gruppene (se under) man me ner pasienten hører inn under på utskrivingstidspunktet:
Pasienter hvor det allerede er etablert (det vil si gjen nom minst ett døgn) en ikke-opioid, medikamentell analgesi med et tilfredsstillende resultat: Disse pasientene bør få råd om videre bruk av parace tamol, så lenge det er behov. Pass på at pasienten ikke overstiger maksimal anbefaling, spesielt om pasienten har kjent leversvikt eller kjent etylmisbruk. For øvrig er paracetamol et «ufarlig» medikament.
Videre bør pasientene få råd om videre bruk av NSAID/ COX-II hemmer på toppen av paracetamol så lenge pa racetamol alene ikke er tilstrekkelig. Eventuelt kan man legge inn en tidsbegrensing (en til to uker), med eventuelt ny vurdering hos fastlege. COX-II hemmer (etoricoxib el ler celecoksib) gir mindre bivirkningsfare og innebærer ikke kardiovaskulær tilleggsrisiko ved bruk inntil to til fire uker.
< 2 uker kutte direkte ut, evt mellomfase med 50 % av dosen i 2-3 dager
2-4 ukers bruk 25% ned hver 3. dag 4-6 ukers bruk 20% ned hver 5. dag >6 ukers bruk: 20% ned hver 2. uke, eller 10 % ned hver uke
Her er det viktig å vurdere bivirkningsfare (gastrointesti nalt, nyre og eventuelt sårtilheling).
Har pasientene behov for ytterligere smertelindring utover paracet og NSAID, kan man vurdere andre ikke-opioide medikamenter ved behov. Disse bør være startet opp under oppholdet: gabapentin, pre-gabalin, klonidin, amitryptilin vesp.
Pasienter hvor man forventer opioidbehov i en til tre dager etter utskrivelse
Disse pasientene bør få med seg aktuelle tabletter i en pose, eventuelt en avgrenset (det vil si mindre enn stan dard resept) resept på medikament: Mest aktuelt vil være oksykodon, kortvirkende og/eller depotformulering. Ved noe mindre sterk smerte kan eventuelt tapentadol (even tuelt tramadol eller paracet-kodein kombinasjon) benyt tes. Ved vedvarende opioidbehov utover to til tre dager, bør de henvende seg til fastlegen for eventuell videre opioidforskrivning. I spesielle tilfeller kan pasienten hen vises til sykehuset/polikinikken. Når pasienten bruker opioider er det viktig at pasienten tar både paracetamol og NSAID/COX II i faste, profylaktiske doser, tre til fire ganger daglig.
Pasienter hvor man forventer opioidbehov utover tre til fem dager etter utskrivelse og/eller pasienter som har brukt opioid mer enn en til to uker sammenheng ende under oppholdet og frem til utskrivelse Det er hovedsakelig fastlege som skal forskrive vanedan nende medikamenter, fastlege må derfor informeres via epikrise. Epikrisen må inneholde en individuell plan for smertebehandling den første perioden etter utskrivelse. Planen bør si noe om hvor lenge man forventer et opioid behov, hva som er anbefalte doser og oppskrift for ned trapping der dette er aktuelt (se tabell 2).
• Pasienter med kroniske, klinisk betydningsfulle smerter forut for traume
• Pasienter med regelmessig opioidforbruk forut for traume
• Pasienter uten smertekontroll med konvensjonelle regimer (det vil si: Paracetamol, NSAID/coxib og opioid i «normale doser»)
• Behov for regionalanalgesi ut over fem døgn
• Pasienter med sterke, lokaliserte smerter hvor regionalanalgesi ville vært ønskelig, men ikke kan brukes (for eksempel koagulopati eller høydose LMWH)
• Pasienter med epidural-analgesi og samtidig bruk av antikoagulantia (eksempel: LMWH > 5000 IE/døgn)
• Pasienter under legemiddel assistert rehabilitering (LAR) -oppfølging
• Pasienter med rusmisbruk
• Pasienter med uttalt psykologisk sårbarhet: Katastrofetenkere, de med stort informasjonsbehov
• Pasienter med alvorlig psykiatrisk lidelse og/eller med medikasjon som antidepressiva, anxiolytika eller gabapentinoider og et samtidig smerteproblem
KLIKK her for å se referansene på kirurgen.no
Retningslinjen er Helsedirektoratets desidert hyppigst brukte retningslinje, med over 70 000 oppslag per måned, og over 100 oppslag per time på natten. Helsemyndigheter anser retningslinjen som et viktig styringsverktøy for antibiotikabruk i Norge. Samtlige kapitler i Helsdirektoratets retningslinje vil være reviderte innen sommeren 2022.
BJØRN WAAGSBØ SPESIALIST I INDREMEDISIN OG INFEKSJONSSYKDOMMER ST. OLAVS HOSPITAL HF KAPITTELANSVARLIGRevisjonen av kapittelet begynte i mai 2021 ved etablerin gen av et fagnettverk sammensatt av spesialister innen infeksjonssykdommer, gastrokirurgi, gastroenterologi, mikrobiologi og nefrologi. Gjennom nettmøter har fag nettverket drøftet og vurdert tidligere etablerte terapi anbefalinger opp mot oppdatert litteratur og øvrige retningslinjer, og kommet fram til flere revisjoner som presenteres her. Klinikere vil nå finne tydeligere og pri oriterte anbefalinger, både når det gjelder regimer og behandlingslengder.
For intraabdominale infeksjoner (IAI) er kombinasjo nen kirurgi og antibiotika sentral for utfallet. En viktig bemerkning, er at kunnskapsgrunnlaget de siste årene er betydelig styrket for å utføre adekvat kirurgi for vel lykket infeksjonsbekjempelse. Antibiotika ansees derfor i større grad som adjuvant terapi for å unngå kompliseren de forhold. Med adekvat kirurgi forstås tidlig og tilstrek kelig kirurgisk intervensjon for å oppnå kontroll med infeksjonsfokus. For pasienter som derved oppnår tidlig kirurgisk kontroll med intraabdominalt infeksjonsfokus, er anbefalinger om antibiotikalengder vesentlig kortere enn før.
Trippelregimet (ampicillin + gentamicin + metronidazol) er velkjent blant kirurger. Regimet er vurdert og på nytt funnet dekkende for mange IAI. Til grunn for dette ligger vurderinger av norske resistensforhold og lang erfarings basert kunnskap. Dette betyr at flertallet av pasienter med IAI skal tilbys trippelregimet. Noen pasienter kan imidlertid ikke få gentamicin, og her tilbyr retningslinjen
andre regimer. Det sentrale blir dermed å dokumentere grunner til å fravike trippelregimet.
ALVORLIGHETSBEDØMMING
En strukturert alvorlighetsbedømming skal ligge til grunn for antibiotikavalg ved IAI. Dette er spesielt presisert i retningslinjen fra Surgical Infection Society fra 2017 (1). Flere faktorer ved infeksjonsdebut påvirker klinisk forløp og utfall. Både morbiditet og mortalitet for sykehuserver vet IAI skiller seg vesentlig fra samfunnservervet IAI. En strukturert alvorlighetsbedømming skal ta disse forhol dene i betraktning, og reviderte antibiotikaanbefalinger legger slike bedømminger til grunn. Dokumenterte al vorlighetsbedømminger skal bidra til avklaringer rundt antibiotisk strategi.
SEKUNDÆR PERITONITT
Sekundær peritonitt er en IAI i bukhulen som konsekvens av annen lokalisert IAI. Tilstanden forekommer hyppig. Empirisk standardbehandling fra 2022 er trippelregimet. Dette representerer dermed et skifte fra tidligere an befaling om bruk av piperacillin-tazobaktam. Se tabell for regimer til pasienter som ikke kan motta trippelregimet.
SPONTAN BAKTERIELL PERITONITT
Spontan bakteriell peritonitt (SBP) er en infeksjon som inntrer hyppigst hos pasienter med underliggende kro nisk leversykdom med cirrhose. Tidligere standardbe handling med cefotaksim monoterapi i 5 døgn er opprett holdt, på bakgrunn av evidensbasert kunnskap i tidligere kliniske studier. Revisjonen har i tillegg utarbeidet nye anbefalinger for antibiotikaprofylakse til pasienter med akutt gastrointestinal blødning, eller dekompensert le versykdom, for å redusere risiko for SBP.
Sekundær peritonitt
Appendicitt
Trippelregimet1 Cefotaksim + metronidazol
Trippelregimet1
Piperacillin-tazobaktam
Piperacillin-tazobaktam
Piperacillin-tazobaktam
Kolecystitt
Divertikulitt, komplisert
Trippelregimet1 Ceftriakson + metronidazol
Trippelregimet1 Ceftriakson + metronidazol Piperacillin-tazobaktam
Piperacillin-tazobaktam Kolangitt
Trippelregimet1 Piperacillin-tazobaktam Piperacillin-tazobaktam
Spontan bakteriell peritonitt Cefotaksim
Pankreatitt, infiserte nekroser Piperacillin-tazobaktam
Leverabscess
Piperacillin-tazobaktam
1Ampicillin + gentamicin + metronidazol i kombinasjon
2Ved etablert nyresvikt, ved organdysfunksjoner i et infeksjonsforløp (= sepsis), og ved høy, samlet nefrotoksisk byrde
3Vurdert ut fra en strukturert alvorlighetsbedømming ved diagnosetidspunktet
Primærbehandling for appendicitt hos voksne er tidlig appendektomi innen 24 timer. Trippelregimet skal på startes til pasienter med uttalt sykdomsbilde som venter på primærbehandlingen, til pasienter som av ulike grun ner ikke kan gjennomgå primærbehandlingen, og til pa sienter med komplisert appendicitt (perforasjon, abscess, peritonitt). Ukompliserte appendicitter skal kun motta antibiotika preoperativt, mens kompliserte appendicitter bør ha antibiotika også postoperativt i 3 – 5 dager.
For akutt kolecystitt gjelder at pasienter skal tilbys tidlig, lapraskopisk, subtotal kolecystektomi som primær behandling. Antibiotika med trippelregimet er indisert til pasienter med ukomplisert, moderat eller alvorlig syk domsbilde inntil primærbehandlingen, men ikke etter. For pasienter som ikke kan gjennomgå kolecystektomi el ler ved komplisert forløp av kolecystitt (ruptur, abscess, peritonitt), er også antibiotika indisert. Total behandlings tid på 4 dager vil for de fleste infeksjoner være adekvat, forutsatt kontroll med infeksjonsfokus.
Primærbehandlingen ved kolangitt er det kirurgiskeeller intervensjonstiltaket som sikrer adekvat galledre nasje. Empirisk standardbehandling med trippelregimet er uansett alltid indisert som støtteterapi ved kolangitt. Total behandlingstid på 4 dager vil for de fleste infeksjo ner være adekvat, forutsatt kontroll med infeksjonsfokus.
Den reviderte retningslinjen anbefaler at ukomplisert divertikulitt observeres uten antibiotika. Dette på bak grunn av randomiserte studier og øvrige internasjonale retningslinjer. CT abdomen vil langt på vei kunne avklare eventuelle kompliserende forhold. Komplisert divertiku litt omfatter situasjoner med abscess, fistel, obstruksjon, perforasjon, pneumoperitoneum, peritonitt, immunsvikt
og sepsisutvikling. Empirisk standardregime er, som før, trippelregimet, hvor de aller fleste infeksjonene kan be handles i 4 døgn.
Revisjonen har vektlagt at kun pasienter under klinisk mistanke om infiserte nekroser ved akutt pankreatitt skal tilbys antibiotika. Gjennomsnittlig debuttidspunkt for infiserte nekroser er etter 12 dager fra symptomstart. Revidert empirisk standardbehandling er piperacil lin-tazobaktam, og ikke et karbapenem som før. Fast be handlingslengde kan ikke sikkert fastslås, men vurderes ut fra klinikk, radiologi og biokjemi.
Ved pyogen leverabscess er kombinasjonen kirurgisk drenasje og antibiotika viktigste behandlingsprinsipper. Abscessene er ofte polymikrobielle. Empirisk standard regime er piperacillin-tazobaktam. Fast behandlings lengde kan ikke sikkert fastslås, men vurderes ut fra klinikk, radiologi og biokjemi.
Adekvat kirurgi betyr tidlig og tilstrekkelig kirurgisk intervensjon for å oppnå kontroll med infeksjonsfokus. Denne er vektet betydelig sterkere enn før, og impliserer derfor kortere antibiotikakurer ved IAI. Trippelregimet er i høyeste grad fortsatt effektivt vurdert ut fra følsom het hos mikrober i Norge, og skal derfor være empirisk standardbehandling for de fleste IAI. Strukturert alvor lighetsbedømming ved IAI er for lengst anbefalt strate gi, og bør gjennomføres og dokumenteres rutinemessig. Denne strategien identifiserer pasienter som skal tilbys annet regime enn trippelregimet.
1. Mazuski JE, Tessier JM, May AK, Sawyer RG, Nadler EP, Rosengart MR, et al. The Surgical Infection Society Revised Guidelines on the Management of Intra-Abdominal Infection. Surg Infect (Larchmt). 2017;18(1):1-76.
Siden 2005 har Avdeling for traumatologi hatt ansvar for å kvalitetssikre den initiale diagnostikken og behandlingen av potensielt alvorlig skadde pasienter ved OUS. I tillegg skal avdelingen sikre kontinuitet i den videre behandlingen gjennom sykehuset. Avdelingen har også ansvar for å koor dinere og bistå i kvalitetssikring av traumefunksjon i Helse Sør-Øst. I 2019 opprettet avdelingen en sosionomstilling som et bidrag til en mer helhetlig forståelse av traumepasientens behov. Jeg ble ansatt i stillingen og vil i dette innlegget redegjøre for noen av mine foreløpige erfaringer om hva sosionomen kan bidra med i traumeforløpet.
RACHEL JØRGENSEN AVDELING FOR TRAUMATOLOGI, OSLO UNIVERSITETSSYKEHUS ( OUS ) ULLEVÅL KORRESPONDANSE: RACHEL JØRGENSEN RACJOE @ OUS HF.NOEn sosionom har bachelor i sosialt arbeid. Sosionomen arbeider med enkeltpersoner, familier eller grupper med formål om å forebygge, redusere og mestre sosiale- og helsemessige problemer. Kommunikasjonsferdigheter og relasjonsbygging er en viktig del av kompetansen og sosionomen tilbyr samtaler som kan bidra til motivering og mobilisering av den enkelte og samfunnets ressurser (1). Brukermedvirkning og hjelp til selvhjelp er viktige prinsipper.
Sosionomen jobber innen områder som for eksempel sy kehus, NAV, fengsel, rus og psykisk helse.
Innen veldedighet strekker sosialt arbeid seg langt tilba ke i tid. Som fag startet sosialt arbeid i helsevesenet og på sykehusene. Allerede i 1905 så legen Richard Cabot fra Boston sammenhengen mellom pasientenes sosiale situasjon og deres sykdomstilstand. Ifølge Cabot var ikke legene villige til å bruke kunnskapen om hvordan sosia le og økonomiske forhold kunne påvirke folks helse. Den medisinske kunnskapen hadde forrang. Han viste til at sykehuspasienter som hadde fått behandling for sine syk domssymptomer, ble sendt hjem til de samme forholde
ne som hadde bidratt til sykdommen. Cabot fikk ansatt sosialarbeidere som en del av sykehusets stab. Dette sik ret en bro mellom sykehuset og livet utenfor. Modellene foregangskvinnene i USA utviklet i praksisutøvelsen, var sterkt påvirket av medisinfagets systematiske og meto diske tilnærming (2)
Norges første sosialarbeiderutdanning startet i 1920, med inspirasjon fra utlandet. I 1950 ble utdanningen i statlig regi. Også i Norge startet faget sosialt arbeid på sykehusene. Sosialarbeiderne var pionerer når det kom til å se og arbeide med sammenhengen mellom livsvilkår og menneskers helse. I dag er dette en del av folkehelse perspektivet (2).
Uavhengig av arbeidsområde er sosionomer vant til å jobbe med mennesker i krise og vanskelige livssituasjo ner. Noe skiller likevel sykehussosionomer fra sosiono mer som jobber andre steder. Sykehussosionomene job ber i større grad etter en biopsykososial arbeidsmodell, som inkluderer sosiale, kroppslige, psykologiske, eksis tensielle og relasjonelle faktorer (3).
Antall sosionomer ansatt i somatiske sykehus i Norge er nedadgående, med 315 ansatte i 2008 til 295 ansatte
i 2018 (4). Hvis vi ser til Sverige, har sosialarbeideren en mye sterkere rolle på dette området, med 4000 sosialar beidere ansatt i den offentlige helsesektoren (3).
OUS Ullevål er regionalt traumesenter for Helse Sør-Øst og har i underkant av 2000 traumealarmpasienter i året.
Traumepasientene er fordelt i ulike aldersgrupper med en gjennomsnittsalder på 44 år. 63% av traumepasiente ne er i yrkesaktiv alder og 70% er menn (5). Personer fra lavere sosioøkonomiske grupper er mer utsatt for skader enn personer fra høyere sosioøkonomiske grupper (6).

Etter at avdeling for traumatologi ble opprettet som en dedikert enhet i 2005 og man startet med systematisk traumeoppfølging, har pasienter som overlever svært al vorlig skade økt betraktelig (7).
Av 1943 traumepasienter i 2020 ble 1140 pasienter skre vet ut direkte til bopel (5). Av disse var 241 pasienter al vorlig skadet med ISS>15. 98 pasienter ble skrevet ut fra Ullevål sykehus til rehabiliteringsopphold, hvorav 81 pa sienter hadde ISS>15. Fra OUS Ullevål er det således flere pasienter som blir skrevet ut direkte til hjemmet sitt etter alvorlig skade enn som skrives ut til rehabiliteringsinsti tusjon.
Det har i flere tiår vært en nedgang i antall dødsulykker (6). Skader og ulykker er likevel en stor utfordring for folkehelsen. Omlag 12% av befolkningen (over 620 000) behandles for skader hvert år. I overkant av 280 000
personer fikk behandling i spesialisthelsetjenesten. Fle re av pasientene vil være i behov av rehabilitering for å komme tilbake til hverdagen. Samtidig med den fysiske og medisinske rehabiliteringen, starter det en sosial og psykososial rehabilitering.
Kommunene har et stort ansvarsområde. Ikke bare skal kommunen sørge for en helhetlig tilnærming med fore bygging, tidlig intervensjon, tidlig diagnostikk, behand ling og oppfølging (8). Den skal også tilby og yte tjenester som skal bidra til stimulering av egen læring, motivasjon, økt funksjons- og mestringsevne, likeverdighet og delta kelse til alle personer som har behov for sosial, psykoso sial eller medisinsk rehabilitering (9). Kommunene har et bredt tilbud av tjenester. I tillegg finnes det organisasjo ner, foreninger og likemannsstøtte (andre som har vært/ er i samme situasjon). Å bistå pasienter og brukere i å komme i kontakt med relevante fagpersoner og tjenester er også noe kommunene har ansvar for (10).
I Nasjonal helse- og sykehusplan 2020-2023 er ett av fo kusområdene at pasienter skal oppleve sammenheng ende tjenester på tvers av sykehus og kommuner (11).
Utfordringer
Med så mange tilbud, rettigheter og gode intensjoner, fin nes det da noen utfordringer innen rehabilitering?
Stortingsmelding 26 peker på at det er mange utfordrin ger i den kommunale helse- og omsorgstjenesten. Man ge pasienter får ikke den rehabiliteringen de har behov for. Ofte kartlegges og vurderes ikke behovet for rehabi
litering. Kompetanse, ledelse, holdninger og kultur i tje nesten blir pekt på som årsaksfaktorer. På noen områder er det kapasitetsutfordringer og for dårlig tilgjengelighet. Det legges ikke nok vekt på forebygging. Tjenestene er si loorganisert og ses ikke i sammenheng som en nødvendig helhet, og det er behov for bedre koordinering (12). Det ble laget en opptrappingsplan for habilitering og rehabi litering 2017-2019 (13). Evalueringen av planen viser at den har økt fokuset på et område som historisk har vært nedprioritert, men det er likevel uvisst om feltet har blitt styrket i perioden 2017-2019 (14).
Oddvar Uleberg, spesialist i anestesiologi, har i en studie sett på sammenhengen mellom hvordan skadealvorlig het på lang sikt påvirker pasientens evne til å komme tilbake i jobb og behovet for medisinske støtteordninger som sykepenger, arbeidsavklaringspenger og uføretrygd (15). Studien bekreftet at alvorlige skader gir betydelige langtidseffekter, med høyere forekomst av medisinske støtteordninger, men også forsinket tilbakeføring til ar beid. Mer overraskende viste studien at pasienter med mindre og moderate skader hadde høyere risiko for ne gative langtidseffekter enn tidligere antydet. Langtidsef fektene var ikke tilstander som nødvendigvis trengte sy kehusinnleggelse. Det dreide seg mer om oppfølging som omhandlet helserådgivning, strategier for å tåle smerte eller ubehag, problemer med redusert mobilitet ved dag lige aktiviteter, og angst og depresjon. Studien understre ker viktigheten av langtidsoppfølging, også hos dem med mindre og moderate skader, som et ledd for å redusere samfunnets totale skadebyrde.
Hva er pasientenes erfaringer når det gjelder selve ut skrivelsen fra sykehus? Folkehelseinstituttet har gjen nomført brukererfaringsundersøkelser blant et utvalg personer som var utskrevet fra døgnopphold ved soma tiske sykehusavdelinger, sist gjennomført i 2019 (16). De konkluderer med at pasienter på landsbasis gir forholds vis gode tilbakemeldinger om erfaringene sine fra selve sykehusoppholdet. Pleiepersonalet, legene og ivaretakel se av pårørende har fått de høyeste skårene. Pasientene har tillitt til legenes faglige dyktighet og de føler seg iva retatt. De laveste skårene er gitt utskrivning og samhand ling. Med samhandling menes samarbeid mellom syke hus og fastlege, hjemmetjenesten eller andre kommunale tjenester. Resultatene fra 2019 indikerer, som i tidligere undersøkelser, at pasienter generelt vil ha nytte av at sykehusene forbedrer sin praksis knyttet til utskrivning og samhandling.
SOSIONOMENS ROLLE GJENNOM TRAUMEFORLØPET
Arbeidsoppgavene til sosionomen varierer ut fra hvor pasienten er i forløpet.
Intensivavdelingen
I denne delen av forløpet vil oppfølgingen til sosionomen først og fremst være rettet mot pårørende. Livet har tatt en brå og uventet vending og noen pårørende kan være i livskrise. Støttesamtale med sosionom er ett av samtale tilbudene pårørende kan få.
Da jeg startet i jobben var forventningen min til oppføl gingen på intensivavdeling at det først og fremst ville være støttesamtaler og kriseoppfølging. Jeg har imidler tid erfart at mange pårørende blir opptatt av det praktis ke. Kanskje tyder det på et behov for å få livet til å funge re i en vanskelig tid. Muligens handler det like mye om å få en følelse av kontroll i en periode der så mye annet er utenfor deres kontroll.
Et vanlig spørsmål fra pårørende er om det er noe de burde tenke på eller ta tak i. For noen er det viktig at pa sientens inntekt ikke stopper opp. Kan pårørende sende inn søknad om sykepenger på vegne av pasienten når pasienten ikke kan gjøre det selv? Hva om pasienten ikke har inntekt ved innleggelsestidspunkt? Er det stønader man bør søke? Andre lurer på hvordan de kan få betalt pasientens løpende utgifter i perioden vedkommende ikke klarer det selv. Når er det nødvendig å søke verge? Noen pårørende kan i akuttfasen få ekstrautgifter, som reise, kost og losji, og trenger råd og veiledning til hvor dan dette kan håndteres.
Klare råd for hva de bør gjøre nå og hva de kan håndtere senere, reduserer bekymring og gir et større overskudd til selvivaretakelse. Min erfaring er at pasienter og pårø rende sjelden spør om hjelp til den praktiske og økono miske delen av rehabiliteringen. Det er ikke fordi de ikke tenker på det. De vet bare ikke at de kan spør om dette på sykehuset, de vet ikke hva de skal spørre om eller de vil ikke belemre oss med «dette også». Sykehuset bør derfor ha en proaktiv tilnærming i arbeidet med å definere pasi enten og pårørendes behov. Samarbeid med andre, både innenfor og utenfor sykehuset, er en del av jobben under alle faser av forløpet.
På sengepostene er arbeidsoppgavene stort sett knyttet til pasienten. Ved ulykker har ikke pasienten planlagt
innleggelsen. Det kan være praktiske ting som må ord nes, eller man ønsker støttesamtale.
Sosionomen kan hjelpe pasienten med å følge legens an befalinger. Hvordan skal pasienten klare å unngå tunge løft når vedkommende er alene med små barn? Påvirkes familien? Hvilke følger får skaden for økonomien? Fin nes det hjelpeordninger? Hvilke rettigheter har man et ter yrkesskade? Hvilke instanser kan hjelpe om man har blitt utsatt for vold? Hvilke forsikringer gjelder om man har blitt påkjørt som fotgjenger og gjerningsperson har stukket av?
Sortering, veiledning og mestring inngår i samtalene med sosionomen, men også rådgivning om hjelpeinstanser og rettigheter etter utskrivelse. Sosionomen ser pasienten i sammenheng med sitt miljø og kjenner til hjelpeinstan ser og rettigheter utenfor sykehuset.
Flere og flere pasienter overlever etter alvorlig skade. Skader og ulykker er en utfordring for folkehelsen. Syke husene og kommunene bør derfor være opptatt av hvor dan det går med pasienter som har blitt utsatt for skade. Etter behandling på Ullevål sykehus overføres en del pa sienter til rehabiliteringsinstitusjon, men hovedtyngden av traumepasientene skrives ut til hjemmet, inkludert pasienter med alvorlig skade. Det legger et ansvar på oss som jobber på sykehuset å sørge for at overgangen fra sy kehus til hjem blir så god som mulig. Dersom overføring hjem og oppfølgingen etterpå ikke er god nok, risikerer vi at arbeidet som er investert på sykehuset blir forringet. Flere ting peker i retning av at sykehusene bør ha større fokus på nettopp denne overføringen. Det har lenge vært pekt på at pasienter ikke får den rehabiliteringen de har krav på. Ofte blir ikke behov kartlagt og vurdert. Overfø ring hjem og samhandling med fastlege, hjemmetjeneste og andre kommunale tjenester er de områdene pasien tene scorer svakest i pasientundersøkelser. Større fokus på de som overlever etter skader, både de med alvorlig og moderat skade, vil kunne bidra til at pasienter kom mer raskere tilbake til hverdagslivet sitt. Det vil ikke bare være en besparelse for den enkelte pasient og dens fami lie, men også for samfunnet.
Som ny sosionom i somatikken har jeg undret meg over at det er så få sosionomer i somatikken i Norge. Det er be tenkelig når vi vet at sosiale problemer påvirker helsen og helsemessige utfordringer får sosiale konsekvenser.
Sosionomene på sykehus har som regel heller ingen so sionomer å overføre saker til i kommunen, slik sykeplei ere, ergoterapeuter og fysioterapeuter har. Det blir mye opp til pasient og pårørende å finne ut av rettigheter og muligheter på egenhånd. Resultatet blir da tilfeldig, av hengig av pasient og pårørendes ressurser, og bidrar ikke til likeverdige helse- og omsorgstjenester for alle.
Flere av utfordringene som blir pekt på innen rehabili teringsfeltet er sosionomens styrker. Vi ser pasienten i sammenheng med sitt miljø. Fra primærhelsetjenesten er vi vant til å koordinere tjenester for den enkelte. Vi vet om rettigheter og muligheter. Vi er også trente på samta ler som handler om motivering, endring og det å stå i en vanskelig livssituasjon.
Sosialarbeiderne var de første som jobbet med sammen hengen mellom livsvilkår og helse. Tidlig på 1900-tallet ble sosialarbeiderne ansett som et viktig bindeledd mel lom sykehus og verden utenfor. Jeg mener at pasienter fortsatt har nytte av en sosionom i den tverrfaglige be handlingen og oppfølgingen. Spesielt traumepasienter som plutselig må forholde seg til en ny livssituasjon etter å ha blitt skadet. Det kan oppleves overveldende å be finne seg i en ny situasjon og samtidig finne ut av ret tigheter og hjelpeinstanser. Det er forståelig. Pasienten er nybegynner på skaden sin. Det er sykehuset som har mengdetreningen. De ansatte vet at det trengs råd, infor masjon og veiledning. Ved å ha en proaktiv tilnærming når det gjelder å definere pasient og pårørendes behov kan vi forebygge problemer som kan komme. Dersom pasienter og pårørende får hjelp til den sosiale og psy kososiale rehabiliteringen, vil det redusere usikkerhet og bekymring, og de kan bruke kreftene sine på det som fak tisk er det viktigste; selvivaretakelse og den medisinske rehabiliteringen.
Vi som jobber på sykehuset har ulik fagkompetanse. Ved å bruke hverandres styrker kan vi hjelpe hverandre til å gi et best mulig behandlingstilbud til pasienten.
KLIKK her for å se referansene på kirurgen.no
In 1978, Marilyn Loden, a manager at the New York Te lephone Company, was asked to fill in on a panel at the Women’s Exposition entitled “Mirror, Mirror on the Wall”, which was focused on how a woman’s poor self-image can limit their advancement in the workforce. On that day, Ms. Loden is credited with coining the term “glass ceiling” in describing an invisible barrier to the advan cement of women that most people did not recognize (1). The term was eventually picked up by the media and in 1986 an article appeared in the Wall Street Journal entit led “The Glass Ceiling”, which reviewed the social science on this topic and interviewed male and female managers in a variety of settings. They blamed the glass ceiling on the beliefs and preferences of male managers regarding women in leadership.
In 1989, Elizabeth Dole launched the “Glass Ceiling In itiative”, which became a project of the United States (US) Department of Labor with a goal to “identify syste matic barriers to the career advancement of minorities and women” and then work with companies to address them. They defined the glass ceiling as “those artificial barriers based on attitudinal or organizational bias that prevent qualified individuals from advancing upward in
their organizations into management level positions.” In 1992, Catherine Berheide conducted a study of women and ethnic minorities in state and local government and coined the term, “sticky floors” to denote those individu als who were stuck in low paying jobs with very limited opportunity for promotion (2).
As a result of these efforts, women have made a lot of progress in the workforce but there are clearly issues that need to be addressed. In 2020 women accounted for 55.9% of the labor force in the US but held only 29.9% of chief executive positions and led only 7.4% of Fortune 500 companies. The profession of surgery has mirrored these challenges. While over 50% of students entering medical school in the US are women, as of 2016, 38.5 % of general surgery residents, 25% of assistant professors, 19% of associate professors and only 9.8% of full profes sors in departments of surgery were women (3). This was an improvement from 1994, when only 3.4% of full pro fessors were women, but it suggests we still have a long way to go. At this pace, it would take 121 years to reach a representation of 50%. This problem is not unique to the US. Data from the United Kingdom demonstrated that as of 2020, 13.2% of surgical consultants were women and
among the subspecialties, trauma and orthopedics had the lowest proportion at just over 7% (4).
In her Presidential address for the Association of Aca demic Surgery in 2017, entitled “Sticky Floors and Glass Ceilings, Dr. Caprice Greenberg discussed the many chal lenges faced by women seeking to advance in surgery (5). She highlighted the salary gaps between men and women surgeons and studies that have demonstrated that 40% of that gap cannot be explained by different career traje ctories or specialty choices. She also spoke to the impact of implicit bias on early career investment and grant fun ding, which can be a significant disadvantage to women at the outset of their academic career. Finally, she spoke frankly about the challenges women surgeons face in na vigating expected gender schemas.

These challenges are not unique to the US and varying cultural issues that impact women across the world can further impact women in surgery. Societal expectations of gender roles may limit opportunities for women to pursue a surgical career. A recent paper from Pakistan reported that while 70% of students entering medical school in Pakistan are women, women represent only
14% of surgeons who have completed training since 1967 (6,7). Furthermore, it is reported that approximately 50% of female doctors do not practice or undertake specialty training after graduating from medical school due to fa mily and social pressures. In a survey of over 200 women surgeons, > 80% of Pakistani surgeons noted that gender discrimination and bias impacted their job satisfaction, and 56.4% were told they could not become a surgeon because of their gender. Particular challenges were no ted in identifying senior mentors and in interacting with nurses. Another study which surveyed women surgeons in Japan identified gender biased discrimination and a lack of family support as impeding their careers (8).
As trauma systems have developed around the world, the most severely injured patients are triaged to regional trauma centers with the appropriate resources to opti mize outcome. While the initial surgical care of injured patients remains an important part of the training for all general surgeons, the advanced care of these patients has become a specialty in many countries. In the US, the field of Acute Care Surgery (ACS) which encompasses trauma,
emergency general surgery and surgical critical care was initially described in 2005, and through the leadership of the American Association for the Surgery of Trauma has developed into a specialty with dedicated fellowships and training curriculum. In other countries, surgical care for trauma patients remains coupled with orthopedics. In any event, it is evident that more women are ente ring this field and the ACS model, which emphasizes a team-based approach, has been very popular among sur gical residents, offering the potential for a better balance of clinical and non-clinical commitments. A recent sur vey of US hospitals demonstrated that 50% of hospitals had at least one woman surgeon providing Emergency General Surgery care and 9.4% had over 40% women on the ACS faculty (9).
Since the Association of Women Surgeons was establis hed by Dr. Patricia Newman in 1981, the importance of supporting career advancement and leadership oppor tunities for women in surgery has been recognized. It is encouraging to see an increasing number of women in leadership positions in our professional trauma societies. The major trauma surgery associations in the US include the American Association for the Surgery of Trauma, the Western Trauma Association (WTA) and the Eastern As sociation for the Surgery of Trauma (EAST) and the Ame rican College of Surgeons (ACS) Committee on Trauma (10). The AAST has had two women serve as president in 1998 and 2016, with a third due to take office in 2023. The WTA elected its first woman as president in 2009 with additional women serving in 2015 and 2019. EAST has had women surgeons as president in 2007, 2014, 2016, and 2022. The American College of Surgerons appointed the first woman to serve as Chair of the Committee on Trauma in 2018. The European Society for Trauma and Emergency Surgery was founded in 2007 and Dr. Inger Schipper from the Netherlands was appointed as the first woman to serve as president in 2021. The International Association for Trauma Surgery and Intensive Care ap pointed Dr. Christine Gaarder from Norway as its first fe male President in 2017, followed by Dr Elmin Steyn from
South Africa. Representation of women in these leaders hip positions offers inspiration for the increasing num ber of young women surgeons entering our field.
In 2020, a group of senior women in trauma surgery from across the globe began meeting virtually for mutu al support and advice as the challenges of the COVID-19 pandemic unfolded. Encouraged by the global reach of virtual meeting platforms and recognizing the need for ongoing dialog to address the issues facing women surge ons across the globe, this group evolved into the Women in Trauma Surgery (WITS) group, which is now sponso red by the AAST. We are an international group of surge ons, open to all (men and women) who are interested in addressing the sticky floors and glass ceilings that conti nue to prevent everyone from thriving in their chosen profession. We hosted two days of international panel discussions as part of the All Levels Trauma Care Confe rence hosted by the Saudi Arabian Academy of Sciences in 2020 and 2021 addressing topics such as: leadership in trauma, surgical ego, gender disparities in trauma care, work life balance, navigating interpersonal conflicts, cultural challenges in trauma surgery, and empowering the next generation of trauma surgeons. We are now hol ding quarterly webinars to continue these challenging conversations and provide opportunities for networking. We hope that this forum will be a source of international collaboration to clean our sticky floors and eliminate the glass ceiling across our profession.
All are welcome! If interested in joining WITS, send your name and contact information to aast@aast.org and ask to be added to the WITS mailing list and you will receive the invitations to join these sessions. There is no cost to participate.
REFERANSER:
KLIKK her for å se referansene på kirurgen.no
“Women have made a lot of progress in the workforce but there are clearly issues that need to be addressed”

With my New Year’s resolution 2022 – amongst others, ‘saying no’ to professional meetings, events and other engagements a bit more often – still at the back of my head, I stare at the agenda for the upcoming week that Outlook presents on my computer. Again, I am amazed by the enormous number of meetings, especially when compared to the time that is allocated for patient care.
Clearly, there is pressure on all of our agendas. Many of us try to combine our clinical work with doing research, writing papers, training students and residents, dealing with the paper work and being active in event organiza tion and boards. Preferably not all at the same time.
Therein lies one of our daily challenges. We aim to both be great surgeons and patient care providers, while at the same time some of our professional satisfaction results from having a voice in decisions and being able to be pre sent at meetings and conferences that matter. A virtual meeting or conference eliminates the need of travel and be at a physical venue to attend the event. It saves a lot of time and costs for everyone involved. Since virtual mee tings have been said to be more productive and less time consuming, they seem to be planned at a much lower threshold and far more frequently than physical mee
tings were back when we still could have them. Although working remotely with in patient care is not really an option for surgeons, we are facing the impact of predo minantly virtual meetings during the Covid-19 era. This applies to both meetings in-hospital and conferences.
Additionally, there is the in-between solution, the hybrid meeting. The hybrid meeting will leave you with a choice and may create expectations with others about your pre sence. You might even ask yourself about the impression you intend to give. The impression of the surgeon that has taken the effort to physically attend, at the cost of extra travel time and being less efficient, but enjoys the company of the people instead of staring at the camera? Or the impression of the very important and busy surge on running from OR to OR, attending virtual meetings in between, but being very efficient and ‘green’.
On the internet one can find impressive amounts of stats on meetings during the Covid-19 pandemic. Not a lot of remarkable scientific research on the topic has been done though, whereas the structural implementation of virtual meetings into our daily practice has brought for ward a whole new area of research. Much of the research seems to relate to the obvious, such as the fatigue that
looking into the camera causes, the discovery of upsides of virtual meeting, and scientists that want virtual mee tings to stay.
In 2015, a Harvard based neurology research group de veloped the Should I travel Index, the so-called ShITI, as a tool to determine whether it is worth the effort and time to travel to a conference [1]. They included time, distance, cost, the fun factor, networking, home related conflicts, and the size of the audience, if you were presenting, into the calculation. However, in the current situation, facing the covid pandemic, and all of the pros and cons concer ning live and virtual meetings that have introduced new factors of influence, the calculation had to be adjusted to the ShIZ index (Should I Zoom) [2]. The calculator now includes the variables scientific value of the meeting, in teraction, Wi-Fi quality, beverage supply, time zone, paja mas possibility, complexity of web, and home distraction or office distraction. A score ≥ 3 means definitely Zoom, ≤ 1 indicates a waste of your time, go do something more useful.
Since taking over the helm of the European Society for Trauma and Emergency, almost all ESTES executive bo ard and ECTES meetings have been via video conference. And looking in retrospect, these meetings all scored high ShIZ-index scores, certainly above 3. They were producti ve and inspiring, and certainly very efficient.
Nevertheless, I miss the face to face interaction, the cam araderie, meeting new people, having a beer and sharing anecdotes after a lengthy meeting, resulting in new fri endships and the inspiration for new studies and inno vation of care.
The same applies to the conferences that I attended last year. All but one were virtual conferences, including EC TES 2021. Tina Gaarder has truly elevated organizing and conducting the ECTES to an art form. After having set up the ECTES 2020 as one of the most multidisciplinary me etings that year, sadly enough it had to be postponed due
to the pandemic. Nevertheless, Tina and her Norwegian team managed to run a very successful and well attended virtual ECTES 2021 meeting. And this all implies that the forthcoming ECTES conference will be the spectacular capstone of three years Norwegian ECTES preparation. Something to really look forward to!
For all of you tired of Zoom meetings and conferences, rest assured. We have decided that this conference will be live, or not at all.
So delete the Should I Zoom factor, and start all over with the [1] If that’s a bit over your head, just go to www.shoudlitra vel.org, a website set up by the authors of the paper of the same name [1]. I just did so for ECTES 2022 Oslo, and, not surprisingly, scored way beyond the maximum: The European Congress of Trauma and Emergency Surgery 2022 is a must-go!
So. Maybe a bit overdue, but if you still are looking for a good New Year’s Resolution, I have one for you:
Go to www.estes-congress.org. Read through the program and be taken away by the overwhelming number and qu ality of speakers - both national i.e. Norwegian, and inter national - that will present in Oslo during the ECTES 2022. Register for the conference. And join us on the 24th of April in enjoying the real thing again! A truly high standard, medical, physical, meeting in a mesmerizing environment!
And yes, we will meet each other again there, exchange ideas, have discussions, listen to inspiring presentations, generate brilliant ideas and future projects, eat Norwegi an food, have some drinks and get unforgettable impres sions of Oslo.
I look forward to see you there.
1.
2015;78:667–669.
2.
Ann Neurol 2021 Jun;89(6):1057-1058.
Det årlige kirurgiske høstmøte vil bli arrangert fysisk på Meet Ullevål for 111. gang i oktober 2022. Vi er godt i gang med å legge kabalen for 2022 og sette sammen et nytt og spennende program med symposier og frie foredrag.
Her er noen viktige datoer å huske:
Innlevering av abstracts: 15. august (digitalt på www.hostmotet .no)
Innlevering av powerpoint presentasjon: 1. oktober (digitalt på www.hostmotet .no)
For de enkelte fagmedisinske foreninger gjelder følgende frister: Innmelding tittel og tid (antall timer/ halv dag/hel dag): 1. april
Endelige program for symposier: 1 august.

Frist for påmelding av foredragsholdere: 1 september
Programmet vil være klart i løpet av august
All informasjon vil være tilgjengelig fortløpende på hostmotet .no
Vi gleder oss veldig, og håper å se flest mulig på Meet Ullevål i uke 43.
Norsk kirurgisk forening arrangerer Høstmøtet 2022 i samarbeid med disse fagmedisinske foreningene: Norsk barnekirurgisk forening Norsk forening for bryst og endokrink Norsk forening for gastroenterologisk kirurgi Norsk forening for maxillofacial kirurgi
Norsk karkirurgisk forening Norsk plastikkirurgisk forening Norsk thoraxkirurgisk forening Norsk urologisk forening

Etter snart to år med pandemi er det på tide å rette fokus på kirurgisk utdanning igjen! Avlyste kurs, færre opera sjoner og mindre møteaktivtet under pandemien har ført til frustrasjon blant mange LIS som opplever at utdan ningen har blitt satt på vent. Foreningen for Unge Norske Kirurger (FUNK) lanserer derfor «Mester-svenn»-kam panjen - for å rette fokus på operasjonssalen som lærings arena og å fremme progresjon i spesialiseringen.

Vi ønsker å blåse liv i god kirurgisk utdanning og mener dette skjer på operasjonsstua. Vi håper våre erfarne ki rurg-kollegaer vil bidra med sin kunnskap gjennom økt veiledning og supervisjon. Som en hjelp på veien har vi utarbeidet en “Mester-svenn”-sjekkliste som kan benyt tes for å strukturere opplæringen på operasjonsstua.
Det er viktig at vi som LIS “tørrtrener” for å oppnå resul tater. D-boksen gir mulighet for å sikre progresjon innen laparoskopisk kirurgi også mellom operasjoner. LIS opp fordres til å benytte D-boksen aktivt! For å ytterligere

stimulere til trening planlegger vi å arrangere historiens aller første Norgesmesterskap i laparoskopi ved årets høstmøte.
”Mester-svenn”- kampanjen lanseres i samarbeid med LIS ved de ulike kirurgiske avdelinger i løpet av våren. Det vil da bli tilsendt ytterligere informasjon og materiell. Vi åp ner allerede nå for bidrag til laparoskopi-konkurransen. For å delta kan LIS eller overlege sende inn filmopptak (gjerne med mobilkamera) av beste tid av «slalåmløypa» i sin skopiboks til laparoskopinm@gmail.com. Reglene er enkle og det vil komme en demonstrasjonsvideo på FUNK sin Facebook-side. Alle bidrag vil vurderes og topp åtte vil bli kontaktet for å delta i finalerundene under høstmøtet 2022!
Etter to år med pandemi ser vi endelig frem til et inn holdsrikt og lærerrikt år!
LET THE GAMES BEGIN!
“For å delta kan LIS eller overlege sende inn filmopptak (gjerne med mobilkamera) av beste tid av «slalåmløypa» i sin skopiboks til laparoskopinm@gmail.com
Sunday, 24 April
Room 1Room 2Room 3Room 4Room 5Room 6Hordaland 1 08:00–20:15
IL 1 EM SURG Bundles of care in emergency surgery
IL 2 EDUC Past and present in surgical training
IL 3 POLYTRAUMA Traumatic brain injury and polytrauma
GS 1 EFORT FPS 1 Abstract presentations 1 NS 1 Global challenges and initiatives in trauma and emergency medicine
IL 4 VTS My 5 take home messages in 10’ from my most difficult case
IL 5 D&M Difficult decisions in military surgery
IL 6 SKELETAL State of the art in fracture care – The daily bread
GS 2 ATCN How trauma nurses have adapted their teaching practices to continue training during the Covid-19 epidemic
FPS 1 Abstract presentations 2 NS 2 COVID-19How did the pandemic affect trauma & emergency surgery and what did we learn?
IL 7 EM SURG Decision and operative dilemmasCase based clinical decision making and operative videos
IL 8 EDUC Five best papers in 10 minutes
M3 Large Board Meeting of the (EJTES) Workshop MedSkin
IL 10 VTS Technology in trauma – Why and when do I really need this?
IL 11 D & MMilitary – civilian collaboration
IL 9 POLYTRAUMA Timing of secondary surgery
GS 3 ATLSRegion XV, challenges and possibilities
FPS 3 Abstract presentations 3
NS 3 NAKOSPrehospital diagnostics and treatment
08:30–10:0008:30–10:0008:30–10:0008:30–10:0008:30–10:0008:30–10:00 10:30–12:0010:30–12:0010:30–12:0010:30–12:0010:30–12:0010:30–12:00 12:15–12:45 E 1 Sten Lennquist Lecture 12:30–13:30 12:45–13:45 14:00–15:3014:00–15:3014:00–15:3014:00–15:3014:00–15:3014:00–15:30 16:00–17:3016:00–17:3016:00–17:3016:00–17:3016:00–17:3016:00–17:30
IL 12 SKELETAL Multiple rib fractures
GS 4 IATSIC Different resources –Tricky cases in different settings
FPS 4 Abstract presentations 4
NS 4 NAKOSPrehospital diagnostics and treatment
Monday, 25 April
Room 1Room 2Room 3Room 4Room 5Room 6
08:30–10:0008:30–10:0008:30–10:0008:30–10:0008:30–10:0008:30–10:00
IL 13 EM SURG
Acute cholecystitis –Time to review our practice
IL 14 EDUC Paediatric session
IL 15 POLYTRAUMA New definition of major fracture?
GS 5 AO Trauma: tba
FPS 5 Abstract presentations 5
NS 5 NKT (Norwegian Advisory Board for Trauma) – Trauma systems in the north: What can we learn from each other, and what did we learn from Covid-19?
10:30–12:0010:30–12:0010:30–12:0010:30–12:0010:30–12:0010:30–12:00
IL 16 VTS It's never that easy – Pitfalls in the management of multiple injury complexes
12:15–12:45 E4 Otmar Trentz Lecture
IL 17 D&M New technology in favour of global surgery
IL 18 SKELETAL Fractures in the frail patients
GS 6 INTRN (International Trauma Research Network)iTACTIC, what did we learn?
FPS 6 Abstract presentations 6 NS 6 Medical student session –The role of teambased simulation now and in the future
14:00–15:3014:00–15:3014:00–15:3014:00–15:3014:00–15:3014:00–15:30
IL 19 EM SURG
Controversies in emergency surgery –Diverticular disease
16:30–18:00
GA General Assembly
IL 20 EDUC Rare and remarkable trauma cases
GS 7 tba
FPS 7 Abstract presentations 7 NS 7 Simulation in emergency medicine – Vital importance globally and new concepts
Tuesday, 26 April
IL 22 VTS Shades of grey – Real life application of techniques and concepts
IL 23 D&M Defining "minimal acceptable care" in mass casual incidents
IL 24 SKELETAL Complex sports injuries – Joint dislocations and fractures
GS 8 IOTA: tba FPS 8 Abstract presentations 8
emergency surgery and critical care
IL 27 POLYTRAUMA –Polytrauma patient with pelvic ring injuries
GS 9 DGU: tba FPS 9 Abstract presentations 9 NS 9 KITS –Teamwork and networking
Room 1Room 2Room 3Room 4Room 5Room 6 08:30–10:0008:30–10:0008:30–10:0008:30–10:0008:30–10:0008:30–10:00 10:30–12:0010:30–12:0010:30–12:0010:30–12:0010:30–12:0010:30–12:00 12:30–14:0012:30–14:0012:30–14:0012:30–14:0012:30–14:0012:30–14:00 14:15–15:15


