HEMATOLOGISK NORSK
HEMATOLOGISK NORSK


 HEMATOLOGISK NORSK
HEMATOLOGISK NORSK

9. januar 2023 ble Hematologisk Norsk aften – POST ASH 22 arrangert på Radisson BLU Scandinavia i Oslo hvor vi var samlet nærmere 80 leger og representanter fra industrien til faglig oppdatering av ASH 2022 kongressen. Det var på dette møte nok en gang rekord i antall deltakere og veldig kjekt å se at så mange nye deltakere også ønsket å være med oss denne kvelden.
Vårt faglige panel formidlet på en forbilledlig måte det de anser som de mest interessante presentasjonene og oppdateringer innenfor de ulike terapifeltene.
Vi ønsker å rette en stor takk til vårt faglige panel som i denne rapporten har beskrevet deres mest interessante «funn» fra ASH 2022.

Vi kommer til å gjenta suksessen fra Wien og vil om kort tid invitere alle norske EHA deltakere til en ny Hematologisk Norsk aften samling 10. juni i Frankfurt i forbindelse med EHA 2023. Vi håper vi ser deg og dine kollegaer der. Vi kan love deg en ettermiddag og kveld fylt med godt faglig innhold i tillegg til en uformell og populær middag etter møtet. Vi håper å se deg i Frankfurt!

Følg med på norskaften.no for mer informasjon og påmelding.
Vennlig hilsen,
Arrangør av Hematologisk Norsk Aften Apriil Congress AS
Sindre Hauge
INNHOLD
6/ Autoimmun hemolytisk anemi
Sigbjørn Berentsen
11/ Kronisk lymfatisk leukemi (KLL) og
Waldenströms makroglobulinemi (WM)
Sigbjørn Berentsen
14/ ITP: Hva er nytt på ASH 2023
Eirik Tjønnfjord
18/ Myelomatose
Immunterapi i fokus – hørt det før?
Fredrik Schjesvold
Overlege, leder for Oslo Myelomatosesenter og fagansvarlig for myelomatose ved OUS
20/ Allogen stamcelletransplantasjon
Tobias Gedde-Dahl
22/ Akutt myelogen leukemi
Tor Henrik Anderson Tvedt
Autoimmun hemolytisk anemi (AIHA) er en samlebetegnelse på flere sykdommer som kjennetegnes ved autoimmunt betinget, økt nedbrytning av røde blodceller, vanligvis mediert ved autoantistoff mot overflateantigener på erytrocyttene.1 Sykdomsgruppen omfatter AIHA av varmeantistofftype (primær eller sekundær), kuldeagglutininsykdom (CAD), sekundært kuldeagglutininsyndrom (CAS), paroksysmal kuldehemoglobinuri (PCH), og blandet AIHA. På ASH var det denne gangen en «education session» om AIHA generelt, et satellittsymposium om CAD, og flere originalpresentasjoner.
1 Berentsen S, Barcellini W. Autoimmune Hemolytic Anemias. N Engl J Med. 2021;385(15):1407-1419
Autoimmun hemolytisk anemi av varmeantistofftype
Under en «education session» om AIHA handlet to av foredragene om AIHA av varmeantistofftype (wAIHA). David J. Kuter fra Boston snakket om kliniske aspekter ved wAIHA med hovedvekt på behandling.1 Terapianbefalingene hans fulgte stort sett internasjonal konsensus med anbefaling av prednisolon som førstelinjebehandling, men Kuter poengterte at prednisolon etter hans mening bør kombineres med rituksimab i første linje i flere tilfeller enn det som ofte blir praktisert, først og fremst i alvorlige tilfeller (hemoglobin <8 g/dL, IgA- eller IgM-involvering, Evans’ syndrom eller blandet AIHA). Sammenliknet med prednisolon monoterapi gir kombinasjon med rituksimab langt høyere rate av vedvarende respons.
Som annenlinjebehandling anbefales rituksimab dersom ikke gitt i første linje. Splenektomi er i dag tredjelinjebehandling og bør vanligvis også komme etter et forsøk med uspesifikk immunsuppresjon, men bør ikke unnlates ved medikamentrefraktær sykdom. Gjennomgått splenektomi for AIHA er indikasjon for tromboseprofylakse. Fostamatinib er et relativt lovende alternativ i tredje linje og ser ut til å gi ca. 50% responsrate.
Susan T. Johnson, transfusjonsimmunolog fra Wisconsin, snakket om transfusjonsmedisinske aspekter ved AIHA med hovedvekt på wAIHA.2 Hun framholdt at den gamle anbefalingen om å bruke det «minst uforlikelige» donorblodet er obsolet og at «uforlikelig blod er uforlikelig blod». Som kjent er imidlertid transfusjon med typelikt uforlikelig erytrocyttkonsentrat forsvarlig og noen ganger nødvendig ved wAIHA under forutsetning av at anbefalte forholdsregler følges. Johnson anbefalte utvidet blodtyping og bruk av fenotypelikt blod dersom tiden tillater, fortrinnsvis også med bruk av adsorpsjonsteknikker for å utelukke eller identifisere alloantistoff. Disse teknikkene forutsetter 24-48 timers varsel før transfusjonen kan gis. Noen ganger er dette for lang tid å vente, og da må man likevel gi typelikt uforlikelig blod under
nøye observasjon.
Referentens merknad: I Norge og en del andre land innebærer «nøye observasjon» at vi bruker «bed-side in vivo compatibility test», på norsk gjerne kalt biologisk forlikelighetsprøve. Anbefalingen om utvidet fenotyping når tiden tillater er for øvrig i samsvar med det vi fra norsk hold har anbefalt i mange år og som alle forhåpentlig praktiserer.
1 Kuter DJ. Warm autoimmune hemolytic anemia and the best treatment strategies. Hematology Am Soc Hematol Educ Program. 2022;2022(1):105-113.
2 Johnson ST, Puca KE. Evaluating patients with autoimmune hemolytic anemia in the transfusion service and immunohematology reference laboratory: pretransfusion testing challenges and best transfusion-management strategies. Hematology Am Soc Hematol Educ Program. 2022;2022(1):96-104.
Satellittsymposium om CAD
På et satellittsymposium om kuldeagglutininsykdom (CAD) snakket Sigbjørn Berentsen (Norge) og Ilene C. Weitz (University of South California) om patogenese ved CAD og om potensiale av komplementhemmere i behandlingen.1 CAD utgjør 15-30% av tilfellene av autoimmun hemolytisk anemi og er fra 2022 anerkjent som en egen entitet i WHOs klassifikasjon av hematolymfoide neoplasmer. Hemolysen er komplementmediert. Sykdomsbyrden ved CAD har ofte vært underestimert i eldre litteratur.
Behandlingen bør individualiseres. Rituksimab monoterapi har effekt hos ca. 50%, men responsen er ofte kortvarig. Bendamustin pluss rituximab gir høy responsrate og lang remisjonsvarighet, men ikke alle pasienter har nytte av den.
Det monoklonale antistoffet sutimlimab, en komplement C1shemmer, er nå godkjent i EU/EØS til behandling av hemolytisk anemi ved CAD. Sutimlimab har raskt innsettende effekt, tolereres godt, og ser ut til å være spesielt velegnet hos svært anemiske pasienter som trenger rask behandlingseffekt. Det har også en klar plass i annenlinjebehandling. Sutimlimab er lite egnet for pasienter der de sirkulatoriske symptomene (akrocyanose og/ eller Raynaud-liknende symptomer) er framtredende, da disse symptomene ikke er komplementmedierte og derfor ikke blir bedre ved komplementhemming.
Pegcetacoplan, et pegylert syklisk peptid som hemmer C3, er også lovende, men er per i dag mindre dokumentert og bør derfor foreløpig bare brukes i kliniske studier. En slik studie er nå
et al. Sustained Complement C1s Inhibition with Sutimlimab in Patients with Cold Agglutinin Disease Results in Continued Efficacy during Part B of the Randomized Placebo-Controlled Phase 3 Cadenza Study (NCT03347422). Blood. 2022;140(Supplement 1):2825-2827.
aktivert (Referentens merknad: Oslo Universitetssykehus deltar i pegcetacoplan-studien.)
1 Berentsen S, Barcellini W, D’Sa S, Jilma B. Sutimlimab for treatment of cold agglutinin disease: why, how and for whom? Immunotherapy. 2022;14(15):1191-1204.
Komplementreseptor 1 er nedregulert ved CAD I en posterpresentasjon beskrev Agnieszka Małecka, molekylærbiolog og postdoc-stipendiat ved Oslo Universitetssykehus og Universitetet i Oslo, gen-ekspresjonsanalyser i blod- og beinmargsmateriale fra pasienter med CAD.1 Małecka har tidligere publisert flere artikler om cytogenetikk og klonale mutasjoner ved CAD og har vist at trisomi 3, 12 eller 18 er hyppig forekommende cytogenetiske avvik. RNA-data har aldri vært publisert. Denne studien omfattet RNA-sekvensering i prøver fra 12 CAD-pasienter (15 for enkelte av analysene) og 4 (-5) friske kontroller. Klonale B-celler ble isolert ved hjelp av FACS (flow cytometry assisted cell sorting)-metodikk. Resultatene viser at i klonale celler fra CAD-pasienter er genene SLC4A1, SPTA1, YBX3, TESC, HBD, AHSP, TRAF1, HBA2, RHAG, CA1, SPTB, IL10, UBASH3B, ALAS2, HBA1, CRYM, RGCC, KANK2 og IGHV4-34 oppregulert til minst 8 ganger nivået hos friske kontroller. Det mest oppsiktsvekkende funnet er imidlertid at genet for komplementreseptor 1 (CR1) er nedregulert med en faktor på 11.
Funnene bekrefter i høy grad at CAD er en klonal sykdom. Nedreguleringen av genet for CR1 er spesielt interessant fordi hemolysen ved CAD er komplementmediert. CR1 er en membranbundet komplementhemmer og finnes på erytrocytter og mange andre celletyper, inkludert makrofager og flere typer immunkompetente celler. På den annen side er CR1 også nødvendig for fagocytose av C3b-opsoniserte erytrocytter, et sentral ledd i patogenesen av hemolyse ved CAD. Derfor er det svært sannsynlig at nedreguleringen av denne reseptoren og fysiologiske komplementhemmeren har en eller annen form for klinisk betydning.
1 Malecka A, Østlie I, Trøen G, et al. Gene Expression Analysis Reveals Downregulation of Complement Receptor 1 in Cold Agglutinin Disease. Blood. 2022;140(Supplement 1):6419-6420.
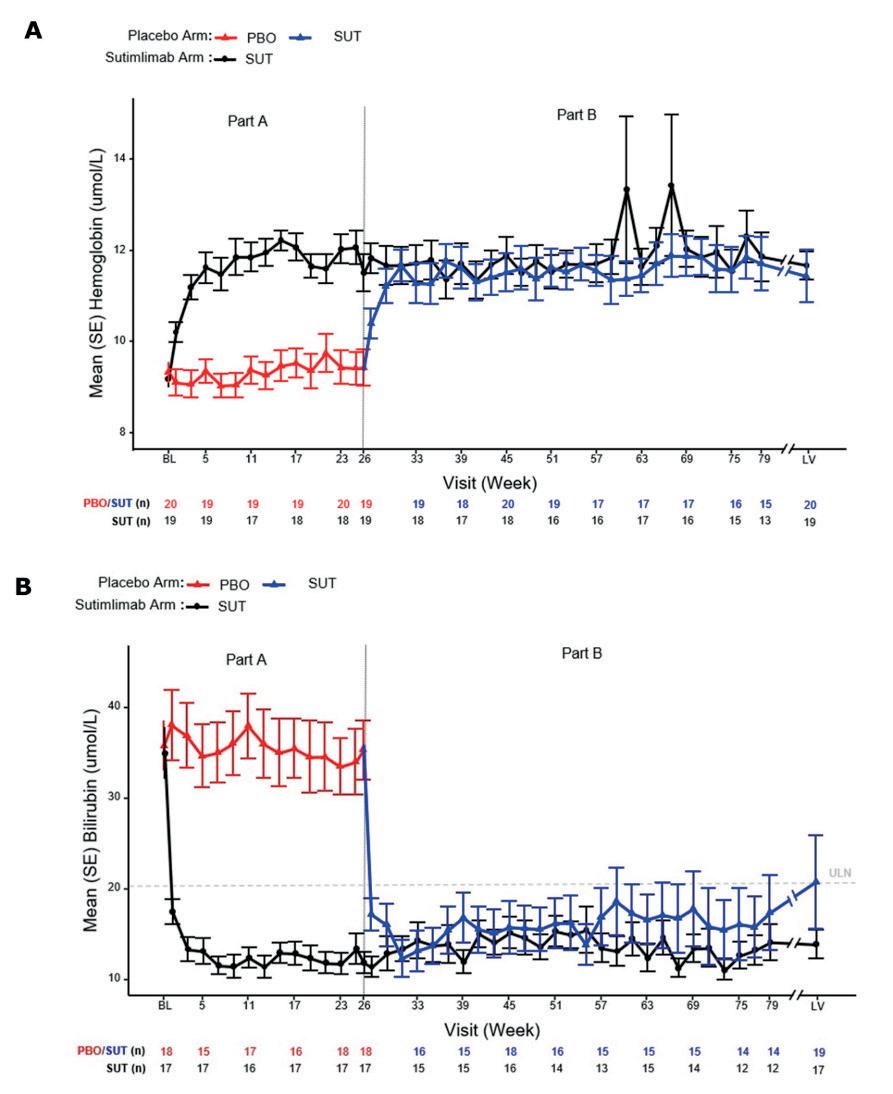
CAD: Sutimlimab har vedvarende effekt under fortsatt behandling Alexander Röth fra Essen, Tyskland, har vært sentral i de kliniske studiene av sutimlimab ved CAD. Han hadde to presentasjoner på ASH 2022, en oral presentasjon om «patient-reported outcome» ved behandling med sutimlimab og en poster om varighet av effekt på hemolyse og anemi ved fortsatt behandling hos pasienter som hadde deltatt i CADENZA-studien.6 CADENZA var en randomisert, placebokontrollert studie av behandling med sutimlimab hos 42
pasienter med behandlingstrengende CAD. Fra norsk side deltok Haukeland Universitetssjukehus.
Ekstensjonsstudien som ble lagt fram nå, viste uendret god behandlingseffekt og toleranse ved 12 måneders fortsatt behandling ut over de første 6 månedene. Når pasientene i placeboarmen skiftet til aktiv behandling etter de første 6 månedene, oppnådde de raskt like god behandlingseffekt som pasientene i behandlingsarmen. Resultatene er vist grafisk i figuren nedenfor.
1 Röth A, Berentsen S, Barcellini W, et al. Sustained Complement C1s Inhibition with Sutimlimab in Patients with Cold Agglutinin Disease Results in Continued Efficacy during Part B of the Randomized Placebo-Controlled Phase 3 Cadenza Study (NCT03347422). Blood. 2022;140(Supplement 1):2825-2827.
A RAPID RESPONSE
88% achieved target platelet levels by Day
A SUSTAINED RESPONSE AND CONSISTENT SAFETY PROFILE
8.8 YEARS demonstrated in a large trial conducted in ITP2,3**
Most common side effects with Revolade®: diarrhea, nausea and anemia 4
Special warnings and precautions for use: Revolade administration can cause abnormal liver function and severe hepatotoxicity, which might be life-threatening.6
50 mg. **Safety profile consistent with previous studies7,8
REVOLADE Indikasjon1: Revolade er indisert til behandling av pasienter i alderen 1 år eller eldre med primær immun trombocytopeni (ITP) som varer 6 måneder eller lengre fra diagnosetidspunkt og som er motstandsdyktige overfor annen behandling (f.eks. kortikosteroider, immunoglobuliner).
Revolade er indisert for behandling av trombocytopeni hos voksne pasienter med kronisk hepatitt C virus (HCV) infeksjon, hvor graden av trombocytopeni er hovedårsaken som hindrer initiering eller begrenser muligheten for å opprettholde optimal interferon-basert behandling.
Revolade er indisert hos voksne pasienter med ervervet alvorlig aplastisk anemi som enten er refraktære overfor tidligere immunosuppressiv behandling eller som allerede er omfattende behandlet og uegnet for hematopoetisk stamcelletransplantasjon.
Dosering2: Dosering av eltrombopag må tilpasses individuelt basert på pasientens blodplatetall. Målet med behandlingen skal ikke være å normalisere blodplatetallet. Pulver til mikstur, suspensjon, kan gi høyere eksponering av eltrombopag enn tablettformuleringen. Ved bytte mellom tablett og pulver til mikstur, suspensjon, bør blodplatetallet overvåkes ukentlig i 2 uker.
Vanligste bivirkninger3: Diaré, kvalme og anemi.
Kontraindikasjoner4: Overfølsomhet overfor eltrombopag eller overfor noen av hjelpestoffene.
Advarsler og forsiktighetsregler5: Administrering av eltrombopag kan forårsake unormal leverfunksjon og alvorlig levertoksisitet, som kan være livstruende. Måling av alaninaminotransferase (ALAT), aspartataminotransferase (ASAT) og bilirubin i serum før oppstart av terapi med eltrombopag skal utføres annenhver uke under dosejusteringsfasen, og månedlig etter etablering av stabil dose.
Reseptgruppe, refusjon & pris 6: Reseptgruppe C. Godkjent etter H-resept. Revolade 50 mg tabletter, 28 stk, kr 23 151,40 per 01.02.2022.
Refusjonsberettiget bruk6: Der det er utarbeidet nasjonale handlingsprogrammer/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/LIS spesialistgruppe skal rekvirering gjøres i tråd med disse. Se Felleskatalogen for mer informasjon.
Bosulif er indisert til behandlingen av voksne pasienter med:
• Nydiagnostisert Philadelphiakromosom-positiv kronisk myelogen leukemi (Ph+ KML) i kronisk fase (KF).
• Ph+ KML i KF, akselerert fase (AF) og blastfase (BF) som tidligere er behandlet med én eller flere tyrosinkinasehemmere (TKIs) og hvor imatinib, nilotinib og dasatinib ikke ansees som egnede behandlingsalternativer.
Bosulif «Pfizer»
Proteinkinasehemmer
Filmdrasjerte tabletter 100 mg, 400 mg og 500 mg
Utvalgt sikkerhetsinformasjon:
L01E A04 (Bosutinib)
Behandling med bosutinib er assosiert med forhøyet nivå av serumtransaminaser (ALAT, ASAT). Nedsatt leverfunksjon er kontraindisert. Det bør tas leverfunksjonstester før behandlingsstart, og månedlig de første tre månedene av behandlingen, og som klinisk indisert.
Behandling med bosutinib er assosiert med diaré og oppkast. Forsiktighet bør derfor utvises hos pasienter med nylig eller pågående klinisk signifikant gastrointestinal sykdom. Behandling med bosutinib er assosiert med myelosuppresjon. Fullstendig blodtelling bør utføres ukentlig den første måneden, og deretter månedlig, eller som klinisk indisert. Behandling med bosutinib kan være assosiert med væskeretensjon, inkludert perikardial effusjon, pleuraeffusjon, lungeødem og/eller perifert ødem. Pasienter bør monitoreres og gis standardbehandling. Infeksjoner: Kan predisponere for infeksjoner. Proarytmisk potensiale: Forsiktighet bør utvises ved tidligere eller predisposisjon for QTC-forlengelse, ved ukontrollert eller signifikant hjertesykdom, eller ved bruk av legemidler kjent for å forlenge QTC.
Interaksjoner: Samtidig bruk av kraftige eller moderate CYP3A-hemmere bør unngås, da de øker plasmakonsentrasjonen av bosutinib. Vis forsiktighet ved samtidig bruk av svake CYP3A-hemmere.
Dosering
Behandling bør startes opp av lege med erfaring i diagnostisering og behandling av KML. Nydiagnostisert KF Ph+ KML: anbefalt dose 400 mg 1 gang daglig. KF, AF eller BF Ph+ KML med resistens/intoleranse mot tidligere behandling: anbefalt dose 500 mg 1 gang daglig.
Dosejustering
Doser >600 mg/dag er ikke undersøkt og bør ikke gis. Doser <300 mg/dag er brukt, men effekt ikke fastslått.
Dosejustering og/eller seponering kan være nødvendig ved ikke-hematologiske bivirkninger og ved alvorlig eller vedvarende nøytropeni og trombocytopeni, se preparatomtale for ytterligere informasjon.
Administrering: Tas 1 gang daglig om morgenen. Skal tas med mat, men samtidig inntak av grapefrukt/grapefruktjuice skal unngås.
Kontraindikasjoner
Overfølsomhet for innholdsstoffene. Nedsatt leverfunksjon.
Svært vanlige og vanlige bivirkninger:
Organklasse Bivirkning
Blod/lymfe
Svært vanlige Anemi (inkl. redusert hemoglobin), nøytropeni (inkl. redusert nøytrofiltall), trombocytopeni (inkl. redusert blodplatetall)
Vanlige Leukopeni (inkl. redusert antall hvite blodceller)
Gastrointestinale
Svært vanlige Abdominalsmerter, diaré, kvalme, oppkast
Vanlige Gastritt, gastrointestinal blødning, pankreatitt (inkl. akutt pankreatitt)
Generelle
Svært vanlige Asteni, fatigue (inkl. asteni, malaise), feber, ødem (inkl. ansiktsødem, lokalisert ødem, perifert ødem)
Vanlige Brystsmerter (inkl. ubehag i brystet), smerter
Hjerte
Vanlige Perikardiell effusjon
Hud
Svært vanlige Kløe, utslett (inkl. generalisert, makuløst, makulopapuløst, papuløst og kløende utslett)
Vanlige Akne, fotosensitivitetsreaksjon, urticaria
Immunsystemet
Vanlige Legemiddeloverfølsomhet
Infeksiøse
Svært vanlige Luftveisinfeksjon (inkl. øvre/nedre, samt viral luftveisinfeksjon), nasofaryngitt
Kar
Vanlige Hypertensjon
Lever/galle
Svært vanlige Økt ALAT, økt ASAT
Vanlige Hepatotoksisitet (inkl. hepatitt, toksisk hepatitt, leversykdom), unormal leverfunksjon, økt bilirubin i blod (inkl. hyperbilirubinemi), økt γ-GT
Luftveier
Svært vanlige Dyspné, hoste, pleuraeffusjon
Vanlige Pulmonal hypertensjon (inkl. pulmontal arteriell hypertensjon, økt pulmonalt arterietrykk respirasjonssvikt)
Muskel-skjelettsystemet
Svært vanlige Artralgi, ryggsmerter
Vanlige Myalgi
Nevrologiske
Svært vanlige Hodepine, svimmelhet
Vanlige Dysgeusi
Nyre/urinveier
Vanlige Akutt nyresvikt, nedsatt nyrefunksjon, nyresvikt
Stoffskifte/ernæring
Svært vanlige Redusert appetitt
Vanlige Dehydrering, hyperkalemi (inkl. økt kalium i blod), hypofosfatemi (inkl. redusert fosfor i blod)
Sist endret: 03.05.2022
Basert på SPC godkjent av SLV/EMA: 07.04.2022


Bosiluf, TABLETTER, filmdrasjerte:
Styrke Pakning Refusjon1 Pris (kr) Reseptgruppe
100 mg 28 stk. (blister) H-resept 9 511,10 C
400 mg 28 stk. (blister) H-resept 41 132,70 C
500 mg 28 stk. (blister) H-resept 41 828,80 C
På kongressen var det nær 200 postere og foredrag om kronisk lymfatisk leukemi (KLL) og en god del presentasjoner om Waldenströms makroglobulinemi (WM). Her skal jeg referere et lite utvalg.
Akalabrutinib ved KLL – løser BTK-hemmere alle problemer?
Richard Furman fra New York presenterte et 4-års oppfølgingsmateriale fra en multinasjonal fase 1/2-studie av behandling med Bruton tyrosin kinase (BTK)-hemmeren akalabrutinib ved residivert eller refraktær KLL.1 Resultatene framgår av følgende diagram.
zanubrutinib og ibrutinib, ALPINE-studien, ble presentert av Jennifer R. Brown fra Boston i «Late breaking abstracts»-sesjonen og ble samme dag publisert som full artikkel.1
I denne store, randomiserte «open label»-studien ble 652 pasienter med refraktær eller residivert KLL eller småcellet lymfocytært B-cellelymfom (SLL, «KLL-lymfom») fra 15 land randomisert til behandling med ibrutinib eller zanubrutinib. Median alder var 67-68 år i begge grupper, og andelen med umutert IGHV-gen, del(17p) eller TP53-mutasjon uten delesjon var også sammenliknbar i de to armene. Median oppfølgingstid var 30 måneder.
Resultatene viste «overall» responsrate på 86% i zanubrutinib-armen mot 75% hos de som fikk ibrutinib. Median progresjonsfri overlevelse (PFS) var 35 måneder i ibrutinib-armen, men ikke nådd ved studieslutt i zanubrutinib-armen. Det var imidlertid ingen signifikant forskjell i totaloverlevelse. Andelen som fikk atrieflimmer var 5% i zanubrutinib-armen mot 13% hos de som fikk ibrutinib. Raten av seponering (som vesentlig forekom pga. bivirkninger) var lavere med zanubrutinib enn med ibrutinib (26% versus 41%). Forfatterne konkluderer med at zanubrutinib er mer effektivt og bedre tolerert enn ibrutinib ved tilbakefall eller behandlingsresistens hos pasienter med KLL.
Vi kan trekke følgende konklusjoner:
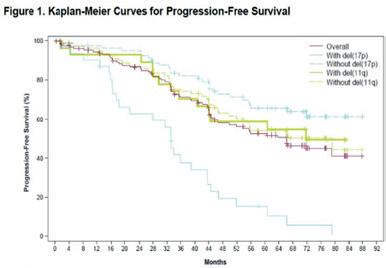
1. Studien bekrefter at akalabrutinib er god behandling ved residivert eller refraktær KLL, slik vi også kjenner til fra studier av andre BTK-inhibitorer. Denne studien viser rundt 70 måneders median progresjonsfri overlevelse (PFS) i de fleste risikogrupper.
2. Studien viser imidlertid at pasienter med 17p-delesjon fortsatt har dårlig prognose for PFS, selv om resultatene selv i denne gruppen er bedre enn man ser ved kjemoimmunoterapi.
1 Furman RR, Wierda WG, Schuh A, et al. Phase 1/2 Study of Acalabrutinib Monotherapy in Patients with Relapsed/Refractory Chronic Lymphocytic Leukemia: Final Results with >4 Years of Follow-up. Blood 2022; 140 (Supplement 1): 9873-5.
BTK-inhibitorer ved KLL – er zanubrutinib bedre enn ibrutinib?
BTK-hemmere er etablert behandling ved KLL, også ved residiverende eller refraktær sykdom, men bruken av førstegenerasjons
BTK-hemmeren ibrutinib begrenses av og til av bivirkninger. Det er derfor av interesse å undersøke om nyere BTK-hemmere gir gunstigere resultater. En sammenliknende prospektiv studie av
Etter min vurdering har denne studien metodologiske svakheter som kan ha påvirket resultatet. Det var altså ingen signifikant forskjell i totaloverlevelse i denne ublindede studien. PFS på ibrutinib var 35 måneder, tatt i betraktning at bare 15 % av pasientene var klassifisert som høyrisiko og mediant antall tidligere behandlinger var 1. Dette er vesentlig kortere PFS enn i andre, sammenliknbare studier (I RESONATE-studien var f.eks. median PFS på ibrutinib 44 måneder på tross av median 3 tidligere behandlinger og 32% høyrisikopasienter). Seponeringsraten var påfallende høy i ibrutinib-armen (41%) sammenliknet med andre studier og klinisk erfaring. Ved uønskede hendelser var det ulike regler for dosereduksjon eller seponering i de to armene. Resultatene og konklusjonene bør derfor leses med forbehold.
1 Brown JR, Eichhorst B, Hillmen P, et al. Zanubrutinib or Ibrutinib in Relapsed or Refractory Chronic Lymphocytic Leukemia. N Engl J Med. 2022; online ahead of print. Doi: 10.1056/ NEJMoa2211582.
Behandling av KLL med ibrutinib pluss venetoklaks CAPTIVATE-studien ble presentert av John N. Allan fra New York.1 Fra før har gruppen publisert deler av denne prospektive multisenterstudien, som handler om førstelinjebehandling med ibrutinib pluss venetoklaks hos behandlingstrengende pasienter med KLL
eller SLL (småcellet lymfocytært B-cellelymfom, «KLL-lymfom»). Foredraget ved ASH 2022 beskrev en substudie av 5-årsresultatene for 86 pasienter som etter fullført kombinasjonsbehandling med oppnådde komplett respons med «confirmed undetectable minimal residual disease». Disse ble deretter randomisert til placebo (dvs. at de hadde fått «fixed duration»-behandling) eller vedlikeholdsbehandling med ibrutinib, 43 pasienter i hver arm. Fireårs totaloverlevelse var >98% og fireårs progresjonsfri overlevelse >88%, uten noen forskjell mellom de to armene. For de fleste typer bivirkninger var det også liten forskjell, men forekomsten av nøytropeni grad >3 var høyere i ibrutinib- enn i behandlingsarmen (26% versus 2%) og forekomsten av hypertensjon var også sannsynligvis reelt høyere i ibrutinib-armen (12% versus 5%).
Forfatterne konkluderer slik:
1. Kombinasjonsbehandling med ibrutinib pluss venetoklaks i første linje gir dype, vedvarende responser ved KLL, og
2. «Benefit/risk»-profilen er gunstigere ved «fixed duration»-regime enn ved tillegg av ibrutinib vedlikeholdsbehandling.
1 Allan JN, Siddiqi T, Kipps TJ, et al. Treatment Outcomes after Undetectable MRD with First-Line Ibrutinib (Ibr) Plus Venetoclax (Ven): Fixed Duration Treatment (Placebo) Versus Continued Ibr with up to 5 Years Median Follow-up in the CAPTIVATE Study. Blood. 2022;140(Supplement 1):224-227.
Waldenströms makroglobulinemi: Skal vi slutte med bendamustin-rituksimab i første linje?
I Norge er bendamustin pluss rituksimab (BR) anbefalt førstelinjebehandling ved Waldenströms makroglobulinemi (WM) i Handlingsprogrammet. BTK-inhibitorene ibrutinib og zanubrutinib er godkjent til annenlinjebehandling, eventuelt i første linje ved kontraindikasjoner mot kjemoimmunoterapi. Internasjonalt er det nå noen som anbefaler BTK-hemmere som førstelinjebehandling, men «real life»-studier viser at på verdensbasis foretrekkes fortsatt ofte kjemoimmunoterapi som f.eks. BR i første linje. En vesentlig del av evidensgrunnlaget er den prospektive studien ved Rummel og medarbeidere, som viste bedre remisjonsinduserende effekt og progresjonsfri overlevelse etter BR enn etter R-CHOP. Det foreligger imidlertid lite langtidsdata.
På ASH 2022 presenterte Kamel Laribi en fransk, retrospektiv multisenterstudie med langtidsoppfølging av 69 konsekutive, behandlingstrengende pasienter med tidligere ubehandlet WM som hadde fått kjemoimmunoterapi med BR.1 Median alder var 71 år (46-88 år).Utvalget virker representativt, bl.a. forelå MYD88- og CXCR4-mutasjoner hos 88% og 25%, respektive. Tjueto prosent av pasientene var bedømt som lavrisikopasienter, 46% som
intermediær risiko og 46% som høyrisiko. «Overall» responsrate var 97%, av dette «very good partial response» (VGPR) med negativ immunfiksasjon hos 19%, VGPR med fortsatt påvisbart monoklonalt IgM hos 37%, PR hos 40%, og minor respons (MR) hos 1%. Residiv inntrådte hos 23%. I hele gruppen var median overlevelse ikke nådd etter 69 måneders observasjon. Median overlevelse var 70 måneder i undergruppe med mutert CXCR4, men ikke nådd ved studieslutt i gruppen med prognostisk gunstige markører. Kumulativ insidens av sekundær malignitet var 10% etter 48 måneder og 18% etter 96 måneder, men dette dreide seg stort sett om solide svulster, bare 2 pasienter med MDS/AML. (Referentens merknad: Altså sannsynligvis ikke påfallende høy risiko for sekundær malignitet sett på bakgrunn av pasientenes alder). Forfatterne konkluderer med at BR er en effektiv behandling med høye responsrater, lang responsvarighet og gunstige tall for overlevelse, men at pasientene bør overvåkes med tanke på sekundær malignitet.
1 Laribi K, Poulain S, Willems L, et al. Long-Term Follow-up of Bendamustine Plus Rituximab Regimen in 69 Treatment Naïve (TN) Patients with Waldenström Macroglobulinemia, a Study on Behalf of the French Innovative Leukemia Organization (FILO). Blood. 2022;140(Supplement 1):3627-3628.
Kryoglobulinemi ved WM – hyppigere enn vi har antatt?
«Type 1 cryoglobulinemia associated with WM, IgM-MGUS or NonHodgkin lymphoma» var tittelen på en poster av Jahanzaib Khwaja og kolleger ved University College London Hospitals (UCLH).1 Materialet var retrospektive data hentet fra UCLHs senter for WM og et stort nederlandsk senter. Av 423 konsekutive prøver fra pasienter med WM, IgM-MGUS og NHL var 33% positive for kryoglobulin. Nittifire pasienter (22% av totalmaterialet) hadde kryoglobulin type 1. WM var den hyppigste underliggende sykdommen (79% av de med kryoglobulin type 1). En betydelig andel av pasientene med påvist kryoglobulin type 1 hadde klinisk manifest kryoglobulinemi. Andre assosierte IgM-relaterte tilstander forekom hyppig ved kryoglobulinemi type 1, herunder kuldeagglutininsykdom eller -syndrom hos 15%, Bing-Neel-syndrom hos 7% og MAG-antistoff hos 5%.
1 Khwaja J, Salter S, Patel AS, et al. Type 1 Cryoglobulinaemia Associated with Waldenström Macroglobulinemia, IgM MGUS or Non-Hodgkin Lymphoma. Blood. 2022;140 (Supplement 1):3653-3654.

is a rare, acquired, haematological disorder 1,2 where dysregulated terminal complement activation leads to intravascular haemolysis (IVH) and thrombophilia, causing premature mortality and significant morbidity.3
PNH: Paroxysmal Nocturnal Haemoglobinuria
References:
1. Risitano AM, et al. Blood. 2009 ;113(17):4094–4100

2. Berentsen S, et al. TherAdv Hematol. 2019;10:1–20
3. Hill A, et al. Blood. 2013 ;121(25):4985–4996
AstraZeneca Rare Disease
ASH 64. årlige møte gikk av stabelen 7-13. desember 2022 i New Orleans, USA. Som vanlig var de siste nyheter og fremskritt innen hematologiske sykdommer på programmet.
Innen benign hematologi og ITP var det også nye og oppdaterte studier og funn og de viktigste abstrakter som ble presentert ut fra mitt ståsted var:
1. Broome CM, McDonald V, Miyakawa Y, et al. Efficacy and safety of intravenous efgartigimod in adults with primary immune thrombocytopenia: results of a phase 3, multicenter, double-blinded, placebo-controlled, randomized clinical trial (ADVANCE IV). Presented at ASH 2022. December 10-13, 2022. Abstract 3.
Bruk av efgartigimod (EFG) ble i dette fase 3 studiet evaluert. Det var et multisenter, dobbeltblidet studies om vurderte effektiviteten og sikkerheten av intravenøs bruk av EFG. EFG er et IgG hemmende legemiddel som gjennom kompetativ hemming av neonatal Fc reseptoren (FcRn), hindrer gjennbruk av endogen IgG og dermed minsker nivået av IgG og antistoffe nivåene I blodet og på den måten demper immunforsvaret og i teorien øker trombocyttnivåene. Dette
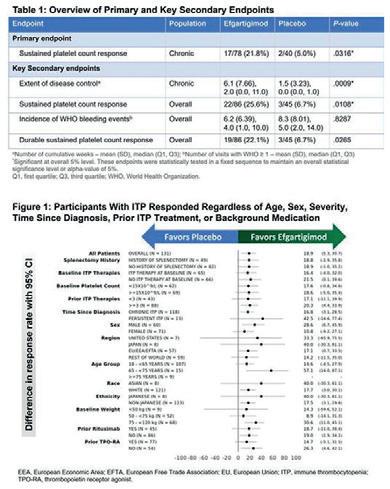
fase 3 studiet ble testet på kronisk ITP pasienter over 18 år med 2 platemålinger <30 × 109/L og ble randomisert 2:1 mot placebo. Pasienten var tidligere tungt behandlet og måtte ved inklusjon ha gjennomgått 2 tidligere behandlinger og de som mottok EFG fikk 10 mg/kg x 1/uke. Studiet hadde som primært endepunkt å oppnå et vedvarende stabilt platetall på 50 × 109/L og oppnådde dette hos 21.8%, sammenlignet med placebo på 5%. I tillegg oppnådde 38.4% i behandlingsgruppen platenivåe på 30 × 109/L etter 1 uke (11.1%i placebogruppen).
Det som også skal bemerkes er at alle pasienter fikk ukentlig dosering av 10mg/kg iv uke 1-4, deretter ble de med respons skiftet til behandling annenhver uke hvor 90% av de som mottok behandling annenhver uke fastholdt response
Konklusjon (se figur 1 under): Sammenlignet med plcebo viste EFG tidligstigning i platetall, høyere stabilt nivå og flere uker med trombocytter ≥50×109/L. EFG oppnådde det primære endepunkt og alle sekundære endepunkter, samt at over halvparten (51.2%) av de som fikk EFG oppnådde stigning i platetall forenelig med endepunktet. EFG var generelt veltolerert og langtidseffekt og sikkerhet er under pågående evaluering i «open-label» forlengelsesarmen av studiet.
2. Long-Term Risk of ITP Higher in Patients With Persistent, Isolated Mild Thrombocytopenia. Nardeen Ayad, MD, of Harvard Medical School in Boston, Massachusetts, and colleagues
Et annet veldig interessant studie ble presentert av doctor Ayad fra Harvard I Boston USA. De har kikket på voksne med isolert mild trombocytopeni (PIMT). Dette retrospektive kohorte studiet evaluerte 91 pasienter med PIMT i perioden 1995 til 2004 mht risikoen for utvikling av ITP og/eller hematologisk neoplasi. Disse 91 personene ble sammenlignet med 364 friske individer (1:4) hvor demografien hadde de samme karakteristika inkludert alder, kjønn og etnisitet. De ble i gjennomsnitt fulgt over 20 år.
Foskerne fant at PIMT personer hadde en 19 x økt risik for utvikling av ITP eller hematologisk malignitet sammenlignet med friske individer, justert analyse.
PIMT personer mangler retningslinjer for diagnostisk utredning og oppfølging og det har ikke vært gjort studier på denne gruppen med henhold til prognose og behandling. Denne studien viser en signifikant økt risiko for utvikling av blodsykdommer som ITP m.fl, og man burde overveie å følge disse som f.eks MGUS eller monoklonal B-celle lymfocytose?
Doptelet® (avatrombopag) er indisert for behandling av primær kronisk immunologisk trombocytopeni (ITP) hos voksne pasienter som er refraktære til andre behandlinger (f.eks. kortikosteroider, immunglobuliner)1
• Doptelet®-pasientene hadde en raskt innsettende og vedvarende effekt, 65,6% av pasientene responderte i løpet av de første 8 dagene.2
• Kliniske studier har vist tolerabilitet uten påvirkning av leverfunksjonen.1-5
• Enkel oral behandling uten matrestriksjoner.1,2
Dosering: Start med 20 mg én gang daglig til mat og titrer opp og ned etter behov, basert på rutinemessig måling av pasientens blodplatetall.
Forsiktighetsregler
• Mulig økning av trombotisk risiko ved kjente risikofaktorer for tromboembolisme skal tas i betraktning.
• Ikke anbefalt ved graviditet.
• Amming skal opphøre eller behandling avsluttes/avstås fra.
• Effekt på fertilitet ikke fastslått.
Bivirkninger
Svært vanlige: Fatigue, hodepine.
Vanlige: Diaré, atulens, kvalme, oppkast, øvre abdominalsmerter, migrene, parestesi, svimmelhet, ubehag i hodet.
** TPO-RA, trombopoietinreseptoragonist.

Referanser: 1. Doptelet EMA Summary of Product Characteristics. Available at: ema.europa.eu/en/ medicines/human/EPAR/doptelet Last accessed: March 2021. 2. Jurczak W, et al . Phase 3 randomised study of avatrombopag, a novel thrombopoietin receptor agonist for the treatment of chronic immune thrombocytopenia. Br J Haematol . 2018; 183(3):479-90. 3. Bussel JB, et al . A randomized trial of avatrombopag, an investigational thrombopoietin-receptor agonist, in persistent and chronic immune thrombocytopenia. Blood . 2014; 123(25):3887-94.
4. Terrault N, et al . Avatrombopag before procedures reduces need for platelet transfusion in patients with chronic liver disease and thrombocytopenia. Gastroenterology . 2018; 155(3):705-18.
5. Terrault N, et al . Phase II study of avatrombopag in thrombocytopenic patients with cirrhosis undergoing an elective procedure. J Hepatol . 2014; 61 (6):1253-9.
Swedish Orphan Biovitrum AS , Dronning Eufemias gate 16, 0191 Oslo, www.sobi.com, www.sobi.no.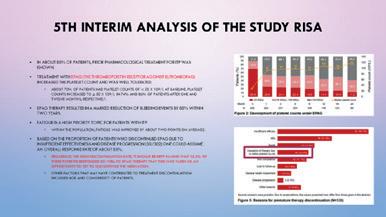
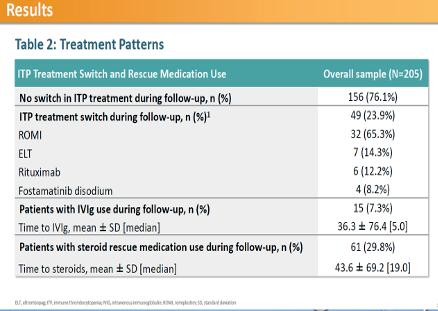
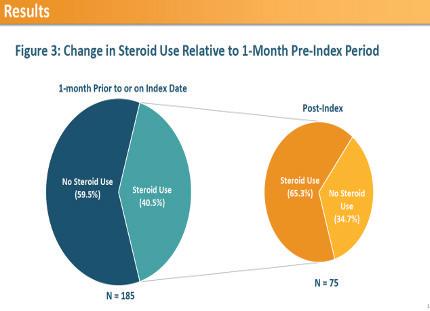
Discontinuations
Konklusjonen på denne interim analysen viser at Eltrombopag (EPAG) til ITP ere n effektiv behandling og øker platetalet, samtisig som det reduserer blødningsrisikoen. Det var ikke mulig å beregne eksakt overall repsonse rate grunnet metodologiske årsaker, men basert på antallet av pasienter som avsluttet behandlingen grunnet
avatrombopag i USA, sammenlignet med behandling med andre TPO-agonister. Spesielt fokus på kliniske karkateristika, behandlings mønster og resultater. De brukte da data fra apoteker og diagnosekoder, sammen med laboratorie data for å se hvordan pasientene hentet ut medisin og fulgte dette over tid.
I følge data fra studiet hadde >80% av pasientene med tilgjengelige data oppnådd et stabilt platetall etter oppstart med AVA, og mange av disse pasientene som ved oppstart stod på kortikosteroider kunne i løpet av oppfølgingsperioden avslutte kortikosteroider. Halvparten av pasientene inkludert i studiet hadde blitt behandlet med en annen TPO-agonist innen de siste 6 mnd før oppstart med AVA, tydende på at dette var en relativt tungt behandlet gruppe. Studiet er dog begrenset i at det er et real-world data studie og kun de pasienter med tilgjengelig data fra ulike databaser er inkludert, men de er i overenstemmelse med de første studiene på AVA.
manglende respons (18%), har man antatt at øvrige pasienter responderte, i hvertfall midlertidig. Medførende en samlet responsrate på 82%, noe som er i tråd med forlengelsesstudiet EXTEND (Wong RSM et al. Blood 2017; 130: 2527-36), hor man hadde en samlet respons rate på ca 86%.
EPAG behandling er generelt veltolerert, uten alvorlige hendelser. Det er også viktig å bemerke at noe av årsaken til den høye diskontinuering av EPAG inneholder pasienter som stoppet grunnet så god effekt at de kunne avslutte i håp om å holde respons uten behandling, dette innebar 1/8 (dvs 12%)
Andre faktorer som kan være medvirkende til at pasienter avsluttet behandlingen inkluderer alder og komorbiditet. Det skal i den forbindelse nevnes at prosentandelen og antallet av komorbiditeter i gruppen som måtte stoppe var høyere en i resten av gruppen. Men dette er et ikke-intervensjons observasjonsstudie og resultatene er deskriptive og må tolkes med omhu.
4. Avatrombopag (AVA) Treatment respons in patients with Immune Thrombocytopenia (ITP): The Real-AVA 1 study. Oladapo A et al.
Dette studiet kikket på real-world data i behandlingen av
E1912 studien inkluderte 529 tidligere ubehandlede pasienter yngre enn 70 år randomisert 2:1 mellom behandlingsarmene Ibrutinib+R og FCR. Ibrutinib ble administrert «en gang daglig» i tillegg til 6 sykluser initialt med rituximab.
75% Probability
av pasientene med umutert IGHV har ikke progrediert på Ibrutinib + R etter 5,8 års median oppfølging vs 33 % for pasienter behandlet med FCR
Umutert IGHV
Totaloverlevelsen i studien var signifikant høyere i Ibrutinib gruppen vs FCR, en forskjell mellom gruppene på
53%
HR = 0,27, (95% Cl: 0,18–0,41)
p<0,0001
5-year rates: 75%, 33%
FCR (42 events/71 cases) IR (56 events/210 cases)
Probability
HR = 0,47, (95% Cl: 0,25–0,89) p<0,018 5-year rates: 95%, 89%
FCR (18 events/175 cases) IR (21 events/354 cases)
UTVALGT
INDIKASJONER:
Som monoterapi til behandling av voksne med residiverende eller refraktær mantelcellelymfom (MCL). Som monoterapi eller i kombinasjon med rituksimab eller obinutuzumab eller venetoklaks til behandling av voksne med tidligere ubehandlet kronisk lymfatisk leukemi (KLL). Som monoterapi eller i kombinasjon med bendamustin og rituksimab (BR) til behandling av voksne med KLL som har fått minst én tidligere behandling. Som monoterapi til behandling av voksne med Waldenströms makroglobulinemi (WM) som har fått minst én tidligere behandling, eller som førstelinjebehandling hos pasienter som ikke er egnet for kjemoimmunterapi. I kombinasjon med rituksimab til behandling av voksne med WM.
DOSERING OG ADMINISTRASJONSMÅTE:
Behandlingen skal innledes av og gjennomføres under tilsyn av lege med erfaring i bruk av legemidler mot kreft. Behandlingen skal fortsette til sykdomsprogresjon eller til pasienten ikke lenger tolererer den. Mantelcellelymfom (MCL): Voksne: Anbefalt dose er 560 mg 1 gang daglig. Kronisk lymfatisk leukemi (KLL): Voksne: Anbefalt dose, enten som monoterapi eller i kombinasjon, er 420 mg 1 gang daglig. Waldenströms makroglobulinemi (WM): Voksne: Anbefalt dose er 420 mg 1 gang daglig. Ved kombinasjon med anti-CD20-behandling, anbefales det å gi ibrutinib før anti-CD20-behandling når de gis på samme dag.
FORSIKTIGHETSREGLER:
Blødningsrelaterte hendelser:
• Spesiell forsiktighet ved antikoagulasjonsbehandling.
• Warfarin/vitamin K-antagonister skal ikke gis samtidig med IMBRUVICA, og fiskeolje og vitamin E-preparater skal unngås.
Atrieflimmer/-flutter, ventrikulær arytmi eller hjertesvikt:
• Ved eksisterende atrieflimmer som krever antikoagulasjonsbehandling bør oppstart med andre behandlingsalternativer vurderes.
• Ved eksisternede relevante risikofatorer for hjertehendelser, eller utvikling under behandling, bør nytte/risiko evalueres, og andre alternativer eller samtidig antikoagulasjonsbehandling vurderes.
• Ved tegn/symptomer på ventrikulær takyarytmi skal behandling midlertidig seponeres.
• Ved grad 2 hjertesvikt skal IMBRUVICA holdes tilbake inntil hjertehendelser når grad 1 eller baseline verdier.
Virusreaktivering:
• Hepatitt B-virus (HBV)-status bør fastslås før behandlingsoppstart. Ved positiv hepatitt B-serologi, bør pasienten overvåkes og behandles for å forebygge hepatitt B-reaktivering.
janssen.som/norway
Janssen-Cilag AS, Drammensveien 288, 0283 Oslo
telefon: + 47 24 12 65 00 mail: jacno@its.inj.com
BIVIRKNINGER:
• Vanligste bivirkninger (≥ 20 %): Artralgi, blødninger, blåmerker, diaré, kvalme, muskel-skjelettsmerter, nøytropeni, trombocytopeni, øvre luftveisinfeksjon og utslett
• Vanligste grad 3/4 bivirkninger (≥5%): Hypertensjon, lymfocytose, nøytropeni, pneumoni og trombocytopeni.
INTERAKSJONER OG DOSEJUSTERING:
Samtidig bruk av moderate til sterke CYP 3A4-hemmere/-induktorer kan gi hhv. økt eller redusert eksponering for IMBRUVICA, og dosejustering eller midlertidig seponering kan være nødvendig.
KONTRAINDIKASJONER:
Preparater som inneholder johannesurt.
PAKNINGER, PRISER OG REFUSJON:
Pakninger og priser: 140 mg: 28 stk.1 (endose) 19 576,60. 280 mg: 28 stk.1 (endose) 39 117,00. 420 mg: 28 stk.1 (endose) 58 657,30. 560 mg: 28 stk.1 (endose) 78 197,70.
Refusjon: 1H-resept: L01E L01_1 Ibrutinib.
Refusjonsberettiget bruk:
Der det er utarbeidet nasjonale handlingsprogrammer/nasjonal faglige retningslinjer og/eller anbefalinger fra RHF/LIS spesialistgruppe skal rekvirering gjøres i tråd med disse.
Vilkår: 216 Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist.

Basert på SPC godkjent av SLV/EMA: 11/2022
CP-362506
Referanser 1. 1. Ref 1. Shanafelt T et al. Long-term outcomes for ibrutinib-rituximab and chemoimmunotherapy in CLL: updated results of the E1912 trial Blood 2022 Jul 14;140(2):112-120.
Overlege, leder for Oslo Myelomatosesenter og fagansvarlig for myelomatose ved OUS
Igjen var det tid for ASH, og igjen var det immunterapi som var i fokus for myelomatose. Med immunterapi mener vi her de målrettede behandlingene som på den ene eller andre måten utnytter T-cellenes kapasitet til å drepe myelomceller, enten i form av CAR-T-behandling eller såkalte T-cell-engagers (TCE), som er medikamenter som binder myelomaceller og T-celler tett sammen, gir aktivering av T-cellene og drap av myelomcellene. Disse medikamentene er allerede i klinisk rutinebruk utenfor Norge, med CAR-T-produktene ide-cel og cilta-cel, og TCEen teclistamab. I Norge har vi denne typen medikamenter i kliniske studier og som compassionate use, både i førstelinje, andrelinje og senlinje. Men det vi vet er at i senlinjebehandling er det fortsatt ikke noe klart tegn til platå; man får tilbakefall. Det er derfor et klart behov for å utvikle og supplere disse behandlingene, og det bringer oss til nyhetene fra årets ASH.
Immunterapi mot BCMA
BCMA er målproteinet for alle godkjente immunterapier per i dag, og det foregår fortsatt forskning for å forbedre disse behandlingene. Teclistamab er den eneste godkjente TCEen, med en PFS på mellom 11 og 12 måneder. Responsraten ligger på 60-70% på de fleste av disse medikamentene, og responsvarigheten på teclistamab er cirka 18 måneder. I 2019 ble preparatet med høyest responsrate publisert, på ca.85%, men medikamentet var gitt intravenøst og toksisiteten var for høy, blant annet med en fatal CRS. Medikamentet har nå fått navnet alnuctamab, og utvikles nå med subkutan formulering. På ASH2022 ble de foreløpige resultatene med subkutan behandling presentert, men også langtidsoppfølgingen på den intravenøse behandlingen, og disse dataene utfyller hverandre (abstract 162). Det mest oppsiktsvekkende med den intravenøse behandlingen var at responsvarigheten var cirka 3 år, betydelig lengre enn for andre medikamenter. Responsraten på den subkutane var 65%, som de andre, og varigheten vet vi ikke noe om ennå. Men hvis den tilsvarer den intravenøse, så kommer PFS til å bli betydelig lengre enn vi har sett for teclistamab. Vi får vente og se.
Som kjent har cilta-cel en høyere responsrate og lengre PFS enn ide-cel. BMS har imidlertid videreutviklet produksjonsmetoden og endret CAR-T-konstruktet, med noe de kaller NEX-T-prosessen (abstract 566). Dette gir mindre differensierte T-celler med anrikning av memory-celler med økt proliferativ kapasitet og bedre tumorkontroll. Responsraten ligger på 95%, tilnærmet lik cilta-cel, så får vi se hvordan PFS blir etter hvert.
Men det morsomste konseptet var fra et lite Nederlandsk selskap som heter CellPoint. Selskapet leverer kokonger som produserer CAR-T-celler on-site, i løpet av 7 dager. Dette forenkler jo prosessen betydelig og vil, hvis det blir en suksess, kunne utvide CAR-Tbehandling til mange flere pasienter, f.eks. dem som per i dag ikke
har tid til å vente 8 uker på sine celler. Sammen med kokongene og teknologien er det også egne CAR-T-konstrukter både mot BCMA og CD19. Kliniske data foreligger foreløpig bare på lymfom/CD19, hvor 6 av 7 pasienter oppnådde CR. Myelomstudien starter snart og Norge er med på den.
Immunterapi mot GPRC5D
Som sagt er BCMA målproteinet som så langt er testet mest. Det neste er GPRC5D, som i tillegg til å være på myelomceller, også er til stede på keratinisert vev, som vi finner i hud, negler, munn og slimhinne. Det viktigste vi foreløpig har lært er at dette målproteinet gir like gode kliniske effekter som behandling mot BCMA, både når det gjelder responsrater (70%) og PFS (11-12mnd). Bivirkningene er dog annerledes, og det kan bli betydelige problemer i hud og negler, men verst er problemet med munnslimhinne, tap av smak og appetitt, og vektnedgang. Dette er fortsatt nytt for oss og noe vi må lære oss å håndtere, men det gir nye utfordringer. Så er det også noen fordeler. Vi er vant med at BCMA-rettet behandling mer eller mindre utsletter B-cellene, gir hypogammaglobulinemi og mye infeksjoner. Dette er annerledes for GPRC5D. Det ses svært lite infeksjoner, man er i stand til å få vaksineresponer og få trenger immunglobuliner (Chari et al; ASH2022). Seleksjonen av myelomceller vs normale plasmaceller er mye sterkere enn for BCMA-rettet behandling. Noen nye problemer, men altså mindre av noen gamle. Og ikke minst kan det virke når målproteinet er resistensmekanismen.
Neste skritt er derfor å angripe GPRC5D med CAR-T-teknologien, og ferske data ble presentert på ASH (abstract 364). Kort fortalt er responsraten 90-100%, og det er like lite infeksjoner som ved TCE mot GPRC5D, men det mest spennende var off-tumor-effektene med hud, negler og munnproblemer. Heldigvis ser det ut til at disse problemene er betydelig mindre enn ved TCE-behandlingen, så denne behandlingen ser veldig lovende ut. Langtidseffektene vet vi selvfølgelig lite om.
Immunterapifremtiden ser lys ut for myelomatose, men også andre medikamenter kommer. Vi har allerede tatt i bruk belantamab i Norge, og fått erfaring både med veldig gode responser, men også en del synsproblematikk. Et spennende spørsmål fremover vil jo være resistensmekanismene for forskjellige behandlinger rettet mot det samme målproteinet, siden belantamab også retter seg mot BCMA. Kort oppsummert er dette det vi tror. Vi tror ikke at tap av BCMA er en vanlig resistensmekanisme for hverken belantamab eller for immunterapiene. Vi vet at TCE-behandlinger virker etter belantamab og CAR-T, og vi vet at CAR-T etter TCE-behandling gir dårlige resultater. Hvordan belantamab virker etter immunterapi vet vi ikke, men studier er på gang.
Utleveringsgruppe C, Reseptbelagt legemiddel.
Indikasjoner: I kombinasjon med lenalidomid og deksametason til behandling av myelomatose hos voksne som har fått minst 1 tidligere behandling. I kombinasjon med pomalidomid og deksametason til behandling av voksne med tilbakevendende og refraktær myelomatose som har fått minst 2 tidligere behandlinger, inkl. lenalidomid og en proteasomhemmer, og sykdomsprogresjon er vist med siste behandling.
Dosering: Voksne inkl. eldre: Premedisinering for forebygging av infusjonsrelaterte reaksjoner (IRR) skal gis. Empliciti i kombinasjon med lenalidomid og deksametason gis som IV, 10 mg/kg kroppsvekt ukentlig de 2 første syklusene, deretter 20 mg/kg kroppsvekt dag 1 i de påfølgende syklusene. Empliciti i kombinasjon med pomalidomid og deksametason gis som IV, 10 mg/kg kroppsvekt ukentlig de 2 første syklusene, deretter 20 mg/ kg kroppsvekt dag 1 i de påfølgende syklusene. En syklus er 28 dager. For detaljert doseringsskjema se www.felleskatalogen.no.
Vanligste bivirkninger: De vanligste bivirkningene (oppstod hos > 10 % av pasientene) ved elotuzumab behandling var IRR, diaré, herpes zoster, nasofaryngitt, hoste, pneumoni, øvre luftveisinfeksjon, lymfopeni og vektreduksjon.
Alvorlige biverkninger: Den alvorligste bivirkningen som kan oppstå under elotuzumab behandling er pneumoni.
Kontraindikasjoner*: Overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene. Preparatomtalene for lenalidomid, pomalidomid og deksametason som brukes i kombinasjon med Empliciti skal gjennomgås før oppstart av behandling.
Advarsler og Forsiktighetsregler: IRR er rapportert hos pasienter som har fått elotuzumab. Premedisinering skal gis før infusjon. Pasienten bør overvåkes for utvikling av Sekundære primære maligniteter (SPM). I kliniske studier hos pasienter med myelomatose var forekomsten av alle infeksjoner, inkludert pneumoni, høyere hos pasienter behandlet med Empliciti. Pasienter bør overvåkes og infeksjoner bør håndteres med standardbehandling. For fullstendig informasjon, se preparatomtale og SPC tilgjengelig på www.felleskatalogen.no.
Interaksjoner: Ingen farmakokinetiske interaksjonsstudier er utført. Metabolisme via CYP450 enzymer eller andre legemiddelmetaboliserende enzymer forventes ikke. Empliciti kan påvises i serumproteinelektroforese (SPEP) og ved immunfiksering i serum hos myelompasienter og kan interferere med riktig responsklassifisering. Tilstedeværelse av elotuzumab i pasientens serum kan forårsake en liten topp i begynnelsen av gamma regionen på SPEP som tilsvarer IgGƙ ved immunfiksering i serum. Denne interferensen kan påvirke vurderingen av fullstendig respons og mulig tilbakefall fra fullstendig respons hos pasienter med IgG kappa myelomprotein. I tilfeller hvor det påvises ekstra topper ved immunfiksering i serum bør en mulig biklonal gammopati utelukkes.
Pakninger, priser og refusjon: 300 mg: 1 stk. (hettegl.) 15190,30 kroner. 400 mg: 1 stk. (hettegl.) kr 20241,70 kroner. Empliciti er godkjent refundert i kombinasjon med lenalidomid og deksametason til pasienter som har fått 3 tidligere behandlingslinjer.
Se felleskatalogen for fullstendig forskrivningsinformasjon før forskrivning.
Bristol Myers Squibb Norge, Lysaker Torg 35 1366 Lysaker, telefon: 23 12 06 37 , www.bms.com/no
Versjon 1
Bristol Myers Squibb Lysaker Torg 35 1366 Lysaker www.bms.com/noGodkjent av beslutningsforum, i kombinasjon med lenalidomid og deksametason, hos voksne myelomatosepasienter som har fått minst 3 tidligere behandlingslinjer1.VIKTIG SIKKERHETS-OG FORSKRIVNINGSINFORMASJON Empliciti® (elotuzumab)
Allogen stamcelletransplantasjon – har vært, er eller kan bli aktuell behandling for de fleste hematologiske maligniteter. Mengden av presenterte transplantasjonsrelaterte data ved ASH 2022, var derfor meget stor. Prospektive randomiserte studier er imidlertid ikke hverdagskost og to slike vakte stor interesse.

Den første er en stor tysk multisenter studie som undersøker prospektivt randomisert nytten av å transplantere refraktær AML med det såkalte FLAMSA regimet (ref) versus standardbehandling som er å transplantere AML etter gitte sykdomsrisikoalgoritmer, kun i remisjon. Denne studien (Abstract # 4) “In patients with relapsed/refractory AML sequencial conditioning and immediate allo-HSCT results in similar OS and LFS compared to intensive remission induction chemotherapy followed by allo HSCT.” ble presentert i «plenary session» søndag 11. desember av Johannes Schetelig fra Dresen på vegne av «Study alliance Leukemia and the German cooperative Transplant study group».
Høy risiko AML pasienter (18 – 75 år) som ikke gikk i remisjon etter første induksjonskur eller pasienter med første ubehandlede tilbakefall bel randomisert 1:1 (stratifisert etter sykdomsstatus,
AML biologi og alder) til enten konvensjonell behandling med ny induksjonskur og deretter transplantasjon om man oppnådde remisjon (remission induction arm) versus den eksperimentelle armen der man praktiserte å holde pasienten «flytende» ved observasjon, lavdose ArA-C eller Mitoxantron 10 mg/kvm til man kunne transplantere etter sekvensiell kondisjonering «FLAMSA RIC» (Schmid C et al J Clin Oncol 2005, 23: 5675-5687) som representerer AML induksjon etterfulgt av en doseredusert kondisjonering med Flu/TBI, så transplantasjon i aplasi (disease control arm). Primære endepunkt i studien var sykdoms fri overlevelse dag 56. etter transplantasjon og overlevelse fra randomisering. Angivelig kunne 76% av «disease control armen» bringes til transplantasjon ila median 4 uker mens bare halvparten i «remission induction armen» oppnådde remisjon og median tid til transplantasjon i denne gruppen var 8 uker. Det var ingen forskjeller mellom gruppene mhp de primære endepunktene. Studien vakte mye diskusjon fordi den utfordrer gjeldende praksis med krav til komplett remisjon v AML som en forutsetning for konsolidering med allo-HSCT. Videre tilbrakte pasientene i eksperimentarmen bare halvparten så mange døgn i sykehus og hadde færre alvorlige bivirkninger. Konklusjonen ble så langt oppfattet å være: Oppsiktsvekkende
data men så langt, mange ubesvarte spørsmål som man først kan vurdere når studien er fullpublisert.
Post transplantasjon Cyklophospamid som GvHD profylakse: Det er nå 20 10 år siden transplantasjonsmiljøene ved John Hopkins, Boltimore i samarbeide med Seattlegruppen pionerte «post transplantasjon cyklofosfamid + Tacrolimus og Mycophenolat Mofetil» som GvHD profylakse og kunne vise at det var trygt og en dramatisk reduksjon i forekomst av spesielt kronisk GvHD (O`Donnell PV, Luznik L et al, BBMT. 2002;8(7):377-386.).
Den andre prospektive randomiserte transplantasjonsstudien ved ASH -2022, ble presentert som; Late Breaking Abstract, tirsdag 13. Desember; “LBA-4”: Post-Tranplant Cyclophosphamide (PTCy), Tacrolimus and Mycophenolate Mofetil (Tac/MMF) as the new standart for Graft-Versus-Host-Disease Prophylaxis in reduced Intensity Conditioning: Results from Phase III BMT CTN 1703.
Studien er utført av det amerikanske “Blood and Marrow Transplant Clinical Network» som basert på en tidligere prospektiv randomisert multisenter studie, har funnet Tacrolimus og metotrexate (Tac/Mtx) bedre enn Sandimmun og metotrexate som standard GvHD profylakse. Studiegruppen randomiserer her i aktuell studie, mellom sin standard GvHD profylakse Tac/Mtx (n=217) og PTCy/Tac/MMF (n= 214). Primært endepunkt er 1 års GvHD- og Relapsefri overlevelse (GRFS) og de finner en signifikant fordel for kombinasjonen PtCy/TAC/MMF, GFRS 52,7% versus 34,9%.
Relevansen for oss er vanskeliggjort av at den relevante komparatoren i Europa vil være Sandimmun/Mtx/ATG i RIC sammenheng. Våre egne OUS registerdata indikerer at disse PTCy/Tac/MMF dataene ikke gir bedre GRFS enn Sandimmun/Mtx /ATG.
Den tredje studien jeg velger å presentere, med stor relevans for GvHD profylakse valg, men som kun har historiske kontroller;
Abstract #722 presentert av Alex Hoover et al. Phase II study of Myeloablative 8/8 – or 7/8 matched allotransplantation with post – transplant cyclophosphamide, Tacrolimus and Mycoohenolate Mofetil. Marked reduction in Gvhd risk without increased relapse risk compared to historical Cyclophosphamide/Methotrexate.
Dette er en fase II studie fra Minnesota som ved transplantasjoner med myeloablativ kondisjonering sammenligner PTC/Cy/MMF med historiske data med Cyklosprin/metotrexat. Endepunktene er her 2 års GRFS og Totaloverlevelse ved 2 år. Det bekreftes også her for begge endepunkter, en klar fordel for PTCy/Cy/MMF versus
konvensjonell GvHD profylakse. Utfordringen er igjen at for de fleste europeiske transplantasjonssentra vil GvHD profylakse med ATG være den naturlige komparator. PtCy som ble pionert i HLA-Haloid familiedonor sammenheng, brukes nå ved flere sentra i Europa også ved MUD og HLA-id familedonores. Det er synes trygt og det har klar gunstig effekt på forekomst av spesielt kronisk GvHD. Videre synes EBV reaktivering, Post Transplantasjons Lymfom utvikling og andre virusinfeksjoner å være langt mindre utfordrende enn ved bruk av ATG, Imidlertid er det ikke helt uten toksistet og det forsinker i gjennomsnitt engraftment og vil dermed øke behovet for blodprodukter. De helseøkonmiske konsekvensene ar derfor ikke endelig avklarte.
The Double Dauno study, 60 vs 90mg/m2 og enkel vs. standard induksjon
Den tyske Double-Dauno studien (abstract #217) er en stor tysk multisenterstudie som forøker å svare på to grunnleggende spørsmål om induksjonsbehandling med 7+3 (antracyclin/ cytarabin); gir daunorubicin 90mg/m2 bedre responsrate og overlevelse enn daunorubicin 60mg/m2, og gir dobbel induksjon (antracyclin i første og andre kur) bedre overlevelse enn enkel induksjon (antracyklin kun i første kur). Studien var todelt. I del 1 av studien ble pasienter randomisert til enten 60mg/m2 eller 90mg/m2. Endepunkt i del 1 var om det var mindre enn 7,5% forskjell i andel pasienter med blastreduksjon dag 15 dager når 218 pasienter hadde blitt inkludert. Studien viste ingen statistisk forskjell i andelen pasienter med reduksjon i andel blaster dag 15 og konkluderte dermed at begge dosene daunorubicin var ekvipotente. Studien fortsatte så med å rekruttere pasienter. Alle pasientene fikk nå daunorubicin 60mg/m2 og de som oppnådde tilstrekkelig blastreduksjon dag 15 ble randomisert til enten enkel eller dobbel induksjon; dvs. daunorubcin 60mg/m ved kun første kur, eller ved både første og andre kur. Etter median oppfølging på 43.6 måneder var 3 års residivfri overlevelse 51% ved enkel induksjon mot 60% ved dobbel induksjon, mens overlevelse etter 3 år var sammenlignbar for begge gruppene (77% vs 75%/ enkel single vs. dobbel induksjon). Konklusjonen i studien var at 60mg/ m2 synes like effektiv som 90mg/m2, og at enkel induksjon var like effektiv som dobbel induksjon.
Kritikk av studien er at primære endepunkt i del 1 er remisjonsrate og ikke overlevelse. Selv om det ikke var en statistiske forskjell mellom gruppene var responsraten betydelig lavere i daunorubicin 60mg/m2 gruppen. Dette gjør at det fortsatt 40 år etter 7+3 ble innført ikke er helt klart hvilke dose daunorubicin som er optimal.
Quizartinib ved induksjonsbehandling, oppdatering av QuANTUM-First.
Ratify studien har tidligere vist at tillegg av midostaurin (en multikinase-hemmer) til standard induksjonsbehandling forbedrer overlevelse hos pasienter med FLT3 mutert AML. Quizartinib er en tyrosinkinasehemmer som gir en mere målrettet og bedre hemming av FLT3 enn midostaurin. Tillegg av quizartinib til standard induksjonsbehandling har blitt undersøkt i QuANTUM-First studien. Mens hovedresultatene av QuANTUM-First ble presentert ved EHA i 2022 ble oppfølgingsdata og subgruppeanalyser nå presentert (abstract # 878 og #225). Overlevelsen var som tidligere rapportert bedre for behandling med quizartinib med median overlevelse 15,1 måneder for placebo mot 31,9 måneder for quizartinib (HR 0.776, 0,6150,979). Oppdaterte data viste at pasienter som ble oppnådde en dyp MRD respons var større hos pasienter som hadde fått quizartinib
(13.8% vs. 7.4%). Selv om pasienter i CR oppnådde en større grad av dyp MRD respons var fortsatt allotransplantasjon den viktigste faktoren for å sikre langtidsoverlevelse. Flere momenter gjør det vanskelig å sammenligne effekt av midostuarin og Quizartinib; Ratify kun inkluderte pasienter mellom 16 og 60 år, var over 40% av pasientene i QuANTUM-FIRST over 60 år og mens Ratify inkluderte pasienter med både FLT3-ITD og FLT3-TKD mutasjoner inkluderte QuANTUM-First kun pasienter med FLT3-ITD mutasjon. Lengre oppfølgingstid og mere data er nødvendig for å kunne sammenligne effekten av quizartinib og midostaurin.
Azacitidine, Venetoclax and Gilteritinib ved FLT3 mutert AML
Abstract #831 presenterte oppdaterte data på behandling med azacitidine, venetoclax og gilteritinib for pasienter med FLT3 mutert AML som ikke var kandidat for induksjonsbehandling, presentert. Hos pasienter med nylig diagnostisert AML oppnådde 25 av 27 pasienter CR, mens hos pasienter med refraktær AML oppnådde 14 av 20 pasienter CR. Behandlingen førte til rask blastreduksjon i benmargen med reduksjon til under 5% hos 67% og flertallet som oppnådde CR ble MRD negative. Ikke overraskende er denne trippelbehandling myelosuppresiv (median tid til neutrofile over 1,0 på 39 dager og trombocytter over 100 på 33 dager), og dose/ behandlingslengde av venetoclax og/eller gilteritinib må antagelig modifiseres for å kunne øke toleransen. En større multicenterstudie er under planlegging for å kunne verifisere disse resultatene.
Venetoclax kombinert med Fludarabin, Idarubicin som induksjonsbehandling.
Maconi og Piciocch presenterte data fra den italienske Gimema AML1718 studien (asbtract #59 og #616) der man undersøkte effekten av Venetoclax kombinert med Fludarabin, Idarubicin og Cytarabine (V-FLAI). Data fra denne studien ser ut til å bekrefte funn fra Md. Anderson om at en høyere andel av pasienter oppnår komplett remisjon med MRD negativitet. Etter at 57 pasienter var inkludert i den italienske studier er andel som har oppnådd CR/CRi 86,7% og 70% CR. Av pasienter som oppnådde CR/CRi var 74% MRD negative. Sammenlignet med matchede historiske kontroller observerte man en forbedret sykdomsfri overlevelse, median overlevelse ved standard induksjon 19,9 måneder vs. ikke nådd for V-FALI. Doseringen med venetoclax fra dag 1 til 14 synes
å gi uttalt benmargsaplasi med økt risiko for infeksjoner og må muligens reduseres til kun 7 dager for å forbedre toleranse. Selv om resultatene for trippelkombinasjonen er svært lovende må effekt og sikkerhet verifiseres, en multisenterstudie er under planlegging
Optimal dosering av venetoclax og langtidsdata fra Viale-A Langtidsdata fra Viale-A er studien som sammenlignet azacitidine
UTVALGT
VIKTIG SIKKERHETS-OG FORSKRIVNINGSINFORMASJON Empliciti® (elotuzumab)
Utleveringsgruppe C, Reseptbelagt legemiddel.
Indikasjoner: I kombinasjon med lenalidomid og deksametason til behandling av myelomatose hos voksne som har fått minst 1 tidligere behandling. I kombinasjon med pomalidomid og deksametason til behandling av voksne med tilbakevendende og refraktær myelomatose som har fått minst 2 tidligere behandlinger, inkl. lenalidomid og en proteasomhemmer, og sykdomsprogresjon er vist med siste behandling.
Dosering: Voksne inkl. eldre: Premedisinering for forebygging av infusjonsrelaterte reaksjoner (IRR) skal gis. Empliciti i kombinasjon med lenalidomid og deksametason gis som IV, 10 mg/kg kroppsvekt ukentlig de 2 første syklusene, deretter 20 mg/kg kroppsvekt dag 1 i de påfølgende syklusene. Empliciti i kombinasjon med pomalidomid og deksametason gis som IV, 10 mg/kg kroppsvekt ukentlig de 2 første syklusene, deretter 20 mg/ kg kroppsvekt dag 1 i de påfølgende syklusene. En syklus er 28 dager. For detaljert doseringsskjema se www.felleskatalogen.no.
Vanligste bivirkninger: De vanligste bivirkningene (oppstod hos > 10 % av pasientene) ved elotuzumab behandling var IRR, diaré, herpes zoster, nasofaryngitt, hoste, pneumoni, øvre luftveisinfeksjon, lymfopeni og vektreduksjon.
Alvorlige biverkninger: Den alvorligste bivirkningen som kan oppstå under elotuzumab behandling er pneumoni.
Kontraindikasjoner*: Overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene. Preparatomtalene for lenalidomid, pomalidomid og deksametason som brukes i kombinasjon med Empliciti skal gjennomgås før oppstart av behandling.
Advarsler og Forsiktighetsregler: IRR er rapportert hos pasienter som har fått elotuzumab. Premedisinering skal gis før infusjon. Pasienten bør overvåkes for utvikling av Sekundære primære maligniteter (SPM). I kliniske studier hos pasienter med myelomatose var forekomsten av alle infeksjoner, inkludert pneumoni, høyere hos pasienter behandlet med Empliciti. Pasienter bør overvåkes og infeksjoner bør håndteres med standardbehandling. For fullstendig informasjon, se preparatomtale og SPC tilgjengelig på www.felleskatalogen.no.
Interaksjoner: Ingen farmakokinetiske interaksjonsstudier er utført. Metabolisme via CYP450 enzymer eller andre legemiddelmetaboliserende enzymer forventes ikke. Empliciti kan påvises i serumproteinelektroforese (SPEP) og ved immunfiksering i serum hos myelompasienter og kan interferere med riktig responsklassifisering. Tilstedeværelse av elotuzumab i pasientens serum kan forårsake en liten topp i begynnelsen av gamma regionen på SPEP som tilsvarer IgGƙ ved immunfiksering i serum. Denne interferensen kan påvirke vurderingen av fullstendig respons og mulig tilbakefall fra fullstendig respons hos pasienter med IgG kappa myelomprotein. I tilfeller hvor det påvises ekstra topper ved immunfiksering i serum bør en mulig biklonal gammopati utelukkes.
Pakninger, priser og refusjon: 300 mg: 1 stk. (hettegl.) 15190,30 kroner. 400 mg: 1 stk. (hettegl.) kr 20241,70 kroner. Empliciti er godkjent refundert i kombinasjon med lenalidomid og deksametason til pasienter som har fått 3 tidligere behandlingslinjer.
Se felleskatalogen for fullstendig forskrivningsinformasjon før forskrivning.
Bristol Myers Squibb Norge, Lysaker Torg 35 1366 Lysaker, telefon: 23 12 06 37 , www.bms.com/no
Versjon 1
Bristol Myers Squibb Lysaker Torg 35 1366 Lysakerwww.bms.com/no
Godkjent av beslutningsforum, i kombinasjon med lenalidomid og deksametason, hos voksne myelomatosepasienter som har fått minst 3 tidligere behandlingslinjer1.1. Beslutningsforum for nye metoder 23.05.2022 sak 064-2022
monoterapi med azacitidine/venetoclax (aza/ven) (abstract #219). Etter en median oppfølging på 43.2 måneder var median overlevelse 14.7 måneder I aza/ven gruppen og 9.6 måneder i azacitidine/ placebo gruppen. Etter ca. 32 måneder var nesten ingen i live i azacitidine gruppen, mens etter 48 måneder var kun et mindretall av pasientene i aza/ven gruppen i live. IDH1/2 mutasjon og dybde på respons var assosiert med bedre overlevelse hos pasienter behandlet med aza/ven med median overlevelse 19.9 måneder for pasienter med IDH1 eller 2 mutasjoner, og 34,2 måneder hos pasienter som ble MRD negativ.
Behandling med venetoclax sammen med azacytidine er assosiert med en betydelig risiko for neutropeni og infeksjoner. Kun et mindretall av pasientene tolererer kontinuerlig behandling med venetoclax i 28 dager og reduksjon av daglig dose eller antall dager med venetoclax er ikke uvanlig. Willekens (Abstract # 222) presenterte data fra en fransk retrospektiv studie av effekten av aza/ ven hos pasienter som kun hadde fått 7 dager med venetoclax ved hver syklus. Studien identifiserte 82 pasienter som ved hver syklus kun hadde fått 7 dager med venetoclax. Med median alder på 75 år, ca. 70% i alvorlig risikogruppe, hos ca. 30% av pasientene ble det indentifisert komorbiditet som ville ekskludert pasientene fra deltagelse i Viale-A studien. Med en andel CR/CRi på 68,3% med median tid til respons 2 sykluser er disse resultatene sammenlignbare med resultatene i Viale-A studien. Selv ved kun 7 dager med venetoclax trengte 34 av 56 som oppnådde CR/CRi dosereduksjon grunnet uttalte cytopenier. Disse resultatene støtter at venetoclax antagelig kan doseres i lavere dose eller for en kortere periode uten at effekten er dårligere. Imidlertid er det ikke klart ved hvilken dosering effekten av venetoclax avtar såpass mye at andel med CR/CRi faller betraktelig. Effekten av dosereduksjon av venetoclax på responsvarighet er også ikke avklart og i løpet av 2023 åpner en studie i Helse vest som vil undersøker dette.
Venetoclax/vidaza eller standard induksjon.
Kombinasjonen venetoclax/ azacitidine (aza/ven) ser ut til å gi en noe lavere andel komplette responser enn standard induksjon med 7+3, men er muligens noe bedre tolerert med lavere risiko for alvorlige komplikasjoner. Randomiserte studier som direkte sammenligner standard induksjon med aza/ven er nylig startet og forventes å ha første resultater om 2 til 3 år (ASH abstract #615). Matthews et al. presenterte en historisk sammenligning mellom standard induksjon og aza/ven (Abstract #426). Studien sammenlignet 305 pasienter som hadde fått standard induksjon mot 504 pasienter som fikk aza/ven. Selv om man forsøkte å identifisere pasienter behandlet med aza/ven som man trodde ville ha tolerert standard induksjon, var det fortsatt betydelige skjevheter i pasientpopulasjonen (høyere alder i aza/ven gruppen,
betydelig høyere tidlig mortalitet i ven/aza gruppen (13% vs 6%,, og studien viser dermed godt hvorfor man trenger en randomisert studie som direkte sammenligner 7+3 og aza/ven.
Magrolimab
Magrolimab er en makrofag- checkpoint inhibitor som, ved å blokkere CD47 (såkalt «don’t eat-me signal»), aktiverer «tumorspisende» makrofager. Magrolimab testes nå ut i kombinasjon med azacitidine og venetoclax (Abstakt #61). I en nylig diagnostisert AML var responsraten 33 av 41 pasienter (80%). Responsraten hos 27 pasienter med TP53 mutasjon var 63% CR/CRi 41%, mens responsraten hos pasienter uten TP53 mutasjon var 86% CR/CRi. Etter en median observasjonstid på 9.2 måneder var 1 års overlevelse for pasienter med TP53 var: 53% og uten TP53 mutasjon 83%. Hos pasienter med AML tidligere behandlet med venetoklask var responsraten ved tillegg av magrolimab lav (2/17 (12%)) og studien var nå stoppet for disse pasientene. Hos pasienter med refraktær AML som ikke tidligere hadde fått venetoclax var responsraten. 8/12 (75%). Behandling med magrolimab var godt tolerert med lav tidlig dødelighet (0% ved refraktær sykdom and 7% nylig diagnostisert AML). Siden magrolimab øker fagocytose av erytrocytter var anemi en forventet bivirkning som ble sett hos 24%. Behandling med magrolimab var ellers godt tolerert. AML med biallelisk TP53 mutasjon har svært alvorlig prognose og kun et mindretall av pasientene blir også etter allogen stamcelletransplantasjon langtidsoverlevere. Høy responsrate hos pasienter med TP53 mutasjoner gjør at magrolimab er et medikament med lovende resultater. Enhance-3 er en fase III studie med tillegg av placebo eller magrolimab til aza/ven. Studien er i Norge åpen for inklusjon ved Haukeland Universitetssykehus or Rikshospitalet.
BLENREP gis som monoterapi og er et antistoff-legemiddel-konjugat (ADC) målrettet mot B-celle modningsantigenet (BCMA) til pasienter som har fått minst fire tidligere behandlinger og er refraktære mot minst en proteosomhemmer, en ImiD og et CD38 antistoff.1
UTVALGT SIKKERHETSINFORMASJON
Korneale bivirkninger er rapportert hos 71% av pasientene: keratopati eller mikrocystelignende epiteliale endringer i korneal epitelium med eller uten: endringer i synet, - uklart syn, - symptomer på tørre øyne. De som tidligere har hatt tørre øyne, er mer utsatt for å utvikle endringer i korneaepitel.
Oftalmisk undersøkelse (inkludert synsprøve og undersøkelse med spaltelampe) utført av øyespesialist skal utføres før oppstart og de tre påfølgende behandlingssyklusene, og som klinisk indisert under behandling
Bruk opplæringsmateriell om korneale bivirkninger for helsepersonell og pasienter (www.felleskatalogen.no)
Se preparatomtalen om bivirkningshåndtering og full informasjon før forskrivning av Blenrep. Ved uønskede medisinske hendelser, kontakt GSK på telefon 22 70 20 00
Maksimalpris: 100 mg (hetteglass) 95 882,40 kr.