NEONATOLOGÍA
Jhon Ortiz




Para una adecuada atención inmediata del recién nacido (AIRN) se debe tener en cuenta pautas previas y posteriores al nacimiento.
Pautas previas al nacimiento:
Identificar factores de riesgo perinatales, preparar recursos y equipos, y prevenir la pérdida de calor. En este último, el ambiente donde se debe realizar la atención debe a estar a una temperatura de 26°C y de esa manera tener un “ambiente térmico neutro”.
Pautas después del nacimiento:
Los procesos que siguen después en la AIRN lo estudiaremos paso a paso, primero debemos realizar 3 eventos que son:
Hacer 3 preguntas en orden: ¿es a término?, ¿tiene buen tono?, ¿llora o respira bien? (recordar que el 90% de recién nacidos responden como “SI” a las 3 preguntas por lo que deberá pasar al segundo evento; de obtenerse algún “NO” como respuesta, se procede a clampaje inmediato y reanimación neonatal).
Hacer 3 cosas: aspiración (ENARM 2003, ENARM 2015 II-B) si es que requiere (primero boca y luego nariz), secado y estimulación, mientras se realiza contacto precoz.
Calcular el APGAR: El Apgar mide el estado fisiológico o la vitalidad del RN (ENARM 2018-A, ENARM 2019-A, ENARM 2021-B) y el grado de depresión, en base a 5 parámetros (ENARM 2006-A): color, frecuencia cardiaca, gesticulación, tono y esfuerzo respiratorio; se mide al 1° y 5° minuto obligatoriamente. Resultados: adecuado (7-10), depresión moderada (4-6) (ENARM 2005, ENARM 2018-B, ENARM 2020-A) y depresión severa (menor o igual a 3) (ENARM 2019-A)
90%
Sala de partos
Sala de atención inmediata
1. Hacer 3 preguntas - Es a término?
- Buen tono?
- Llora o respira bien?
2. Hacer 3 cosas
- Aspirar si requiere - Secado
- Estimulación
3. Apagar
El 90% de recién nacidos pasa bien los periodos de adaptación, responder con tres “Sí” a las tres preguntas y tienen un Apgar adecuado.
Damos a la Madre
Por min 45-60 min:
1. Contacto precoz
2. Lactancia precoz
3. Clampaje e identificación
Evaluación del RN
1. Antropometría
2. Examen físico
3. Calcular EG y PN/EG
Profilaxis Ocular Sangrado Vacunas Cord. Umb
DAMOS A LA MADRE Alojamiento conjunto
TNU y Evaluac. sgtes A las 12h c/24h
Alta
Damos al Neonatologo 10% (1% RCP)

Reingreso
1. Ictericia
2. Deshidratación
Educación a la Madre
Parto vaginal 48h
Parto por cesárea 96h
Ante un RN con síndrome de abstinencia hijo de madre consumidora de opioides, está contraindicado el uso de naloxona (ENARM 2014 I-B)
Los eventos que estudiaremos ahora son solamente para el recién nacido que curso sin problemas su nacimiento, que como mencionamos son aproximadamente el 90% de RN. 1) Damos a la madre por 2 motivos: contacto precoz (ENARM 2015 II-B) (no menor de 45-60 min) y lactancia precoz, realizar también el “clampaje oportuno” e identificación del RN con la madre. 2) 1° Evaluación del RN: Antropometría (peso, talla, PC, PT), examen físico (encontrar cosas groseras), determinación de la EG (Dubowitz, Ballard, Capurro, Usher) y la relación Peso/EG (PEG, AEG, GEG). 3) Profilaxis (ocular, sangrado, cordón umbilical, vacunas). 4) Damos a la madre (alojamiento conjunto). 5) Evaluaciones siguientes, en las primeras 12h y luego cada 24h. 6) Tamizaje neonatal universal (TNU). 7) Plantear el alta (PV 48h, PC 96h). 8) Educación de la madre, durante todo este proceso e incluso antes del nacimiento. Todos los datos deben estar registrados en la HC del CLAP.
El 10% de RN, son aquellos que requieren algún otro proceso de más, y el 1% son aquellos que requieren maniobras verdaderas de RCP neonatal.
CONVECCIÓN: por corriente de agua o aire, se evita con puertas y ventanas cerradas.
CONDUCCIÓN: por contacto directo, se evita con toalla precalentada (ENARM 2022-B)
RADIACIÓN: sin contacto directo, se evita con cobertura o cuna radiante.
EVAPORACIÓN: por estar mojado en piel o por vía respiratoria, se evita con el secado o calentando gases respiratorios (si es que recibe ventilación asistida) respectivamente.
El principal mecanismo de perdida de calor en los primeros minutos de vida es la evaporación.
Convección Evaporación
Radiación Conducción

SIGNOS VITALES Y FUNCIONES BIOLÓGICAS: frecuencia cardiaca entre 120-160x´, frecuencia respiratoria entre 40-60x´, saturación de oxígeno depende del minuto de vida (ver RCP neonatal). La primera orina y deposición (meconio) se pueden esperar hasta las 48 horas. El meconio es oscuro y luego las deposiciones se vuelves amarillentas de 5 a 6 cámaras por día (ENARM 2017-B)



SOMATOMETRIA: El peso normal es de 2500-3999 gramos; cursa con una “pérdida de peso fisiológica” con un porcentaje de perdida máxima de 10% (ENARM 2015 I-A), en 5 días máximo y recuperación en 1 a 2 semanas; su talla normal es de 50cm, perímetro cefálico normal de 34 +/-2cm y torácico de 32cm.
PIEL: hallazgos normales como eritema toxico, milia, picadura de la cigüeña, ictericia fisiológica, lanugo, unto sebáceo o vérmix caseoso, mancha mongólica. Alteraciones que pueden ocurrir: mancha en vino oporto el cual es aplanado al inicio (ENARM 2001) (hay que sospechar en síndrome de Sturge Weber (ENARM 2007-A,
2019-B)
CABEZA Y CUELLO: con fontanela anterior normal de 3-4cm, cabalgamiento de huesos craneales, moldeamiento cefálico, distancia entre cantos internos de ojos entre 1.5-2.5cm, puede tener edema palpebral y hemorragia conjuntival, dientes congénitos (1/2000 RN), perlas de Ebstein o nódulos de Bohn. Los senos
al nacer son maxilar y etmoidal (ENARM 2004)
Los RN tienen
hipermetropia

(ENARM 2007-B)
Alteraciones que pueden ocurrir: cefalohematoma (ENARM 2011-A, ENARM 2013-B, ENARM 2015 II-B, ENARM 2017-B), caput succedaneum (ENARM 2006-B, ENARM 2012-A, ENARM 2016-B, ENARM 2020A), craneosinostosis (la escafocefalia es la más frecuente), craneotabes, nódulo de Stroemayer, ránula, escleras azules , debe hacer sospechar en osteogénesis imperfecta (ENARM 2007-A, ENARM 2010-A) Ante un bebe que se ahoga al lactar hay que pensar en atresia de coanas con
prueba inicial de intentar pasar una SNG (ENARM 2007-A). Otro sangrado en cabeza es la hemorragia subgaleal (ENARM 2017-B). Si un bebe tiene lagrimeo constante en un ojo debe sospecharse en dacrioestenosis (ENARM 2007-A). Si un RN tiene fontanela amplia también hay que sospechar en hipotiroidismo congénito (ENARM 2012-A, ENARM 2015 I-B)
Caput succedaneum
Cephalohematoma

Subgaleal hemorrhage
Epidural hemorrhage
Figura 6.
Galea aponeurotica
Subdural hematoma
Scalp
Skull and periosteum
Dura mater
Arachnoid membrane

Alteraciones en cabeza del recién nacido. Nótese las ubicaciones del cefalohematoma, caput succedaneum y hematoma subgaleal.
Figura 7.
Alteraciones en el inadecuado cierre de las fontanelas. Nótese los lugares de cierre para cada uno.
ABDOMEN: hígado palpable, caída de cordón umbilical normal. Alteraciones que pueden estar: persistencia del conducto de uraco (ENARM 2020-B), persistencia del conducto onfalomesentérico, quiste del conducto onfalomesentérico, divertículo de Meckel, granuloma umbilical (su tratamiento es nitrato de plata ENARM 2014 I-B, ENARM 2017-A), arteria umbilical única, hernia inguinal congénita. Ante una masa abdominal la causa más frecuente es hidronefrosis (ENARM 2002) y se debe solicitar ecografía (ENARM 2007-A)
GENITALES: alteraciones que puede tener: fimosis, adherencias balanoprepuciales, 98% tiene testículos en escroto. Es normal encontrar una protrusión de pliegue vaginal en mujeres (ENARM 2017-A), pero si tiene una protrusión en racimo de uvas hay que sospechar en sarcoma botrioide (ENARM 2015 I-A)
EXTREMIDADES: Alteraciones que pueden estar: falta de movimiento en un miembro por fractura de clavícula o parálisis de plexo braquial, asimetría de miembros por LCC.
Luxación congénita de cadera
Se realiza la pruebas de Barlow (ENARM 2013-A) y Ortolani (ENARM 2009-B, ENARM 2019-A) para tamizaje
Clínica: cursa con asimetría de miembros, pliegues y glúteos, limitación para la abducción (ENARM 2015 II-A), dolor al cambio de pañales, Galeazzi positivo, al pasar el año de vida puede presentar cojera.
Exámenes: en menores de 3 meses se sugiere ecografía (ENARM 2014 II-B) y en mayores de 3 meses se sugiere radiografía.

Tratamiento: Para menores de 6 meses se plantea el uso de arnés de Pavlick (ENARM 2007-A) y para mayores de 6 meses se plantea cirugía.
Ante un moro asimétrico debes sospechar en orden de frecuencia en: 1° fractura de clavícula,
2° Lesión de plexo braquial superior y 3° lesión de plexo braquial inferior.
Reflejo de moro asimétrico
Fractura de clavícula (ENARM 2007-A, ENARM 2013-A, ENARM 2015 II-B)

El tercio medio la zona más frecuente de fractura. Lesión musculoesquelética más frecuente. Su manejo es reposo.

Lesión plexo braquial superior
La parálisis de Erb Duchenne es una parálisis de los nervios periféricos cervicales C5 y C6 (ENARM 2001, ENARM 2005, ENARM 2015-B). Adopta la postura de mano de la propina. Su manejo es fisioterapia.
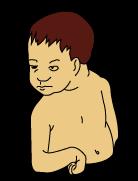
Lesión plexo braquial inferior
La parálisis de Déjèrine -Klumpke o de la porción inferior del plexo braquial se produce por lesión de C7 y C8, e incluso D1. Adopta la postura de mano en garra. Su manejo es fisioterapia.
DUBOWITZ: Mide 21 parámetros de los cuales 11 son somáticos y 10 son neurológicos, dan un margen de error de +/- 2 semana, se puede hacer en >12-24h.
Los score que tienen parámetros neurológicos no pueden ser usados al nacimiento, sino después de 12 a 24 horas.
BALLARD: Mide 12 parámetros de los cuales 6 son somáticos y 6 son neurológicos, dan un margen de error de +/- 2 semanas, se puede hacer en >12-24h.
CAPURRO (ENARM 2012-A): Aquí existe 2 tipos, 1) Solo somáticos (5): forma del pezón, tamaño del tejido mamario, textura de la piel, forma de la oreja, pliegues plantares; con margen de error de +/- 18 días, y se puede usar al nacimiento.
2) Somático y Neurológico (6): tamaño del tejido mamario, textura de la piel, forma de la oreja, pliegues plantares, signo de la bufanda, signo de la cabeza en gota; con margen de error de +/-2 semanas, y se puede hacer en >12-24h.
USHER: No se suele utilizar. Mide parámetros somáticos principales y secundarios (ENARM 2015 II-B).
Según el peso:
≥4000 gramos Macrosómico (ENARM 2003)
3000-3999 gramos Peso normal
2500-2999 gramos Peso insuficiente
<2500 gramos Bajo peso (ENARM 2018-B, ENARM 2012-B)
<1500 gramos Muy bajo peso (ENARM 2010-A, ENARM 2015 I-A)
<1000 gramos Ext-bajo peso (ENARM 2015 II-B)
Si en un caso clínico te dicen oreja bien corvada, pliegues en la mayor parte de la planta del pie y escroto arrugado, marca la mayor edad gestacional (ENARM 2011-B, ENARM 2016-A, ENARM 2017-B, ENARM 2018-B)
Según la EG:
Tabla 4. Clasificación según el peso
≥42 semanas Postérmino (ENARM 2001)
37-41 6/7 semanas A. Termino
34-36 6/7 semanas P. Tardío (ENARM 2000)
32-34 semanas P. Moderado
<32 semanas Muy prematuro
<28 semanas Ext-prematuro
Tabla 5. Clasificación según la edad gestacional
Según la relación Peso/EG: En base a la curva de Lubchenco pueden ser PEG (<P10) (ENARM 2021-B), AEG (P10 - P90) (ENARM 2015 II-B), GEG (>P90).
La profilaxis ocular esta dirigida para gonococo (ENARM 2019-A)

Ocular: previene la conjuntivitis del RN, se usa antibióticos (ENARM 2012-A) (eritromicina, tetraciclina o gentamicina), 1 gota en saco conjuntival, no se da en partos por cesárea.
Sangrado: previene trastornos hemorrágicos del RN, se da vitamina K, 1mg en a término y 0.5mg en prematuro, vía IM en 1/3 medio anterior de muslo.
Cordón umbilical: previene onfalitis (ENARM 2015 II-A), 1 gota de alcohol 70%, se cubre con gasa.
Vacunas: aplicar vacuna BCG y para Hepatitis B. La BCG previene presentación grave de tuberculosis y la vacuna para la hepatitis B previene la transmisión vertical.
El reflejo de ojo rojo también es conocido como la prueba de Bruckner
La normatividad para tamizaje neonatal en el Perú, inicio el 1997 por parte del Ministerio de Salud (MINSA) quien emitió la resolución 494-97-SA/DM que declara necesario el uso del método de tamizaje para el diagnóstico del hipotiroidismo congénito. Actualmente, la normatividad rige que debería realizarse tamizaje neonatal universal (TNU) para
las siguientes patologías: hipotiroidismo congénito, hiperplasia suprarrenal congénita, fenilcetonuria, fibrosis quística, hipoacusia y catarata congénita; teóricamente a todo recién nacido. Las primeras 4 se realizan con 4 gotas de sangre obtenidas del talón del RN (siguiendo el esquema de Blumenfeld) y aplicadas en un papel filtro especial, esto se realiza después de 48 horas de vida o en el primer control, pero no más de 7 días.

El tamizaje de catarata se realiza mediante inspección ocular, reflejo pupilar, reflejo palpebral y reflejo de ojo rojo; esto se hace antes del alta.
El tamizaje de sordera (ENARM 2003) se realiza con otoemisiones acústicas entre las 24 a 48 horas de vida pero no más del 1° mes.

Consta de 4 controles: a las 48 horas del alta y luego cada semana; los controles pueden ser en el establecimiento de salud o en el domicilio (ENARM 2018-A).
1° control: 48 horas del alta
2° control: 7 días de vida
3° control: 14 días de vida
4° control: 21 días de vida
Las malformaciones congénitas más frecuentes son las cardiopatías congénitas.
Las anomalías congénitas son cualquier defecto que presente el recién nacido y se pueden encontrar 4 tipos:
Malformación
Deformación
Disrupción (ENARM 2014 II-B)
Displasia
Estos tipos de anomalías pueden presentarse juntas, el producto de su presentación simultánea puede generar 4 tipos de patrones de anomalías congénitas:
Síndrome
Secuencia
Defecto de un campo
Asociación
Este tipo de síndrome se debe en el 95% de los casos a una trisomía 21 (ENARM 2012-B), 3-4% a una translocación Robertsoniana y 1-2% a mosaicos. 95% se debe a un error meiótico en la disyunción y un 5% por error en la mitosis de células somáticas. En 90% el cromosoma 21 extra es materno, por eso a mayor edad materna mayor es el riesgo. Es la cromosomopatía más frecuente. Cursa con braquicefalia, facies Down, manchas de Brushfield, catarata, nistagmos, macroglosia, boca abierta, orejas de implantación baja, CIV, hipotonía e hiperlaxitud, clinodactilia, mano simeana, hipotiroidismo congénito, diabetes-1 piel redundante en región cervical, atresia duodenal, atresia esofágica/FTE, megacolon aglangliosido, hernia umbilical, retardo mental, signo de la sandalia, retardo mental, mujeres son generalmente fértiles, varones suelen ser infértiles, trastornos hematológicos, inestabilidad atlanto-axial, deficiencias inmunológicas. Su diagnóstico puede ser prenatal con prueba combinada del tercer trimestre (beta-HCG, PAPP-A, transluscencia nucal), biopsia corial; también con el examen físico; y confirmarlo con el cariotipo.
Neonato con Síndrome de Down.
Nótese la facies Down, mano simiana, cardiopatía congénita, atresia intestinal, hernia umbilical y signo de la sandalia


Este síndrome puede ocurrir de 3 maneras, por una trisomía 18 (90%) por no disyunción meiótica, por translocación que involucra al cromosoma 18 y mosaicismo de trisomía 18. Es la 2° trisomía autosómica más frecuente. Aumenta el riesgo a mayor edad materna. Más frecuente en mujeres que varones (3/1). Suelen cursar con RCIU, hipertonía, occipucio prominente, boca pequeña, micrognatia, orejas puntiagudas, esternón corto, riñón en herradura, dedos flexionados patológicamente (ENARM 2013-B)(ESSALUD 2019), cardiopatías congénitas tipo CIV y PCA, divertículo de Meckel y malrotación, onfalocele. Su diagnóstico prenatal se puede sospechar con la asociación de RCIU, polihidramnios y flexión anormal de dedos. La confirmación se hace con cariotipo. La mayoría de diagnosticados prenatalmente mueren en el útero, aproximadamente 50% mueren en las primeras 2 semanas de vida y 5-10% sobreviven al año. (Ver Figura 12)


Los pacientes con síndrome de Patau o síndrome de Edwards no suele pasar del 1° o 2° año de vida.
Se puede deber a un cromosoma 13 extra (ENARM 2021-B, ENARM 2010-A, ENARM 2016-B, ENARM 2015 I-A) por un error meiótico, a una translocación Robertsoniana desequilibrada y por un mosaicismo. Cursa con una triada clásica micro/anoftalmia, labio/paladar hendido y polidactilia. Más del 50% puede presentar holoprosencefalia, discapacidad intelectual severa, sordera, oídos, anormales, coloboma, frente inclinada, hemangioma capilar, pliegue simeano, uñas hiperconvexas, polidactilia (ENARM 2017-B) en manos, talón prominente, CIV, PCA, CIA, dextro posición, criptorquidia y útero bicorne. El diagnóstico prenatal se puede sospechar por los defectos característicos del SNC. La mayoría de diagnosticados prenatalmente mueren, 91% muere en el primer año y 80% en el primer mes de vida. (Ver Figura 13)
El motivo más frecuente de consulta en pediatría de un síndrome de Klinefelter es ginecomastia.
El síndrome de Klinefelter se puede definir como un tipo de hipogonadismo hipergonadotrópico con fenotipo varón. Su cariotipo más frecuente es 47, XXY y el segundo es mosaico. El paciente cursa con ginecomastia patológica, hábito eunucoide (ENARM 2001), brazada mayor a la talla, infantilismo sexual, micropene, testículos pueden aumentar de tamaño, pero igual son pequeños, azoospermia, infertilidad, vello facial escaso, hombros estrechos, musculatura poco desarrollada. (Ver Figura 14)

El motivo más frecuente de consulta en pediatría de un síndrome de Turner es talla corta.

Es un tipo de hipogonadismo hipergonadotrópico con fenotipo mujer. Su cariotipo más frecuente es 45, X0 (ENARM 2003), seguido de mosaico. Al nacimiento se puede evidenciar pterigium coli, cúbito valgo, tamaño pequeño, piel redundante en nuca, edema duro de manos y pies (ENARM 2014 I-B) Es común que tenga alteraciones cardiovasculares típicamente en la aorta como coartación de aorta y aorta bicúspide (ENARM 2020-A). La paciente con síndrome de Turner tiene talla corta, infantilismo sexual, infertilidad, amenorrea primaria, cuello alado, pecho amplio, pezones separados (ENARM 2011-B, ENARM 2014 I-B). (Ver Figura 15)

La asfixia es un estado de hipoxia de todo el cuerpo, por lo tanto hay daño de diferentes órganos.
La asfixia perinatal es una agresión producida al feto o al recién nacido alrededor del momento del nacimiento por la falta de oxígeno y/o de una perfusión tisular adecuada, por lo tanto, afecta a toda la economía del recién nacido, especialmente el sistema nervioso central (encefalopatía hipóxica isquémica - EHI). Las causas para que se presente pueden ser: intraparto (56-80%), preparto (4-20%) y postparto (10%). Clásicamente se le puede clasificar según el puntaje de APGAR al minuto 0-3 (severa) y 4-6 (moderada). La asfixia se caracteriza por una triada bioquímica de hipoxia, hipercapnia y acidosis metabólica/mixta que se agravan según pasa el tiempo.
CRITERIOS ACOG (Colegio Estadounidense de Obstetras y Ginecólogos):
Puntuación de Apgar < 3 a los 5 minutos (ENARM 2020-B)
PH de la arteria umbilical fetal < 7.0 (ENARM 2012-A)
Presencia de insuficiencia orgánica multisistémica compatible con encefalopatía hipóxicoisquémica (EHI). La encefalopatía hipóxico isquémica (EHI) es un síndrome clínico de disfunción neurológica aguda de gravedad variable que acontece tras un episodio de asfixia al nacimiento. Para determinar la gravedad de la EHI existe la clasificación de SARNAT.
ESTADÍO I ESTADÍO II (ENARM 2016-B) ESTADÍO III
Conciencia Hiperalerta Letárgico Estupor profundo o coma
Tono muscular Normal Hipotonia o debilidad proximal Flacidez
ROT Aumentados Aumentados Deprimidos o ausentes
Succión Activa Débil Ausente
Moro Exagerado Incompleto Ausente
Prensión Normal o exagerado Exagerado Ausente
R. oculocefálico Normal Hiperreactivo Reducido o ausente
Pupilas Midriasis Miosis Variables o fijas
Respiración Regular Prof y fr variables o periódicas Apnea irregular
FC Normal o traquicardia Baja en reposo <120x´ Bradicardia Convulsiones Ausentes Frecuentes (70%) Raras
EEG Normal ↓ voltaje, actividad epileptiforme periódica o paroxistica Periódica o isoeléctrica
Sarnat brinda pronóstico y gravedad, en cambio Apgar solo brinda gravedad.
El tratamiento inicial de un lactante tras un episodio de asfixia perinatal incluye la estabilización cardiorrespiratoria en la sala de partos y la evaluación del grado de afectación de los órganos diana. La hipotermia terapéutica es el estándar de atención para tratar la EHI y la asfixia perinatal en recién nacidos a término y prematuros tardíos. La hipotermia reduce el metabolismo cerebral, que es neuroprotector. También da como resultado una disminución del gasto cardíaco debido a la caída tanto de la frecuencia cardíaca como del volumen sistólico, aumenta la presión parcial de dióxido de carbono (PCO 2 ), disminuye la utilización de glucosa y disminuye el metabolismo hepático, lo que afecta la vida media y la dosificación del fármaco.
Según el SIBEN los criterios para hipotermia en neonatos con EHI:
Encefalopatía neonatal moderada o grave Antecedentes de potencial agresión hipóxico-isquémica alrededor del parto Alteración del estado al nacimiento:
♦ Apgar ≤5 a los 10 minutos de edad postnatal.
♦ pH ≤7,0, déficit de base ≥-16mEq/L en sangre arterial de cordón umbilical o en sangre venosa dentro de la primera hora tras el nacimiento.
♦ Necesidad de ventilación mecánica durante por lo menos 10 minutos después del nacimiento.
♦ Necesidad de reanimación cardiopulmonar avanzada.
Según el SIBEN hay dos tipos de hipotermia terapéutica: pasiva o activa, la activa puede ser cefálica o corporal total. La mejor es la corporal total. La hipotermia terapéutica tiene las siguientes características:
Se indica para mayor o igual a 35 semanas de EG
Se debe iniciar antes de las 6 horas
La temperatura objetivo es de 33-34 °C
Debe durar menos de 72 horas
El recalentamiento debe ser a una velocidad menor o igual a 0.5 °C/h
El RCP neonatal comprende una secuencia de pasos estructurados que tienen su última versión de la AHA en el año 2020, aunque se mantienen varias características de la guía del 2015. El porcentaje de recién nacidos que requerirá verdaderas maniobras de RCP es 1%.
Asesoramiento prenatal Reunión informativa y berifación del equipo
Gestación al término? Buen tono? Respirar o llorar?
Respirar o llorar?
Nacimiento Si No
1 minuto
Advertir y mantener a temperatura normal, posicionar las vías respiratorias, limpiar las secreciones si es necesario, secar, estimular
¿Apnea o jadeo?
¿Ritmo cardiáco inferior 100/min?
PPV Monitorizar SPO2 Monitorear y considerar con ECG

¿FC por debajo de 100/min?
Comprobar el movimiento de torax Ventilación de pasos correctivos si es necesario ETT o mascara laringea ysi es necesario
¿FC por debajo de 60/min?
Intubar si no se ha hecho ya compresiones toraxicas.
Coordinar con PPV 100% de O2 Monitorear EKG Considerar una emergencia UVC
¿FC por debajo de 60/min?
Ipenefrina intravenosa Si la frecuencia cardiaca persiste por debajo de 60 por minuto, considerar hipolemia, considerar neumotorax
Figura 14. RCP neonatal AHA 2015-2020
Ver permanencia con la madre para los cuidados rutinarios: calentar y mantener a temperatura normal, colocar las vías respiratorias, limpiar las secreciones sea necesario, limpiar y secar Evaluación contuinua
¿Respiración dificultosa o cianosis persistente?
Posición y despejar las vías repiratorias, monitorizar SpO2, consolamiento de O2 según sea necesario, considerar CPAP
Cuidados posteriores a la reanimación Informe de equipo
La decisión de iniciar la VPP se realizará a los 60 segundos y la determinación de que requiere compresiones se realiza después de 30 segundos del VPP bien ejecutado.
(ENARM 2022-B, ENARM 2018-B)
Los puntos importantes que detallar en la secuencia de RCP neonatal son: La secuencia de RCP neonatal sigue siendo A-B-C-D, donde “A” es la permeabilización de la vía aérea con aspiración si lo requiere (ENARM 2005, 2016-A, ENARM 2017-A, ENARM 2018-A), intubación y posicionamiento. La “B” es la ventilación la cual se brinda con el dispositivo bolsa-válvula-mascarilla (BVM) ya sea con máscara o a través del tubo endotraqueal. La “C” se refiere a las compresiones torácicas y la “D” hace referencia a la adrenalina. Durante toda la secuencia de RCP neonatal los signos más importantes que se evalúan son la frecuencia cardiaca y el patrón respiratorio (ENARM 2014 I-A)
El inicio de la ventilación a presión positiva (VPP) será por alguna de estas tres razones: 1) FC<60 por minuto, 2) apnea, 3) boqueo (ENARM 2012-B, ENARM 2014 I-A, ENARM 2018-B). Esta VPP se hará con la BVM a una frecuencia de 40 a 60 por minuto y con un PIP de 20-25 cmH2O (en RN a término puede darse 30-40 cmH2O). El FiO2 a usar dependerá de la edad gestacional (EG) y de la frecuencia cardiaca, así si tiene >35 semanas de EG se usará FiO2 21%, si tiene <35 semanas de EG se usará FiO2 21-30%, pero si tiene una frecuencia cardiaca menor de 60 por minuto se usará FiO2 100% (ENARM 2022-A) (aquí no importa la EG). Si es que se brindará ventilación con BVM y mascarilla, deberá usarse la maniobra C/E.
La mejor manera de medir la frecuencia cardiaca es con el EKG, pero sino la regla práctica es contar los latidos en 6 segundos y multiplicar por 10.
En los prematuros hay un poco cantidad de surfactante, lo que determinaría la pobre respuesta a las ventilaciones y por ende al RCP neonatal.
(ENARM 2015 II-A)
La monitorización de la saturación de oxígeno es preductal, esto quiere decir que se colocará el sensor en la mano o muñeca derecha. Es importante vigilar la saturación de oxígeno del paciente comparado a lo que debería tener (ver el recuerdo del algoritmo) para determinar si se aumenta, mantiene o disminuye el FiO2.
Las maniobras correctivas se recomienda recordarse con el acrónimo “MRSOPA”, donde:
♦ M – mascara: verificar si la mascarilla es adecuada para el RN.
♦ R – reposición: verificar si está adecuadamente posicionado el RN.
♦ S – secreciones: verificar que no haya secreciones en la vía aérea.
♦ O – open: verificar que la boca del RN esté abierta.
♦ P – presión: verificar que se le está brindando una presión adecuada en la ventilación.

♦ A – alternativa: ir pensando en que probablemente el RN requiera otra manera de brindar la ventilación como por ejemplo intubación endotraqueal o mascara laríngea.
El inicio de las compresiones será cuando el RN mantiene una FC<60 por minuto a pesar de un adecuado VPP (ENARM 2016-A)(ESSALUD 2018). Las compresiones deben ejecutarse con relación a las ventilaciones, a razón de VPP/C = 1/3 (ENARM 2017-A), además para comprimir debe usarse dos manos y dos dedos pulgares aplicando la fuerza con los dedos pulgares en el tercio inferior del esternón para deprimir aproximadamente un tercio del tórax.

El primer parámetro que se recupera en el RCP neonatal es la frecuencia cardiaca seguido del patrón ventilatorio. (ENARM 2009-B)
La adrenalina se usará si es que a pesar de realizar las ventilaciones y compresiones el paciente no mejora y mantiene una FC <60 por minuto (ENARM2018-B). La adrenalina debe tener la concentración de 1:10000, recuerda que la ampolla de adrenalina es 1mg/1ml la cual es 1:1000, por lo tanto, debe diluirse para obtener 1:10000. La dosis para usar de adrenalina 1:10000 por vía endovenosa o intraósea es 0.1 a 0.3 cc/kg/dosis, pero por vía endotraqueal es 0.5 a 1 cc/kg/dosis. La mejor vía es la endovenosa o intraósea.
La ictericia es un signo clínico de coloración amarilla en la piel y mucosas. La ictericia puede deberse a una elevación de bilirrubinas (Bilirrubina neurotóxica (ENARM 2001) o no conjugada) en sangre (BT>5mg/dl en neonatos), que puede ser a predominio indirecto o directo. La hiperbilirrubinemia se puede definir como la elevación de bilirrubina total por encima del percentil 95 de acuerdo a la edad postnatal. Antes de continuar, es importante recordar los pasos en la formación y metabolismo de las bilirrubinas para poder entenderlo mejor.

La bilirrubina indirecta genera neurotoxicidad manifestandose como encefalopatía aguda o crónica, esta última tiene como secuela más frecuente la coreoatetosis (ENARM 2013-A)
La bilirrubina indirecta al llegar al cerebro se deposita más frecuentemente en los ganglios basales (ENARM 2016-A), a esto se llama kernicterus.
Es causado por cambios neonatales normales en el metabolismo de la bilirrubina resultante en un aumento de la producción de bilirrubina (ya que el RN-AT tiene 2-3veces más producción de bilirrubina que el adulto por: 1)tienen más GR [Hcto 50-60%], 2)tienen una vida ½ más corta [aprox. 85 días]), disminución del aclaramiento de bilirrubina (debido a la deficiencia
La ictericia fisiológica es la causa más frecuente de ictericia neonatal (ENARM 2010-B)
de UridinedifosfoGlucoronosilTranasferasa [UDPGA- el más importante de ellos es la UGT1A1], su actividad a los 7 días de vida es 1% la del adulto y lo iguala a las 14ss de vida), y el aumento de la circulación enterohepática (por la presencia de la beta-glucoronidasa en el intestino que convierte la B conjugada en No Conjugada, dando más carga de bilirrubina). Tiene como principales características: no aparece en el 1er día de vida (ENARM 2014 II-B), los valores no aumentan > 5mg/día o >0.5mg/dl/h (ENARM 2014 II-B), la BD no es > 2.5mg/dl o 10% de BT, los valores superiores no son mayores de 16mg/dl en RNT alimentados con pecho, de 13mg/dl en RNT alimentados con fórmula, de 12mg/dl en RNPT. Su presentación clínica clásica suele ser de inicio al 2-3 día de vida (ENARM 2013-A) con un pico máximo al 5° día y
que suele desaparecer aproximadamente entre el 7-10° día de vida. La gravedad generalmente es leve sin estar asociado a otra sintomatología (ENARM 2001, ENARM 2009-B, ENARM 2014 II-A, ENARM 2015 II-B, ENARM 2017-B), por tal motivo el manejo de estos suele ser expectante.
Estas pueden ser por causas patológicas per se o por exageración de la fisiológica. Estas se pueden dividir por tres mecanismos: aumento de la producción (hemolisis (ENARM 2014 I-B), policitemia, secuestro de sangre, macrosomía), disminución de la excreción (Sd CriglerNajjar, Sd Gilbert, Diabetes materna, hipotiroidismo congénito, galactosemia), aumento de la circulación enterohepática (por pobre consumo de leche materna, por mucho consumo de leche materna, obstrucción intestinal mecánica o funcional). Un tipo especial de patológico es la ictericia colestásica que esta se define por tener BD>1mg/dl si la BT es <5mg/dl o BD>20%BT si la BT es >5mg/dl (ENARM 2006-A, ENARM 2007-A). Mencionaremos las más importantes: Incompatibilidad de grupo: para que se presente, la madre debe ser grupo O y el RN debe ser grupo A o sino B (son las más frecuentes en ese orden), se presenta desde el primer día de vida (ENARM 2020-A, ENARM 2022-A) y no requiere inmunización previa; la clínica suele ser más leve que la incompatibilidad Rh pero sí más frecuente. Su base fisiopatológica es la hemolisis. Suele requerir fototerapia y/o exanguineotransfusión (ENARM 2011-A, ENARM 2012-B, ENARM 2016-B) (con Grupo O y Rh del RN).
Incompatibilidad Rh (ESSALUD 2018): para que se presente, la madre debe ser Rh negativo y el RN debe ser Rh positivo, también se presenta desde el primer día de vida y si requiere inmunización previa; la clínica suele ser más severa que la incompatibilidad de grupo pero menos frecuente. Su base fisiopatológica es la hemolisis. Suele requerir fototerapia y/o exanguineotransfusión (con Grupo del RN y Rh negativo).
Ictericia por lactancia materna: se debe al pobre consumo de leche materna haciendo que aumente la circulación enterohepática y así aumenta los niveles sanguíneos de bilirrubina, suele asociarse a signos de deshidratación, suele requerir fototerapia y técnicas para mejorar la lactancia.

Ictericia colestásica en menores de 14 días hay que pensar en hepatitis por TORCH (ENARM 2017-A) y en mayores de 14 días hay que pensar en atresia de vías biliares (ENARM 2007-A, ENARM 2011-A, ENARM 2015 I-B, ENARM 2019-A).
Ictericia por leche materna: se debe al exceso de consumo de leche materna haciendo también que aumente la circulación enterohepática y de esa manera que aumente los niveles de bilirrubina en sangre, no se acompaña de otra sintomatológica más que la ictericia (ENARM 2013-B, ENARM 2021-B), su manejo se basa actualmente en una conducta expectante (ENARM 2012-B, ENARM 2019-A) Este también se le conoce con el nombre de Síndrome de Arias.
Colestasis neonatal: utiliza a menudo para referirse a la enfermedad hepática colestásica que está presente al nacer y / o se desarrolla durante los primeros meses de vida, en lugar de referirse estrictamente al período neonatal (los primeros 28 días de vida). Las causas de la colestasis en recién nacidos y lactantes pequeños incluyen varios tipos de obstrucción biliar, infección hepática o sistémica, enfermedades metabólicas y lesiones tóxicas o aloinmunes. La atresia biliar y la hepatitis neonatal explican la mayoría de los casos de colestasis en recién nacidos a término. En los bebés prematuros, la colestasis se debe con mayor frecuencia a la nutrición parenteral total o la sepsis.
Una manera de apreciar clínicamente la ictericia y su compromiso es con la escala de KRAMER que brinda una correlación entre lo que se observa y el nivel de bilirrubina probable que puede llegar a tener. Pero debe solicitarse niveles de bilirrubina total y fraccionadas para poder confirmar elevación de bilirrubina.
Zona 1: 4 a 7 mg/dl
Zona 2: 5 a 8,5 mg/dl
Zona 3: 6 a 11,5 mg/dl

La escala de Kramer solo sirve en la primera evaluación y no para evaluaciones después del tratamiento.
Zona 4: 9 a 17 mg/dl
Zona 5: > a 15 mg/dl (ENARM 2017-B)

Hay gran variabilidad en la apreciación subjetiva de la ictericia.
Adaptado de Kramer: AJDC 1069; 118:454 y Finn: Acta Obstet Gynecol Scand 1975; 54:329
El tratamiento de la ictericia neonatal dependerá del nivel y tipo de bilirrubina elevada, y de la causa desencadenante. Aquí detallaremos el manejo de las ictericias a predominio indirecto en la cual el manejo tiene por objetivo evitar la neurotoxicidad causada por la BI (ENARM 2014 II-A). Se tiene dos armas importantes en dicho manejo: fototerapia y exanguinotransfusión. La fototerapia tiene dos mecanismos la fotooxidación y la fotoisomerización (vía principal). Por otro lado, la exanguineotransfusión se base en un hecho mecánico de retiro de sangre con bilirrubinas y administración de sangre sin bilirrubinas. Para determinar el uso de fototerapia o exanguineotransfusión depende de muchos factores como son la edad gestacional, el nivel de bilirrubina, el tiempo de vida y los factores asociados; por lo que existen tablas para poder determinar si lo requieren o no, como por ejemplo de Bhutani y de las Guías NICE.
Bebes con menor riesgo ($ 38 semanas )
Lactantes con riesgo medio ($ 38 semanas más factores de riesgo o 35 a 37 6/7 semanas y bien)
Lactantes con mayor riesgo (35 a 37 semanas más factores de riesgo)

La complicación más frecuente de fototerapia es eritema, quemadura o erupción (ENARM 2013-A). Otras son: deshidratación (ENARM 2012-A), síndrome de niño bronceado (ENARM 2010-B)
La fototerapia, que debe utilizarse cuando la bilirrubina sérica total exceda la línea indicada para cada categoría de riesgo según la figura 4. Los factores de riesgo incluyen enfermedades hemolíticas isoinmunes, deficiencia de G6PD, asfixia, letargo significativo, inestabilidad de temperatura, sepsis, acidosis, albúmina <3 g / dl (si se mide) o edad gestacional más baja.
Bebes con menor riesgo ($ 38 semanas )
Lactantes con riesgo medio ($ 38 semanas más factores de riesgo o 35 a 37 6/7 semanas y bien)
Lactantes con mayor riesgo (35 a 37 semanas más factores de riesgo)
Indica la incertidumbre debido a una amplia gama de circuntancias clínicas y una gama de respuestas a la fototerapia (consulte la leyenda a continucación para obtener más detalles)
Las líneas discontinuas de la figura. durante las primeras 24 horas indican incertidumbre debido a una amplia gama de circunstancias clínicas y una gama de respuestas a la fototerapia. Se recomienda una exanguinotransfusión inmediata si el lactante muestra signos de encefalopatía aguda por bilirrubina (hipertonía, opistótonos, fiebre, llanto agudo) o si la bilirrubina sérica es ≥ 5 mg / dL (85 micromol / L) por encima de estas líneas de la figura. Los factores de riesgo son los mismos que ya se describieron.
Casi todas las convulsiones neonatales pueden clasificarse como convulsiones "sintomáticas" (agudas y reactivas), que se producen como consecuencia de una etiología identificable específica.
La encefalopatía neonatal que se produce como resultado de hipoxia-isquemia es la causa más común de convulsiones neonatales sintomáticas. Otras causas comunes son accidente cerebrovascular isquémico o hemorrágico, alteraciones metabólicas (Hipoglicemia, hipocalcemia, hipomagnesemia, hipo o hipernatremia) (ENARM 2000) e infección del sistema nervioso central. Los errores innatos del metabolismo, aunque raros, son importantes de identificar, ya que puede estar disponible una terapia modificadora de la enfermedad.
Se conocen bien tres síndromes de epilepsia neonatal raros pero distintos: epilepsia neonatal familiar benigna, encefalopatía mioclónica temprana y encefalopatía epiléptica infantil temprana.
El diagnóstico de convulsiones neonatales se basa en la observación clínica combinada con la monitorización EEG.
Tratamiento
En el recién nacido, las convulsiones constituyen una emergencia médica. Deben impulsar una evaluación inmediata para determinar la causa e instituir una terapia específica de etiología.
El tratamiento de la causa subyacente de las convulsiones neonatales (para trastornos metabólicos, infección sistémica o del sistema nervioso central o encefalopatía isquémica hipóxica) es fundamental, ya que puede prevenir una mayor lesión cerebral. Los factores que deben tenerse en cuenta al decidir el tratamiento anticonvulsivo incluyen la etiología, la duración y la gravedad de las convulsiones.
Cuando se toma la decisión de iniciar la medicación anticonvulsivante, se recomienda un tratamiento de primera línea con fenobarbital en lugar de fenitoína.
Las convulsiones neonatales resistentes al fenobarbital a menudo responden mal a los medicamentos anticonvulsivos de segunda línea. Los fármacos más utilizados en este contexto son la fenitoína, el levetiracetam , la lidocaína y el midazolam. Piridoxina (100 mg por infusión intravenosa) y piridoxal 5'-fosfato (PLP, 60 mg / kg por día por vía oral en tres dosis divididas) deben administrarse secuencialmente a los recién nacidos con convulsiones que no responden a los medicamentos anticonvulsivos convencionales, especialmente si se desconoce la causa de las convulsiones.
Tipo Clínica
Movimientos buco-linguales, succión, deglución, chupeteo
– Motilidad ocular anormal, fijación de la mirada, nistagmo, parpadeo
Las convulsiones neonatales de difícil diagnóstico y que pasan desapercibidas son las sutiles.
Sutil
(ENARM 2011-B)
– Movimientos estereotipados: remo, boxeo, pedaleo
Posturas anómalas
Disfunción autonómica: cianosis, apnea, bradicardia
Sacudidas musculares lentas
Clónicas
Focales, multifocales, migratorias
– Raro: alteraciones autonómicas
– Sacudidas musculares rápidas en flexión

Características
– Las segundas en frecuencia
– Dificultad diagnóstica
– Escasa correlación
EEG
– Las más frecuentes.
– Nivel de vigilia conservado
Infrecuentes
Asociadas a clonias
Mioclónicas
– Repetidas o en salva
Suelen ser unilaterales
Extensión de extremidades
– Mala correlación con EEG
Tónicas
Tabla
Actitudes catatónicas
Más frecuentes generalizadas
– Las focales con alteración en EEG, inexistente en las generalizadas
Los factores predominantes más probables que afectan el resultado a largo plazo son la etiología de las convulsiones y el grado y distribución de la lesión cerebral causada por la alteración subyacente. La electroencefalografía interictal (EEG) también puede ser útil para ayudar a predecir el pronóstico a largo plazo. UNIDAD 01: SEPSIS NEONATAL
Convulsiones clínicas o eléctricas
Fenobarbital 20 mg/kg/ IV en 10 minutos (ENARM 2012-B, ENARM 2014 I-A)
Corrige factores comórbidos
- Hipoglucemia (ENARM 2012-A)
- Hipocalcemia
- Hipomagnesemia
- Hiponatremia
1.a línea de tratamiento
Máxima dosis de cargas de 30 mg/kg
Máxima docisi de carga de 30 mg/kg
2.a línea de tratamiento
Persisten convulsiones
Dosis de carga adicional de Fenobarbital
10 mg/kg IV en 10 minutos
Persisten convulsiones
Levetiracetam 20-40 mg/kg IV
Posibilidad de mantener el tratamiento crónico con ese fár maco y por vía oral
3.a línea de tratamiento
No lidocaina si se utilizó previamente fenitoina
Lidocaina (dilución 1mg/1mL)
2 mg/Kg IV en 10 minutos
Una de estas dos opciones
Atención a la respuesta clínica y a la respuesta en el a EEG o en el EEG
Si no hipoter mia la dosis de carga adicional pueden ser 2 dosis de 10 mg/kg
Fenitoína 150-20 mg/kg IV
Necesidad de monitorizar niveles.
Suspender cuando retirar acceso IV
Persisten convulsiones
(Despues de la dosis de carga de cualquiera de los fár macos de 2.a línea de tratamiento)
Algunas de estas opciones
Diacepam 0,25 - 0,5
Midazolamm 0,15
6 mg/Kg perfusión continua durante 6 h
2 mg/kg/ 12 horas
Si hipoter mia reducir cada dosis un 20 %
Dosis de mantenimiento
*Iniciar a las 24 horas de la dosis de carga. **Perfusión continua. IV = intravenosa, h = hora, d = día

Las etiologías más frecuentes de sepsis neonatal son Streptococcus agalactiae y E. coli.
Se debe tener en cuenta que todo RN tiene probabilidades para desarrollar infecciones importantes incluyendo la sepsis neonatal y la meningitis, debido a que el sistema inmunológico del RN aún es inmaduro para poder batallar contra una infección, por ello es que la atención y cuidados del RN deben ser con total asepsia y antisepsia. Existen términos que podemos utilizar para catalogar el riesgo y la presencia de sepsis, como son: sospecha de sepsis (cuando solo tiene factores de riesgo), sepsis probable (tiene clínica de sepsis o exámenes tributarios de sepsis), sepsis confirmada (cuando tiene hemocultivo positivo). Otra
manera de clasificar a la sepsis neonatal es en Temprana (<72h de vida) (ENARM 2010-A, ENARM 2020-A) y Tardía (>72h de vida) (ENARM 2019-A). Las vías de transmisión por las que puede acceder un microorganismo al RN pueden ser intrauterina, ascendente (la vía principal), o intra/extrahospitalaria. De los microorganismos que se destacan son en primer puesto Streptococcus betahemolítico del Grupo B (también llamada S. agalactiae) (ENARM 2013-B) y en segundo puesto Escherichia coli (ENARM 2018-A). La presentación clínica de la sepsis neonatal es muy variada e inespecífica.
Cuando el RN cursa con ITU la vía de infección más frecuente es hematógena (ENARM 2014 II-A)
* +++: Comúnmente asociado (≥50 por ciento de los casos)
++: frecuentemente asociado (25 a 50 por ciento)
+: ocasionalmente asociado (<25 por ciento)
La prueba gold standard y confirmatoria de sepsis neonatal es el hemocultivo (ENARM 2006-A)
La prueba a solicitar ante clínica de meningitis es punción lumbar (ENARM 2013-A).

Para el diagnóstico de los términos descritos (sospecha, probable o confirmado) es necesario realizar una búsqueda de factores de riesgo, examen físico detallado y exámenes auxiliares. Una sospecha de sepsis se determinará con la presencia de factores de riesgo (RPM prolongada (ENARM 2011-A), parto domiciliario, fiebre materna, ITU materna, ausencia de CPN, etc.), la sepsis probable (ENARM 2014 II-B) se determinará con clínica de sepsis (ENARM 2013-A, ENARM 2015 I-A) o con reactantes de fase aguda alterados (Leucocitos <5,000/mm3 y >25,000/mm3 (ENARM 2014 I-A) luego de 12 horas de vida (esto es variable), relación de inmaduros/totales >0,2, plaquetas <100,000/mm3, granulaciones tóxicas y vacuolizaciones, PCR positivo, procalcitonina positivo, VSG prolongado), la sepsis confirmada será diagnosticada por un hemocultivo positivo, por lo que este último es el Gold estándar.
La antibioticoterapia en MEC neonatal es de 14 días para gram positivos y 21 días para gram negativos (ENARM 2014 I-A)
El manejo dependerá del momento en el que se presente el paciente, esto teniendo en cuenta si se trata de una sospecha, probable o confirmada. Ante una sospecha de sepsis el manejo va dirigido a buscar si se trata de una sepsis probable por lo que se hace un examen físico detallado y solicitud de reactantes de fase aguda, de ser el caso que sea positivo se le cataloga como una sepsis probable y es aquí donde se solicita el hemocultivo para luego iniciar antibioticoterapia empírica (ENARM 2012-A) con ampicilina más gentamicina o ampicilina más amikacina, cuando se tenga el resultado de hemocultivo se deberá redirigir el tratamiento antibiótico según el germen encontrado y su antibiograma, de salir un hemocultivo negativo y el paciente curse asintomático deberá suspenderse los antibióticos.
Terapia empírica
Inicio temprano (<7 días)
Esquema antibiótico
Ampicilina y gentamicina (ENARM 2004, ENARM 2010-B, ENARM 2011-B, ENARM 2013-A, ENARM 2015 I-A, ENARM 2017-B)
Inicio tardío (≥7 días) adquirida de la comunidad Ampicilina y gentamicina
Inicio tardío (≥7 días) Hospitalizado desde el nacimiento Gentamicina y vancomicina
Circunstancias especiales:
Sospecha de meningitis - inicio temprano Ampicilina y gentamicina
Sospecha de meningitis - inicio tardío, adquirida de la comunidad Ampicilina, gentamicina y cefotaxima
Sospecha de meningitis - inicio tardío, Hospitalizado desde el nacimiento Gentamicina, vancomicina y cefotaxima
Sospecha de neumonía
Ampicilina y gentamicina
*Alternativa: Ampicilina y cefotaxima, o
*Alternativa: Vancomicina y cefotaxima, o
*Alternativa: Vancomicina y gentamicina
Sospecha de infección de tejidos blandos, piel, articulaciones o huesos (s. aureus es un patógeno probable) Vancomicina o vancomicina y nafcilin
Sospecha de infección intravascular relacionada a catéter
Sospecha de infección debido a organismos encontrados en el tracto gastrointestinal (p.e. bacterias anaerobias)
Terapia específica
Streptococcus del grupo B
Escherichia coli: Ampicilino-sensible
Escherichia coli: Ampicilino-resistente
Bacilos Gram negativos multidrogorresistentes (incluidos organismos productores de BLEE)
Listeria monocytogenes
S. aureus Meticilino susceptible (MSSA)
S. aureus Meticilino resistente (MRSA)
Staphylococo coagulasa negativo
Vancomicina y gentamicina
Ampicilina, gentamicina y clindamicina
*Alternativa: Ampicilina, gentamicina, y metronidazol, O

*Piperazilina- tazobactam y gentamicina
Penicilina G
Ampicilina
Cefotaxima
*Alternativa: Meropenem
Meropenem
Ampicilina y gentamicina
Nafcilin o cefazolina
Vancomicina
Vancomicina
BLEE: beta-lactamasa de espectro extendido. * Cefotaxima debe agregarse al régimen empírico por sospecha de meningitis de aparición temprana si la tinción de Gram del CSF revela bacilos gramnegativos. Si la cefotaxima no está disponible, los agentes alternativos incluyen ceftazidima, ceftriaxona (no se debe usar en lactantes con hiperbilirrubinemia clínicamente significativa o en aquellos que reciben calcio iv concurrente [incluida la nutrición parenteral]) o meropenem. Se prefiere el meropenem si existe preocupación por la infección debido a un microorganismo gramnegativo resistente a múltiples fármacos.
Se puede hacer profilaxis para sepsis neonatal, pero dicha profilaxis va dirigida para el microorganismo más frecuente, S. agalactiae. Para realizar la profilaxis, primero se debe identificar la presencia del S. agalactiae en la madre, este se busca mediante hisopado rectal y vaginal en la gestante entre las 36 0/7 a 37 6/7 semanas de gestación; si el resultado es negativo no se realiza la profilaxis, pero si el resultado es positivo se debe administrar antibiótico a la gestante:

Antibióticos recomendados: Penicilina G o Ampicilina
Mejor momento de aplicación: intraparto
Mejor vía de aplicación: endovenosa

Este tipo era causado clásicamente por el uso de nitrato de plata en la profilaxis del RN, su presentación es en las primeras 24 horas de vida (ENARM 2007-A), cursando con hiperemia conjuntival leve, lagrimeo constante (epifora), con una autolimitación espontanea en los primeros 2 a 4 días de vida.
Si bien la causa clásica de conjuntivitis química era el nitrato de plata, también puede ser causada por los antibióticos que se utilizan en la profilaxis ocular del recién nacido, solo que la frecuencia es mucho menor, es ese motivo por lo que se dejó de usar nitrato de plata y no porque tenga menor cobertura para gonococo, sino todo lo contrario.
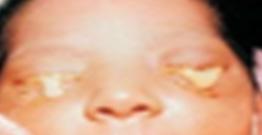
Este tipo es causado por la bacteria gran negativa Neisseria gonorrhoeae (ENARM 2014 II-A), siendo el ojo el lugar de infección más frecuente de este patógeno, presentándose clásicamente dentro de la primera semana de vida ya que tiene un periodo de incubación de 2 a 5 días, su clínica es de mayor gravedad con secreción francamente purulenta (ENARM 2022-A, ENARM 2020-A) y serohemática, edema palpebral importante y quemosis, membranas conjuntivales, pudiendo cursar con queratitis. Así también, puede cursar con complicaciones tipo neumonitis, meningitis y sepsis. Su diagnóstico se basa tinción Gram del exudado con diplococo gramnegativos y cultivo (Thayer-Martin), la coinfección con C. trachomatis es común. El tratamiento debe ser hospitalizado con una sola dosis de ceftriaxona (ENARM 2018-A) (25-50mg/Kg sin exceder 125mg, EV o IM), también se puede dar una dosis de cefotaxima (100mg/kg EV o IM) en especial para RN con hiperbilirrubinemia, otra alternativa es la ceftazidima; además deben irrigarse frecuentemente los ojos con solución salina. Recordar que la profilaxis ocular protege notablemente de esta infección, sin embargo, dicha profilaxis no es efectiva para prevenir conjuntivitis por C. trachomatis.
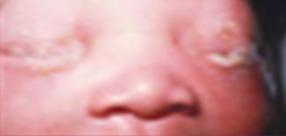

Este tipo es causado por una bacteria especial, la C. trachomatis (ENARM 2000), siendo también la presentación clínica más frecuente de este patógeno. También, se le conoce como conjuntivitis de inclusión en el RN o blenorrea de inclusión. El periodo de incubación es de 5-14 días después del parto, por lo que suele presentarse en la segunda semana de vida. Su presentación va desde un leve edema palpebral con secreción acuosa que se vuelve mucopurulenta hasta marcada hinchazón con quemosis, se puede formar una pseudomembrana a medida que el exudado se adhiere a la conjuntiva, también puede tener secreción sanguinolenta, si no recibe tratamiento en más de 2 semanas puede formar una membrana de tejido de granulación (micropannus).
El periodo de incubación de conjuntivitis por gonococo es de 2 a 5 días y por Chlamydia es de 5 a 14 días.
Para su diagnóstico se debe solicitar pruebas de cultivo (McCoy) de muestra conjuntival. El tratamiento debe ser basado en una prueba diagnóstica positiva, se puede utilizar eritromicina (50mg/kg/día VO por 14 días), también puede utilizarse azitromicina (20mg/kg/día VO por 3 días).
El término TORCH (ENARM 2009-A) es un acrónimo de los microorganismos más importantes que se puede transmitir de manera vertical (de la madre al hijo) como son Toxoplasma gondii (ENARM 2007-A), Otros (como Treponema pallidum, Listeria monocytogenes, Trypanosoma cruzi, Parvovirus B19, VIH, Mycobacterium tuberculosis, virus de la varicela zoster, enterovirus, virus de la hepatitis B), virus de la Rubéola, citomegalovirus y virus herpes simple. La mayoría de estas infecciones tienen su principal transmisión por vía transplacentaria, con algunas excepciones como el virus herpes simple que su principal transmisión es durante el parto.

Es causada por Toxoplasma gondii, quien es un protozoario intracelular del tipo Esporozoo (antiguamente llamados Apicomplexa), la infección en el feto ocurre a través de la transmisión de taquizoitos que atraviesan la placenta después de una infección materna primaria durante el embarazo, si la infección materna primaria ocurre a mayor edad gestacional mayor es el riesgo de infección (ENARM 2010-A), sin tratamiento la mayoría de infectados al principio del embarazo mueren intraútero o en el periodo neonatal o desarrollan severas secuelas neurológicas y oftalmológicas. La presentación clásica de la infección es la tétrada de Sabin, también llamada como las 4C (ENARM 2011-A, ENARM 2013-B) (calcificaciones intracraneales, hidrocefalia, corioretinitis y convulsiones), pero la gran mayoría cursa asintomática.
La sospecha diagnóstica se puede hacer en RN de madre que tuvo infección primaria en la gestación, RN de mujeres que están inmunosuprimidas y tienen evidencia serológica, RN con hallazgos compatibles, RN con pruebas de detección positiva para IgM de toxoplasma (en lugares donde se realiza). El diagnóstico se basa en la evaluación clínica, imágenes y pruebas de laboratorio. La confirmación se basa en la presencia de IgM o IgA especifica de toxoplasma o la detección molecular de ADN de T. gondii en LCR. Para el tratamiento se recomienda antiparasitarios en el siguiente régimen: pirimetamina 2mg/Kg (max 50mg/dosis) c/24h por 2 días, luego 1mg/Kg (max 25mg/dosis) c/24h por 6 meses, luego 1mg/Kg (max 25mg/dosis) 3 veces/ semana hasta el año; más sulfadiacina 100mg/Kg/día c/12h por 1 año; más ácido folínico 10mg 3 veces/semana durante y hasta 1 semana después de la terapia con pirimetamina; se podría asociar corticoide tipo prednisona 0.5mg c/12h si la proteínas en LCR es >1g/dl o cuando hay corioretinitis activa que amenaza la visión; para alergia a sulfadiacina puede ser sustituida por Clindamicina 20-30mg/Kg/día c/6h.
Es causada por la bacteria espiroqueta Treponema pallidum. La infección ocurre por la transmisión transplacentaria u ocasionalmente a través del contacto directo con una lesión infecciosa durante el nacimiento, la transmisión lo pueden hacer tanto las gestantes que tienen infección primaria o secundaria, así como las que están en fase latente, pero más riesgoso son las primeras; no se transmite por leche materna. Cuando el Treponema pallidum ingresa a la sangre del feto se disemina a casi todos los órganos dando clínica como resultado de la respuesta inflamatoria, los más afectados son hueso, hígado, páncreas, intestino, riñón y bazo. La presentación de estos pacientes puede ser como sífilis congénita temprana y tardía. La temprana se define por manifestaciones antes de los 2 años, aunque la mayoría son asintomáticos, si es que hace clínica resaltan la hepatomegalia, ictericia, secreción nasal (“resopla”), erupción maculopapular o vesicular (“pénfigo sifilítico”), linfadenopatía generalizada y anormalidades esqueléticas (periostitis (ENARM 2000), signo de Wegner [metáfisis en dientes de sierra], signo de Wimberger [destrucción ósea de la parte superior de la tibia]). La tardía se define por manifestaciones que inician después de los 2 años, entre ellos los rasgos faciales (protuberancia frontal, nariz en silla de montar, maxilar corto, mandíbula protuberante), oftalmológicas (queratitis, corioretinitis, glaucoma secundario, atrofia óptica), hipoacusia neurosensorial, orofaríngea (dientes de Hutchinson, molares de mora, paladar duro perforado), cutáneas (rhagades, gomas), del SNC (discapacidad intelectual, hidrocefalia, parálisis de pares craneales), esqueléticas (espinillas en sable, signo de Higoumnakis, articulaciones de Clutton).



El fármaco usado en sífilis congénita es penicilina G, siendo la dosis la misma en todas, es decir 50 000 U/Kg/dosis

RPR/VDRL reactivo materno

Test de treponema mater no no reactivo mater no
Falso positivo: no necesita mayor evaluación
Tratamiento mater no
- Ninguno
- No documentados
- 4 semanas o menos antes del parto
- Fár maco no penicilina
- Evidencia mater na de reinfección / recaída (aumenta de cuatro veces o más en títulos mater nos)
Evaluar
Examen físico del lactante nor mal, evaluación nor mal.
RPR/VDRL infantil igual o menos de cuatro veces el título de RPR/VDRL mater no
Examen físico del lactante anor mal, evaluación anor mal, incompleta RPR/VDRL al menos cuatro veces mayor que el título mater no de PR/VDRL.
Test de treponema mater no reactivo mater no
Tratamiento mater no con penicilina durante el embarazo y más de 4 semanas antes del parto, y sin evidencia de reinfección / recaída mater na
RPR/VDRL infantil al menos cuatro veces que el título materno de RPR/VDRL

RPR/VDRL infantil igual o menos de cuatro veces el título de RPR/VDRL mater no
Examen físico del lactante anor mal
Evaluación tratamiento (opción 2)
Tratamiento mater no adecuado antes del embarazo con títulos bajos estables (serofast) y examen del lactante nor mal, si el examen del infante es anor mal, proceder con la evaluación.
No evaluación No tratamiento
Examen físico del lactante nor mal
No evaluación tratamiento (opción 2)
Tratamiento
Tratamiento (Opcion 2)
OPCIONES DE TRATAMIENTO:
– Penicilina G cristalina, 50.000 U/kg (ENARM 2005), por vía intravenosa, cada 12 horas (1 semana de vida o menor) o cada 8 horas (más de 1 semana); O penicilina G procaínica, 50.000 U/kg, por vía intramuscular, como dosis única diaria durante 10 días Si se omiten 24 horas o más de tratamiento, se debe reiniciar todo el ciclo
Penicilina G benzatínica, 50.000 U/kg (ENARM 2014 II-B), por vía intramuscular, dosis única
Aquí revisaremos el síndrome de rubéola congénita, causada por la infección del virus de la rubeola, el cual es un virus ARN de la familia Togaviridae y del género Rubivirus. Su transmisión ocurre por el pasaje hematógeno de la mamá al feto, que generalmente ocurre de 5 a 7 días después de la inoculación materna, el virus en el feto genera defectos congénitos resultado del daño citopático a los vasos sanguíneos y la isquemia en los órganos afectados. El riesgo de transmisión es mayor en las primeras 10 semanas (primer trimestre) y al final del embarazo; por otro lado, el riesgo de defectos congénitos es poco probable si la infección materna ocurre después de las 18 a 20 semanas de gestación y más probable si la infección al recién nacido es más temprana. Las manifestaciones que puede dar la infección es muerte fetal, parto prematuro o defectos congénitos; por ser una enfermedad crónica tiene un amplio espectro de manifestaciones clínicas que puede manifestarse a lo largo de la vida; la mayoría son asintomáticos al nacer, pero desarrollan clínica a lo largo del tiempo; clásicamente existe la tétrada de Gregg (ENARM 2015 II-A, ENARM 2001, ENARM 2012-B, ENARM 2018-B, ENARM 2020-A, ENARM 2020-B, ENARM 2003) (microcefalia, sordera, catarata y defecto cardiaco [PCA]); los neonatos pueden presentar además RCIU, MEC, hipoacusia, catarata, retinopatía, neumonía intersticial, defectos cardiacos, hepatoesplenomegalia, ictericia, hepatitis, diarrea, petequias, purpura, adenopatías, anemia hemolítica, trombocitopenia.


El síndrome de rubéola congénita no tiene tratamiento etiológico específico


El diagnóstico se basa en la clínica del paciente descritos arriba y/o presencia de criterios laboratoriales (aislamiento del virus, IgM específica para rubéola, IgG para rubéola que no disminuye, PCR para el virus de la rubéola); en base a estos se plantea que es confirmado el diagnóstico de SRC cuando tiene clínica y laboratorio compatibles. El SRC no tiene tratamiento específico, su manejo se basa en la clínica que presente, así como cualquier otro paciente que no tenga SRC.

CMV es la infección viral congénita más frecuente.
Esta infección es causada por el virus citomegalovirus, el cual es un virus ADN de la familia de los virus herpes del tipo betaherpesvirus, también llamado VHH-5. Esta infección es la causa principal de pérdida auditiva neurosensorial no hereditaria, a la vez que también es la infección viral congénita más común. Generalmente la infección materna suele ser asintomática (ENARM 2012-A) y se da por contacto con niños pequeños, la transmisión al feto es más probable cuando la infección materna se da durante la gestación, la tasa de transmisión al
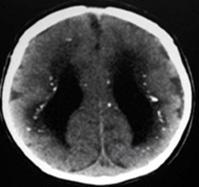
feto aumenta con el avance de la gestación y las secuelas suelen ser más graves cuando la infección se adquiere más temprano en el embrazo. La mayoría son asintomáticos al nacer, ya que aproximadamente 10% de los RN con infección congénita son sintomáticos; su clínica es similar a otras infecciones congénitas (petequias, ictericia, hepatoesplenomegalia, PEG, microcefalia, hipoacusia neurosensorial, letargo/hipotonía, corioretinitis, convulsiones, anemia hemolítica, neumonía, calcificaciones periventriculares (ENARM 2011-B, ENARM 2009-B).
El diagnóstico se logra mediante el aislamiento o la detección molecular de CMV a partir de muestras de orina o saliva recolectadas en las primeras 3 semanas con cultivo y PCR. Para el tratamiento se puede usar ganciclovir EV y su profármaco el valganciclovir VO, que son los fármacos de primera elección y han demostrado ser beneficiosos cuando se inicia dentro del primer mes de vida; por otro lado, foscarnet y cidofovir están reservados para casos de enfermedad refractaria, resistencia a ganciclovir, toxicidad por ganciclovir y coinfección con adenovirus.

El momento de transmisión para herpes neonatal es durante el parto
Esta infección está dada por los virus herpes simples que son virus ADN de la familia de los virus herpes del subtipo alfavirus herpes. La infección de estos virus (VHS-1 y -2, [la -2 se asocia a peor resultado]) en el nuevo ser se puede dar por vía perinatal (85%), postnatal (10%) o intrauterino (rara). La infección perinatal se logra por la transmisión durante el nacimiento a través de un tracto genital materno infectado, el riesgo de transmisión es mayor cuando es por primoinfección materna que por reactivación. La infección neonatal puede presentarse en 3 patrones: enfermedad piel-ojos-boca (SEM) [45% de casos], enfermedad del SNC [30% de casos] o enfermedad diseminada [25% de casos].
Se debe sospechar en RN y lactantes hasta las 6 semanas de edad con vesículas mucocutáneas, enfermedad similar a sepsis, pleocitosis en LCR, convulsiones, signos neurológicos focales, neuroimagen anormal, dificultad respiratoria, apnea o neumonitis progresiva, trombocitopenia, hepatitis, conjuntivitis, lagrimeo excesivo o síntomas dolorosos en ojo. Para el diagnostico se puede utilizar aislamiento del virus en cultivos, PCR-DNA o inmunofluorescencia directa. La terapia de elección en las 3 presentaciones descritas es el Aciclovir en un régimen primario de 60mg/Kg/día EV c/8h por 14 días para la enfermedad SEM y 21 días para la forma diseminada y del SNC; luego el régimen será como terapia de supresión a 300mg/m2/dosis


Causada por el Mycobacterium tuberculosis, el cual es una bacteria BAAR positivo. La importancia de este tema radica en la búsqueda de la infección en el recién nacido, así como la profilaxis y tratamiento oportuno si es que lo requiere.
Los exámenes que se puede solicitar en el recién nacido con sospecha de tuberculosis congénita son: radiografía de tórax y toma de muestras para baciloscopía y cultivo (aspirado gástrico, aspirado endotraqueal, LCR, sangre, secreciones, otros según corresponda). Si la madre presenta tuberculosis resistente a isoniacida, el recién nacido no debe recibir terapia preventiva con isoniazida (TPI), se le debe vacunar con BCG y ser evaluado periódicamente por el pediatra o médico consultor. Todo hijo de madre con tuberculosis debe ser evaluado cada 3 meses hasta los 2 años para detección precoz de tuberculosis.
Hijo de madre con tuberculosis sensible
Evaluación clínica para detectar signos de infección perinatal y remitir la placenta para estudio histopatológico y cultivo. Si hay sospecha debe colicitarse exámenes al recien nacido
Tratamiento antituberculosis con el mismo esquema de mamá
TPI por 3 meses Isoniacida 10mg/kg/día + Vit B6 5-10 mg/día (ENARM 2013-A, ENARM 2014 II-B, ENARM 2016-B)
con BCG
TPI por 3 meses más y luego vacunar con BCG
En este tipo de pacientes se debe tener en cuenta el riesgo que tienen por presentar mayor frecuencia y severidad de complicaciones neonatales, por lo que la atención de ellos va dirigida a prevenirlos.

≥42 semanas Postérmino (ENARM 2001)
37-41 6/7 semanas A. Termino
34-36 6/7 semanas P. Tardío (ENARM 2000)
32-34 semanas P. Moderado
<32 semanas Muy prematuro
<28 semanas Ext-prematuro
Control de funciones vitales: medir cada 4 horas; peso diario; peso/talla/perímetro cefálico cada semana (curva de Fenton); prevención de hipoglicemia (HGT a la 1°h-3°h, luego c/4h); la alimentación con calostro y darlo directo cuando llegue a las 34ss EGC; control de Hb y Hcto al 1°-2°-6°-12°-24° meses; dar hierro si está en anemia según edad postnatal. Hay que recordar que todo prematuro <2000g debe hospitalizarse, así tenga o no complicaciones.
Una medida importante que se realiza en el prematuro es la técnica mamá canguro, dicha técnica brinda muchos beneficios, entre ellos:
Menor tiempo de hospitalización

Menor morbimortalidad
Mejora del patrón ventilatorio y cardiaco
Mejor regulación de la temperatura
Mejor ganancia de peso
Mayor producción de leche materna
Termorregulación: hipotermia.
Metabólicos: hipoglucemia, hipocalcemia, acidosis metabólica e hiperglicemia.
Respiratorios: enfermedad de membrana hialina, apnea recurrente, taquipnea transitoria, asfixia perinatal, broncoaspiración.
Los recién nacidos tienen poca vitalidad para soportar el proceso del parto y por ende mayor mortalidad (ENARM 2015 II-B)
Infecciosos: sepsis, meningitis.

Neurológicos: hemorragia intracraneana (ENARM 2020-B), encefalopatía hipóxica isquémica, leucomalacia periventricular.
Cardiovasculares: hipotensión e hipovolemia, persistencia de ductus arterioso (PDA) persistencia de la circulación fetal (PCF).
Hematológicos: anemia y hemorragias.
Renales: hiponatremia, incapacidad para manejar exceso de líquidos.
Nutricionales: inmadurez enzimática del tracto intestinal. Gastrointestinales: enterocolitis necrotizante (NEC).
Ictericia: hiperbilirrubinemia. Malformaciones congénitas. Trauma al nacer.
Las apneas son el cese de la respiración más de 20 segundos. Requieren estimulación (ENARM 2016-B) y tratamiento con cafeína que también reduce la tasa de displasia broncopulmonar (ENARM 2020-A)
Disfunción del sistema nervioso central (motora, visual, auditiva y parálisis cerebral).
Displasia broncopulmonar (ENARM 2020-A, ENARM 2015 II-B)
Patrones de crecimiento alterado.
Retinopatía del prematuro. Enfermedad metabólica ósea: osteopenia. Anemia.
Lesión del nervio auditivo.
El desarrollo vascular del ojo durante el periodo fetal empieza desde la parte más posterior del ojo y avanza periféricamente hacia delante terminando aproximadamente a las 36 y 40 semanas. Es importante reconocer ese desarrollo ya que, si un bebé nace prematuro, dicho avance se detendrá. En el desarrollo del ROP se identifica dos fases fisiopatológicas:
Fase 1 (vaso obliterante o hiperóxica), la cual cursa con una disminución de los factores de crecimiento (IGF-1, VEGF) por lo que permanece en estancamiento el crecimiento de los vasos.
Fase 2 (vaso proliferativa o de hipoxia), la cual cursa con aumento de los factores de crecimiento y conlleva a una neovascularización anormal.
Los factores de riesgo para ROP:
Recién nacido prematuro de igual o menos de 37 semanas de EG y/o con menos de 2000 gramos de peso.
Prematuro que requiere suplemento de oxígeno (ENARM 2010-A)
Los recién nacidos prematuros con peso superior a 2000 gramos que precisen tratamiento con oxigenoterapia.
Factores de riesgo asociado:
Hipoxia crónica en útero – RCIU
Preclampsia
Hemorragia del tercer trimestre
Diabetes materna
Madre gran fumadora
Corioamnionitis
ETT o ETP y anemia
Hipercapnea, hipocapnia, acidosis o alcalosis metabólica.
Enfermedad pulmonar crónica, distrés respiratorio del recién nacido, ventilación mecánica, episodios de apnea, anestesia general.
PCA
Enterocolitis necrotizante
Hemorragia periventricular
Septicemia
Lactancia artificial
La primera evaluación oftalmológica se debe realizar por un oftalmólogo pediatra especializado en ROP mediante oftalmoscopía indirecta. El momento de la primera evaluación dependerá de la edad gestacional:
La oftalmoscopia usada para descarte de ROP es la indirecta.
Edad gestacional al nacer
*SEGC: Semana de edad gestacional corregida Tabla 10. Edad gestacional al nacer y primera evaluación de fondo de ojo
Los grados de ROP son:
Grado 1: línea de demarcación
Grado 2: cresta de demarcación
Grado 3: Presencia de tejido fibrovascular
El mejor tratamiento para ROP es laserterapia.

Grado 4: Desprendimiento parcial de retina
Grado 5: Desprendimiento total de retina
El mejor tratamiento de ROP es la laserterapia y en segunda línea la crioterapia, las cuales deben ser realizadas idealmente dentro de las 48 horas.
La dificultad respiratoria en el recién nacido comprende a un amplio grupo de patologías que pueden expresarse de esa manera, sin embargo, las más frecuentes son la Enfermedad de Membrana Hialina (EMH), Taquipnea Transitoria del RN (TTRN) y el Síndrome de Aspiración de Líquido Amniótico Meconial (SALAM). Antes de explicar cada una de ellas, primero debemos aprender a determinar el grado de dificultad respiratoria con el Score de Silverman-Anderson (ENARM 2001, ENARM 2010-B, ENARM 2011-B), con el puntaje de este score se determina si la dificultad es leve (1-3 puntos), moderado (4-6 puntos) o severo (7-10 puntos).
Causas de dificultad respiratoria:

Causas del parénquima pulmonar: Taquipnea transitoria, Aspiración meconial, Neumonía perinatal, Membrana Hialina, Hipertensión pulmonar persistente, Hemorragia pulmonar.
Malformaciones: Hernia diafragmática, Atresia de esófago, Secuestro pulmonar, fistula traqueo esofágico.
Anomalías de la vía aérea superior: Atresia de coanas, S. de Pierre-Robin (micrognatia, glosoptosis y alteración de la vía aérea con o sin paladar hendido), laringotraqueomalacia.
Anomalías mecánicas: Derrame pleural (hidrops), quilotórax
Causas cardiovasculares: Cardiopatías congénita, Arritmia cardiaca, Miocardiopatía
Causas infecciosas: Sepsis/meningitis neonatal
Causas metabólicas: Acidosis metabólica, Hipoglicemia, Hipotermia/hipertermia
Causas hematológicas: Anemia, Hiperviscosidad
Causas neurológicas: Asfixia, Lesión difusa del SNC, Síndrome de abstinencia a drogas
ASPECTOS GENERALES
El factor de riesgo más importante para EMH es la prematuridad
La EMH cursa con dificultad respiratoria grave, cursa con acidosis, hipercapnea e hipoxia, y no responden a la simple administración de oxígeno

Es conocido también como Síndrome de distrés Respiratorio tipo 1 o Idiopático, o simplemente Síndrome de Distress Respiratoria del RN; se trata de una atelectasia pulmonar progresiva por déficit del surfactante (ENARM 2013-B, ENARM 2016-A, ENARM 2017-A) en un pulmón inmaduro, por lo que es propia del prematuro. Es la segunda causa más frecuente de dificultad respiratoria después de la TTRN. La incidencia de EMH aumenta a menor EG. Aunque es menos probable también se puede presentar en prematuros tardíos y a términos. Los factores de riesgo de EMH son sexo masculino, hermano previo con EMH, prematuridad, situaciones de shock (asfixia perinatal, sepsis), hidrops fetal, metrorragia en el tercer trimestre, cesárea sin trabajo de parto, RN hijo de madre diabética, segundo gemelar. La falta de surfactante en un pulmón inmaduro condiciona a aumento de la tensión superficial que conlleva a una inestabilidad pulmonar al final de la espiración, bajo volumen pulmonar y disminución de su compliance, de esta manera condiciona al colapso pulmonar llevando a hipoxemia; pero la falta de surfactante también genera una inflamación pulmonar y lesión del epitelio respiratorio, de esta manera condiciona a un edema pulmonar (también por la ineficaz limpieza pulmonar) y aumento de la resistencia de las vías respiratorias; también cursa con inactivación del surfactante por el meconio, la sangre, el edema proteináceo y productos inflamatorios. Bioquímicamente el paciente cursa con hipoxemia y acidosis respiratoria/metabólica. La clínica se presenta en los primeros minutos u horas después de nacer y se basa en aspecto de prematuro, taquipnea, aleteo nasal, quejido espiratorio, tirajes, cianosis, MV disminuido, palidez, pulsos periféricos disminuidos, flujo urinario bajo y edema periférico; la evolución natural de la EMH es progresar hasta las 48-72h y resolverse en una semana, con el uso de surfactante exógeno este curso se acorta.
Las muertes sobrevienen entre el segundo y séptimo día, y se asocia a pérdidas de aire alveolar (enfisema intersticial, neumotórax) y con hemorragia pulmonar o intraventricular.
El diagnóstico se basa en la presencia de dificultad respiratoria poco después del nacimiento en un prematuro (ENARM 2011-B, ENARM 2013-B, ENARM 2014 I-A, ENARM 2014 II-A, ENARM 2015 I-B, ENARM 2019-B) más una radiología sugestiva de EMH (patrón de bajo volumen pulmonar y el aspecto vidrio esmerilado reticulogranular con broncograma aéreo (ENARM 2016-B). Otros hallazgos laboratoriales son la hipoxemia, hipercapnia, acidosis, hiponatremia.
TRATAMIENTO
Administración de corticoides prenatales: dexametasona o betametasona.
Presión positiva de la vía aérea para prevenir atelectasia: nCPAP, NIPPV, HFNC, intubación para VM o CPAP. Sat O2 objetivo 89-95% (ENARM 2022-B) y de PaCO2 objetivo 45-60mmHg.

Terapia con surfactante exógeno (ENARM 2018-A): existen de tipo sintético y naturales. Uno conocido es el Survanta, que es de bovino, tiene 25mg fosfolípidos/ml, dosis de 4ml/Kg, se puede repetir c/6h con un total de 4 dosis según sea necesario.
Sindrome de Distrés Respiratorio Agudo (SDRA)

CPAP
Esfuerzo respiratorio sostenido y FiO2 < 0.4
CPAP
Obtener AGA
FiO2 < 0.4
Ph 7.2
FiO2 >0.4 Ph 7.2
Continuar CPAP Intubar y administrar terapia con surfactante
Obtener AGA
Algoritmo1. Manejo de EMH
Apnea o FiO2 0.4
FiO2 0.3
Terapia adicional con surfactante si el bebé sigue intubado
FiO2 < 0.3
Ph 7.25
Rápida extubación a CPAP o IPPV nasal
Conocido como SDR tipo II o Síndrome de Pulmón Húmedo, se trata de un retraso en la reabsorción del líquido pulmonar contenido en este, teniendo al final un edema pulmonar. Es la causa más frecuente de dificultad respiratoria en recién nacidos. Sus factores de riesgo son producto de cesárea (ENARM 2014 I-B) sin trabajo de parto, parto precipitado, pretermino tardío y a término, mamá con diabetes, mamá con asma bronquial. La eliminación de líquido alveolar inicia incluso antes del nacimiento continuando durante y después del parto; el aumento de la PaO2 en el RN mejora la capacidad del epitelio de transportar sodio y agua; se cree que la mayor parte del agua que pasa a través de la membrana apical se debe a canales de aquaporin-5; después del nacimiento también se piensa que sigue la absorción pasiva de líquido desde los espacios aéreos, el intersticio y los vasos sanguíneos. Se piensa que la TTRN se debe a una reabsorción retardada de líquido pulmonar, este pasará del espacio de aire hacia el intersticio, donde se acumula en los tejidos perivasculares y las fisuras interlobulillares hasta que finalmente pase a los linfáticos y pequeños vasos; el exceso de líquido lleva a disminución de la distensibilidad pulmonar y en respuesta se desarrollará taquipnea; además como se acumula líquido en el linfático peribronquial e intersticio promoverá a un colapso parcial de los bronquiolos con el consiguiente atrapamiento de aire; dará hipoxemia por perfusión de alveolos mal ventilados e hipercapnia debido a la inadecuada ventilación por el edema pulmonar. La clínica cardinal de la TTRN es la taquipnea desde el nacimiento (ENARM 2015 I-B, ENARM 2015 II-B) y dentro de las dos horas posteriores al parto, así como cianosis, tirajes, aleteo nasal y quejido, el diámetro anteroposterior puede aumentar, MV generalmente pasa bien, suelen ser leves a moderado y resolverse en las primeras 12 a 24h (ENARM 2013-B), y en casos graves hasta 72 horas, no suelen requerir FiO2 >40%.

La TTRN cursa con dificultad respiratoria leve, cursa sin acidosis, hipercapnea e hipoxia, y sí responden a la simple administración de oxígeno.

El diagnóstico es clínico, pero podría respaldarse con una radiografía de tórax compatible; volumen pulmonar aumentado con diafragmas planos (ENARM 2018-A, ENARM 2019-A), cardiomegalia leve y marcas vasculares prominentes en “rayos solares”, cisuritis, puede haber derrame pleural, el edema puede aparecer como densidades esponjosas. Otros hallazgos probable son hipoxemia leve a moderada, hipercapnia leve, acidosis respiratoria.


Su manejo es de apoyo, ya que es un proceso benigno y autolimitado. De administrarse oxígeno (ENARM 2019-A) se hará con campana o cánula binasal para mantener SatO2 por encima de 90%. Puede haber casos que requiera mayor O2 o que aumente el trabajo respiratorio, ahí podría utilizarse nCPAP. La restricción de líquido puede ser beneficiosa (se necesitan más estudios). La terapia diurética no es beneficiosa.
El factor de riesgo más importante para SALAM es la postmadurez (ENARM 2002)
Es una dificultad respiratoria en un RN teñido de meconio por la aspiración de este a la vía aérea terminal, sin otra causa que lo justifique. El SALAM se suele presentar en 2-10% de los RN con LAM. Tanto el RN con LAM y SALAM es más frecuente en postmaduros y PEG, la asfixia intraparto aumenta el riesgo (ENARM 2015-B), así como la preclampsia. La fisiopatología del SALAM se basa en tres pilares: la obstrucción, la inflamación química y la inactivación del surfactante; además un evento que ocurre en el SALAM grave es la HPPRN (Hipertensión pulmonar persistente del recién nacido).
Meconio en el arbol traqueobronquial
Obstrucción de la vía aérea Inflamación
Inactivación del surfactante
Inflamación
Desajuste ventilación/perfusión Bloqueo de aire

Hipoxemia/acidosis
Hipertensión pulmonar

La complicación más grave del SALAM es el síndrome de hipertensión pulmonar persistente (ENARM 2010-A, ENARM 2014 II-A)
La presentación clínica del paciente será: tinción de meconio (uñas manchadas significa que estuvo expuesto al meconio hace 6 horas y el vérnix manchado implica que estuvo expuesto hace 12-14 horas), signos de postmadurez y PEG, los RN con SALAM nacen deprimidos, dificultad respiratoria inmediata (ENARM 2012-A, ENARM 2013-B, ENARM 2016-A, ENARM 2019-B) al nacimiento con marcada taquipnea, cianosis, tirajes, respiración paradójica (abdominal), quejidos y aleteo nasal, tórax en tonel por diámetro anteroposterior aumentado por la hiperinflación, al auscultar se ausculta estertores y roncus, en un SALAM grave el neumotórax y el neumomediastino son hallazgos comunes, también corren el riesgo de desarrollar HPPRN.
El diagnóstico se realiza mediante la evidencia de LAM, dificultad respiratoria al nacer o poco después del nacimiento, características radiológicas compatibles (pulmón hiperinsuflado con aplanamiento de diafragma, densidades en parches difusos alternadas con aéreas de expansión, fuga de aire [en 10-30%]), evidencia de meconio en la tráquea al realizar una intubación, cuando lo requería. Otros hallazgos son la hipoxemia, hipercapnia y acidosis.
El SALAM cursa con dificultad respiratoria grave, cursa con acidosis, hipercapnea e hipoxia, y no responden a la simple administración de oxígeno.
El manejo de los pacientes con SALAM es un manejo también de soporte máximo, dentro de ello se debe realizar: Aspiración: Lo primero es brindar aspiración (ENARM 2022-A) para evitar que siga entrando el meconio, la aspiración puede ser con o sin intubación.
Gestión oxigenatoria y ventilatoria: debe evitarse la hipoxemia porque contribuye a la vasoconstricción pulmonar y posiblemente a la HPPRN, por lo que se debe mantener una PaO2 objetivo entre 55-90mmHg y PaCO2 objetivo entre 50-55mmHg; la ventilación asistida se inicia cuando no logra esto con respiración espontanea, se indica CPAP cuando la FiO2 excede 0.4-0.5, pero se debe tener cuidado ya que puede aumentar la captura de aire, otro método es la Ventilación Mecánica (VM), si no responden a VM convencional podría considerarse el uso de Ventilación Oscilatoria de Alta Frecuencia, y si la VM más la terapia con fármacos (ONi y surfactante) falla se pensaría en Terapia de Oxigenación con Membrana Extracorpórea (ECMO); el surfactante pulmonar también reduce la gravedad de la enfermedad respiratoria; óxido nítrico inhalatorio (ONi) es un vasodilatador pulmonar selectivo que puede mejorar la oxigenación en pacientes con HPPRN asociada, así como también el sildenafilo.
Soporte circulatorio: mantener suficiente volumen intravascular, optimizar el volumen de glóbulos rojos con transfusiones, soporte vasopresor.
Antibióticos: El uso de antibióticos no es por la enfermedad per se sino por el riesgo de infección y la dificultad de distinguir entre SALAM y neumonía bacteriana.
Otra causa de dificultad respiratoria son los síndrome de fuga de aire como neumotórax (ENARM 2017-B), y lo sospecharas en antecedente de RCP.

La neumonía causa importante de morbimortalidad neonatal, tanto en el RN a término como en el pretérmino. Las neumonías perinatales pueden ser de tres tipos, que tienen una etiología y un mecanismo de transmisión diferentes: La neumonía puede ser adquirido en el útero, durante el parto (perinatal), o postparto.
Neumonías de transmisión vertical: Adquirida por vía transplacentaria por virus (rubéola, citomegalovirus, varicela-zoster, herpes simple, VIH, adenovirus, enterovirus, etc.) y por algunas bacterias (L. monocytogenes, M. tuberculosis, T. Pallidum)
Neumonías por vía ascendente o durante el parto: como ocurre con el estreptococo b-hemolítico del grupo B (EGB) (ENARM 2016-A)(ESSALUD 2018), enterobacterias gramnegativas (E. coli, Klebsiella,) y algunas bacterias atípicas (C. trachomatis, U. urealiticum), aunque estas últimas pueden ser más tardías.
Neumonías de transmisión horizontal/ nosocomial: algunas adquiridas en el hogar de etiología viral (virus sincicial respiratorio, influenza, parainfluenza) o intrahospitalarias (IAAS) bacteriana (Klebsiella, serratia, Pseudomonas, Proteus, S. aureus (ENARM 2015 I-B), S. epidermidis) y con frecuencia creciente fúngica (C. albicans, parapsilosis, C. tropicalis,).
El neonato esta más susceptible a la neumonía por la inmadurez del sistema mucociliar y la disminución de las defensas del huésped, los procedimientos invasivos como la intubación traqueal y la ventilación mecánica.
Las neumonías bacterianas ascendentes o adquiridas durante el parto suelen presentar clínica precoz, en forma de sepsis inespecífica con dificultad respiratoria. El agente etiológico más frecuente es el EGB. Antecedentes de corioamnionitis, RPM > 18 horas, fiebre materna y/o colonización de EGB.
Radiografía: Pueden ser indistinguibles de los que se observan en la EMH, la TT o el SAM. La presencia de condensaciones alveolares orienta la etiología bacteriana. Las neumonías por C. Trachomatis se manifiestan a las 2-8 semanas de vida con clínica respiratoria y antecedente de infección conjuntival, suele observarse infiltrado intersticial e hiperinsuflación. El U. Urealyticum causa rara de neumonía neonatal aguda se asocia con enfermedad pulmonar crónica. Las neumonías nosocomiales se observan en neonatos en ventilación mecánica, manifestándose con clínica de sepsis y aumento del compromiso respiratorio, con radiografía de nuevas imágenes pulmonares, se confirma con el cultivo cuantitativo de secreción bronquial, hemograma y PCR en sangre La radiología es inespecífica. La neumonía causada por Cándida se presenta en un prematuro grave, con compromiso sistémico.




TRATAMIENTO
La terapia de oxígeno, apoyo ventilatorio, drogas vasoactivas como la dopamina y dobutamina acompañan a los antibióticos que serán ampicilina y gentamicina en las neumonías con natales y en las nosocomiales según gérmenes prevalentes, evitando usar cefalosporinas o vancomicina de rutina, la
10 días.

La hipoglicemia neonatal se define como la disminución del nivel de glicemia por debajo de lo normal. Según la guía de práctica clínica del INSN-MINSA Perú, la definición de hipoglicemia sería una glicemia menor de 47 mg/dl como definición conceptual y menos de 45 mg/dl (ENARM 2013-A) como definición operativa.
Otras definiciones internacionales descritas por el informe clínico de la Academia Estadounidense de Pediatría (AAP) de 2011 y las pautas de la Sociedad Endocrina Pediátrica para realizar el diagnóstico de hipoglicemia neonatal que requiere intervención médica son:
Pacientes sintomáticos (p. Ej., Nerviosismo / temblores, hipotonía, cambios en el nivel de conciencia, apnea / bradicardia, cianosis, taquipnea, mala succión o alimentación, hipotermia y / o convulsiones):
Que tienen menos de 48 horas de vida con niveles de glucosa plasmática <50 mg / dL (2,8 mmol/L)
Que tienen más de 48 horas de vida con niveles de glucosa plasmática <60 mg / dL (3,3 mmol/L) Los pacientes asintomáticos en riesgo de hipoglucemia (por ejemplo, bebé prematuro o un bebé con la restricción del crecimiento fetal) o pacientes en los que se identificó bajo nivel de glucosa como un hallazgo de laboratorio incidental:
Que tienen menos de 4 horas de vida con niveles de glucosa plasmática <25 mg / dL (1,4 mmol/L)
Que tienen entre 4 y 24 horas de vida con glucosa plasmática <35 mg / dL (1,9 mmol / L)
Que tienen entre 24 y 48 horas de vida con niveles de glucosa plasmática <50 mg / dL (2,8 mmol/L)
Que tienen más de 48 horas de vida con niveles de glucosa plasmática <60 mg / dL (3,3 mmol/L)
Factores medioambientales:
Falta de controles prenatales
Alta incidencia de embarazo adolescente
Factores hereditarios:
Hiperinsulinismo
Glucogenosis
Galactosemia
Mal control glicémico en gestantes diabéticas
Acidemias orgánicas
Deficiencia de carnitina
Deficiencia de Acil-CoA deshidrogenasa
Factores de riesgo más comunes para desarrollar hipoglicemia:
Prematuridad
RCIU
Asfixia perinatal
Hijos de madre diabética
Macrosomía
Sepsis
Cesárea
Mayor ganancia de peso durante el embarazo

Los lactantes con concentraciones bajas de glucosa en sangre con frecuencia son asintomáticos; la hipoglucemia en estos casos generalmente se detecta mediante la glucosa en sangre en bebés en riesgo o como un hallazgo de laboratorio incidental.
En el lactante sintomático, los signos son inespecíficos y reflejan respuestas del sistema nervioso a la privación de glucosa. Estos se pueden clasificar como hallazgos neurogénicos o neuroglucopénicos:
Los síntomas neurogénicos (autónomos) son el resultado de cambios debidos a la descarga simpática neural desencadenada por la hipoglucemia.
Nerviosismo / temblores (ENARM 2002)
Transpiración
Irritabilidad
Taquipnea
Palidez
Los síntomas neuroglucopénicos son causados por una disfunción cerebral debida al deterioro del metabolismo energético del cerebro debido a un suministro deficiente de glucosa.
Mala succión o alimentación
Llanto débil o agudo
Cambio en el nivel de conciencia (letargo, coma)
Convulsiones
Hipotonía
En los recién nacidos, los signos adicionales de hipoglucemia incluyen apnea, bradicardia, cianosis e hipotermia.
Debido a que estos hallazgos son inespecíficos, se debe realizar una evaluación adicional para otras posibles causas (p. Ej., Sepsis) si los síntomas no se resuelven después de la normalización de la concentración de glucosa en sangre.
En aquellos con factores de riesgo o con sintomatología sugestiva de hipoglicemia se debe medir la glicemia en la primera hora de vida y cada 2 horas durante las primeras 8 horas y cada 4-6 horas en las siguientes 24 horas. Hay que considerar que el valor de glucosa en sangre total capilar medida por glucómetro es 15% inferior al suero por la menos concentración de glucosa en los eritrocitos. De acuerdo a la evaluación se puede solicitar otras pruebas como insulina, lactato, piruvato, cortisol, AGA, GH, glucagón tiroxina, etc., e incluso examen de orina para sustancias reductoras, aminoácidos, cuerpos cetónicos y ácidos orgánicos.
El manejo dependerá del valor de glicemia y la presencia o no de síntomas, como se aprecia en el siguiente algoritmo:
Hipoglicemia
El primer control de glicemia después del mini bolo se realiza a los 30 minutos.

El VIG normal es 4-5 (ENARM 2013-B), el VIG máximo es 20.
Asintomática
Glu > 30mg/dl

Probar alimentación
Glu
Tomas frecuentes Controles de glicemia
Glu < 30mg/dl Glu O no tolera
Sintomática
Minibolo 2cc Dx10%/Kg (ENARM 2010-B, ENARM 2011-A, ENARM 2015 I-A, ENARM 2020-A, ENARM 2022-B)
Dx infusión VIG
Glu (N) Mantener infusión Control de Glu Dar leche
Algoritmo 8. Algoritmo de manejo de hipoglicemia neonatal
Glu Aumentar VIG Control en 30 minutos
El volumen de hidratación de un RN en su primer día es de aprox. 70-80 cc/kg/día, luego se aumenta 10cc/kg por cada día. Los electrolitos se dan desde el segundo día (ENARM 2022-A), así: sodio 3-4meq/kg/día y potasio 1-2meq/Kg/día
El recién nacido puede presentar trastornos hematológicos como policitemia, anemia o plaquetopenia, además en el contexto de una sepsis neonatal es muy alta la probabilidad de desarrollar una coagulación intravascular diseminada asociado a falla de órganos.
Según el SIBEN, la policitemia se define como el nivel de hematocrito (Hto) venoso central mayor a 65% o nivel de hemoglobina mayor a 22 g/dl. Es importante considerar la edad posnatal, ya que el Hto asciende en las primeras 6 horas y luego desciende hasta estabilizarse alrededor de las 18-24 horas de edad posnatal, el sitio de extracción ya que el Hto capilar y de venas periféricas con escaso flujo puede ser 5-25% mayor que el de una vena con buen flujo, la altitud geográfica, la edad gestacional y el método utilizado para la determinación del Hto, con el micro hematocrito capilar se obtiene un valor mayor y con mejor correlación con viscosidad en comparación con el contador automático.
Las causas de la policitemia son multifactoriales, pero se deben a dos mecanismos principales: pasivo (transfusión de eritrocitos) y activo (aumento de la eritropoyesis intrauterina). La tabla enumera las afecciones que se han asociado con la policitemia.
Transfusión de eritrocitos (pasiva)
Pinzamiento tardío del cordón umbilical (p. Ej.,> 2 minutos después del nacimiento)
Entrega incontrolada o precipitada
Hipoxia intraparto
Transfusión de gemelo a gemelo (10 a 15% de gemelos mono-coriónicos)
Transfusión materno-fetal (rara)
Aumento de la eritropoyesis intrauterina (activa)
Insuficiencia placentaria
Preeclampsia
Otros trastornos hipertensivos
Otros trastornos vasculares
Hipoxemia materna debida a trastornos cardíacos o pulmonares.
Trastornos cardíacos o pulmonares.
Fármacos (p. Ej., Propranolol)
De fumar
Alta altitud
Entrega posterior al término
Factores de riesgo infantil
Grande para la edad gestacional
Diabetes mellitus materna
Síndrome de Beckwith-Wiedemann
Anomalías endocrinas (hiperplasia suprarrenal congénita, hipotiroidismo, hipertiroidismo)
Anomalías cromosómicas (trisomía 21, 18 y 13)

Hay dos eventos que pueden ocurrir en la policitemia: la hiperviscosidad y la hipervolemia. El aumento en la viscosidad sanguínea ocasiona incremento en la resistencia al flujo sanguíneo, enlentecimiento de este, disminución de la perfusión, disminución en la oxigenación tisular y tendencia a formar microtrombos. La policitemia puede o no estar relacionada con hipervolemia. Si ésta existe será la causa de muchos de los síntomas. La presentación más frecuente es asintomática. Se cree que los síntomas que generalmente se atribuyen a este trastorno se deben a una perfusión tisular reducida o anomalías metabólicas asociadas.
Efectos cardiorrespiratorios: signos cardiorrespiratorios, tales como cianosis y taquicardia; al igual que los síntomas respiratorios, incluida la taquipnea (ENARM 2015 I-B)

(ENARM 2020-A)
Trastornos gastrointestinales: síntomas gastrointestinales, incluyen vómitos y falta de apetito.
Hipoglucemia: la hipoglucemia es un problema metabólico común en pacientes con policitemia. El mecanismo puede implicar una mayor utilización de glucosa por el aumento del número de glóbulos rojos circulantes. Sin embargo, no hay datos que apoyen una relación causal, y la hipoglucemia en estos lactantes puede estar relacionada con las causas multifactoriales de policitemia (p. Ej., La policitemia suele ocurrir en lactantes de madres diabéticas que tienen riesgo de hipoglucemia debido al aumento de la producción de insulina).
La presentación más frecuente del RN con policitemia es asintomática
Figura 41. Recién nacido con policitemia. Nótese la coloración roja del bebe
Hiperbilirrubinemia: al menos un tercio de los bebés con policitemia desarrollan hiperbilirrubinemia, muy probablemente debido a la degradación de un mayor número de glóbulos rojos circulantes. En ocasiones, esto puede conducir al desarrollo de cálculos biliares. El efecto real de la policitemia sobre la hiperbilirrubinemia es difícil de cuantificar ya que las intervenciones para la policitemia, como la exanguinotransfusión y la hidratación, también mitigan la hiperbilirrubinemia. Estos efectos del tratamiento pueden explicar por qué algunos estudios no muestran una asociación entre policitemia e hiperbilirrubinemia.
En el manejo de la policitemia/hiperviscosidad, se incluyen las medidas generales y el tratamiento específico. Las medidas generales están destinadas a mantener un buen estado de hidratación, corregir las alteraciones metabólicas y electrolíticas que se presenten, y tratar las complicaciones asociadas.
El tratamiento específico es la exanguinotransfusión parcial (ETP). Está destinado a disminuir el Hto y la viscosidad sanguínea, reduce la resistencia vascular pulmonar e incrementa la velocidad del flujo sanguíneo cerebral. Se recomienda solicitar Hto entre 8 a 12 horas de vida a aquellos recién nacidos que tienen factores de riesgo para presentar policitemia/ hiperviscosidad:
Recién nacidos con hipoxia intrauterina crónica (restricción de crecimiento intrauterino (RCIU), diabetes materna, hipertensión materna, madre fumadora, madre que recibió propranolol).
En una anemia en RN que requiera transfusión de paquete globular, la dosis es
10 a 20 cc/kg/dosis
(ENARM 2015 I-B)
Transfusión placentaria (clampeo tardío del cordón, transfusión feto-fetal, transfusión materno-fetal).
Factores de riesgo fetales (hijo de madre diabética; trisomías 13, 18, 21; hiperplasia suprarrenal congénita; hipotiroidismo; hipertiroidismo; síndrome de BeckwithWiedemann; asfixia perinatal).
La ETP debe realizarse en recién nacidos policitémicos (Hto >65%) en presencia de síntomas. En los niños asintomáticos no parece estar justificado el tratamiento universal. Considerar ETP cuando el Hto venoso confirmado por segunda medición es >70 (ENARM 2004). Mortalidad neonatal
Volumen a intercambiar = Volemia x (HTO observado - HTO deseado)
HTO observado

Las causas más frecuentes de mortalidad neonatal en general son:
Prematuridad e inmadurez (ENARM 2013-A) (ENARM 2014 I-B)
Infecciones
Asfixia y causas relacionadas
Las causas más frecuentes según el peso del recién nacido son:
En menores de 1.5 kilos: Prematuridad e inmadurez
En aquellos que tienen entre 1.5 y 2.5 kilos: Infecciones
En mayores de 2.5 kilos: Asfixia y causas relacionadas
Según el momento de vida del recién nacido fallecen con más probabilidad en el siguiente orden:
1. Entre los 2 a 7 días de vida
2. En el primer día de vida
3. Después de los 7 días de vida
Otros datos para recordar es que las muertes neonatales son más frecuentes en las zonas rurales, región natural selva y en el quintil inferior de riqueza.
Existen tres tipos de mortalidad perinatal dependiendo del momento en el cual fallecen y son:
Mortalidad perinatal I: También llamada “internacional” e incluye a los que fallecen entre las 28 semanas de gestación (100 gramos) y 7 días de vida (ENARM 2002)
Mortalidad perinatal II: También llamada “ampliada” e incluye a los que fallecen entre las 20 semanas de gestación (500 gramos) y 28 días de vida
Mortalidad perinatal III: También llamada “nacional” e incluye a los que fallecen entre las 20 semanas de gestación y 7 días de vida