ENDOCRINOLOGÍA
Luis Villar





El hipopituitarismo ocurre debido a una falla parcial o total de la glándula pituitaria para secretar ≥ 1 de las hormonas que produce o almacena.
Las causas incluyen tumores y quistes hipofisarios, tumores no hipofisarios que comprimen la hipófisis, lesión cerebral traumática, cirugía hipofisaria, radioterapia en la silla turca, hemorragia posparto (síndrome de Sheehan), hemorragia subaracnoidea e hipofisitis.
Masas intraselares/paraselares
♦ Los macroadenomas hipofisarios no secretores (≥ 10 mm de diámetro) son la causa más común de hipopituitarismo entre los adultos.
♦ Menos frecuentes: Meningiomas, craneofaringiomas
Apoplejía hipofisaria
♦ Infarto de la glándula pituitaria como resultado de isquemia y/o hemorragia
♦ Es más común que ocurra en pacientes con preexistente adenoma hipofisario
♦ Síndrome de Sheehan: necrosis postparto de la glándula pituitaria. Por lo general, ocurre después de una hemorragia posparto, pero también puede ocurrir incluso sin evidencia clínica de hemorragia. – Durante el embarazo, la hipertrofia de regiones productoras de prolactina aumenta el tamaño de la glándula pituitaria, lo que es muy sensible a la isquemia.
Pérdida de sangre durante el parto/hemorragia posparto; isquemia de la glándula pituitaria → silla turca vacía en las imágenes
Lesión cerebral traumática
Congénito
Infiltración de la pituitaria y/o el hipotálamo
♦ Hemocromatosis
♦ Sarcoidosis
Síndrome de la silla turca vacía
Deficiencia congénita de hormonas hipotalámicas.
♦ Deficiencia de GnRH (síndrome de Kallmann)
Irradiación hipofisaria
La causa de Hipopitituarismo más frecuente es el adenoma pituitario.
La única causa aguda de hipopituarismo es la apoplejía pituitaria.
El hipopituitarismo se vuelve sintomático cuando más del 80% de las células pituitarias están dañadas.
♦ En la mayoría de los casos, el hipopituitarismo se desarrolla lentamente (Adenomas, postirradiación)
♦ Ciertos casos de hipopituitarismo se desarrollan rápidamente (Apoplejía hipofisaria). El hipopituitarismo se refiere a la deficiencia de una o más hormonas de la hipófisis anterior
♦ Deficiencia de GH → retraso del crecimiento (durante la infancia)
♦ Deficiencia de prolactina → insuficiencia de la lactancia después del parto
♦ Deficiencia de FSH/LH → hipogonadismo hipogonadotrópico (ESSALUD 2004)
♦ Deficiencia de TSH → hipotiroidismo secundario
♦ Deficiencia de ACTH → insuficiencia suprarrenal secundaria
Además de las deficiencias hormonales mencionadas anteriormente, los pacientes con daño hipofisario severo (pan hipopituitarismo) también presentan deficiencias de hormonas hipofisarias posteriores:
♦ Deficiencia de ADH → diabetes insípida central
♦ Deficiencia de oxitocina → sin efecto

Evaluar a los pacientes asintomáticos para detectar hipopituitarismo, incluidos aquellos con macroadenomas hipofisarios y después de una lesión cerebral de moderada a grave, hemorragia subaracnoidea, cirugía transesfenoidal o radioterapia hipofisaria.
La presentación clínica varía con la deficiencia hormonal específica, que puede incluir insuficiencia adrenocortical, hipotiroidismo, hipogonadismo, deficiencia de la hormona del crecimiento (GH) y diabetes insípida central.
Deficiencia de prolactina
♦ Mujeres: insuficiencia de la lactancia después del parto.
♦ Hombres: asintomático.
♦ La prolactina se incrementa cuando la causa de hipopituitarismo es hipotalámica porque va a faltar el PIF, por tanto, la prolactina se incrementa y será causa de hiperprolactinemia (ENARM 2005).
La única causa aguda de hipopituarismo es la apoplejía pituitaria.
La secuencia de compromiso sigue esa secuencia: GH, Prolactina, Gonatrofinas, TSH y ACTH y lo podemos recordar como GiLiTA
(G= GH, Li= LH/FSH, T= TSH y A= ACTH)
Los pacientes con sospecha de crisis suprarrenal agudo requieren tratamiento inmediato con hidrocortisona.
La apoplejía hipofisaria, que produce hipercortisolismo agudo e hipotiroidismo, puede manifestarse con cefalea intensa, hipotensión repentina y shock hipovolémico.
El diagnóstico varia de prueba dependiendo del cuadro clínico presente o preponderante y con imágenes por resonancia.
El tratamiento del hipopituitarismo incluye:
Además del reemplazo de la hormona hipofisaria, se debe tratar la causa subyacente del hipopituitarismo. Los pacientes con hipopituitarismo con deficiencia de TSH no deben ser tratados con levotiroxina hasta que se haya descartado y/o tratado la deficiencia de ACTH porque la levotiroxina aumenta el aclaramiento de cortisol y puede precipitar una crisis suprarrenal.
HIPOPITUITARISMO
Insuficiencia suprarrenal secundaria
Manejo de rutina: glucocorticoides con aumentos de dosis durante períodos de estrés
Hipotiroidismo secundario
Hipogonadismo secundario
Deficiencia de hormona del crecimiento
Nuevo diagnóstico: descarte la deficiencia de ACTH antes de iniciar el tratamiento, ya que la levotiroxina aumenta el aclaramiento de cortisol y puede precipitar una crisis suprarrenal.
Manejo de rutina: levotiroxina
Varones: Reemplazo de testosterona
Si se desea fertilidad, gonadotropinas exógenas (HCG)
Mujeres: reemplazo de estrógeno con progesterona
Niños: reemplazo de la hormona del crecimiento
Adultos: se puede ofrecer reemplazo de GH, pero generalmente no es necesario.
Diabetes insípida central Manejo de rutina: desmopresina

CLÍNICA: Orden de Afectación

El hallazgo incidental de un tumor hipofisiario por imágenes se denomina Incidentaloma.
Las masas selares suelen presentarse de una o más formas: Con síntomas neurológicos, como discapacidad visual, diplopía o dolor de cabeza. Como hallazgo incidental en una resonancia magnética (RM) o una tomografía computarizada (TC) realizada por alguna otra razón.
Con anomalías hormonales
Craneofaringioma: los craneofaringiomas son tumores benignos sólidos quísticos sólidos o mixtos que surgen de los restos de la bolsa de Rathke a lo largo de una línea desde la nasofaringe hasta el diencéfalo. La mayoría son intraselares o supraselares. Aproximadamente el 50 por ciento se presenta clínicamente durante la infancia y la adolescencia, el otro 50 por ciento se presenta después de los 20 años, algunos no hasta los 70 u 80 años. Los principales síntomas de presentación son retraso del crecimiento en niños y visión anormal en adultos. Además, son comunes las deficiencias hormonales hipofisarias, incluida la diabetes insípida.
Son tumores benignos de la hipófisis anterior, pero son neoplasias verdaderas, como lo demuestran los estudios de clonalidad.
Etiología
La mayoría de los casos ocurren esporádicamente.
Algunos casos (∼ 5%) tienen una asociación genética/familiar:
♦ Neoplasia endocrina múltiple tipo 1
♦ Complejo de Carney
♦ Síndrome de adenoma hipofisario aislado familiar
Epidemiología
Pico de incidencia: 35 a 60 años
Patogenia
Los adenomas hipofisarios son tumores intraselares bien delimitados con células poligonales monomórficas dispuestas en láminas o cordones sin tejido conectivo y/o reticulina.
Clasificación
Clasificación de tumores según tamaño
♦ Microadenoma hipofisario: ≤ 10 mm
♦ Macroadenoma hipofisario: > 10 mm
Clasificación de los tumores según la capacidad de secretar hormonas.
Adenomas hipofisarios no secretores
♦ Los tumores no funcionales representan 15 a 45% de todos los adenomas hipofisarios.
♦ Adenomas gonadotropo
♦ Adenomas de células nulas
♦ Adenomas plurihormonal
♦ Adenomas somatotropo y corticotropo silenciosos
Adenomas hipofisarios secretores: funcionales → hiperpituitarismo
♦ La mayoría de las veces prolifera exclusivamente en un solo tipo de célula endocrina y, por lo tanto, secreta solo una hormona
♦ La presencia de múltiples hormonas hipofisarias también debe suscitar sospechas de adenomas hipofisarios atípicos o carcinomas hipofisarios.
Adenoma lactótropo (prolactinoma)
Adenoma somatotropo
Adenoma
Adenoma tirotropo
Hiperprolactinemia en:
Mujeres: galactorrea, amenorrea, disminución de la densidad ósea debido a la supresión de estrógenos Hombres: reducción de la libido e infertilidad
↑ Hormona del crecimiento → acromegalia o gigantismo
Adenoma gonadotropo Raro ↑ LH y FSH (solo el 10-20% son adenomas funcionantes)
TIPO
Los prolactinomas son los adenomas hipofisarios más comunes.
Los síntomas asociados con los adenomas hipofisarios dependen del tamaño del tumor y de si el tumor produce hormonas.
Microadenomas < 10 mm
Exceso de producción de una hormona pituitaria; la hormona está determinada por la histopatología del adenoma hipofisario
Macroadenomas ≥ 10 mm
La hormona que se produce en exceso está determinada por la histopatología del adenoma hipofisario; otras hormonas hipofisarias pueden ser deficientes como resultado de la destrucción hipofisaria.
Efectos de masa (cefalea, hemianopsia bitemporal por compresión del quiasma óptico, diplopía)
Mayormente asintomático
Hipopituitarismo
Efectos masivos (cefalea, hemianopsia bitemporal, diplopía)
Los adenomas hipofisarios pueden sangrar espontáneamente, causando apoplejía hipofisaria (es decir, apoplejía tumoral hipofisaria); esto se manifiesta con fuertes dolores de cabeza, síntomas visuales, colapso cardiovascular y / o insuficiencia suprarrenal secundaria aguda.

Trate a los pacientes con incidentalomas secretores según el tipo de tumor y trate a los pacientes con Incidentalomas no secretores si hay síntomas de efecto de masa.
Después de la resección transesfenoidal y / o la irradiación hipofisaria, los pacientes pueden desarrollar hipopituitarismo y potencialmente requerir terapia de reemplazo hormonal de por vida.
Tratamiento
Los prolactinomas pueden ser manejados con supresión hormonal
♦ Agonistas de la dopamina (hacen que el adenoma se encoja)
♦ 1° línea: Cabergolina
♦ 2° línea: Bromocriptina
Los adenomas secretores y los no secretores sintomáticos necesitan cirugía.
Los microprolactinomas asintomáticos y los adenomas no secretores asintomáticos
→ Observación Manejo quirúrgico

Tratamiento de 1° línea para:
♦ Adenomas secretores (excluidos los prolactinomas)
♦ Adenomas no secretores sintomáticos
♦ Apoplejía hipofisaria con síntomas visuales
Tratamiento de 2° línea si el tratamiento médico falla en los prolactinomas
♦ Procedimiento: hipofisectomía transesfenoidal
♦ Extirpación de tejido pituitario; realizado bajo guía microscópica o endoscópica a través del seno esfenoidal
♦ Puede ser parcial (hemihipofisectomía) o completa (hipofisectomía total)
♦ Hacer un seguimiento
♦ Monitoree las complicaciones postoperatorias tempranas durante la hospitalización.
♦ Es necesario realizar seguimientos periódicos para detectar de forma temprana desequilibrios hormonales nuevos o recurrentes.
La hiperprolactinemia más frecuente es fisiológica y luego se ve medicamentosas, siendo la patológica más frecuente el prolactinoma
La hiperprolactinemia es una afección común en la que el nivel sérico de la hormona hipofisaria prolactina es más alto de lo normal, lo que se debe a un exceso de síntesis y secreción o una disminución del aclaramiento hepático o renal.
La prolactina elevada puede ser fisiológica, por ejemplo, durante el embarazo y la lactancia.
La hiperprolactinemia patológica a menudo se debe a medicamentos, tumores hipofisarios (especialmente microprolactinomas o macroprolactinomas secretores de prolactina), daño del tallo hipofisario o trastornos subyacentes (como hipotiroidismo primario o insuficiencia renal).
Causas fisiológicas
♦ Embarazo
♦ Lactancia
♦ Estimulación mamaria / lactancia materna
♦ Actividad sexual
♦ Ejercicio
Trastornos hipofisarios e hipotalámicos
♦ Tumores
Pituitaria
♦ Dormir
♦ Estrés (físico o psicológico)
♦ Comiendo
♦ Pulsatilidad de prolactina
• Prolactinoma (microadenoma o macroadenoma secretor de prolactina)
• Macroadenoma no secretor de prolactina (debido al efecto compresivo de “tallo”)
• Adenoma plurihormonal (que secreta prolactina y hormona del crecimiento, o más raramente, prolactina y tirotropina u hormona adrenocorticotrópica)
Hipotálamo (por ejemplo: craneofaringioma, cualquier masa hipofisaria supraselar, glioma, hamartoma) al comprimir el sistema portal hipofisario o daño neuronal dopaminérgico
– Hipotálamo o pituitaria (por ejemplo: meningioma, germinoma, metástasis) al ejercer el efecto de “tallo”
Masa paraselar (por ejemplo: meningioma)
♦ Enfermedades infiltrativas (por ejemplo: sarcoidosis, tuberculosis o histiocitosis de células de Langerhans)
Radiación craneal
Trauma – Cirugía
Quiste de la hendidura de Rathke
Malformación vascular
Trastornos sistémicos
♦ Afecciones que afectan al tórax (por ejemplo: traumatismo neurogénico de la pared torácica, anillos en los pezones, quemaduras, cirugía, herpes zóster)
♦ Enfermedad renal crónica en adultos o niños
Causas farmacológicas
Medicamentos para el sistema nervioso central
♦ Antipsicóticos
– Pseudotumor cerebri
Otras causas hipofisarias
– Síndrome de la silla turca vacía
Hipofisitis
– Macroprolactinemia
♦ Cirrosis
♦ Convulsiones (adultos o niños)
♦ Síndrome de ovario poliquístico
♦ Insuficiencia suprarrenal (raramente)
♦ Hipotiroidismo primario en adultos o niños
Antipsicóticos de primera generación, que incluyen fenotiazinas y haloperidol.
Antipsicóticos de segunda generación, que incluyen risperidona y olanzapina.
Los adenomas
hipofisarios son la causa más común (+ 50%) de hiperprolactinemia patológica.
Los niveles de prolactina normales están por debajo de 25, por debajo de 100 sería un microprolactinoma y por encima de 250 debe ser macro prolactinoma.
El manejo de hiperprolactinemia debe estar acorde con la clínica y la causa, medicamentosa debe ser suspensión, Cabergolina y reemplazo de la medicación.
El fracaso de la terapia médica indica la cirugía.
♦ Antidepresivos tricíclicos (en contraste, los inhibidores selectivos de la recaptación de serotonina rara vez o nunca causan hiperprolactinemia)
♦ Anticonvulsivos
♦ Opiáceos y antagonistas de opiáceos
♦ Gases anestésicos
♦ Antihipertensivos: algunos bloqueadores de los canales de calcio (verapamilo), metildopa, reserpina
♦ Antieméticos, especialmente metoclopramida y domperidona
♦ Cocaína
♦ Hierbas medicinales

♦ Equinácea purpúrea
♦ Posiblemente anticonceptivos orales que contienen estrógenos, aunque la evidencia es inconsistente
Medir la prolactina sérica en ayunas para confirmar el diagnóstico de hiperprolactinemia
La prolactina < 25 mcg / L suele descartar la hiperprolactinemia.
La prolactina < 100cg/L se corresponde con microprolactinomas
La prolactina > 250 mcg / L suele indicar un macroprolactinoma.
Si se sospecha hiperprolactinemia inducida por fármacos, considere suspender la medicación durante 3 días y volver a analizar la prolactina sérica (recomendación débil). Se debe tener precaución al cambiar los medicamentos en pacientes con enfermedad psiquiátrica grave.
Si la hiperprolactinemia persiste, realice más pruebas para determinar la causa subyacente (recomendación fuerte):
♦ Prueba de embarazo
♦ Pruebas de función tiroidea, hepática y renal
♦ Imágenes de la hipófisis para detectar una masa hipofisaria o hipotalámica (se prefiere la resonancia magnética mejorada con gadolinio a la tomografía computarizada)
♦ Pruebas genéticas si se sospecha un síndrome asociado con hiperprolactinemia (esto es bastante raro y la neoplasia endocrina múltiple tipo 1 [MEN-1] sería el trastorno genético más común asociado con la hiperprolactinemia).
Considerar no tratar a pacientes con hiperprolactinemia asintomática inducida por medicamentos o microprolactinoma asintomático estable, particularmente en hombres eugonadales o mujeres premenopáusicas que no buscan la fertilidad o en mujeres posmenopáusicas
Para la hiperprolactinemia sintomática inducida por medicamentos, considere, en orden preferencial, la suspensión del fármaco, la sustitución del fármaco o la terapia con agonistas de la dopamina, si no está contraindicado debido a una enfermedad psiquiátrica
Para los pacientes con prolactinoma sintomático, los agonistas de la dopamina, específicamente la Cabergolina, son el tratamiento de primera línea (ENARM 2005). Durante el embarazo, suspenda los agonistas de la dopamina en la mayoría de las mujeres Considere la interrupción gradual de la terapia con agonistas de dopamina después de ≥ 2 años si la prolactina sérica ya no está elevada y no hay restos de tumor visibles en la resonancia magnética Se debe considerar la terapia con estrógenos o testosterona para el hipogonadismo a largo plazo relacionado con la hiperprolactinemia inducida por fármacos si no se puede suspender el medicamento
Para el prolactinoma maligno o agresivo, considere la temozolomida
Para los prolactinomas que no responden a la medicación, considere la cirugía transesfenoidal.
La acromegalia es producida generalmente por un adenoma somatotropo.
La acromegalia es una enfermedad lenta y progresiva causada con mayor frecuencia por un adenoma hipofisario esporádico funcional (generalmente un macroadenoma) que secreta la hormona del crecimiento (GH), que ocurre después del cierre de las placas de crecimiento.
Con menos frecuencia (notificada en <5% de los casos), la acromegalia puede ser causada por un tumor familiar, hiperplasia hipofisaria o secreción ectópica de GH u hormona liberadora de GH (GHRH) de un tumor hipotalámico o un tumor neuroendocrino (generalmente de pulmón o páncreas).
Adenoma hipofisario benigno secretor de hormona del crecimiento (> 95% de los casos)
Muy raras: tumores neuroendocrinos o hipotalámicos, síndromes paraneoplásicos
♦ Secreción ectópica de hormona del crecimiento por tumores neuroendocrinos (carcinoma de pulmón de células pequeñas, tumor de células de los islotes pancreáticos (MEN 1)
♦ ↑ Secreción de hormona liberadora de hormona del crecimiento (GHRH) de un tumor hipotalámico o en síndromes paraneoplásicos
La mortalidad incrementada en acromegalia es cardiovascular y específicamente IMA.
El exceso de secreción de GH antes de la conclusión del crecimiento longitudinal (es decir, antes del cierre de la placa epifisaria) conduce a gigantismo hipofisario. Después del cierre de la placa epifisaria, el exceso de GH causa acromegalia, pero sin cambios en la altura.
Se sospecha el diagnóstico en adultos con dismorfia facial y acral, especialmente si existen comorbilidades relacionadas con el efecto compresivo del tumor o exceso de hormona del crecimiento.
Los signos y síntomas se desarrollan de forma característica en la quinta década de la vida, que incluyen agrandamiento acral, rasgos faciales toscos y diversas comorbilidades (como complicaciones cardiovasculares, neurológicas, metabólicas y del campo visual) debido a los efectos de masa del tumor y al exceso de GH.
La prueba diagnóstica por excelencia es el nivel de IGF-1 elevado, su nivel normal descarta.
Pruebas diagnósticas:
♦ Concentración sérica de IGF-1: la mejor prueba individual
– Nivel elevado de IGF-1: sospecha de acromegalia; realizar una prueba de tolerancia a la glucosa oral.
Nivel normal de IGF-1: acromegalia descartada
♦ Test de tolerancia a la glucosa oral con GH basal y medir GH después de 2 horas: la prueba más específica
Si se suprime la GH: se descarta la acromegalia
– Si no se suprime la GH: acromegalia confirmada, realizar una resonancia magnética pituitaria para determinar la fuente del exceso de GH
♦ Resonancia magnética hipofisaria
– Modalidad de imagen de elección
Suele mostrar una masa visible: adenoma hipofisario secretor de GH confirmado
– Si es normal: pensar en causas extra pituitarias (TC del tórax y el abdomen, medir la GHRH)
Considerar apuntar a un nivel de IGF-1 normalizado por edad, que indica un control exitoso de la acromegalia
Considerar apuntar a un nivel aleatorio de hormona del crecimiento (GH) <1 mcg / L, que se correlaciona con un control exitoso de la acromegalia
Se sugiere el uso del mismo ensayo de GH e IGF-1 en el mismo paciente durante el curso del tratamiento
La adenomectomía transesfenoidal es el método de elección para tratar la acromegalia. En pacientes con tumores inoperables o cirugía fallida, la medicación y la radioterapia están indicadas para reducir el tamaño del tumor y limitar los efectos de la GH y el IGF - 1
♦ Cirugía
Adenomectomía transesfenoidal (método preferido)
– Citorreducción quirúrgica (en pacientes con enfermedad paraselar y tumores inoperables)
Las tasas de remisión después de la cirugía por acromegalia son:
• 75% para microadenomas hipofisarios y macroadenomas intraselares
El tratamiento de elección es la cirugía.
• 44,5% para adenomas supraselares sin compromiso visual
• 41,5% para adenomas con expansión paraselar y / o esfenoidal
• 33% para adenomas supraselares con compromiso visual.
♦ Médico

– Análogos de la somatostatina (octreótide, lanreotida)
– Agonistas de la dopamina (cabergolina): reducen el tamaño del tumor y la secreción de GH
– Antagonistas del receptor de GH (pegvisomant)
♦ Radioterapia
– Radioterapia convencional fraccionada
Radiocirugía estereotáctica
Masculino
El hipogonadismo es una función testicular disminuida en comparación con la función de los testículos apropiada para la edad que puede incluir una actividad alterada del eje hipotalámicopituitario-testicular y / o un trastorno de la espermatogénesis.
Mujer
La pubertad retrasada femenina se define como la falta de desarrollo de los senos entre 2 y 2,5 desviaciones estándar mayores que la media de la población, por lo general 13 años en las niñas, aunque el inicio de la pubertad varía según el país, la raza y la etnia.
Hipogonadismo hipergonadotrófico (hipogonadismo primario)
Es causado por una producción insuficiente de esteroides sexuales en las gónadas
♦ Insuficiencia gonadal primaria: síndrome de Turner (mujeres), síndrome de Klinefelter (hombres), anorquia
♦ Insuficiencia gonadal secundaria (daño a las células de Leydig o tejido ovárico): quimioterapia, irradiación pélvica, trauma/cirugía, enfermedad autoinmune (Síndrome poli glandular autoinmune), infecciones (paperas, tuberculosis)
Hipogonadismo hipogonadotrópico (hipogonadismo secundario)
El hipogonadismo hipogonadotrópico es causado por una cantidad insuficiente de hormona liberadora de gonadotropina (GnRH) y/o liberación de gonadotropina en el eje hipotalámicohipofisario.
Desórdenes genéticos
♦ Síndrome de Kallmann
♦ Hipogonadismo hipogonadotrópico idiopático (HHI): un trastorno genético caracterizado por un defecto en la producción/acción de GnRH en ausencia de anosmia.
♦ Síndrome de Prader-Willi
♦ Enfermedad de Gaucher
Lesiones hipotalámicas y / o pituitarias
♦ Neoplasia (prolactinoma, craneofaringioma, astrocitoma)
♦ Trauma, cirugía, irradiación
♦ Infección
Trastornos de la alimentación (amenorrea hipotalámica funcional)
Drogas (opioides)
Manifestaciones clínicas

♦ Pubertad retrasada
♦ ♂: Hipoplasia testicular, ↓ Crecimiento del vello corporal, Voz aguda, ↓ Masa corporal magra
♦ ♀: Amenorrea primaria
♦ Anormalidades del desarrollo con genitales (testículos no descendidos, hipospadias)
♦ Infertilidad (↓ recuento de espermatozoides), impotencia y / o ↓ libido
♦ Amenorrea secundaria
♦ Síndrome de Klinefelter: ginecomastia
♦ Síndrome de Turner: cuello palmeado, baja estatura
♦ Síndrome de Kallmann: anosmia, ausencia de desarrollo mamario, presencia de útero, sindactilia, paladar hendido o labio leporino
♦ Síndrome de Prader-Willi: hipotonía muscular, talla baja, dismorfia facial
♦ Enfermedad de Gaucher: hepatomegalia, esplenomegalia, crisis ósea dolorosa
Pruebas de diagnostico
♦ Después de confirmar la deficiencia de testosterona, mida los niveles séricos de hormona luteinizante (LH) y hormona estimulante del folículo (FSH) para distinguir entre hipogonadismo primario y secundario.
Para distinguir entre hipogonatrófico e hipergonadotrófico se debe realizar un dosaje de LH y FSH.
♦ ↓ Niveles séricos de testosterona (en hombres; generalmente <300 ng / dL) y ↓ niveles séricos de estrógeno (en mujeres)
♦ Determine si la fuente es hipogonadismo primario o secundario.
Hipogonadismo hipergonadotrófico: ↑ GnRH, ↑ LH / FSH – Hipogonadismo hipogonadotrópico: ↓ GnRH, ↓ LH / FSH
♦ La gammagrafía ósea puede apoyar el diagnóstico de hipogonadismo: muestra ↓ densidad ósea (osteoporosis) o cierre epifisario retrasado Pruebas adicionales: basadas en la etiología sospechada
♦ Pruebas genéticas
♦ Prolactina sérica (↑ en prolactinoma)
♦ Ecografía pélvica (disgenesia gonadal en el síndrome de Klinefelter)
♦ RM cerebral: para lesión del SNC o síndrome de Kallmann (ausencia de bulbos olfatorios en el síndrome de Kallmann)
♦ Prueba de estimulación de la hormona adrenocorticotrópica (prueba de estimulación de ACTH): para excluir la hiperplasia suprarrenal congénita
Tratar la causa subyacente: Extirpación quirúrgica de tumores, farmacoterapia para prolactinomas (ENARM 2022 - A)
Además de ciclar a la mujer y usar testosterona de depósito en varones, la fertilidad es posible en los hipogonatrofico.
Terapia de reemplazamiento de hormonas
Desencadena el inicio de la pubertad en individuos prepúberes a la edad apropiada
Terapia de reemplazo de testosterona en hombres
Terapia de reemplazo de estrógenos en mujeres
Para mejorar la fertilidad en personas pospúberes con hipogonadismo hipogonadotrópico y, si es prepuberal, una alternativa para desencadenar el inicio de la pubertad y el crecimiento
Hormona liberadora de hormona luteinizante pulsátil (LHRH) o gonadotropina coriónica humana (HCG) en hombres
LHRH pulsátil o gonadotropinas en mujeres
La causa más frecuente de hipotiroidismo es primario y es Tiroiditis de Hashimoto la enfermedad autoinmune que lo causa con más frecuencia.
El hipotiroidismo es una deficiencia de la hormona tiroidea generalmente causada por insuficiencia tiroidea primaria y, con menos frecuencia, debido a insuficiencia pituitaria, insuficiencia hipotalámica o resistencia congénita a la hormona tiroidea.
El hipotiroidismo primario manifiesto se define como hormona estimulante de la tiroides (TSH) elevada con tiroxina libre baja (T4L) y puede estar relacionado con la autoinmunidad, ser congénito o ser causado por cirugía de tiroides, radioablación previa o radioterapia en el cuello o deficiencia endémica de yodo (ENARM 2020 - B, ENARM 2022 - B).
El hipotiroidismo subclínico se define como TSH elevada con T4 libre normal.
El hipotiroidismo central generalmente se presenta con TSH baja a normal con T4L bajo y puede ser causado por hipopituitarismo (hipotiroidismo secundario), un proceso hipotalámico (hipotiroidismo terciario) o una enfermedad grave (síndrome de enfermedad no tiroidea).
Los medicamentos que pueden causar hipotiroidismo incluyen litio y amiodarona.
Prevalencia: más común en mujeres
La causa más frecuente de hipotiroidismo es debido a enfermedad
autoinmune por tiroiditis crónica de Hashimoto y le sigue el Bocio Endémico que es más prevalente en zonas de mayor pobreza y poca ingesta de yodo (ENARM 2013 – A).
HIPOTIROIDISMO PRIMARIO
Tiroiditis crónica autoinmune (HASHIMOTO)
– Bocio endémico
– Iatrogémico
– Tiroidectomía
– Tiroiditis subaguda
Post Iodo radioactivo
Agenesia congénita
HIPOTIROIDISMO CENTRAL
Deficiencia TSH
– Deficiencia TRH
El hipotiroidismo puede presentarse con:
♦ Sin síntomas (condición detectada en el cribado)
♦ Síntomas leves a moderados, como actividad física y mental lenta, intolerancia al frío, estreñimiento y aumento de peso
♦ Cambios en el estado mental (coma mixedematoso) en la enfermedad avanzada.

Signos y síntomas generales
♦ Síntomas relacionados con la disminución de la tasa metabólica.
♦ Fatiga, disminución de la actividad física
♦ Intolerancia al frío
♦ Disminución de la sudoración.
♦ Pérdida de cabello, uñas quebradizas, piel fría y seca
♦ Aumento de peso (a pesar de tener poco apetito)
♦ Estreñimiento
♦ Bradicardia
♦ Miopatía hipotiroidea, mialgia, rigidez, calambres
♦ Signo de Woltman: relajación retardada de los reflejos tendinosos profundos, que se observa comúnmente en pacientes con hipotiroidismo, pero que también puede asociarse con edad avanzada, embarazo, diabetes mellitus.
♦ Síndromes de atrapamiento (Síndrome del túnel carpiano)
Síntomas relacionados con mixedema generalizado
♦ Textura de piel delgada, apariencia hinchada
♦ Cardiopatía mixedematosa (miocardiopatía dilatada, bradicardia, disnea)
♦ Voz ronca, dificultad para articular palabras.
♦ Edema pre-tibial y periorbitario
♦ Coma mixedematoso
Síntomas de la hiperprolactinemia.
♦ Ciclo menstrual anormal (especialmente amenorrea secundaria o menorragia)
♦ Galactorrea
♦ Disminución de la líbido, disfunción eréctil, eyaculación retardada e infertilidad en los hombres.
Otros síntomas
♦ Cognición deteriorada (concentración, memoria), somnolencia, depresión

♦ Hipertensión
♦ Bocio (en la tiroiditis de Hashimoto) o tiroides atrófica (en la tiroiditis atrófica)
Es característico del hipotiroidismo secundario o central la ausencia de Bocio.
Laboratorio
Diagnóstico de hipotiroidismo en adultos no gestantes
El diagnóstico de hipotiroidismo primario manifiesto puede sospecharse en pacientes con signos y síntomas clásicos de hipotiroidismo, y se diagnostica cuando los análisis de sangre muestran:
TSH elevada, a menudo> 10 miliunidades / L
T4 L bajo en suero
Es posible que los pacientes mayores no presenten los síntomas típicos del hipotiroidismo. En cambio, puede parecer que padecen demencia o depresión.
Función hipotalámica-hipófisis normal
Hipotiroidismo primario Alto Bajo Normal o bajo Hipotiroidismo subclínico Alto Normal
Hipertiroidismo primario Bajo Alto o normal Alto
Hipertiroidismo subclínico Bajo Normal Normal
Función hipotalámica-hipófisis anormal
Hipertiroidismo central Alto o normal Alto Alto
Hipotiroidismo central Bajo o normal Baja o baja-normal Bajo o normal
Prueba de anticuerpos
♦ Ac-Tg (tiroglobulina) y Ac-TPO (peroxidasa tiroidea): detectable en la mayoría de los pacientes con hipotiroidismo autoinmune
♦ Ac-TSHR (receptor TSH): positivo en ∼ 20% de los pacientes con hipotiroidismo autoinmune
El hipotiroidismo primario tiene un TSH alto (mayor de 10) y un T4L bajo y el T3L normal o bajo.
♦ Prueba de captación de yodo radiactivo

– Mide la proporción de yodo exógeno que es absorbido por la tiroides (normalmente 10 a 35%)
La disminución de la captación indica hipotiroidismo.
♦ Ecografía de la glándula tiroides: para evaluar el tamaño, la estructura o el flujo sanguíneo
♦ Descartar otras afecciones que pueden imitar el hipotiroidismo puede ser útil en el diagnóstico.
– Hipercolesterolemia (aumento de LDL), hiperlipidemia, hipoglucemia
Aumento de la creatina quinasa
– Anemia leve – Posiblemente hiponatremia
Reemplazo con L-tiroxina
♦ Drogas
♦ Levotiroxina (una forma sintética de T4): periféricamente convertida en T3 (biológicamente activa) y rT3 (biológicamente inactiva)
♦ Liotironina: forma sintética de triyodotironina (T3)
♦ La monoterapia con levotiroxina (T4L) es el tratamiento recomendado para pacientes con hipotiroidismo y se inicia con la mitad de la dosis calculada que se calcula con 1.6 mcg/k/día, usual 100 mcg, es la mitad de esta dosis si hay riesgo cardiovascular o son mayores de 50 años (ENARM 2015 I – B)
♦ Indicaciones de levotiroxina
– Tratar a todos los pacientes con hipotiroidismo manifiesto con levotiroxina
La decisión de tratar el hipotiroidismo subclínico es controvertida
– Para las pacientes no gestantes con hipotiroidismo subclínico, considere el tratamiento con levotiroxina si los niveles séricos de TSH son> 10 mili unidades / L debido a un mayor riesgo de insuficiencia cardíaca y mortalidad cardiovascular
Si se toma la decisión de tratar el hipotiroidismo subclínico, considere una dosis más baja (25-75 mcg / día por vía oral), dependiendo del grado de elevación de TSH (recomendación débil)
Principios generales
♦ Reemplazo de por vida
♦ Inicio pronto del tratamiento Indicaciones
♦ Mixedema
♦ Hipotiroidismo
Efectos secundarios
♦ Sudoración, intolerancia al calor
♦ Taquicardia, palpitaciones, arritmias, dolor de pecho

♦ Temblores
♦ Pérdida de peso (a veces los pacientes que intentan perder peso abusan de este medicamento)
El coma mixedematoso es una forma rara y potencialmente mortal de hipotiroidismo descompensado con una alta tasa de mortalidad (hasta el 40% a pesar del tratamiento). La detección temprana y el tratamiento oportuno y apropiado son fundamentales para evitar un desenlace fatal.
Se observa con mayor frecuencia en mujeres> 60 años, especialmente aquellas con hipotiroidismo no tratado o tratado de manera inadecuada.
La afección generalmente se desencadena por un evento precipitante agudo en un paciente con hipotiroidismo, como:
♦ Infección
♦ Infarto de miocardio
♦ Exposición intensa al frío, especialmente si resulta en hipotermia.
♦ Sobredosis de diuréticos y / o sedantes, especialmente opioides
♦ Cirugía importante
♦ Hemorragia gastrointestinal
El diagnóstico de coma mixedematoso se basa en la presentación clínica y la exclusión de otras causas de coma, ya que ningún conjunto de resultados de pruebas de laboratorio establece definitivamente el diagnóstico.
En pacientes precomatosos, que es mucho más común que los pacientes comatosos, sospechar coma mixedematoso en adultos mayores (especialmente mujeres de 60 a 85 años) con:

♦ Hipotermia profunda (<95 grados F [35 grados C])
♦ Disminución de la capacidad mental (puede presentarse inicialmente como confusión, obnubilación y letargo)
♦ Edema generalizado
♦ Signos y síntomas típicos de hipotiroidismo severo
♦ Síntomas cardinales: deterioro del estado mental, hipotermia, y mixedema concurrente
♦ Hipoventilación con hipercapnia
♦ Hipotensión (posiblemente shock) y bradicardia
Hallazgos frecuentes:
♦ Hipoxemia
♦ Hiponatremia
♦ Anemia normocítica o macrocítica
♦ Hipercolesterolemia
♦ Glucosa en sangre baja
♦ Bajo en sodio y cloruro
♦ Alto calcio total e ionizado
♦ Nitrógeno ureico y creatinina en sangre elevados (asociado con insuficiencia renal leve)
Ante la sospecha clínica de coma mixedematoso, se debe iniciar el tratamiento sin esperar los resultados de laboratorio.
Antes de iniciar reemplazo hormonal con levotiroxina se debe dar glucocorticoides.
Inicie el tratamiento basándose únicamente en la sospecha clínica, sin retrasar los resultados de las pruebas de laboratorio.
Ingrese al paciente en la unidad de cuidados intensivos para monitoreo y apoyo continuo pulmonar y cardiovascular.

Se necesitan cuidados de apoyo urgentes para controlar la hipoventilación y la hipotermia.
Proporcione reposición de líquidos según sea necesario para pacientes con hiponatremia y / o hipoglucemia.
Iniciar tratamiento empírico inmediato con glucocorticoides con hidrocortisona 50 - 100 mg IV
Una vez que haya comenzado la cobertura de glucocorticoides, administre la terapia de hormona tiroidea con levotiroxina (LT4)
♦ Una dosis de carga es de 200 a 400 mcg IV, seguida de una dosis de reemplazo del 75% de 1,6 mcg / kg / día IV.
♦ Use dosis más bajas para pacientes más pequeños o mayores y aquellos con antecedentes de enfermedad de las arterias coronarias o arritmia.
Considere agregar liotironina (LT3) a LT4
♦ Una dosis de carga es de 5-20 mcg IV, seguida de una dosis de mantenimiento de 2.5-10 mcg cada 8 horas hasta que el paciente mejore claramente.
♦ Use dosis más bajas para pacientes más pequeños o mayores y aquellos con antecedentes de enfermedad de las arterias coronarias o arritmia.
♦ Evite dosis altas debido a una asociación reportada de triyodotironina (T3) sérica alta con mortalidad.
La tirotoxicosis es un estado clínico caracterizado por niveles excesivos de hormona tiroidea. El hipertiroidismo es una forma de tirotoxicosis resultante de una síntesis y secreción inadecuadamente altas de hormona tiroidea por la glándula tiroides. Las causas más comunes de hipertiroidismo son la enfermedad de Graves, el bocio multinodular tóxico y el adenoma tiroideo tóxico.
Hipertiroidismo manifiesto
♦ ↓ TSH con ↑ T4 y/o T3
♦ Los pacientes suelen experimentar síntomas de tirotoxicosis. Hipertiroidismo subclínico
♦ ↓ TSH con T4 y T3 normales
♦ Los pacientes normalmente son asintomáticos o levemente sintomáticos. Puede progresar a un hipertiroidismo manifiesto.
Sexo: ♀ > ♂ (5: 1)
Rango de edad en el momento de la presentación
♦ Enfermedad de Graves: 20-30 años de edad
♦ Adenoma tóxico: 30-50 años
♦ Bocio Multinodular tóxico: pico de incidencia > 50 años
La causa más frecuente de hipertiroidismo es autoinmune y es la enfermedad de Graves Basedow con TSH bajo o indetectable y T3 siempre alto y T4 normal o alto.
Glándula tiroides hiperfuncionante
♦ Enfermedad de Graves (∼ 60 a 80% de los casos)
♦ Bocio Multinodular Toxico tóxico (∼ 15-20% de los casos)

♦ Adenoma tóxico (3-5% de los casos)
♦ Adenoma hipofisario secretor de TSH (adenoma tirotropo)
♦ Hipertiroidismo mediado por β-hCG (mola hidatiforme, coriocarcinoma)
Destrucción de la glándula tiroides.
♦ Tiroiditis
♦ Tiroiditis granulomatosa subaguda (tiroiditis de Quervain)
♦ Tiroiditis linfocítica subaguda (Tiroiditis posparto)
♦ Tiroiditis inducida por fármacos (Amiodarona, litio)
♦ Tiroiditis inducida por contraste (fenómeno de Jod-Basedow)
♦ Hashitoxicosis
♦ Tiroiditis por radiación
♦ Tiroiditis por palpación: debido a la manipulación de la glándula tiroides durante la cirugía de paratiroides.
Tirotoxicosis exógena
Ectópico (extratiroidea)
♦ Teratoma de ovarios
♦ Carcinoma folicular de tiroides metastásico
En su clínica el hipertiroidismo prevalece efectos adrenérgicos como taquicardia, sudoración profusa, ansiedad, intolerancia al calor y elevación de la temperatura.
Sospeche tirotoxicosis en pacientes con síntomas característicos como intolerancia al calor, aumento de la sudoración, palpitaciones, pérdida de peso a pesar del aumento del apetito, fatiga, temblores finos, ansiedad o falta de concentración.
General (ENARM 2001)
♦ Intolerancia al calor
♦ Sudoración excesiva debido al aumento del flujo sanguíneo cutáneo.
♦ Pérdida de peso a pesar del aumento del apetito
♦ Evacuaciones intestinales frecuentes (debido a la hipermotilidad intestinal)
♦ Debilidad, fatiga
♦ Onicolisis
♦ Dermopatía infiltrativa, especialmente en la zona Pre-tibial (mixedema Pre-tibial)
Ojos
♦ Retracción palpebral
♦ “Mirada fija”
♦ Oftalmopatía de Graves (exoftalmos, edema del tejido periorbitario)
Bocio
♦ Bocio difuso, liso, no doloroso; soplo a menudo audible
Cardiovascular (ENARM 2009 – B)
♦ Taquicardia
♦ Palpitaciones, pulso irregular (debido a fibrilación auricular/latidos ectópicos)
♦ Hipertensión con aumento de la presión del pulso
♦ Sistólica presión se incrementa
Musculoesquelético
♦ Fino temblor de los dedos extendidos
♦ Miopatía hipertiroidea
♦ Los músculos proximales se ven afectados predominantemente

Endocrinológico
♦ Insuficiencia cardíaca inducida por tirotoxicosis; disnea de esfuerzo
♦ Anormales del corazón ritmos, incluyendo la fibrilación auricular
♦ Dolor de pecho
♦ Los niveles séricos de creatina quinasa suelen ser normales
♦ Osteopatía: osteoporosis por efecto directo de T3 sobre la resorción ósea osteoclástica
♦ Mujeres: oligo/amenorrea, infertilidad anovulatoria, hemorragia uterina disfuncional
♦ Hombres: ginecomastia, disminución de la libido, infertilidad, disfunción eréctil
Sistema neuropsiquiátrico
♦ Ansiedad
♦ Inquietud
♦ Insomnio
Evaluación inicial
♦ Temblor (resultado del estado hiperadrenérgicos)
♦ Hiperreflexia
♦En pacientes sintomáticos o con signos de tirotoxicosis se mide la TSH sérica. Se mida la tiroxina libre (T4L), con o sin triyodotironina total (TT3), si la TSH es baja. (ENARM 2021 – B) (ESSALUD 2011)
♦ La TSH normal o alta prácticamente excluye el diagnostico
♦ La TSH baja sugiere tirotoxicosis, pero también se puede observar con enfermedades no tiroideas, uso de ciertos medicamentos (como levotiroxina, amiodarona o litio) o en el primer trimestre del embarazo.
♦ T4L elevado confirma tirotoxicosis.
♦ Si la TSH es baja y la T4L es normal, verifique TT3 para evaluar la tirotoxicosis T3.
♦ T4L y T3L normales con TSH baja sugieren hipertiroidismo subclínico, error de laboratorio, enfermedad hipotalámica o pituitaria, enfermedad no tiroidea o efectos de medicamentos.
♦ Si la etiología de la tirotoxicosis aún es incierta en pacientes no embarazadas, realice una captación de yodo radiactivo para aclarar las diferentes causas.
♦ Diagnosticar la enfermedad de Graves en pacientes con hallazgos clínicos característicos como tiroides agrandada simétricamente y exoftalmos
♦ Considere medir los anticuerpos del receptor de TSH (TSI) si la etiología aún no está clara después de la gammagrafía tiroidea.
Gammagrafía de tiroides con medicina nuclear y medición de la captación de yodo radiactivo
♦ Indicaciones
♦ Para la mayoría de los pacientes con una etiología incierta de tirotoxicosis después de la evaluación inicial
♦ Identificación de tejido tiroideo ectópico
♦ Evaluación de bocios retroesternales
♦ Contraindicaciones: mujeres embarazadas o en período de lactancia
El control de los síntomas de la tirotoxicosis es con Beta bloqueadores, se debe dar antitiroideos siendo el metimazol el más efectivo y el tratamiento definitivo si fracasa el medico con ablación por radioterapia o cirugía.
Terapia sintomática para la tirotoxicosis
Tratamiento de los síntomas hiperadrenérgicos con Beta bloqueadores (1° línea) para aliviar los síntomas de taquicardia, temblores y ansiedad.
Primera línea: propranolol
Alternativas: atenolol o metoprolol

Tirotoxicosis severa o tormenta tiroidea tratada en UCI: esmolol
Si existen contraindicaciones para los betabloqueantes, como: Asma grave, fenómeno de Raynaud, considere BCC no dihidropiridínicos: verapamilo o diltiazem.
Tratamiento definitivo para el hipertiroidismo y la tirotoxicosis
Fármacos antitiroideos para la tirotoxicosis
♦ Tormenta tiroidea: manejo inicial, así como la prevención en pacientes de riesgo antes de la cirugía o RAIA
♦ Enfermedad de Graves: pacientes con alta probabilidad de remisión y/o oftalmopatía de Graves activa de moderada a grave
♦ Contraindicaciones tanto para RAIA como para cirugía
– Otros: hipertiroidismo durante el embarazo, esperanza de vida limitada, preferencia del paciente
♦ Medicamento
– La mayoría de los pacientes: metimazol
– Tormenta tiroidea o 1° trimestre del embarazo: propiltiouracilo (ENARM 2002).
Ablación con yodo radiactivo (ENARM 2009 – A)
♦ Destrucción del tejido tiroideo a través de yodo radiactivo (yodo -131) a través de un simportador de sodio/yodo
♦ El yodo radiactivo -131 emite rayos gamma y beta.
♦ Rayos gamma: efecto diagnóstico
♦ Rayos beta: efecto terapéutico
♦ Indicaciones
Bocio multinodular tóxico y adenoma tóxico con alta captación nodular de yodo radiactivo
– No lograr el eutiroidismo con fármacos antitiroideos en enfermedad de Graves
Alto riesgo quirúrgico por comorbilidades o cirugía previa o radiación del cuello
– Esperanza de vida limitada
– Otros: parálisis periódica tirotóxica
♦ Contraindicaciones
– Mujeres embarazadas o en período de lactancia
Los niños <5 años
– Tratamiento inicial de una neoplasia maligna tiroidea confirmada o sospechada
Oftalmopatía de Graves moderada a grave
♦ Procedimiento: dosis oral única de yodo -131 → captación de isótopos por la glándula tiroides → emisión de radiación beta que destruye lentamente el tejido tiroideo
♦ Complicaciones
Tempranas
• La mayoría de los pacientes con enfermedad de Graves se vuelven hipotiroideos después de RAIA y requieren reemplazo de hormona tiroidea de por vida
• Náuseas y vómitos.
• Sialoadenitis
Cirugía de tiroides
♦ Indicaciones
Bocios grandes (≥ 80 g) o síntomas obstructivos
– Neoplasia maligna tiroidea confirmada o sospechada
– Enfermedad de Graves con:
• Hiperparatiroidismo primario concomitante o parálisis periódica
• Oftalmopatía de Graves activa de moderada a grave
– Bocio multinodular tóxico o adenoma tóxico con: hiperparatiroidismo primario concomitante, RAIA insuficiente o extensión retroesternal
• Otros: pérdida transitoria del gusto u olfato, estomatitis, supresión transitoria de la médula ósea
– Tardías
• Tiroiditis inducida por radiación
• Neoplasia maligna secundaria o leucemia
• Sequedad de boca (xerostomía)
– Otro: nódulos tiroideos grandes, tirotoxicosis refractaria inducida por amiodarona, embarazo planificado en los próximos 6 meses o preferencia del paciente
♦ Contraindicaciones
Comorbilidades graves que influyen en el riesgo quirúrgico, embarazo
♦ Procedimiento
Enfermedad de Graves o Bocio multinodular tóxico: tiroidectomía casi total o total (ENARM 2016 -A)
– Adenoma tóxico aislado: lobectomía
Tionamidas (Metimazol y PTU)

Probabilidad de remisión permanente.
Algunos pacientes evitan el hipotiroidismo permanente. Menor costo inicial.
Radioyodo Resolución permanente del hipertiroidismo.
Efectos secundarios menores - Erupción, urticaria, artralgias, granulocitopenia transitoria, síntomas gastrointestinales. Efectos secundarios graves - Agranulocitosis, vasculitis (Lupuslike), hepatitis. Riesgo de bocio fetal, hipotiroidismo y defectos congénitos si está embarazada
Hipotiroidismo permanente. Precauciones de radiación durante varios días pequeños y mujeres embarazadas. Desarrollo o empeoramiento de la oftalmopatía de Graves Tiroiditis.
Cirugía Cura rápida y permanente del hipertiroidismo
Hipotiroidismo permanente. Riesgos de hipoparatiroidismo iatrogénico y daño recurrente en los nervios laríngeos (ESSALUD 2010)
Riesgos asociados con la anestesia general. Alto riesgo.
La enfermedad de Graves es un trastorno autoinmunitario caracterizado por manifestaciones tiroideas (hipertiroidismo y bocio) y extra tiroideas (orbitopatía de Graves [Oftalmopatía de Graves], mixedema Pre-tibial y acropaquía de Graves).

Sexo: ♀ > ♂ (8: 1)
La presentación clínica de los pacientes con enfermedad de Grave varía según la edad de aparición, la gravedad y la duración del hipertiroidismo, el sexo y las comorbilidades. Los pacientes suelen presentar síntomas y signos de ≥ 1 de:

Hipertiroidismo, como palpitaciones, temblores, pérdida de peso o sudoración
Bocio, como agrandamiento difuso de la tiroides (con o sin frémito o soplo) y, en raras ocasiones, síntomas de obstrucción de las vías respiratorias superiores y del esófago que provocan sensación de globo, disfagia u ortopnea
Manifestaciones extra tiroideas de autoinmunidad subyacente que incluyen orbitopatía (puede presentarse con proptosis y retracción del párpado superior), dermopatía tiroidea (también denominada mixedema pretibial, caracterizada por engrosamiento nodular o difuso de la piel en el área pretibial) y, en raras ocasiones, acropaquía (caracterizada por hinchazón de tejidos blandos y acropaquías de dedos de manos y pies).
Tríada de la Enfermedad de Graves
♦ Bocio difuso, liso y uniformemente agrandado
♦ Oftalmopatía: Exoftalmos
♦ Dermopatía (mixedema pretibial): edema sin fóvea y placas firmes en la cara anterior / lateral de ambas piernas.

El diagnóstico de Graves Basedow es con clínica y confirmación con anticuerpos
Anti-TSH-R o TSI
(ENARM 2015 II – A, ENARM 2019 A).
Mejor prueba inicial: TSH ↓/indetectable y ↑ T3 / T4 Medir los anticuerpos tiroideos

♦ ↑ Ac - TR (específico)
♦ ↑ Anticuerpos anti-TPO y anticuerpos anti-Tg (inespecíficos)
Gammagrafía de tiroides
♦ Indicado si las Ac - TR son bajos para establecer diagnóstico
♦ Muestra una captación difusa de yodo radiactivo
♦ Contraindicado en el embarazo
Ecografía de tiroides (con Doppler color)
♦ Indicado en mujeres embarazadas si las Ac - TR son bajos
♦ Muestra una tiroides hipervascular agrandada
Betabloqueantes: control rápido de los síntomas del hipertiroidismo
Fármacos antitiroideos: tionamidas (Metimazol, propiltiouracilo)
♦ Objetivo: alcanzar el estado eutiroideo
♦ Los pacientes con un bocio pequeño e hipertiroidismo leve pueden experimentar una remisión con fármacos antitiroideos solos (en ∼ 50% de los casos).
♦ Una vez que se logra la remisión, disminuya lentamente y pare.
Ablación de yodo radiactivo
♦ Terapia de primera línea en pacientes no embarazadas con bocios pequeños
♦ Tratamiento de segunda línea en pacientes que recaen después de un tratamiento prolongado con fármacos antitiroideos
Cirugía: la tiroidectomía casi total rara vez se realiza en la enfermedad de Graves (ENARM 2015 II – B).
Complicaciones de la terapia
♦ Hipotiroidismo permanente después de la ablación o cirugía con yodo radiactivo → necesidad de terapia de reemplazo de tiroides de por vida
♦ Nueva aparición / exacerbación de la oftalmopatía de Graves después de la ablación con yodo radiactivo.
El manejo estándar de hipertiroidismo es cesar la tirotoxicosis sintomática con beta bloqueo siempre y antitiroideos siendo Metimazol de elección. El tratamiento definitivo es Quirurgico o ablación con RT y se aplica al año de no controlar (eutiroideo) o cuando hubo tormenta tiroidea.
La tormenta tiroidea (también llamada crisis tirotóxica) es una forma rara y potencialmente mortal de hipertiroidismo severo (tirotoxicosis).
La presentación clínica más común de la tormenta tiroidea incluye todo lo siguiente:
♦ Fiebre alta (a menudo entre 40 y 41 grados C)
♦ Taquicardia o fibrilación auricular
♦ Alteración del sistema nervioso central que varía de leve a grave (por ejemplo, temblor, agitación, confusión, delirio, obnubilación, estupor, coma)
♦ Síntomas gastrointestinales, como
Náusea – Vómitos severos
Diarrea
También son frecuentes la sudoración profusa, las palpitaciones, la disnea y el shock.
También pueden estar presentes signos oculares de hipertiroidismo, que incluyen:
♦ Mirar fijamente
♦ Retracción del párpado
♦ Retraso del parpado superior
Características clínicas
♦ Hiperpirexia con sudoración profusa

♦ Taquicardia (> 120/minuto) y arritmia (posiblemente grave: Fibrilación auricular), hipertensión con presión de pulso amplia, insuficiencia cardíaca congestiva
♦ Hipotensión / shock secundario a insuficiencia cardíaca de alto gasto o hipovolemia como resultado de pérdidas GI e insensibles
♦ Síntomas de la tirotoxicosis.
♦ dolor abdominal
♦ Náuseas intensas, vómitos, diarrea, posiblemente ictericia
♦ Severa agitación y la ansiedad, delirio y psicosis, convulsiones, estado de coma
Pruebas de función tiroidea
♦ TSH baja / indetectable, T3 / T4 libre elevada.
ECG para evaluar la fibrilación auricular
Perfil hepático para evaluar la evidencia de ictericia
La tormenta tiroidea tiene una alta tasa de mortalidad y los pacientes deben recibir un tratamiento agresivo para controlar las complicaciones y restaurar la función tiroidea normal.
Cuidados iniciales
Considerar ingreso a UCI para monitorización.
Iniciar un tratamiento sintomático para controlar la hipotensión, la hiperpirexia y la taquicardia.
Administrar medicamentos para reducir la síntesis y liberación de hormonas tiroideas e inhibir su acción periférica.
Identificar y tratar cualquier causa desencadenante.
Una vez que el paciente esté estable, iniciar la terapia definitiva para el hipertiroidismo y la tirotoxicosis.
Considerar la plasmaféresis o la cirugía de emergencia como tratamiento que salve la vida de los casos refractarios raros.
Tratamiento sintomático
Síntomas hiperadrenérgicos: los betabloqueantes son de 1° línea
Preferido: propranolol, debido a los efectos combinados de betabloqueante y antitiroideo
Alternativas
Insuficiencia cardíaca preexistente: esmolol
Enfermedad obstructiva leve de las vías respiratorias / asma estable: atenolol o metoprolol

Contraindicaciones de los betabloqueantes: considere los BCC (Diltiazem)
Hipertermia
♦ Medios físicos para bajar la temperatura corporal
♦ Antipiréticos, p. Ej., Acetaminofén
Hipotensión e hipovolemia: reanimación con líquidos para tratar pérdidas gastrointestinales e insensibles
Reposición de electrolitos si hay alteración
La secuencia de tratamiento incluye 5 medidas: Hidratación, Beta bloqueo, Antitiroideo, Yodo elemental y Corticoide (Dexametasona) (ENARM 2004).
Fármacos antitiroideos en la tormenta tiroidea
♦ Inhibición de la síntesis de hormonas tiroideas.
– Primera línea: propiltiouracilo
Alternativa: metimazol
♦ Inhibición de la liberación de hormona tiroidea (a través del efecto Wolff-Chaikoff)
– Primera línea: soluciones de yodo administradas al menos 1 hora después de los fármacos antitiroideos
• Solución de yodo de potasio
• Solución de Lugol
En pacientes con alergia al yodo o tirotoxicosis inducida por yodo, se puede utilizar litio.
♦ Inhibición de la conversión periférica de T4 en T3
– Propranolol
– Glucocorticoides: también pueden tratar la insuficiencia suprarrenal concurrente
• Primera línea: hidrocortisona
• Alternativa: dexametasona
Cuadro de inflamación tiroidea que produce hiperfunción inicial por liberación hormonal y no hiperproducción, luego hipofunción secuencial asociado en ese periodo de marcadores de inflación altos. Pueden ser
♦ Tiroiditis Dolorosas
♦ Tiroiditis No dolorosas
Definición: se refiere a los bocios dolorosos asociados a cuadros definidos (ver cuadro).
Tiroiditis Subaguda
Tiroiditis infecciosa
Tiroiditis inducida por radiación o por Radioyodo (ENARM 2021 – A)
Tiroiditis inducida por palpación o trauma
Tabla 8. Tiroiditis dolorosas
Definición
Tiroiditis subaguda granulomatosa
Tiroiditis subaguda no supurativa
Tiroiditis de Quervain
Tiroiditis aguda o crónica
La tiroiditis subaguda es una enfermedad inflamatoria rara y autolimitada de la glándula tiroides caracterizada por dolor en la parte anterior del cuello, niveles anormales de hormona estimulante de la tiroides y baja captación de yodo-123 en la gammagrafía tiroidea.
Epidemiología
Sexo: ♀ > ♂ (3:1)
Pico de incidencia: 30–50 años
Etiología
Se desconoce la causa definitiva de la tiroiditis subaguda.
Las infecciones virales del tracto respiratorio superior están ampliamente implicadas; sin embargo, no se ha demostrado que un solo agente viral esté directamente involucrado (ENARM 2022 - A).
El antígeno leucocitario humano (HLA) -B35 puede conferir susceptibilidad a infecciones virales y, posteriormente, puede resultar en la progresión a tiroiditis subaguda.
El curso clínico de la enfermedad en la mayoría de los pacientes incluye la fase hipertiroidea, la fase hipotiroidea y la fase eutiroidea posterior.
El cuadro inicia con dolor faríngeo y luego hay dolor en el cuello, clínica de tirotoxicosis a lo cual sobreviene semanas después hipotiroidismo.
La inflamación de la glándula tiroides se manifiesta con una respuesta trifásica. La duración de cada fase puede variar:
Fase tirotóxica
♦ Dura de 2 a 8 semanas
♦ Causado por daño a las células foliculares y la liberación de coloide preformado (hormonas tiroideas almacenadas)
Fase hipotiroidea
♦ Suele durar de 2 a 8 semanas; permanente en aproximadamente el 15% de las personas con tiroiditis granulomatosa subaguda
♦ Causado por el agotamiento del coloide preformado y la síntesis alterada de nuevas hormonas tiroideas como resultado del daño a las células foliculares
Fase eutiroidea: la función tiroidea se recupera y los cambios patológicos ya no son visibles en la glándula tiroides.
Tiroiditis granulomatosa subaguda (tiroiditis de De Quervain) (ENARM 2014 II -B)

♦ Posible historial de infecciones del tracto respiratorio superior unas semanas antes del inicio de la tiroiditis subaguda
♦ Bocio doloroso, difuso y firme, dolor de mandíbula
♦ Puede haber fiebre y/o malestar.
La enfermedad es autolimitada, pero pueden experimentar recaídas y el hipotiroidismo ser permanente ocurre en ∼ 15% de los casos.
Los fármacos antitiroideos no deben administrarse en la fase tirotóxica de la tiroiditis subaguda.
La clínica clásica de bocio doloroso posfaringitis con clínica de tirotoxicosis primero y después de hipotiroidismo pensamos siempre primero en Tiroiditis subaguda tipo Quervain.
♦ Características del hipertiroidismo seguidas de características del hipotiroidismo
Tiroiditis linfocítica subaguda
♦ Bocio indoloro, difuso y firme (el tamaño de la tiroides puede ser normal)
♦ Características del hipertiroidismo seguidas de características del hipotiroidismo
Tratamiento
Fase tirotóxica
♦ Betabloqueantes para controlar los síntomas del hipertiroidismo (es decir, palpitaciones y/o ansiedad).
♦ AINEs: control del dolor en caso de tiroiditis granulomatosa aguda
♦ Ocasionalmente, corticosteroides (prednisolona)
♦ No se deben administrar fármacos antitiroideos (Metimazol).
Fase hipotiroidea: levotiroxina

La tiroiditis aguda es un proceso infeccioso agudo con compromiso general y mortalidad que requiere antibióticos sistémicos y es Staphylococcus aureus la causa más frecuente.

La tiroiditis indolora siempre pensar en Medicamentos como Amiodarona y Litio, y crónica es la clásica Hashimoto.
Definición
La tiroiditis infecciosa aguda (supurativa) es una infección en la glándula tiroides que da como resultado un absceso y un tipo de tiroiditis aguda potencialmente mortal que debe tratarse como una emergencia médica.
La mayoría de los pacientes con tiroiditis infecciosa aguda son eutiroideos al momento de la presentación, pero algunos pacientes pueden tener hiper o hipotiroidismo según el grado de destrucción de la glándula tiroides (ENARM 2022 - B)
Definición
La tiroiditis indolora (silenciosa) es una forma de tiroiditis destructiva que clásicamente se presenta con un curso trifásico (fase tirotóxica, fase hipotiroidea y luego fase eutiroidea), sin dolor de cuello, pródromo o recuento elevado de glóbulos blancos, velocidad de sedimentación globular o C -proteína reactiva.
Tiroiditis silenciosa
Tiroiditis indolora
Tiroiditis linfocítica con hipertiroidismo resuelto espontáneamente
Tiroiditis linfocítica subaguda
Posparto que ocurre Tiroiditis posparto Asociado con drogas Interferón alfa Interleucina-2 litio
Inhibidores de la tirosina quinasa Inmunoterapia inhibitoria de punto de control
Tiroiditis linfocítica crónica Tiroiditis de Hashimoto
Exacerbación posparto Tiroiditis posparto
Tiroiditis asociada a la amiodarona. (ENARM 2017 – B, ENARM 2010 – A)
Tiroiditis fibrosa
Tiroiditis de Riedel
Tiroiditis invasiva
Un nódulo tiroideo es una lesión discreta en la glándula tiroides que es radiológicamente distinta del tejido tiroideo normal circundante.
Los nódulos tiroideos suelen ser ubicados incidentalmente por imágenes o examen y el 90% son benignos.
Los nódulos tiroideos se detectan en hasta un 50% -65% de las personas sanas. Son 4 veces más comunes en mujeres que en hombres y ocurren con mayor frecuencia con la edad.
La mayoría de los nódulos tiroideos son asintomáticos. Los nódulos palpables a menudo se descubren en el examen físico, y los nódulos no palpables con frecuencia se detectan de manera incidental en estudios de imágenes realizados por razones no relacionadas.
Los nódulos tiroideos pueden ser causados por lesiones tanto benignas (alrededor del 90%) como malignas (alrededor del 10%). Los factores de riesgo de malignidad incluyen antecedentes familiares de cáncer de tiroides y antecedentes de radiación.
Los pacientes sintomáticos pueden quejarse de síntomas relacionados con el hipertiroidismo o el hipotiroidismo (en aproximadamente el 5% de los casos), síntomas compresivos (en aproximadamente el 5% de los casos) o problemas estéticos.
Sexo: ♀ > ♂ (4: 1)
Incidencia: aumenta con la edad
Distribución geográfica: más común en las regiones sin programas de enriquecimiento con yodo, donde el contenido de yodo en los alimentos y el agua es bajo
Además de las señales de alerta para el cáncer de tiroides, un nódulo sólido en la ecografía de la tiroides o un nódulo frío en la gammagrafía tiroidea deben suscitar sospechas de cáncer de tiroides.
Nódulos tiroideos benignos (∼ 95% de los casos)
♦ Adenomas de tiroides
♦ Adenoma folicular (más común)
♦ Adenoma de células de Hürthle
♦ Adenoma tóxico

Nódulos tiroideos malignos (∼ 5% de los casos)
♦ Tipos
Carcinoma de tiroides
– Linfoma de tiroides
♦ Adenoma papilar (menos común)
♦ Quistes de tiroides
♦ Nódulos dominantes de bocios multinodulares
♦ Tiroiditis de Hashimoto
– Cáncer metastásico de mama / carcinoma renal (raro)
♦ Señales de alerta para el cáncer de tiroides
– Sexo masculino
Edad: <14 años o > 70 años
– Historial de radiación en la cabeza o el cuello.
Historia familiar de: Sd de MEN2, Cáncer de tiroides diferenciado, Síndrome de Gardner
– Crecimiento rápido del nódulo tiroideo
Aparición reciente de ronquera persistente, disfagia o disnea
– Nódulo firme o duro
– Nódulo fijo
Linfoadenopatía cervical
Todos los nódulos tiroideos (incluidos los Incidentalomas tiroideos) deben evaluarse en busca de malignidad.
Pruebas iniciales en todos los pacientes

Niveles de TSH y ecografía tiroidea
Pruebas posteriores
Gammagrafía tiroidea para pacientes con TSH baja
♦ Citología si la ecografía muestra indicaciones de PAAF en nódulos tiroideos
Exámenes adicionales
Evaluación diagnóstica de hipertiroidismo o hipotiroidismo (p. Ej., FT4, T3 total, anticuerpos tiroideos)
Marcadores tumorales de cáncer de tiroides (Calcitonina sérica por sospecha de carcinoma medular)
Evaluación inicial de un paciente con un nódulo tiroideo
NÓDULO TIROIDEO CLÍNICO O INCIDENTAL
TSH, Ecografía Tiroides
TSH, nor mal o TSH subnor mal
Gamma Tiroidea
Ver T4L, T3 Tiene criterios para BAAF?
SÍ NO
Nódulo No funcional Nódulo funcional Hipertiroidismo Subclínico
BAAF Monitoreo Monitoreo
Hipertiroidismo y algunos casos de subclínico
Observación Tratamiento
La ecografía de tiroides no es una prueba de detección para la población en general. Está indicado como prueba inicial para pacientes con nódulos tiroideos palpables o sospecha clínica de malignidad tiroidea.
Visión general Patrón de riesgo Hallazgos ecográficos
Signos ecográficos de malignidad tiroidea
Signos ecográficos de nódulos tiroideos benignos
Alto riesgo
Sólido hipoecoica nódulo o sólido hipoecoica componente con al menos una de las siguientes: Márgenes irregulares Forma más alta que ancha Microcalcificaciones Calcificaciones del borde con tejido extruido Extensión extra tiroidea Riesgo intermedio Nódulo sólido hipoecoicos sin características de alto riesgo

Riesgo bajo
Nódulo sólido isoecoico o hiperecoico Nódulo quístico con componente sólido excéntrico Muy bajo riesgo Nódulo parcialmente quístico
Benigno Nódulos quísticos (anecoicos) sin componente sólido
Los nódulos sólidos, hipoecoicos con márgenes irregulares, microcalcificaciones, forma más alta que ancha, crecimiento extra tiroideo y / o linfoadenopatía cervical deben hacer sospechar una malignidad y requieren una evaluación adicional con Biopsia por PAAF. La malignidad es rara en los nódulos hiperfuncionantes (calientes).
Si se realiza una gammagrafía tiroidea, se deben utilizar las características ecográficas de los nódulos tiroideos para determinar qué nódulos fríos requieren PAAF. Los nódulos fríos con un aspecto benigno en la ecografía tiroidea no requieren de manera rutinaria PAAF.
Que el examen de mayor rendimiento, definitivo para el diagnóstico es la Biopsia por punción con aguja fina (BAAF o PAAF) (ENARM 2015 II – A, ENARM 2006 – A, ENARM 2019 A, ENARM 2018).
Citología por aspiración con aguja fina (PAAF)
Clase de bethesda Categoría de diagnóstico Riesgo de cáncer
I No diagnóstico (insatisfactorio) 5 a 10%
II Benigno 0 a 3%
III Atipia de significado indeterminado (AUS) o lesión folicular de importancia indeterminada (FLUS) 10 a 30%
IV Neoplasia folicular (o sospechosa de neoplasia folicular)
V Sospechoso por malignidad
25 a 40%
50 a 75%
VI Maligno 97 a 99%
Tabla 11. Categorías de diagnóstico del sistema de bethesda para reportar citopatología tiroidea
Sexo
♦ Carcinoma diferenciado (papilar y folicular): ♀ > ♂ (3: 1)
♦ Carcinoma pobremente diferenciado (medular y anaplásico): ♀ ≈ ♂
Etiología
El carcinoma papilar es el más frecuente entre 80 y 90% de todos los casos y de buen pronóstico, asociado a exposición a radiación en la infancia.
Factores genéticos
♦ Carcinoma medular: asociado con MEN2 (mutaciones del gen RET) o carcinoma medular familiar
♦ Carcinoma papilar: asociado con reordenamientos de RET/PTC y mutaciones BRAF
♦ Carcinoma folicular: asociado con reordenamiento PAX8-PPAR-γ y mutación RAS
♦ Carcinoma indiferenciado/anaplásico: asociado con la mutación TP53 Radiación ionizante (particularmente durante la infancia): principalmente asociado con carcinoma papilar
Carcinoma papilar de tiroides
Tiroidocitos
Células parafoliculares (células C)
Carcinoma folicular de tiroides
Carcinoma anaplásico de tiroides
Bien diferenciado
El tipo más común de cáncer de tiroides (ENARM 2001)
Ganglios linfáticos palpables debido a diseminación metastásica (a menudo detectados antes del tumor primario)
Puede ser multifocal

Muy buen pronóstico (ENARM 2013 – A, ENARM 2018)
Metástasis hematógena especialmente para Pulmones, (ENARM 2017 – A)
Hueso (lesiones líticas)
Rara vez multifocal
Invasión vascular y capsular
Buen pronóstico
Crecimiento local rápido
Síntomas de compresión de las estructuras del cuello (p. Ej. Disfagia, disnea)
Metástasis linfática y hematógena
Pronóstico muy malo
∼ 80% de los casos 30-50 años
∼ 10% de los casos 40-60 años
∼ 1-2% de los casos Después de 60 años
Pobremente diferenciado
A veces, una predisposición genética
→ neoplasia endocrina múltiple tipo 2 (MEN2) (25% de los carcinomas medulares)
Carcinoma medular
Esporádico (75% de los carcinomas medulares)
Produce calcitonina
Diarrea y enrojecimiento facial
<10% de los casos 50-60 años
Los nódulos que parecen hipoecogénico en la ecografía tiroidea y fríos en la gammagrafía tiroidea deben aumentar la sospecha de malignidad.
La elevación de los marcadores tumorales después de la tiroidectomía total o RAIA indica enfermedad persistente, recurrencia o metástasis.
♦ Carcinoma de células de Hürthle
– 3 a 10% de todos los cánceres de tiroides bien diferenciados
A menudo clasificado como subtipo de carcinoma folicular
– Tiroides (histopatología): hipercelularidad con un predominio de células de Hürthle (grande, poligonal epitelial células con citoplasma granular eosinofílica con citoplasma alterado como resultado de numerosas mitocondrias)
Las células de Hürthle son inespecíficas y también se observan en la tiroiditis de Hashimoto, la enfermedad de Graves, las glándulas tiroideas previamente irradiadas y en el adenoma de células de Hürthle (sin invasión vascular o capsular; sin metástasis)
También se encuentran en las glándulas paratiroides, glándulas salivales y riñones.
♦ Linfoma de células B: generalmente se desarrolla a partir de tiroiditis de Hashimoto.
♦ Sarcoma: raro
♦ Metastásico (p. Ej., Mama, renal, melanoma): raro
La terapia de supresión de RAIA y TSH no es útil en el tratamiento del carcinoma medular o el cáncer de tiroides anaplásico.
Cáncer de tiroides bien diferenciado
♦ Manejo estándar (independientemente de metástasis ganglionares o distantes): tiroidectomía total (con disección del cuello según sea necesario) + terapia de supresión de RAIA + TSH
♦ Cánceres pequeños sin metástasis ganglionares o distantes: considere la terapia de hemitiroidectomía + supresión de TSH.
Cáncer de tiroides poco diferenciado
♦ Carcinoma medular: tiroidectomía total + disección del cuello ± radioterapia y/o quimioterapia sistémica según sea necesario.
♦ Carcinoma anaplásico
– Cáncer resecable: tiroidectomía total + disección de cuello + radio quimioterapia

Cáncer irresecable o metastásico: cuidados paliativos
♦ Cáncer de tiroides bien diferenciado
Ablación con yodo radiactivo (RAIA): se realiza entre 4 y 6 semanas después de la tiroidectomía total para destruir el tejido tiroideo restante o las metástasis
– Terapia de supresión de TSH:
Administración de L-tiroxina para suprimir la TSH sérica a niveles subnormales para minimizar el riesgo de recurrencia del
tumor – Administrado después de la finalización de RAIA en pacientes que se han sometido a tiroidectomía total
La L-tiroxina también sirve como terapia de reemplazo hormonal después de la cirugía y RAIA.
♦ Cáncer de tiroides pobremente diferenciado: radioterapia adyuvante y/o quimioterapia según sea necesario
La glándula suprarrenal es un órgano par retroperitoneal ubicado en el polo superior de cada riñón
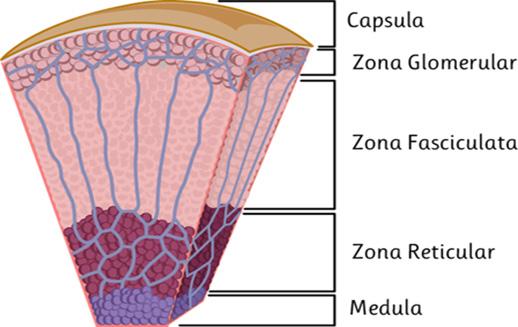
Descripción: una glándula endocrina bilateral compuesta por una corteza externa que produce hormonas esteroides y una médula interna que produce catecolaminas (p. ej., epinefrina).
El cortisol inhibe la secreción de CRH y ACTH a través de retroalimentación negativa, lo que, a su vez, da como resultado una disminución de la secreción de cortisol.
Función
♦ Corteza suprarrenal: producción de hormonas esteroides (mineralocorticoides, glucocorticoides y andrógenos)
♦ Médula suprarrenal: producción de catecolaminas (epinefrina, norepinefrina)
Hormonas de la corteza suprarrenal.
♦ La síntesis de todas las hormonas esteroides comienza con la molécula precursora común, el colesterol, que se convierte en pregnenolona a través del colesterol desmolasa
Características Aldosterona Cortisol Dehidroepiandrosterona (DHEA)
Clase de hormonas Mineralocorticoide Glucocorticoide Andrógino
Sitio de producción Zona glomerulosa (ESSALUD 2018)
Función
Regulación de la presión arterial: influye en la reabsorción renal de sodio y agua y en la excreción de potasio.
Homeostasis de electrolitos
Regulación de la secreción Sistema renina-angiotensinaaldosterona (SRAA)
Trastornos asociados
Hiperaldosteronismo primario Insuficiencia suprarrenal Hiperplasia suprarrenal congénita
Zona fasciculada (ENARM 2020-B) Zona reticularis
Movilización de reservas energéticas Inmunosupresión Antiinflamatorio
Sustrato en la síntesis de estrógenos y testosterona.
CRH → ↑ secreción de ACTH en la glándula pituitaria → ↑ secreción de glucocorticoides y andrógenos en la corteza suprarrenal
síndrome de Cushing
Insuficiencia suprarrenal
Hiperplasia suprarrenal congénita
Insuficiencia suprarrenal
Hiperplasia suprarrenal congénita
La insuficiencia suprarrenal es un síndrome clínico potencialmente mortal causado por insuficiencia adrenocortical primaria o enfermedad suprarrenal secundaria debido al deterioro del eje hipotalámico-pituitario-adrenal que da como resultado una producción o acción deficiente de glucocorticoides, con o sin deficiencia concurrente de mineralocorticoides y andrógenos suprarrenales.
Tenemos 3 cuadros bien definidos:
♦ 1. La insuficiencia suprarrenal primaria (también llamada enfermedad de Addison) se debe a una insuficiencia adrenocortical (ENARM 2010 – B)
♦ 2. La insuficiencia suprarrenal central se debe a una alteración de la regulación suprarrenal por parte de la glándula pituitaria (en la enfermedad secundaria) o el hipotálamo (en la enfermedad terciaria).
♦ 3. La insuficiencia suprarrenal relacionada con enfermedades críticas es una insuficiencia relativa, en la que la producción de cortisol es inadecuada para controlar la respuesta inflamatoria o para satisfacer una demanda metabólica elevada.
La insuficiencia suprarrenal es una falla de las glándulas suprarrenales para producir cantidades adecuadas de hormonas adrenocorticales. Puede ser primario, secundario o terciario.
La ISR del paciente critico es de tipo funcional y no es por déficit de cortisol si no por aclaramiento rápido y no ser suficiente para el proceso por lo que se requiere manejo como crisis adrenal, ejemplo Sepsis severa y Shock séptico
Causada por la destrucción abrupta de la glándula suprarrenal (insuficiencia suprarrenal aguda; p. Ej. Debido a una hemorragia suprarrenal masiva) o por su destrucción o atrofia progresiva y gradual (insuficiencia suprarrenal crónica; p. Ej., Debido a enfermedades autoinmunes, infección).
Adrenalitis autoinmune
♦ Causa más común en los EE UU.
♦ Asociado con otros endocrinopatías autoinmunes

Adrenalitis infecciosa
♦ Tuberculosis: la causa más común en todo el mundo
♦ Enfermedad por CMV en estados inmunodeprimidos (especialmente SIDA)
♦ Histoplasmosis
Hemorragia suprarrenal
♦ Sepsis meningocócica (shock endotóxico) → necrosis hemorrágica (síndrome de WaterhouseFriderichsen)
♦ Coagulación intravascular diseminada (CID)
Infiltración de las glándulas suprarrenales.
♦ Tumores
♦ Amilosis
♦ Hemocromatosis
Suprarrenalectomía
Actividad alterada de las enzimas responsables de la síntesis de cortisol.
♦ Inhibidores de la síntesis de cortisol
♦ Deficiencia de 21β-hidroxilasa
Deficiencia de vitamina B5
Causada por afecciones que disminuyen la producción de ACTH
La interrupción repentina de la terapia crónica con glucocorticoides o stress (por ejemplo, infección, trauma, cirugía) durante una prolongada terapia de glucocorticoides
♦ Supresión iatrogénica prolongada del eje hipotalámico-pituitario-suprarrenal
♦ Deterioro de la producción de cortisol endógeno además de la interrupción del tratamiento con esteroides, disminución de la dosis o aumento de la necesidad (p. Ej., Estrés) → deficiencia aguda de glucocorticoides
Hipopituitarismo
Causada por condiciones que disminuyen la producción de CRH. La causa más común es la interrupción repentina de la terapia crónica con glucocorticoides. Las causas más raras incluyen disfunción hipotalámica (p. Ej., Debido a traumatismo, masa, hemorragia o anorexia): ↓ CRH → ↓ ACTH → ↓ liberación de cortisol

El diagnóstico de insuficiencia suprarrenal se basa en niveles bajos de cortisol basal cuando hay síntomas y signos sugestivos, y / o en la prueba de estimulación post-adrenocorticotropina (ACTH) en los niveles séricos de cortisol en cualquier momento.
La insuficiencia suprarrenal puede presentarse de forma aguda con hipotensión o depleción de volumen (crisis suprarrenal), o con un inicio lento de síntomas inespecíficos.
Si se sospecha de insuficiencia suprarrenal aguda, comience el tratamiento inmediatamente (antes de que los resultados de las pruebas de diagnóstico estén disponibles).
Realizar pruebas de diagnóstico para excluir insuficiencia suprarrenal primaria en pacientes que están gravemente enfermos o que presentan síntomas o signos inexplicables que sugieran insuficiencia suprarrenal primaria, incluida la depleción de volumen, hipotensión, hiponatremia, hiperpotasemia, fiebre, dolor abdominal, hiperpigmentación o hipoglucemia (ENARM 2007 – A, ENARM 2021 – A, ENARM 2012 – A, ENARM 2006 – B, ENARM 2004).
Cambios hormonales Características clínicas Hallazgos de laboratorio
Hipoaldosteronismo Hipotensión Ansia de sal
Hipocortisolismo Pérdida de peso, anorexia. Fatiga, letargo, depresión.
Dolores musculares
Debilidad
Quejas gastrointestinales (p. Ej. Náuseas, vómitos, diarrea)
Hipotensión (ortostática)
Hipoandrogenismo Pérdida de la libido
La pérdida de la axilar y púbico pelo
ACTH elevada Hiperpigmentación de áreas que normalmente no están expuestas a la luz solar (p. Ej. Pliegues palmar, mucosa de la cavidad oral)
Hiponatremia (ENARM 2022 - A)
Hiperpotasemia
Acidosis metabólica con brecha aniónica normal
Hipoglucemia
Hiponatremia
Insuficiencia suprarrenal primaria
Insuficiencia suprarrenal secundaria
Insuficiencia suprarrenal terciaria
✓ Ausente Ausente
✓ ✓ ✓
↓ DHEA-S ✓ ✓ ✓
↑ MSH
✓ Ausente Ausente
La mayoría de los casos de insuficiencia suprarrenal son subclínicos y solo se manifiestan durante períodos de estrés (p. Ej., Cirugía, traumatismo, infecciones), cuando el requerimiento de cortisol es mayor.
Estudios endocrinos
♦ Prueba de estimulación de ACTH en dosis estándar (prueba de Cosintropina): Gold standard para el diagnóstico de insuficiencia suprarrenal primaria
– Método

– Respuesta fisiológica: ACTH exógena → ↑ cortisol
♦ Detección de hipoaldosteronismo e hipoandrogenismo
– Hipoaldosteronismo
• ↑ Actividad de renina plasmática (ARP) o ↑ concentración de renina plasmática (PRC)
– Hipoandrogenismo
• ↓ DHEA-S
Se requiere terapia de reemplazo de glucocorticoides con hidrocortisona en todas las formas de insuficiencia suprarrenal.
En pacientes con sospecha de crisis suprarrenal:
♦ Administrar inmediatamente 100 mg de hidrocortisona por vía intravenosa seguida de una reanimación con líquidos adecuados e hidrocortisona 200 mg / día como infusión intravenosa continua o 50 mg por vía intravenosa cada 6 horas durante 24 horas
♦ Disminuya la dosis de glucocorticoides IV y cambie a la dosis de mantenimiento oral una vez que la condición del paciente sea estable.
Insuficiencia suprarrenal primaria: reemplazo del hipocortisolismo, hipoaldosteronismo e hipoandrogenismo
♦ Glucocorticoides
♦ Mineralocorticoides
Insuficiencia suprarrenal secundaria / terciaria: reemplazo del hipocortisolismo y el hipoandrogenismo
♦ Glucocorticoides
Reemplazo de esteroides
♦ Glucocorticoides (ENARM 2022 - B):
Hidrocortisona
– Acetato de cortisona

– Prednisolona
♦ Mineralocorticoides
– Fludrocortisona (un mineralocorticoide sintético con efectos principalmente mineralocorticoides y glucocorticoides limitados)
Esteroides en dosis de estrés
♦ Las dosis de esteroides deben aumentarse para prevenir la crisis suprarrenal en pacientes de riesgo
Crisis suprarrenal
La crisis suprarrenal es una deficiencia aguda y grave de glucocorticoides que requiere tratamiento de emergencia inmediato
Para prevenir el desarrollo de insuficiencia suprarrenal secundaria y terciaria, la terapia con esteroides prolongada debe reducirse lentamente en lugar de interrumpirse abruptamente.
Considere una crisis suprarrenal en pacientes con hipotensión severa refractaria a la reanimación con líquidos y/o vasopresores. La crisis suprarrenal puede poner en peligro la vida, por lo que el tratamiento con altas dosis de hidrocortisona debe iniciarse de inmediato, sin esperar la confirmación diagnóstica de hipocortisolismo.
La crisis adrenal es la forma más frecuente de diagnóstico de la ISR y requiere hoy Hidrocortisona en infusión inicial acompañada de fludrocortisona en la mayoría de los casos (ENARM 2020-B).
Factores precipitantes
Estrés en pacientes con insuficiencia suprarrenal subyacente, por ejemplo:
♦ Enfermedad gastrointestinal (más común)
♦ Otras infecciones
♦ Periodo perioperatorio
♦ Estrés físico o dolor
♦ Estrés psicológico
Signos y síntomas
♦ Hipotensión, shock
♦ Deterioro de la conciencia, coma
♦ Fiebre
♦ Vómitos, diarrea
♦ Severo dolor abdominal (que puede parecerse a peritonitis)
Pruebas en el lugar de atención y estudios de laboratorio de rutina
♦ Hiponatremia, hiperpotasemia, hipercalcemia
Reemplazo empírico de glucocorticoides
♦ Hidrocortisona (preferida). 100 mg de hidrocortisona IV una vez, luego 200 mg durante 24 horas
♦ Prednisolona (alternativa si la hidrocortisona no está disponible)
♦ Dexametasona (la alternativa menos preferida si la hidrocortisona no está disponible)
Considere agregar un reemplazo de mineralocorticoides. Fludrocortisona para:
♦ Pacientes que reciben glucocorticoides distintos de hidrocortisona
Interrupción repentina de glucocorticoides después de un tratamiento prolongado con glucocorticoides.
Hemorragia o infarto suprarrenal bilateral (p. Ej., Síndrome de WaterhouseFriderichsen)
Apoplejía hipofisaria
♦ Hipoglucemia
♦ Acidosis metabólica con brecha aniónica normal
Pruebas endocrinas: considere si el diagnóstico es incierto (p. Ej., Primera presentación).
♦ Nivel de cortisol aleatorio
♦ La muestra debe extraerse antes de la administración de hidrocortisona.
♦ Prueba de estimulación con ACTH: confirmación del diagnóstico una vez que el paciente se ha estabilizado.
♦ Pacientes con shock séptico Resucitación con fluidos

♦ 1 L de solución salina normal (isotónica) en la primera hora
♦ El tratamiento adicional debe estar guiado por la respuesta clínica
Hipoglucemia: dextrosa intravenosa, p. Ej. Dextrosa al 50% Identificar y tratar las causas subyacentes (p. Ej., Sepsis).
Considerar la monitorización en Cuidados intensivos
La enfermedad de Cushing (síndrome de Cushing hipofisario) es el hipercortisolismo causado por un tumor hipofisario que secreta hormona adrenocorticotrópica (ACTH) (generalmente un micro adenoma) (ENARM 2021 – A)
El exceso de ACTH hiperestimula las glándulas suprarrenales, lo que produce una sobreproducción de cortisol.
El cortisol circulante inapropiadamente alto y la pérdida de la variación fisiológica diurna causan los síntomas y signos variables del síndrome de Cushing
Síndrome de Cushing exógeno (iatrogénico) (ESSALUD 2015)
Tratamiento prolongado con glucocorticoides → hipercortisolismo → disminución de ACTH → atrofia suprarrenal bilateral
Causa más común de hipercortisolismo
Mientras que el término “síndrome de Cushing” se puede aplicar a cualquier causa de hipercortisolismo, “ enfermedad de Cushing “ se refiere específicamente al hipercortisolismo secundario que resulta de la producción excesiva de ACTH por los adenomas hipofisarios.
Tipos Hipercortisolismo primario (síndrome de Cushing Independiente de ACTH)
Causas Sobreproducción autónoma de cortisol por la glándula suprarrenal → supresión de ACTH
→ atrofia de la glándula suprarrenal contralateral
Adenomas suprarrenales
Adrenal carcinoma
Hiperplasia macronodular adrenal
Hipercortisolismo secundario
Producción de ACTH hipofisaria (enfermedad de Cushing)
Adenomas
hipofisarios
→Secreción de ACTH→ hiperplasia bilateral de la glándula suprarrenal
Producción ectópica de ACTH
Síndrome paraneoplásico

→ ↑ secreción de ACTH
→hiperplasia de glándula suprarrenal bilateral
Los carcinomas incluyen:
- Cáncer de pulmón de células pequeñas
(ESSALUD 2015)
- Carcinoma de células
renales
- Tumores carcinoides
pancreáticos o bronquiales
- Feocromocitoma
- Carcinoma medular de tiroides
Considere un diagnóstico de hipercortisolismo en pacientes que presenten debilidad muscular proximal, obesidad central, adelgazamiento de la piel, aumento de peso, trastornos del sueño y / o depresión.
Características clínicas (ENARM 2012 – B, ENARM 2011 – B)
Piel fina, fácilmente magullada con equimosis
Estrías abdominales clásicamente moradas
Hirsutismo
Acné
Si hay hipercortisolismo secundario: a menudo hiperpigmentación (oscurecimiento de la piel debido a una sobreproducción de melanina), especialmente en áreas que normalmente no están expuestas al sol (p. Ej., Pliegues de la palma, cavidad oral)
Neuropsicológico: Letargo, depresión, trastornos del sueño, psicosis: Osteoporosis
Atrofia / debilidad muscular
Resistencia a la insulina → hiperglucemia → poliuria leve en el caso de hiperglucemia
severa
Dislipidemia
Obesidad central, facies lunar y joroba de búfalo (ESSALUD 2004 y 2013)
♦ ♀: disminución de la libido, virilización y / o ciclos menstruales irregulares (p. Ej., Amenorrea)
♦ Retraso del crecimiento (en niños)
♦ Hipertensión secundaria (∼ 90% de los casos)
♦ Mayor susceptibilidad a las infecciones (debido a la inmunosupresión)
Hallazgos generales de laboratorio
Detección de hipercortisolismo
♦ ↑ cortisol en orina de 24 horas (ENARM 2014 II – B)

♦ ↑ Niveles de cortisol sérico temprano en la mañana (> 50 nmol / L) después de una prueba de supresión con dexametasona en dosis bajas
♦ ↑ Cortisol salival de medianoche
♦ ↑ Cortisol sérico de medianoche
Solo la enfermedad de Cushing permanece (parcialmente) susceptible a la supresión (prueba de supresión de dexametasona en dosis altas) o estimulación (prueba de estimulación CRH) de la secreción de cortisol.
Identificar la causa del hipercortisolismo
Análisis de hormonas
♦ 1. Niveles séricos de ACTH
Bajo (<5 pg / mL): sospecha de hipercortisolismo primario (adenoma suprarrenal, carcinoma)
Normal o elevado (> 20 pg / ml): sospecha de hipercortisolismo secundario
♦ 2. Si se sospecha hipercortisolismo secundario: se puede usar una de las siguientes pruebas para diferenciar entre la enfermedad de Cushing y la producción ectópica de ACTH
Prueba de supresión de dosis alta de dexametasona
♦ Supresión adecuada de los niveles de cortisol a menos del 50% del valor inicial: enfermedad de Cushing
♦ Sin supresión: producción ectópica de ACTH
Prueba de estimulación CRH
♦ Los niveles de ACTH y cortisol aumentan aún más: enfermedad de Cushing (ENARM 2000)
♦ Sin aumento de los niveles de ACTH o cortisol: producción ectópica de ACTH
Imágenes para localizar el tumor
TC y / o RMN del abdomen: para tumores suprarrenales (si se sospecha hipercortisolismo primario)
La corteza suprarrenal contralateral al tumor muestra atrofia debido a la estimulación reducida de ACTH.
Tomografía computarizada y / o la resonancia magnética del abdomen muestran hiperplasia bilateral tanto de la zona fasciculada como de la zona reticular
Tomografía computarizada y / o resonancia magnética del cráneo: si se sospecha enfermedad de Cushing
Otras pruebas: si se sospecha producción ectópica de ACTH
Radiografía de tórax y / o tomografía computarizada

Después de la terapia quirúrgica, los pacientes que desarrollan insuficiencia suprarrenal requieren terapia de reemplazo de glucocorticoides de por vida.
Los pacientes que desarrollan hipopotasemia grave debido al efecto mineralocorticoide del cortisol pueden ser tratados con espironolactona (antagonista de la aldosterona).
Síndrome de Cushing endógeno
Enfermedad inoperable: fármacos para suprimir la síntesis de cortisol: Metirapone Enfermedad operable: la terapia quirúrgica es el tratamiento de elección.
♦ Tumor adrenocortical: adrenalectomía laparoscópica o abierta (un procedimiento quirúrgico para extirpar una o ambas glándulas suprarrenales)
Las feocromocitomas y paragangliomas son tumores neuroendocrinos raros que surgen de paraganglios simpáticos y parasimpáticos, que son células derivadas de la cresta neural que están presentes dentro de la médula suprarrenal y en tejidos a lo largo del eje paravertebral.
La feocromocitoma se refiere a un tumor que generalmente secreta catecolaminas dentro de la médula suprarrenal.
El Paraganglioma se refiere a tumores extraadrenales, que pueden o no secretar catecolaminas. Los paragangliomas simpáticos son tumores secretores de catecolaminas que suelen localizarse en el retroperitoneo (o con menos frecuencia en la pelvis o el tórax).
Los paragangliomas parasimpáticos suelen localizarse en la base del cráneo y el cuello, y se ha informado que sólo alrededor del 5% secretan catecolaminas.
La mayoría de las feocromocitomas y paragangliomas no son malignos.
Metástasis reportadas en:

♦ 5% -20% de feocromocitomas
♦ Hasta el 35% de los paragangliomas simpáticos (el riesgo varía según la ubicación, con el mayor riesgo asociado con paragangliomas mediastínicos y abdominales)
♦ Los sitios metastásicos más comunes incluyen huesos, pulmones, hígado y ganglios linfáticos
Las crisis hipertensivas pueden desencadenarse por la palpación del tumor en el examen abdominal.
El diagnóstico es con el dosaje de metanefrinas en orina o suero.
La presentación clínica está relacionada con niveles fluctuantes de secreción excesiva de epinefrina, norepinefrina y dopamina, por lo tanto, los síntomas son recurrentes y remitentes (síndrome hiperadrenérgicos episódico).
Hipertensión episódica
Dolor de cabeza punzante Diaforesis
Palpitaciones cardíacas, taquicardia Palidez
Signos de policitemia, si se secreta EPO
Mejor prueba inicial: prueba de metanefrinas
♦ Ejemplos: ácido homovanílico, ácido vanililmandélico
♦ Alta sensibilidad
Prueba de confirmación: metanefrinas y catecolaminas en orina de 24 horas (alta especificidad)
Tinción inmunohistoquímica: positiva para cromogranina, sinaptofisina y NSE
Tomografía computarizada o resonancia magnética suprarrenal / abdominal
Está contraindicado iniciar betabloqueantes antes que los alfa bloqueantes. Los betabloqueantes cancelan el vasodilatador efecto de periféricos beta-2 adrenérgicos, conduciendo potencialmente a sin oposición alfa- adrenoceptor estimulación, causando vasoconstricción y en última instancia crisis hipertensiva.
Enfermedad operable
♦- Manejo preoperatorio de la presión arterial
– Primero, un alfa bloqueante irreversible no selectivo; Fenoxibenzamina
– Después de suficiente bloqueo alfa-adrenérgico, un betabloqueante
♦ Resección tumoral laparoscópica (adrenalectomía): tratamiento de elección
– Técnica de no tocar
– La resección quirúrgica abierta se reserva para tumores grandes o invasivos. Enfermedad inoperable
♦ Feocromocitoma benigno: tratamiento primario con Fenoxibenzamina
♦ Feocromocitoma maligno
– Terapia con metayodobencilguanidina (MIBG): debido a que la MIBG es similar en estructura a la noradrenalina, es captada por las células nerviosas simpáticas, incluidas las células tumorales del neuroblastoma o feocromocitoma, en todo el cuerpo. Cuando MIBG se combina con yodo radiactivo, se puede usar como un tratamiento que administra radiación directamente a las células cancerosas.
– De lo contrario, tratamiento paliativo (quimioterapia, embolización tumoral)

El síndrome metabólico es un grupo de factores de riesgo metabólico comúnmente coexistentes asociados con la enfermedad cardiovascular y la diabetes mellitus tipo 2, que incluyen:
♦ Presión sanguínea elevada
♦ Dislipidemia aterogénica
♦ Resistencia a la insulina
♦ Obesidad central
Es más común en pacientes con sobrepeso y obesidad, pero puede ocurrir en pacientes con peso normal.
Los factores de riesgo incluyen el tabaquismo, la inactividad física y los antecedentes familiares. Las complicaciones incluyen enfermedad cardiovascular aterosclerótica (ECV), diabetes y enfermedad renal crónica.
El SM es el riesgo elevado de desarrollar DM y ECV definido por 3 o más de 5 factores asociados todos a hiperinsulinemia.
Son los criterios: Deterioro de la Glucosa en ayunas, HDL bajo, Triglicéridos altos, incremento del perímetro de la cintura e HTA.
(ENARM 2010 – B)
Los criterios de definición/diagnóstico para el síndrome metabólico varían según la organización y se han propuesto varios conjuntos de criterios de diagnóstico.
El criterio de diagnóstico más común para el síndrome metabólico proviene del Grupo de Trabajo sobre Epidemiología y Prevención de la Federación Internacional de Diabetes (FID) y de la Asociación Estadounidense del Corazón / Instituto Nacional del Corazón, los Pulmones y la Sangre (AHA / NHLBI) y requiere 3 de los siguientes 5 criterios:
Parámetros NCEP/ATP3/AHA 2005
PUNTAJE ≥3 de: ≥3 de:
FDI 2009
Glucosa G ayunas ≥100, o TTO G ayunas ≥110, o DM diagnosticada
Colesterol HDL <40 mg/dL (hombres); 50 mg/dL (mujeres) o TTO <40 mg/dL (hombres); 50 mg/dL (mujeres) o TTO
Triglicéridos ≥150 mg/dL o TTO ≥150 mg/dL o TTO
Obesidad
Cintura ≥102 cm (hombres) o ≥88 cm (mujeres)
Cintura ≥94 cm (hombres) o ≥80 cm (mujeres)
Hipertensión ≥130/85 mmHg o TTO ≥130/85 mmHg o TTO
Tabla 16. Criterios diagnósticos del síndrome metabólico
La indicación más importante de manejo del SM son los cambios de estilo de vida y bajar de peso, siendo a veces indicado iniciar metformina.
El tratamiento del síndrome metabólico incluye el manejo de los componentes individuales del síndrome con el objetivo de prevenir las enfermedades cardiovasculares y la diabetes tipo 2.
La modificación del estilo de vida es el tratamiento de primera línea para todos los pacientes
Tratar la obesidad con un equilibrio de intervenciones dietéticas, actividad física y programas formales de modificación del comportamiento; los objetivos incluyen:
♦ Reducir el peso corporal del paciente en un 7% -10% durante el primer año de tratamiento, el objetivo final es un índice de masa corporal de <25 kg / m2.
♦ Lograr y mantener una circunferencia de la cintura por debajo de los umbrales de definición del síndrome metabólico.
♦ Aconsejar una actividad física de intensidad moderada durante 30 minutos, preferiblemente 45-60 minutos, ≥ 5 días / semana.
Las intervenciones dietéticas incluyen:
♦ Reducir la ingesta de grasas totales, saturadas y trans, colesterol, azúcares simples y alimentos con alto índice glucémico.
♦ Proporcione una ingesta adecuada de fibra, grasas insaturadas, frutas, verduras, cereales integrales y pescado.
En pacientes que fuman, se recomienda dejar de fumar.
El tratamiento para los factores de riesgo metabólico individuales con medicación si el paciente no está logrando los objetivos con cambios en el estilo de vida solo incluye:
♦ Los objetivos del tratamiento de la dislipidemia son una reducción del colesterol elevado de las LDL y del incremento del HDL.
♦ El objetivo del tratamiento de la hipertensión es una presión arterial objetivo de <140/90 mm Hg, o <130/80 mm Hg en pacientes con diabetes o enfermedad renal crónica.
Para glucosa elevada:
♦ Para los pacientes que no responden a la modificación del estilo de vida o tienen limitaciones para la actividad física, prescriba metformina como terapia farmacológica de primera línea.
♦ Otros medicamentos que pueden reducir la progresión a diabetes en pacientes con prediabetes incluyen:

– Inhibidores de la alfa-glucosidasa (Acarbosa, voglibosa)
Orlistat
– Liraglutide
La obesidad se define con mayor frecuencia como un índice de masa corporal (IMC) ≥ 30 kg/m2, aunque se han recomendado valores de corte de detección de IMC más bajos en adultos de origen étnico del sur de Asia, el sudeste asiático o el este de Asia.
La obesidad a menudo se subclasifica como: (ENARM 2016 – B, ENARM 2017 – A).
La obesidad se mide por IMC y es mayor o igual a 30, incrementándose la morbi mortalidad cardiovascular y la incidencia de diabetes en estos pacientes.
Infrapeso IMC < 18,5 kg/m²
Peso normal IMC ≥ 18,5 a 24,9 kg/m²
Sobrepeso IMC ≥ 25 a 29,9 kg/m²
Obesidad IMC ≥ 30 kg/m²
Obesidad clase 1 IMC 30 a 34,9 kg/m² (LEVE)
Obesidad clase 2 IMC 35 a 39,9 kg/m² (MODERADA)
Obesidad clase 3 IMC ≥ 40 kg/m² (SEVERA o MÓRBIDA)
(SUPEROBESO) IMC ≥ 50 kg/m²
Tabla 17. Clasificación IMC (OMS, NIH)
La obesidad se asocia con un aumento de la morbilidad y la mortalidad, incluido un mayor riesgo de eventos cardiovasculares y un mayor riesgo de ciertos cánceres. Un balance energético positivo (aumento de la ingesta energética y / o disminución del gasto energético entre sí) de 50-60 calorías /día sostenido durante un año puede llevar a un aumento de peso de> 2,4 kg.
Evaluar la obesidad en todos los pacientes ≥ 18 años con índice de masa corporal (IMC) ≥ 30 kg / m2.
Preguntar acerca de la herencia/desarrollo, el sueño, la dieta / actividad, los factores económicos, el apoyo social, la ingesta emocional / compulsiva y los medicamentos, que pueden ser causas secundarias del aumento de peso y pueden afectar la decisión de buscar complicaciones. En pacientes con un IMC <35 kg / m2, se debe considerar la adición de la circunferencia de la cintura (medida en la cresta ilíaca de la pelvis) para la clasificación del riesgo de obesidad con:
Las pruebas que pueden ser útiles para identificar complicaciones de la obesidad o afecciones asociadas incluyen glucosa en ayunas, prueba de tolerancia a la glucosa o HbA1C, panel de lípidos, enzimas hepáticas, hemograma completo y hormona estimulante de la tiroides.
La leptina se produce en el tejido adiposo y puede estar eventualmente elevado, pero no hay relación directa entre su actividad y la obesidad común (ENARM 2002, ENARM 2019 A).
También se debe evaluar la presión arterial para evaluar la hipertensión asociada (ENARM 2015 II – B)
La dieta y el ejercicio son los métodos de primera línea para perder peso. Los diferentes enfoques dietéticos son efectivos para la pérdida y el mantenimiento del peso siempre que se logre la reducción de calorías objetivos.
Las opciones recomendadas para lograr la restricción de calorías incluyen:
♦ Déficit de energía de 500 a 750 calorías por debajo de las necesidades energéticas estimadas
♦ Consumo de 1200 a 1500 calorías / día para mujeres o de 1500 a 1800 calorías / día para hombres (calorías ajustadas al peso corporal del individuo.
♦ Adherencia a una dieta restrictiva (como dietas bajas en carbohidratos, bajas en grasas, altas en fibra o de reemplazo de comidas) para crear un déficit de energía a través de la reducción de la ingesta de alimentos
El manejo principal de la obesidad son los cambios de estilo de vida y bajar de peso, siendo necesario la medicación ante comorbilidades y la cirugía bariátrica cuando esta obesidad es mórbida o mayor o igual a 40.
Se recomienda el ejercicio de intensidad moderada para adultos con obesidad. Se necesitan más de 150 minutos a la semana para mostrar cualquier pérdida de peso. Medicación: como parte de un programa integral de pérdida de peso y pueden ser útiles para pacientes con índice de masa corporal (IMC) ≥ 27 kg / m2 con factores de riesgo o enfermedades concomitantes relacionados con la obesidad (diabetes, hipertensión o dislipidemia), o aquellos con IMC ≥ 30 kg / m2. Los medicamentos aprobados por la FDA para el manejo crónico (> 6 meses) de la pérdida de peso incluyen:
♦ Orlistat 120 mg por vía oral 3 veces al día
♦ Liraglutide 3 mg por vía subcutánea una vez al día (después de un aumento de 4 semanas, comenzando con 0,6 mg una vez al día y seguido de aumentos semanales de 0,6 mg [0,6, 1,2, 1,8, 2,4, 3] hasta la dosis de mantenimiento de 3 mg una vez al día)
♦ Fentermina / topiramato de liberación prolongada 7.5 mg / 46 mg por vía oral una vez al día La Cirugía Bariátrica puede ser apropiada para pacientes con:
♦ IMC ≥ 40 kg / m2 sin problemas médicos coexistentes y sin riesgo quirúrgico excesivo.

♦ IMC ≥ 35 kg / m2 con ≥ 1 comorbilidad relacionada con la obesidad grave.
♦ IMC ≥ 30 kg / m2 con ≥ 1 comorbilidad grave relacionada con la obesidad o diabetes tipo 2 con poca evidencia.
En comparación con el tratamiento no quirúrgico, la cirugía bariátrica puede asociarse con una reducción de la mortalidad, una mejor pérdida de peso a largo plazo (mantenida hasta 10 años), mayores reducciones en las afecciones relacionadas con la obesidad como diabetes, hiperlipidemia, hipertensión y apnea obstructiva del sueño, y mejoró fertilidad en mujeres.
Una pérdida de peso del 5% al 15% puede reducir en gran medida las complicaciones y mejorar los parámetros metabólicos en personas con sobrepeso u obesidad. Algunas complicaciones requieren una mayor pérdida de peso que otras para mejorar.
El término diabetes mellitus describe enfermedades de metabolismo anormal de carbohidratos que se caracterizan por hiperglucemia. Se asocia con un deterioro relativo o absoluto de la secreción de insulina, junto con diversos grados de resistencia periférica a la acción de la insulina (ENARM 2020-A) (ESSALUD 2010).
La glucosa plasmática en ayunas (GPA), la glucosa plasmática de dos horas durante una prueba de tolerancia oral a la glucosa (TSGO) de 75 g, o la hemoglobina glucosilada (A1C) se pueden utilizar para las pruebas de diagnóstico. La TSGO no se usa comúnmente (excepto durante el embarazo) debido a sus inconvenientes.
Hiperglucemia asintomática: el diagnóstico de diabetes en un individuo asintomático (generalmente diabetes tipo 2) se puede establecer con cualquiera de los siguientes criterios:
♦ Valores de GPA ≥126 mg / dL. El ayuno se define como la ausencia de ingesta calórica durante al menos ocho horas (ENARM 2014 II – A, ENARM 2009 – B, ENARM 2016 – A, ENARM 2012 – A, ENARM 2011 – A)
♦ Valores de glucosa plasmática a las dos horas de ≥200 mg / dL durante un TSGO de 75 g.
♦ Valores de A1C ≥6,5 por ciento (ENARM 2014 I – B)
La prueba diagnóstica de elección para diabetes y patologías afines es el test de Glucosa plasmática en ayunas (GPA) y es la Hemoglobina A1c la prueba confirmatoria y necesaria para el manejo.
Una glucemia mayor o igual a 126 en la glucemia en ayunas puede ser ya diagnostica, pero la recomendación es hacer una segunda prueba que determinaría el diagnostico antes de las 72h.
1. A1C o Hemoglobina glicosilada ≥6.5%. El mejor, debe ser realizado con un método estandarizado, con 10 gr% de Hb a más, o (ENARM 2004-B) (ESSALUD 2005)
2. GLICEMIA EN AYUNAS ≥126 mg/dL. Ayuno definido como 8 horas sin alimentos, o
3. Glicemia a las 2 horas de un TSGO ≥200 mg/dL, el test debe ser realizado de acuerdo con la OMS con 75g de glucosa disuelta en agua, o
4. Glicemia al Azar: En pacientes con síntomas clásicos de diabetes definidos, una Glicemia aleatoria ≥200 mg/dL.
Hiperglucemia sintomática: el diagnóstico de diabetes mellitus se establece fácilmente cuando un paciente presenta síntomas clásicos de hiperglucemia (sed, poliuria, pérdida de peso, visión borrosa) y tiene un valor aleatorio de glucosa en sangre de 200 mg / dL o más alto. La mayoría de los pacientes con diabetes tipo 1 son sintomáticos y tienen concentraciones de glucosa plasmática muy por encima de ≥200 mg / dl. Algunos pacientes con diabetes tipo 2 también presentan hiperglucemia sintomática y glucosa en sangre ≥ 200 mg / dl. (ESSALUD 2003)
Prediabetes: las mismas pruebas que se usan para detectar y diagnosticar la diabetes también se pueden usar para identificar a las personas con prediabetes. Los criterios de la ADA para diagnosticar la prediabetes son los siguientes:
♦ Glucosa en ayunas alterada (GAA) - GPA entre 100 y 125 mg / dL. La OMS define GAA como una GPA de 110 a 125 mg / dL. El ayuno se define como la ausencia de ingesta calórica durante al menos ocho horas.
♦ Intolerancia a la glucosa oral (IGO): valor de glucosa plasmática a las dos horas durante una TSGO de 75 g entre 140 y 199 mg / Dl. La OMS define la IGO como una glucosa post-TSGO a las dos horas ≥ 140 mg / dL, pero <200 mg / dL y una GPA <126
♦ A1C: las personas con A1C de 5,7 a <6,5 %; 6,0 a <6,5 % en el informe del Comité Internacional de Expertos tienen el mayor riesgo, aunque existe un continuo de aumento del riesgo en todo el espectro de niveles de A1C inferiores al 6,5 %.
Definición
La DM tipo 1 es destrucción autoinmune de las células beta y con frecuencia (50%) se presenta con CAD, siendo su edad más frecuente de presentación entre 12 y 14 años
El manejo de la DM tipo1 requiere insulina en forma permanente.
La diabetes mellitus tipo 1 es un trastorno endocrino que se caracteriza por deficiencia de insulina por lo general debido a la destrucción autoinmune de las células beta del páncreas y que produce hiperglucemia y complicaciones como cetoacidosis, enfermedad cardiovascular, nefropatía y retinopatía.
La diabetes tipo 1 puede ocurrir a cualquier edad, pero comúnmente se presenta en la infancia o la adolescencia, a menudo con síntomas clásicos como poliuria, polidipsia, polifagia y pérdida de peso repentina; aproximadamente el 30% de los niños y adolescentes presentan cetoacidosis diabética (CAD), una emergencia metabólica. Los pacientes con diabetes tipo 1 tienen un mayor riesgo de padecer otros trastornos inmunomediados, especialmente la enfermedad tiroidea autoinmune y la enfermedad celíaca.
Diagnóstico
Los criterios expuestos son los que se deben utilizar. Si se sospecha cetoacidosis diabética, medir también los electrolitos, el BUN, la creatinina, los gases en sangre arterial y las cetonas en suero y orina.
Si los hallazgos clínicos por sí solos no son suficientes para diferenciar entre la diabetes tipo 1 y el tipo 2, considerar la posibilidad de realizar análisis de sangre para detectar autoanticuerpos y péptido C. Los resultados consistentes con un diagnóstico de diabetes tipo 1 incluyen:
♦ Autoanticuerpos contra descarboxilasa del ácido glutámico, células de los islotes, insulina, proteína tirosina fosfatasa (ICA512 o IA2A) o proteína transportadora de zinc (ZnT8).
♦ Niveles bajos o indetectables de péptido C.
Tratamiento
Todos los pacientes con diabetes tipo 1 necesitan insulina. Para la mayoría de los pacientes, prescriba múltiples inyecciones diarias de insulina (1-2 inyecciones de insulina basal y ≥ 3 inyecciones / día de insulina prandial) o infusión continua de insulina subcutánea (bomba de insulina).(ESSALUD 2003)
La DM tipo2 tiene como principal mecanismo de enfermedad la resistencia a la insulina.
La diabetes mellitus tipo 2 es un trastorno endocrino común que se caracteriza por grados variables de resistencia y deficiencia de insulina, lo que resulta en hiperglucemia. Es más frecuente en mayores de 50 años, el 80% de los pacientes son obesos o tiene sobrepeso.
Las posibles complicaciones de la diabetes mellitus incluyen enfermedad cardiovascular, neuropatía, nefropatía, retinopatía y aumento de la mortalidad. A menudo se identifica mediante exámenes de detección de rutina que comienzan en la mediana edad, o mediante exámenes de detección dirigidos a adultos de cualquier edad con sobrepeso u obesidad y con factores de riesgo como síndrome metabólico, síndrome de ovario poliquístico, antecedentes de diabetes gestacional u otros problemas familiares o clínicos, o características demográficas.

La hemoglobina A1c es necesaria para el control metabólico y glucémico.
Evaluar función renal, microalbuminuria, transaminasas, perfil de lípidos, examen de retina y prueba para descartar polineuropatía al menos una vez al año.
La diabetes tipo 2 suele ser asintomática, pero puede presentarse con síntomas típicos de hiperglucemia como poliuria, polidipsia y polifagia. El procedimiento diagnóstico es el mismo expuesto.
Evalúe la HbA1c (u otra medición glucémica) para determinar el control glucémico.
(ESSALUD 2011)
Para los pacientes que tienen un control glucémico estable y que están cumpliendo los objetivos del tratamiento, considere realizar la prueba al menos 2 veces al año Para los pacientes que no alcanzan los objetivos del tratamiento o si la terapia cambia, considere realizar la prueba al menos cada 3 meses (trimestralmente) y según sea necesario. (ESSALUD 2012)

Pruebas adicionales para las complicaciones diabéticas
Evalúe la tasa de filtración glomerular estimada del paciente (calculada a partir de la creatinina sérica) al menos una vez al año.
Evaluar las transaminasas hepáticas (alanina aminotransferasa y aspartato aminotransferasa) en el momento del diagnóstico y anualmente a partir de entonces para evaluar la enfermedad del hígado graso no alcohólico.
Mida la albúmina en orina, como la relación entre albúmina y creatinina en orina, al menos una vez al año.
Realizar un examen ocular dilatado y completo en el momento del diagnóstico
Prueba de polineuropatía simétrica distal y pérdida de la sensación protectora con un monofilamento de 10 g y ≥ 1 de las siguientes pruebas en el momento del diagnóstico y anualmente para identificar los pies con riesgo de ulceración y amputación:
El Octeto Ominoso nos sirve para explicar en forma didáctica las causas conocidas de Hiperglucemia, siendo el mecanismo primordial de la DM2 la Gluconeogénesis hepática incrementada en ayunas, así como: Déficit de secreción de insulina, exceso de secreción de Glucagón, deterioro de la secreción de incretinas, reabsorción incrementada de glucosa en el túbulo proximal por deterioro del cotransportador SGLT2, deterioro en la captación periférica de glucosa y lipolisis incrementada. (ENARM 2016 – B).
En los mecanismos de hiperglucemia de la DM2 destacan la gluneogénesis hepática incrementada, el déficit de secreción de insulina y la captación de glucosa periférica (resistencia)
(ENARM 2014 I – A).
El mecanismo clave de hiperglucemia en la DM2 es la gluconeogénesis hepática descontrolada y por ello es clave la Metformina para su control.

OCTETO OMINOSO DE LA HIPERGLICEMIA
HIPERGLICEMIA
Biguanidad:
Metformina
Sulfonilurea:
Glibenclamida
Glimepirida
Disminuye la producción hepática de glucosa Disminuye absorción intestinal de glucosa (ESSALUD 2009)
Incrementa la sensibilidad a la insulina
Incrementa la secreción de insulina (ENARM 2022 - A)
Disminuye la producción hepática de glucosa Incrementa la sensibilidad a la insulina
Dispepsia
Acidosis láctica
Déficit B12
Hipoglicemia moderada (ESSALUD 2015)
Incremento de peso
Infecciones respiratorias altas
Tiazolidinedionas:
Pioglitazona Incrementa la respuesta a la insulina Disminuye la gluconeogénesis
Edemas combinada con SU/In ICC
Metiglinidas:
Repaglinida Incrementa la secreción de insulina por bloqueo de canales de potasio.
Inhibidores SGLT2:
DAPAGLIFLOZINA
EMPAGLIFLOZINA
CANAGLIFLOZINA
Inhibidor selectivo del cotransportador SGLT2 –Glucosuria
Disminuye riesgo ECV y hospitalización por ICC y progresión ERC
Hipoglicemia
Infección respiratorias altas
Infecciones micóticas genitales Leve disminución de la función renal ITU
Inhibidores DPP-4: SITAGLIPTINA Incrementa y prolonga la actividad de incretinas Diarrea No hipoglicemia
Agonistas GLP-1: EXENATIDE LIRAGLUTIDE
Amilinomiméticos: PRAMLINTIDE
Mimetiza las acciones de la incretina: Incrementando la secreción de insulina, disminuye la secreción de glucagón y retarda el vaciado gástrico
Análogo sintético del polipropileno pancreático
Amilina: disminuyendo secreción de glucagón, retardo vaciamiento gástrico y regula apetito
Tratamiento
Objetivos glucémicos
♦ Individualice los objetivos glucémicos.
♦ HbA1c <7% es un objetivo razonable para muchas mujeres adultas no embarazadas sin hipoglucemia significativa.
♦ Hba1c <6.5%, puede ser razonable si se puede lograr sin hipoglucemia significativa u otros efectos adversos del tratamiento (como polifarmacia) para pacientes seleccionados como aquellos con:
– Una corta duración de la diabetes
Una larga esperanza de vida
– Sin enfermedad cardiovascular significativa
♦ Los objetivos menos estrictos (<8%) también pueden ser apropiados para ciertos pacientes si:

– El paciente tiene antecedentes de hipoglucemia grave
El paciente tiene una esperanza de vida limitada
Náuseas, vómitos y diarrea Retracciones en el lugar de inyección Pancreatitis
Náuseas y vómitos Cefalea Anorexia
Glucemia en ayunas 70 a 130 mg/dL
Glucemia post prandial <180 mg/dL
HbA1c <7%
Colesterol total <200 mg/dL
Colesterol HDL >50 mg/dL
Colesterol LDL <100 mg/dL
Triglicéridos <150 mg/dL
Presión arterial <140/80 mmHg
– Es probable que los daños del tratamiento superen los beneficios.
El tratamiento de elección en DM2 es la metformina que solo se deja de usar por efectos adversos o cuando hay falla renal con < 30 de depuración o falla hepática o alcoholismo.
Añadir una segunda droga hoy es muy beneficioso sobre todo si la A1c es > 8% y se recomienda si hay alto riesgo cardiovascular o enfermedad activa, GLP-1-RA como Exenatida e Inhibidores de la SGLT2 como la Dapagliflozina. Si hay ICC en el Diabético se recomienda uso de I-SGLT2.
Modificación de estilo de vida
♦ Brindar apoyo para el control de la dieta, el mantenimiento de la actividad física y la educación y el apoyo para el autocontrol de la diabetes.
♦ Esto se puede hacer de forma individual (por parte del médico, educadores certificados en diabetes y enfermeras), en grupo o mediante telemedicina.

Medicamentos para reducir la glucosa:
♦ La metformina es la terapia de primera línea para la diabetes tipo 2, a menos que esté contraindicada o no se tolere. Considere medir periódicamente los niveles de vitamina B12 en pacientes tratados con metformina (especialmente si el paciente tiene anemia o neuropatía periférica), ya que el uso prolongado de metformina puede estar asociado con una deficiencia de vitamina B12. (ESSALUD 2018 y 2010)
♦ En pacientes con enfermedad cardiovascular aterosclerótica (o que tienen un alto riesgo de enfermedad cardiovascular aterosclerótica), insuficiencia cardíaca o enfermedad renal diabética, agregue un agonista del receptor del péptido 1 similar al glucagón (GLP-1) o un cotransportador de sodio-glucosa-2 (SGLT). -2) inhibidor (si la tasa de filtración glomerular estimada es adecuada) que se ha demostrado que reduce los eventos de enfermedad cardiovascular y / o proporciona protección renal, incluso si la HbA1c del paciente está en el objetivo y en consideración de factores específicos del paciente.
– En casos de insuficiencia cardíaca o enfermedad renal crónica, un inhibidor de SGLT-2 es el agente de segunda línea preferido si la tasa de filtración glomerular estimada es adecuada.
Si el inhibidor de SGLT-2 no se tolera o está contraindicado o la tasa de filtración glomerular estimada es inadecuada, ofrezca un agonista del receptor de GLP-1 para reducir la albuminuria (como criterio de valoración renal), la progresión de la albuminuria y los episodios cardiovasculares.
♦ Muchos pacientes con diabetes tipo 2 y HbA1c ≥ 1.5% por encima del objetivo glucémico requerirán terapia dual (metformina más un agente adicional) y algunos pacientes pueden requerir terapia triple (metformina más agentes adicionales) para alcanzar su objetivo glucémico.
♦ Continúe usando metformina en combinación con otros medicamentos (incluida la insulina) si se tolera y no está contraindicada
♦ En pacientes con diabetes tipo 2 con sobrepeso u obesidad, considerar el efecto sobre el peso al elegir medicamentos hipoglucemiantes, favoreciendo a los agentes negativos para el peso, como los agonistas del receptor de GLP-1.
♦ En pacientes en terapia dual / triple con HbA1c por encima del objetivo, considere la terapia inyectable. (ENARM 2015 I – A).
♦ Para los pacientes con enfermedad cardiovascular, considere un agonista del receptor de GLP-1 con beneficio comprobado para la enfermedad cardiovascular.
♦ Considere la introducción temprana de insulina (en el momento del diagnóstico o como primera terapia inyectable) en pacientes con cualquiera de los siguientes: (ENARM 2019A) (ESSALUD 2016)
– Pérdida de peso u otra evidencia de catabolismo
Hiperglucemia sintomática (como poliuria o polidipsia)
– Hba1c> 10% o niveles de glucosa en sangre ≥ 300 mg/dl
Tiempo de acción de la insulina comercial
Definición
La cetoacidosis diabética (CAD) es una emergencia metabólica que ocurre principalmente en pacientes con diabetes tipo 1, caracterizada por hiperglucemia, acidosis metabólica y cetonemia. (ENARM 2007 – A)
La CAD es causado por una deficiencia absoluta o relativa de insulina junto con un aumento de los niveles de hormonas contrarreguladoras (ENARM 2010 – A)
Los factores desencadenantes de la CAD incluyen diabetes de nueva aparición, omisión de insulina, infección y otros factores de estrés fisiológicos (como infarto de miocardio).
Se informa que el uso de inhibidores de SGLT2 en pacientes con diabetes está asociado con un aumento de 2-4 veces en la CAD
Las complicaciones de la CAD no tratada pueden incluir hiperpotasemia, shock, insuficiencia renal aguda, complicaciones cardíacas y rabdomiólisis (en pacientes con deshidratación grave).
Las complicaciones del tratamiento de la CAD pueden incluir edema cerebral, hipopotasemia e hipoglucemia
Su clínica característica es generada por los cetoácidos y es de tipo gastrointestinal como náuseas, vómitos, dolor abdominal, aliento a manzanas, además de deshidratación, taquipnea tipo Kussmaul por efecto de la acidosis metabólica con anión GAP alto. El trastorno de sensorio se puede dar en el marco del cuadro severo (HCO3 ≤ 10). (ENARM 2018, ENARM 2011 – A, ENARM 2014 I – A, ENARM 2015 I – B, ENARM 2007 – A) (ESSALUD 2014 y 2008)
Diagnóstico
Las pruebas iniciales para pacientes con sospecha de cetoacidosis diabética deben incluir:
♦ Glucosa
♦ Cetonas (la medición directa de los niveles de beta-hidroxibutirato es el método preferido para todos los pacientes, incluidos los pacientes que toman inhibidores del transportador de sodio-glucosa-2 [sglt2])
♦ Electrolitos (incluido el bicarbonato sérico)
♦ Gasometría arterial o venosa
♦ Nitrógeno ureico en sangre y creatinina
♦ Hemograma completo con diferencial
El estado hiperosmolar hiperglucémico (EHH) es una emergencia metabólica que ocurre en pacientes con diabetes mellitus, aunque alrededor del 15% de los pacientes presentan EHH como diagnóstico inicial de diabetes.
Se caracteriza por glucosa sérica extremadamente elevada, aumento de la osmolalidad, deshidratación significativa y cetoacidosis mínima (ENARM 2022 - A).
Tanto el EHH como la cetoacidosis diabética (CAD) a menudo se precipitan por la falta de adherencia de la medicación en pacientes con diabetes conocida, infección subyacente, otras enfermedades médicas concurrentes (como pancreatitis, infarto agudo de miocardio o accidente cerebrovascular), hemorragia gastrointestinal o fármacos que afectan el metabolismo de los carbohidratos.
La clínica del EHH es característico al estado de hiperosmolaridad y severa deshidratación en un paciente que tiene al menos 2 semanas de poliuria y polidipsia constante que genera progresivamente síntomas neurológicos que van de la confusión, a la somnolencia, sopor y coma, incluso la convulsión probable, los pacientes además tienen un severo déficit de potasio (ENARM 2001, ENARM 2012 – B, ENARM 2015 II – B, ENARM 2021 – A) (ESSALUD 2010 y 2015).


La CAD es un cuadro agudo asociado a un evento descompensador y su clínica es gastrointestinal y acidótica. El EHH es un cuadro subagudo asociado a una descompensación en el abandono del tratamiento o inadecuado donde prevalece la deshidratación y la clínica neurológica.
Hidratación enérgica en ambos casos: con solución fisiológica (ClNa0.9%) si el Na sérico no supera el valor de 155 en cuyo caso se utilizaría medio normal (0.45%). Los volúmenes como se muestran en el cuadro. (ESSALUD 2014)
Luego de 2 horas de hidratación se reevalúa volumen con producción de orina que debe ser superior a 1 ml/k/h (ENARM 2001).
Se inicia paralelamente a la resucitación, insulina en infusión a una dosis de 0.1UI/k/h sin necesidad de bolo inicial y se controla cada hora con glucemia sérica (ENARM 2022 - A).
Antes de iniciar la insulina se debe evaluar el nivel de potasio sérico y si este es bajo no iniciar (ver tabla 38)
Con el control horario de Glucemia y electrolitos se ajusta el tratamiento. (ESSALUD 2015)
Solo si indica Bicarbonato si este es menor de 5 o el pH es menos de 7.0.
En pacientes con diabetes, la hipoglucemia se define como cualquier episodio de glucosa en sangre anormalmente baja que expone a un individuo a un daño potencial, usualmente < 70 mg/dL.
La hipoglucemia tiene síntomas neuroglucopénicos e hiperactividad autonómica con sudoración fría, taquicardia e hipertensión.
La reversión de la hipoglucemia se hace con dextrosa al 33%.
La hipoglucemia es más común en la diabetes tipo 1 que en la diabetes tipo 2 y generalmente es causada por medicamentos para reducir la glucosa, a menudo en el contexto de una ingesta oral reducida, condiciones de requisitos de tratamiento disminuidos (como ejercicio o insuficiencia renal) o dosis incorrectas (ENARM 2022 -A) Cualquier paciente que experimente hipoglucemia repetida, pero especialmente aquellos con diabetes tipo 1 o diabetes tipo 2 avanzada, puede desarrollar inconsciencia de la hipoglucemia.
El desconocimiento de la hipoglucemia se caracteriza por la reducción o ausencia de los síntomas autonómicos que normalmente ocurren con la hipoglucemia (como palpitaciones, temblores, hambre) y pueden estar asociados con un umbral de glucosa más bajo para el desarrollo de estos síntomas. La clínica característica está dada por síntomas de hiperrespuesta autonómica como sudoración fría, taquicardia, cefalea e hipertensión asociado a síntomas neuroglucopénicos como confusión, sopor, coma y convulsión (ENARM 2012 – B, ENARM 2019 A, ENARM 2009 – A).
El primer signo de hipoglucemia en un paciente con inconsciencia de hipoglucemia puede ser confusión, que requiere la ayuda de otras personas para reconocer y tratar el episodio de hipoglucemia. Los individuos que no se dan cuenta de la hipoglucemia desarrollan un embotamiento progresivo de las respuestas cerebrales a la hipoglucemia.
La hipoglucemia severa puede causar convulsiones o eventos cardiovasculares, lo que lleva a accidentes automovilísticos, coma y / o muerte.
Manejo: tratamiento agudo de la hipoglucemia en la diabetes
Si el paciente está consciente, administre glucosa de 15 a 20 g por vía oral con Dextrosa al 33%. (ESSALUD 2015 y 2018)

El hipercolesterolemia es una afección caracterizada por niveles séricos elevados de colesterol total, colesterol de lipoproteínas de baja densidad (LDL), colesterol de lipoproteínas de no alta densidad (HDL) y apolipoproteína B (Apo B) (ENARM 2019-A).
El colesterol no HDL y el colesterol LDL elevados se asocian con un mayor riesgo de enfermedad cardiovascular y mortalidad. (ESSALUD 2010)
Las causas de la hipercolesterolemia pueden incluir trastornos genéticos primarios o pueden ser secundarias a obesidad, diabetes tipo 2, síndrome metabólico, enfermedad renal crónica, síndrome nefrótico, hipotiroidismo, enfermedad hepática colestásica y medicamentos seleccionados (como esteroides anabólicos)
Elevado CT y LDH (190-450) TG: normal Xantomas tendíneos o tuberosos. Xantelasmas, ECV prematura
millón Marcada elev. CT y LDH (>500) TG: normal Severa y extensa ateroesclerosis. Xantoma extensa
Elevado CT y LDL (130-250) TG: normal ECV prematura
Disbetalipoproteinemia familiar 1/5,000 Elevado CT y TG Xantoma tubero eruptiva y palmar
Hiperapobetalipoproteinemia familiar <1% APOB >135, LDL: <160 Xantelasmas, ECV prematura y obesidad
Utilice cambios en la dieta que incluyan reducir la ingesta de grasas saturadas (<7% de kcal) y reducir el porcentaje de calorías de grasas trans y grasas saturadas para reducir los niveles de colesterol LDL y de lipoproteínas de baja densidad
Considere aumentar la actividad física, como 40 minutos de ejercicio de intensidad moderada a vigorosa, 3 o 4 veces por semana
Cuando se prescriba farmacoterapia para el colesterol, utilice estatinas (inhibidores de la 3-hidroxi-3-metil-glutaril-coenzima A [HMG Co-A] reductasa) como fármacos de primera elección para reducir los niveles de colesterol LDL y de lipoproteínas de alta densidad, los cuales tiene como efecto adverso el daño muscular con dolor y a veces debilidad, elevación de la CPK y en casos extremos rabdomiólisis (ENARM 2006 – B) (ESSALUD 2003)
Terapia con estatinas de Alta intensidad
La dosis diaria reduce el c-LDL ≥ 50%
Atorvastatina 40-80 mg
Rosuvastatina 20-40 mg
Terapia con estatinas de Moderada intensidad
La dosis diaria reduce el c-LDL entre el 30% a <50%
Atorvastatina 10-20 mg
Rosuvastatina 5-10 mg
Simvastatina 20-40 mg
Pravastatina 40-80 mg
Lovastatina 40 mg
Flusvastatina 80 mg
Pitavastatina 2-4 mg
Terapia con estatinas de Baja intensidad
La dosis diaria reduce el c-LDL < 30%
Simvastatina 10 mg
Pravastatina 10-20 mg
Lovastatina 20 mg
Flusvastatina 20-40 mg
Pitavastatina 1 mg
Prevención secundaria en pacientes con enfermedad cardiovascular aterosclerótica clínica Recetar estatinas de alta intensidad con un objetivo de reducción del colesterol LDL ≥ 50% en pacientes ≤ 75 años, considerar estatinas de intensidad moderada o alta en pacientes> 75 años después de evaluar los riesgos y beneficios de la terapia Considere agregar ezetimiba a la terapia con estatinas máximamente tolerada en pacientes con LDL-C ≥ 70 mg / dL (≥ 1.8 mmol / L) que tienen un riesgo muy alto Considere agregar inhibidor de PCSK9 después de evaluar los riesgos y beneficios de la terapia en pacientes de muy alto riesgo con LDL-C ≥ 70 mg / dL (≥ 1.8 mmol / L) o nivel de no HDL-C ≥ 100 mg / dL (≥ 2.6 mmol / L) a pesar de la terapia combinada máxima tolerada de una estatina con ezetimiba.

Todo diabético debe utilizar estatinas excepto cuando el LDL inicial es menor de 70 y el objetivo general de los tratamientos es 100.
Tabla 26. Indicaciones de estatinas por estado y riesgo cardiovascular AHA (ENARM 2011 – A)
ECV = Enfermedad Cardiovascular Ateroesclerótica Clínica
Discuta los riesgos y beneficios de la terapia para reducir el colesterol, basándose en el riesgo de 10 años de ECV y teniendo en cuenta las preferencias del paciente utilizando la toma de decisiones compartida. Para los pacientes de alto riesgo (riesgo de ECV a 10 años ≥ 20%), administre una estatina de alta intensidad con el objetivo de reducir el C-LDL en ≥ 50%
Administre estatinas de intensidad moderada a pacientes con diabetes de 40 a 75 años, independientemente del riesgo estimado de ECV, considere estatinas de alta intensidad en pacientes con diabetes que tienen múltiples factores de riesgo de ECV Prescribir la terapia con estatinas máximamente tolerada en pacientes de 20 a 75 años con hipercolesterolemia primaria grave (C-LDL ≥ 190 mg / dl [≥ 4,9 mmol / L]) (recomendación fuerte); considerar la adición de ezetimiba si LDL-C ≥ 190 mg / dl (≥ 4,9 mmol / L) con una reducción <50% en LDL-C mientras recibe el tratamiento con estatinas tolerado al máximo y / o si LDL-C ≥ 100 mg / dl (≥ 2,6 mmol / L)
La vitamina A es un retinoide soluble en grasa importante para la visión normal, la función inmunológica, la reproducción y el crecimiento celular, la diferenciación y la comunicación
El Déficit de vitamina A causa una variedad de trastornos, que con frecuencia se manifiestan como:
♦ Anomalías oculares (xeroftalmia) que pueden progresar a ceguera
♦ Aumento de la morbilidad y la mortalidad infecciosas
♦ Crecimiento y desarrollo infantil deficiente
(ENARM 2007 – A, ENARM 2015 I -A, ENARM 2020 A)
La deficiencia de vitamina D, causada por niveles bajos de vitamina D en la sangre, puede causar anomalías en el metabolismo del calcio, el fósforo y los huesos
No existe un límite de consenso para la deficiencia de vitamina D, pero generalmente se considera como una 25-hidroxivitamina D (25 [OH] D) sérica <20 ng / mL (50 nmol / L)
Los niveles séricos de 25 (OH) D ≥ 20-30 ng / mL (50-75 nmol / L) generalmente se consideran normales
Tipos de vitamina D:
♦ Vitamina D2 (ergocalciferol): presente en algunos alimentos y suplementos dietéticos
♦ Vitamina D3 (colecalciferol): se forma en la piel expuesta a la luz ultravioleta y está presente en algunos alimentos y suplementos dietéticos
♦ 25-hidroxivitamina D (25 [OH] D, calcidiol) - principal forma circulante de vitamina D, creada a través del metabolismo hepático de la vitamina D2 y D3
♦ 1,25 dihidroxivitamina D (1,25- [OH] 2D3, calcitriol): forma biológicamente activa de vitamina D (promueve la absorción intestinal de calcio y fosfato, la homeostasis del calcio y la mineralización del esqueleto), creada a través del metabolismo renal de la 25 (OH) D
Las causas comunes de la deficiencia de vitamina D incluyen una síntesis disminuida en la piel (por ejemplo, debido a la pigmentación oscura de la piel, el envejecimiento o la falta de exposición a la luz solar), ingesta dietética inadecuada, absorción gastrointestinal alterada, síndrome nefrótico, medicamentos y metabolismo hepático alterado
(ENARM 2004, ENARM 2001)
Trastorno adquirido del tejido conjuntivo por alteración de la síntesis de colágeno debido a una deficiencia de ácido ascórbico en la dieta (vitamina C).
Se denomina ESCORBUTO
Manifestaciones clínicas del escorbuto:
♦ Se puede ver dentro de 1-3 meses de ingesta irregular o inadecuada
♦ Debido principalmente al papel esencial de la vitamina C en la síntesis de colágeno, incluyendo
– Vainas de apoyo alrededor de los vasos sanguíneos pequeños
Hueso de rápido crecimiento
Las primeras etapas (1-3 meses de ingesta inadecuada) se pueden caracterizar por:
♦ Manifestaciones dermatológicas, que incluyen petequias, hemorragias perifoliculares (a menudo se observan primero en las extremidades inferiores), equimosis, hiperqueratosis, pelos en tirabuzón
♦ Enfermedad gingival, caracterizada por hinchazón, equimosis, sangrado y aflojamiento de los dientes
♦ Anemia, mialgia, dolor de huesos, fácil aparición de hematomas (a menudo se observa primero en las extremidades inferiores) e hinchazón
♦ Mala cicatrización de heridas
♦ Malestar, fatiga y letargo
♦ Cambios de humor
♦ Depresión
(ENARM 2001, ENARM 2004)
Deficiencia de vitamina B1 (tiamina) que puede causar una amplia gama de trastornos, principalmente neurológicos, cardiovasculares y gastrointestinales
Población afectada:
♦ Anciano
♦ Poblaciones en países con dietas deficientes y donde no se han establecido programas de enriquecimiento y complementación con tiamina
♦ Pacientes con trastorno por consumo de alcohol (dependencia o abuso) y mala nutrición

♦ Déficit agudo causa Beriberi (ENARM 2000, ENARM 2003)
Beriberi seco
• Parestesias
• Fatiga
• Confusión
• Debilidad de la pierna
• Sensibilidad en los músculos de la pantorrilla
– Beriberi mojado
• Síntomas de insuficiencia cardíaca, incluyendo disnea, edema
• Inquietud
– Beriberi gastrointestinal
• Anorexia
• Pérdida de peso
• Náuseas y vómitos
• Dolor abdominal severo
• Estreñimiento
• Diarrea (raro)
ENCEFALOPATÍA DE WERNICKE (ENARM 2010 – A, ENARM 2021 – B)
♦ La encefalopatía de Wernicke es un síndrome neuropsiquiátrico agudo causado por deficiencia de tiamina (vitamina B1) con una tríada clásica de nistagmo y oftalmoplejía, cambios en el estado mental y ataxia.
♦ Suele ocurrir en pacientes que abusan del alcohol, aunque también se puede observar en pacientes en tratamiento por cáncer, aquellos con vómitos crónicos o desnutrición, o en aquellos que se han sometido a cirugía gastrointestinal, en particular cirugía bariátrica.
SÍNDROME DE KORSAKOFF
♦ El síndrome de Korsakoff es un deterioro en la función de la memoria que generalmente sigue a la encefalopatía de Wernicke, con la memoria y el aprendizaje afectados de manera desproporcionada a otras funciones cognitivas en un individuo alerta y receptivo.
♦ Se ha informado del síndrome de Korsakoff hasta en el 85% de los pacientes con encefalopatía de Wernicke que sobreviven.
♦ La causa más común de encefalopatía de Wernicke subyacente es la deficiencia de tiamina relacionada con el alcohol.
La vitamina B12 (también llamada cobalamina) es un cofactor importante para la síntesis de ADN y el metabolismo celular.
Los efectos clínicos más comunes de la insuficiencia de vitamina B12 son la anemia megaloblástica y la enfermedad neuropsiquiátrica.
La causa más común de deficiencia grave de vitamina B12 es la anemia perniciosa, que se debe a la pérdida del factor intrínseco de la gastritis atrófica autoinmune.
Otras causas de la deficiencia de vitamina B12 incluyen:
♦ Absorción gastrointestinal alterada debido a malabsorción de alimentos gástricos-vitamina B12 (especialmente común entre los ancianos), cirugía bariátrica (bypass gástrico) o resección o enfermedad gástrica o ileal
♦ Medicamentos comunes que interfieren con la absorción de vitamina B12 y afectan los niveles séricos, como el uso prolongado de antagonistas del receptor H2 o inhibidores de la bomba de protones y metformina; Además, el abuso de óxido nitroso puede conducir a la inactivación química de la vitamina B12.
Las presentaciones varían ampliamente en tipo y gravedad, pero la deficiencia de vitamina B12 a menudo se presenta como uno o ambos de:
♦ Anemia macrocítica, con o sin síntomas (como fatiga o disnea)
♦ Hallazgos neuropsiquiátricos como parestesias, paraparesia espástica, alteración de la marcha, déficits sensoriales, deterioro cognitivo leve o demencia
Los mecanismos de la deficiencia de folato incluyen:
♦ Ingesta reducida, por ejemplo, debido a una dieta deficiente o un trastorno por consumo de alcohol
Ver el cuadro resumen de la UNIDAD:
Vitaminas en la Tabla 42.
♦ Malabsorción, por ejemplo, debido a un trastorno por consumo de alcohol, enfermedades gastrointestinales (especialmente enfermedad celíaca, enfermedad de Crohn y esprúe tropical en países en desarrollo) y drogas
♦ Interferencia inducida por fármacos con el metabolismo del folato, por ejemplo, análogos del folato, trimetoprima y pirimetamina.
♦ Aumento de las necesidades, por ejemplo, debido al embarazo y la lactancia, enfermedades neoplásicas, diálisis o medicamentos.

Los pacientes pueden estar asintomáticos o presentar síntomas de anemia, pancitopenia, deterioro neurológico o defectos del tubo neural (en recién nacidos).
VITAMINAS HIDROSOLUBLES
Vitamina B1 (Tiamina) (ENARM 2000) Beriberi – Insuficiencia cardíaca congestiva (beriberi húmedo), afonía, neuropatía periférica. Encefalopatía de Wernicke (nistagmo, oftalmoplejía, ataxia), confusión o coma
Vitamina B2 (Riboflavina)
(ENARM 2019 - A, ENARM 2022 - A)
Niacina (Acido Nicotínico) (ENARM 2006 – B, ENARM 2018) (ESSALUD 2004 y 2016)
Síntomas inespecíficos que incluyen edema de las membranas mucosas, estomatitis angular, glositis y dermatitis seborreica
Pelagra – Dermatitis en áreas expuestas a la luz solar; diarrea con vómitos, disfagia, inflamación de la boca (glositis, estomatitis angular, queilitis); dolor de cabeza, demencia, neuropatía periférica, pérdida de memoria, psicosis, delirio, catatonia.
Vitamina B6 (Piridoxina) Anemia, debilidad, insomnio, dificultad para caminar, neuropatía periférica, dermatitis seborreica naso labial, queilosis, estomatitis
Vitamina B12 (Cobalamina) Anemia megaloblástica (anemia perniciosa), neuropatía periférica con deterioro de la propiocepción; puede incluir neuropatía axonal u óptica y proceso mental lenta Folato Anemia megaloblástica; puede incluir neuropatía sensorial predominante
Vitamina C Escorbuto – Fatiga, petequias, equimosis, encías sangrantes, depresión, piel seca, deterioro de la cicatrización de heridas
VITAMINAS LIPOSOLUBLES
Vitamina A (Retinol) (ENARM 2002)
Ceguera nocturna, xeroftalmía, queratomalacia, mancha Bitot, hiperqueratosis folicular (ESSALUD 2012, 2013 y 2019)
Vitamina D (Colecalciferol) Raquitismo, osteomalacia, craneotabes, rosario raquítico
Vitamina E (Tocoferoles) (ENARM 2003)
Antioxidante por excelencia. Neuropatía sensorial y motora, ataxia, degeneración retiniana, anemia hemolítica
Vitamina K (Filoquinonas) Enfermedad hemorrágica