

Together, we can improve patient outcomes
Dextile™ anatomical shape
V-Loc™ wound closure device





One complete solution for your surgical needs
Veriset™ hemostatic patch


LigaSure™ Maryland device EEA™ circular stapler with Tri-Staple technology

VersaOne™ optical trocar
Procedural kit
Sonicision™ curved jaw cordless ultrasonic dissection system


© 2022 Medtronic. 22-weu-si-products-box-ad-1-6655623 medtronic.com/covidien/uk
Signia™ small diameter reload

TEMAER I 2022
Nr. 1 Utenfor komfortsonen – den knivløse behandlingen Nr. 2 Anoproktologi Nr. 3 Pankreatitt Nr. 4 Kneluksasjon – vurdering og behandling
INNLEVERINGSFRISTER:
Kirurgen nr 1: 24. januar
Kirurgen nr 2: 24. april
Kirurgen nr 3: 24. august
Kirurgen nr 4: 24. oktober
Kirurgen ønsker å være en nasjonal plattform for kirurgi ved å inspirere til faglig kompetanseheving, bedre utdanning og opplæring av unge kirurger, samt øke interessen for kirurgisk forskning.


– VISJON, KIRURGEN
UTGIVER
Norsk Kirurgisk Forening Pb 17 Kjelsås, 0411 Oslo ISSN 1504-88 88
REDAKSJON
Marte Bliksøen (redaktør) OUS Rikshospitalet marte@kirurgen.no
Saira Mauland Mansoor (webredaktør) OUS Ullevål. saira@kirurgen.no


Ingvar Rognum (redaksjonsmedlem)
Vestre Viken Bærum sykehus ingvar@kirurgen.no
Uzma Ilyas (redaksjonsmedlem)
Vestre Viken Drammen sykehus uzma@kirurgen.no
LAYOUT, PRODUKSJON
OG ANNONSESALG WebPress
Tlf.: 22 76 00 00 john@webpress.no www.webpress.no
FASTE SPALTER
Ord fra redaktøren 193
Ord fra lederen 195
TEMA
The mother of all knee injuries 196
Kneluksasjon – diagnostikk og initial behandling 198 Knee dislocations with vascular injuries 202 Kirurgiske behandlingsmetoder ved kneluksasjoner 206
Behandling av droppfot etter skade av nervus peroneus 211 Nervetransposisjon for droppfot etter kneluksasjon 216
Resultater etter kirurgisk behandling av kneluksasjon 220 Rehabilitering etter multiligament knekirurgi 224
AKTUELT
Bekkenreservoar og noen kirurgiske forhold som er nødvendige for et godt resultat 230 Vinner av Kirurgens pris 2021/2022 233 Funks ærespris og det kirurgiske samholdet 234 Brynjulf Ystgaard nytt æresmedlem i NKF 236
Enkel sårlukking med automatisk vevsekspander
Sår lukkes i løpet av få dager. Konstant og kontrollert kraft på 1,2 kg gir rask vevsekspansjon. Bruk flere enheter på større sår. Lett å påføre og fjerne.
Les mer på www.medistim.no
Medistim Norge AS, Postboks 6631 Etterstad, 0607 Oslo. Tlf: 23 03 52 50 E-mail: norge@medistim.com - www.medistim.no



 MARTE BLIKSØEN , REDAKTØR MARTE @ KIRURGEN.NO
MARTE BLIKSØEN , REDAKTØR MARTE @ KIRURGEN.NO
TAKK FOR ET FINT 2022
Redaksjonen vil gjerne takke alle bidragsytere til året 2022 – dere gjør arbeidet med Kirurgen givende og spennende!
Kirurgen vil formidle nyeste kunnskap og oppdatert praksis til medlemmer av NKF. Skal vi klare det, er vi prisgitt bidrag fra leserne våre. Vi i redaksjonen er svært takknemlige for at dere stiller opp – tusen takk! Bladet består i dag av en temadel, som har vært velkjent i mange år. I tillegg publiserer vi forskning og utdanning med PhD-sammendrag og akuttkirurgiske bidrag. Sistnevnte er ment som hjelp for alle kollegaer som håndterer akuttkirurgiske tilstander. Aktuelt-spalten inneholder pasientkasus og annet som er spennende og nyttig. Det skal ikke bare være rom for bidrag fra spesialister og etablerte kirurger – vi setter også stor pris på bidrag fra yngre kirurger. Har du et forslag til tema som kan være interessant for NKFs medlemmer – send en mail til redaksjonen i Kirurgen!

Hvert år deler Kirurgen ut en pris for årets beste artikkel. En uavhengig og kompetent bedømmelseskomite leser og vurderer alle artiklene fra temadelen, og kårer én vinner. I år vant Seternes med medforfattere fra St. Olavs hospital prisen for artikkelen om enteroatmosfæriske fistler behandlet med chimney-VAC. Førsteforfatteren vant også i 2019, hvilket vitner om svært høy kvalitet og
gode ideer om hvordan man kan komme seg ut av vanskelige situasjoner. Vinneren av årets artikkel mottar et stipend på 15.000 NOK. Andreplassen gikk til Elin Thorsen for artikkelen om ernæring, som ble publisert i Kirurgen nr 1, 2022. Ernæring er et tema som for de fleste kirurger ikke har høyest fokus, men som er svært viktig for pasientrekonvalesensen og pasientutfallet. Artikkelen fungerer godt som et oppslagsverk og det er ikke spesielt vanskelig å huske tallet 30! I år ble det også bemerket at det ortopediske nummeret om nakke- og ryggskader i sin helhet var spesielt godt skrevet med svært nyttige og fine illustrasjoner.
Kirurgens redaksjonsmedlemmer består av kirurger i hundre prosent kliniske stillinger og flere av oss forsker i tillegg. Arbeidet vi gjør i Kirurgen gjør vi på vår fritid og jeg vil rekke en stor takk til redaksjonsmedlemmene: Uzma, Saira og Ingvar. De stiller opp på sene kvelder, korrekturleser alle artikler og kommer med svært gode innspill og ideer. Vi utfyller og avlaster hverandre godt.
I 2023 vil Kirurgen dekke kreft i magesekken, sykdommer i lever og galleveier og sarkom. Redaksjonens mål for 2023 er å bedre brukeropplevelsen og navigasjonen på kirurgen.no, slik at den blir et enda bedre oppslagsverk i en travel klinisk hverdag. Vi ser frem til et spennende nytt år.
Mitomycin medac 40 mg pulver og væske til intravesikaloppløsning
Indikasjoner: Mitomycin medac er indisert for intravesikal administrasjon som profylakse mot tilbakefall hos pasienter med overflatisk blærekarsinom etter transuretral reseksjon. Kontraindikasjoner: Overfølsomhet overfor virkestoffet(ene) eller overfor noen av hjelpestoffene. Amming, Perforasjon av blæreveggen, Cystitt. Advarsler og forsiktighetsregler: Ekstravasasjon etter intravesikal administrasjon: Symptomer på ekstravasasjon etter intravesikal mitomycinadministrasjon kan være til stede rett etter bruk eller uker eller måneder senere. Det kan være uklart om ekstravasasjonen oppsto som følge av uoppdaget perforasjon, en fortynnet muscularis propria eller om legemidlet ikke ble korrekt administrert. På grunn av mitomycins toksiske effekt på benmargen må andre behandlingsmodaliteter som virker hemmende på benmargen (spesielt andre cytostatika og strålingsbehandling) administreres med særlig forsiktighet for å minimere risikoen på ytterligere benmargssuppresjon. Langvarig terapi kan resultere i kumulativ benmargstoksisitet. Benmargssuppresjon blir først synlig etter en forsinkelse, sterkest etter 4 – 6 uker, og akkumuleres etter lengre bruk og krever derfor ofte en individuell dosejustering. Eldre pasienter har ofte redusert fysiologisk funksjon og benmargssuppresjon, som kan ha et forlenget forløp, og hos denne populasjonen må mitomycin derfor administreres med særlig forsiktighet mens pasientens tilstand overvåkes nøye. Mitomycin er en substans som er mutagent og potensielt karsinogent for mennesker. Kontakt med hud og slimhinner skal unngås. Når det oppstår pulmonale symptomer som ikke kan tilskrives underliggende sykdom skal behandlingen seponeres umiddelbart. Pulmonal toksisitet kan behandles på en god måte med steroider. Behandlingen skal også seponeres umiddelbart ved symptomer på hemolyse eller tegn på ny-resvikt (nefrotoksisitet). Forekomst av hemolytisk-uremisk syndrom (irreversibel nyresvikt [HUS], mikroangiopatisk hemolytisk anemi [MAHA-syndrom] og trombocytopeni) er vanligvis fatalt. Det er observert mikroangiopatisk hemolytisk anemi ved intravenøse doser > 30 mg mitomycin/m² kroppsover-flate. Nøye overvåking av nyrefunksjonen anbefales. Ingen tilfeller av MAHA er observert hittil etter intravesikal bruk av mitomycin. Nye funn tyder på at en terapeutisk prøveperiode kan være hensiktsmessig for å fjerne immunkomplekser, som ser ut til å spille en stor rolle når symptomer oppstår for første gang, ved hjelp av immunadsorpsjon med stafylokokkprotein A-kolonner. Forekomst av akutt leukemi (i noen tilfeller etter en preleukemisk fase) og myelodysplastisk syndrom er rapportert hos pasienter som fikk samtidig intravenøs behandling med mitomycin og andre antineoplastiske midler. Bivirkninger: Bivirkninger er listet opp nedenfor etter organklassesystem og frekvens. Frekvensene er definert på følgende måte: Svært vanlige (>1/10), vanlige (> 1/100 til < 1/10), mindre vanlige (> 1/1000 til < 1/100), sjeldne (> 1/10 000 til < 1/1000), svært sjeldne (< 1/10 000), og ikke kjent (kan ikke anslås ut ifra tilgjengelige data). Mulige bivirkninger under intravesikal behandling: Bivirkninger kan oppstå enten på grunn av oppløsningen til intravesikal instillasjon eller etter dyp reseks-jon. De mest vanlige bivirkningene av intravesikal administrering av mitomycin er allergiske hudreaksjoner i form av lokalt eksantem (f.eks. kontaktdermatitt, også i form av palmar- og plantarerytem) og cystitt. Hud- og underhudssykdommer: Vanlige: Allergisk hudutslett, kontaktdermatitt, palmar-/plantarerytem, pruritus. Sykdommer i nyre og urinveier: Vanlige: Cystitt (muligens hemoragisk), dysuri, nokturi, pollakisuri, hematuri, lokal irritasjon av blæreveggen. De mest vanlige bivirkningene av systemisk administrert mitomycin er gastrointestinale symptomer som kvalme og oppkast, og benmargssuppresjon med leukopeni og vanligvis dominant trombocytopeni. Denne benmargssuppresjonen opptrer hos opptil 65 % av pasientene. Hos opptil 10 % av pasientene må alvorlig organtoksisitet i form av interstitiell pneumoni eller nefrotoksisitet forventes. Mitomycin er potensielt hepatotoksisk. Sykdommer i blod og lymfatiske organer: Svært vanlige: Benmargssuppresjon, leukopeni, trombocytopeni. Vanlige: Interstitiell pneumoni, dyspné, hoste, kortpustethet. Svært vanlige: Kvalme, oppkast. Hud- og underhudssykdommer: Vanlige: Eksantem, allergisk hudutslett, kontaktdermatitt, palmar-/plantarerytem. Mindre vanlige: Alopesi. Sykdommer i nyre og urinveier: Vanlige: Ny-resvikt, økt kreatininnivå i serum, glomerulopati, nefrotoksisitet. Generelle lidelser og reaksjoner på administrasjonsstedet: Vanlige: Etter ekstravasasjon: cellulitter, vevsnekrose. Mindre vanlige: Feber. Emballasje (type og innhold): Mitomycin medac leveres i et klart hetteglass (type I-glass) med gummipropp av bromobutyl som er dekket av fluorplast, og et flip-off-lokk med aluminiumsforsegling. Pakninger med 1 hetteglass (50 ml), 1 PVC-pose på 40 ml med natriumklorid 9 mg/ml (0,9 %) oppløsning, med/uten katetre. Pakninger med 4 hetteglass (50 ml), 4 PVC-poser på 40 ml med natriumklorid 9 mg/ml (0,9 %) oppløsning, med/uten katetre. Pakninger med 5 hetteglass (50 ml), 5 PVC-poser på 40 ml med natriumklorid 9 mg/ml (0,9 %) oppløsning, med/uten katetre. Ikke alle pakningsstørrel-ser vil nødvendigvis bli markedsført. Se gjeldende pris på: www.felleskatalogen.no. Utlevering: Reseptpliktig legemiddel, Reseptgruppe C. ATC-Kode: L01DC03. National version, SPC: 19.01.2021.
BCG-medac (Bacillus Calmette-Guérin), pulver og væske til intravesikalsuspensjon
Virkestoff: Tuberkulosebakterier levende Bacillus Calmette-Guerin (BCG) bakterier stamme RIVM fra stamme 1173-P2



Indikasjoner: Behandling av ikke-invasiv urotelial blærekreft (karsinom): kurativ behandling av karsinom in situ, profylaktisk behandling av re-kurrens av: urotelial karsinom begrenset til mucosa: Ta G1G2 hvis multifokal og/eller rekurrent tumor, Ta G3, urotelial karsinom i lamina propria, men ikke i blærens muskulatur (T1), karsinom in situ. Kontraindikasjoner: Overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene. BCG-medac skal ikke brukes av pasienter med immunsuppresjon, eller av personer med kongenitale eller akvirerte immundefekter, enten forårs-aket av sykdom (f. eks. positiv HIV serologi, leukemi, lymfom), kreftbehandling (f. eks. cytostatiske legemidler, strålebehandling) eller immunterapi (f. eks. kortikosteroider). BCG-medac skal ikke administreres til personer med aktiv tuberkulose. Risiko for aktiv tuberkulose må utelukkes ved grundig anamnese og, hvis indisert ved diagnostiske tester, i samsvar med lokale retningslinjer. Tidligere strålebehandling av blæren. Be-handling med BCG-medac er kontraindisert for ammende kvinner. BCG-medac skal ikke instilleres før 2 til 3 uker etter TUR, blærebiopsi eller katetertraumatisering. Blæreperforasjon, akutt urinveisinfeksjon. Advarsler og forsiktighetsregler: BCG-medac skal ikke brukes til subkutan, intradermal, intramuskulær eller intravenøs administrasjon eller vaksinasjon. Bivirkninger: Lokale eller systemiske symptomer under behandling med BCG-medac kan påvirke evnen til å kjøre bil eller bruke maskiner. Innenfor hver frekvensgruppering er bivirkninger presentert etter synkende alvorlighetsgrad. Infeksiøse og parasittære sykdommer Svært vanlige: Cystitt og betennelse (granulom) i blæren, asymptomatisk granulomatøs prostatitt. Mindre vanlige: Urinveisinfeksjon, orkitt, epididymitt, symptomatisk granulomatøs prostatitt, alvorlig systemisk BCG-reaksjon/infeksjon, BCG-sepsis, miliær pneumonitt, hudabscess, Reiters syndrom (konjunktivitt, asymmetrisk oligoartritt, og cystitt). Forstyrrelser i immunsystemet Svært vanlige: Forbigående systemisk BCG-reaksjon (feber < 38,5 °C, influensalignende symptomer, inkludert illebefinnende, feber, frysninger, generelt ubehag, myalgi). Mindre vanlige: Pulmonal granuloma. Gastrointestinale sykdommer Svært vanlige: Kvalme. Vanlige: Diaré. Sykdommer i muskler, bindevev og skjelett Vanlige: Myalgi. Mindre vanlige: Artritt, artralgi. Sykdommer i nyre og urinveier Svært vanlige: Hyppig vannlating med ubehag og smerte. Mindre vanlige: Makroskopisk hematuri, blæreretensjon, urinveisobstruksjon, kontraktert blære. Generelle lidelser og reaksjoner på administrasjonsstedet Vanlige: Feber > 38,5 °C. Mindre vanlige: Hypotensjon. Bivirkninger ved BCG-behandling er hyppige, men generelt milde og forbigående. Bivirkningene øker vanligvis med antallet BCG-instillasjoner. Emballasje (type og innhold): Pulver på hetteglass (type I glass) med gummipropp + 50 ml væske i en pose (PVC) med et koblingsstykke og en kateteradapter (konisk eller Luer-Lock adapter). Pakningsstørrelser (konisk adapter): 1, 3, 5 eller 6 med/uten kateter. Pakningsstørrelser (Luer-Lock adapter): 1 eller 3 med/uten kateter. Ikke alle pakningsstørrelser vil nødvendigvis bli markedsført. Se gjeldende pris på: www. felleskatalogen.no. Utlevering: Reseptpliktig legemiddel. Reseptgruppe C. ATC-Kode: L03AX03. National version, SPC: 07.06.2021. For fullstendig produktinformasjon: www.legemiddelverket.no / www.felleskatalogen.no

KJÆRE KOLLEGER

Det 98. Høstmøtet er vel overstått. Det er svært gledelig å registrere at norske kirurger fortsatt prioriterer Høstmøtet og at deres tilbakemeldinger er gode. Godt faglig utbytte, aktuelle og spennende sesjoner, stort sosialt utbytte og bra representasjon fra utstillere er noe som går igjen i tilbakemeldingene. Høstmøtet er nå tilgjengelig på web for de som ikke fikk med seg alt eller vil se noe om igjen. Mye godt materiale for internundervisninger fremover.
Arbeidet med Høstmøtet 2023 er allerede startet og våre ambisjoner blir stadig større.
Spesialistdiplom i Generellkirurgi sendes nå gratis til de som ikke har fra før, se senere i bladet.

NKF ser tilbake på et effektivt år. Mye arbeid har blitt lagt ned for å styrke norsk kirurgi og vi ser resultater av vårt arbeid. Sammen har vi hevet den kirurgiske stemmen og tatt vår plass som den naturlige parten vi er når spesialisthelsetjenesten, spesialistutdanning etc. skal diskuteres og forbedres. Vårt arbeid stopper aldri, men vi seiler i medvind inn i 2023.
På vegne av styret i NKF håper vi julefreden gradvis begynner å senke seg og ønsker dere alle en god jul og godt nytt år.
Mvh John ChrTHE MOTHER OF ALL KNEE INJURIES
 LARS ENGEBRETSEN OG GILBERT MOATSHE ORTOPEDISK AVDELING, OSLO UNIVERSITETSSYKEHUS
LARS ENGEBRETSEN OG GILBERT MOATSHE ORTOPEDISK AVDELING, OSLO UNIVERSITETSSYKEHUS
 MOATSHE
MOATSHE
Kneluksasjonen, definert som en akutt skade av minst tre av kneets viktigste bånd-fremre og bakre korsbånd og enten det laterale eller mediale båndkompleks eller begge, er heldigvis sjelden. Trolig er det omtrent 40-50 per år i Norge (vi har i snitt 30 per år ved OUS). Hvert år er det en pasient eller to som har neurovaskulære skader i tillegg og som ender med en crus amputasjon. Ortopeden ved OUS har hatt en spesiell interesse for kneluksasjonene siden mai 1996. Vi har en stor pasientdatabase (>450 pasienter) som har hjulpet oss i tilnærmingen til behandling som er basert på andres og vår erfaring gjennom de siste 25 år. I tillegg har Gilbert Moatshe disputert med en avhandling på dette området.
De aller fleste pasienter ender opp pä OUS fordi denne skaden krever spesialkompetanse. En kneluksasjon er ofte komplisert med kar, nerve, brusk og beinskader og krever spesialkompetanse på diagnostikk, kirurgi og rehabilitering. Vanligvis skjer skaden i forbindelse med idrett (44%), men på Ullevål ser vi den ofte i trafikken, typisk i mai når folk tar ut motorsykkelen fra vinteroppla-
get (50% hvorav 25% skjer ved ulykker med store motorsykler). Mens mer enn 50 % er høy energi skader, skjer nesten 50% med lav energi-typisk i idrett. Noen få ganger i året ser vi en kneluksasjon hos en overvektig pasient som med hunden i band trår feil, for eksempel i en vannpytt, og pådrar seg en kneluksasjon med kar og nerveskade. MEN HUSK: >40% har multitraumer, inkludert mange frakturer, nesten 30% livstruende skader i hodet, thoraks og abdomen som taes hand om etter ATLS prinsippet og da er faren stor for at kneluksasjonen ikke oppdages, selv om 5-10 % har skade av arteria poplitea og er uten sirkulasjon i ekstremiteten. Ankel-arm index på <0.9 skal lede til CT angiografi. Karkirurgien prioriteres og knekirurgien gjøres i senfasen (> 6 uker senere).
Basert på erfaring og publikasjoner vil de fleste pasientene bli operert i løpet av de to første ukene etter skaden, pasienter med multitraumer og frakturer etter noen måneder, mens noen få blir rehabilitert uten kirurgi. I tillegg til ligamentskadene har 37% meniskskader, 30% bruskskader, 16% frakturer i samme underekstremitet, 8 % skade av ekstensorapparatet, 20% mer eller mindre skade av nervus peroneus (noen fører til klinisk droppfot) og 6% skade av arteria poplitea.
Hos OUS pasientene er gjennomsnittsalderen 38 år og 65% er menn. Ved ankomst på Ortopedisk klinikk vil alle gjennomgå en vanlig kundeundersøkelse, alle vil gjennomføre en kne MR, noen pasienter CT angio og noen røntgen stressbilder i utredningen. De aller fleste vil gjennomgå kirurgi i løpet av to uker, korsbånd og sidebånd blir rekonstruert, menisker og brusk blir reparert, nervus peroneus blir frilagt, mens frakturer i samme ekstremitet blir reponert og fiksert slik at pasienten kan starte rehabilitering i form av ledd bevegelighet dager etter kirurgien.
I denne utgaven av “Kirurgen” presenteres ulike sider ved kneluksasjonen. Utviklingen i nødvendig diagnostikk, det beste tidspunkt for kirurgi, komplikasjoner ved skaden og kirurgien samt rehabiliteringen blir presentert i korte artikler. Avslutningsvis presenterer vi resultater av dagens behandling inkludert retur til arbeid og idrett samt langtidsresultater. Det er fortsatt en høy grad av gonartrose etter kneluksasjoner og det er behov for mer forskning for å forbedre resultater etter kirurgisk behandling.

De kirurgiske metodene er blitt utviklet mye (blant annet av Ortopedisk Klinikk OUS) de siste 25 årene og nye kirurgiske metoder publiseres årlig. Denne utgaven av Kirurgen presenterer dagens metoder ved Ortopedisk klinikk OUS.
REFERANSER:
KLIKK her for å se referansene på kirurgen.no
KNELUKSASJON
DIAGNOSTIKK OG INITIAL BEHANDLING
BAKGRUNN
Kneluksasjon er en sjelden ortopedisk skade, men dersom skaden ikke håndteres riktig i løpet av de første timene kan konsekvensen for pasienten være stor. Historisk sett har man hatt stor respekt for skaden, og i 1825 skrev William Gibson at en kneluksasjon vanligvis leder til voldsomme symptomer og i noen tilfeller død, dersom ekstremiteten ikke raskt behandles med amputasjon (1). Heldigvis har både diagnostikken og behandlingen gått fremover siden den tiden, men resultatene av behandlingen har fortsatt stort potensiale for forbedring nesten 200 år senere.
DEFINISJON
Historisk sett har en dislokasjon av kneleddet vært en klinisk eller radiologisk diagnose, med en unormal stilling i tibiofemoralleddet ved undersøkelse (Figur 1). Opprinnelig, da diagnosen var avhengig av klinisk verifisert luksasjon, ble det brukt en anatomisk klassifikasjon som beskrev tibias posisjon i forhold til femur i luksasjonen (2). Dette er problematisk siden omtrent 50% av alle dislokasjoner reponeres spontant, og vil derfor kunne overses eller ikke kunne klassifiseres. Spontant reponert kneluksasjoner med skade i begge korsbånd har like høy risiko for nerve- og karskader som ikke reponerte kneluksasjoner. Det er nå vanligere å omtale en kneluksasjon som en samtidig skade på begge korsbånd (fremre og bakre), oftest i kombinasjon med ett eller begge sideligamentkomplekser. Det er rapportert dislokasjoner der kun ett av korsbåndene er skadet, men det er såpass sjeldent at det nesten kan ignoreres. I dag brukes klassifikasjonen utarbeidet av Robert Schenk og senere modifisert av Wascher, som beskriver de skadede strukturene (Tabell 1) (3). Denne klassifikasjonen forenkler kommu-
nikasjonen mellom klinikere, er nyttig i planlegging av kirurgisk behandling og kan brukes i forskning.
FOREKOMST
Den sanne forekomsten av kneluksasjon er sannsynligvis underestimert, da en del av disse skadene autoreponerer og går under den diagnostiske radaren. Undersøkelse i akuttfasen er ofte smertefull, og dynamisk muskulær kompensasjon kan lure også den erfarne klinikeren til å tro at skaden ikke er så stor. På Ullevål sykehus opereres årlig omtrent 20-30 kneluksasjoner, og nedslagsfeltet dekker omtrent 50% av Norges befolkning, men vi får også pasienter fra andre helseregioner. En studie fra Finland, som brukte diagnosekoder fra et nasjonalt register til å identifisere kneluksasjoner, konkluderte med at insidensen hos den delen av befolkningen med høyest risiko (menn i alderen 18-29 år) var 29 per 1 000 000 personår i 2019 (4). Det tilsvarer omtrent én av 35 000 personer i den aldersgruppen per år.
Schencks anatomiske klassifikasjon av knedislokasjoner
Skadet struktur
KD I Kun et korsbånd + kollateralligamenter
KD II ACL + PCL med intakte kollateralligamenter
KD III M ACL + PCL + MCL
KD III L ACL + PCL + LCL
KD IV ACL + PCL + MCL + LCL
KD V Knedislokasjon + fraktur
TABELL 1: Schenck klassifikasjon av kneluksasjoner basert på ligamentskader ACL, anterior cruciate ligament (fremre korsbånd); PCL, posterior cruciate ligament (bakre korsbånd); MCL, medial collateral ligament (mediale kollateralligament); LCL, lateral collateral ligament (laterale kollateralligament).
SKADEMEKANISME
Historisk sett har høyenergiskader blitt sett på som den vanligste skademekanismen. Rapporter om kneluksasjoner på 1800- og 1900-tallet beskrev ofte ulykker i forbindelse med hestetransport eller gruvearbeid som skadeårsak. Dette har over tid endret seg til å inkludere bil- og motorsykkelulykker samt idrettsrelaterte skader. Imidlertid kan kneluksasjoner også oppstå ved lavenergitraumer. Pasienten med kneluksasjon etter lavenergitraume er ofte overvektig og skader seg ved uhell i hverdagsaktiviteter (5). Denne pasientgruppen er vanskelig å behandle grunnet risiko for komplikasjoner særlig med tanke på nerve- og karskader (6). Skademekanismen hos pasienter som behandles ved Oslo universitetssykehus (OUS) er rapportert jevnt fordelt mellom høy- og lavenergitraumer (7).
DIAGNOSTIKK/INITIAL VURDERING
Sykehistorien gir viktig informasjon om initial feilstilling og energi som er involvert i skadeøyeblikket. Husk å notere tidspunktet for skaden i tilfelle det er behov for senere karkirurgi. Vanlige Advanced Trauma Life Support (ATLS) prinsipper følges hos multitraumepasienter med undersøkelse av kneleddet etter at vitale funksjoner er sikret.

Klinisk undersøkelse
Området rundt kneet undersøkes med tanke på blodutredelser, hevelse og sår. Ved en kneluksasjon skades leddkapselen, og væsken blir diffust fordelt i vevet i tillegg til intraartikulært. Dette kan gjøre at hevelsen ikke nødvendigvis er «sprengstor». Dersom kneet fortsatt er dislokert ved presentasjon er det vanligvis enkelt å se feilstilling (Figur 1). Ved subluksasjoner ser en oftest forskjeller i rotasjon og benete konturer rundt kneleddet sammenliknet med frisk side. Det vil også være vanskelig å få til passiv bevegelse i et ledd som ikke er på plass. Et kneledd som har åpenbar løshet anterioposteriort og uten endepunkt for sideveis testing (varus eller valgus), har ofte vært ut av stilling og bør initialt vurderes som en luksasjon for å utelukke tilleggsskader. Ved mistanke om gjennomgått kneluksasjon bør diagnostisk fokus tidlig fokusere på distal status for å sikre tidlig behandling av eventuell karskade. Distale pulser palperes og ankel-arm-indeks (AAI) utføres (Figur 2). Det er viktig å kontrollere distale pulser flere ganger det første døgnet dersom angiografi ikke er tatt. Aktuell nerveskade (vanligvis nervus peroneus communis) undersøkes for sensorisk og motorisk funksjon (Figur 3). Ved komplett droppfot er diagnosen åpenbar, men man må undersøke nøye for lett krafttap, for eksempel ved dorsalfleksjon av første tå. En nerveskade er lett å overse, og dersom den først påvises etter en operasjon vet man ikke når den har oppstått. Man må da anta at det er en iatrogen skade. Ved OUS har cirka 6% av pasientene skade på arteria poplitea og 19% har peroneus nerveskade ved innkomst.
Når knestabiliteten skal undersøkes klarer pasienten sjelden å flektere helt opp til 90 grader slik at standard skuffetest, for å undersøke bakre korsbånd (PCL) kan gjennomføres. For å vurdere
FIGUR 1: Bakre kneluksasjon venstre side. Disse må reponeres umiddelbart og stabiliseres i enten gipslaske eller ortose før bildediagnostikk.
FIGUR 2: Ankel-arm indeks (AAI) skal tas av alle pasienter med kneluksasjon. Doppler systolisk trykk i ankelen av skadet ekstremitet deles med doppler systolisk trykk i arteria brachialis i overekstremitet. Ved AAI <0,9 skal CT-angiografi utføres.

FIGUR 3: Det sensoriske gebetet for nervus peroneus communis. Undersøkelse av både sensorisk og motorisk nervefunksjon skal utføres og dokumenteres. Pasienter med nerveskader har høy risiko for karskader og skal videre utredes med CT-angiografi.

FIGUR 4: Undersøkelse av bakre instabilitet. Tydelig «sagging» med mindre prominerende tuberositas tibiae på pasientens høyre legg (markert rødt) sammenlignet med venstre (markert grønt), som tyder på en PCL-skade.
FIGUR 5: Ikke-reponerbar kneluksasjon venstre kne. Pasient med interponert medial kapsel og vastus medialis. Pasienten har medial misfarging i hud med små hudinndragninger, «dimples», samt lite mobil patella grunnet samtidig interponat av vastus medialis, kapsel som gjør det vanskelig å reponere lukket. Øyeblikkelig åpen reposisjon i narkose må utføres for å unngå utvikling av nekrose som kan komplisere forløpet.

PCL er det imidlertid relativt enkelt å se at tibia henger lengre ned med tyngdekraften, såkalt «sagging», og dette er et spesifikt funn for en relevant PCL-skade (Figur 4). Tuberositas tibia er sjelden signifikant hovent og kan brukes som et referansepunkt. Løshet for PCL kan også vurderes ved mindre fleksjonsgrad enn 90 grader, og fremre korsbånd (ACL) vurderes best med Lachman test. Strekkeapparatet kan skades samtidig – patellar- og quadricepssenen bør nøye palperes og strekkefunksjonen bør evalueres (klarer pasienten å løfte hele ekstremiteten med strakt kne fra sengen?). Data fra OUS viser at 8% av pasienter som behandles har skade på strekkapparatet.



Tilleggsundersøkelser Mills og medforfattere dokumenterte i en studie med 38 kneluksasjoner at AAI over 0,9 hadde 100% negativ prediktiv verdi for forekomst av signifikant karskade. En ratio under 0,9 hadde 100% sensitivitet, spesifisitet og positivt prediktiv verdi for signifikant karskade (8). Derfor bør alle kneluksasjoner undersøkes med AAI. Dersom AAI er under 0,9 eller ekstremiteten er klinisk dårlig sirkulert etter reposisjon, bør nærmeste karkirurg umiddelbart kontaktes for råd om videre diagnostikk. Som regel vil dette være en CT-angiografi, men pasienten kan også ønskes transportert til karkirurgisk kompetanse uten videre undersøkelser for å ikke forsinke endelig behandling av en truet ekstremitet. CT-angiografi har høy sensitivitet for skade på arteria poplitea ved kneluksasjoner.
DIFFERENSIALDIAGNOSER
Hvis pasienten beskriver at «kneet var ut av ledd», er den vanligste skaden en patellaluksasjon eller en skade kun av det fremre korsbåndet. Patellaluksasjon fører raskt til hevelse, ofte i løpet av få minutter. Kneleddet er stabilt ved undersøkelse og har ofte mest palpasjonsømhet medialt på patellas kant, og lateralt over distale femur. Ved isolert skade på det fremre korsbåndet vil laksiditeten ikke være like uttalt som ved kneluksasjon.
INITIAL BEHANDLING Reponering
Som ved andre luksasjoner bør kneleddet også reponeres så raskt som mulig. Det er ofte nødvendig med narkose eller smertelindring med sedasjon dersom kneleddet ikke har spontant gått tilbake i stilling. Drag i lengderetning, eventuelt i kombinasjon med rotasjon og motpress på prominerende femurkondyle, avhengig av luksasjonstype, vil som oftest føre til at leddet kommer tilbake i stilling.
Ved noen tilfeller kan bløtvev interponere og hindre reposisjon. Dette er beskrevet ved luksasjoner som involverer skade på medialsiden, der enten mediale kollateralligament og kapsel, eller i tillegg vastus medialis er slått inn i leddet i skadeøyeblikket (9). Slike interponat må reponeres eller fjernes kirurgisk, fortrinnsvis gjennom en medial artrotomi. Det er ofte synlig inndragning av hud på medialsiden av kneet (Figur 5). Det er viktig å tenke
Praktisk håndtering ved kneluksasjoner innkommet lokalsykehus:
1. Ved dislokert kne – reponere i narkose.
2 Sjekk sirkulasjon, nevrologi (droppfot) og grad av løshet i alle retninger Karskade må fanges opp (puls, AAI, CT-angio) og håndteres umiddelbart.
Indikasjon for CT-angio:
– AAI under 0,9
– Droppfot
– Knær som kommer inn luksert/subluksert
– Annen mistanke om nedsatt sirkulasjon
– Intraartikulære knefrakturer
3
Vær obs på kneluksasjon også ved tilsynelatende mindre skader. Nøyaktig klinisk undersøkelse og snarlig MR gjøres ved større kneskader for å fange opp alle typer skader som krever tidlig operasjon (NB sikre rask oppfølging når MR er tatt).
4 Undersøk alle mistenkte kneluksasjoner med ankel-arm indeks
5
6
Ta kontakt med sykehus som skal behandle pasienten videre påfølgende dag – dette gjør videre planlegging enklere (må opereres innen 14 dager etter skaden).
Ta MR så snart som mulig og husk å følge opp videre straks MR er tatt –send bilder til sykehus som skal behandle pasienten videre.
7 Kinetecskinne så lenge pasienten ligger på sykehuset.
8 Pasienten kan sendes hjem med ortose i påvente av videre behandling når han/hun er klar til det – 0-90 grader (eventuelt også droppfotskinne).
TABELL 2. Primær håndtering av kneluksasjoner
på senere ligamentkirurgi ved artrotomien, og en snittføring fra mediale epikondyl og videre distalt vil kunne brukes ved behov for en senere rekonstruksjon av det mediale kollateralligamentet.

Stabilisering
Kneleddet bør stabiliseres på egnet måte i akuttfasen. Ved behov for akutt karkirurgi, vil kneleddet oftest bli stabilisert med ekstern fiksasjon inntil det er trygt å bevege, vanligvis fire uker. Et godt første alternativ er alltid en bakre gipslaske med bred gips slik at den også vil gi sidestabiliserende støtte. Hvis pasienten er omfangsrik kan en bruke en laske på respektive medial- og lateralsiden. En vanlig lang sidestabiliserende ortose er ofte godt tolerert allerede i akuttfasen. Dersom pasienten har mye smerter, kan den også låses i lett fleksjon (15-30 grader), men bør åpnes så raskt smertene tillater mobilisering. Gipslasken må kunne tillate undersøkelse av distal puls og sirkulasjon.
RADIOLOGI
Vanlig røntgendiagnostikk tas for å utelukke åpenbare frakturer og for å kontrollere leddstilling etter reposisjon. MR gir nyttig informasjon om skade på ligamenter, menisker og brusk (Figur 6). Det er mindre rapporterte meniskskader ved kneluksasjoner (37%) sammenlignet med tall fra Nasjonalt Korsbåndregister ved primære korsbåndsrekonstruksjoner (49%) (7, 10), kanskje fordi energien går ut i strukturer utenfor leddet når kneet går ut av stilling. Ved mistanke om intraartikulær fraktur an-
befales CT-angiografi for å vurdere både fraktur og karstatus. Det er økt risiko for karskade ved samtidig fraktur i samme ekstremitet.
FØR KIRURGI
Dersom skadeomfanget ikke krever umiddelbar operasjon, blir pasienten ofte utskrevet fra sykehus etter initial håndtering og smertelindring, i påvente av eventuell rekonstruktiv kirurgi. Pasienten vil normalt sett bli anbefalt å få ned hevelse i kneet og få tilpasset en lang leddet ortose med fritt bevegelsesutslag til bruk før operasjon. Belastning på foten og bevegelse i kneet kan utføres inntil smertegrense, uten ytterligere restriksjoner. Det anbefales å bruke krykker i et tilnærmet normalt gangmønster. Det er viktig at pasienten gjør øvelser for å opprettholde bevegelighet i kneet, både for å unngå tilstivning, men også for å få i gang sirkulasjon med tanke på å få ned hevelse. Når pasienten ikke er i aktivitet, bør pasienten tilstrebe å hvile med benet høyt, samt ligge med full ekstensjon i kneet. Ligamentkirurgi utføres som regel i løpet av to uker. Tabell 2 oppsummerer viktig informasjon om vurdering og utredning av pasienter med kneluksasjon.
REFERANSER:
KLIKK her for å se referansene på kirurgen.no
2
KNEE DISLOCATIONS WITH VASCULAR INJURIES
MOATSHE G 1,2,3, ENGEBRETSEN L 2,31
ORTOPEDISK KLINIKK, OSLO UNIVERSITETESSYKEHUS OSTRC, NORWEGIAN SCHOOL OF SPORTS SCIENCES3 UNIVERSITY OF OSLO
GILBERT MOATSHE – GILBERT.MOATSHE @ MEDISIN.UIO.NO“Of this I have only seen one instance, and I conclude it, therefore, to be a rare occurrence; and there are scarcely any accidents to which the body is liable which more imperiously demand immediate amputation than these.” This is a statement on knee dislocation from Sir Astley Cooper in 1824, who is usually credited to be the first to report on these injuries (1). Similar sentiments were echoed by William Gibson in 1825 when he wrote: “Complete luxation of the knee was extremely rare and was generally followed by violent symptoms and even death unless treated by timely amputation.” To some this might seem dramatic, but it highlights the seriousness of the injury and serious consequences of the injury if not treated in a timely manner. Some of the reasons amputation was the treatment of choice at the time is probably vascular injuries, open injuries with contamination and of course lack of aseptic surgical techniques at the time. Despite advances in modern technology and surgical techniques, late diagnosis and treatment of vascular injuries will usually result in amputation, which can be lifesaving, but devastating for the patient. Therefore, early diagnosis and treatment of vascular injuries is paramount. Interestingly, a recent study from Mayo Clinic emphasized the seriousness of vascular injuries when they reported that knee dislocation patients with concomitant vascular injuries had worse outcomes compared to those without vascular injuries (2).
Knee dislocation injuries were historically believed to be relatively rare and reported to constitute 0,02–0,2% of orthopaedic injuries. The true incidence of knee dislocations is unknown but probably higher due to challenging diagnosis. Furthermore, some knee dislocations can be misdiagnosed because about 50 % are reported to reduce
before presentation (3,4). What was interesting was that the risk of neurovascular injuries are similar in patients presenting with dislocated knees and those presenting with reduced bicruciate ligament injured knees (3,4). This highlights the need for high level of suspicion and meticulous and systematic evaluation of these patients.
Historically, knee dislocations have been associated with high energy trauma such as motor vehicle accidents, falls from heights and farm/industry injuries resulting in frank knee dislocation (Figure 1). In the 19th century and early 20th century, the mechanisms of injury usually included a cart and horse falling on its owner, a man on horseback whose leg was pinned between a rail and the horse from which he was being thrown, and less often, some less dramatic injury mechanisms such as falls. With the advent of motorized vehicles, industrialization and sports participation, the mechanisms of injury have changed. In recent years there has been increasing focus on knee dislocations in the morbidly obese patients, often termed ultra-low velocity knee dislocations. These patients often sustain a knee dislocation during daily activities or a fall from their own height. The morbidly obese patients also represent a special treatment group because they have a higher risk of concomitant neurologic and vascular injuries (5).
Knee dislocations are complex injuries and are often associated with other injuries. The rate of associated injuries to other vital organs such as head, chest and/or abdomen has been reported to be 27% in high energy trauma (4). Fractures are also commonly associated with knee dislocations, reported in the order of 50-60%; and the rate of multiple fractures has been reported to be 41%
FIGURE 1: A radiograph showing a knee dislocation. This increases risk of vascular injuries because the popliteal artery runs just posterior to the posterior joint capsule.

FIGURE 2: Posterior view of a right knee showing the neurovascular structures. The gastrocnemius muscle heads are retracted to the sides, and the popliteal artery, popliteal vein and the tibial nerve can be visualized. These structures are at risk during knee dislocations and during surgery, especially during posterior cruciate ligament reconstruction. In this image, the close proximity of the neurovascular structures to the posterior knee capsule can be appreciated.


(3). The prevalence of concomitant fractures in the ipsilateral limb is high (17-58%), and may influence the decision making in the initial treatment of these injuries. Patients with bilateral multi-ligamentous knee injuries are reported to have a higher risk of concomitant head, chest and abdominal injuries compared to unilateral multi-ligamentous knee injuries with similar mechanisms.
The rate of popliteal artery injury has been reported to range between 7% and 48%, and as high as 64% in cases of fractures, depending on the individual hospital reporting (6). Level 1 trauma centers, where the majority of patients with knee dislocations have high energy trauma, usually report a higher prevalence of concomitant vascular injuries. The risk of vascular injury is correlated with the degree of energy, concomitant fractures and the type of dislocation. Peroneal nerve injury is associated with vascular injury, and therefore presence of peroneal nerve injuries should be considered as indicators for potential vascular injuries. Merritt et al. reported that 38% of the patients presenting with common peroneal nerve palsy had a concomitant arterial injury, and 62% of the patients with knee instabilities associated with arterial injuries had transient or permanent peroneal nerve neuropraxia (7). This implies that vascular injuries should be
suspected in patients with nerve injuries because of the associated risk and the difficulty in assessing perfusion in patients with nerve injuries. The threshold for vascular assessment with angiography should be low, because the consequences of missing a vascular injury may be devastating for the patient. Data from Oslo University Hospital shows that 5-6% of patients with knee dislocations sustain a concomitant vascular injury (8). Interestingly, the odds for popliteal artery injury were nine times higher among those with knee dislocations involving the lateral structures than other ligament injury types. Additionally, peroneal nerve injury was significantly associated with vascular injury (OR, 20.6; 95% CI, 5.3-118.8).
It is paramount to know the anatomy of the knee in order to understand the risk for vascular structures around the knee. The popliteal artery courses through the adductor hiatus, where there are fibrous attachments to the tendinous attachment of the adductor magnus muscle, “securing” the artery in place (Figure 2). The popliteal artery has branches which form the superior genicular, middle genicular and the inferior genicular arteries. In the popliteal space, the artery has relatively little structural attachment, making this section relatively mobile. It is the deepest or most anterior structure in the popliteal fossa,
FIGURE 4: Calculation of ankle-brachial index (ABI). All patients with knee dislocations should be evaluated with ABI. Where ABI is not possible, a CT angiography should be considered.

FIGURE 5: CT angiography showing occlusion of the popliteal artery requiring repair.

FIGURE 6: A picture showing vascular repair of the popliteal artery with a venous graft. A fasciotomy is performed and closed after some days when the swelling subsides. A spanning external fixator is used to stabilize the knee. (Courtesy Dr Joakim Jørgensen, OUS).

separated from the knee joint capsule by a thin layer of fat tissue (Figures 2 and 3). When it passes distally, the artery is anchored to the proximal tibia by the fibrous arch of the soleus muscle, thus the artery is tethered at this point, before it divides into the anterior and posterior tibial arteries. Because of the firm attachments proximal and distal to the popliteal space, when the knee dislocates, the portion of the artery in the popliteal space is susceptible to injury. Contusion injuries to the artery in this section can also occur if there is a direct trauma. Injuries can also occur if there is a concomitant fracture because of the close proximity to both the femur and tibia in the popliteal space.
DIAGNOSIS
Pulses are routinely utilized to assess vascularity and the presence of vascular injuries. The presence of pulses in patients without neurologic injuries and hypovolemia can be used to assess vascular injuries. However, it should be noted that presence of pulses does not exclude vascular injuries. The examination of pulses alone has been demonstrated to be unreliable in detecting vascular injuries, leading some authors to recommend routine angiography for a knee dislocation. In patients with abnormal or asymmetric pulses, an ankle-brachial index (ABI) measurement has been recommended (Figure 4). There are some limitations on the utility of measuring ABI, including cases of knee dislocation associated with ipsilateral limb fracture or hypovolemic shock. Furthermore, an ABI is not able to detect vascular intimal lesions that may lead to secondary occlusion despite an initial normal ABI. ABI of <0,9 warrants further examination with angiography because ABI <0,9 is shown to have a 95-100% sensitivity and 80-100% specificity in detecting vascular lesions requiring surgery (9). Standard angiography has 1,2-6% false negatives, up to 7% false positives and is associated with complications. However, the risk of complications with angiography seems to outweigh the potential risk of limb loss when the diagnosis of arterial injury is delayed or missed. With recent developments in imaging, CT angiography is preferred to standard angiography because of low complication rates and high sensitivity (Figure 5).
TREATMENT
Vascular injuries require urgent treatment and when suspected, a vascular surgeon should be contacted. Further evaluation after performing ABI should be discussed with the vascular surgeon. However, further investigations in a hospital without vascular surgery care should not delay transfer and treatment.
Treatment of vascular injuries usually involve repair of the popliteal artery utilizing a venous graft. Fasciotomy is performed to mitigate development of reperfusion compartment syndrome (Figure 6). A spanning external fixator is used to stabilise the limb during surgery and is maintained for four to six weeks post-surgery to stabilize the knee and protect the repair. After four to six weeks, the spanning external fixator is removed, and a brace is used to stabilize the knee. At the time of removing the external fixator, manipulation under anaesthesia might be indicated if there is severe stiffness. In cases of vascular injuries requiring repair, ligament reconstruction is delayed to about six months.
CONCLUSION
Concomitant vascular injuries during knee dislocations are not uncommon, and require timely diagnosis and treatment. Delay over eight hours can end up in an amputation, which is physically and emotionally devastating for the patient. ABI should be performed in all patients with knee dislocations, and the threshold for CT angiography should be low to avoid delay in treatment. Vascular surgeons should be contacted early when vascular injury is suspected because vascular repair takes precedence over ligament repair.
REFERANSER:
KLIKK her for å gå til referansene på kirurgen.no
“It is paramount to know the anatomy of the knee in order to understand the risk for vascular structures around the knee. ”
KIRURGISKE BEHANDLINGSMETODER VED KNELUKSASJONER
Kneluksasjoner er omfattende skader som involverer tre av fire stabiliserende strukturer i kneet. Uten behandling blir det vedvarende instabilitet som fører til redusert funksjon, og som regel redusert knerelatert livskvalitet. Kirurgisk behandling anbefales for å oppnå god stabilitet i kneet og bedre knefunksjon, som er viktig i hverdagen og andre fysisk aktiviteter, inklusiv jobb og idrett (1,2). Kirurgisk behandling kan utføres i akuttfasen eller i kronisk fase. Ideelt bør operasjon i akuttfasen gjøres én til to uker etter skaden. Ved operasjon i kronisk fase venter man til pasienten har gjenvunnet full bevegelighet, hevelse har gått ned og muskelkontroll og en viss muskelstyrke er gjenvunnet. Ofte vil pasienten som opereres i kronisk fase ha vært gjennom en rehabiliteringsperiode på noen måneder, men opplever likevel fortsatt at kneet er ustabilt.
De fleste anbefaler tidlig ligamentkirurgi fordi forløpet blir kortere og det kun blir én rehabiliteringsperiode (2,3). I tillegg er kirurgi i akuttfasen teknisk bedre fordi disseksjon og identifisering av strukturer er enklere før arrvevdannelse (Figur 1). Dette er særlig viktig når man skal dissekere lateralsiden rundt nervus peroneus. I de fleste studier der pasienter som er operert i akuttfasen er sammenlignet med pasienter som er operert i kronisk fase, har de akutt opererte bedre funksjonelle resultater. Imidlertid er slike sammenligninger usikre da gruppene kan være nokså forskjellige.
HVEM KAN VENTE MED OPERASJON?
Pasienter med reparerte karskader, åpne skader, store intraartikulære frakturer operert med åpen reposisjon og
fiksasjon, andre skader nær kneet samt skader eller pasientfaktorer som kan forhindre anbefalt postoperativ rehabilitering gjør ofte at ligamentkirurgi må utsettes til et senere tidspunkt. Pasienter med skade i strekkapparatet (ekstensormekanisme) kan vurderes for to-seanse kirurgi med reparasjon av strekkapparatet, så kneligamentkirurgi etter rehabilitering. Sen diagnostikk kan også gjøre at ligamentkirurgi utføres i en kronisk fase. Skade av mediale kollateralligament (MCL) og bakre korsbånd (PCL) kan til en viss grad tilhele med ikke-operativ behandling, men ved kneluksasjon og store skader på mange stabiliserende strukturer blir det ofte rest-instabilitet som trenger kirurgisk behandling. Noen ganger kan derfor en strategi med primær ortosebehandling gjøre at man kan unngå senere operasjon, eller man kan klare seg med en mindre omfattende operasjon. Dette er mest aktuelt der man er i grenseland mellom en total eller partiell skade, eller dersom pasienten ikke ønsker kirurgi. De som velger å ikke la seg operere ender ofte med et instabilt kne, men tilpasser sitt aktivitetsnivå etter det og noen bruker en ortose.
HVEM BØR OPERERES TIDLIG?
Våre retningslinjer for den generelle pasienten med kneluksasjon er tidlig operasjon, det vil si innen to uker. Noen tilleggsskader styrker indikasjonen for tidlig operasjon. Dersom det foreligger meniskskader som krever rask behandling, vil man reparere meniskskaden og gjøre ligamentkirurgi i samme seanse. Dette er først og fremst meniskskader der meniskvev ligger innslått i leddet og hindrer bevegelse (bøttehankrupturer). Distale avulsjoner, med eller uten ben, av laterale kollateralliga-
FIGUR 3: Distal biceps femorissene-avulsjon høyre kne. Senen skal reinsettes enten med borekanaler eller suturankre. Ved samtidig rekonstruksjon av laterale kollateralligament skal man passe på at suturer eller suturanker ikke er i veien for laterale kollateralligament graft.


ment (LCL), distale biceps femorissenen eller MCL, kan ofte repareres og må i så fall gjøres i akuttfasen. Dette gjelder også benede avulsjoner av fremre korsbånd (eminensfrakturer) (Figur 2) og bakre korsbånd.
KIRURGISKE OVERVEIELSER
Reparasjon eller rekonstruksjon
I akuttfasen kan sideligamentene i kneet enten repareres eller rekonstrueres, alternativt kan man gjøre en reparasjon og forsterke med en rekonstruksjon. Sistnevnte gjelder særlig MCL, der man oppnår bedre resultater ved samtidig rekonstruksjon og reparasjon. På lateralsiden er det vanlig med reparasjon av distale biceps femorissenen ved distale avulsjoner med eller uten ben. Strukturene sutureres og festes til fibula, vanligvis via suturankre eller borekanaler (Figur 3). Ved avulsjonsfraktur behandles dette etter vanlige frakturprinsipper, for eksempel med pinner og cerclage. Dersom det er åpenbare skader på
større deler av LCL, enten på MR eller i operasjonsfeltet, gjøres det primært en rekonstruksjon. Rekonstruksjon av LCL anbefales i stedet for reparasjon fordi studier viser høyere risiko for svikt ved reparasjon sammenlignet med rekonstruksjon (4,5).
«Staged» kirurgi
Noen velger å gjøre såkalt «staged» kirurgi ved at sidebånd opereres i akuttfasen og korsbåndene senere. Ved ortopedisk avdeling på Oslo Universitetssykehus gjøres dette sjelden, men det kan noen ganger være aktuelt å gjøre en reparasjon ved åpne skader der kirurgi uansett utføres i områder nære et skadet sideligament. Man tilstreber å behandle alle skader samtidig for å gjenskape anatomi og biomekanikk. Dersom man ikke rekonstruerer alle bånd som er røket, blir det rest-instabilitet og økt belastning på rekonstruerte strukturer som kan føre til rekonstruksjonssvikt og dårlige resultater.
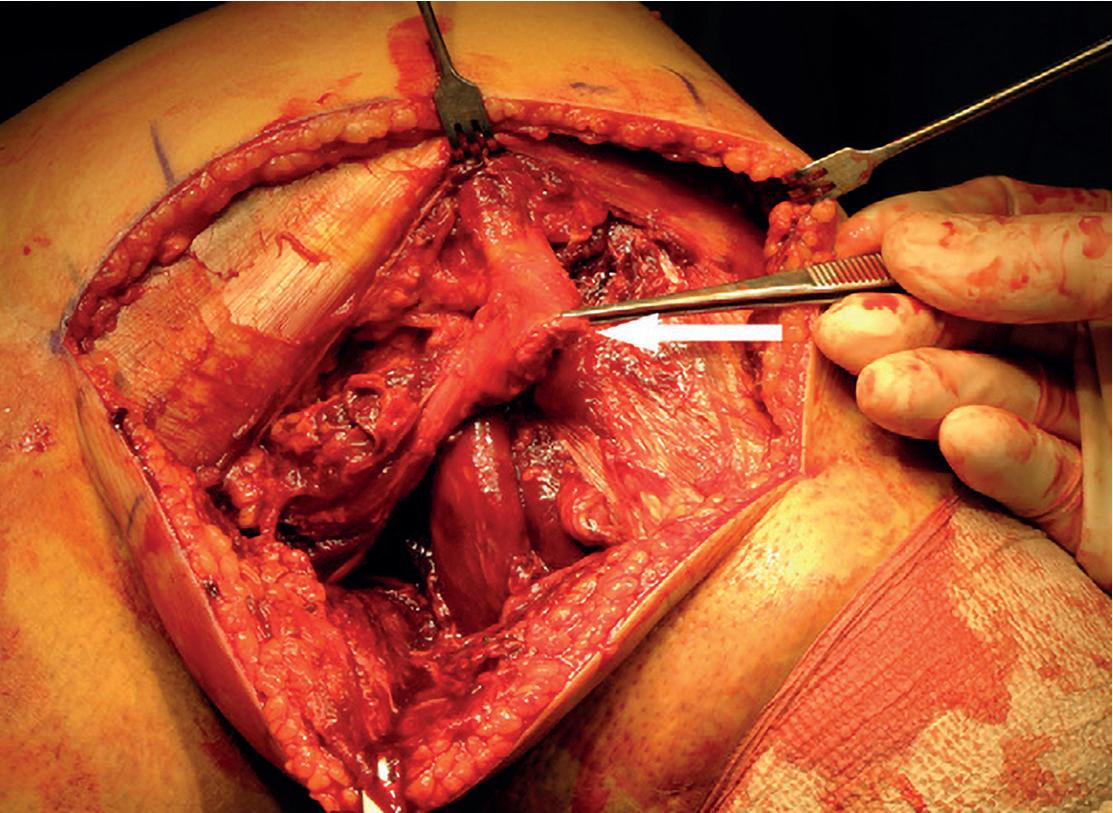
FIGUR 4: Lateral disseksjon som viser nervus peroneus (holdes med karstrikk) som kan bli skadet i forbindelse med kneluksasjon eller iatrogent ved kirurgi.
LIGAMENTREKONSTRUKSJON
FIGUR 5: Medial disseksjon av venstre kne som viser stor skade medialt med kapselskade og mediale kollateralligamentskade. Medial kapsel skal repareres, mediale kollateralligament repareres og i tillegg forsterkes med semitendinosus sene-graft
Rekonstruktiv operasjon etter en kneluksasjon er omfattede kirurgi med både åpen og artroskopisk teknikk. God planlegging av kirurgi med tanke på personell, graftvalg, tunnelplassering og postoperativ rehabilitering er viktig for resultatet. Ligamentene tilstrebes rekonstruert anatomisk for å gjenskape opprinnelig biomekanikk i den grad det er mulig. Særlig kirurgisk omtanke må gis til hvordan graft-tunellene plasseres for å gjenskape anatomi og for å unngå kollisjon mellom tunnelene. Ved rekonstruksjon av alle båndstrukturer lages det opp til sju tunneler i femur, fire tunneler i tibia og én tunnel i caput fibula, med høy risiko for tunnelkollisjon og komplikasjoner.
Graftvalg
FIGUR 6: Illustrasjon som viser viktige landemerker på medialsiden av kneet og lokalisasjon av festepunkt til mediale kollateralligament.
Til rekonstruksjon kan man bruke autograft fra pasienten selv eller man kan bruke allograft fra avdød donor. Til fremre korsbånd brukes oftest autograft av midtre del av patellarsenen med benbit i hver ende, hamstringssener eller quadricepssene. Til PCL brukes ofte allograft (vanligst er akillessene, tibialis posteriorsene eller quadricepssene). Det er viktig å ha tilgang til allograft når man behandler disse skadene. Ved skade på alle båndstrukturer kan det være behov for opptil åtte graft totalt. Dersom man ikke har tilgang til allograft kan autograft fra frisk side brukes.

Kirurgisk teknikk
Ved rekonstruksjon av LCL og posterolaterale hjørne (PLC) bruker man LaPrade/Engebretsen-teknikk med akilles-allograft (6,7). Dersom man ikke har akilles-allograft, kan semitendinosus- eller tibialis anterior- eller poseriorsene-allograft brukes. Man starter med lateral incisjon og skarp disseksjon til tractus iliotibialis. Her er det viktig å finne nervus peroneus som ligger medialt og posteriort for biceps



femoris og nær til caput fibula (Figur 4). Ved samtidig avulsjon av biceps femoris kan nerven være vanskelig å lokalisere, derfor er forsiktig disseksjon viktig. Deretter lager man tunneler for graft i caput fibula, proksimale tibia og laterale femur.
Ved rekonstruksjon av MCL kan man bruke LaPrade/Engebretsen-teknikk med semitendinosusene i akuttfase eller allograft i kronisk fase (8). Lind teknikk kan også brukes ettersom kliniske studier ikke viser signifikante forskjeller mellom disse teknikkene. Medial incisjon kan brukes til å høste graft til ligamentrekonstruksjon (Figur 5). Semitendinosus høstes og fikseres med suturanker til tibia 6 cm distalt for leddlinjen. Graftet tunneleres under sartoriusfascien og utenpå MCL og leddkapsel. Man lokaliserer mediale kollateralligament sitt festepunkt på femur, som regel 12 mm distalt og 8 mm anteriort for adduktorknuten (Figur 6). Her lager man tunnel for graftfiksasjon. Det er viktig å passe på at tunnelen ikke kolliderer med tunneler for eventuelt bakre korsbånd.
Korsbåndene vil nesten alltid rekonstrueres i tidlig fase. Et unntak kan være dersom det foreligger en benet avulsjon som kan reposisjoneres og fikseres. I kronisk fase må det alltid gjøres en rekonstruksjon av korsbåndene. Korsbåndkirurgi utføres artroskopisk der man lager tunneler i femur og tibia før man setter in graftene. For PCL-kirurgi er det nå vanlig med dobbelbunt-rekonstruksjon utviklet av LaPrade et al. (9), men internasjonalt er det flere som bruker enkeltbunt-rekonstruksjon. Biomekaniske studier viser at dobbelbunt-rekonstruksjon er bedre enn enkeltbunt-rekonstruksjon, men dette er ikke vist i kliniske studier.
Når alle tunneler er laget må også graftene fikseres i riktig rekkefølge og vinkel/posisjon for å få et så godt biomekanisk sluttresultat som mulig. Vanligvis bores kanaler for korsbånd og i noen tilfeller også kollateralligament ferdig, med samtidig kameraovervåking i utsatte kanaler underveis for å unngå kollisjon (Figur 7). Deretter fikseres korsbåndene i femur og trekkes ned i kanalene i tibia, samtidig som sideligamenter ferdigstilles. Til slutt fikseres korsbåndgraftene i tibia og sideligamenter ferdigstilles. Ved et vellykket resultat har kneet fortsatt full strekk og bøy.
Rekonstruksjon i kronisk fase
For de som ikke ønsker operasjon tidlig, eller ved andre kontraindikasjoner, vurderes rekonstruktiv kirurgi fortløpende under rehabilitering, avhengig av pasientens instabilitetsplager. Ved operasjon i kronisk fase må man vurdere mekaniske akser i planleggingen. Ved varuskne vil det være stor fare for at en lateral rekonstruksjon vil
tøye seg ut, og tilsvarende på medialsiden ved et valguskne. Noen pasienter kan ha en såkalt ”varus thrust”, der kneet svikter i varus ved vanlig gange. Ved samtidig akseavvik korrigeres dette først med en osteotomi og ligamentkirurgi gjøres senere når osteotomien har tilhelet og osteosyntesematerielet kan fjernes. Stressrøntgen brukes i utredning for evaluering av ligamentlaksitet fordi MR har dårligere sensitivitet for LCL- og PCL-skader i kronisk fase. Hos eldre pasienter med uakseptabelt løse knær, kan en hengslet kneprotese være et alternativ.
POSTOPERATIV BEHANDLING
Det brukes en spesialortose som særlig beskytter PCL under tilhelingsfasen. Denne ortosen skyver leggen forover og forhindrer at PCL-graftet tøyer seg ut. Den vil også stabilisere og beskytte sideligamenter. Pasienten føler ofte at den er ubehagelig å bruke og i noen tilfeller hindrer den derfor rehabiliteringen og bevegelse av kneet. Det brukes ofte et allograft til PCL-rekonstruksjon, som sannsynligvis har lengre graftmodelleringsfase sammenlignet med et autograft. Det vil da kunne strekke seg ut og gi mer instabilitet dersom det ikke beskyttes. Lengden på ortosebehandlingen er omdiskutert. Vi har tidligere anbefalt tre måneder døgnkontinuerlig og deretter tre måneder ved aktivitet, samtidig som andre anbefaler opp til seks måneder døgnkontinuerlig bruk. Lengden på ortosebehandlingen må vurderes opp mot pasientens plager ved bruk av ortosen. I hvilken grad pasienten følger anbefalingene er uvisst.
OPPSUMMERING
Behandling av knesluksasjoner individualiseres der skadens omfang, tilleggsskader både i og rundt kneet og øvrige skader tas med i vurderingen. Ligamentkirurgi ved kneluksasjon krever mye ressurser både med tanke på personell, utstyr, implantater, graft og postoperativ oppfølging. Alder og rehabiliteringspotensiale må også tas i betraktning. I de fleste tilfeller vil man anbefale ligamentkirurgi i tidlig fase. Ved tilleggsskader som kontraindiserer tidlig ligamentkirurgi, eller om pasienten ikke ønsker kirurgi, kan man behandle med ortose først og gjøre rekonstruksjon senere. Fordelen med tidlig kirurgi er at forløpet blir kortere og studier tyder på at sluttresultatet er noe bedre. Fordeler med å vente med kirurgi til kronisk fase er lavere risiko for stivhet og artrofibrose, og at noen kan klare seg med en mindre omfattende operasjon.
REFERANSER:
KLIKK her for å se referansene på kirurgen.no




BEHANDLING AV DROPPFOT ETTER SKADE AV NERVUS PERONEUS
Nervus peroneus communis er utsatt for skade under en kneluksasjon. Dette kan medføre droppfot som følge av lammelser av peroneusinnerverte muskelgrupper. Initialbehandlingen er tilpasning av en droppfotskinne. Dersom det innen første året ikke tilkommer en spontan regenerasjon og nervefunksjonen, kan en transposisjon av tibialis posteriorsenen til fotryggen vurderes.
1 ORTOPEDISK AVDELING, SYKEHUSET ØSTFOLD
2 ORTOPEDISK AVDELING, OSLO UNIVERSITETSSYKEHUS
INTRODUKSJON
En droppfot foreligger når en pasient har mistet evnen til aktiv dorsalfleksjon i ankelleddet. Tyngdekraften gjør at foten «dropper» til spissfotstilling, noe som kan forsterkes av intakte plantarfleksorer. Droppfot påvirker pasientens gangfunksjon i betydelig grad. Pasienten som er rammet har en klaskende gange og prøver å kompensere med økt fleksjon i kne- og hofteleddet. I tillegg til nedsatt funksjonalitet fører en droppfot til økt fare for å snuble og kan dermed føre til ytterligere skader. Musklene i leggens fremre losje står for dorsalfleksjon i ankelleddet. Tibialis anterior er den sterkeste muskelen blant disse. Den fremre muskellosjen er innervert av nervus peroneus profundus, som er en gren av nervus peroneus communis, og som igjen har sitt utspring fra nervus ischiadicus.
Droppfot kan ha mange årsaker. Den kan forekomme i sammenheng med sentralnervøse tilstander (cerebral parese, slag, multippel sklerose), ryggpatologier (prolaps, lumbal myelodysplasi), nevromuskulære sykdommer (Charcot-Marie-Tooth, Guillain-Barré syndrom) og infeksiøse nevropatier (forårsaket av borreliose eller lepra). Videre kan skade på nervus ischiadicus i hofteområdet (som er en sjelden komplikasjon etter hofteprotesekirurgi eller etter en traumatisk hofteluksasjon), ruptur av tibialis anteriorsenen, kompartmentsyndrom i leggen, frakturer i proksimale legg, dype sårskader og kneluksasjon også føre til droppfot.
Nervus peroneus communis har fra proksimalt et overfladisk forløp bak biceps femorissenen. Den fortsetter subkutant rundt nedre kant av fibulahodet før den deler seg i flere gener (Figur 1). Nervens bløtdelstilheftning i dette området er god. Under en kneluksasjon er nerven derfor utsatt for å bli skadet, spesielt når kneet utsettes for varus- og hyperekstensjon. Nerveskaden kan variere fra nevropraksi (nerveutfall forårsaket av for eksempel kompresjon eller strekk, med bevart aksonal kontinuitet) til fullstendig kontinuitetsbrudd av nerven (1,2).
En isolert skade av nervus peroneus profundus kjennetegnes ved bortfall av dorsalfleksjon i ankelen og stortåen samt at sensibiliteten mellom stortå og andre tå er rammet. Dersom også peroneus superficialisgrenen er påvirket, kan i tillegg evertorene (peroneusmusklene) samt sensibiliteten i lateralsiden av leggen og fotryggen være affisert. Andre kraftige muskler i leggen, som fleksorgruppen (gastrocnemius-soleus komplekset som samler seg i akillessenen) og tibialis posterior muskelen, bevarer derimot sin funksjon. Tibialis posterior muskelen er fotens viktigste invertor og bidrar også til å opprettholde fotbuen.
En stor, prospektiv norsk studie fant peroneusnerveskade i rundt 19% av alle pasienter med kneluksasjon, 8% av pasientene hadde et komplett utfall (3). Risikoen for nerveskade øker med 42 ganger dersom det foreligger en skade av det posterolaterale hjørnet (PLC)(4). Etter ett år
hadde 35% av pasientene opplevd en spontan bedring og hadde ikke behov for ytterlig behandling av droppfot.
En oversiktsartikkel rapporterer en forekomst av komplett motorisk utfall ved 20% av pasientene med kneluksasjon (5). Av disse hadde rundt 35% en spontan bedring (minst kraftgrad 3) som samsvarer med norske data. Blant pasientene som initialt kun hadde partielt utfall observerte man ved 87% en spontan bedring.
IKKE - OPERATIV BEHANDLING
En droppfotskinne kan være en temporær eller en varig symptomatisk behandling ved peroneusnerveskade med ledsagende droppfot. Graden av parese vil variere, og hos mange ser man en gradvis bedring. Noen pasienter med vedvarende parese rapporterer at droppfotskinnen gir en så god symptomlindring og funksjonskompensasjon at de ikke ønsker ytterligere tiltak (6).


En droppfotskinne kan konstrueres på flere vis. Konstruksjon og tilpasning gjøres sammen med en ortopediingeniør. Parese av peroneusnerven med droppfot gir grunnlag for økonomisk støtte fra NAV til ortopediske hjelpemidler. Hovedprinsippet bak skinnen er å forhindre at den manglende dorsalfleksjonen i ankelleddet gjør
at foten «dropper» ned mot underlaget når foten skal settes i gulvet i siste del av svingfasen. Skinnen bidrar også til å forhindre utvikling av kontrakturer med ledsagende spissfot. Det anbefales regelmessig tøying av muskulatur i tillegg til skinnebruk (6). Skinnen støtter foten plantart, som en stiv L som går fra under foten til baksiden av leggen (Figur 2). Alternativt kan man bruke en stropp rundt leggen og strikk som går ned til nederste del av skosnøring (dictusbånd). Hovedpoenget er at foten aldri faller ned i plantarfleksjon når hjelpemiddelet brukes.
I de senere år er det utviklet ortoser som bruker funksjonell elektrisk stimulasjon (FES) for pasienter med sentralnervøs skade. Imidlertid har undersøkelser i slagpasienter med droppfot ikke demonstrert fordeler ved disse sammenholdt med tradisjonelle ortoser (7).
OPERATIVE BEHANDLINGER
Dersom droppfot varer i mer enn ett år etter kneluksasjonen er sjansen for spontan remisjon svært lav (4). I slike tilfeller kan man vurdere kirurgisk behandling for å gjenopprette pasientens evne til aktiv dorsalfleksjon i ankelen. Dette kan forbedre funksjonaliteten og gangfunksjonen og gjøre et liv uten fast ortosebruk mulig. Flere operative behandlinger kan være aktuelle. For ortope-

Kraftgrad Beskrivelse
0 Ingen muskelkontraksjon
1 Muskelkontraksjon uten bevegelse av kroppsdel 2 Beveger med eliminert tyngdekraft 3 Beveger mot tyngdekraft 4 Beveger mot noe motstand 5 Normal kraft
diske kirurger er det hovedsakelig senetransposisjoner som er arbeidshesten. En nøye klinisk undersøkelse må kartlegge hvilke sener som har adekvat kraft og om det foreligger kontrakturer som må i hensyntas og behandles samtidig.
Tibialis posterior transposisjon er den mest anvendte og mest forutsigbare senetranposisjonen og ble beskrevet så tidlig som på 1930-tallet (8). Prosedyren omgjør tibialis posteriors inverterende kraft til en dorsalflekterende kraft ved å flytte dens innfestning fra os naviculare medialt, til os cuboid eller laterale os cuneiforme, på dorsolaterale siden av foten. Gjennom årenes løp har det blitt beskrevet flere varianter og modifikasjoner av prosedyren.
Indikasjon
Indikasjonen for transposisjon av tibialis posterior er relativ og kan vurderes dersom paresen har stått i over ett år, uten utsikt til spontan bedring. Det må foreligge god kraft i tibialis posteriorsenen (minst kraftgrad 4 av 5) og intakt evne til å passivt dorsalflektere foten (9). Pasienten må være i stand til å samarbeide om det postoperative forløpet. Røykeslutt og vektreduksjon preoperativt er en fordel.
Preoperativ undersøkelse
Pasientens gangfunksjon uten droppfotskinne skal observeres. Funksjonaliteten til samtlige muskelgrupper i leggen skal undersøkes og graderes etter kraftgrad (Tabell 1). I tillegg til evnen til dorsalfleksjon skal også evnen til eversjon (utføres av peroneusmusklene som også er innervert av nervus peroneus) og inversjon (tibialis posterior muskelen) testes. Akseforhold og eventuelle feilstillinger i ankelen og foten skal undersøkes og eventuelle kontrakturer i leggen kartlegges. Viktigst er leggens bakre muskler som står for plantarfleksjon i ankelledd og dermed vil være antagonister til den transponerte senen. Dersom kontrakturer fører til at ankelen ikke kan passivt dorsalflekteres til 5-10 grader, skal en vurdere å supplere senetransposisjonen med en akillesseneforlengelse.
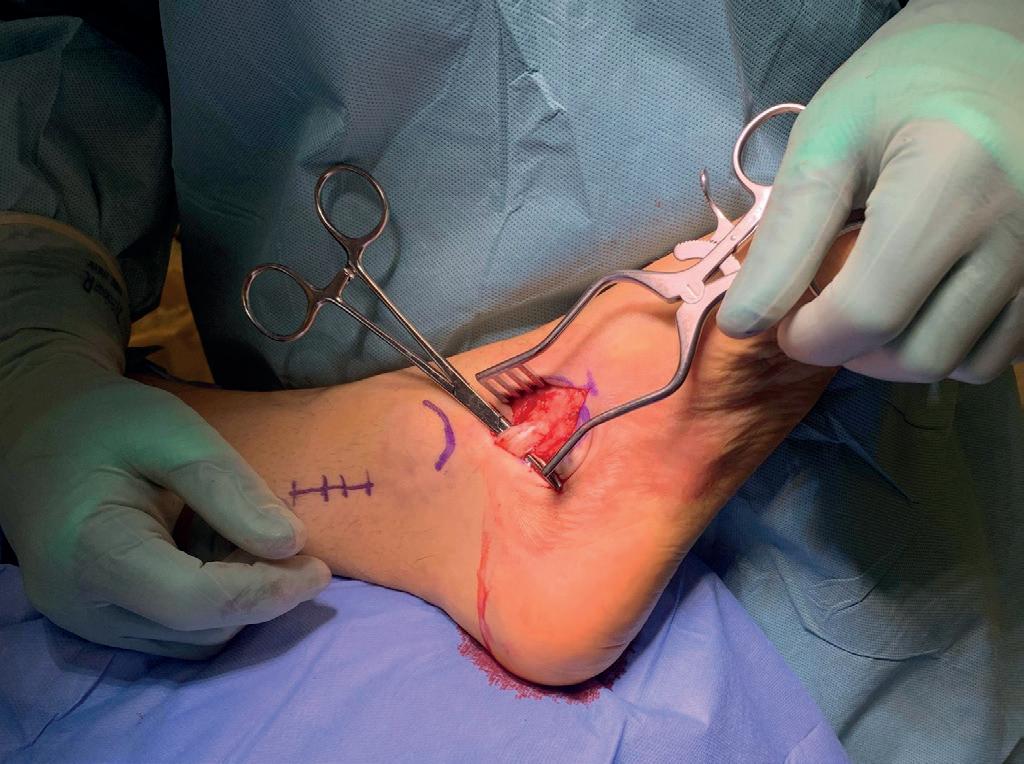
Prosedyrebeskrivelse - Tibialis Posterior Transposisjon Følgende prosedyrebeskrivelse er basert på forfatternes erfaringer og gjennomgang av aktuell litteratur (4,6,10,11). Prosedyren gjøres via fire incisjoner. Tibialis posteriorsenens innfestning og transposisjonssted markeres. Gjennomlysning brukes for å verifisere korrekt plassering (Figur 3). Er everterende muskulatur bevart, festes tibialis posteriorsenen til os cuneiforme laterale. Hvis ikke, plasseres den lenger lateralt i os cuboid, slik

FIGUR
FIGUR 4B. Tibialis posteriorsenen løsnes fra sitt feste på os naviculare. Mange tilheftninger må klippes for å få senen til å slippe. Det settes en holdesutur i enden av senen.





FIGUR
4F.
Pasienten har samtykket til publisering av bildene.
at den transponerte muskelen også bidrar med noe eversjon. Gjennom den første incisjonen løsnes tibialis posteriorsenen fra sitt feste på os naviculare. Dette gjøres så distalt som mulig for å bevare lengden av senen (Figur 4a). En holdetråd festes i enden av senen (Figur 4b). Incisjon nummer to lages langs bakre tibiakant, 7-8 cm proksimalt for spissen av mediale malleol. Tibialis posteriorsenen identifiseres og den distale, avløste delen av senen trekkes så ut proksimalt (Figur 4c). Med en lang peang tunneleres en kanal via samme incisjon mot lateralsiden. Peangen legges på baksiden av tibia og sklir skrått langs benet mot distalt og lateralt, før den treffer membrana interossea. Det er her kritisk å unngå nevromuskulære strukturer. Peangen tunneleres med noe kraft gjennom membrana interossea. Åpningen gjennom membranen må være stor nok til å tillate passasje av senen uten hinder. Peangen legges så langs forsiden av fibula, før den anføres mot huden anterolateralt (Figur 4d). Den tredje incisjonen legges der peangen treffer huden, og tibialis posteriorsenen trekkes ut gjennom denne åpningen. Man bør være oppmerksom på nervus peroneus superficialis som forløper i dette området. Incisjon nummer fire legges over tranposisjonstedet/mottakerstedet (Figur 3). Herfra lages en ny subkutan tunnelering mot proksimalt for å hente senen som nå skal ligge lateralt (Figur 4e). Alternativt tunneleres senen under ekstensorretinakelet, men det er fare for at dette blir for trangt. Senen trekkes ned til transposisjonstedet hvor den festes med et suturanker på 5 mm (Figur 4f). Ankelleddet må innstilles i 20 graders dorsalfleksjon når senen festes.
Tilleggsprosedyrer
Skulle det foreligger en akillessenekontraktur eller annen form for kontraktur som hindrer dorsalfleksjon av foten, må denne adresseres på forhånd for å få effekt av inngrepet. Akillessenen kan forlenges med en åpen z-plastikk eller perkutan trepunkts forlengelse.
Postoperativ protokoll
Ankelen gipses i nøytral stilling i seks uker, deretter overgang til walkerortose med tillatt full belastning fram til uke 12 postoperativt. Pasienten kan trene aktive øvelser med dorsalfleksjon etter gipsfjerning, men skal unngå passiv tøyning fram til det har gått fire måneder postoperativt. Risikoidrett kan tidligst gjenopptas seks måneder etter kirurgi.
RESULTATER
Det er flere pasientserier som har rapportert resultater etter senetransposisjon for behandling av droppfot. De fleste studier rapporterer gode resultater etter tibialis
posterior transposisjon. Imidlertid er det store flertallet av disse studiene retrospektive, består av et relativ lite pasientmateriale (mellom fem og 69 pasienter), og bruker varierende indikasjonsstilling og operasjonsteknikk (12). En norsk studie fra 1990-tallet fulgte 20 tibialis posterior transposisjoner i 17 pasienter med ulik etiologi (13). Ved oppfølging klarte alle pasienter å gå uten droppfotskinne og hadde evnen til aktiv dorsalfleksjon i ankelen (median 5 grader). Seksten av de opererte 20 føtter hadde et godt eller meget godt sluttresultat.
En annen norsk studie fra 2014 undersøkte det kliniske og funksjonelle resultatet hos 12 pasienter etter senetransposisjon for droppfot som følge av kneluksasjon (4). Forfatterne fant at 72% av ankelens totale bevegelsesutslag og 42% av dorsalfleksjonskraft var bevart etter senetranposisjon, sammenliknet med frisk side. I samme materiale hadde de opererte pasientene American Orthopedic Foot and Ankle Society (AOFAS) skår på 91/100 og 90% av maksimale gangdistanse på seks minutter sammenliknet med en frisk referansepopulasjon. Ingen av de undersøkte pasientene brukte droppfotskinne ved dagligdagse aktiviteter og to pasienter brukte ortosen under trening. Dette samsvarer med en oversiktsartikkel som konkluderte med at 91% av pasientene som brukte ortose preoperativt ikke hadde behov for den postoperativt (12). Aktivitetsnivået til de undersøkte norske pasienter var høyt, med blant annet én pasient som løp maraton med transponert sene. Forekomsten av komplikasjoner var lav. Én pasient fikk en ruptur av den transponerte senen syv måneder etter kirurgi og hadde behov for revisjonskirurgi. Én pasient utviklet en asymptomatisk svikt av fotbuen. Etter senetransposisjon kan et mer normalisert gangbilde forventes sammenliknet med ikke-operativ behandling (14). Kraftgraden til den transponerte muskelen vil etter transposisjonen være noe redusert, med anslagsvis en kraftgrad (Tabell 1) (9).
KONKLUSJON
Droppfot er en vanlig komplikasjon etter kneluksasjon. Initialbehandlingen skal bestå av tilpassing av en droppfotskinne (ortose) og ekspektans. Dersom det ikke tilkommer en spontan bedring i løpet av det første året, kan man vurdere transposisjon av tibialis posteriorsenen til fotryggen. Resultater etter denne prosedyren er gode.
REFERANSER:
KLIKK her for å gå til referansene på kirurgen.no
NERVETRANSPOSISJON FOR DROPPFOT ETTER KNELUKSASJON
Skade på nervus peroneus og ledsagende droppfot kan være en av de mest plagsomme sekvelene etter alvorlige kneskader, og kirurgisk har dette vært utfordrende å behandle (1). Dette skyldes kombinasjonen av den ugunstige skademekanismen (traksjon) og nervens beliggenhet lateralt for collum fibula, der særlig den dype grenen er relativt låst eller forankret av fascien mellom laterale og fremre losje. Det gjenspeiles også i at denne grenen pleier å ha det største og mest alvorlige utfallet av de to grenene etter traksjonsskaden. Kadaverstudier har vist at antallet fasikler i peroneusnerven øker i området lateralt for kneet, mens mengden bindevev innad i nerven i samme området minker. Dette tilleggsmomentet øker sårbarheten for denne nerven når den utsettes for strekk (2). Skadeomfanget kan variere fra skader med partielle til totale utfall. De førstnevnte vil ofte kunne bedre seg spontant i løpet av de første månedene etter skaden, mens prognosen for totale skader er dårlig.
Peskun et al. fant ved regresjonsanalyse av 26 pasienter med peroneusskader (blant en kohort på 91 pasienter med kneluksasjon) at høy BMI, proksimal fibula fraktur og karskade økte risikoen for skade av peroneusnerven (1). I deres materiale hadde 18 pasienter vedvarende droppfot og plager, mens åtte pasienter (31%) kom seg spontant. I andre studier meldes det om spontan bedring hos 14-75%(3-5). Den store spredningen skyldes antagelig
forskjellige pasientpopulasjoner, der andelen med høyenergiske skader varierer. De voldsomme traksjonskreftene nerven utsettes for gir langstrakte skader der det kan være vanskelig å definere overgangen mellom frisk og skadet nerve. I det mest skadde området fremstår nerven enten som uttøyd over et lengere parti eller den kan være revet helt over. Slike nerveskader har tradisjonelt blitt håndtert med reseksjon av det skadde partiet og rekonstruksjon med nervegraft (som oftest nervus suralis). For alle nerver er det slik at prognosen er invers proporsjonal til lengden på graftene man bruker. En eksakt grenseverdi der nerverekonstruksjon med graft ikke er regningssvarende er man ikke helt enig om, men grensen synes å ligge rundt 7-8 cm. Lengre nervegraft enn dette ser ikke ut til å klare å støtte de regenererende aksonene godt nok til at mange nok når muskulaturen/endeorganet. Dette problemet er beskrevet for nervus peroneus, nylig oppsummert i en oversiktsartikkel fra 2015 (6).
De siste 20 årene har vi sett en økende interesse for, og bruk av nervetransposisjoner i ansiktet (fascialisskader) og overekstremitetene. Teknikken har senere blitt anvendt i underekstremiteten. Vi vil her gjøre rede for prinsippene bak nervetransposisjoner i sin alminnelighet før vi ser nærmere på muligheten for å reanimere tibialis anterior med nervetransposisjon, ved skade på nervus peroneus.
Nervetransposisjon er ikke en ny teknikk, den ble beskrevet for over 100 år siden. En av de første pasientseriene ble publisert så tidlig som 1903 i British Medical Journal av Charles Ballance som behandlet pasienter med fascialisparese ved å koble nervus fascialis fra siden av nervus accessorius, en såkalt ende-til-side-transposisjon (7). Noen få år senere (1907) ble forskjellige nervetransposisjoner beskrevet av Williams i sin tekstbok «The surgery of the nerves» og den tyske ortopeden Stoffel beskrev mange av nervetransposisjonene som er i bruk i overekstremiteten i dag i sin bok «Ortopädische Operationslehre» utgitt i 1913 (8). En del av teknikkene som ble beskrevet på denne tiden var nok i overkant fantasifulle og ikke alle ga ønsket resultat.
I årene som fulgte ble nervetransposisjon lite brukt og perifere nervekirurger konsentrerte seg om å perfeksjonere den primære nervesuturen og rekonstruksjon med nervegraft (9). Dette gjorde kirurgene i stand til å håndtere de aller fleste typer nerveskader. Likevel er det tre typer skader som fortsatt er problematiske;
1) Skader der de proksimale rotfilamentene er dratt ut fra medulla (såkalt rotavulsjoner, som først og fremst ses ved plexusskader).
2) Skader der det er langt fra nerveskaden til endeorganet (for eksempel vil nerveskader på lår- eller knenivå svært sjeldent kunne gi reinnervasjon av fotsålen).
3) Langstrakte skader der lange graft må benyttes (som er tilfellet ved de mest alvorlige nerveskadene sett ved kneluksasjoner).
I disse tilfellene kan nervetransposisjoner være et viktig supplement. Teknikken går ut på at man ofrer en gren eller fasikkel fra en nabonerve og kobler denne til nervegrenen man ønsker å reinnervere. Nerveskjøten anlegges som regel ende-mot-ende og helst så nær muskelen man skal reinnervere som mulig. Man kobler seg derfor som regel inn på nervegrenen like før den går inn i muskulaturen. På denne måten tilbys friske motoriske aksoner til den denerverte muskelen med kort reinnervasjonsvei, og prognosen for reinnervasjon forbedres. Teknikken forutsetter at donormorbiditeten er lav (aller helst neglisjerbar) og at man bruker en motorisk nervegren. Selv om det ikke finnes rene «motoriske» nerver eller nervegrener så er tanken at de inneholder en høy andel aksoner som skal reinnervere muskulatur. Når denne kobles til mottakeren (også en «motorisk» gren) så blir det mindre mulighet for krysskoblinger mellom sensoriske og motoriske aksoner. I tillegg er det gunstig om donor og mottaker har synergistiske funksjoner.
I underekstremiteten er det to hovedteknikker man har erfaring med; transposisjon av grener fra nervus obturatorius til nervegrenene til quadriceps (for pasienter med langstrakte defekter i nervus femoralis, ofte etter tumorkirurgi) og nervetransposisjon for skade på peroneusnerven. Skade på peroneusnerven, etter kneluksasjoner, er i teorien en type skade der nervetransposisjon skulle være en god løsning (gitt de dårlige erfaringene med tradisjonell rekonstruksjon av disse skadene) og flere mulige transposisjoner er blitt foreslått. Til felles har de at grener fra nervus tibialis benyttes som donornerve. Det bringer oss til et annet viktig prinsipp ved nervetransposisjoner; donornerven må være uskadd. Det vil si at pasienter med større kneskader der det har vært skade på nervus tibialis i tillegg, ikke egner seg til denne teknikken. Samtidig karskade er ofte en markør for skade på tibialisnerven, så ved slike kombinerte skader er ofte ikke nervetransposisjon mulig eller tilrådelig. Hos alle pasienter som vurderes for nervetransposisjon bør nervus tibialis undersøkes nøye preoperativt, både klinisk og nevrofysiologisk, for å sørge for at denne er uskadd og frisk.
De første teknikkene for nervetransposisjon ved skade på peroneusnerven benyttet seg av grener fra soleus eller gastrocnemius. Flores og kollegaer gjorde først en kadaverstudie før de publiserte et retrospektivt materiale med ti pasienter (10). Dessverre var det bare to pasienter som gjenvant dorsalfleksjon tilsvarende grad 3 eller 4 (11). På samme tid publiserte gruppen fra Mayo Clinic, med førsteforfatter Giuffre fra Pan Am Clinic i Canada, en retrospektiv gjennomgang av nervetransposisjoner utført etter høyenergiske kneskader (ti luksasjoner, en knusningsskade) (12). Deres tilnærming var å benytte en fasikkel lengre distalt fra nervus tibialis. Inngrepet ble foreslått utført via en lang lateral incisjon med fremstilling av den dype grenen til nervus peroneus og grenen(e) til tibialis anterior muskelen proksimalt i såret. Ved denne metoden dissekerer man seg inn bak fibula, mellom peroneus- og soleusmuskulaturen, cirka midt på leggen. Tibialisfasiklen man vil benytte velges med omhu (ved bruk av nervestimulator) og skal gi tåfleksjon. Spesielt viktig er det å ikke velge eller skade grenen til tibialis posterior som er «fallskjerm»-løsningen (tradisjonell senetransposisjon hvis nervetransposisjonen ikke virker godt nok). Den aktuelle fasiklen må kunne frigjøres tilstrekkelig langt nok proksimalt slik at den får lengde til å svinges, enten via membrana interossea eller rundt på utsiden av fibula, til grenene til tibialis anterior, der de skjøtes sammen i en ende-til-ende nervesutur. Man tilstreber også å velge en donor som gir en passende
kaliber-match med mottakergrenen til tibialis anterior. Artikkelen vakte stor interesse da den kom, men resultatene var bare marginalt bedre enn tidligere publikasjoner (12). Gjennomsnittlig alder for de 11 pasientene inkludert i studien av Giuffre et al. var 33,8 år. Alle hadde komplette peroneusnerveskader uten kliniske og nevrofysiologiske tegn til bedring. Nervetransposisjonen ble utført i snitt 5,8 måneder etter skaden og gjennomsnittlig oppfølgning var 17,7 måneder. Fire av de 11 pasientene gjenvant dorsalfleksjon mot tyngdekraft eller bedre. Disse og tre andre kunne senere klare seg uten droppfotortose. Gruppen mente å se bedre resultater hos yngre pasienter og i de tilfellene der nervetransposisjonen ble gjort tidlig (før seks måneder).
Et lignende materiale ble publisert i 2017 fra Melbourne, hvor en prospektiv kohort studie fulgte ni pasienter (åtte menn), med gjennomsnitt alder på 28,2 år (13). Pasientene ble behandlet med lignende nervetransposisjon som beskrevet av Giuffre et al., med donorfasikler til tåfleksorer, høstet fra nervus tibialis via to-incisjonsteknikk. Nervus tibialis er noe lettere å komme til fra medialt. Donorgrenen(e) fra nervus tibialis ble ført fra medialsiden via membrana interossea til det proksimale laterale snittet og koblet til tibialis anterior sin nervegren. Kirurgien ble utført i snitt 5,8 måneder etter skaden. Operasjonsindikasjon og oppfølgning virker ellers nokså likt som i Giffre et al. sin studie, men i dette materialet var resultatet bedre. Syv av ni pasienter oppnådde M4 dorsalfleksjon etter en gjennomsnittlig oppfølgning på 30,8 måneder. Kontraksjoner i tibialis anterior muskulaturen kunne merkes ved snaue seks måneder postoperativt og M4 kraft var oppnådd cirka halvannet år etter kirurgien i snitt.
I begge studiene beskrevet over ble det registrert liten donormorbiditet i form av lett svekket tåfleksjon og noe redusert leggomkrets, men ingen andre komplikasjoner. Begge gruppene anbefalte kortvarig immobilisering av ankel og kne med gipslaske eller ortose i to til tre uker før gradvis økende mobilisering og belastning. Her kan vi skyte inn at vi ved seksjon for overekstremitets- og mikrokirurgi, OUS, har prøvd begge teknikkene og synes ikke to-incisjonsteknikken ga noen større fordeler. Den var heller ikke enklere å utføre rent kirurgisk, hvorfor vi har holdt oss til den laterale tilgangen foreslått av Giuffre et al.
Head og kollegaer publiserte en oversiktsartikkel i 2018 der de også utførte en metaanalyse (14). De fant fire studier som kunne inkluderes (totalt 41 pasienter). De fant M3 dorsalfleksjon hos 15% og M4 hos 37%, men studiene som ble inkludert var nokså heterogene.
Basert på det som er publisert hittil virker det som suksessraten for nervetransposisjon ved skade på peroneus nerven ligger på rundt 50%, noe som er viktig å informere pasientene om. Et annet poeng som foreløpig ikke er undersøkt er utholdenheten en slik transposisjon kan gi. Det vil selvfølgelig være avgjørende for den daglige gangfunksjonen og burde ses på, for eksempel ved etterundersøkelse i et ganglaboratorium.
Ved seksjon for overekstremitets- og mikrokirurgi, OUS, har vi benyttet metoden hos syv pasienter hittil. Flere går fortsatt til oppfølgning så vi har dessverre ikke resultater som kan publiseres her, men metoden har vært vellykket hos enkelte av pasientene hittil. Vår erfaring har også vært at donormorbiditeten er beskjeden. Dorsalfleksjonen man oppnår ved denne teknikken gir løft til mediale del av foten. Dersom peroneus superficialis muskulaturen er utslått, hvilket den ofte er, vil dorsalfleksjonen trekke foten opp i supinasjon. Dette er heller ikke noe som har blitt adressert i publikasjonene som har kommet hittil. I et forsøk på å gi tåløft og en mer naturlig fotavvikling har Gatskiy et al. nylig foreslått en kombinasjon av sene- og nervetransposisjoner, med tibialis posterior til tibialis anterior senetransposisjon for å gi dorsalfleksjon, og nervetransposisjoner til grenene til ekstensor hallucis longus og ekstensor digitorum longus for å gi tåstrekk (15). Gruppen mener at denne kombinasjonen gir en bedre gangfunksjon ved videobasert ganganalyse 12 måneder postoperativt.
Det er fortsatt flere uavklarte spørsmål med metoden for nervetransposisjon ved skade på peroneusnerven, inkludert spriket i publiserte resultater, funksjonssammenligning med pasienter som har fått utført senetransposisjoner og utholdenheten for dorsalfleksjon. En forklaring på de litt skuffende resultatene kan være at donornervene man har benyttet inneholder for få aksoner. Dette har ikke overraskende vist seg å være avgjørende ved nervetransposisjoner generelt. White og kollegaer publiserte funn fra en kadaverstudie i 2012 der de fleste av grene-
ne til nervus tibialis gjengis (13). De fant at antall aksoner i motorgrenen til tibialis anterior var på drøye 3000 aksoner og fra denne artikkelen kan man derfor anta at nervene til gastrocnemius bør være en god match (cirka 2300 aksoner til laterale hodet og 2800 til det mediale). Fleksor hallucis longus er noe spinklere med cirka 1500 aksoner (16). Ellers kan mangel på synergistisk funksjon spille inn. Donornervene innerverer tåfleksorer og det er nok ikke en like opplagt synergisme mellom dorsalfleksjon i ankelen og fleksjon i tærne som det vi ser i hånden, der fingerfleksjon stort sett ledsages av ekstensjon i håndleddet. Denne mangelen på synergisme kan være en av årsakene til at teknikken ikke har virket så godt som forventet. Andre har også påpekt at fleksorene er overlegent sterkere enn ekstensorene i ankelen og mener at dette også kan være en del av forklaringen (11).
Hittil har vi ved seksjon for overekstremitets- og mikrokirurgi, OUS, tilbudt operasjonen til pasienter med

isolerte, komplette peroneusnerveskader, der bedring (klinisk og nevrofysiologisk) uteblir tre måneder etter kneluksasjon. Vi har tatt sikte på å operere pasientene innen seks måneder fra skadedato. Pasientene må informeres nøye om potensielle fordeler og ulemper ved metoden før de kan treffe et valg og på sikt vil vi ønske å etterundersøke dem for å se om metoden har en plass i behandlingen av denne pasientgruppen her i landet.
REFERANSER:
KLIKKherforåsereferansenepåkirurgen.no
RESULTATER ETTER KIRURGISK BEHANDLING AV KNELUKSASJON
En kneluksasjon er en alvorlig skade som nesten alltid gir en varig funksjonsnedsettelse også ved optimal behandling. Realistisk målsetning etter en slik skade er å kunne fungere i de fleste typer arbeid, gå tur/skitur, sykle og lignende. Mer krevende aktiviteter er det få som vil klare.
BERTE BØE OG SVERRE LØKEN ORTOPEDISK AVDELING, OSLO UNIVERSITETSSYKEHUS KORRESPONDANSE: BERTE BØE – BERTE2 @ MAC.COMINTRODUKSJON
Kneluksasjoner klassifiseres etter Schenk klassifikasjonen (Tabell 1) (1). I følge Moatshe et al. med flere, er over halvparten (52 %) av kneluksasjonene KD3-M, det vil si skade av begge korsbånd kombinert med skade av mediale kollateralligament (MCL). KD3-L, som er skade av begge korsbånd og laterale kollateralligament (LCL) og/ eller posterolaterale hjørne (PLC), representerer nesten en tredjedel av skadene (28 %) (2). De som har skader av menisk, brusk, kar og/eller nerver har dårligere resultat etter kirurgi enn de som har isolerte ligamentskader (3). De laterale skadene (KD3-L) har høy risiko for samtidig skade av nervus peroneus (odds x42) og karskade (odds x9). En skade av nervus peroneus gir ofte varig droppfot og mange av disse pasientene hemmes mer av dette enn av selve kneskaden.
De fleste artikler som er publisert om resultater etter kirurgisk behandling av kneluksasjoner og multiligamentskader i kne, er små kohorter av pasienter med relativt kort oppfølging. I tillegg er pasientgruppen svært heterogen; alt fra lavenergi med to-ligamentskader, der kneet ikke nødvendigvis har vært helt luksert, til høyenergi kneluksasjoner med omfattende bløtdelsskader og skade av alle ligamenter i kneet. Mange artikler som presenterer resultater etter kirurgi skiller ikke mellom disse ulike pasientgruppene og skademekanismene, selv om det er åpenbart at en ung idrettsutøver med en skade av to ligamenter (for eksempel fremre korsbånd (ACL) og mediale kollateralligament (MCL)) vil kunne forvente et bedre re-
sultat enn eldre pasienter som har hatt kneet ute av ledd som følge av høy energi i en bilulykke. Ulike pasienter har også ulike krav og forventninger til funksjon etter kirurgisk behandling. Det er derfor viktig med preoperativ kommunikasjon mellom pasient og behandler slik at informasjonen kan tilpasses den enkelte og legge grunnlaget for realistiske forventninger.
For å rapportere resultatene etter kirurgisk behandling av multiligamentskader brukes både funksjonelle scoringsskjemaer og røntgenundersøkelser. Knee Injury and Osteoarthritis Outcome Score (KOOS) er det scoringsskjemaet som brukes oftest i Norge og det er også det skjemaet som brukes av korsbåndregisteret. Dette er en pasient rapportert utfall score (PROM) der pasientene svarer på hvordan kneet fungerer innenfor fem underkategorier (symptomer, smerte, activities of daily living (ADL), sportog fritidssaktivitet og livskvalitet). Andre hyppig brukte knescorer er Lysholm, Cincinatti, International Knee Documentation Committee (IKDC). Alle disse har en skala fra 0-100 der 100 er et friskt kne. I tillegg klassifiseres ofte aktivitetsnivå med Tegner score der null tilsvarer å ikke vært i stand til å gå en tur og ti tilsvarer fotball/håndball på nasjonalt toppnivå eller bedre. Røntgenundersøkelser kan kartlegge objektiv instabilitet (stress røntgen) og utvikling av artrose (Kellgren-Lawrence).
KIRURGI
Det anbefales kirurgisk behandling av kneluksasjoner i akutt fase (mellom en og to uker etter skaden) fordi det
Schencks anatomiske klassifikasjon av knedislokasjoner
Skadet struktur
KD I Kun et korsbånd + kollateralligamenter
KD II ACL + PCL med intakte kollateralligamenter
KD III M ACL + PCL + MCL
KD III L ACL + PCL + LCL
KD IV ACL + PCL + MCL + LCL
KD V Knedislokasjon + fraktur
TABELL 1: Schencks klassifikasjon av kneluksasjoner basert på røket ligamenter. ACL: anterior cruciate ligament (fremre korsbånd), PCL: posterior cruciate ligament (bakre korsbånd), MCL: medial collateral ligament (mediale kollaterale ligament), LCL lateral collateral ligament (laterale kollateralligament).

fremmer tidlig rehabilitering og er rapportert å gi bedre funksjonelt resultat enn ikke operativ behandling. I tillegg er det lettere å dissekere og identifisere strukturer i en tidlig fase uten mye arrvev. De som ikke opereres akutt kan rekonstrueres i kronisk fase (fra tre måneder til flere år etter skaden).
Etter kirurgisk behandling for multiligamentskader i kneet blir pasientene anbefalt å delbelaste med krykker og bruke ortose for å beskytte kneet mot bevegelse sideveis. Ved bakre korsbåndskader brukes en ortose som i tillegg presser leggen fremover for å hindre at PCL-graftet skal tøyes ut. Med en slik PCL-ortose tillates fleksjon av kneet umiddelbart etter operasjonen. Dette er viktig for at pasientene skal komme i gang med trening. Alle pasienter får atrofi av quadricepsmuskulaturen når de må delbelaste i åtte uker. De som klarer å opprettholde muskelmasse og komme raskt i gang med styrketrening, kommer raskere tilbake til normale dagligdagse aktiviteter. Det tar som regel minst 12 måneder etter inngrepet før pasientene oppnår tilnærmet normal muskelstyrke igjen (Bilde 1).
Chahla et al. har sett på innvirkningen av meniskskader i tillegg til multiligamentskader (4). Av de 105 pasientene i denne studien var det imidlertid bare syv av dem som hadde det vi tenker på som en kneluksasjon med skade av begge korsbånd og sidebånd. Meniskskadene i denne studien ble suturert med multiple innside-ut suturer.
BILDE 1. 19 år gammel turner fire måneder etter rekonstruksjon av fremre korsbånd, bakre korsbånd og posterolaterale hjørne strukturer. Pasienten hadde forbigående peroneusparese og som bildet viser uttalt muskelatrofi.
Kun en av 43 pasienter ble reoperert for ny meniskskade innen to år. Det er mulig at samtidig rekonstruksjon av korsbånd og/eller suturteknikk gir en biologisk stimulering som bidrar til tilheling av menisskaden, men manglende tilheling av menisker gir nødvendigvis ikke så mye tilleggsplager at de blir oppdaget. Det var flere i meniskgruppa som ble operert akutt (33 av 43) sammenlignet med de som ikke hadde meniskskade (39 av 62) og det var 16 % ufullstendig oppfølging i meniskgruppen sammenlignet med 0 % ufullstendig oppfølging i kontrollgruppen. Pasientene i meniskgruppen hadde lavere Lysholm og Tegner score før operasjon sammenlignet med de som ikke hadde meniskskade. Etter to år var det ingen klinisk forskjell etter multiligamentkirurgi hos de som fikk utført menisksutur sammenlignet med de som ikke hadde meniskskade. Her er det imidlertid mange faktorer som kan påvirke resultatene og vi kan derfor ikke konkludere med at meniskskader ikke påvirker resultatet etter kneluksasjoner.
RESULTATER ETTER KIRURGI
I en studie fra Geeslin et al. på 29 pasienter (åtte knær med isolert posterolateral skade, 22 med kombinerte skader inkludert posterolateral skade) hadde pasientrapportert resultat økt fra 22 til 81 på Cincinnati score og fra 29 til 82 på subjektiv IKDC. Imidlertid blir det i studier der man inkluderer akutte skader litt meningsløst å rapportere klinisk forbedring fra før operasjonen til over to år etter inngrepet. Åpning av laterale leddspalte på stress-
røntgen ble redusert fra 6,2 mm preoperativt til 0,1 mm postoperativt. Stress røntgen postoperativt er en viktig og objektiv metode til å evaluere laksiditet (Bilde 2).


God funksjon har også blitt rapportert av andre forfattere (5-10). Selv om pasientene har god funksjon er det mange studier som rapporterer relativ høy forekomst av radiologisk artrose, fra 23 til 87 % (5, 8, 11, 12). Moatshe med flere har utført en oppfølging av 65 pasienter minimum ti år etter operasjon for kneluksasjon. Etter gjennomsnittlig 13 år hadde 42 % radiologisk artrose (>Kellgren Lawrence 1) i operert kne sammenlignet med 6 % i uoperert kne. Klinisk hadde denne gruppen Lysholm score på 84 (good), Tegner score på 4 og IKDC på 73 (fair) (11). Hantes et al. publiserte resultatene til en gruppe på 26 pasienter der de utførte stabiliserende kirurgi i kronisk fase (delayed ligament reconstruction). Der var andelen med artrose enda høyere, 70 % etter minimum åtte år. De fant at alder og bruskskade økte risikoen for artrose (13).
I en studie publisert av Engebretsen med flere på 85 pasienter med kneluksasjoner etter to til ni år fant Lysholm score på 83, median Tegner score på 5 og gjennomsnittlig IKDC 2000 på 64. Dog hadde hele 87 % radiologisk artrose på røntgen (>Kellgren Lawrence 1) i aktuelt kne (Bilde 3).
Høyenergi traumer, alder over 30 år, samtidig bruskskade, samtidig operasjon av skade på mediale strukturer, kombinerte skader på mediale og laterale menisk, behov for rekonstruksjon av posterolaterale strukturer eller begge korsbånd er faktorer som er forbundet med dårligere resultat (3, 12, 14-16).
Vi må erkjenne at pasienter som pådrar seg luksasjon av kneet ikke oppnår normal knefunksjon uansett om de behandles kirurgisk eller med ortose og trening. Ved
kirurgisk behandling er det høy risiko for komplikasjoner og reoperasjoner. I en systematisk oversikt skrevet av Everhart med flere rapporterer at bare 22 % - 33 % av idrettsutøvere på høyt nivå klarer å komme tilbake til samme nivå som før skaden (17). Det finnes dog absolutt pasienter som blir godt fornøyd med funksjonen etter kneluksasjoner også. En av dem vendte tilbake til World Cup i alpin etter luksasjon og operasjon av begge knær! Beskrivelse av skader og operasjonsteknikk er publisert av Sonnery-Cottet med flere (18). Lars Engebretsen og Robert LaPrade er to pionerer som har publisert en rekke artikler om operasjonsteknikker ved ligamentrekonstruksjon. Anatomisk rekonstruksjon er ansett som beste behandling sammenlignet med sutur/reparasjon eller ikke-anatomiske rekonstruksjoner. I en serie på 194 pasienter med sportsrelaterte multiligamentskader fra LaPrade et al. rapporterte Lysholm score på 90, Tegner score på 6 (kan jogge fem ganger i uken og stå alpint) og WOMAC 3 som må anses å være svært gode resultater etter omfattende skader (19).
KONKLUSJON
Det er vitenskapelig grunnlag for å hevde at kirurgisk behandling gir bedre Lysholm score og høyere sjanse for å returnere til sportsaktiviteter sammenlignet med ikke-kirurgisk behandling. Rekonstruksjon av ligamenter gir bedre resultater enn sutur/reparasjon og operasjon bør utføres innen to uker etter skaden. Pasientene får en akseptabel knefunksjon, men de har høy grad av artrose etter ti år.
REFERANSER:
KLIKK her for å se referansene på kirurgen.no
det tas prøver for okkult blod i avføringen, deretter årlige prøver. Ved symptomer relatert til galleblæren eller galleganger, bivirkninger i pankreas, gjentagende tarmobstruksjon skal behovet for fortsatt behandling med Revestive revurderes. Bør ikke brukes under graviditet og amming.
Hyppigst rapporterte bivirkninger: Abdominal

REHABILITERING ETTER MULTILIGAMENT KNEKIRURGI
INTRODUKSJON
Kneluksasjon er en svært omfattende skade og representerer en betydelig belastning i pasientens liv. Tidligere studier har vist at 20-40 % må bytte yrke etter rekonstruksjon av kneluksasjon [1], og at 19 % av pasientene ikke kommer tilbake i arbeid overhodet [2]. Tilbakevending til sport (RTS) har historisk sett vært ansett som svært usannsynlig, med en RTS-rate på 53 % for mosjonister, mens konkurrerende idrettsutøvere har en lavere rate på 22 % [2]. Rehabilitering etter en slik omfattende skade er en kompleks og tidkrevende prosess som bør være gjennomtenkt, gradvis og kriteriebasert. Til tross for kompleksiteten har disse skadene ikke fått samme oppmerksomhet som enkeltbåndskader i kneet. Evidensbaserte retningslinjer er blitt utarbeidet i henhold til det som er kjent om enkelbåndsskader selv om det er store ulikheter i skademønster og skadens kompleksitet. Våre anbefalinger for rehabilitering etter kneluksasjoner er basert på det som er vitenskapelig dokumentert om enkeltbåndskader [3,4,5] og vår egen kliniske erfaring. Vi vurderer nøye den beste tilnærmingen for å sikre tilheling av det rekonstruerte vevet. Likevel er det mer sannsynlig at pasienter, ved massive skader og kompliserte operasjoner utvikler stivhet i kneleddet. Rehabiliteringen bør derfor balanseres mellom det å beskytte det rekonstruerte/reparerte vevet og samtidig forebygge bevegelsestap.
Vi ønsker i denne artikkelen å gi en oversikt over vår tilnærming til denne pasientgruppen fra den akutte rehabiliteringsfasen til endt rehabilitering.
BEHANDLINGSPRINSIPPER OG – RETNINGSLINJER
Vi ønsker å gå igjennom de ulike fasene i vår rehabiliteringsprotokoll. Hovedprinsippene for protokollen er oppsummert i tabell 1. Målene for vår kriteriebaserte rehabilitering er å få pasienten tilbake til 1) dagligdagse aktiviteter, 2) arbeid og 3) sports- og fritidsaktiviteter på samme nivå som før skaden. Vi har skissert fire faser av rehabiliteringen etter operasjon: 1) vevsbeskyttelse, 2) gjenoppretting av motorisk kontroll, 3) optimalisering av funksjon og 4) tilbake til fritidsaktiviteter og sport.
Treningen bør inneholde både styrketrening og balanseutfordrende trening. Da det per i dag ikke er tilstrekkelig dokumentert en eksakt rehabiliteringsprotokoll for denne pasientgruppen er dette en «veileder». Det er betydelig variasjon i hvordan pasientene håndterer en slik omfattende skade, og i tillegg store variasjoner i opplevd smerte, hevelse og hvor raskt pasienten gjenvinner funksjon. Individuelle tilpasninger i øvelsesutvalg og dosering blir derfor svært viktig under rehabiliteringen.
I første fase starter pasienten med muskelaktivering i ikke-vektbærende stilling før styrketreningen fortsetter med bruk av egen kroppsvekt som den primære motstand for å øke styrken. Når kneet tåler egen kroppsvekt kan ytre motstand legges til. Det er vanskelig å si noe eksakt om hva riktig dosering er, men vi starter gjerne med mange repetisjoner, 25-30 repetisjoner à to til tre sett. Dette holdes gjennom fase 1 og 2. I fase 3, når en begynner med tyngre belastning, kan en gjerne redusere antall
Tabell 1 Rehabiliteringsprotokoll.
FASE 1: AKUTTFASEN (vev beskyttelse)
Tid Funksjonelle milepæler
Første uken etter operasjon
Innen 2 uker etter operasjon
Veiledende kriterie til neste fase:
• Sidelik full passiv ekstensjon
• Quadricepsaktivering
• Aktiv eller passiv knefleksjon opp mot 45 grader
• Stå og gå med passende ganghjelpemiddel
• Håndtering av kneortose
• Sidelik full aktiv ekstensjon
• Knefleksjon opp mot 60 grader
• Normal gange på flatt underlag med krykker
Etterfølgende tiltak
• RICE (ro, is, kompresjon og elevasjon)
• Sirkulasjonsøvelser for ankel
• Isometriske quadricepskontraksjoner
• Aktiv eller passiv bevegelse for ROM
• Mobilisering opp til stående og gående med passende ganghjelpemiddel
• Grundig instruksjon i kneortose
• Aktiv bevegelse for ROM med kneortose på
• Passive bevegelse for ROM uten kneortose
• Strak benløft med full ekstensjon i kneet. Innlæring i riktig gange med krykker
Reduksjon i hevelse. Aktiv knefleksjon til 90 grader. Full smertefri kneekstensjon. God quadricepskontroll. Strak benløft med full ekstensjon i kneet uten “heng”.
FASE 2: REHABILITERINGSFASEN (Gjennoppretting av motorisk kontroll)
Tid Funksjonelle milepæler
Tidligst 8 uker etter operasjon
• Liten til moderat hevelse og lite smerte
• God muskulær kontroll i ett normalt gangmønster
• Full kneekstensjon
• Aktiv knefleksjon til over 90 grader
• Langsomt oppsteg på lav kasse med full vektbæring, stabil hofte og kne
Etterfølgende tiltak
• Fortsette bevegelighetstrening
• Tyngdeoverføring stående med forskyvning fra side til side/frem og tilbake
• Avvikle krykker og innlæring i riktig gange
• Stabilitets/balansetrening på to og ett ben
• Ergometersykling for bevegelighetstrening
• Trappegang/oppsteg/nedsteg på kasse
• Knebøy med kroppsvekt
Veiledende kriterie til neste fase:
Minimal hevelse og smerte. Knefleksjon til 120 grader. Evne til å stå på ett ben med kontroll (10 sekunder). Lavt oppsteg med full vektbæring, stabil hofte og kontrollert full aktiv kneekstensjon.
FASE 3: REHABILITERINGSFASEN (optimalisering av funksjon)
Tid Funksjonelle milepæler
Tidligst 16 uker etter operasjon
• Gjennvinne fulle bevegelsesutslag
• Øke musklær kontroll
• Gå 30 minutter uten økende smerte eller påfølgende hevelse de neste 12-24 timer.
Etterfølgende tiltak
• Funksjonstrening med økende belastning (gange, trapp, balanseøvelser)
• Nevromuskulær trening; sakte øke fra stabilt til dynamisk underlag
• Pertubasjonstrening
• Økende styrketrening med fokus på kontroll og styrkeutvikling med høy belastning også eksentriske styrkeøvelser
• Deretter styrketrening med fokus på stabilitet i bevegelser Veiledende kriterie til neste fase:
Ingen hevelse. Full knefleksjon. Høyt oppsteg med full vektbæring, stabil hofte og kontrollert full aktiv kneekstensjon. Styrketester over 85 % frisk side.
FASE 4: TILBAKE TIL FRITITSAKTIVITET OG SPORT
Tid
Tidligst 6 måneder
Funksjonelle milepæler
• Avvikling av kneortose
• Kondisjonstrening uten økt hevelse
• Hoppe symmetrisk og beherske myke landinger på to ben
• Hinke ned fra kasse -kontrollert landing med god kne- og hoftefleksjon
• Løpe 10 min på tredemølle uten økende smerte eller hevelse
• Retur til ikke-vridningsidretter og idretter med mindre belastende vridninger (f.eks. løping/langrenn):
• Isokinetisk styrketest > 85 % sammenliknet med frisk side
• Hinketester > 85 % sammenlignet med frisk side
• IKDC spørreskjema > 85 %
Tidligst 12 måneder
• Retur vridningsidretter
• Kan hoppe og hinke med retningsforandringer og kvalitet tilsvarende frisk side
Etterfølgende tiltak
• Kondisjonstrening: ergometersykling/ ellipse/romaskin/langrenn
• Jogge på tredemølle
• Introdusere øvelser med hopp og landinger på to ben
• Hopp og landingsøvelser grader t til skadeomfang (ett eller to ben)
• Gjelder for alle idrettene:
• Starte gradvis deltagelse i trening med lag
• Fokusere på idretts-/aktivitetsspesifikke bevegelser
Videreføre trening av:
• Hopp og myke landinger på ett og to ben med retningsforandringer
• Eksplosivitet
• Hurtig stryke
• Dynamisk stabilitet
• Retningsforandring
Veiledende kriterier for tilbake til vridningsidretter:
Ingen hevelse eller smerte under aktivitet. Isokinetisk styrketest > 90 % sammenlignet med frisk side. Hinketester > 90 % sammenlignet med frisk side. IKDC spørreskjema > 90 %.
repetisjoner i flere sett. En kan også med fordel variere øvelsesutvalg regelmessig. Eksempler kan være benpress der en endrer fra ett ben til to ben, eller knebøy der en endrer hastighet og tyngde.
Med nevromuskulær trening mener vi øvelser som har til hensikt å utfordre balansen og fremme dynamisk stabilitet av kneet. Det er vist at pasienter med ligamentskader har andre muskulære aktiveringsmønstre under aktivitet enn friske [6]. En viktig del av rehabiliteringen er derfor å gjenvinne aktiveringsmønstre som er hensiktsmessige. Under balansetrening ønsker vi å tilstrebe kvalitet i bevegelsene. Pasienten skal kunne utføre samtlige repetisjoner i hver øvelse med kontroll og riktig utførelse. Det er viktig at vi som terapeuter nøye observerer eventuelle uønskede kompensatoriske bevegelser og gjennom instruksjon forsøker å minimere disse. Under behandlingen benytter vi speil aktivt, og bruker mye tid på å lære pasientene å se hva som er riktig utførelse av en bevegelse. Ved balansetrening tilsier vår erfaring at seks til åtte repetisjoner á to til tre sett er hensiktsmessig. Ved flere repetisjoner vil ofte kvaliteten i bevegelsene ikke bli som ønsket. Øvelsene progredieres ved å endre underlag eller ha ytre påvirkninger (ujevnt underlag, kaste ball, gi ett push og så videre).


Som ved alle skader og operasjoner forventes det smerter. Ved større skader og operasjoner er det naturlig å
forvente mer smerter, noe vi opplever hos denne pasientgruppen. I tillegg er vår erfaring at det er svært stor variasjon når det gjelder opplevd smerte hos disse pasientene. Det er viktig å forberede pasienten på at det forventes at smerter oppstår under trening, men at trening allikevel bør gjennomføres. Det er derimot viktig å ta hensyn til smertene under trening. Som hovedregel bør pasientens smerter ikke overskride 3-4 på en VAS skala. Eventuelle økte smerter i kneet bør avta i løpet av noen timer. Smerter over 5 på VAS bør resultere i endring i aktivitet, det samme gjelder om smertene varer i 12-24 timer. Dersom smerter er begrensende for utførelsen av øvelsene, bør det vurderes å endre belastning, antall repetisjoner, hastighet og aktivt bevegelsesutslag i øvelsen. Hvis nevnte endringer ikke reduserer pasientens plager, anbefales det å kutte ut øvelsen for en periode. Hevelse bør også observeres. Blir det en betydelig hevelse etter trening og dette ikke avtar i løpet av 12-24 timer, bør aktivitet reduseres. Det er derimot forventet at ved økende belastning i treningen kan smerte og hevelse tilta. Dette bør derimot stabiliseres, hvis ikke er dette en indikator på at kneet ikke er klar for denne belastningen.
Ofte er det ulike restriksjoner ut ifra hvilke strukturer som er reparert eller rekonstruert. En må ta hensyn til de strukturer som bruker lengst tid på tilheling eller som er mest sårbare.
FASE 1: DE FØRSTE ÅTTE UKENE – AKUTTFASEN/ VEVSBESKYTTELSE
Hovedmålene i det tidligste stadiet etter operasjon er å minimere hevelse og smerte fra kneet, starte bevegelighetstrening (ROM) innenfor de restriksjoner som er gitt, og å minimere hypotrofi av muskulaturen i benet. Det er også viktig å tilstrebe ett tilnærmet normalt gangmønster med avlastning av krykker som også vil bidra til å forbedre funksjonen i kneet. I tillegg må klinikeren overvåke pasienten med tanke på postoperative komplikasjoner som sårinfeksjon, dyp venetrombose, nerveskade og utvikling av artrofibrose.
Kuldebehandling med kuldemansjett, elevasjon av benet og kompresjonsbandasje brukes for å minimere leddeffusjon og for å håndtere postoperative smerter. Manuell lymfedrenasje er også et tiltak som kan benyttes for ødem i operert ben. Pasienten får tilpasset en ortose rett etter operasjonen. Ved kombinerte skader som omfatter bakre korsbåndsruptur skal pasienten benytte en bakre korsbåndsortose (Jack PCL ortose) (Figur 1). Jack-ortosen gir ett press av tibia fremover for å minimere posterior tibial translasjon ved fleksjon slik at det blir minimalt drag på PCL [7]. Ved samtidig fremre korsbåndsruptur (ACL) justeres presset noe ned for å hindre foroverluksasjon av tibia. Trykkinnstilling skal ikke overstige åtte ved samtidig ACL-ruptur. Ortosen brukes dag og natt i åtte uker, deretter 16 uker ved belastning. De fleste pasienter har epiduralt smertekateter, eller lokal nerveblokade de første dagene postoperativt. Da smertekateteret ofte gir redusert sensibilitet og motorikk får disse pasientene tilpasset en lang, leddet ortose i full ekstensjon inntil smertekateter er seponert. Deretter tilpasses en Jack-ortose. Pasienten avlaster med krykker med cirka 20 kg belastning i åtte uker for å beskytte graftene, men også for å minimere hevelse og smerte i det tidligste stadiet av rehabiliteringen. Etter åtte uker tillates full belastning.
Umiddelbar bevegelighetstrening med ortose er trygt og et avgjørende tiltak for å redusere risikoen for artrofibrose. Fleksjon er begrenset til 90 grader de første åtte ukene for å beskytte tilhelende graft. Pasienten instrueres umiddelbart i aktive understøttede øvelser for bevegelighet i kneet, i tillegg bør passiv ROM av terapeut startes umiddelbart etter operasjon. Passiv ROM, med (trykk av) eller uten ortose, utføres i mageleie for å redusere posterior tibiale translasjon og redusere tibial sag (Figur 2). Tøyning i hyperekstensjon frarådes for å begrense drag på rekonstruerte strukturer som oppstår ved hyperekstensjon. Det er imidlertid avgjørende å gjenopprette full kneekstensjon. Vi anbefaler pasientene å hvile i mageleie uten ortose. Patellofemorale mobiliseringer er tiltak, sammen med hyppig aktivering av musculus quadriceps
for å gjenopprette og opprettholde full kneekstensjon. Tidlig musculus quadriceps-aktivering er også avgjørende for å gjenopprette motorisk kontroll og minimere atrofi. Pasienten instrueres umiddelbart i øvelser for musculus quadriceps i understøttet og i lukket kjede.
Neuromuskulær elektrisk stimulering (NMES) kan benyttes for å hjelpe pasienten til å aktivisere musculus quadriceps og har vist seg å forbedre funksjon og utfall etter operasjon [8]. Vi benytter også transkutan elektrisk nervestimulering (TENS) som smertelindring om pasienten har vedvarende smerter som hemmer trening og aktivitet, selv om det er lite evidens for dette [9]. Andre terapeutisk øvelser inkluderer aktivering av glutealmuskulatur, ankel pumping og treveis «strakt-ben-løft» (hoftefleksjon, -abduksjon og -ekstensjon). Ved slutten av denne fasen bør pasienten ha full ekstensjon, tilstrebe benløft uten ekstensorlag og ha oppnådd omlag 90 grader knefleksjon. Ved nedsatt ekstensjon og fleksjon uten fremgang bør mobilisering i narkose vurderes i samråd med ortoped.
FASE 2: TIDLIGST ÅTTE UKER – GJENOPPRETTING AV MOTORISK KONTROLL
Fase 2 er en overgangsfase mellom beskyttelsesfasen og optimalisering av funksjon. Denne fasen har to hovedmål:
1. gå videre til full vektbæring i ett normalt gangmønster
2. forberede det opererte kneet på å tåle belastning slik at det er klart for den økende styrketreningen i påfølgende fase
I denne fasen avvikler pasienten krykker. Når pasienten har minimalt med hevelse i kneet og kan gå på flatt underlag med full ekstensjon uten halting, kan krykker avvikles. Ett annet kriterie for å avvikle krykker er at pasienten klarer «strakt-ben-løft» uten heng. Pasienten starter med grunnleggende vektbærende øvelser som vektoverføring i stående med forskyvning fra side til side og frem/tilbake, innlæring av gange uten krykker, og oppsteg i trinn. Bevegelighetstrening på ergometersykkel uten belastning kan startes opp i denne perioden. Dette skal utføres i en jevn og kontrollert bevegelse. Om pasienten ikke klarer å fullføre en hel omdreining på grunn av begrenset knefleksjon, skal ikke kneet tvinges inn i bevegelsen, kun bevege seg i en behagelig bue. For å fullføre en hel omdreining kan setehøyden justeres opp og etter hvert som ROM forbedres kan setehøyden senkes. Hevelse kan fortsatt være til stede, men må være ikke-reaktiv før faseprogresjon. Å starte med vektbærende øvelser kan fremprovosere både hevelse og ubehag i kneet. Øvelser bør utføres i trygge omgivelser der pasienten har tilgang til støtte for balanse om nødvendig (for eksempel
terapeutstøtte, parallelle barer, og så videre). Øvelsene i denne fasen retter seg mot den generelle styrkingen av underekstremitetsmuskulaturen, samt det å gjenoppta et normalt gangmønster.
FASE 3: TIDLIGST 16 UKER – OPTIMALISERING AV FUNKSJON
Etter at pasienten har fullført overgangsfasen og kneet tåler egen kroppsvekt, kan pasienten gå videre til neste rehabiliteringsfase. Målet for denne fasen er å gjenvinne fulle bevegelsesutslag, normalisere muskelstyrke og reetablere kneets dynamiske stabilitet. Gjenvinning av muskelstyrke, spesielt i musculus quadriceps, har vist seg å være essensielt for å kunne oppnå god stabilitet og redusere risikoen for episoder der kneet gir etter [10]. I starten av denne fasen forventes svakhet og muskelatrofi, spesielt for musculus quadriceps og hamstringsmuskulaturen, grunnet belastnings- og bevegelsesrestriksjoner i de tidligste fasene av rehabiliteringene. Progresjon i belastningen for å gjenvinne muskelstyrke og volum vektlegges på dette stadiet. Styrketreningen bør ha fokus på kontroll og styrkeutvikling med høy belastning og få repetisjoner (4x6 repetisjoner) forutsatt fullt bevegelsesutslag og ingen vesentlig økt hevelse i etterkant.
Når pasienten har avviklet krykker og har tilstrekkelig musculus quadriceps-styrke, kan oppstart på ellipsemaskin begynnes. Ved gange på tredemølle, ergometersykling og bruk av ellipsemaskinen bør treningen starte med konstant belastning og konstant hastighet for å gi kneet en tilvenning til aktiviteten. Dette bør gjøres i et par måneder. Om kneet er reaksjonsløst og tåler dette, kan en gå videre til et intervalltreningsprogram med variabel hastighet og motstand ut ifra hva kneet tåler. Progresjonen bør gå sakte frem (omtrent 10 til 20 % per uke).
FASE 4: TIDLIGST 6 MÅNEDER – TILBAKE TIL
FRITIDS AKTIVITETER OG SPORT
Alle utøvere kan ha mulighet til å gå tilbake til sport etter en kneluksasjon. Dette vil imidlertid avhenge av tidligere funksjonsnivå, toleranse for rehabilitering, progresjon, kompleksiteten av skaden og operasjonen, og tilstedeværelse av nerve og/eller vaskulær skade. Realistiske forventinger bør diskuteres tidlig i rehabiliteringen.
På grunn av den relativt lange perioden av immobilisering for at vevet skal tilheles, er det viktig å avvente kondisjonsøvelser inntil dette er trygt. Sykling for aerob kondisjonstrening kan starte tidligst 6 måneder etter operasjon om pasienten har oppnådd tilnærmet fulle bevegelsesutslag og har oppnådd en slik kontroll av un-
derekstremiteten at de kan kontrollere farten til pedalene tilstrekkelig.
Etter 6 måneder kan pasienten starte med hopp og landingsøvelser hvor hovedfokuset er stabilitet og myke landinger. Lett jogging på tredemølle kan også gjenopptas, forutsatt full bevegelighet, god musculus quadriceps kontroll og 30 min gange uten smerte eller økende hevelse. Som nevnt innledningsvis returnerer kun 53 % til mosjonsidrett og 22 % til konkurranseidrett etter denne omfattende skaden. Introduksjon til hopp og løp er derfor ikke aktuelt for alle pasienter. Det er i hovedsak smerter og instabilitetsproblematikk som er avgjørende for om pasienten kan klare å returnere til hopp- og løpsøvelser. For de som ønsker å returnere til sin idrett er det viktig med klargjøring av pasient før gjenopptakelse. Selv om det finnes begrenset dokumentasjon på hvilke kriterier som bør ligge til grunn for å klarere en pasient tilbake til idrett, anbefales et testbatteri som inkluderer objektiv styrketesting, standardiserte hinketester og validerte spørreskjemaer [11,12]. Vår testprotokoll etterligner de som brukes til fremre korsbåndspasienter, da spesifikke protokoller for kneluksasjonspasienter ennå ikke er utarbeidet eller validert [13]. Dersom det er aktuelt med gjenopptakelse av en vridningsidrett, anbefales dette tidligst 12 måneder etter operasjon.
AVSLUTNING
Kneluksasjon er en alvorlig skade og medfører langvarig rehabilitering. Prognosen varierer fra pasient til pasient, og er avhengig av skadens omfang. De fleste pasientene er tilbake i arbeid innen ett år etter operasjon/skade. Det er usikkert hvor mange pasienter med slik alvorlig ligamentskade i kneet som returnerer tilbake til idrett. Pasienter som har skadet flere strukturer i kneet, får ofte alvorlige senkomplikasjoner i form av vedvarende instabilitet og posttraumatisk artrose. Vi vet ikke hva som er optimal behandling av denne pasientgruppen, men erfaringen er at rehabilitering etter en slik omfattende skade er en kompleks og tidkrevende prosess. Rehabiliteringen bør inkludere både styrketrening og nevromuskulær trening med regelmessig og strukturert oppfølging og veiledning av fysioterapeut det første året etter operasjon.
REFERANSER
:
KLIKK her for å se referansene på kirurgen.no
Be

Vi har igjen gleden av å delta på Høstmøte og ser frem til å treffe dere blant annet på vår stand (401). I år har vi mye nytt å presentere for dere, så ta turen innom oss. Ønsker du å avtale et eget møte med oss en av dagene, vennligst ta kontakt.
Jørn Eide - 468 08 861 - joern.eide@olymps.no
Hjalmar Ous - 418 05 110 - hjalmar.ous@olympus.no
Vi avholder symposium/foredrag torsdag 27. oktober kl 14:30 i Auditoriet S2.
For mer informasjon, vennligst se www.olympus.eu/ViseraEliteIII
BEKKENRESERVOAR OG NOEN KIRURGISKE FORHOLD SOM ER NØDVENDIGE FOR ET GODT RESULTAT
Det ileale bekkenreservoaret har ingen definitive medisinske fordeler fremfor en permanent stomi. Hensikten er forbedret livskvalitet ved at tarminnholdet tømmes viljestyrt gjennom anus, helt ulikt den konvensjonelle stomien.
Bekkenreservoarets akilleshæl er, som ellers i rekonstruktiv tarmkirurgi, anastomosen. En anastomose må ha tilstrekkelig blodforsyning og den må ikke utsettes for tensjon for tilheling. Annet er ikke god medisinsk praksis. Den ileo-anale anastomosen er spesielt utsatt. Den er lav og anlegges på anus. Anus påvirkes ikke bare av glatt muskulatur, men også av tverrstripet muskulatur. Anastomose her er mer fiksert enn ved en vanlig tarmanastomose og ofte rekker ikke ileumslyngen ned til anus for tensjonsfri anastomose. Ved proktektomien er det ikke lege artis å bruke metoder som truer viktige funksjonelle nerver da skade på disse gir redusert livskvalitet. Ved kreftkirurgi er det primære målet overlevelse og der kan man tolerere risiko for redusert livskvalitet, men ikke ved bekkenreservoarkirurgi.
Vi vil her beskrive anerkjente metoder som reduserer muligheten for komplikasjoner som undergraver målet for kirurgien.
GOD NOK LENGDE?
Før man fjerner rektum, som ofte står igjen etter kolektomi, må man måle ut lengden på ileumslyngen. Lengden er også avhengig av hvor langt ned i anus man må legge anastomosen. Ved ulcerøs kolitt kan anastomosen legges på toppen av anus, det vil si maksimalt 2 cm ovenfor linea dentata. Ved familiær adenomatøs polypose (FAP) der det er grov dysplasi helt ned til line dentata eller store polypper, og ved primær skleroserende kolangitt (PSC) med atypi distalt i rektum, bør anastomosen legges lenger ned på linea dentata. Slike tilstander kan kreve mukosektomi og håndsydd anastomose. Dette avklares i god tid før inngrepet. Slike tilstander er sjeldne og inngrep bør foretas på sentra med erfaring.
Den nødvendige lengden utmåles fra symfysekanten og
distalt. En god regel er at avstanden ikke bør være mindre enn 7 cm, helst mer. Da vil ileumslyngen nå ned til toppen av anus. Den er vanligvis anatomisk for kort, men økes med opptil 2 cm med transeksjoner av krøsets peritoneum som første tiltak. Arteria ileocolica bør alltid bevares ved kolektomi når bekkenreservoar kirurgi kan bli aktuelt. Det øker frihetsgradene for krøsforlengelse når dette er nødvendig. Den begrensede faktoren for tilstrekkelig lengde er forsyningsarteriene til ileum, vel 10-20 cm inn på ileum. Ved gjennomlysning av krøset vil man se hvilket kar som begrenser lengden. Dette kan man dele. Arkadene bibeholdes og blodforsyningen sikres via arteria ileocolica og arteriae ilei, proksimalt. Denne manøveren har vært kjent i mer enn 30 år (1,2,3). Er arteria ileocolica likevel fjernet tidligere, kan man teste ut blodforsyningen ved å bruke karstrikker på aktuelle karstilker. Med denne tilnærmingen er vår erfaring at vi ikke opplever kortkrøs fenomen. Lengden blir ofte opp mot 10 cm, noe som sikrer en slakk anastomose uansett, og uten å gå på bekostning av blodforsyningen.
Det er sjeldent nødvendig med mukosektomi og håndsydd anastomose fordi dobbelstapling kan gjøres ned på linea dentata (4,5). Teknisk feilstapling kan skje, og andre tvingende grunner til håndsydd anastomose tilsier at der det drives bekkenreservoarkirurgi må den håndsydde teknikk likevel beherskes. I øvede hender kan den nye distale tobakkpungsutur-teknikken erstatte transeksjonsstapling ved proktektomien (6).
PROKTEKTOMI VED BEKKENRESERVOARKIRURGI ER IKKE KREFTKIRURGIMETODEN
Ved kreftkirurgi skal man holde seg «lengst» mulig unna tumor og dens spredningsvei. Ved bekkenreservoarkirurgi skal man holde seg lengst mulig unna de urogenitale nervene. Disseksjonsstrategiene skiller seg derfor vesentlig fra hverandre. Total mesorektal eksisjons (TME) «holyplane» utfordrer nerver og nervepleksa, selv ved korrekt utførelse. TME-disseksjonen utfordrer nervepleksa over promotoriet, der skade kan gi blæreforstyrrelser og retrograd ejakulasjon. Ned mot bekkenbunnen går planet nært nervi erigendi. De kommer fram (dorsolateralt) og
går sammen med nervus hypogastricus lateralt, for så å bre seg ut langs med og på prostata hvor de ikke lenger er særlig synlige.
Proktektomien ved bekkenreservoar må være risikoreduserende og ikke følge TME-planet der den truer nervene. Her må disseksjonen gå i mesorektum. Man må gå lateralt inn gjennom mesorektum før bekkenbunnen er nådd (7). Man koner da inn på rektumrøret og følger dette ned til anus. Man skal ikke dissekere seg til vesicula seminalis og man skal ikke gå foran Denonvilliers fascie. Man skal alltid være dorsalt for fascien. Denne anterolaterale koningen inn i mesorektum er det internasjonal enighet om (7). Den modifiserte TME-teknikk er mye brukt og har i økende grad erstatt den tidligere møysommelige tarmnære disseksjonen. Denne metoden følger tarmrøret hele veien ned, legger mesorektum in situ og er anatomisk ikke i konflikt med nervene. Med moderne ligeringsdiatermi er metoden nå rask og sikker og med disse forhåndsreglene er risiko for impotens og/eller retrograd ejakulasjon svært liten.
TRANG ANASTOMOSE OG BLOKKING?
Den ileo-anale anastomosen er spesiell. Musculus internus i analsegmentet mister sin innervering og den funksjonelle tilknytningen til rektum. Muskelen atrofierer og som følge blir anus trangere. Postoperativt, særlig ved håndsydd anastomose, kan det danne seg et arrsegl som må blokkes til en diameter som er funksjonell. Blokkingen gjøres én til tre-fire ganger i løpet av de første måneder. Andre ganger er det en pågående inflammatorisk prosess i anastomoseområder som gir striktur. Denne skyldes anastomoseseparasjon i mer eller mindre grad. Stenosen må blokkes for å bedre funksjonen. I alvorlige tilfelle skyldes stenosen anastomoselekkasje og fisteldannelser, som trenger sine egne tiltak.
Hvor mye skal det blokkes? Det skal blokkes til man oppnår en akseptabel funksjon. Det er funksjonen som plager pasienten det skal blokkes for. Det kan være for hyppige tømninger, vansker med å
få tømt seg, siving og «urge». Blokkingen må ikke medføre inkontinens. Hegar 13 tilsvarer omlag tykkelsen på pekefingerens proximale interfalangialedd, eller et stivt barnerektoskopi/endoskop. Dette er mye mindre enn en normal anus, men det er ikke grunnlag for å øke dilatasjonen utover dette, tatt funksjonen i betraktning.
Ved stenoser skal de tøyes opp, ikke sprenges. Da oppstår sår og ny arrstriktur. Bruk av finger og forsiktig oppblokking gir god følelse med strikturens beskaffenhet. Andre bruker Hegarstifter i økende størrelse. Man bør stoppe ved smerter og blod på hansken eller Hegarstiften. Blokking gjentas med maksimalt 14 dagers intervaller til ønsket funksjon er oppnådd. Trengs det narkose må man vurdere om ikke mer alvorlige komplikasjoner ligger bak. Endoskopi, MR og reservoarografi er da aktuelt.
Bekkenreservoarkirurgi er komplekst, inneholder mange ulike steg med spesifikke utfordringer. Hvert steg krever sine løsninger og man må kjenne til alternativene når slike løsninger ikke kan gjennomføres. Det siste ligger utenfor denne gjennomgangen.
I Norge får mindre enn halvparten av alle aktuelle pasienter bekkenreservoar, sammenlignet med andre land i Norden. Alle aktuelle pasienter bør få tilbud om henvisning til sykehus der reservoarkirurgi drives for rett og balansert informasjon om bekkenreservoaret. Pasienter kan lett få mistillit til bekkenreservoarkirurgi dersom tidlige komplikasjoner vedvarer. Komplikasjoner med påfølgende redusert livskvalitet er noe som potensielle pasienter fanger opp gjennom mange kanaler og fora. De vil da neppe ønske å utsette seg for slik kirurgi. Med for mange komplikasjoner vil bekkenreservoaret tape sitt renommé; også blant leger.
REFERANSER:
KLIKK her for å se referansene på kirurgen.no
Kirurgen ønsker alle annonsører, bidragsytere og lesere en god jul.
VINNER AV KIRURGENS PRIS 2021/2022
Prisen ble overrakt førsteforfatter Arne Seternes av Harald Hugeschmidt under kirurgmiddagen i Høstmøteuken.
En stor takk rettes til bedømmelseskomiteen for årets utdeling. Bedømmelseskomiteen besto av Harald Hugenschmidt (ved transplantasjonskirurgisk avdeling, Oslo universitetssykehus) og Kaare S. Midtgaard (ved ortopedisk klinikk, Oslo universitetssykehus). Det var ingen enkel oppgave, mange artikkler holdt høyt nivå og spesielt Kirurgen nr. 4 2021, som omhandlet akutte nakke- og ryggskader, var gjenomgående velskrevet og godt illustrert. Etter flere runder ble bedømmelseskomiteen enig om at artikkelen fra Seterenes med medforfattere skåret høyest på listen.

Bedømmelseskomiteens begrunnelse var som følger: Artikkelen omhandler kirurgisk behandling av tarmfistler hos pasienter som behandles med åpen buk for kirurgiske komplikasjoner. Å snu løpet til det bedre for disse pasienter krever en høy grad av dedikasjon og
en gjennomtenkt tilnærming fra den behandlende kirurgen.
Seternes og medforfatterne får prisen for årets artikkel fordi den formidler både erfaringen og det bakenforliggende konseptet med sin selvutviklede teknikk over de siste ti årene. ChimneyVAC-metoden, som presenteres her, bruker materialer som er lett tilgjengelige i norske sykehus og som derfor vil være lett å ta i bruk for alle som behandler denne pasientgruppen. Artikkelen er didaktisk oppbygd i bruken av illustrasjoner og fotografier. Prinsippene er klart formulert og nødvendigheten av nitidig oppfølging og teamwork fremheves. Resultatene som gruppen fremlegger er imponerende med en mortalitet som er langt lavere enn hva man kunne forvente. Samtidig illustrerer både gjennomsnittlig antall VAC-skifter og liggetiden på nærmere tre måneder hvilken innsats som kreves. Artikkelen er viktig lesning for kirurger under utdanning og inspirerende lesning for erfarne kollegaer.
FUNKS ÆRESPRIS OG DET KIRURGISKE SAMHOLDET
Hvert år deler vi ut FUNKs ærespris til en person som har gjort en ekstra innsats for kirurgisk utdanning. Vi har vært gjennom snart fire år med ny spesialistutdanning. For de fleste har dette kun gjort seg til kjenne med kompetanseportalen, men i realiteten er det hele spesialiststrukturen i Norge som er endret. Opprinnelig skulle også sykehusstrukturen endres, med færre og større sykehus, men slik ble det ikke. I den gamle ordningen var basen i kirurgisk utdanning å bli generell kirurg for deretter å subspesialisere seg i ønsket fagområde. I ny ordning ble alle subspesialitetene egne hovedspesialiteter etter ønske fra det kirurgiske miljøet. Årsaken var at mange mente kirurgen brukte for lang tid i andre spesialiteter enn den man endte opp i. Vi skulle ha en “common trunk” som ny kirurgisk base som var stipulert til å ta to år. Ikke ulikt strukturer i andre land hvor man roterer til forskjellige kirurgiske avdelinger i to år for så å søke seg inn i et utdanningsløp i valgt spesialitet. Dette ble angivelig stoppet på foretaksnivå da det ble vanskelig å arrangere. Samtidig ønsker ikke YLF at man skal ha ansettelser som er tidsbegrenset. Da står vi igjen med en del 2 som er svært flytende og som kan oppnås ved hospiteringer istedenfor rotasjoner.
Det ble tydelig for det kirurgiske miljøet at man sto i fare for å miste bredden i kirurgisk utdanning. På større sykehus med vaktlag i de fleste spesialiteter er dette kanskje ikke et problem, men på mindre og mellomstore sykehus går de fleste generell-kirurgiske vakter. Hvordan skulle kompetansen sikres? Et annet problem viste seg; siden alle subspesialitetene nå var egne hovedspesialiteter var ikke lenger NKF paraplyforening for disse. Det sterke kirurgiske samholdet sto for fall.
Det ble kjempet en hard kamp for å få de sentrale aktørene til å forstå utfordringene man sto ovenfor. Både at et samlet kirurgisk miljø og god generellkirurgisk kompetanse i Norge, med mange mindre sykehus, er helt nødvendig for pasientsikkerheten. Utfordringene har vært mange. Flere har jobbet utrettelig med disse sakene og først vil vi gi en stor takk til spesialitetskomiteen med av-
troppende leder Tom Glomsaker i spissen, samt gamle og nye styrer i NKF og FUNK.
Vi vil i år trekke frem én person som har hatt et enormt pågangsmot og arbeidskapasitet i disse sakene. Uten ham er det vanskelig å si hvor utdanningen og det kirurgiske samholdet hadde vært. I dag består fortsatt NKF som paraplyforening og det kirurgiske samholdet er sterkt. Høstmøtet er større enn noen gang. Generell kirurgi er en egen hovedspesialitet og mange gir uttrykk for at de ønsker å bli generell-kirurger. Legeforeningen har i mye større grad sett viktigheten av å ha samlede kirurgiske og medisinske miljøer. Det er prosesser i gang rundt parallelle løp og dobbelt spesialisering. Vi har fortsatt mange utfordringer foran oss. Men i slike prosesser er det viktig å fokusere på hva vi har oppnådd og mye av det er takket være årets vinner av FUNKs ærespris: John Christian Glent.
Karina Dyb Zwart og Ragnhild Tveit Hhv. av- og påtroppende leder i FUNK På vegne av styret i FUNK

Suturmaskiner fra Panther Healthcare


• Panther Healthcare
• Verdens 3 største leverandør av suturmaskiner
• Innovativt

• Kostnadseffektivt
• Pålitelig

• Benyttes i over 60 land Telefon 55987700 Info@kebomed.no Midttunhaugen17




Kontakt Kebomed for mer informasjon.

BRYNJULF YSTGAARD NYTT ÆRESMEDLEM I NKF
Under NKF Årsmøte og senere Kirurgmiddagen ble Brynjulf Ystgaard utnevnt til nytt æresmedlem i Norsk Kirurgisk Forening. Æresmedlemskap i NKF er en mulighet NKF har for å hedre en kollega som gjennom sitt virke har gjort en helt spesiell innsats. Som det står i vedtektene:
§ 5 ÆRESMEDLEMMER

Til æresmedlem kan årsmøtet velge enhver som har gjort en særlig fortjenstfull innsats for kirurgien eller for Norsk kirurgisk forening og som foreningen vil hedre i særlig grad.
Brynjulf Ystgaard ble født julaften 1951. Etter Strinda gymnas i Trondheim startet han på medisinstudiet i Bergen i 1971. Etter turnustjenste og førstegangstjeneste var
han en kort periode innom patologi og allmennpraksis før han startet sin kirurgiske spesialisering ved Kristiansund Sykehus. Ved Kristiansund Sykehus ble forskningsinteressen unnfanget og skulle følge ham videre resten av karrieren. Gruppe 1 tjeneste ble gjennomført ved UNN og St. Olav og han var ferdig spesialist i generellkirurgi i 1991. Som assistentlege, og senere Overlege ved St. Olav var han med å innføre laparoskopisk kirurgi Norge etter hvert i tett samarbeid med Nasjonal Kompetansetjeneste for Avansert Laparoskopisk Kirurgi. Klinisk fattet han tidlig interesse for kirurgisk behandling av gastrointestinal-kreft, spesielt laparoskopisk. Han har vært en pioner innen medisinsk teknologi og var president for «Society for Medical Innovation and Therapy» (SMIT) mellom 2009 og 2010.
Opptatt av legers arbeidsforhold og rettigheter har han vært tillitsvalgt for både YLF og OF, og senere hatt en flere verv i Legeforeningen både lokalt og nasjonalt. Han var fra 2012-2016 leder for Norsk Forening for Gastroenterologiskkirurgi og styremedlem i Norsk Kirurgisk Forening.
Med sine 33 år ved St. Olavs hospital har han i perioder besittet en rekke stillinger som bla Avdelingsoverlege ved kirurgisk avdeling, medisinsk direktør og leder av prosjektet «Nye St. Olav», men alltid vendt tilbake til klinikken og sitt virke som kirurg. Som avdelingsoverlege ved kirurgisk avdeling var han spesielt engasjert i kvalitet på kirurgisk behandling og forebygging av komplikasjoner. Han gikk av med pensjon som Overlege og gastrokirurg ved St Olav i 2019.
Hans forskningsinteresse ble unnfanget da han var student ved University of California San Francisco hvor han forsket på Chagas-sykdom både i laboratoriet og med felt-arbeid i Mexico. Hans kliniske forskning senere har vært innen flere felt, men hovedsakelig innen gastro og thoraxkirurgi. Siden 1988, og fortsatt, har han undervist medisinstudenter og LiS ved NTNU og UiT. I tillegg underviser han leger og sykepleiere i Røde Kors sin responsenhet i samarbeid med Utenriksdepartementet. Han er gjesteforeleser ved Kings College i London.
Som kirurg har han i over 40 år hatt et enormt humanitært engasjement, mye i samarbeid med Røde Kors. Han reiste ut som kirurg første gang i 1990 til Pakistan og Afghanistan. I tillegg til å bidra som kirurg har han ledet koordinering og etablering av humanitære bidrag i Rwanda, Sudan, Kenya, India, Gaza, Haiti, Indonesia, Mocambique og Libya. For å nevne noe. Med Forsvaret jobbet han som kirurg under den første gulf-krigen i 1991 og senere som kirurg på beredskap for Forsvarets Feltsykehus fra 1993-2001.
Helt siden hans studenttid i San Francisco og forskning i Mexico har han hett et brennende engasjement for medisinsk kompetanse i utviklingsland. Sammen med Håkon Bolkan grunnla han CapaCare som senere har etablert organisasjoner i Nederland, Sierra Leone og Liberia og har siden oppstarten sendt ut over 300 spesialister. Disse bidrar sammen med lokalt stedlig ansatte med kirurgisk opplæring i Vest-Afrika, både til kirurgiske legeassistenter og til de nasjonal spesialiserings-løpene. Han er aktiv som instruktør og styremedlem i CapaCare Internasjonal som koordinerer aktiviteten mellom alle prosjektene.
Han er utnevnt til Ridder 1. klasse av Den Kongelige Norske St. Olavs Orden for hans innsats innen medisin og humanitært arbeid. Han er også tildelt Krigsmedaljen i tillegg til flere andre internasjonale medaljer for sin innsats.
I både nominasjonen, og i begrunnelsen til Norsk Kirurgisk Forening, trekkes særskilt frem hans enorme humanitære engasjement. Men det vektlegges også betydelig hans engasjement nasjonalt både faglig og organisatorisk for å fremme og utvikle den kirurgiske behandling.

Det var derfor med ydmykhet og stor glede at Norsk Kirurgisk Forening utnevnte Brynjulf Ystgaard til æresmedlem i NKF for sitt ekstraordinære bidrag til utvikling av kirurgien som fag og helsetjeneste både i Norge og internasjonalt over mange tiår.
Takk og gratulerer!
På vegne av NKF
John Christian Glent


International speakers:















