PRESENTE Y FUTURO DE LA APNEA OBSTRUCTIVA DEL SUEÑO

 Patrocinado por
Cordinador Dr. Miguel Ángel Martínez García
Patrocinado por
Cordinador Dr. Miguel Ángel Martínez García


 Patrocinado por
Cordinador Dr. Miguel Ángel Martínez García
Patrocinado por
Cordinador Dr. Miguel Ángel Martínez García
Patrocinado por

ISBN 978-84-124841-4-4
Editado y coordinado por RESPIRA-FUNDACIÓN ESPAÑOLA DEL PULMÓN-SEPAR. Reservados todos los derechos. Ninguna parte de esta publicación puede ser reproducida ni transmitida en ninguna forma o medio alguno, electrónico o mecánico, incluyendo las fotocopias, grabaciones o cualquier sistema de recuperación de almacenaje de información, sin el permiso escrito del titular del copyright.
Miguel Ángel Martínez García
Editor jefe de Archivos de Bronconeumología
Mikel Azpiazu Blocona
Unidad Funcional de Sueño, OSI Araba. Vitoria-Gasteiz
María del Pilar Bañuls Polo
Unidad Trastornos Respiratorios del Sueño, Servicio de Neumologia, Hospital Clínic Universitari de València
Thais Beaupertuy Levy Departamento de Neumología, Hospital Universitario y Politécnico La Fe, Valencia
Amina Bekki Servicio de Neumología. Hospital Universitario y Politécnico La fe. Valencia
Carla Blanco Pino Servicio de Neurofisiología y Unidad de Sueño. Hospital Universitario de la Ribera. Valencia
Francisco Campos-Rodríguez
Servicio de Neumología. Hospital Universitario de Valme. Sevilla. Instituto de Biomedicina de Sevilla (IBiS). Sevilla Centro de Investigación Biomédica en Red de Enfermedades Respiratorias (CIBERES). Madrid
Irene Cano Pumarega
Unidad Multidisciplinar de Sueño. S. Neumología. Hospital Ramón y Cajal. IRYCIS. CIBERES. Madrid
María Castillo García
Unidad de Sueño, Servicio de Neumología, Hospital Universitario de Guadalajara, 19002 Guadalajara, España
Carlos Egea Santaolalla
Unidad Funcional de Sueño. OSI Araba. Vitoria Gasteiz Facultad Medicina. Universidad País Vasco
Alberto García Ortega
Departamento de Neumología, Hospital Universitario y Politécnico La Fe, Valencia
Aldara García Sánchez Unidad Multidisciplinar de Sueño. S. Neumología. Hospital Ramón y Cajal. IRYCIS. Madrid
José Daniel Gómez Olivas Servicio de Neumología. Hospital Universitario y Politécnico La fe. Valencia
Mario Henríquez Beltrán
Escuela de Kinesiología, Facultad de Salud, Universidad Santo Tomas, Chile
Francisco Javier Puertas Servicio de Neurofisiología y Unidad de Sueño. Hospital Universitario de la Ribera. Valencia. 2 Facultad de Medicina y Ciencias de la Salud. Universidad Católica de Valencia
Gonzalo Labarca Division de Sleep Medicine, Brigham and Women’s Hospital, Harvard Medical School, Estados Unidos
Eva Mañas Baena Unidad Multidisciplinar de Sueño. S. Neumología. Hospital Ramón y Cajal. IRYCIS. Madrid
José María Marín Hospital Universitario Miguel Servet, IIS Aragón; Departamento de Medicina, Universidad de Zaragoza. Zaragoza, España
Miguel Ángel Martínez García Servicio de Neumología. Hospital Universitario y Politécnico La fe. Valencia. CIBER de enfermedades Respiratorias
Celio Martínez Ramírez Servicio de Neurofisiología y Unidad de Sueño. Hospital Universitario de la Ribera. Valencia
Olga Mediano San Andrés
Unidad de Sueño, Servicio de Neumología, Hospital Universitario de Guadalajara, 19002 Guadalajara, España. Departamento de Medicina, Universidad de Alcalá, Alcalá de Henares, Madrid, España
Departamento de Neumología, Hospital Universitario y Politécnico La Fe, Valencia
Unidad de Sueño, Servicio de Neumología, Hospital Universitario de Guadalajara, 19002 Guadalajara, España
Manuel Sánchez de la Torre
Medicina de Precisión en Enfermedades Crónicas, Hospital Universitari Arnau de Vilanova-Santa Maria, IRB Lleida, Departamento de Enfermería y Fisioterapia, Facultad de Enfermería y Fisioterapia. Universidad de Lleida, Lleida, España. Centro de Investigación Biomédica en Red de Enfermedades Respiratorias (CIBERES), Madrid, España
1. Consenso Internacional de sueño 2021. Nuevos conceptos 08
2. Obesidad y apnea del sueño. ¿Qué nos espera? 25
3. Medición de la hipersomnia. Presente y futuro. 38
4. Fenotipos clínicos en la apnea del sueño 49
5. Más allá del índice de apneas-hipopneas en el diagnóstico de la apnea del sueño 68
6. La tecnología que viene en apnea del sueño. Nuevos dispositivos y telemedicina 82
7. ¿Es la CPAP el futuro tratamiento de la apnea del sueño?. Potenciales alternativas. 96
8. Hipersomnia residual en apnea del sueño. Importancia y manejo. 112
9. Biomarcadores y medicina de medición en apnea del sueño 126
10. De la atención primaria a las Unidades especializadas. Manejo integral de la apnea del sueño. 142
11. ¿Cómo debemos de realizar la investigación futura en apnea del sueño? 155
PRESENTE Y FUTURO DE LA APNEA OBSTRUCTIVA DEL SUEÑO
DOCUMENTO INTERNACIONAL DE CONSENSO (DIC) SOBRE APNEA OBSTRUCTIVA DEL SUEÑO, 2022. NUEVOS CONCEPTOS
Autores
María Castillo García
Pilar Resano Barrio
Olga Mediano San Andrés
El Documento Internacional de Consenso (DIC) sobre Apnea Obstructiva del Sueño (AOS) establece los algoritmos que permiten orientar en el manejo diagnóstico y terapéutico del paciente con esta enfermedad según una revisión actualizada. El grupo de trabajo se formó con 17 sociedades científicas y 56 expertos en esta área de conocimiento, con amplia representación geográfica internacional, además de un metodólogo experto y un documentalista del Centro Cochrane Iberoamericano.
Los Trastornos Respiratorios del Sueño (TRS) abarcan desde la roncopatía simple hasta la AOS, siendo esta última la máxima expresión de los TRS¹. El reciente DIC publicado en 2022² actualiza la nomenclatura propuesta en el anterior documento de 2005³, (SAHS: Síndrome de Apneas Hipoapneas del Sueño) reintroduciendo el término obstruc tiva y diferenciándolo así de la apnea de origen central. Elimina también las palabras hipopnea y síndrome, ya anticuadas, y da a la entidad la categoría de enfermedad por sus importantes consecuencias asociadas. Dado lo anterior, la denominación correcta a día de hoy sería Apnea Obstructiva del Sueño, y sus siglas, AOS.
En el mencionado DIC también se realiza una actualización de la definición de AOS, que se establece si se da cualquiera de las siguientes condiciones (1 o 2):
1. La presencia de un Índice de Apneas Hipopneas (IAH) ≥ 15 eventos respiratorios/ hora, predominantemente obstructivos.
2. La presencia de un IAH ≥ 5/h acompañado de uno o más de los siguientes: excesiva somnolencia durante el día, sueño no reparador, cansancio excesivo y/o deterioro de la calidad de vida relacionada con el sueño, no justificables por otras causas.
Se han realizado distintas definiciones de apneas e hipopneas a lo largo de los años. En 1978, Guilleminault et al4. definieron apnea como un cese completo de la señal respiratoria de al menos 10 segundos de duración. Dicha definición tendría varias limi taciones, como serían no reflejar la presencia o la ausencia de las desaturaciones y/o
arousal (microdespertares) ni tampoco las comorbilidades asociadas. Esta definición se ha mantenido hasta hoy, con la única salvedad de que se permite definir apneas cuando la reducción de la señal respiratoria es >90%. Por lo tanto, hablaremos de apnea obstructiva siempre que exista una ausencia o una reducción >90% de la señal respiratoria de ≥ 10 segundos de duración en presencia de esfuerzo respiratorio. La apnea será central si este esfuerzo está ausente y mixta cuando se produce una com binación de ambos. Habitualmente, comienzan con un componente central y terminan con un componente obstructivo.
En 1979, Block et al5. definieron el concepto de hipopnea como una reducción parcial de la señal respiratoria que cursaba con desaturación. Se incluyó la relevancia de la desaturación, ya que se estimó una menor importancia de las mismas respecto a las apneas. Sin embargo, se ha comprobado que las hipopneas tienen un efecto negativo sobre la salud equiparable a las apneas6. Aunque la definición de hipopnea es contro vertida, y ha sufrido variaciones a lo largo del tiempo, el actual DIC recomienda la defi nición siguiente: reducción de la señal respiratoria (aproximadamente >30% y <90%) ≥ 10 segundos de duración que cursa con una disminución de la saturación ≥3% y/o un microdespertar en el electroencefalograma. Para la clasificación de la hipopnea, que implica una mayor dificultad, la Asociación Americana de Medicina del Sueño (AASM)7 considera hipopnea obstructiva si cumple alguno de los siguientes criterios: aparece ronquido durante el evento, existe movimiento paradójico toraco-abdominal durante el evento y no previamente y/o existe un aplanamiento inspiratorio de la onda de presión respecto a la respiración.
Los esfuerzos respiratorios asociados a microdespertares (ERAM) se definieron hace años como periodos de más de 10 segundos, sin una reducción de la amplitud de flujo marcada y que terminaban en microdespertares, sin cumplir con los criterios de hipop nea8. En la actualidad, el DIC propone identificar este tipo de eventos como hipopneas y no como ERAM.
El IAH representa el número de apneas más hipopneas dividido por las horas de sueño, principal parámetro para la clasificación de la gravedad de la AOS. La AASM clasifica la gravedad de la AOS únicamente basándose en el IAH, como se indica a continuación:
AOS leve: ≥ 5 y <15 eventos/hora
AOS moderada: ≥ 15 y < 30 eventos/hora
AOS grave: ≥ 30 eventos /hora.
Sin embargo, esta clasificación basada fundamentalmente en el IAH tiene sus limitacio nes, ya que no pone de manifiesto la gran heterogeneidad de la enfermedad ni predice
sus efectos a largo plazo9. A pesar de que a día de hoy no existe aún una escala vali dada, el DIC recomienda a los especialistas tener en cuenta los siguientes parámetros a la hora de hablar de la gravedad de la AOS:
El IAH.
Tiempo acumulado con saturación por debajo del 90% (CT 90%). Somnolencia diurna.
Grado de obesidad medido por el índice de masa corporal (IMC).
Comorbilidades que se han relacionado con la AOS (HTA, especialmente si es resistente al tratamiento o tiene un patrón non-dipper, diabetes mellitus tipo 2, dis lipemia, enfermedad coronaria, ictus, insuficiencia cardíaca o fibrilación auricular).
Por lo tanto, para clasificar la gravedad de la AOS se intenta abordar varios aspectos a tener en cuenta, como el IAH, en el que se incluye como novedad el término de muy grave (IAH >50/h), el CT 90%, la escala de somnolencia Epworth, según la cual una puntuación mayor de 14 nos clasificaría la enfermedad como grave o muy grave, así como el IMC y la relevancia de las comorbilidades asociadas a la AOS (Figura 1). Queda demostrado así que para definir de forma más concreta la enfermedad necesitamos, no solo el IAH, sino también otras variables que nos ayuden a predecir la respuesta al tratamiento y el pronóstico de la enfermedad.
Debido a la importante sobrecarga asistencial, así como a la limitación de medios tanto en el ámbito de la atención primaria como en las unidades de sueño, es preciso dis poner de instrumentos y estrategias diagnósticas que ayuden al clínico a mejorar la sospecha clínica de la AOS y a establecer su diagnóstico de forma eficaz.
La excesiva somnolencia diurna (ESD) es la principal expresión de muchos trastornos del sueño, y puede formar parte del espectro clínico de muchas enfermedades médicas o psiquiátricas no relacionadas con alteraciones del sueño, o estar en relación con la ingesta de fármacos¹0. Con el fin de evaluar la ESD, disponemos de herramientas que miden aspectos subjetivos de la somnolencia (los autocuestionarios) o rasgos objetivos de la misma. Algunas de las escalas más ampliamente difundidas son la escala de Standford, la de Karolinska, la escala analógica visual o la escala de somnolencia de Epworth (ESE), siendo este último el cuestionario más extendido y utilizado para valorar la somnolencia subjetiva dentro del ámbito de los trastornos respiratorios del sueño¹¹. Es un cuestionario autoadministrado en el que el sujeto debe responder ante cuáles de las situaciones presentadas se sentiría más somnoliento. La suma de puntuaciones
oscila entre 0 y 24. Se acepta como punto de corte para somnolencia una puntuación superior a 10. Existe una versión traducida y validada para la población española¹².
Las herramientas de cribado son útiles para identificar con rapidez a los individuos que pueden estar en riesgo de padecer una AOS. Este tipo de cuestionarios tienen su mayor utilidad para establecer prioridades a la hora de realizar una prueba diagnóstica, ya que no están exentos de falsos positivos y negativos y no sirven por sí solos para confirmar el diagnóstico. Entre ellos se encuentran el cuestionario de Berlín, el cuestionario OSA50, el cuestionario NoSAS y el cuestionario STOP-BANG. Este último es un test muy sencillo e incluye cuatro medidas subjetivas (STOP, por el acrónimo en inglés de roncar, cansancio, apnea observada y presión arterial alta) y cuatro elementos demográficos (BANG, por el acrónimo en inglés de IMC, edad, circunferencia delcuello y sexo) y es el recomendado por el DIC.
El método de referencia para establecer el diagnóstico de la AOS es la polisomnografía convencional (PSG). Se han desarrollado métodos diagnósticos alternativos que, en base a su complejidad, se clasifican en 4 niveles: el tipo 1 es la PSG convencional vigilada por un técnico en el laboratorio de sueño que incluye un mínimo de 7 canales. El tipo 2 es la PSG realizada con un equipo portátil y no vigilada por un técnico. El tipo 3 corresponde a la poligrafía cardiorrespiratoria (PR), donde se registra la respiración, esfuerzo toracoabdominal, pulsioximetría y frecuencia cardíaca (con un total de 4-7 canales), y el tipo 4 corresponde a estudios supersimplificados con aparatos de 1 o 2 canales (oximetría y/o respiración). A continuación, se describen brevemente las carac terísticas básicas de cada una de las pruebas.
La PSG convencional es el método de referencia para establecer el diagnóstico de la AOS. Consiste en el registro continuo de variables cardiorrespiratorias y neurofisio lógicas, con el fin de analizar el tiempo y la estructura del sueño, identificar y cuanti ficar las alteraciones respiratorias (obstructivas o centrales), establecer su gravedad y diagnosticar otros trastornos. Las señales habitualmente recogidas en el registro son: electroencefalograma (EEG), electrooculograma (EOG), electromiograma (EMG) mentoniano y/o tibial anterior, flujo respiratorio, movimientos respiratorios torácicos y abdominales, saturación de oxígeno, posición y electrocardiograma (ECG).
La señal del EEG es lo más característico de la PSG con respecto a otros estudios más simplificados, ya que nos permite identificar la actividad cerebral de base (sueño y vigilia) así como realizar una correcta clasificación de los diferentes estadios de sueño mediante sus cambios en la amplitud y la frecuencia. La AASM establece un montaje con un mínimo de 3 canales para la estadificación del sueño, en concreto
derivaciones frontal, central y occipital con referencia a la mastoides contralateral7 La PSG deberá realizarse en horario nocturno o en el habitual de sueño del sujeto, en un laboratorio de sueño, con un registro no menor de 6,5 horas y que incluya por lo menos 180 minutos de sueño. El análisis del registro de la PSG debe hacerse siempre manualmente.
La PR es un sistema plenamente aceptado según las diferentes normativas para el abordaje diagnóstico de la AOS² ³. La PR registra al menos cuatro tipos de señales que incluyen el flujo, el esfuerzo respiratorio, la saturación de oxígeno y una variable cardíaca, que en general es la frecuencia cardíaca. Tiene una serie de limitaciones, entre ellas, no evaluar las variables neurofisiológicas, como son subestimar la grave dad de la AOS, o no diagnosticar trastornos no respiratorios del sueño. Tiene la gran ventaja de que, al tratarse de equipos portátiles, puede realizarse fuera del ámbito hospitalario, con el consecuente ahorro económico¹³ ¹4. A fecha de hoy, y según las diferentes sociedades, para el manejo de pacientes con probabilidad intermedia o alta de padecer AOS se considera que la PR es un método aceptado para confirmar el diagnóstico, entendiendo como tal aquellos pacientes que presentan ESD y al menos dos de los siguientes criterios: ronquido fuerte habitual; apneas presenciadas; respiración dificultosa, ahogos o hipertensión arterial diagnosticada² ¹4 ¹6. La utili zación de la PR para pacientes con baja sospecha de AOS o con sospecha de otros trastornos del sueño no está validada.
Se dispone de equipos de monitorización portátiles para el manejo de la AOS, que constan de 1 o de 2 señales de registro, que suelen ser la saturación de oxígeno y/o el flujo aéreo. Estos sistemas tienen su mayor utilidad para agilizar el diagnóstico en ámbitos diferentes a la atención especializada fundamentalmente en pacientes con alta probabilidad de AOS.
Basándonos en la reciente publicación del DIC², la AOS debería ser manejada por diferentes niveles asistenciales, lo que requeriría dos algoritmos diagnósticos, uno a nivel especializado (Figura 2) y otro a nivel de atención primaria (Figura 3). El algoritmo diagnóstico en atención primaria subraya el relevante papel de los métodos supersimplificados en los pacientes con alta probabilidad de AOS (Epworth ≥ 12 y al menos 2 de los siguientes 3 criterios: ronquido, apneas presenciadas e hipertensión arterial). Permiten la implicación del médico de familia en el proceso diagnóstico de la AOS, como indica la figura 3. La principal novedad del algoritmo diagnóstico en el ámbito de la unidad de sueño especializada es establecer la presencia de una probabilidad intermedia-alta de AOS (Epworth <10, y 2 de los siguientes 3 criterios:
ronquido fuerte habitual; apneas presenciadas; respiración dificultosa o ahogos o bien hipertensión arterial diagnosticada). En este caso sí sería posible la utilización de la PR como herramienta diagnóstica, teniendo en cuenta que un resultado negativo obliga a considerar la realización de una PSG. En los casos de baja probabilidad, si se ha realizado una valoración experta se puede prescindir del estudio de sueño y, si es necesario, establecer un seguimiento. Se mantiene la necesidad de utilizar PSG en aquellos casos de enfermedad cardio-pulmonar inestable, sospecha de otro trastorno de sueño diferente de la AOS y presencia de enfermedad psiquiátrica, ansiedad o depresión que requiera la toma de medicación (figura 2).
A lo largo de este apartado desarrollaremos los tipos de tratamiento de la AOS. A pesar del abanico de posibilidades, es importante recalcar que estos no son excluyentes y que es necesario un abordaje multidisciplinar¹7. Insistimos en la importancia, como se ha desarrollado anteriormente, de la evaluación diagnóstica con un estudio de sueño previo al planteamiento de cualquiera de los tratamientos que se desarrollarán a con tinuación.
Estarán indicadas en todos los pacientes con AOS, independientemente del resto de tratamientos (Figura 4)
Obesidad: es recomendable el tratamiento tanto del sobrepeso como de la obe sidad de inicio, modificando el estilo de vida y realizando estrategias de tipo con ductual¹8. Si estas estrategias fueran insuficientes o la obesidad muy relevante, se debe plantear la necesidad de añadir tratamiento farmacológico o valorar la cirugía bariátrica.
Otros: cualquier patología potencialmente reversible que pueda contribuir a la aparición de la AOS debe ser tratada, como, por ejemplo, hipotiroidismo, reflujo gastroesofágico, hipertertrofia amigdalar o alteraciones dentofaciales graves.
Una vez valoradas las causas reversibles de la AOS, la CPAP sigue siendo el tratamiento de elección. Las indicaciones del uso de CPAP se desarrollan a continuación según se representa en el algoritmo de manejo terapéutico (Figura 5)²:
1. AOS moderada-grave (IAH≥15/h) con somnolencia diurna excesiva (Epworth >10), alteraciones de la calidad de vida relacionadas con el sueño y/o HTA.
2. En pacientes con IAH ≥15/h sin los criterios previamente mencionados, IAH entre 5 y 15/h o que rechacen el tratamiento, se valorarán otras alternativas de manera individual (dispositivos de avance mandibular [DAM], tratamiento posicional, ciru gía, etc.), según se explica más adelante.
3. Para adultos que no cumplan los 3 criterios expuestos en el punto 1, no existe evidencia para recomendar el uso de CPAP de manera sistemática. Para estos, se realizará valoración individualizada de tratamiento conservador, monitorización de síntomas o una prueba terapéutica con CPAP.
4. En pacientes con AOS que presenten un IAH <15/h con sintomatología importante o riesgo cardiovascular, se puede considerar la posibilidad de realizar un trata miento de prueba con CPAP. La evidencia, en la actualidad, refiere que la CPAP podría tener un mayor papel para la prevención de eventos cerebrovasculares, más que cardiovasculares.
5. Cuando fracase la CPAP, deben plantearse otros tratamientos alternativos.
Para alcanzar los objetivos del tratamiento, es importante ajustar la presión de la CPAP y cumplir la misma. Para ello, el ajuste de presión se realizaría de manera general por auto-CPAP¹9, que consigue un manejo de la AOS similar con respecto a la titulación con PSG. Esta se reservará para los casos de pacientes con enfermedad cardiopulmonar grave o inestable (insuficiencia cardiaca o EPOC), trastornos respiratorios del sueño complejos (apneas centrales, síndrome de obesidad hipoventilación…) o aquellos en los que no se haya podido realizar la titulación con mecanismos simplificados. El ajuste de presión con fórmula solo debe utilizarse de forma temporal hasta realizar un método de titulación definitivo.
En cuanto al cumplimiento, su uso durante los tres primeros meses mostrará una visión de la adherencia a largo plazo²0. Existe evidencia en cuanto a la relación dosis-res puesta, entre las horas de uso y la respuesta terapéutica, sobre todo en el ámbito neu rocognitivo y cardiovascular y en la percepción de la calidad de vida. Dado lo anterior, se recomienda utilizar el dispositivo al menos 4 horas por noche durante al menos el 70% de las noches.
Con el desarrollo de nuevas tecnologías médicas, el abanico de opciones terapéuticas en el campo de la cirugía de los TRS se ha ampliado de manera significativa²¹. Hasta ahora, la cirugía se ha clasificado, según los criterios de Stanford, en cirugía de fase I y cirugía fase II. La fase I engloba las partes blandas de la vía aérea superior (VAS), y la fase II, el marco óseo. El tratamiento comenzaba con la fase I y, si esta fracasaba, se pasaba a la fase II. En el momento actual, la medicina es más personalizada, por lo que se puede ofrecer cirugías orofaríngeas y palatinas según la clínica y los hallazgos de la endoscopia mediante sedación inducida o cirugía esquelética como tratamiento inicial en aquellos pacientes con IAH >65/h y/o colapso concéntrico y/o alteraciones dentales graves.
Los DAM son dispositivos intraorales que se utilizan durante el sueño. Permiten estabi lizar y mantener la mandíbula adelantada, lo que aumenta el área de la VAS y evita su colapso. Para el uso del DAM, es necesaria una exploración por parte de un odontólogo experto. Se recomiendan los dispositivos hechos a medida y graduables. Las indicacio nes del DAM son las siguientes²:
1. Pacientes con AOS e indicación de tratamiento con CPAP pero imposibilidad de adaptarse a la misma.
2. Pacientes sin indicación de CPAP pero que presentan sintomatología menor o ronquido molesto.
Terapia posicional: se denomina AOS posicional al incremento del IAH en decúbito su pino de al menos el doble que el IAH en decúbito no-supino. En la actualidad, existen tres dispositivos aprobados²².
Tratamiento farmacológico: existe escasa evidencia del efecto farmacológico sobre la AOS, lo que no hace recomendable su uso para esta patología a día de hoy²³.
Terapia miofuncional: realizar ejercicio sobre los músculos de la VAS podría estar indicado en pacientes no obesos con AOS leve-moderado, como tratamiento con comitante a la CPAP o complementario al DAM²4 .
BIPAP: la terapia de presión binivel (BiPAP) es un soporte ventilatorio que pro porciona una presión inspiratoria mayor que la espiratoria. No ha demostrado ser mejor que la CPAP en cuanto a la reducción del IAH, la somnolencia diurna o los efectos secundarios, excepto en los pacientes con dificultad para el cumplimien to²5. Se recomienda cuando no se tolere CPAP por presiones muy altas o para pacientes que necesitan presiones >15 cm H2O².
EPAP nasal: válvulas de resistencia unidireccional, alta durante la espiración y muy baja durante la inspiración²6. Indicada para pacientes muy concretos con AOS leve-moderada².
Terapia de presión oral: falta de evidencia para recomendar su uso²7 .
Documento Internacional de Consenso (DIC); Apnea Obstructiva del Sueño (AOS); Trastornos Respiratorios del Sueño (TRS); Índice de Apneas Hipopneas (IAH); Asociación Americana de Medicina de Sueño (AASM); Esfuerzos Respi ratorios Asociados a Microdespertares (ERAM); Tiempo acumulado con satu ración por debajo del 90% (CT90%); Índice de Masa Corporal (IMC); Excesiva Somnolencia durante el Día (ESD); Escala de Somnolencia de Epworth (ESE); Polisomnografía (PSG); Poligrafía cardiorrespiratoria (PR); Electroencefalogra ma (EEG); Electrooculograma (EOG); Electromiograma (EMG); Electrocardiogra ma (ECG); Dispositivo de Avance Mandibular (DAM); Vía Aérea Superior (VAS).
1. Young T, Palta M, Dempsey J, Skatrud J, Weber S, Badr S. The occurrence of Sleep disorders breathing among middle aged adults. N Engl J Med. 1993;328:1230-1236. Doi: 10.1056/ NEJM199304293281704.
2. Mediano O, González Mangado N, Montserrat JM, Alonso-Álvarez ML, Almendros I, Alon so- Fernández A, et al. Documento internacional de consenso sobre apnea obstructiva del sueño. International Consensus Documenton Obstructive Sleep Apnea. Arch Bronconeumol. 2021;:S0300-2896 (21)00115-0. Doi: 10.1016/j.arbres. 2021.03.017.
3. Durán-Cantolla J, Puertas-Cuesta FJ, Pin-Arboledas G, Santa María Cano J. Consenso Na cional sobre el síndrome de las apneas-hipopneas del sueño. ArchBronconeumol. 2005;41 (supl4):1-110. Doi: 10.1016/S0210-5705(09)71003-9.
4. Guilleminault C, Tilkian A, Dement WC. The sleep apnea syndromes. Annu Rev Med. 1976;27;465-85. Doi: 10.1146/annurev.me.27.020176.002341.
5. Block AJ, Boysen PG, Wyne JW, Hunt LA. Sleep apnea, hypopnea and oxygen des aturation in normal subjects. N Engl J Med. 1979;300:513-517. Doi: 10.1056/ NEJM197903083001001.
6. Gould GA, Whyte KF, Rhind GB, Airlie MA, Catterall JR, Shapiro CM, et al. The sleep hypop nea syndrome. Am Rev Respir Dis. 1988;137:895-8. Doi: 10.1164 ajrccm/137.4.895.
7. Berry RB, Quan SF, Abreu AR, Bibbs ML, DelRosso L, Harding SM, et al., for the American Academy of Sleep Medicine. The AASM Manual of the Scoring of Sleep and Associated Events: Rules, Terminology and Technical Specifications. Darien, IL: American Academy of Sleep Medicine; 2020. Version 2.6.
8. Mansukhani MP, Kolla BP, Wang Z, Morgenthaler TI. Effect of varying definitions of hypopnea on the diagnosis and clinical outcomes of sleep disordered breathing. A systematic review and meta-analysis. J Clin Sleep Med. 2019;15(5):687-696. Doi: 10.5664/jcsm.7750.
9. Martínez-García MA, Campos-Rodríguez F, Barbé F, Gozal D, Agustí A. Precision medicine in obstructive sleep apnoea. Lancet Respir Med. 2019;7(5):456-464. Doi: 10.1016/S22132600(19)30044-X.
10. Monderer R, Ahmed IM, Thorpy M. Evaluation of the sleepy patient: differential diagnosis. Sleep Med Clin. 2017;12(3):301-312. Doi: 10.1016/j.jsmc.2017.03.006.
11. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep. 1991;14(6):540-545. Doi: 10.1093/sleep/14.6.540.
12. Chiner E, Arriero JM, Signes-Costa J, Marco J, Fuentes I. Validation of the Spanish version of the Epworth Sleepiness Scale in patients with a sleep apnea syndrome. Arch Bronconeumol. 1999;35(9):422-427. Doi: 10.1016/S0300-2896(15)30037-5.
13. 13.Benjafield AV, Ayas NT, Eastwood PR, Heinzer R, Ip M, Morrell MJ, et al. Estim tion of the global prevalence and burden of obstructive sleep apnoea: A literature-based analysis. Lancet Respir Med. 2019;7:687-798. Doi: 10.1016/S2213-2600(19)30198-
14. Corral J, Sánchez-Quiroga MA, Carmona-Bernal C, Sánchez-Armengol A, Sánchez de la Torre A, Durán-Cantolla J, et al. Conventional Polysomnography Is Not Necessary for the Management of Most Patients with Suspected Obstructive Sleep Apnea. Noninferiority,
Randomized Controlled Trial. Am J Respir Crit Care Med. 2017;196(9):1181-1190. Doi: 10.1164/rccm.201612-2497OC.
15. Kapur VK, Auckley DH, Chowdhuri S, Kuhlmann DC, Mehra R, Ramar K, et al. Clinical practi ce guideline for diagnostic testing for adult obstructive sleep apnea: an American Academy of Sleep Medicine clinical practice guideline. SJ Clin Sleep Med. 2017;13(3):479- 504. Doi: 10.5664/jcsm.6506.
16. Masa JF, Corral J, Pereira R, Duran-Cantolla J, Cabello M, Hernández-Blasco L, et al. Effec tiveness of home respiratory polygraphy for the diagnosis of sleep apnoea and hypopnoea syndrome. Thorax. 2011; 66(7):567-573. Doi: 10.1136/thx.2010.152272.
17. Duran J, Esnaola S, Rubio R, Iztueta A. Obstructive sleep apnea-hypopnea and related cli nical features in a population-based sample of subjects aged 30 to 70 yr. Am J Respir Crit Care Med. 2001;163:685-689. Doi: 10.1164/ajrccm.163.3.2005065.
18. Hudgel DW, Patel SR, Ahasic AM, Bartlett SJ, Bessesen DH, Coaker MA, et al. The role of weight management in the treatment of adult obstructive sleep apnea. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2018; 198):e70-e87. Doi: 10.1164/rccm.201807-1326ST.
19. Berry RB, Sriram P. Auto-adjusting Positive Airway Pressure Treatment for Sleep Apnea Diagnosed by Home Sleep Testing. J Clin Sleep Medicine. 2014;10(12). Doi: 10.5664/ jcsm.4272.
20. Budhiraja R, Parthasarathy S, Drake CL, Roth T, Sharief I, Budhiraja P, et al. Early CPAP use identifies subsequent adherence to CPAP therapy. Sleep. 2007;30:320-324.
21. Liu SY, Awad M, Riley R, Capasso R. The role of the revised Stanford protocol in today’s precision medicine. Sleep Med Clin. 2019;14:99. Doi:10.1016/j.jsmc.2018.10.013.
22. Hidalgo Armas L, Turino C, Cordero-Guevara J, Manjón JL, Durán-Carro J, Barbé F, et al; Spa nish Sleep Network. A new postural device for the treatment of positional obstructive sleep apnea. A pilot study. Respir Med. 2019;151:111-117. Doi: 10.1016/j.rmed.2019.02.005.
23. Taranto-Montemurro L, Messineo L, Wellman A. Targeting endotypic traits with medications for the pharmacological treatment of obstructive sleep apnea. A re-view of the current lite rature. J Clin Med. 2019;8:1846. Doi: 10.3390/jcm8111846.
24. De Felício CM, Da Silva Dias FV, Trawitzki LVV. Obstructive sleep apnea: focus on myofunc tional therapy. Nat Sci Sleep. 2018;10:271-286. Doi: 10.2147/NSS.S141132.
25. Patil SP, Ayappa IA, Caples SM, Kimoff RJ, Patel SR, Harrod CG. Treatment of Adult Obs tructive Sleep Apnea with Positive Airway Pressure: An American Academy of Sleep Me dicine Clinical Practice Guideline. J Clin Sleep Med. 2019;15(2):335-343. Doi: 10.5664/ jcsm.7640.
26. Riaz M, Certal V, Nigam G, Abdullatif J, Zaghi S, Kushida CA, et al. Nasal expiratory positive airway pressure devices (Provent) for OSA: a systematic review and metaanalysis. Sleep Disord. 2015;734798. Doi: 10.1155/2015/734798.
27. Colrain IM, Black J, Siegel LC, Bogan RK, Becker PM, Farid-Moayer M, et al. A multicenter evaluation of oral pressure therapy for the treatment of obstructive sleep apnea. Sleep Med. 2013;14:830-837. Doi: 10.1016/j.sleep.2013.05.009.Szklo M, Nieto Nafria JM. Epidemio logia Intermedia: Conceptos y aplicaciones. 1ª ed. Madrid, Díaz Santos, 2003.
Figura 1. Gravedad de la AOS siguiendo una serie de parámetros según reco mienda el Documento Internacional de Consenso (DIC)
CI: cardiopatía isquémica; CT 90%: tiempo acumulado con saturación de oxihemoglobi na por debajo del 90%; CV: enfermedad cardiovascular o cerebrovacular; DLP: dislipi demia; DM2: diabetes mellitus tipo 2; ESE: escala de somnolencia de Epworth; EVC: en fermedad vascular cerebral; FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial; IAH: índice de apnea-hipopnea; ICC: insuficiencia cardíaca congestiva; IMC: índice de masa corporal.

Figura 2 .Algoritmo para el diagnóstico de pacientes con sospecha de apnea obstructiva del sueño (AOS) a nivel especializado²
ESD: excesiva somnolencia diurna; IAH: índice de apnea-hipopnea; PR: poligrafía respi ratoria; PSG: polisomnografía. *Se define como intermedia-alta probabilidad para AOS por la presencia de ESD (Epworth >10) y 2 de los siguientes 3 criterios: ronquido intenso habitual, despertares asfícticos o apneas observadas e hipertensión arterial.

Figura 3. Algoritmo diagnóstico en pacientes con sospecha de apnea obstructiva del sueño (AOS) en atención primaria² en coordinación con el laboratorio de sueño
ESD: excesiva somnolencia diurna; IAH: índice de apneas-hipopneas; IMC: índice de masa corporal. *Se define alta probabilidad de AOS por la presencia de ESD con Epworth ≥ 12 y 2 de los siguientes 3 criterios: ronquido alto habitual, despertares asfícticos o apneas observadas e hipertensión arterial. **En estos casos, puede ofrecerse la opción de un análisis manual del registro por parte del laboratorio de sueño coordinador para un diagnóstico más preciso.

Figura 4. Medidas higienico-dietéticas recomendadas a todos los pacientes con apnea obstructiva del sueño, tengan o no indicación de CPAP

CPAP: presión positiva continua en las vías respiratorias; DAM: dispositivos de avance mandibular; IAH: índice de apnea-hipopnea; IMC: índice de masa corporal; ORL: otorri nolaringología.

OBESIDAD Y APNEA DEL SUEÑO. ¿QUÉ NOS ESPERA?
Grace Oscullo Yepez
Thais Beaupertuy Levy
Alberto García Ortega
La prevalencia de la apnea obstructiva del sueño está aumentando en todo el mundo debido a la actual epidemia de obesidad, con importantes implicaciones socioeconómi cas y en la morbimortalidad. Las proyecciones epidemiológicas apuntan a que este in cremento de la prevalencia seguirá en los próximos años, por lo que debe considerarse un tema de preocupación a nivel mundial.
Numerosos estudios han demostrado que la obesidad es el factor de riesgo modificable más importante para el desarrollo de la apnea obstructiva del sueño, y además han evidenciado una relación directamente proporcional entre el índice de masa corporal y la prevalencia y gravedad de esta enfermedad. La obesidad ocasiona cambios anató micos y neurohormonales que favorecen la colapsabilidad de la vía aérea superior y su control neuromuscular, lo que contribuye a la génesis de la apnea obstructiva del sueño. La pérdida de peso como terapia complementaria a cualquier terapia nocturna es fun damental. Sin embargo, precisa un abordaje multifactorial integral con estrategias de tipo conductual, cambios del estilo de vida y evaluación en unidades especializadas en el manejo de fármacos con indicación en la obesidad o tratamiento quirúrgico.
La obesidad es una patología crónica producida por la acumulación anormal o excesiva de grasa corporal. Fue incluida por la Organización Mundial de la Salud (OMS) en la cla sificación internacional de enfermedades en 1949, y desde 1998 es considerada una epidemia mundial dado su relevante impacto en la calidad de vida, su morbimortalidad y el gasto sanitario que provoca.
A finales de la década de 1990, la OMS adoptó el índice de masa corporal (IMC) como método para evaluar y definir puntos de corte para el sobrepeso y la obesidad. Este índice es el cociente resultante de dividir el peso en kilogramos entre el cuadrado de la altura en metros. Sin embargo, presenta limitaciones a la hora de valorar pacientes con porcentajes extremos de masa muscular, como, por ejemplo, ancianos y deportistas. La obesidad se define por un índice de masa corporal (IMC) mayor de 30 kg/m². (Tabla I)
Algunos estudios epidemiológicos evidencian un incremento de la incidencia de la obe sidad poblacional, siendo cada vez más evidente en individuos más jóvenes. En países en vías de desarrollo, esta patología incluso supera los indicadores de desnutrición y malnutrición. (Figura 1)
Según datos estadísticos recientes (Figura 2), en España más de la mitad de adultos tiene exceso de peso (sobrepeso 37% y obesidad 16%), siendo esta patología más frecuente en hombres.
La obesidad es un proceso multifactorial relacionado con un desequilibrio entre la in gesta y el consumo energético. A menudo, este desequilibrio está relacionado con una inapropiada conducta alimentaria, el sedentarismo y algunas comorbilidades, así como trastornos físicos o psicológicos. La obesidad tiene un impacto creciente en la mor bimortalidad, y así favorece el desarrollo de hipertensión arterial, diabetes mellitus, dislipidemias, trastornos articulares, insuficiencia renal, entre otros. Todo ello implica un importante consumo de recursos sanitarios.
La Apnea Obstructiva del Sueño (AOS) es uno de los trastornos del sueño más frecuen tes. Su prevalencia en la población general se ha incrementado en los últimos años y oscila, según los estudios, entre un 4% y un 30%¹ 2
La obesidad es el principal factor de riesgo modificable para el desarrollo de la AOS, por lo que su incremento conlleva un aumento en la prevalencia del AOS. Se estima que entre el 50 y el 70% de pacientes con AOS presentan obesidad, mientras que un 40-90% de pacientes obesos padecen AOS. El incremento de peso es determinante en la evolución de un paciente roncador hacia el desarrollo de una AOS. Algunos estudios revelan que la incidencia de AOS se multiplica por 6 al incrementar el peso corporal un 10%. En sentido contrario, una pérdida de peso del 10% puede reducir hasta un 30% el índice de apnea hipopnea (IAH)³ 5
A su vez, la presencia de AOS puede predisponer al desarrollo y mantenimiento de la obesidad. Existen estudios que han demostrado que la disminución de horas de sueño se relaciona con la presencia de obesidad. Además, los pacientes con AOS presentan mayor dificultad para perder peso, probablemente por el menor gasto energético basal debido a la somnolencia y al cansancio diurno. La presencia de AOS también puede producir desregulación neurohormonal incrementando la secreción de hormonas ore xigénicas, como la glerina, y disminuyendo el efecto anorexigénico de la leptina, lo que favorece el incremento de la ingesta y, en consecuencia, la ganancia ponderal. Dada la elevada prevalencia de ambas patologías (AOS y obesidad), resulta difícil esta blecer de forma independiente su papel en el desarrollo de enfermedades cardiovascu lares. Existe evidencia sólida que sugiere que la AOS aumenta la disfunción metabólica, inflamación sistémica, desregulación autonómica, vascular y cardíaca de la obesidad exacerbando el síndrome metabólico y elevando el riesgo cardiovascular.
La obesidad central con acumulación de grasa en tejidos parafaríngeos supone una so brecarga mecánica para el sistema respiratorio. El exceso de tejido adiposo que rodea las vías respiratorias superiores puede favorecer que estas se estrechen y se colapsen debido al efecto Venturi, según el cual mientras que la velocidad del flujo de aire au menta en el sitio de la estenosis en la vía aérea, la presión en la pared lateral de la fa ringe disminuye y la probabilidad de colapso faríngeo aumenta significativamente 1 4 6 La acumulación de grasa cervical, evidenciada como un aumento de la circunferencia del cuello medido en la zona de la membrana cricotiroidea, es un marcador de obesidad central y un factor predictor diagnóstico de AOS. El riesgo de padecer AOS se determina con una circunferencia de cuello de 38 cm en mujeres, y en hombres, de 40 cm, con una sensibilidad y especificidad del 61% y el 93% respectivamente.
Algunos estudios han encontrado una correlación entre la cantidad de grasa visceral medida por tomografía axial computarizada (TAC) abdominal con la gravedad de la AOS, una correlación incluso mayor que con el IMC³.
El aumento de grasa abdominal y la posición en decúbito ocasiona una disminución del volumen pulmonar durante el sueño, que se evidencia como una disminución de la capacidad residual funcional (FRC) y del volumen de reserva espiratorio (ERV), lo que disminuye las fuerzas de tracción traqueal longitudinal y la tensión de la pared faríngea, lo que a su vez predispone a un mayor estrechamiento de las vías respiratorias. En ocasiones, la gravedad de la disminución es tal, que tanto la capacidad pulmonar total (TLC) como la capacidad inspiratoria comienzan a disminuir y provocan el cierre de vías respiratorias pequeñas distales y empeoran el shunt fisiológico7 8 .
La adiposidad central limita el movimiento diafragmático y la expansión de la pared to rácica, y así provoca un mayor trabajo respiratorio. Como respuesta compensatoria, los pacientes adoptan un patrón respiratorio superficial, lo que provoca una relativa fatiga muscular que, sumada a una mayor atonía evidenciada durante el sueño de movimien tos oculares rápidos (REM), puede provocar un fracaso de la respuesta ventilatoria. Los pacientes obesos eucápnicos pueden mantener un impulso respiratorio aumentado. Sin embargo, los pacientes con hipercapnia mantenida pueden desarrollar un debilita miento de su impulso respiratorio central y, en consecuencia, una hipoventilación con alteraciones en el intercambio de gases, como se evidencia en pacientes con síndrome de obesidad-hipoventilación9 .
La grasa visceral es metabólicamente activa. A través de la secreción de hormonas y citoquinas, puede desestabilizar el centro respiratorio. Los pacientes con obesidad presentan un aumento de las concentraciones de leptina secretada por los adipocitos.
Esta hormona está relacionada con la disminución del apetito y el aumento de la termo génesis, por lo que probablemente en la obesidad exista una resistencia a este péptido. Se ha evidenciado además un incremento en la ghrelina, una hormona orexígena, que fomenta el aumento de peso incrementando la ingesta alimentaria, disminuyendo el gasto energético y estimulando la acumulación de tejido graso. En la obesidad existe además una regulación a la baja de adiponectina, que es una citoquina que favorece la inmunosensibilidad a la insulina. Otras adipoquinas, incluido el factor de necrosis tumo ral (TNF)-a, y la interleuquina 6 (IL-6), están también elevadas; su actividad inflamatoria favorece la resistencia a la insulina, la disfunción endotelial y la lipólisis incrementando la liberación de ácidos grasos libres¹0 ¹¹. (Figura 3)
El tratamiento de los trastornos respiratorios del sueño en individuos con obesidad no es significativamente diferente al tratamiento de la población general, con algunas consideraciones adicionales.
Se recomienda tratar el sobrepeso u obesidad en todos los pacientes con AOS. Es im prescindible corregir el desequilibrio entre la ingesta calórica y el consumo energético; para ello, serán necesarios un programa integral con estrategias duraderas de tipo conductual y la modificación del estilo de vida, que incluirá un aumento de la actividad física¹².
Las nuevas directrices marcadas por la OMS elevan el tiempo recomendado de activi dad física moderada aeróbica a 300 minutos semanales en adultos, incluidas las per sonas con afecciones crónicas o discapacidad; o bien hasta 150 minutos semanales de actividad física intensa aeróbica, o una combinación equivalente de actividad moderada e intensa. En el caso de los niños y adolescentes, aconseja como mínimo 60 minutos diarios de actividad física de intensidad de moderada a intensa, aunque se resalta que, si se dedica más tiempo al ejercicio, los beneficios para la salud serán mayores.
Otras medidas higienico-dietéticas comunes, tales como abstenerse de consumir alco hol, dejar el tabaco, corregir las posturas, suprimir el estrés y evitar comidas copiosas, deben recomendarse a todos los pacientes obesos diagnosticados de AOS.
El pilar del tratamiento para la AOS de moderada a grave es la presión positiva continua en las vías respiratorias (CPAP) nocturna. Aunque uno de los problemas a largo plazo es la adherencia al tratamiento (entre el 35 y el 80%), no se ha evidenciado que el IMC tenga ningún impacto en la misma. Se ha debatido sobre el efecto de la CPAP en la pérdida de peso, con evidencia contradictoria; sin embargo, no se ha podido demostrar en estudios protocolizados.
La CPAP elimina la clínica de roncopatía, la somnolencia diurna, además de reducir significativamente el IAH. A pesar de ello, en los pacientes con obesidad la CPAP tiene un impacto limitado con resultados poco concluyentes en la reducción de la morbimor talidad cardiovascular. A menudo, los trastornos metabólicos no mejoran en pacientes obesos con AOS a pesar del tratamiento con CPAP14 .
La obesidad es un proceso de enfermedad complejo y multifactorial, por lo que requiere un manejo multidisciplinar con evaluación en unidades especializadas¹³ . Las interven ciones de pérdida de peso, rehabilitación y cambios de los hábitos de vida se asocian con mejoras de la gravedad de la AOS, las comorbilidades cardiometabólicas y la ca lidad de vida, pero rara vez son suficientes para eliminar por completo los trastornos respiratorios del sueño, por lo que, además de los consejos médicos y la terapia cogni tivo-conductual, se debe valorar la indicación de fármacos antiobesidad anorexizantes o la necesidad de un abordaje intervencionista mediante técnicas endoscópicas o un tratamiento quirúrgico de la obesidad15 18
El consenso de la American Thoracic Society recomienda terapias adicionales destina das a reducir el peso corporal para los pacientes con sobrepeso u obesidad con AOS que inician CPAP dado su efecto sinérgico. Estas terapias precisan una evaluación pre via y un compromiso por parte de los pacientes que asegure un seguimiento adecuado.
Según la guía europea sobre el manejo de la obesidad, el tratamiento farmacológico se recomienda para pacientes con IMC >30 kg/m 5 o bien IMC >27 kg/m 2 con al menos una enfermedad asociada a la obesidad (DM tipo 2, HTA, AOS, entre otros).
Actualmente, en Europa se dispone de 3 fármacos aprobados para el uso en el trata miento de la obesidad: orlistat, la combinación de naltrexona-bupropión y liraglutida. Estos fármacos han demostrado una diferencia respecto a placebo de más del 5% de pérdida de peso. El efecto de los fármacos se reevaluará a los 3-6 meses. Se consi derarán efectivos si producen una pérdida mayor o igual al 10% del peso inicial, y su uso se podrá prolongar hasta un año. Una pérdida menor del 5% se considera fracaso terapéutico; en este caso, se debe considerar suspender el fármaco.
El orlistat es un inhibidor de la lipasa pancreática, por lo que la reducción de peso se asocia al efecto de inhibición de la absorción intestinal de grasa. Esta malabsorción puede incluir vitaminas liposolubles. La combinación de naltrexona-bupropión, un ago nista opiáceo y un antidepresivo atípico que reduce el deseo por la comida y la sensa ción de recompensa que produce la ingesta, asocia efectos adversos, como nauseas, estreñimiento, sequedad oral, mareos o vómitos. La liraglutida, un fármaco agonista del receptor del péptido similar al glucagón tipo 1 (GLP-1), es utilizada en el tratamiento de la diabetes mellitus tipo 2 y requiere administración por vía subcutánea. Recientemente se han publicado resultados con semaglutida, otro agonista del receptor de GLP-1, con administración subcutánea semanal y con una significativa pérdida ponderal de hasta un 15% del peso inicial.
La evidencia de estos fármacos en pacientes con obesidad y AOS es escasa. Existe algún estudio con orlistat que evidencia mejora de los síntomas de AOS y de la calidad de vida. La liraglutida ha evidenciado una reducción significativamente mayor del IAH relacionada con la pérdida de peso en comparación con modificaciones del estilo de vida solamente19 18 .
En los últimos años, se ha desarrollado el abordaje intervencionista endoscópico de la obesidad. Estos métodos pretenden aumentar la sensación de saciedad mediante la reducción del tamaño de la capacidad gástrica, y pese a que presentan excelentes resultados a corto plazo, de momento no están considerados en guías ni documentos de consenso del manejo de la obesidad.
La cirugía bariátrica (CB) es un tratamiento emergente para pacientes con obesidad que obtiene el mayor resultado en la pérdida de peso. También se considera actualmente una intervención metabólica que reduce la morbimortalidad cardiovascular20. A pesar de ello, es un tratamiento al que solo llega el 2% de todos los potenciales candidatos.
Las indicaciones de la CB están vigentes desde el año 1991. Se considera una técnica segura, útil, duradera y reproducible. Su indicación se plantea a los pacientes de entre 18 y 60 años con IMC >40 kg/m 2 o bien a aquellos con IMC >35 kg/m 2 con comor bilidades graves. Los estudios han revelado que la cirugía bariátrica y su consecuente reducción del IMC en pacientes con AOS mejoran de manera significativa los síntomas de ronquidos, la somnolencia diurna y el IAH. Sin embargo, un porcentaje significativo de pacientes precisan mantener tratamiento con CPAP, pues presentan una enferme dad residual entre moderada y grave²¹.
La CB es un procedimiento seguro, con una mortalidad en torno al 0,3 %. Sin embargo, presenta riesgos importantes inherentes a las características propias del tipo de inter vención y del paciente, por lo que los candidatos deben seleccionarse cuidadosamente. Se recomienda tener cuidado en el período perioperatorio y posoperatorio, dado que la AOS es un factor de riesgo importante para eventos adversos, como enfermedad trom boembólica, reintervención percutánea, endoscópica o quirúrgica y muerte. Además, al tratarse de procedimientos malabsortivos, tienen un mayor riesgo de deficiencias nutri cionales (hierro, vitaminas B12 y calcio) debido a la propia técnica quirúrgica. (Tabla II)
La obesidad es una epidemia mundial creciente, y con ella aumentará la prevalencia de la AOS, lo que implica una importante morbimortalidad, un gran impacto social y un elevado consumo de recursos, tanto para los pacientes como para los proveedores de servicios de salud. Su tratamiento conlleva muchas dificultades teniendo en cuenta el elevado porcentaje de población afectada susceptible de ser tratada con los criterios de indicación y de intervención médica.
La complejidad y la dificultad de la estrategia terapéutica obliga a la participación con junta de gobiernos, administraciones sanitarias, investigadores y personal sanitario en la lucha contra el sobrepeso y la obesidad, así como al desarrollo de estrategias de salud pública.
Puesto que su tratamiento precisa un abordaje multidisciplinar, resulta de elevada prio ridad desarrollar un sistema centralizado en el manejo de estos pacientes, la comuni cación entre facultativos especialmente formados y motivados en el manejo de estos pacientes, la estandarización de procedimientos terapéuticos y el desarrollo de un pro grama integral de nutrición, ejercicio y rehabilitación.
Los avances recientes en el conocimiento de los endotipos fisiopatológicos y fenoti pos clínicos de la AOS abren nuevos caminos y oportunidades para el desarrollo de la medicina de precisión. Un fenotipo clínico destacado corresponde a la acumulación de dos o más comorbilidades cardiometabólicas en individuos obesos de mediana edad con pocos síntomas y mala adherencia a la CPAP; en estos pacientes, se ha demos trado que la CPAP es insuficiente para reducir el riesgo cardiovascular, por lo que debe combinarse con intervenciones de cambio del estilo de vida22. Se requiere más investi gación para establecer estrategias terapéuticas dirigidas, personalizadas y, sobre todo, destinadas a la práctica clínica habitual.
La AOS en pacientes obesos es una patología crónica, por lo que el seguimiento de los pacientes con terapia nocturna resulta relevante. Existe evidencia de que los sistemas de telemonitorización23 y la retroalimentación empleada desde un punto de vista edu cativo con intervención cognitivo-conductual han conseguido una mejor adherencia a la CPAP y podrían favorecer el mantenimiento de los cambios del estilo de vida. Los avan ces que se han producido en estos últimos años en este ámbito ayudarán al desarrollo de una medicina personalizada.
Resulta interesante la investigación y la identificación de genes regulados por hormonas implicadas en la génesis de la obesidad. Es indispensable el desarrollo de nuevas dia nas terapéuticas más eficaces para el tratamiento del paciente obeso.
La prevalencia de la apnea obstructiva del sueño está aumentando en todo el mundo debido a la creciente epidemia de obesidad, lo que tiene impor tantes implicaciones socioeconómicas y en la morbimortalidad. En conse cuencia, debe considerarse un tema de preocupación a nivel mundial.
La obesidad es el principal factor de riesgo modificable para el desarrollo de la AOS. La presencia de AOS puede, a su vez, predisponer al desarrollo y al mantenimiento de la obesidad.
Los pacientes obesos presentan cambios anatómicos y neurohormonales que favorecen la colapsabilidad de la vía aérea superior y su control neuro muscular, lo que contribuye a la génesis de la apnea obstructiva del sueño. En el tratamiento de la obesidad, resulta imprescindible un programa in tegral multidisciplinar con estrategias duraderas de tipo conductual y la modificación del estilo de vida.
La CPAP sigue siendo el pilar del tratamiento para la AOS en pacientes obesos.
Se recomienda incluir terapias adicionales (farmacológicas o quirúrgicas) destinadas a reducir el peso corporal para los pacientes con sobrepeso u obesidad con AOS que inician CPAP dado su efecto sinérgico.
La telemonitorización tiene un papel fundamental en la adherencia terapéu tica y puede favorecer el mantenimiento de los cambios en el estilo de vida.
1. Lévy P, Kohler M, McNicholas WT, Barbé F, McEvoy RD, Somers VK, Lavie L, Pépin JL. Obs tructive sleep apnoea syndrome. Nat Rev Dis Primers. 2015;1:15015.
2. Meurling IJ, Shea DO, Garvey JF. Obesity and sleep: a growing concern. CurrOpinPulm Med.2019;25(6):602-608.
3. Peppard PE, Young T, Palta M, Dempsey J, Skatrud J. Longitudinal study of moderate weight change and sleep-disordered breathing. JAMA. 2000;284(23):3015-3021.
4. Wang SH, Keenan BT, Wiemken A, Zang Y, Staley B, Sarwer DB, Torigian DA, Williams N, Pack AI, Schwab RJ. Effect of Weight Loss on Upper Airway Anatomy and the Apnea-Hypopnea Index. The Importance of Tongue Fat. Am J Respir Crit Care Med. 2020;201(6):718-727.
5. Schwartz AR, Patil SP, Laffan AM, Polotsky V, Schneider H, Smith PL. Obesity and obstructive sleep apnea: pathogenic mechanisms and therapeutic approaches. Proc Am Thorac Soc. 2008;5(2):185-192.
6. Sutherland K, Lee RW, Cistulli PA. Obesity and craniofacial structure as risk factors for obs tructive sleep apnoea: impact of ethnicity. Respirology. 2012;17:213-222.
7. Crummy F, Piper AJ, Naughton MT. Obesity and the lung: 2. Obesity and sleep-disordered breathing. Thorax. 2008;63:738-746.
8. Jones RL, Nzekwu MMU. The effects of body mass index on lung volumes. Chest. 2006;130:827-833.
9. Masa JF, Pépin JL, Borel JC, Mokhlesi B, Murphy PB, Sánchez-Quiroga MA. Obesity hypo ventilation syndrome. EurRespir Rev. 2019;28(151):180097.
10. Ong CW, O’Driscoll DM, Truby H, Naughton MT, Hamilton GS. The reciprocal interaction between obesity and obstructive sleep apnoea. Sleep Med Rev. 2013;17(2):123:131.
11. Shapiro SD, et al. Leptin and the control of pharyngeal patency during sleep in severe obe sity. J. Appl. Physiol. 2014;116:1334-1341.
12. Carneiro-Barrera A, Díaz-Román A, Guillén-Riquelme A, Buela-Casal G. Weight loss and lifestyle interventions for obstructive sleep apnoea in adults: Systematic review and me ta-analysis. Obesity Reviews. 2019;1-13.
13. Burgess E, Hassmén P, Welvaert M, Pumpa KL. Behavioural treatment strategies improve adherence to lifestyle intervention programmes in adults with obesity: a systematic review and meta-analysis. ClinObes. 2017;7(2):105-114.
14. Drager LF, et al. Effects of CPAP on body weight in patients with obstructive sleep apnoea: a meta-analysis of randomised trials. Thorax. 2015;70:258-264.
15. Dixon JB, et al. Surgical versus conventional therapy for weight loss treatment of obstructive sleep apnea: a randomized controlled trial. JAMA. 2012;308:1142-1149.
16. Bray GA, Heisel WE, Afshin A, et al. The science of obesity management: an Endocrine Society scientific statement. EndocrRev. 2018;39:79-132.
17. Consenso SEEDO'2000 para la evaluación del sobrepeso y la obesidad y el estable cimiento de criterios de intervención terapéutica. Sociedad Española para el Estudio de la Obesidad. MedClin (Barc). 2000;115(15):587-597.
18. Blackman A, Foster GD, Zammit G, et al. Effect of liraglutide 3.0 mg in individuals with obe sity and moderate or severe obstructive sleep apnea: the SCALE Sleep Apnea randomized clinical trial. Int J Obes. 2016;40:1310-1319.
19. Blackman A, Foster GD, Zammit G, Rosenberg R, Aronne L, Wadden T, Claudius B, Jensen CB, Mignot E. Effect of liraglutide 3.0 mg in individuals with obesity and moderate or severe obstructive sleep apnea: the SCALE Sleep Apnea randomized clinical trial. Int J Obes (Lond). 2016;40(8):1310-1319. doi: 10.1038/ijo.2016.52. Epub 23-03-2016. PMID: 27005405; PMCID: PMC4973216.
20. Drager LF, Togeiro SM, Polotsky VY, Lorenzi-Filho G. Obstructive sleep apnea: a cardiome tabolic risk in obesity and the metabolic syndrome. J Am CollCardiol. 2013;62(7):569-576.
21. Webber L, Divajeva D, Marsh T, et al. The future burden of obesity-related diseases in the 53 WHO European-Region countries and the impact of effective interventions: a modelling study. BMJ Open. 2014.
22. Pépin JL, Eastwood P, Eckert DJ. Novel avenues to approach non-CPAP therapy and im plement comprehensive obstructive sleep apnoea care. EurRespir J. 2022;59(6):2101788.
23. Schwab RJ, Badr SM, Epstein LJ, Gay PC, Gozal D, Kohler M, Lévy P, Malhotra A, Phillips BA, Rosen IM, Strohl KP, Strollo PJ, Weaver EM, Weaver TE; ATS Subcommittee on CPAP Adherence Tracking Systems. An official American Thoracic Society statement: continuous positive airway pressure adherence tracking systems. The optimal monitoring strategies and outcome measures in adults. Am J Respir Crit Care Med. 2013;188(5):613-620.
Tabla 1. Clasificación del estado nutricional en función del índice de masa cor poral (IMC) según la Organización Mundial de la Salud (OMS)

Figura 1. Prevalencia de la obesidad en adultos, Organización Mundial de la Salud, 2016
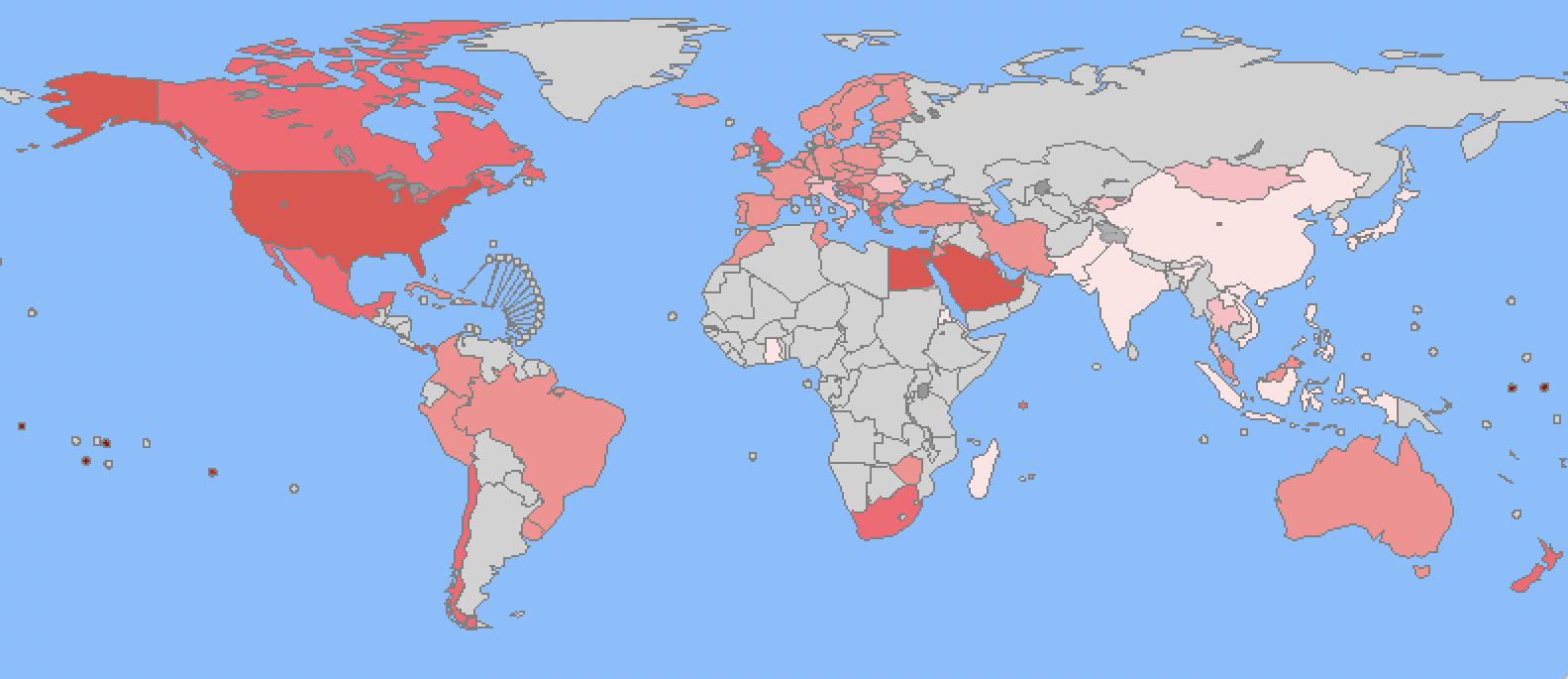
Figura 2. Prevalencia (%) de sobrepeso y obesidad en adultos en España. En cuesta Nacional de Salud de España (ENSE) 2001-2017. Encuesta Europea de Salud en España (EESE) 2009-2020


Sobrepeso
Obesidad
Figura 3. Relación entre la obesidad y la apnea obstructiva del sueño. Tomada y modificada de Lévy P, et al., Nature Reviews

Comorbilidades cardiovasculares y metabólicas Grasa visceral
Infiltración grasa toracoabdominal
Menor movilidad diafragmática
Menor expansibilidad torácica
Colapsabilidad de la vía aérea superior
Disminución del volumen pulmonar
Infiltración grasa cervical
Inestabilidad del centro respiratorio
Secreción de hormonas y citoquinas
PRESENTE Y FUTURO DE LA APNEA OBSTRUCTIVA DEL SUEÑO
MEDICIÓN DE LA HIPERSOMNIA. PRESENTE Y FUTURO
Francisco Javier Puertas
Carla Blanco Pino
Celio Martinez-Ramírez
La somnolencia excesiva diurna (SED) es una queja frecuente entre la población gene ral, aunque los estudios de prevalencia presentan cifras muy dispares. Algunas encues tas con sistemas expertos¹ muestran una cifras de hasta el 27%, aunque se reduciría a un 5% si se incluyeran las condiciones de que esté presente más de 3 días por semana y durante más de tres meses y de que tenga un impacto en la calidad de vida del paciente. La presencia de SED se asocia a un mayor riesgo cardiovascular² en la población general.
En sentido estricto, el concepto de hipersomnia hace referencia a un aumento anormal de la necesidad de sueño –habitualmente más de 11 horas al día, o un sueño nocturno de más de 9 horas–, y en la actualidad se aplica a un tipo de trastorno (por ej. la hiper somnia idiopática)³ 4 .
En un sentido más amplio, la alteración de la capacidad de mantenerse despierto y aler ta se manifiesta como hipersomnolencia e incluye tanto la somnolencia excesiva diurna como la necesidad aumentada de sueño. La somnolencia diurna anormal se expresa como una propensión irresistible de quedarse dormido –ataques de sueño– o como una dificultad importante para mantener la atención y la reactividad con el entorno durante el periodo diurno, experimentando lapsos de la vigilancia. Por otro lado, la somnolencia presenta aspectos motivacionales, rasgos fenotípicos individuales y variaciones con la edad y el género que pueden dificultar la definición misma y su valoración clínica de la misma. Además, es frecuente que haya distintas formas de referirse al espectro de síntomas similares a la somnolencia y que en ocasiones pueda ser difícil de distinguir de la fatiga5, astenia, cansancio y sueño no reparador6. Por ejemplo, es típico que los pacientes insomnes se quejen de sensación de sueño durante el día, aunque son incapaces de dormir siestas, aseguran dormir muy poco y levantarse muy cansados. De hecho, a pesar de objetivar una baja eficiencia del sueño en la polisomnografía (PSG) previa, los insomnes no suelen presentar una latencia acortada al sueño en las pruebas objetivas de somnolencia.
La somnolencia es, en sí misma, un fenómeno fisiológico y necesario como pródromo al establecimiento del estado de sueño. Desde el punto de vista conductual, se puede observar que el sujeto experimenta una caída de los párpados, una oscilación lenta de los globos oculares, bostezos, cabeceo, adquisición de una postura quiescente, etc7 .
El clínico debe hacer una cuidadosa evaluación de la somnolencia orientada a una sospecha diagnóstica. Hay que tener en cuenta el origen multifactorial de la somno
lencia. Aspectos como la edad, la obesidad y la depresión8 son determinantes en las quejas de somnolencia, junto con una valoración de los hábitos de sueño, trabajo por turnos, etc. Se pueden identificar fenotipos de somnolencia en los que en unos casos hay una mayor tendencia a quedarse dormidos –a tener ataques de sueño– y en otros a tener una sensación de dificultad para mantenerse despierto y despejado durante el día. La evaluación de la SED en los pacientes con apnea obstructiva del sueño (AOS) es especialmente importante, no solo como marcador de la gravedad, sino también para evaluar la posterior respuesta al tratamiento. Por ejemplo, la presencia de episodios frecuentes de somnolencia irresistible, más que una impresión de somnolencia ines pecífica durante el día, se asocia a casos más graves de apnea y a mejor adherencia a la CPAP9. Así mismo, los pacientes con un perfil de somnolencia grave presentan un mayor riesgo cardiovascular10 .
La valoración de la somnolencia muestra que no suele haber una buena correlación entre las pruebas subjetivas –como los cuestionarios, por ej., la escala de somnolencia de Epworth– y las objetivas –como el test de latencias múltiples del sueño (MSLT)7 12 . Respecto a la SDE en la AOS, no hay una buena correlación entre la somnolencia subje tiva y la gravedad de la enfermedad. En cambio, se encuentra una asociación significa tiva entre la somnolencia objetiva en el MSLT y la gravedad de la AOS, tanto en términos de índice de apnea/hipopnea (IAH)¹² como de otros biomarcadores de gravedad13
La somnolencia excesiva diurna puede ser evaluada de forma introspectiva o subjetiva por el propio sujeto, o de forma más objetiva mediante el registro de variables fisiológi cas que permitan establecer el estado de vigilia o sueño y, eventualmente, el momento de transición del uno al otro. Así mismo, los diferentes test permiten valorar distintos aspectos de la somnolencia, como la rapidez en quedarse dormido (como el MSLT) o la capacidad para mantenerse despierto (como el test de mantenimiento de la vigilia, MWT). En la tabla I se resumen los principales métodos utilizados en la práctica clínica.
La valoración subjetiva de la somnolencia requiere la estimación por parte del propio sujeto de su grado de alerta o propensión al sueño, bien en un momento concreto del día, como ocurre en las escalas de Somnolencia de Karolisnka (KSS) o Stanford (SSS), bien marcando un punto sobre un trazo de 10 cm en una escala analógico-visual en que un extremo significa completamente alerta, y el otro, a punto de dormirse. Estas escalas valoran la somnolencia en el instante del tiempo en el que se realizan; se suelen utilizar en ensayos clínicos o para ver la evolución de la somnolencia a la largo
de un corto periodo de tiempo. Tiene la limitación de que dan poca información sobre la somnolencia del paciente en su medio habitual. Este inconveniente lo solventó la aparición de4 la escala de Somnolencia de Epworth (ESE), un cuestionario autoaplicado publicado originalmente por Johns en 199114 que ha sido ampliamente utilizado para valorar de forma rápida la somnolencia comportamental en las semanas previas a la realización del mismo, con traducciones validadas a la mayoría de idiomas, incluido el español15. La ESE es práctica y útil en la clínica diaria, permite hacer un seguimiento de la propensión al sueño del paciente en las semanas previas a la consulta, pero tiene una pobre correlación con la somnolencia medida con test objetivos¹².
La ESE presenta 8 situaciones en las que el paciente debe valorar la probabilidad de dormirse en cada una de las diferentes situaciones: ninguna (0), ligera (1), moderada (2) elevada (3) probabilidad de dormirse. En un rango entre 0 y 24, el punto de corte de la normalidad en la publicación original está en 10, aunque en España podría aceptarse un valor de normalidad algo mayor¹6-¹7. En los estudios sobre fenotipos en pacientes con AOS se establece como somnolencia grave una puntuación en la ESE >1418 .
En determinadas circunstancias, es necesario evaluar de forma objetiva las característi cas de la somnolencia mediante el registro de variables fisiológicas, no solo por las mu chos factores que pueden influir en el grado de subjetividad, consciente o inconsciente, del propio sujeto en su estimación, sino también porque las características de la som nolencia tienen implicaciones en el diagnóstico de uno u otro trastorno, medico-legales sobre la capacidad de un sujeto de realizar determinadas actividades-como conducir-, o de dediciones terapéuticas. La Academia Americana de Medicina del Sueño establece como métodos recomendados de valoración de la somnolencia el Test de Latencias Múltiples del Sueño (Multiple Sleep Latency Test, MSLT) y el Test de Mantenimiento de la Vigilia (Maintenance Wakfulness Test, MWT)19 . Además del MSLT y del MWT, hay otros métodos objetivos de valoración de la som nolencia, aunque son menos utilizados en la rutina clínica de las unidades de sueño y suelen realizarse más en el contexto de investigación clínica, como el test de vigilancia psicomotora (PVT)20, basado en el tiempo de reacción, la pupilografía o el test de ate nuación de la actividad alfa5 7 .
2.2.1
El MSLT mide la propensión al sueño. Consiste en una secuencia de 4 o 5 siestas programadas al día siguiente de una PSG en la que se han registrado más de 7 horas y ha habido al menos 6 horas de tiempo total de sueño (TTS). La primera siesta se inicia entre 1,5 y 3 horas tras levantarse, y después las siestas se realizan cada 2 horas. En la figura 1 se ve el esquema de realización del test. La latencia al sueño en el protocolo
clínico se establece como la media de las 4-5 siestas, y se considera normal >10 min, patológica >de 8 min, y entre 8 y 10 min se hablaría de una zona indeterminada. Se establece como latencia al inicio del sueño el primer periodo de 30 segundos en que aparezca cualquier fase de sueño; si el paciente no se duerme, se interrumpe el test a los 20 min y se toma esta cifra para la media. El MSLT debe ser anormal (>8 min ) para poder hablar de una somnolencia objetiva. Es criterio diagnóstico en la narcolepsia tipo 2 (sin cataplejía) o en la hipersomnia idiopática. En el caso de la narcolepsia, es necesario además que haya más de una siesta en que aparezca fase REM con una latencia menor de 15 minutos tras el adormecimiento. La narcolepsia es el trastorno en que más claramente se observa una latencia anormal al sueño en el MSLT (Figura 2), respecto a trastornos que cursan con SDE, como la AOS, la hipersomnia idiopática, las quejas de hipersomnia en pacientes psiquiátricos o en los movimientos periódicos de extremidades (PLM) (Figura 3) (datos no publicados)²¹.
A diferencia del MSLT, el MWT valora la capacidad de mantenerse despierto en si tuaciones propicias al adormecimiento. En la figura 1 se representa el esquema de realización del MWT. Consiste en 4 intentos de mantenerse despierto el máximo tiempo posible tras una PSG con 7 horas de registro y 6 horas de TTS. El sujeto permanece sentado en la cama o en un sillón reclinable en una habitación confortable y con luz muy tenue. Si en la media de los 4 intentos muestra que la aparición del sueño <de 18 minutos, se considera anormal. El test se interrumpe a los 40 min si no se ha dormido, o inmediatamente después de los 3 primeros periodos de fase N1 o cualquier otra fase de sueño. Así como el MSLT tiene una orientación más diagnóstica, el MWT se ha empleado sobre todo para valorar el efecto de fármacos estimulantes²² ²³, por ejemplo en ensayos clínicos o la aptitud para realizar tareas que requieren atención mantenida. En algunos países, es necesario realizar un MWT y obtener un resultado normal para aprobar o renovar el permiso de conducir.
Tanto el MSLT como el MWT requieren una preparación y un protocolo cuidadosos¹9 para que los resultados sean fiables. En condiciones ideales, el lugar donde se realiza debe estar aislado, con un nivel de ruido por debajo de los 36 dB, y mantener una temperatura confortable. Se recomienda que los pacientes permanezcan en tratamiento estable el tiempo suficiente a criterio del clínico y que se valoren los horarios de sueño mediante diario de sueño o actigrafía al menos 15 días antes de la realización del estu dio. Es importante que el paciente no esté bajo los efectos de fármacos psicótropos que puedan producir sedación o estimulación o que puedan alterar la latencia a la fase REM. Ante la duda, en algunos casos es recomendable realizar test de fármacos en orina antes de la prueba. Es una situación frecuente, con respuestas variables en función de los centros, si un paciente en tratamiento con CPAP debe llevarlo durante la prueba. Se recomienda que lo lleve para la realización del MSLT, pero no para el MWT.
Es un test que trata de valorar la capacidad de mantenerse despierto en condiciones favorables al adormecimiento. En este sentido, es similar al MWT, y ambos proce dimientos guardan ciertas similitudes. Consta de 4 intentos en los que el paciente permanece en una habitación con luz tenue y en posición semisentada en la cama o en un sillón; debe estar atento a un diodo luminoso y marcar cada vez que aparece una luz presionando el dispositivo con un dedo. Se estima que la ausencia de 3 reconocimien tos seguidos de la señal luminosa, que suele aparecer cada 7 segundos, se interpreta como latencia del sueño24 .
Los métodos actuales de valoración de la somnolencia tienen la ventaja de que son utilizados en la mayoría de laboratorios del mundo de una forma estandarizada y re producible. Están muy extendidos entre los investigadores y forman parte de la rutina clínica. Sin embargo, como hemos visto, entre ellos hay poca correlación. El MSLT, que es la prueba objetiva de referencia, solo mide un aspecto de la somnolencia, y en un medio fuera del habitual del paciente. Además, tiene una pobre correlación con otros métodos, como el MWT, que mide otro aspecto de la somnolencia como es la capacidad de mantenerse alerta, y tampoco con valoraciones comportamentales subjetivas, como el ESE. Así se podría dar la paradoja de diagnosticar somnolencia patológica a alguien que no se queja de somnolencia SDE pero se duerme en <de 8 min en el MSLT. Es también importante poder valorar la somnolencia mediante biomarcadores más ac cesibles que el MSLT y el MWT. Así, se han descrito moléculas en sangre como el acido oxálico o el diacilglicero25, y se han identificado redes neuronales y grupos de ARNm de el transcriptoma de muestras de sangre26 asociadas a la privación de sueño. Por otro lado, se ha demostrado que el aumento de la temperatura distal de la piel es un marcador fiable de somnolencia que puede preceder a los episodios de sueño27 . Finalmente, la evolución de la tecnología de nanosensores y registro de variables per mitirá que los dispositivos portátiles (weareables), como actígrafos y relojes inteligentes, incorporen, por ejemplo, datos de temperatura periférica y variabilidad de la frecuencia cardiaca. Esta información, mediante programas de gestión de grandes grupos de da tos e inteligencia artificial, podrá ser validada para la medición de la somnolencia diurna durante muchos días y en el medio habitual del paciente.
La hipersomnia es un síntoma que puede expresarse de muchas formas y cuyo origen puede ser multifactorial, por lo que el clínico debe hacer una cuidadosa anamnesis orientada a identificar las posibles causas de la misma, prestando especial atención a los aspectos de hábitos de sueño, medicación y comorbilidades.
La somnolencia diurna excesiva puede manifestarse como una propensión irresistible al sueño o una dificultad para mantener un adecuado nivel de alerta durante el día. La otra forma en que se presenta la hipersomnia es una necesidad aumentada de tiempo de sueño.
La medición de la somnolencia diurna excesiva se basa en pruebas objeti vas que registran variables fisiológicas, como el test de latencias múltiples del sueño y el test de mantenimiento de la vigilia; y de escalas subjetivas referidas por el propio paciente, bien a lo largo de un periodo de tiempo (es cala de Epworth) bien mediante escalas que valoran la sensación subjetiva de mayor o menor grado de alerta o adormecimiento en un momento dado (Stanford, Karolinska, etc.).
La correlación de la intensidad de la somnolencia entre los diferentes méto dos es baja, debido a que cada uno valora aspectos distintos.
En el futuro dispondremos de biomarcadores que permitirán caracterizar los distintos aspectos de la somnolencia y de dispositivos de registro de variables fisiológicas que el paciente podrá llevar durante periodos más largos de tiempo.
1. Ohayon MM, Dauvilliers Y, Reynolds III CF. Operational Definitions and Algorithms for Ex cessive Sleepiness in the General Population. Implications for DSM-5 Nosology. Arch Gen Psychiatry. 2012;69(1):71-79.
2. Li J, Covassin N, Bock JM, Mohamed EA, Pappoppula LP, Shafi C, et al. Excessive Daytime Sleepiness and Cardiovascular Mortality in US Adults: A NHANES 2005- 2008 Follow-Up Study. Nat Sci Sleep. 2021;13:1049-1059.
3. American Academy of Sleep Medicine. International Classification of Sleep Disorders, 3rd. ed. American Academy of Sleep Medicine, editor. Darien, Illinois; 2014.
4. Kallweit U, Bassetti CLA. Hypersomnias of Central Origin. Nosological classification, defini tions, and epidemiology. En: Bassetti CLA, McNicholas WT, Paunio T, Peigneux P (eds.) Sleep Medicine Textbook, 2nd Ed. European Sleep Reserach Society; 2021. p. 379-385.
5. Shen J, Barbera J, Shapiro CM. Distinguishing sleepiness and fatigue: focus on definition and measurement. Sleep Med Rev [Internet]. 2006;10(1):63-76. Disponible en: http://www. ncbi.nlm.nih.gov/pubmed/16376590.
6. Wilkinson K, Shapiro C. Nonrestorative sleep: symptom or unique diagnostic entity? Sleep Med [Internet]. 2012 Jun [cited 2013 Sep 19];13(6):561-569. Disponible en: http://www. ncbi.nlm.nih.gov/pubmed/22560828.
7. Mathis J, De Lacy S, Roth C, Hill EA. Measuring: Monitoring Sleep and Wakefulness. En: Bassetti CL, McNicholas WT, Paunio T, Peigneux P (eds.) Sleep Medicine Textbook, 2nd Ed. European Sleep Reserach Society; 2021. p. 181-200.
8. Fernandez-Mendoza J, Vgontzas AN, Kritikou I, Calhoun SL, Liao D, Bixler EO. Natural history of excessive daytime sleepiness: role of obesity, weight loss, depression, and sleep propen sity. Sleep. 2015;38(3):351-360.
9. Thorarinsdottir EH, Janson C, Aspelund T, Benediktsdottir B, Júlíusson S, Gislason T, et al. Different components of excessive daytime sleepiness and the change with positive airway pressure treatment in patients with obstructive sleep apnea: Results from the Icelandic Sleep Apnea Cohort (ISAC). J Sleep Res. 2022;31(3):e13528.
10. Mazzotti DR, Keenan BT, Lim DC, Gottlieb DJ, Kim J, Pack AI. Symptom subtypes of obstruc tive sleep apnea predict incidence of cardiovascular outcomes. Am J Respir Crit Care Med. 2019;200(4):493-506.
11. Munkhjargal O, Oka Y, Tanno S, Shimizu H, Fujino Y, Kira T, et al. Discrepancy between subjective and objective sleepiness in adolescents. Sleep Med. [Internet]. 2022;96:1-7. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S1389945722001691.
12. Fong SYY, Ho CKW, Wing YK. Comparing MSLT and ESS in the measurement of exces sive daytime sleepiness in obstructive sleep apnoea syndrome B. J Psychosom Res. 2005;58:55-60.
13. Li Y, Vgontzas AN, Fernandez-Mendoza J, Kritikou I, Basta M, Pejovic S, et al. Objective, but not subjective, sleepiness is associated with inflammation insleep apnea. Sleep. 2017;40(2).
14. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep. 1991;14(6):540-545.
15. Chiner E, Arriero JM, Signes-Costa J, Marco J, Fuentes I. [Validation of the Spanish version of the Epworth Sleepiness Scale in patients with a sleep apnea syndrome]. Arch Bronconeu mol. 1999;35(9):422-427.
16. Izquierdo-Vicario Y, Ramos-Platón MJ, Conesa-Peraleja D, Lozano-Parra AB, Espinar-Sierra J. Epworth Sleepiness Scale in a Sample of the Spanish Population.Sleep. 1997;20(8):676677.
17. Durán-Cantolla J, Puertas FJ, Pin Arboledas G, Santamaria J, GES. Consenso nacional so bre el síndrome de apneas-hipopneas durante el sueño. Arch Bronconeumol. 2005;41(Ext 4):1-110.
18. Mediano O, González Mangado N, Montserrat JM, Alonso-Álvarez ML, Almendros I, Alon so-Fernández A, et al. International Consensus Document on Obstructive Sleep Apnea. Arch Bronconeumol. 2021.
19. Krahn LE, Arand DL, Avidan AY, Davila DG, DeBassio WA, Ruoff CM, et al. Recommen ded protocols for the Multiple Sleep Latency Test and Maintenance of Wakefulness Test in adults: guidance from the American Academy of Sleep Medicine. J Clin Sleep Med. 2021;17(12):2489-2498.
20. Thomann J, Baumann CR, Landolt HP, Werth E. Psychomotor Vigilance Task demonstra tes impaired vigilance in disorders with excessive daytime sleepiness. J Clin Sleep Med. 2014;10(9):1019-1024.
21. Billiard M, Seguret F, Puertas FJ. Excessive Daytime Sleepiness: Clinical Impression Versus Final Diagnosis. En: Dolenc Groselj L (ed.). Symposium on Sleep Research. Ljubljana: Lek Pharmaceuticals dd; 2004. p. 3-14.
22. Dauvilliers Y, Verbraecken J, Partinen M, Hedner J, Saaresranta T, Georgiev O, et al. Pitoli sant for Daytime Sleepiness in Obstructive Sleep Apnea Patients Refusing CPAP: A Rando mized Trial. Am J Respir Crit Care Med. [Internet]. 2020;201(9):1135-1145. Disponible en: https://www.atsjournals.org/doi/10.1164/rccm.201907-1284OC.
23. Bonsignore MR, Pepin J-L, Cibella F, Barbera CD, Marrone O, Verbraecken J, et al. Ex cessive Daytime Sleepiness in Obstructive Sleep Apnea Patients Treated With Continuous Positive Airway Pressure : Data From the European Sleep Apnea Database. Front Neurol. 2021;12:690008.
24. Huang Y, Aumüller P, Fietze I, Penzel T, Veauthier C. Comparison of the Oxford Sleep Resistan ce Test and the Multiple Sleep Latency Test. Physiol Meas [Internet]. 2020;41(10):104005. Disponible en: https://iopscience.iop.org/article/10.1088/1361-6579/ab9feb.
25. Weljie AM, Meerlo P, Goel N, Sengupta A, Kayser MS, Abel T, et al. Oxalic acid and diacyl glycerol 36:3 are cross-species markers of sleep debt. PNAS. 2015;112(8):2569-2574.
26. Laing EE, Möller-Levet CS, Dijk D-J, Archer SN. Identifying and validating blood mRNA bio markers for acute and chronic insufficient sleep in humans: a machine learning approach. Sleep. 2019;42(1).
27. Martinez-Nicolas A, Guaita M, Santamaría J, Montserrat JM, Rol MA, Madrid JA. Circadian Impairment of Distal Skin Temperature Rhythm in Patients With Sleep- Disordered Brea thing: The Effect of CPAP. Sleep. 2017;40(6).
PSG la noche previa con un mínimo de 7 horas de registro y 6 horas de tiempo total de sueño
Paciente se acuesta 30 seg
1ª siesta 1,5 3 horas tras levantarse
Paciente adopta postura semisentado en la cama o sentado confortablemente en sillón reclinable 30 seg
Consigna: “Intente estar despierto y no dormirse tanto como le sea posible” 5 seg
Luces apagadas
Primer periodo de cualquier fase de sueño
Consigna: “Adopte una postura confortable, deje que venga el sueño” 5 seg T0 T1 T2
Primer periodo de fase REM
Test finaliza tras 20’ sin dormir, 15’ tras T1 o T2
Luces apagadas T0
Primeros 3 periodos seguidos de fase N1 o cualquier otra fase de sueño T1
Test finaliza tras T1 o tras 40’ sin dormir
Figura 2. Hipnograma de 5 siestas realizadas en un paciente con Narcolepsia tipo 1. Latencia media al sueño 4,1 min. 3 Siestas de Inicio en fase REM (SO-

Nar tipo 1: Narcolepsia tipo 1. AOS: Apnea Obstructiva del Sueño. IDIO Hiper: Hipersom nia idiopática. PSY Hiper: Hipesomnia asociada a trastorno mental. PLM: Movimientos periódicos de las extremidades durante el sueño. En abscisas la siesta realizada a las 10, 12, 14 o 16 horas del día. En ordenadas la latencia media al sueño en cada siesta segun las diferentes patologias.
PRESENTE Y FUTURO DE LA APNEA OBSTRUCTIVA DEL SUEÑO
FENOTIPOS CLÍNICOS DE LA APNEA OBSTRUCTIVA DEL SUEÑO
Autores
Gonzalo Labarca
Mario Henriquez-Beltran
La apnea obstructiva del sueño (AOS) es un trastorno respiratorio del sueño con múlti ples presentaciones clínicas y asociaciones con otras enfermedades crónicas no trans misibles¹ ², lo que se traduce en una enfermedad con una elevada carga de morbimor talidad y costes sanitarios³. Hoy en día, nadie pone en duda que la AOS es un problema de salud pública importante debido a su prevalencia y consecuencias negativas para la población general3 4 .
Los tratamientos de elección son las medidas dietéticas y de higiene del sueño, así como la presión positiva continua en las vías aéreas (CPAP), en especial para los pa cientes con AOS moderada y grave5. Sin embargo, los estudios clínicos aleatorizados realizados para evaluar la eficacia de la CPAP en la disminución de las complicaciones cardiometabólicas a largo plazo no han logrado probar el beneficio de la intervención en todos los pacientes con AOS6 .
Entre las potenciales explicaciones de estos resultados no concluyentes se encuentra la elevada heterogeneidad de los pacientes con AOS7, tanto en su presentación clíni ca como en su evolución a través del tiempo. Además, la AOS tiene un componente multidimensional conformado por múltiples manifestaciones clínicas con variaciones en función de la edad, el sexo y las características clínicas del paciente8 9. La presen tación clínica clásica de la AOS diagnosticada en las unidades de sueño corresponde a un hombre de mediana edad, obeso, hipertenso y con hipersomnia diurna¹0. En base a este fenotipo, la mayoría de los estudios observacionales y ensayos clínicos han demostrado la eficacia del tratamiento con CPAP y la relación de la AOS con diferentes enfermedades cardiovasculares11 12. Sin embargo, los estudios clínicos aleatorizados diseñados para evaluar el impacto de este tratamiento en distintos desenlaces relevan tes, como mortalidad, infarto agudo al miocardio¹³ ¹6, manejo de la diabetes mellitus¹7 o prevención de arritmias cardiacas como la fibrilación auricular¹8, han mostrado un impacto limitado o nulo.
Además de las diferencias en la presentación clínica de la AOS, otra fuente de hete rogeneidad está relacionada con los fenotipos polisomnográficos de la AOS¹9. Se ha postulado que la forma actual en la que los pacientes con AOS inician el tratamiento, basada en el índice de apnea-hipopnea (IAH), es una variable que tan solo hace referen cia a la frecuencia de los eventos respiratorios (eventos/hora), sin tener en cuenta otras características del evento respiratorio como la gravedad de la hipoxemia, la duración del evento respiratorio, las repercusiones sistémicas o la interacción con el fenotipo clínico²0 .
El fenotipo es el resultado de la asociación entre la genética (genotipo) y el ambiente en el que se desarrolla la condición o enfermedad. En el caso de la AOS, últimamente se han descrito múltiples fenotipos clínicos con diversas presentaciones clínicas y re percusiones sobre desenlaces clínicamente relevantes. El objetivo de este capítulo es describir los distintos fenotipos clínicos de la AOS identificados en los últimos años, así como el impacto de estos fenotipos sobre el tratamiento de la AOS y su pronóstico.
Históricamente, el fenotipo clásico de la AOS descrito por el Dr. Guilleminault era un hombre de mediana edad, obeso, roncado, y con somnolencia diurna excesiva¹0. Sin embargo, con el paso del tiempo y el desarrollo científico se han logrado identificar otros fenotipos de la AOS, con riesgos de complicaciones multisistémicas diferentes¹9 Para comprender mejor el desarrollo de los fenotipos clínicos de la AOS, es importante mencionar las estrategias epidemiológicas utilizadas para clasificar a los pacientes en conglomerados a partir de grandes bases de datos. Por lo tanto, el primer punto rele vante es el origen de la base de datos, que pueden ser estudios poblacionales o bases clínicas especializadas en estudios de patologías del sueño. Finalmente, dentro de los análisis estadísticos usados con mayor frecuencia se encuentran los análisis de clús teres o conglomerados, que agrupan a los participantes en subgrupos específicos en base a una serie de características similares (frecuencias de una característica o me diana de un valor continuo)²¹. Todos estos aspectos previos son claves para determinar la validez de los hallazgos y la aplicabilidad clínica.
Existe evidencia sólida que asocia diferentes síntomas de la AOS, como la excesiva somnolencia diurna, la presencia de insomnio o la apnea presenciada, a un mayor riesgo de complicaciones, principalmente cardiovasculares²². En la práctica clínica, el cuestionario de somnolencia de Epworth es la herramienta clínica que se ha diseñado y utilizado con mayor frecuencia para determinar la gravedad de la somnolencia durante la semana previa a su aplicación²³. Una puntuación mayor de 10 puntos es considerada como somnolencia. Además, este cuestionario ha sido empleado como una medida de respuesta a la terapia con CPAP o,más recientemente, como respuesta a fármacos para la hipersomnia en el AOS, siendo considerado un cambio de 2 puntos como clínicamen te significativo²4 ²5.
Sin embargo, un paciente con AOS puede presentarse exclusivamente con una puntua ción de Epworth elevada, mientras que otro puede presentar una excesiva somnolencia diurna o somnolencia al conducir, pero con puntuaciones por debajo de 10 puntos. En
este escenario, en 2014 se publicó el primer análisis de clústeres o conglomerados poblacionales a partir de bases de datos clínicas de sueño en población islandesa. En este estudio se evaluaron 21 variables (18 síntomas de sueño y 3 comorbilidades clíni cas) en 780 pacientes con AOS de moderada a grave que fueron agrupados mediante análisis de clúster latentes en tres fenotipos 1) No somnoliento, 2) Sueño fragmentado y 3) Excesiva somnolencia diurna²6. El resumen de las principales variables incluidas en este enfoque basado en síntomas se muestra en la tabla I.
Posteriormente, el consorcio de clínicas de sueño SAGIC (acrónimo de Sleep Apnea global international Consortium), que agrupa múltiples clínicas de sueño ubicadas en Norteamérica, Asia, Europa y Latinoamérica, replicó la técnica empleada en el estudio ISAC y encontró similares grupos en una cohorte de 972 pacientes con AOS de mode rada a grave²7, hallazgos que fueron confirmados en la cohorte poblacional de KOGES (Korean Genome Epidemiologycal Study) procedente de Corea del Sur²8, siendo este el primer estudio de validación en base de datos comunitaria. Sin embargo, no fue hasta 2019 cuando se determinó la asociación entre estos clústeres y la incidencia de eventos cardiovasculares en la cohorte comunitaria del Sleep Health Heart Study (SHHS) de Estados Unidos, en el que se observó una asociación entre el fenotipo de excesiva somnolencia diurna y una mayor incidencia de eventos cardiovasculares²9. Validaciones posteriores de esta técnica de análisis de conglomerados latentes se han realizado tam bién en otras cohortes clínicas y poblacionales de Norteamérica30 y población hispana/ latina 31 33, concluyendo similares resultados.
En un análisis transversal de la cohorte comunitaria del estudio de comunidad hispana/ latina de Norteamérica, el fenotipo con excesiva somnolencia diurna se asoció a un mayor riesgo cardiovascular medido a través de la calculadora de riesgo cardiovascular de la American Heart Association (AHA)³². En otro estudio con seguimiento a 5 años en una cohorte clínica de sueño en Chile, el riesgo de mortalidad cardiovascular de este fenotipo hipersomnia fue HR 5,47 (IC95%: 1,74-8,29)³¹, mientras que en Canadá el riesgo de eventos cardiovasculares tras 8 años de seguimiento de una cohorte clínica fue de HR 2,25 (IC95%: 1,02-4,94)³4. El resumen de la evidencia respecto al enfoque basado en fenotipos se muestra en la tabla II.
A pesar de que el fenotipo con excesiva somnolencia diurna ha demostrado un mayor riesgo de complicaciones y de comorbilidades de manera constante²7 ²9 31 34, una de las principales limitaciones de este enfoque es la complejidad de la técnica estadística utilizada y el número de síntomas incluidos, lo que limita la aplicabilidad clínica del método. En un estudio posterior, Mazzoti y cols. diseñaron un algoritmo que permitía simplificar la identificación del subtipo de excesiva somnolencia diurna, con una sensi bilidad del 92%, con lo que se optimizaba el diagnóstico de este fenotipo35 .
Si bien tanto el insomnio de conciliación como el de mantención son parte de los sínto mas incluidos en los análisis de conglomerados sintomáticos, también se pueden aso
ciar independientemente con peores desenlaces clínicos. Existe una asociación directa entre la AOS y el insomnio, fenotipo denominado como COMISA36.(del inglés comorbid insomnia and sleep apnea). Este fenotipo se ha asociado con una mayor prevalencia de enfermedad cardiovascular. En la cohorte del SHHS, el riesgo de eventos cardio vasculares ajustado de este grupo fue del 75%, mientras que la combinación de AOS de moderada a grave e insomnio de conciliación se asoció a un 36% de mayor riesgo ajustado de eventos cardiovasculares incidentes37 .
El objetivo del análisis de los fenotipos basados en características clínicas es identificar patrones clínicos que permitan determinar distintos subtipos de AOS, así como identi ficar distintos riesgos de complicaciones y de respuesta al tratamiento y, por lo tanto, ser una herramienta útil en la medicina de precisión19 38. Sin embargo, a diferencia de los fenotipos basados exclusivamente en síntomas descritos anteriormente, la principal limitación de estos análisis es la escasa validación externa en muestras independientes, lo que reduce la aplicabilidad de los resultados.¹9 En la actualidad, existen publicacio nes de fenotipos basados en características obtenidas a partir de bases clínicas de Europa, Norteamérica, Suramérica y Asia39 45
A pesar de que los grupos o clústeres no son idénticamente iguales, es posible identifi car patrones similares entre ellos. Dentro de las principales variables incluidas en este tipo de análisis, destacan las características demográficas, hábitos, datos antropomé tricos, comorbilidades, síntomas y estudio de sueño.
El número de conglomerados varía entre 3-8 subtipos19 41 43. En la figura 1 se mues tran los principales patrones identificables en estos subtipos. Los subtipos clínicos más representativos hacen referencia a los patrones que se exponen a continuación.
Este fenotipo destaca por una edad superior a 65 años, en su mayoría hombres, obe sos y no somnolientos, con una elevada carga de comorbilidades cardiovasculares, así como un elevado IAH e hipoxemia nocturna. Este grupo presenta una menor adherencia a la CPAP, con una alta prevalencia de eventos cardiovasculares.
Este fenotipo se caracteriza por un mayor porcentaje de mujeres, de mediana edad, con múltiples síntomas asociados a sueño y alta prevalencia de depresión e insomnio tanto de inicio como de mantenimiento. La carga de comorbilidades (diabetes, hipertensión arterial, enfermedad coronaria) es intermedia, y tanto el IAH como la hipoxemia noctur na no están tan elevadas como en el grupo anterior. A diferencia de otros subgrupos, la calidad de vida asociada a la salud se encuentra alterada. En este subgrupo, la adhe rencia a la CPAP es baja y el pronóstico a largo plazo no está bien establecido.
Este subtipo corresponde al patrón “clásico” de la AOS, es decir, hombresmenores de 65 años, obesos, con excesiva somnolencia diurna y baja carga de comorbilidades cardiovasculares. El patrón de PSG destaca por presentar un IAH elevado y una T90% moderada. Dentro de las principales complicaciones descritas, se encuentran una ma yor accidentabilidad y de riesgo de eventos cardiovasculares..
Este subtipo está formado por hombres, no obesos y menores de 50 años. Presentan ronquido, somnolencia diurna leve-moderada y una baja prevalencia de comorbilidades. La PSG de este subtipo se caracteriza por presentar un elevado IAH y una baja carga de hipoxemia, lo que indicaría que el trastorno respiratorio es predominantemente de la vía aérea superior.
El estudio de sueño mediante poligrafía respiratoria (PR) o PSG otorga información adicional sobre múltiples procesos fisiológicos y fisiopatológicos que ocurren durante el sueño que, de manera tradicional, se simplifica en el valor del IAH20 46 48, como la fre cuencia de eventos respiratorios por hora de sueño. Sin embargo, otros canales, como la oximetría de pulso o el electroencefalograma, entre otros, presentan información de alto valor respecto a los mecanismos y consecuencias del AOS en el individuo20 49 51 . De manera similar a los análisis descritos previamente, se ha logrado identificar distin tos subtipos de AOS basados en las características de la PSG o PR. El primer estudio publicado fue realizado por Zinchuk y cols. en 2018, y en él se destacaban dos subtipos predominantes52. En primer lugar, el fenotipocaracterizado por excesiva frecuencia de eventos respiratorios acompañados de una marcada hipoxemia nocturna. Clínicamente, este subtipo se caracterizaba por presentar un predominio de hombres obesos con excesiva somnolencia diurna, lo que sugiere una alta colapsabilidad de la vía aérea que favorece la hipoxia secundaria al evento respiratorio52. Además, este subtipo se asociaba a una alta incidencia de eventos cardiovasculares o muerte, HR 1,91 (IC95%: 1,27- 2,85). Este fenotipo hipóxico también ha sido descrito en otros estudios usando PR50 53 54, en los que se identificó un subtipo de excesiva hipoxemia que presentaba un elevado T90%, ODI3% y saturación minina de O2, lo que se asociaba a una mayor prevalencia de comorbilidades y a un mayor riesgo independiente de mortalidad por todas las causas y por mortalidad asociada a cáncer53 55
Si bien este fenotipo ha sido descrito mediante indicadores convencionales de la PSG y/o PR, estudios recientes han concluido que es posible diseñar y validar índices de hipoxemia nocturna que se asocien con un mayor riesgo de eventos cardiovasculares y
mortalidad. Azarbarzin y cols. diseñaron el concepto de carga hipóxica como un indica dor adicional al IAH que añade información con el cálculo del área bajo curva de SaO2 asociada al evento respiratorio. Este índice se extrae a partir del oxímetro de pulso e identificando el final del evento respiratorio como indicador para el cálculo posterior de la carga hipóxica. Para ello, se designa una ventana de análisis que incluye el evento respiratorio50 51. En base a esta ventana de observación, es posible cuantificar la gra vedad de la desaturación (definida como la diferencia entre la SaO2 al inicio del evento menos la desaturación máxima asociada al evento respiratorio) y la duración del evento respiratorio. Este valor se conoce como la carga hipóxica por evento, y el sumatorio de todos los eventos individuales se conoce como la carga hipóxica asociada a la apnea del sueño, expresada en % min/hora (Figura 2)
En base a estudios de cohortes, tanto de base poblacional como clínica, el fenotipo con una elevada carga hipóxica ha demostrado un riesgo aumentado de presentar mayor mortalidad cardiovascular, mayor incidencia de fallo cardiaco y de nuevos eventos car diovasculares tras 8-11 años de seguimiento en Norteamérica39. De manera adicional, la combinación de una alta carga hipóxica y un cambio en la frecuencia de pulso sobre 10 lpm se asoció con un aumento de riesgo significativo de mortalidad cardiovascular (HR, 3,50 (CI95%: 2,15-5,71), mortalidad por todas las causas, HR 1,84 (CI95%: 1,402,40) y eventos cardiovasculares no fatales, HR, 1,93 (CI95%, 1,36-2,73)40
El segundo fenotipo de PSG se caracteriza por AOS grave con un alto índice de micro despertares y pobre calidad de sueño. Destaca por presentar un índice de masa cor poral (IMC) intermedio y un menor grado de hipoxemia. Este patrón presenta menores valores de Epworth, siendo catalogados como AOS no somnolientos. Se postula que, a diferencia del fenotipo hipoxémico, este fenotipo tiene una elevada colapsabilidad faríngea, con un bajo umbral para un microdespertar (arousal threshold) y un elevado loop gain, lo que produce un microdespertar antes de que progrese la hipoxemia. Este subtipo de pacientes tiene la menor tasa de adherencia a la CPAP (29%) entre los casos de moderados a graves, y los datos actuales sugieren que presenta un limitado beneficio al iniciar la terapia con CPAP19
En el subgrupo de mujeres con AOS, un gran número de estudios muestran diferencias respecto a múltiples dominios, como por ejemplo la calidad y la estructura del sueño, así como los hallazgos polisomnográficos de los trastornos respiratorios del sueño9 Otras diferencias clínicas de género están relacionadas con la estructura anatómica de la faringe, la presentación clínica de la AOS56 y el impacto de la AOS a nivel de la calidad de vida y de la frecuencia de comorbilidades cardiovasculares y metabóli cas41 44 45. A nivel de sintomatología, las mujeres presentan una mayor frecuencia dentro del clúster correspondiente a “sueño fragmentado” y “excesiva somnolencia
diurna”57. Además, el efecto de la CPAP en mujeres es muy diferente al encontrado en los hombres, y probablemente influenciado por el estado hormonal y las comorbilidades más frecuentemente encontradas en mujeres, como la ansiedad, la depresión, y sus tratamientos9 45. Por otro lado, el instrumento más utilizado para medir subjetivamente la hipersomnia, como es la escala de somnolencia de Epworth²³, no está validado en mujeres en ningún rango de edad58. Otro instrumento de screnning, el STOP-BANG, tiene incorporado el género masculino como variable de análisis59 69. Además, la re presentación de las mujeres en los conglomerados basados en síntomas es de alrede dor del 20%41 45. A pesar de todo ello y siguiendo las indicaciones de la mayoría de las guías internacionales, el diagnóstico y el tratamiento de la AOS se realizan en mujeres extrapolando los resultados de los estudios en hombres de me diana edad5
Según los resultados del estudio de base poblacional Hypnolaus61, la prevalencia de AOS en mujeres de 35-75 años es muy elevada (60,8% con índice de apnea-hipopnea [IAH] ≥ 5 eventos/hora y 23,4% con IAH ≥ 15 eventos/hora), por lo que llama la aten ción el desconocimiento de casi todos los aspectos de la AOS, incluido el efecto de la CPAP y su pronóstico, en la mujer.
La mayor parte de la evidencia sobre la prevalencia y el impacto de la AOS en las muje res se basa en el embarazo y las mujeres con ovarios poliquísticos62 63. Sin embargo, estos no son los perfiles observados con mayor frecuencia en los laboratorios del sue ño41. Hasta la fecha, tan solo existe un ensayo clínico (307 mujeres con un IAH ≥ 15 eventos/horas aleatorizadas a CPAP o tratamiento conservador durante tres meses)64 y un estudio observacional (1.116 mujeres seguidas una media de 72 meses) que incluyan solo series de mujeres que evalúen el efecto de la CPAP11. Estos dos estudios clínicos sugirieron un efecto positivo de la CPAP en los síntomas relacionados con el sueño, el estado de ánimo y los parámetros neurocognitivos y cardiovasculares en mujeres con AOS de moderada a grave. Sin embargo, es necesario avanzar hacia una correcta caracterización de este fenotipo.
Los fenotipos de la AOS son un componente primordial en el enfoque personalizado de la enfermedad. Una correcta interpretación de las características clínicas, síntomas asociados al impacto de la enfermedad y patrones polisomnográficos asociados a un mayor riesgo de eventos adversos es clave para la identificación precoz y la estratifi cación de la población con un mayor riesgo de eventos adversos y de peor adherencia al tratamiento con CPAP. Sin embargo, aún existen grandes campos por investigar, en especial los relacionados con el AOS en las mujeres y la validación de los resultados obtenidos en hombres de mediana edad en otras poblaciones infrarrepresentadas en la literatura científica.
La presentación clínica de la apnea obstructiva del sueño (AOS) es hetero génea, con múltiples formas clínicas y polisomnográficas que se asocian a un distinto pronóstico a largo plazo.
La identificación de fenotipos basados en características clínicas y patrones polisomnográficos permiten personalizar los cuidados sanitarios.
El fenotipo basado en una excesiva somnolencia diurna se asocia a un mayor riesgo de eventos y mortalidad cardiovasculares.
El fenotipo basado en una alta carga hipóxica se asocia a un mayor riesgo de nuevos eventos cardiovasculares, insuficiencia cardiaca, así como a una m yor mortalidad cardiovascular y por todas las causas.
Los fenotipos basados en características clínicas deben ser validados en cohortes independientes y pueden variar según las características evalua das y el país de origen.
Las mujeres con AOS presentan una menor gravedad de AOS, pero pre sentan una mayor frecuencia de excesiva somnolencia diurna y sueño frag mentado. Es necesario incorporar más información sobre el impacto de la AOS y de su tratamiento en este subgrupo de sujetos.
1. Veasey SC, Rosen IM. Obstructive Sleep Apnea in Adults. N Engl J Med. 2019;380(15):14421449.
2. Malhotra A, White DP. Obstructive sleep apnoea. Lancet. 2002;360(9328):237-245.
3. Faria A, Allen AH, Fox N, Ayas N, Laher I. The public health burden of obstructive sleep apnea. Sleep Sci. 2021;14(3):257-265.
4. Benjafield AV, Ayas NT, Eastwood PR, Heinzer R, Ip MSM, Morrell MJ, et al. Estimation of the global prevalence and burden of obstructive sleep apnoea: a literature-based analysis. Lancet Respir Med. 2019;7(8):687-698.
5. Qaseem A, Holty JE, Owens DK, Dallas P, Starkey M, Shekelle P. Management of obstructive sleep apnea in adults: A clinical practice guideline from the American College of Physicians. Ann Intern Med. 2013;159(7):471-483.
6. Yu J, Zhou Z, McEvoy RD, Anderson CS, Rodgers A, Perkovic V, et al. Association of Positive Airway Pressure With Cardiovascular Events and Death in Adults With Sleep Apnea: A Sys tematic Review and Meta-analysis. JAMA. 2017;318(2):156-166.
7. Javaheri S, Martinez-Garcia MA, Campos-Rodriguez F. CPAP Treatment and Cardiovascu lar Prevention: We Need to Change the Design and Implementation of Our Trials. Chest. 2019;156(3):431-437.
8. Chen X, Wang R, Zee P, Lutsey PL, Javaheri S, Alcantara C, et al. Racial/Ethnic Diffe rences in Sleep Disturbances: The Multi-Ethnic Study of Atherosclerosis (MESA). Sleep. 2015;38(6):877-888.
9. Martinez-Garcia MA, Labarca G. Obstructive sleep apnea in women: scientific evidence is urgently needed. J Clin Sleep Med. 2022;18(1):1-2.
10. Pevernagie DA, Gnidovec-Strazisar B, Grote L, Heinzer R, McNicholas WT, Penzel T, et al. On the rise and fall of the apnea-hypopnea index: A historical review and critical appraisal. J Sleep Res. 2020;29(4):e13066.
11. Campos-Rodriguez F, Martinez-Garcia MA, De la Cruz-Moron I, Almeida-Gonzalez C, Cata lan-Serra P, Montserrat JM. Cardiovascular mortality in women with obstructive sleep apnea with or without continuous positive airway pressure treatment: a cohort study. Ann Intern Med. 2012;156(2):115-122.
12. Marin JM, Carrizo SJ, Vicente E, Agusti AG. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. Lancet. 2005;365(9464):1046-1053.
13. Peker Y, Glantz H, Eulenburg C, Wegscheider K, Herlitz J, Thunstrom E. Effect of Positi ve Airway Pressure on Cardiovascular Outcomes in Coronary Artery Disease Patients with Nonsleepy Obstructive Sleep Apnea. The RICCADSA Randomized Controlled Trial. Am J Res pir Crit Care Med. 2016;194(5):613-620.
14. Sanchez-de-la-Torre M, Sanchez-de-la-Torre A, Bertran S, Abad J, Duran-Cantolla J, Ca briada V, et al. Effect of obstructive sleep apnoea and its treatment with continuous po sitive airway pressure on the prevalence of cardiovascular events in patients with acu te coronary syndrome (ISAACC study): a randomised controlled trial. Lancet Respir Med. 2020;8(4):359-367.
15. McEvoy RD, Antic NA, Heeley E, Luo Y, Ou Q, Zhang X, et al. CPAP for Prevention of Cardio vascular Events in Obstructive Sleep Apnea. N Engl J Med. 2016;375(10):919-931.
16. Labarca G, Dreyse J, Drake L, Jorquera J, Barbe F. Efficacy of continuous positive airway pressure (CPAP) in the prevention of cardiovascular events in patients with obstructive sleep apnea: Systematic review and meta-analysis. Sleep Med Rev. 2020;52:101312.
17. Labarca G, Reyes T, Jorquera J, Dreyse J, Drake L. CPAP in patients with obstructive sleep apnea and type 2 diabetes mellitus: Systematic review and meta-analysis. Clin Respir J. 2018;12(8):2361-2368.
18. Traaen GM, Aakeroy L, Hunt TE, Overland B, Bendz C, Sande LO, et al. Effect of Continuous Positive Airway Pressure on Arrhythmia in Atrial Fibrillation and Sleep Apnea: A Randomized Controlled Trial. Am J Respir Crit Care Med. 2021;204(5):573-582.
19. Zinchuk A, Yaggi HK. Phenotypic Subtypes of OSA: A Challenge and Opportunity for Preci sion Medicine. Chest. 2020;157(2):403-420.
20. Malhotra A, Ayappa I, Ayas N, Collop N, Kirsch D, McArdle N, et al. Metrics of sleep apnea severity: beyond the apnea-hypopnea index. Sleep. 2021;44(7).
21. Silveira MG, Lloberes P. Cluster Analysis to Identify Apnea-Hypopnea Syndrome Phenotypes: Where Are We Heading? Arch Bronconeumol (Engl Ed). 2020;56(11):689-690.
22. Martinez-Garcia MA, Labarca G. Sleep apnea phenotypes: do not forget the external valida tion. Sleep. 2021;44(12).
23. Johns MW. Sleepiness in different situations measured by the Epworth Sleepiness Scale. Sleep. 1994;17(8):703-710.
24. Crook S, Sievi NA, Bloch KE, Stradling JR, Frei A, Puhan MA, et al. Minimum important di fference of the Epworth Sleepiness Scale in obstructive sleep apnoea: estimation from three randomised controlled trials. Thorax. 2019;74(4):390-396.
25. Dauvilliers Y, Verbraecken J, Partinen M, Hedner J, Saaresranta T, Georgiev O, et al. Pitoli sant for Daytime Sleepiness in Patients with Obstructive Sleep Apnea Who Refuse Conti nuous Positive Airway Pressure Treatment. A Randomized Trial. Am J Respir Crit Care Med. 2020;201(9):1135-1145.
26. Ye L, Pien GW, Ratcliffe SJ, Bjornsdottir E, Arnardottir ES, Pack AI, et al. The different clinical faces of obstructive sleep apnoea: a cluster analysis. Eur Respir J. 2014;44(6):1600-1607.
27. Keenan BT, Kim J, Singh B, Bittencourt L, Chen NH, Cistulli PA, et al. Recognizable clinical subtypes of obstructive sleep apnea across international sleep centers: a cluster analysis. Sleep. 2018;41(3).
28. Kim J, Keenan BT, Lim DC, Lee SK, Pack AI, Shin C. Symptom-Based Subgroups of Koreans With Obstructive Sleep Apnea. J Clin Sleep Med. 2018;14(3):437-443.
29. Mazzotti DR, Keenan BT, Lim DC, Gottlieb DJ, Kim J, Pack AI. Symptom Subtypes of Obs tructive Sleep Apnea Predict Incidence of Cardiovascular Outcomes. Am J Respir Crit Care Med. 2019;200(4):493-506.
30. Allen AH, Beaudin AE, Fox N, Raneri JK, Skomro RP, Hanly PJ, et al. Symptom subtypes and cognitive function in a clinic-based OSA cohort: a multi-centre Canadian study. Sleep Med. 2020;74:92-98.
31. Labarca G, Dreyse J, Salas C, Letelier F, Jorquera J. A Validation Study of Four Different Cluster Analyses of OSA and the Incidence of Cardiovascular Mortality in a Hispanic Popu lation. Chest. 2021;160(6):2266-2274.
32. Gonzalez KA, Tarraf W, Wallace DM, Stickel AM, Schneiderman N, Redline S, Patel SR, Gallo LC, Mossavar-Rahmani Y, Daviglus ML, Zee PC, Talavera GA, Sotres-Alvarez D, González HM, Ramos A. Phenotypes of obstructive apnea in the Hispanic Community Health Study/ Study of Latinos. Sleep. 2021;Accepted.
33. Tempaku PF, Oliveira ESL, Guimaraes TM, De Aguiar Vidigal T, D'Almeida V, Andersen ML, et al. The reproducibility of clinical OSA subtypes: a population-based longitudinal study. Sleep Breath. 2022.
34. Allen AJH, Jen R, Mazzotti DR, Keenan BT, Goodfellow SD, Taylor CM, et al. Symptom sub types and risk of incident cardiovascular and cerebrovascular disease in a clinic-based obstructive sleep apnea cohort. J Clin Sleep Med. 2022.
35. Mazzotti DR, Keenan BT, Thorarinsdottir EH, Gislason T, Pack AI. Is the Epworth Sleepiness Scale Sufficient to Identify the Excessively Sleepy Subtype of OSA? Chest. 2022;161(2):557561.
36. Sweetman A, Lack L, McEvoy RD, Smith S, Eckert DJ, Osman A, et al. Bi-directional re lationships between co-morbid insomnia and sleep apnea (COMISA). Sleep Med Rev. 2021;60:101519.
37. Lechat B, Appleton S, Melaku YA, Hansen K, McEvoy RD, Adams R, et al. The association of co-morbid insomnia and sleep apnea with prevalent cardiovascular disease and incident cardiovascular events. J Sleep Res. 2022:e13563.
38. Zinchuk AV, Gentry MJ, Concato J, Yaggi HK. Phenotypes in obstructive sleep apnea: A defi nition, examples and evolution of approaches. Sleep Med Rev. 2017;35:113-123.
39. Silveira MG, Sampol G, Mota-Foix M, Ferrer J, Lloberes P. Cluster-derived obstructive sleep apnea phenotypes and outcomes at 5-year follow-up. J Clin Sleep Med. 2022;18(2):597607.
40. Zhu Z, Guo KD, Wu YH, Chen R. Clinical phenotypes of patients with obstructive sleep ap nea-hypopnea syndrome: a cluster analysis. Chin Med J (Engl). 2021;134(18):2240-2242.
41. Labarca G, Dreyse J, Salas C, Schmidt A, Rivera F, Letelier F, et al. A clinic-based cluster analysis in patients with moderate-severe obstructive sleep apnea (OSA) in Chile. Sleep Med. 2020;73:16-22.
42. Bailly S, Grote L, Hedner J, Schiza S, McNicholas WT, Basoglu OK, et al. Clusters of sleep apnoea phenotypes: A large pan-European study from the European Sleep Apnoea Databa se (ESADA). Respirology. 2021;26(4):378-387.
43. Zhang XL, Zhang L, Li YM, Xiang BY, Han T, Wang Y, et al. Multidimensional assessment and cluster analysis for OSA phenotyping. J Clin Sleep Med. 2022.
44. Van Overstraeten C, Andreozzi F, Youssef SB, Bold I, Carlier S, Gruwez A, et al. Obstructive Sleep Apnea Syndrome Phenotyping by Cluster Analysis: Typical Sleepy, Obese Middle-aged Men with Desaturating Events are A Minority of Patients in A Multi-ethnic Cohort of 33% Women. Curr Med Sci. 2021;41(4):729-736.
45. Romero-Peralta S, Garcia-Rio F, Resano Barrio P, Viejo-Ayuso E, Izquierdo JL, Sabroso R, et al. Defining the Heterogeneity of Sleep Apnea Syndrome: A Cluster Analysis With Implica tions for Patient Management. Arch Bronconeumol. 2022;58(2):125-134.
46. Mazzotti DR, Lim DC, Sutherland K, Bittencourt L, Mindel JW, Magalang U, et al. Opportuni ties for utilizing polysomnography signals to characterize obstructive sleep apnea subtypes and severity. Physiol Meas. 2018;39(9):09TR1.
47. Lim DC, Mazzotti DR, Sutherland K, Mindel JW, Kim J, Cistulli PA, et al. Reinventing polysom nography in the age of precision medicine. Sleep Med Rev. 2020;52:101313.
48. Labarca G, Gower J, Lamperti L, Dreyse J, Jorquera J. Chronic intermittent hypoxia in obs tructive sleep apnea: a narrative review from pathophysiological pathways to a precision clinical approach. Sleep Breath. 2020;24(2):751-760.
49. Azarbarzin A, Ostrowski M, Hanly P, Younes M. Relationship between arousal intensity and heart rate response to arousal. Sleep. 2014;37(4):645-653.
50. Azarbarzin A, Sands SA, White DP, Redline S, Wellman A. The hypoxic burden: a novel sleep apnoea severity metric and a predictor of cardiovascular mortality-Reply to’The hypoxic burden: also known as the desaturation severity parameter'. Eur Heart J. 2019;40(35):2994- 2995.
51. Azarbarzin A, Sands SA, Younes M, Taranto-Montemurro L, Sofer T, Vena D, et al. The Sleep Apnea-Specific Pulse-Rate Response Predicts Cardiovascular Morbidity and Mortality. Am J Respir Crit Care Med. 2021;203(12):1546-1555.
52. Zinchuk AV, Jeon S, Koo BB, Yan X, Bravata DM, Qin L, et al. Polysomnographic phenotypes and their cardiovascular implications in obstructive sleep apnoea. Thorax. 2018;73(5):472480.
53. Labarca G, Jorquera J, Dreyse J, Salas C, Letelier F. Hypoxemic features of obstructive sleep apnea and the risk of mortality: a cluster analysis. Sleep Breath. 2021;25(1):95-103.
54. Azarbarzin A, Sands SA, Taranto-Montemurro L, Vena D, Sofer T, Kim SW, et al. The Sleep Apnea-Specific Hypoxic Burden Predicts Incident Heart Failure. Chest. 2020;158(2):739750.
55. Tan BKJ, Teo YH, Tan NKW, Yap DWT, Sundar R, Lee CH, et al. Association of obstructive sleep apnea and nocturnal hypoxemia with all-cancer incidence and mortality: a systematic review and meta-analysis. J Clin Sleep Med. 2022;18(5):1427-1440.
56. Bouloukaki I, Tsiligianni I, Schiza S. Evaluation of Obstructive Sleep Apnea in Female Pa tients in Primary Care: Time for Improvement? Med Princ Pract. 2021;30(6):508-514.
57. Morris JL, Mazzotti DR, Gottlieb DJ, Hall MH. Sex differences within symptom subtypes of mild obstructive sleep apnea. Sleep Med. 2021;84:253-258.
58. Beaudreau SA, Spira AP, Stewart A, Kezirian EJ, Lui LY, Ensrud K, et al. Validation of the Pittsburgh Sleep Quality Index and the Epworth Sleepiness Scale in older black and white women. Sleep Med. 2012;13(1):36-42.
59. Labarca G, Dreyse J, Salas C, Gaete MI, Jorquera J. Performance of instruments aimed at detecting obstructive sleep apnea syndrome among individuals in Chile. J Bras Pneumol. 2019;46(1):e20190015.
60. Patel D, Tsang J, Saripella A, Nagappa M, Islam S, Englesakis M, et al. Validation of the STOP questionnaire as a screening tool for OSA among different populations: a systematic review and meta-regression analysis. J Clin Sleep Med. 2022;18(5):1441-1453.
61. Heinzer R, Vat S, Marques-Vidal P, Marti-Soler H, Andries D, Tobback N, et al. Prevalence of sleep-disordered breathing in the general population: the HypnoLaus study. Lancet Respir Med. 2015;3(4):310-318.
62. Tasali E, Chapotot F, Leproult R, Whitmore H, Ehrmann DA. Treatment of obstructive sleep apnea improves cardiometabolic function in young obese women with polycystic ovary syn drome. J Clin Endocrinol Metab. 2011;96(2):365-374.
63. Facco FL, Redline S, Hunter SM, Zee PC, Grobman WA, Silver RM, et al. Sleep disordered Breathing in Pregnancy and after Delivery: Associations with Cardiometabolic Health. Am J Respir Crit Care Med. 2022;205(10):1202-1213.
64. Campos-Rodriguez F, Queipo-Corona C, Carmona-Bernal C, Jurado-Gamez B, CorderoGuevara J, Reyes-Nunez N, et al. Continuous Positive Airway Pressure Improves Quality of Life in Women with Obstructive Sleep Apnea. A Randomized Controlled Trial. Am J Respir Crit Care Med. 2016;194(10):1286-1294.
Tabla 1. Principales preguntas incluidas en el cuestionario de síntomas de la apnea del sueño (adaptada de referencias 29 y 31)



Figura 1. Principales variables incluidas en los subtipos basados en característi cas clínicas en apnea obstructiva del sueño

El panel A muestra un sujeto con eventos respiratorios registrados por la cánula nasal, con un IAH de 32 eventos/hora; el panel B muestra la carga hipóxica por evento y la carga hipóxica total baja (2% y 64% respectivamente). En el panel C se muestra el mismo IAH, pero con una carga hipóxica por evento y carga total elevada (4% y 128% respectivamente).

PRESENTE Y FUTURO DE LA APNEA OBSTRUCTIVA DEL SUEÑO
MÁS ALLÁ DEL ÍNDICE DE APNEAS-HIPOPNEAS EN EL DIAGNÓSTICO DE LA APNEA DEL SUEÑO
Autora
Maria del Pilar Bañuls Polo
Según la última clasificación internacional de trastornos del sueño (ISD-3), el término Apnea Obstructiva del Sueño (AOS) se aplica tanto a la presencia de un número limitado de eventos respiratorios de predominio obstructivo por hora de sueño (5/h) acompaña dos de signos y síntomas diurnos como a las consecuencias patológicas de la presencia de dichos eventos o a la presencia de más de 15 eventos por hora de predominio obstructivo. Sin embargo, el índice de eventos que define la enfermedad presenta una serie de incongruencias que aconsejan revisar sus puntos fuertes y sus puntos débiles, así como introducir nuevas medidas de evaluación de la gravedad.
El primer criterio de normalidad se estableció comparando series cortas de sujetos sanos con pacientes con clínica utilizando polisomnografía con termistor en el montaje. Se estableció la normalidad en 5 apneas por hora o, con más precisión, 30 apneas por estudio completo¹. El criterio de gravedad se estableció en 30 apneas por hora para la agrupación de pacientes que presentaban hipertensión más grave². En los índices basados en la polisomnografía, el tiempo que se toma como denominador es el tiempo de sueño total (TST).
Con posterioridad, se añadió a este índice la presencia de hipopneas, si bien su defini ción es arbitraria y, además, ha ido cambiando con el tiempo (Tabla I)
La mayor precisión de los métodos diagnósticos y el umbral más bajo del criterio diag nóstico de las hipopneas (3% y/o microdespertares) han llevado a que dos grandes estudios epidemiológicos europeos muestren prevalencias extraordinariamente altas de AOS (24% en mujeres y 49,9% en hombres)3 .
Sobre estas variaciones, se introdujeron además en el manejo convencional de la AOS los estudios simplificados domiciliarios (PRD), que incluyen una gran variedad de mon tajes que oscilan entre 2 canales y equipos más sofisticados que recogen variables cardiorrespiratorias. El hecho de que estos equipos domiciliarios utilicen como denomi nador el tiempo de grabación correcto puede infraestimar el índice en un 20%4
Por ello, la AAS propone el uso del índice de eventos respiratorios (IER), en el que se incluyen los RERA (eventos discernibles que no cumplen criterio de apnea o hipopnea) y el tiempo en cama en lugar de TST. No obstante, las nuevas tecnologías permiten una precisión en la estimación de la presencia de sueño en casa, por EEG simplificado o extrapolado de otras señales, que aporta una buena correlación entre los IAH obtenidos en domicilio y por PSG convencional, con la ventaja añadida para los primeros de evitar los sesgos de laboratorio y posibilitar el registro de múltiples noches.
A pesar de todas estas variaciones en los métodos de medición, se mantienen los puntos de corte en la definición, tanto si el valor se ha obtenido mediante polisomno grafía convencional como mediante estudios de menor nivel. Además, no hay valores específicos para los diferentes grupos de edad ni para hombres respecto a mujeres.
En el cálculo del IAH se da el mismo valor al colapso completo de la vía aérea que al parcial, si bien cabe decir que existen muy pocas pruebas acerca de la relevancia de las diferencias en cuanto a las consecuencias de los diferentes tipos de eventos.
Aunque en la explicación fisiopatológica de la repercusión cardiovascular de la apnea del sueño aparece la hipoxia cíclica, el IAH establece un punto de corte arbitrario y cambiante para la desaturación (entre el 3 y el 4%), y no tiene en cuenta la potencial repercusión ni de la duración ni de la profundidad de dichas desaturaciones. Como consecuencia de esto, cuenta igual una desaturación del 5% y 15 segundos que una de 2 minutos de hasta el 10%, por ejemplo (Figura 1)
Por último el IAH es un valor único que no aporta información de la distribución de los eventos durante la noche. Por ello, un paciente que tenga 100 eventos en las primeras 2 horas de sueño de un estudio con un TST de 5 horas tendría un IAH 20/h, igual que el de un paciente con 20 eventos cada hora durante un estudio de la misma duración. Sin embargo, en el primer caso quedaran 3 horas de sueño reparador. El intento de mejorar esta limitación mediante la discriminación de IAH posicional o la distribución de IAH en sueño nREM-REM no la resuelve por completo.
En los más de 30 años transcurridos desde la primera descripción del IAH, se ha acu mulado una gran cantidad de datos que asocian la gravedad de la apnea del sueño con resultados clínicos, tanto en síntomas y alteraciones metabólicas como en riesgo car diovascular. Sin embargo, las limitaciones metodológicas inherentes a la construcción del índice hacen que no consiga expresar los cambios fisiológicos que subyacen bajo las alteraciones conductuales, neurocognitivas, metabólicas y clínicas.
A continuación se analiza la utilidad del IAH en la predicción de los principales puntos a observar en la apnea del sueño:
Somnolencia diurna. Es un síntoma principal de AOS, presente en aproximadamente el 40% de los pacientes5. Existen diferencias en cuanto a presencia de hipersomnia diurna según las comorbilidades: es mucho más frecuente en asma que en insufi ciencia cardiaca o fibrilación auricular6. La presencia de hipersomnia diurna es más frecuente cuando aumenta la gravedad de la AOS medida por IAH desde las etapas más leves de la enfermedad7. Sin embargo, la gravedad de la hipersomnia al diagnóstico es el mejor predictor de su posible mejora con el tratamiento.
Calidad de vida. Existen pocos datos que apoyen la relación que aparentemente existe entre la calidad de vida y el IAH. La cohorte SHHHS demuestra disminución en varios ámbitos de la calidad de vida en los pacientes con IAH-4% mayor de 30/h: estado físico, dolor, percepción general de salud, vitalidad y salud mental8. En un estudio observa cional basado en población norteamericana (WSC), el aumento de IAH se relacionó con menor puntuación en la calidad de vida9 .
Siniestralidad de tráfico. Múltiples estudios relacionan la AOS con un aumento de los accidentes de tráfico, y un metanálisis confirma que los pacientes con AOS presen tan un aumento significativo de accidentes de tráfico comparados con no AOS10. Sin embargo, no hay datos concluyentes en cuanto a la relación de los accidentes con la gravedad de la enfermedad medida por IAH.
Hipertensión. La AOS se asocia indudablemente con la HTA tanto incidente como pre valente, con relación lineal entre la cifras de HTA e IAH. Esta relación se mantiene cuando se ajusta por índice de masa corporal, sexo y edad. El aumento de IAH se relaciona con el aumento de la presión tanto sistólica como diastólica y como la media. Algunos datos de análisis multivariante muestran que el IAH-4% mayor de 30/h está más relacionado con la hipertensión que el sexo masculino o el índice de masa corporal mayor de 30/h¹¹.
Enfermedad coronaria. Existen numerosos estudios dirigidos a establecer la relación entre AOS y EC. Algunos estudios que comparan pacientes con EC con pacientes sin EC muestran una asociación independiente con IAH mayor de 10/h, tanto en hombres como en mujeres12 14. Sin embargo, esta asociación no se mantiene en los estudios poblacionales (SHHS), en los que, tras ajustar con otros factores de riesgo cardiovas cular, la relación entre la AOS medida por IAH se mantiene solo en hombres por debajo de 70 años.
Ictus. Los estudios de prevalencia en pacientes afectos de ictus muestran una fuerte asociación, con prevalencia de hasta 70% (IAH >5/h) y 30% de AOS grave (IAH >30%). En los estudios de cohortes poblacionales se mantiene una asociación mayor que con EC solamente en hombres, y se debilita tras ajustar por IMC, para IAH >15/h15.
Mortalidad. El riesgo de mortalidad asociado a IAH >15/h es similar a otros factores de riesgo, como el ser fumador, DM o HTA, y aumenta para IAH mayor de 30/h16. En los estudios observacionales de cohortes, esta asociación es más fuerte para sujetos de sexo masculino por debajo de 70 años.
Respuesta a tratamiento con CPAP. Numerosos estudios reflejan la mejoría del riesgo cardiovascular y los objetivos clínicos en los pacientes con AOS adherentes a CPAP. Sin embargo, el IAH como medida de gravedad de la enfermedad no es un predictor fiable de adherencia al tratamiento17 .
El fracaso del IAH a la hora de establecer una relación fiable entre la gravedad de la AOS y los hallazgos clínicos o el riesgo cardiovascular llevan a la necesidad de buscar medidas alternativas. Dado que un estudio convencional de PSG contiene más de 1G de datos que en la práctica pueden verse reducidos a un solo parámetro a la hora de tomar decisiones clínicas, se han propuesto nuevos índices derivados de los estudios de sueño tradicionales, a fin de mejorar la estimación de la gravedad del síndrome y su relación con los objetivos clínicos.
Una de las mayores limitaciones teóricas del IAH es que no tiene en cuenta ni la du ración de los eventos ni la profundidad de las caídas de la SpO2. La hipoxia cíclica se ha asociado a un incremento de la enfermedad cardiovascular asociada a AOS. Se han definido nuevos índices que reflejan estos parámetros.
Es el índice de carga hipóxica específico para la apnea del sueño (SASHB). Se define como el área bajo la curva, por debajo de la línea de SpO2, asociada a eventos respira torios. La SpO2 basal se establece para cada evento. Se toma el valor de SpO2 máximo registrado en los 100 segundos previos al final de cada evento. Al no tener en cuenta la SpO2 en vigilia, al calcular el área bajo la curva, el SASHB refleja la hipoxemia relacio nada específicamente con la apnea del sueño excluyendo otras causas que disminui rían la SpO2 de base. El SASHB se expresa en %min/hora; por ej. un SASHB 50% se considera la disminución de 5% SpO2 durante 10 min cada hora de sueño (Figura 1).
El criterio de normalidad de SASHB se estableció en 2 grandes cohortes: SHHS y MrOS18. El análisis por quintiles de las mismas muestras encontró19 un aumento del
riesgo de mortalidad por todas las causas CV en los pacientes que tenían el SASHB más alto. En un segundo estudio por comparación con el IAH, se calculó el punto de corte en el percentil 75 de la población, que corresponde con los pacientes con IAH >15/h, que a su vez está relacionado con un aumento de los eventos cardiovasculares. Este corte corresponde a 75,2%min/h y crea dos categorías: SASHB bajo y SASHB elevado.
En este estudio se demuestra una asociación entre AOS e insuficiencia cardiaca (HF), que se mantiene significativa estadísticamente para el grupo de hombres, con la AOS medida por SASHB tras ajustar el riesgo para otros factores de confusión.
En el Multi-Ethnic Study of Atherosclerosis Sleep Ancillary Study, se evaluaron variables demográficas, socioeconómicas, parámetros de calidad percibida de sueño, horas de sueño medidas con actigrafía y PSG convencional. Se encontró que los pacientes con AOS más grave medida por la combinación IAH+SASHB y aquellos en que la duración del sueño era muy corta se asociaban con mayor prevalencia de enfermedad renal crónica moderada-grave20 .
El SASHB tiene como punto fuerte que se puede calcular a partir de los estudios de sueño convencionales y de manera automática, y además, que ha demostrado predecir la presencia y el riesgo de enfermedad cardiovascular mejor que el IAH.
La carga hipóxica corresponde al tiempo pasado durante la noche con SpO2 por de bajo del 90%. Es un parámetro clásico en el estudio de la oximetría nocturna que no discrimina la hipoxia inducida por otras enfermedades de la relacionada con la apnea del sueño. La Tc90% prolongada se ha asociado a muerte cardiovascular en pacientes mayores21 y a aumento de la masa muscular del ventrículo izquierdo, y es predictor de arteriosclerosis.
Es un índice novedoso que se calcula como el sumatorio de los productos del área bajo la curva de SpO2 asociada a cada evento respiratorio por el tiempo de duración y dividiendo dicho sumatorio entre el tiempo total de sueño.
Difiere del SASHB en que tiene en cuenta la duración de cada evento. Se encontró que este índice se correlaciona mejor que el IAH en pacientes graves con peor situación clínica. La GO mejora menos que el IAH tras la pérdida de peso. Tras ajustar el IAH por este nuevo índice, se obtuvo una mejor correlación de la gravedad del índice con la presencia de enfermedad cardiovascular22 .
La intensidad y duración de los microdespertares asociados a la apnea del sueño es muy variable. Así, algunos son sutiles e incluso no detectables según el criterio clásico, mientras que otros llevan al despertar completo. La intensidad media de los despertares no se asocia a la magnitud del evento respiratorio previo, pero sí se asocia con la dura ción del despertar y al cambio de la presión de la epiglotis, y se relaciona negativamente con el IMC. Estos hallazgos son compatibles con que la intensidad del despertar sea un rasgo fisiopatológico distintivo. La respuesta de los músculos respiratorios y faríngeos aumenta junto con la intensidad de los microdespertares, lo que hace que estos pacien tes tengan un control de la respiración más inestable.
Estos microdespertares no detectables por el EEG convencional se asocian a frag mentación del sueño y síntomas diurnos, y también se han asociado a aumento de la respuesta de la frecuencia cardiaca a los eventos obstructivos, que a su vez se ha relacionado con aumento de los eventos cardiovasculares, fatales y no fatales.
Acoplamiento cardiopulmonar: Este método basado en la monitorización del electrocar diograma (ECG) ha ganado interés. Se basa en el acoplamiento de las variaciones de la frecuencia cardiaca (HRV) y las fluctuaciones del ECG producidas por la respiración, y permite cuantificar la calidad del sueño. Se considera estable el acoplamiento de alta frecuencia (HFC) e inestable el acoplamiento de baja frecuencia (LFC). Además, se ha visto que en pacientes con AOS tratados con presión positiva aumenta el HFC, lo cual le aporta un papel potencial en la monitorización del tratamiento de los pacientes con AOS.
Variabilidad de la frecuencia cardiaca (HVR)
El HRV refleja las variaciones en el sistema nervioso: se evalúan dos dominios: el domi nio tiempo y el dominio frecuencia. Ambos pueden usarse para analizar la actividad del sistema nervioso autónomo, lo que resulta de utilidad, ya que se altera con la disfunción autonómica de AOS.
Las alteraciones del HRV predisponen a alteraciones cardiovasculares. Un estudio re ciente mostró que las alteraciones del HRV se revierten con el tratamiento con CPAP, por lo que el índice puede ayudar en el diagnóstico y en la valoración de la eficacia del tratamiento con presión positiva23 .
Es un índice continuo que estima la profundidad del sueño, aunque varía de forma significativa en cada etapa de sueño y aunque, como todas las medidas de profundidad del sueño, tiene una gran variabilidad de una noche a otra.
A pesar de esto, los valores de ORP mejoran con el tratamiento con CPAP en pacientes con AOS.
Los niveles bajos se han relacionado bien con el aumento de tiempo de vigilia en AOS y movimiento periódico de piernas.
Al analizar este parámetro en la cohorte SHHS, se encontró que la correlación entre ORP interhemisferios cerebrales (coherencia de profundidad del sueño interhemisféri ca) puede ser un predictor de susceptibilidad para las consecuencias neurocognitivas de la AOS. Los pacientes con mayor coherencia tenían el menor riesgo de accidentes de tráfico a los dos años de la realización del estudio del sueño25
El uso de estos nuevos índices en combinación con la clínica y con los parámetros clásicos ofrece una oportunidad para estratificar mejor la gravedad de la AOS y sus consecuencias y, por lo tanto, para ofrecer un mejor manejo a los pacientes.
Introducción
Índice de apneas e hipopneas del sueño. Puntos fuertes y puntos débiles
Inexactitud en la construcción del índice
Limitaciones a la hora de discriminar la carga de los diferentes meca nismos fisiopatológicos
Utilidad del IAH
Otras medidas de gravedad de AOS Análisis respiratorio
Intensidad de los microdespertares
Otros índices
1. Guilleminault C. State of the art. Sleep and control of breathing. Chest. 1978;73(2):293, 297-299.
2. Young T, Peppard P, Palta M, Hla K. M, Finn L, Morgan B, Skatrud, J. Population-based study of sleep-disordered breathing as a risk factor for hypertension. Archives of Internal Medicine, 1997;157(15): 1746-1752.
3. Heinzer R, Vat S, Marques-Vidal P, Marti-Soler H, Andries D, Tobback N, Mooser V, Preisig M, Malhotra A, Waeber G, Vollenweider P, Tafti M, Haba-Rubio J. Prevalence of sleepdisordered breathing in the general population: the HypnoLaus study. Lancet Respir Med. 2015;3(4):310-318. doi: 10.1016/S2213.
4. Light MP, et al. Addition of frontal EEG to adult home sleep apnea testing: does a more accurate determination of sleep time make a difference? Sleep Breath. 2018;22(4):11791188.
5. Saaresranta T, et al.; ESADA Study Group. Clinical phenotypes and comorbidity in European sleep apnoea patients. PLoS One. 2016;11(10):e0163439.
6. Bonsignore MR, et al.; ESADA Study Group. Clinical presentation of patients with suspected obstructive sleep apnea and self-reported physician-diagnosed asthma in the ESADA cohort. J Sleep Res. 2018;27(6):e12729.
7. Kapur VK, et al. Sleepiness in patients with moderate to severe sleep-disordered breathing. Sleep. 2005;28(4):472-477.
8. Baldwin CM, et al. The association of sleep-disordered breathing and sleep symptoms with quality of life in the Sleep Heart Health Study. Sleep. 2001;24(1):96-105.
9. Finn L, et al. Sleep-disordered breathing and self-reported general health status in the Wisconsin Sleep Cohort Study. Sleep. 1998;21(7):701-706.
10. Tregear S, et al. Obstructive sleep apnea and risk of motor vehicle crash: systematic review and meta-analysis. J Clin Sleep Med. 2009;5(6):573-581.
11. Guillot M, et al. Association between severe obstructive sleep apnea and incident arterial hypertension in the older people population. Sleep Med. 2013;14(9):838-842.
12. Mooe T, et al. Sleep-disordered breathing in women: occurrence and association with coronary artery disease. Am J Med. 1996;101:251-256.
13. Mooe T, et al. Sleep-disordered breathing in men with coronary artery disease. Chest. 1996;109(3):659-663.
14. Peker Y, et al. An independent association between obstructive sleep apnoea and coronary artery disease. Eur Respir J. 1999;14(1):179-184.
15. Yaggi HK, et al. Obstructive sleep apnea as a risk factor for stroke and death. N Engl J Med. 2005;353(19):2034-2041.
16. Marshall NS, et al. Sleep apnea as an independent risk factor for all-cause mortality: the Busselton Health Study. Sleep. 2008;31(8):1079-1085.
17. Bakker JP, et al. Adherence to CPAP: What Should We Be Aiming For, and How Can We Get There? Chest. 2019;155(6):1272-1287. doi: 10.1016/j. chest.2019.01.012. Epub 2019 Jan 23. PMID: 30684472.
18. Azarbarzin A, et al. The hypoxic burden of sleep apnoea predicts cardiovascular diseaserelated mortality: the Osteoporotic Fractures in Men Study and the Sleep Heart Health Study. Eur Heart J. 2019;40(14):1149-1157. doi: 10.1093/eurheartj/ehy624. Erratum in: Eur Heart J. 2019;40(14):1157. PMID: 30376054; PMCID: PMC6451769.
19. Azarbarzin A, et al. The hypoxic burden of sleep apnoea predicts cardiovascular diseaserelated mortality: the Osteoporotic Fractures in Men Study and the Sleep Heart Health Study. Eur Heart J. 2019;40(14):1149-1157. doi: 10.1093/eurheartj/ehy624. Erratum in: Eur Heart J. 2019;40(14):1157. PMID: 30376054; PMCID: PMC6451769.
20. Jackson CL, et al. Multiple, objectively measured sleep dimensions including hypoxic burden and chronic kidney disease: findings from the Multi-Ethnic Study of Atherosclerosis. Thorax. 2021;76(7):704-713. doi: 10.1136/thoraxjnl-2020-214713. Epub 2020 Dec 4. PMID: 33277428; PMCID: PMC8175452.xxtt.
21. Baumert M, Immanuel SA, Stone KL, et al. Composition of nocturnal hypoxaemic burden and its prognostic value for cardiovascular mortality in older community-dwelling men. Eur Heart J. 2020;41(4):533-541. doi: 10.1093/eurheartj/ehy838. PMID:30590586; PMCID: PMC7850139.xx.
22. Muraja-Murro A, Kulkas A, et al. Adjustment of apnea-hypopnea index with severity of obstruction events enhances detection of sleep apnea patients with the highest risk of severe health consequences. Sleep and Breathing, 2014;18(3):641-647. doi:10.1007/ s11325-013-0927-z
23. Azarbarzin A, Ostrowski M, Hanly P, Younes M. Relationship between arousal intensity and heart rate response to arousal. Sleep. 2014;37(4):645-653. doi: 10.5665/sleep.3560. PMID: 24899756; PMCID: PMC4044744.
24. Cao W, Luo J, Xiao Y. A Review of Current Tools Used for Evaluating the Severity of Obstructive Sleep Apnea. Nat Sci Sleep. 2020;12:1023-1031. doi: 10.2147/NSS.S275252. PMID: 33239929; PMCID: PMC7680675.s
1978
Primera definición: > 5 apneas a la hora o > 30 apneas en 1 estudio
Guilleminault et al. Sleep apnea syndromes
1988
1999
Gould et al. Am Rev Respir Dis
Se describen las hipopneas. Pueden tener el mismo valor que las apneas a la hora de causar síntomas
AASM Task Force. Sleep “Chicago criteria”, caída del 50% en flujo o caída clara de la amplitud de flujo junto con desaturación O2 3% y/o arousal
2000
Redline et al. Am J Respir Crit Care Med
2005
AASM. International Classification of SleepDisorders, second edition (ICSD 2)
2007 AASM. The AASM manual for the scoring of sleep and associate d events. Rules, terminolo gy and technical specificati ons
Diferentes medidas de los eventos llevan a gran variabilidad a la hora de clasificar la AOS de forma diferente.
Segunda edición del ICSD. En esta versión, la AOS se define como la combinación de síntomas diurnos y nocturnos con un IAH por encima de la normalidad (per ejemplo, ≥ 5 per h) o a AHI ≥ 15 per hr, incluso sin síntomas relevantes.
2012
AASM. The AASM manual for the scoring of sleep and associated events. Rules, terminology and technical specifications, second edition
El AASM Scoring Manual (v 1.0) propone 2 reglas para hipopneas: "Recomendada" (30% caída de flujo + 4% desaturación) y "Alternativa" (3% desaturación y/o arousal)
El AASM Scoring Manual propone 2 reglas para hipopneas: "Recomendada" (30% caída de flujo + 3% desaturación y/o arousal) y "Opcional" (30% caída de flujo + 4% desaturación)
Hipoxia intermitente Tc90 Convencional SpO2
Sleep Apnea Specific Hipoxic burden Novedoso y disponible Flujo aéreo, SpO2
Gravedad de la obstrucción Novedoso Flujo aéreo, SpO2
Arousabilidad
Intensidad de los arousals Novedoso EEG
Producto ODS ratio Emergente EEG
Activ idad d simpátic a
Acoplamiento cardiopulmonar Emergente EKG 1 derivación
Var iabilidad de la frecuencia cardiaca Emergente EKG 1 derivación
Sin embargo, en la figura A la SpO2 mínima es de 89% y en la figura B las desaturacio nes son mucho más profundas (SpO2 min 60%).

Para el cálculo de SASHB de cada evento (banda roja), se considera una ventana de 100 s desde el fin de cada evento. La SpO2 máxima en ese periodo se considera la basal sobre la que calcular el área bajo la curva (sombreado azul).

LA TECNOLOGÍA QUE VIENE EN APNEA DEL SUEÑO. NUEVOS DISPOSITIVOS Y TELEMEDICINA
Irene Cano Pumarega
Aldara García Sánchez
Eva Mañas Baena
La apnea obstructiva del sueño (AOS) es una patología muy prevalente, pero con un alto infradiagnóstico. Se estima que afecta a casi mil millones de personas en todo el mundo¹. La polisomnografía (que incluye el registro de variables neurofisiológicas y cardiorrespiratorias) es el gold standard para el diagnóstico de la AOS, pero conlleva un coste significativo, pues requiere equipamiento, instalaciones y recursos humanos específicos y cualificados. Esto supone una disponibilidad y una accesibilidad limitadas y genera largas listas de espera. Por ello, hoy en día, la poligrafía respiratoria domicilia ria es el método diagnóstico más utilizado y se está investigando, de forma muy activa, para encontrar nuevos métodos diagnósticos simplificados, poco invasivos y automa tizados que permitan un mejor diagnóstico al proporcionar una mayor accesibilidad a un menor coste.
La AOS se caracteriza además por ser una enfermedad heterogénea con distintas etio logías subyacentes y una presentación clínica variada. El tratamiento habitual mediante presión positiva continua en las vías respiratorias (CPAP) es costo-efectivo, pero pre senta escasa adherencia2 y dista mucho de ser ideal en lo que respecta a las expecta tivas de la medicina personalizada y de precisión3. No obstante, los recientes avances en el conocimiento de la fisiopatología de la AOS y la investigación traslacional han abierto nuevas líneas de investigación, con diversas posibilidades para el tratamiento y el seguimiento de la AOS. Asimismo, las nuevas tecnologías y el uso de la telemedicina (impulsada por la pandemia del SARS-CoV-2) proporcionan procedimientos más pre cisos, sencillos y a distancia que permiten una gestión personalizada de los trastornos respiratorios del sueño.
Este capítulo resume los avances tecnológicos que han aparecido para la AOS, tanto para su diagnóstico como para su tratamiento y seguimiento, a los que sin duda se sumarán otros en breve plazo debido a la rápida evolución de la investigación y a los avances en salud electrónica e inteligencia artificial (IA). La implementación de la IA en el manejo de la AOS permite minimizar el coste asociado al diagnóstico y optimizar el tratamiento. No obstante, todavía existen barreras para la adopción de estas herra mientas.
La alta prevalencia de la AOS ha generado la necesidad pragmática de implementar métodos diagnósticos accesibles y que reduzcan el gasto sanitario, a fin de poder aten der la alta demanda diagnóstica4. En la tabla I se muestra un resumen de todos los métodos diagnósticos que se van a desarrollar a lo largo del presente capítulo.
Los dispositivos disponibles para el diagnóstico domiciliario de patología del sueño (ni vel 3) constituyen herramientas costo-eficientes que pueden ser accesibles de forma remota. Ofrecen una transmisión inalámbrica de los módulos de registro a la unidad principal colocada en el paciente mediante tecnología Bluetooth. Esta tecnología libera al usuario de varios cables, lo que mejora la comodidad para el paciente. Del mismo modo, se puede utilizar una aplicación que transmita los datos a un teléfono inteligente, tableta u ordenador para controlar la calidad de la señal, monitorizar al paciente de forma continua o realizar cambios en el dispositivo si el paciente lo requiere5
Los métodos de diagnóstico súper simplificados (uno o dos canales basados en oxime tría y/o flujo nasal) permiten diagnosticar la AOS mediante algoritmos matemáticos, sin precisar la lectura del registro por parte de un especialista en sueño. Algunos de estos dispositivos no utilizan las señales habituales (electromiografía, bandas, flujo), como el dispositivo WatchPAT® (Itamar Medical, Ltd)6. Se trata de un método diagnóstico de muñeca que utiliza la tecnología PAT®, que puede realizar la estadificación del sueño y de los eventos respiratorios por medio de algoritmos matemáticos a partir del tono arterial periférico, la frecuencia cardiaca, la actigrafía y la pulsioximetría. Gracias a la integración de datos demográficos y antropométricos, su precisión se ha mejorado7 . Otro algoritmo que ha demostrado mejorar la sensibilidad y la especificidad de las señales autonómicas y respiratorias registradas por un dispositivo portátil es el análisis cardiopulmonary coupling (CPC), que, utilizando el electrocardiograma o la fotopletis mografía, ha demostrado tener una precisión diagnóstica comparable a la de la poli somnografía: 100% de sensibilidad y 93,63% de especificidad8 .
La American Academy of Sleep Medicine (AASM) recomienda que un dispositivo do miciliario adecuado incorpore los siguientes sensores: presión nasal, pletismografía de inductancia respiratoria torácica y abdominal y oximetría; o bien tecnología PAT con oximetría y actigrafía9. En relación con los estudios simplificados con dispositivos de uno o dos canales basados en oximetría y/o presión nasal, el actual Documento Inter nacional de Consenso sobre AOS indica que pueden utilizarse ante una alta sospecha clínica de AOS, definida por excesiva somnolencia diurna (Epworth ≥ 12) y al menos 2 de los siguientes criterios: ronquido intenso, pausas de apnea e hipertensión arterial10 . Otra de las tecnologías aplicadas al diagnóstico de la AOS fue la desarrollada por Ali hanka et al11., quienes diseñaron sistemas de sensores basados en efectos electrostá ticos que usaban láminas sensibles a la presión (colocadas debajo de una manta de la cama) para registrar el sueño, la frecuencia cardíaca y la respiración durante el sueño, sin precisar ningún contacto con el paciente. Hoy en día, disponemos de sistemas muy pequeños y efectivos que hacen uso de la detección y el procesamiento de señales de alta calidad y están conectados de forma inalámbrica, generalmente mediante Blue tooth, a un sistema de grabación (como una tableta o un teléfono inteligente). De este modo, es posible registrar la frecuencia cardíaca y monitorizar el sueño de los pacientes con una gran precisión12
Otros tipos de sensores empleados en el diagnóstico de la AOS son los que utilizan reflexiones de ondas electromagnéticas13 14. Las ondas de radiofrecuencia, similares a la tecnología de radar, pueden detectar movimientos corporales muy pequeños, cau sados por los latidos del corazón y la respiración, incluso a través del edredón, de un sujeto dormido. Una vez más, estas señales de reflexión deben filtrarse y procesarse. Un procesamiento optimizado de las señales de movimiento permite a los médicos dis tinguir los estados de sueño y de vigilia, la apnea del sueño y la respiración normal. Así, se supervisa el sueño de personas mayores que vivan en residencias de ancianos, así como de pacientes hospitalizados, sin mucha interferencia con el sujeto. En el estudio de Han et al15. se muestran nuevos sensores cutáneos, conectados por vía telemática a un portátil, que pueden recoger muchas de las señales que se analizan durante los estudios del sueño tradicionales.
El campo que actualmente tiene más líneas de investigación abiertas es el del uso de los teléfonos y relojes inteligentes, debido a su gran accesibilidad por parte de la po blación. Se han desarrollado múltiples aplicaciones para teléfonos inteligentes con sen sores incorporados (por ejemplo, un pulsioxímetro), que captan datos de la saturación de oxígeno, movimientos respiratorios o la posición. Una de estas aplicaciones16, que utiliza la oximetría externa, el esfuerzo respiratorio utilizando el micrófono incorporado, así como el movimiento detectado mediante el acelerómetro del teléfono inteligente, obtuvo una sensibilidad del 100% y una especificidad del 85,7% en la clasificación de la apnea obstructiva del sueño. Los smartwatches van más allá de los teléfonos inteligentes con sensores externos, ya que estos relojes inteligentes, que se llevan en la muñeca, pueden captar señales corporales directamente sin que se conecten sensores adicionales. Un reloj inteligente con sensores de luz en la parte inferior puede grabar la señal de onda de pulso dondequiera que esté conectado el dispositivo y, mediante algoritmos sofisticados, determinar la frecuencia cardíaca y la saturación de oxígeno. Debido a la muy alta capacidad de almacenamiento digital de los teléfonos inteligentes (en comparación con los primeros dispositivos médicos digitales), es posible almacenar todos los datos de las señales en bruto. Dichos datos pueden evaluarlos posteriormente técnicos o médicos capacitados en sueño mediante el uso de la puntuación visual convencional o pueden evaluarse mediante un software de análisis del sueño. En este tipo de configuración, el teléfono inteligente sirve simplemente como un registrador de datos móvil, fácilmente disponible, con una gran capacidad de almacenamiento digital y una fácil comunicación con sensores externos conectados. La evaluación y el análisis de los datos seguirían siendo tradicionales, con una metodología de puntuación visual establecida y aceptada. Los datos deben transferirse a un centro especializado en patología del sueño. Una opción posible para realizar dicha transferencia de datos es la transmisión inalámbrica de los datos a un almacenamiento en la nube, de modo que el centro especializado pueda descargarlos de allí. Además, este almacenamiento de datos podría estar vinculado a una base de datos de salud personal. Desafortunada
mente, la mayoría de las aplicaciones de sueño disponibles en el mercado aún no han sido verificadas con un registro del sueño ni se han validado clínica y científicamente17 . Una reciente revisión sistemática y metanálisis sobre la utilidad clínica de los teléfonos inteligentes en la detección de la AOS moderada-grave18 encontró una sensibilidad combinada del 90% y una especificidad agrupada del 88%, lo que llevó a la conclusión de que el cribado de la AOS mediante teléfono inteligente sería útil para los pacientes con AOS de moderada a grave.
Uno de los dispositivos externos que funciona mediante una aplicación de teléfono inte ligente y del que se dispone de estudios que lo comparan con un polígrafo respiratorio es el wearable electrónico AcuPebble SA100, un pequeño dispositivo que se adhiere al cuello mediante un adhesivo desechable de calidad médica19. La funcionalidad del dispositivo se basa en el principio de detección acústica de una serie de de sonidos fisiológicos, incluidos los generados por los sistemas respiratorio y cardiovascular. Los resultados muestran que AcuPebble SA100 es preciso para diagnosticar AOS con una especificidad del 96,8% y una sensibilidad del 92,7%, además de gozar de una gran aceptación por parte de los pacientes y de ser muy sencillo de usar sin precisar entre namiento previo.
Por último, el uso de la inteligencia artificial (IA) crea una vía para el cribado y el diag nóstico de la AOS, y así reduce el coste y abre el camino hacia un tratamiento eficaz. La IA se está aplicando para la toma de decisiones que requieren el análisis de datos complejos, como establecer un diagnóstico, predecir resultados y decidir tratamientos. La técnica de IA más empleada en medicina es la de redes neuronales artificiales (RNA), que son programas analíticos informáticos diseñados para emular la estructura y el comportamiento del sistema nervioso biológico20. La red puede “aprender” durante el entrenamiento mediante la exposición a conjuntos de datos y sus resultados, mediante ajustes u optimizaciones posteriores de las conexiones entre las neuronas. Uno de los primeros estudios que examinó el uso de la IA en el diagnóstico de la AOS se centró en una red neuronal de regresión generalizada, entrenada con 23 variables clínicas21. Esta red neuronal demostró la capacidad de descartar con precisión la AOS a partir de datos clínicos, con una sensibilidad y una especificidad del 98,9% y el 80%, respectivamente. Este estudio introdujo los temas de cómo las redes neuronales podrían determinar si la polisomnografía era necesaria en pacientes sin diagnóstico de AOS y de cómo podría orientar hacia un estudio terapéutico en lugar de un estudio diagnóstico.
No obstante, se han identificado distintas barreras para la implementación de sistemas de inteligencia artificial (a nivel de tecnología, datos, regulación, recursos humanos, educación y cultura) que es necesario conocer y solucionar para su aplicación22 .
La innovación tecnológica en el manejo de la AOS nos ofrece diversas posibilidades para una mejor optimización y personalización del tratamiento23-24, las cuales se de tallan acontinuación y se resumen en la figura 1.
1. Inicio de CPAP con autoaprendizaje y control telemático.
2. Terapia miofuncional orofacial monitorizada a través de aplicaciones.
3. Dispositivo de avance mandibular con control de cumplimiento a través de aplica ción de teléfonos inteligentes.
4. Dispositivo postural con control de cumplimiento y posición corporal durante el sueño.
5. Estimulador del nervio hipogloso y musculatura orofaríngea con control telemático.
1. Inicio de CPAP con autoaprendizaje y control telemático
Cuando se prescribe tratamiento con CPAP, durante el periodo inicial de seguimiento es posible realizar el control a través de la telemedicina mediante la transmisión de infor mación sobre el tiempo de uso, el índice de apnea-hipopnea (IAH) y las fugas. A través de redes inalámbricas, los datos recopilados se envían a un servidor en la red, donde pueden ser recuperados por la Unidad de Sueño y por el paciente. Ello ofrece nuevas oportunidades para un mejor control al inicio del tratamiento con CPAP, periodo más complejo para el paciente y fundamental para la adherencia al tratamiento.
Asímismo, existen instrumentos para reforzar el aprendizaje, mediante aplicaciones de teléfonos inteligentes o videos explicativos para los pacientes. Estas innovaciones repercuten en una mejor adherencia al tratamiento y en una mayor optimización del tiempo por parte tanto del personal sanitario como de los pacientes25. No obstante, es necesario tener en cuenta que no existe una gran evidencia que demuestre la eficacia de la telemedicina de forma aislada para mejorar por sí sola el cumplimiento, lo cual pudiera deberse a diversos factores, como la variabilidad de estrategias o la disponibi lidad de los medios de tecnológicos26 .
La terapia miofuncional orofacial (TMO) es uno de los tratamientos alternativos para los trastornos respiratorios del sueño. Se basa en realizar ejercicios diarios utilizando los músculos orofaríngeos para favorecer la apertura de las vías respiratorias.
Uno de los aspectos más importantes para su eficacia es el buen cumplimiento, ya que es un tratamiento muy dependiente de la implicación del paciente. En este sentido, O’Connor y col27, publicaron los resultados de un estudio en el que mostraron que los ejercicios orofaciales realizados con una aplicación mHealth redujeron la gravedad y los síntomas de la AOS, y además incrementaron la adherencia en comparación con el grupo control. Kim et al28. desarrollaron, asimismo, un programa de apoyo a la TMO basado en la teoría de la autoeficacia, consistente en sesiones educativas, mensajes de texto móviles y sesiones de entrenamiento telefónico. También observaron un aumento significativo de la tasa de adherencia.
En dos metanálisis recientes que estudian la TMO29 30 concluyen la necesidad de dis poner de más estudios debido a las limitaciones de los mismos. A pesar de ello, la TMO es considerada una terapia alternativa para la AOS, especialmente en pacientes no obesos con AOS leve-moderada y como tratamiento concomitante con otras terapias10. La utilización de herramientas como las descritas facilita su correcto cumplimiento.
El dispositivo de avance mandibular (DAM) constituye una alternativa terapéutica en pacientes con AOS de cualquier gravedad con intolerancia a CPAP o en AOS leves o moderadas con sintomatología menor10. Sin embargo, existe incertidumbre sobre qué pacientes responderán a esta terapia en términos de reducción de la apnea, disminu ción de la somnolencia, disminución del riesgo de comorbilidades y aparición de efectos secundarios31. Por ello, resulta de gran utilidad realizar un seguimiento cercano de los pacientes que utilizan esta terapia. Al respecto, recientemente se han presentado unos DAM que monitorizan el cumplimento terapéutico a través de un microchip insertado en la férula. Éste, a través de la medición de la temperatura, detecta cuándo se está usando la férula. El software puede generar informes detallados que presentan horas de uso y posición cefálica durante el tiempo de registro. Con los datos obtenidos, se puede evaluar los hábitos de uso del paciente y comprobar el cumplimiento real del tratamiento32
El objetivo de la terapia posicional (TP) es evitar que el paciente con AOS posicional (AOSP) duerma en posición supina mediante un estímulo vibratorio que se emite al de tectar dicha posición. En los últimos años se han publicado diversos estudios, revisiones sistemáticas y metanálisis que sugieren que los dispositivos vibratorios de terapia posi cional podrían ser una terapia eficaz para reducir el IAH y el tiempo en posición supina
en los pacientes con AOSP33. Además, estos dispositivos presentan buena tolerancia, y algunos de ellos permiten monitorizar la eficacia y el cumplimiento diario a través de aplicaciones de teléfonos inteligentes que pueden consultar tanto el paciente como el facultativo, favoreciendo el seguimiento y la optimización de recursos34 .
5. Estimuladores del nervio hipogloso y musculatura orofaríngea, monitorización de cumplimiento y ajuste de parámetros
La estimulación del nervio hipogloso es una terapia para la AOS que consiste en la estimulación del nervio hipogloso mediante pulsos eléctricos para estimular la protusión de la lengua. Está indicado en pacientes con AOS moderada-grave (índice de apnea hi poapnea: 20- 50/h), intolerantes a CPAP y sin mejoría tras DAM, sin obesidad (índice de masa corporal <32 kg/m 2 ) y sin colapso circunferencial valorado por somnoscopia10
Dispone de una función integrada para supervisar diariamente el cumplimiento tera péutico. El paciente puede controlar el sistema con el mando a distancia, encendiendo, pausando en despertares y apagando al levantarse, de forma que lo ajusta a sus ritmos de sueño. Por otra parte, el sistema permite configurar los ajustes de la terapia dentro de unos límites previamente configurados por el especialista, para mejorar el confort del paciente35
Por último, aunque sólo se dispone de datos preliminares y todavía no se encuentra comercializado36, existe un nuevo dispositivo portátil para el tratamiento de la AOS que fortalece la musculatura orofaríngea por medio de estimulación electromagnética a través de electrodos colocados a nivel submandibular, cuya intensidad/frecuencia se ajustan por algoritmos con técnicas de inteligencia artificial.
La telemedicina aplicada a los trastornos respiratorios durante el sueño es una herra mienta emergente y necesaria. Según el documento de posicionamiento en este aspec to de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), es necesario que los profesionales que trabajan en las Unidades de Sueño se impliquen y contribuyan en el liderazgo de este cambio tecnológico37
Cabe mencionar que la literatura científica es, en parte, controvertida debido a que no existen suficientes estudios multicéntricos aleatorizados, con elevado número de pacientes y seguimiento a largo plazo. Además, los equipos y sistemas telemáticos en el mercado son diferentes. Como consecuencia, las recomendaciones se basan sobre todo en un consenso de profesionales expertos. Aunque la aplicación total de la tele medicina y su transferencia al sistema sanitario a gran escala aún no es posible, debe fomentarse su uso. Para ello, resultan imprescindibles la colaboración entre las empre sas fabricantes de equipos, las prestadoras de servicios y los profesionales sanitarios.
Las recomendaciones más importantes incluidas en el documento de posicionamien to37 son que la telemedicina con telemonitorización continua se destina, básicamente, a sujetos con problemas de desplazamiento o con domicilio lejano, a aquellos que no cumplan de forma adecuada el tratamiento con CPAP y en la mayoría de los casos con ventilación mecánica no invasiva. Un elemento clave es la individualización de los pacientes. Es imperativo que se cumplan los requisitos técnicos, legales y deontológi cos pertinentes (normativa de los productos sanitarios, protección de datos y consenti miento informado). En la figura 2 se puede observar un ejemplo de la aplicación de la telemedicina en la práctica diaria.
La alta prevalencia de la apnea obstructiva del sueño (AOS) ha generado la necesi dad de implementar nuevos dispositivos simplificados, poco invasivos y automatiza dos, que permitan un mejor diagnóstico al proporcionar una mayor accesibilidad a un menor coste y así poder atender la alta demanda diagnóstica.
Las nuevas tecnologías aplicadas al diagnóstico comprenden nuevos dispositivos domiciliarios con transmisión inalámbrica, dispositivos súper simplificados, senso res de presión y radiofrecuencia, teléfonos y relojes inteligentes y la aplicación de la inteligencia artificial mediante el uso de redes neuronales artificiales.
La innovación tecnológica en el manejo de la AOS nos ofrece diversas posibilidades para una mejor optimización y personalización del tratamiento: CPAP con telemoni torización, dispositivos de avance mandibular y dispositivos posturales con control de cumplimiento y posición a través de aplicación de teléfonos inteligentes, terapia miofuncional orofacial monitorizada a través de aplicaciones o estimulador del ner vio hipogloso y musculatura orofaríngea con control telemático.
La telemedicina (impulsada por la pandemia del SARS-CoV-2) es una herramienta emergente y necesaria que permite una gestión personalizada de los trastornos respiratorios del sueño y es aplicable en los procesos diagnósticos y terapéuticos y en el seguimiento de los pacientes con AOS.
1. Benjafield AV, Ayas NT, Eastwood PR, Heinzer R, Ip MSM, Morrell MJ, et al. Estimation of the global prevalence and burden of obstructive sleep apnoea: a literature-based analysis. Lancet Respir Med. 2019;7(8):687-698.
2. Weaver TE, Grunstein RR. Adherence to continuous positive airway pressure therapy: the challenge to effective treatment. Proc Am Thorac Soc. 2008;5(2):173-178.
3. Martinez-Garcia MA, Campos-Rodriguez F, Barbé F, Gozal D, Agustí A. Precision medicine in obstructive sleep apnoea. Lancet Respir Med. 2019;7(5):456-464.
4. Murphie P, Little S, McKinstry B, Pinnock H. Remote consulting with telemonitoring of continuous positive airway pressure usage data for the routine review of people with obstructive sleep apnoea hypopnoea syndrome: A systematic review. J Telemed Telecare. 2019;25(1):17-25.
5. Bruyneel M, Libert W, Ameye L, Ninane V. Comparison between home and hospital set- up for unattended home-based polysomnography: a prospective randomized study. Sleep Med. 2015;16(11):1434-1438.
6. Zhang Z, Sowho M, Otvos T, Sperandio LS, East J, Sgambati F, et al. A comparison of automated and manual sleep staging and respiratory event recognition in a portable sleep diagnostic device with in-lab sleep study. J Clin Sleep Med. 2020;16(4):563-573.
7. Loachimescu OC, Dholakia SA, Venkateshiah SB, Fields B, Samarghandi A, Anand N, et al. Improving the performance of peripheral arterial tonometry-based testing for the diagnosis of obstructive sleep apnea. J Investig Med. 2020;68(8):1370-1378.
8. Seo MY, Yoo J, Hwang SJ, Lee SH. Diagnosis of Obstructive Sleep Apnea in Adults Using the Cardiopulmonary Coupling-Derived Software-Generated Apnea-Hypopnea Index. Clin Exp Otorhinolaryngol. 2021;14(4):424-426.
9. Rosen IM, Kirsch DB, Carden KA, Malhotra RK, Ramar K, Aurora RN, et al. Clinical Use of a Home Sleep Apnea Test: An Updated American Academy of Sleep Medicine Position Statement. J Clin Sleep Med. 2018;14(12):2075-2077.
10. Mediano O, González Mangado N, Montserrat JM, Alonso-Álvarez ML, Almendros I, AlonsoFernández A, et al. [Translated article] International consensus document on obstructive sleep apnea. Arch Bronconeumol. 2022;58(1):T52-68.
11. Alihanka J, Vaahtoranta K, Saarikivi I. A new method for long-term monitoring of the ballistocardiogram, heart rate, and respiration. Am J Physiol. 1981;240(5).
12. Paalasmaa J, Toivonen H, Partinen M. Adaptive Heartbeat Modeling for Beat-to-Beat Heart Rate Measurement in Ballistocardiograms. IEEE J Biomed Heal informatics. 2015;19(6):1945-1952.
13. Penzel T, Schöbel C, Fietze I. New technology to assess sleep apnea: Wearables, smartphones, and accessories. F1000Research. 2018;7.
14. O’Hare E, Flanagan D, Penzel T, Garcia C, Frohberg D, Heneghan C. A comparison of radiofrequency biomotion sensors and actigraphy versus polysomnography for the assessment of sleep in normal subjects. Sleep Breath. 2015;19(1):91-98.
15. Han S, Kim J, Won SM, Ma Y, Kang D, Xie Z, et al. Battery-free, wireless sensors for full- body pressure and temperature mapping. Sci Transl Med. 2018;10(435).
16. Al-Mardini M, Aloul F, Sagahyroon A, Al-Husseini L. Classifying obstructive sleep apnea using smartphones. J Biomed Inform. 2014;52:251-259.
17. Patil SP, Ayappa IA, Caples SM, John Kimoff R, Patel SR, Harrod CG. Treatment of Adult Obstructive Sleep Apnea with Positive Airway Pressure: An American Academy of Sleep Medicine Clinical Practice Guideline. J Clin Sleep Med. 2019;15(2):335-343.
18. Kim DH, Kim SW, Hwang SH. Diagnostic value of smartphone in obstructive sleep apnea syndrome: A systematic review and meta-analysis. PLoS One. 2022;17(5):e0268585.
19. Devani N, Xaviero R, Pramono A, Anas Imtiaz S, Bowyer S, Rodriguez-Villegas E, et al. Accuracy and usability of AcuPebble SA100 for automated diagnosis of obstructive sleep apnoea in the home environment setting: an evaluation study. BMJ Open. 2021;11:46803.
20. Ramesh AN, Kambhampati C, Monson JRT, Drew PJ. Artificial intelligence in medicine. Ann R Coll Surg Engl. 2004;86(5):334-338.
21. Kirby SD, Danter W, George CFP, Francovic T, Ruby RRF, Ferguson KA. Neural network prediction of obstructive sleep apnea from clinical criteria. Chest. 1999;116(2):409-415.
22. Brennan HL, Kirby SD. Barriers of artificial intelligence implementation in the diagnosis of obstructive sleep apnea. J Otolaryngol Head Neck Surg. 2022;51(1).
23. Schutte-Rodin S. Telehealth, Telemedicine, and Obstructive Sleep Apnea. Sleep Med Clin. 2020;15(3):359-375.
24. Pépin J-L, Eastwood P, Eckert DJ. Novel avenues to approach non-CPAP therapy and implement comprehensive obstructive sleep apnoea care. Eur Respir J. 2022;59(6):2101788.
25. Verbraecken J. Telemedicine in Sleep-Disordered Breathing: Expanding the Horizons. Sleep Med Clin. 202;16(3):417-445.
26. Hwang D, Chang JW, Benjafield AV, Crocker ME, Kelly C, Becker KA, et al. Effect of Telemedicine Education and Telemonitoring on Continuous Positive Airway Pressure Adherence. The Tele-OSA Randomized Trial. Am J Respir Crit Care Med. 2018;197(1):117126.
27. O’Connor-Reina C, Ignacio Garcia JM, Ruiz ER, Del Carmen Morillo Dominguez M, Barrios VI, Jardin PB, et al. Myofunctional Therapy App for Severe Apnea-Hypopnea Sleep Obstructive Syndrome: Pilot Randomized Controlled Trial. JMIR mHealth uHealth. 2020;8(11).
28. Kim J, Oh EG, Choi M, Choi SJ, Joo EY, Lee H, et al. Development and evaluation of myofunctional therapy support program (MTSP) based on self-efficacy theory for patients with obstructive sleep apnea. Sleep Breath. 2020;24(3):1051-1058.
29. Rueda JR, Mugueta-Aguinaga I, Vilaró J, Rueda-Etxebarria M. Myofunctional therapy (oropharyngeal exercises) for obstructive sleep apnoea. Cochrane database Syst Rev. 2020;11(11).
30. Hsu B, Emperumal CP, Grbach VX, Padilla M, Enciso R. Effects of respiratory muscle therapy on obstructive sleep apnea: a systematic review and meta-analysis. J Clin Sleep Med. 2020;16(5):785-801.
31. Marklund M, Braem MJA, Verbraecken J. Update on oral appliance therapy. Eur Respir Rev. 2019 Sep 30;28(153).
32. Gjerde K, Lehmann S, Naterstad IF, Berge ME, Johansson A. Reliability of an adherence monitoring sensor embedded in an oral appliance used for treatment of obstructive sleep apnoea. J Oral Rehabil. 2018;45(2):110-115.
33. Ravesloot MJL, White D, Heinzer R, Oksenberg A, Pépin J-L. Efficacy of the New Generation of Devices for Positional Therapy for Patients With Positional Obstructive Sleep Apnea: A Systematic Review of the Literature and Meta-Analysis. J Clin Sleep Med. 2017;13(06):813824.
34. Beyers J, Vanderveken OM, Kastoer C, Boudewyns A, De Volder I, Van Gastel A, et al. Treatment of sleep-disordered breathing with positional therapy: long-term results. Sleep Breath. 2019;23(4):1141-1149.
35. Mashaqi S, Patel SI, Combs D, Estep L, Helmick S, Machamer J, et al. The Hypoglossal Nerve Stimulation as a Novel Therapy for Treating Obstructive Sleep Apnea-A Literature Review. Int J Environ Res Public Health. 2021;18(4):1-24.
36. Esmaili S, Vargas Centanaro G, Rodríguez Hermosa JL, Álvarez-Sala JL, Raissouni N, Calle Rubio M. KaLinix® in the treatment of Obstructive Sleep Apnea-Hypopnea syndrome (OSAHS). Eur Respir J. 2020;56(suppl 64):2147.
37. Montserrat Canal JM, Suárez-Girón M, Egea C, Embid C, Matute-Villacís M, de Manuel Martínez L, et al. Spanish Society of Pulmonology and Thoracic Surgery positioning on the use of telemedine in sleep-disordered breathing and mechanical ventilation. Arch Bronconeumol. 2021;57(4):281-290.
Tabla 1. Nuevas tecnologías para el diagnóstico de la apnea obstructiva del sueño -
---
Figura 1. Innovación tecnológica aplicada al tratamiento de la apnea obstructiva del sueño
Abreviaturas: AOS: apnea obstructiva del sueño; CPAP: presión continua positiva en la vía aérea; DAM: dispositivo de avance mandibular.
Figura 2. Posibilidades de aplicación de la telemedicina en la práctica diaria
Abreviaturas: AOS: apnea obstructiva del sueño; CPAP: presión continua positiva en la vía aérea; DAM: dispositivo de avance mandibular; DP: dispositivo posicional; ENH: estimulación del nervio hipogloso; PR: poligrafía respiratoria; PSG: polisomnografía.


PRESENTE Y FUTURO DE LA APNEA OBSTRUCTIVA DEL SUEÑO
¿ES LA CPAP EL FUTURO TRATAMIENTO DE LA APNEA DEL SUEÑO? POTENCIALES ALTERNATIVAS
Autor Francisco Campos-Rodríguez
La CPAP consiste en la aplicación de una presión positiva continua en la vía aérea supe rior (VAS) a través de una mascarilla nasal, con el objeto de presurizar dicha VAS y evitar el colapso dinámico de la misma que provoca la apnea obstructiva del sueño (AOS). A pesar de que esta terapia fue descrita por primera vez en 19811, desde entonces, y sin apenas variaciones, es el tratamiento de elección de los pacientes AOS sintomáticos y de la mayoría de casos con AOS grave.
Durante todos estos años, se ha intentado desarrollar otras terapias que rivalicen con la CPAP evitando las molestias que supone utilizar durante toda la noche este dispositivo, que no es bien tolerado por un porcentaje importante de casos. Sin embargo, a día de hoy, las alternativas a la CPAP, aunque variadas, tienen un papel secundario en la práctica clínica.
Esto es debido a tres factores principales: 1) ninguna de estas terapias ha demostrado ser superior a la CPAP para corregir la AOS; 2) falta de evidencia científica en la mayoría de ellas; 3) falta de financiación por parte de la sanidad pública para muchas de ellas. En el presente capítulo analizaremos las diferentes opciones de tratamiento alternativo a la CPAP de la AOS y su papel actual en el tratamiento de la AOS (Tabla I).
Los DAM son la principal alternativa terapéutica a la CPAP. Consisten en una prótesis que avanza la mandíbula y la lengua, lo que aumenta el área de sección de la VAS y disminuye su colapsabilidad. Los modelos hechos a medida y ajustables son preferibles a los modelos prefabricados.
Actualmente existe suficiente evidencia para afirmar que los DAM mejoran el ronquido, la,estructura del sueño, la excesiva somnolencia diurna (ESD) y el índice de apneas-hi popneas (IAH) cuando se comparan con placebo, consiguiendo un IAH<5 en el 19-75% de los casos2.
Sin embargo, la CPAP es superior para corregir el IAH (reducción media del IAH del 83% con CPAP versus 55% con DAM, reducción media superior en 7,8 eventos/hora con CPAP versus DAM), y es casi el doble de eficaz para conseguir un IAH>10. Respecto a la corrección de síntomas, los DAM son tan eficaces como la CPAP para mejorar la
calidad de vida y la ESD. La evidencia de los DAM sobre el riesgo cardiovascular, sin embargo, es muy escasa. Así, el efecto sobre la tensión arterial, aunque parece positivo (reducción de 2 mmHg, similar al obtenido con CPAP), presenta la limitación de basarse en estudios observacionales, y no existen trabajos que analicen su efecto sobre otras variables cardiovasculares o aporten resultados a largo plazo. La CPAP es superior a los DAM para reducir la presión arterial sistólica nocturna3.
La adherencia parece ser mejor con DAM que con CPAP, aunque el cumplimiento es subjetivo en casi todos los trabajos y se reduce con el tiempo, de forma que solo la mitad de pacientes sigue usándolos tras 4 años. En la mayoría de trabajos comparati vos, los pacientes suelen preferir los DAM a la CPAP. Entre las variables predictoras de éxito con DAM, se cuentan menor edad, menor perímetro de cuello, menor IMC, sexo femenino, AOS postural y AOS menos graves (de leves a moderadas)4.
En cuanto a los efectos secundarios, al igual que ocurre con la CPAP, son frecuentes (en la mitad de los casos), pero leves, y se resuelven espontáneamente en semanas. El uso a largo plazo de los DAM puede producir alteraciones dentales permanentes, disfunción de la articulación temporomandibular y cambios en la oclusión.
Actualmente, la mayoría de normativas y guías nacionales e internacionales, incluyendo el reciente Documento Internacional de Consenso (DIC), recomiendan el uso de DAM en los casos de AOS leve o moderada como alternativa a la CPAP, así como en los pacien tes con AOS grave que no toleran la CPAP2 5. La reciente guía de práctica clínica de la European Respiratory Society (ERS)6 posiciona la CPAP como primera opción, antes que los DAM, salvo en casos de AOS leve-moderada, en los que considera que ambas terapias serían equivalentes. En España, y salvo contadas comunidades autónomas, la realidad es que la falta de cobertura por parte de la sanidad pública ha llevado a una utilización escasa de los DAM.
El tratamiento quirúrgico de la AOS incluye un amplio abanico de técnicas dirigidas a corregir la obstrucción anatómica en diferentes niveles de la VAS, desde las más sim ples, como la cirugía nasal y palatofaríngea, hasta una cirugía multinivel más agresiva (Tabla II).
El principal problema para evaluar la eficacia de estas técnicas quirúrgicas reside en la falta de una evidencia científica potente, en parte por ausencia de estudios bien diseñados y en parte por la variabilidad de la selección de pacientes, tipos de técnicas y definición no estándar de tratamiento eficaz (reducción >50% del IAH basal y/o un IAH final >20). Para la selección de la técnica quirúrgica, y con la finalidad de localizar el lugar de la obstrucción, se recomienda utilizar exploraciones como la fibronasofarin goscopia o la somnoscopia/DISE (Drug-Induced Sleep Endoscopy).
La mayoría de normativas y guías no recomiendan la cirugía como tratamiento de pri mera elección en la AOS, y solo se recomienda como alternativa el avance maxiloman dibular, y al mismo nivel que la CPAP, en AOS graves que rechacen otros tratamientos, especialmente si son jóvenes y no obesos5 8. A nivel práctico, sin embargo, presenta como limitación el ser una técnica agresiva con potenciales efectos secundarios y la necesidad de profesionales entrenados en esta técnica, lo que reduce mucho su ámbito de aplicación.
También se recomienda la amigdalectomía en pacientes adultos con hipertrofia amig dalar grado3 4, así como la corrección de la obstrucción nasal que mejore la adaptación al tratamiento con CPAP. El reciente DIC incluye la cirugía como una herramienta más dentro de una aproximación integral, basada en una medicina personalizada en que las diferentes opciones terapéuticas sean complementarias y no excluyentes (Figura 1)5.
La posición supina aumenta la resistencia nasal y la colapsabilidad de la VAS, lo que empeora el patrón respiratorio. Aproximadamente el 50% de los pacientes con AOS padece una AOS postural (definida como un IAH global >5/hora y un IAH en decúbito supino de al menos el doble que en posición no supina), y hasta el 30% una AOS ex clusivamente en supino, por lo que evitar esta postura durante el sueño puede ser un tratamiento eficaz en muchos casos de AOS.
Dentro de las diferentes modalidades de tratamiento, tradicionalmente se ha recomen dado una pelotita de tenis colocada en la espalda para evitar el supino, pero la adhe rencia a esta técnica suele ser pobre y no supera el 30% a largo plazo. En la actualidad se han desarrollado dispositivos más sofisticados que emiten una vibración creciente al detectar la posición supina y que son mejor tolerados y parecen más eficaces. La evidencia sobre esta terapia es, sin embargo, muy pobre9. Los escasos estudios que comparan la terapia posicional con la CPAP encuentran que ambas reducen el IAH, siendo la CPAP más eficaz en este aspecto, aunque con peor adherencia. Respecto a la mejoría de la ESD y la calidad de vida, parece que ambas terapias son equivalentes. Sin embargo, no se dispone de evidencia a largo plazo, ni de su efecto sobre parámetros cardiovasculares.
En base a esta evidencia, la reciente guía de práctica clínica de la ERS indica que en pacientes con AOS posicional leve-moderada en los que el IAH no supino sea <15/h, los dispositivos posturales vibratorios se podrían recomendar al mismo nivel que la CPAP6. De forma similar, el DIC recomienda su uso como tratamiento único en pacientes con
eventos respiratorios solamente en posición de supino o con un IAH <15/h en otras posiciones, o bien como terapia adyuvante que permita disminuir la presión de CPAP5. A día de hoy, la terapia posicional no está financiada por la sanidad pública.
La TMF consiste en una serie de ejercicios isotónicos e isométricos dirigidos a poten ciar la musculatura de estructuras orales (lengua, labios), orofaríngeas (paladar blando, paredes laterales de la faringe) y músculos faciales. Desde 1990, existe interés por la potencial utilidad de la TMF para mejorar la AOS mediante el entrenamiento y la poten ciación de la musculatura de la VAS.
Aunque la evidencia disponible es muy escasa, parece que puede disminuir el IAH (50%; de 24,5 a 12,3 episodios/h) y mejorar la ESD (Epworth de 14,8 a 8,2) y la ca lidad de vida. Sin embargo, la mayoría de estos estudios son observacionales¹0. Los pocos ensayos clínicos encuentran una reducción media del IAH de 8,1 eventos/h y del Epworth de 2,7 puntos respecto a no tratamiento. Se ignora si esta mejoría se mantiene a largo plazo. En base a esta evidencia muy débil, la ERS no recomienda la TMF dentro de la estrategia de tratamiento estándar de la AOS, que queda relegada como tratamiento alternativo en casos articulares que rechacen tratamientos más eficaces, como la CPAP o la cirugía6.
Consiste en la implantación de un neuroestimulador (bien de forma invasiva, bien sub cutáneo) que proporciona una corriente eléctrica al nervio hipogloso sincronizada con la fase inspiratoria de la respiración, con el objetivo de aumentar el tono del músculo geniogloso (principal dilatador faríngeo) y evitar el colapso de la VAS. Un estudio multi céntrico encontró una reducción significativa del IAH de 29,3 a 9,0 (mejoría del 68%), así como una mejoría de la ESD y la calidad de vida al cabo de 12 meses de tratamiento, si bien los criterios de selección fueron tan estrictos que solo se incluyó el 13% de los pacientes iniciales11.
Debido a la escasa evidencia, la ERS no recomienda la ENH como tratamiento de pri mera elección en la AOS, aunque sería preferible a no tratamiento en pacientes sinto máticos que rechacen CPAP o DAM, con IAH<50 y no obesos6.
El uso de esta técnica en nuestro país es prácticamente inexistente, puesto que esta técnica es aún novedosa, requiere entrenamiento, no está exenta de potenciales efec tos secundarios, está aún poco estandarizada, no está claro qué perfil de pacientes se podría beneficiar de la técnica y tiene un elevado coste.
No existe en la actualidad ningún fármaco que evite la obstrucción de la VAS. Sin em bargo, algunos fármacos podrían tener utilidad para esta enfermedad12. Por ejemplo, existen medicamentos que serían útiles en el tratamiento de la ESD residual que per siste a pesar de tratamiento correcto con CPAP (solriamfetol, pitolisan, modafinil)13. Los inhibidores de la anhidrasa carbónica (acetazolamida), e incluso fármacos hipnóticos que reducen el umbral del despertar, podrían tener un papel en pacientes en los que la AOS se deba a ciertos mecanismos fisiopatológicos (ver más adelante)14. En pacientes con fallo cardiaco, los diuréticos impiden el acúmulo de líquido en miembros inferiores, evitando que durante el decúbito este líquido se desplace y se acumule en el cuello, lo que aumentaría la colapsabilidad de la VAS. Se ha comprobado que la desipramina, un antidepresivo con efecto noradrenérgico y antimuscarínico, puede aumentar la activi dad del músculo geniogloso y reducir la colapsabilidad de la VAS (ver más adelante).
Otras terapias marginales para la AOS, con aún menor evidencia de su eficacia, apare cen reflejadas en la tabla I
Tal y como se indicaba en la introducción de este capítulo, a pesar de que la CPAP tiene más de 40 años de historia no ha sido superada en eficacia y sigue siendo de primera elección en el tratamiento de la AOS sintomática. Sin embargo, la investigación hacia una medicina de precisión para la AOS puede cambiar este paradigma y priorizar algu nos de los tratamientos alternativos según el fenotipo y la fisiopatología de la obstruc ción de la VAS en cada sujeto particular, permitiendo así una estrategia de tratamiento más personalizada15.
En este sentido, un estudio pionero que analizó los rasgos fenotípicos de la obstrucción de la VAS en 58 sujetos AOS y 17 controles 16 observó que solo en el 23% de los suje tos estudiados la obstrucción se justificaba por un problema anatómico grave, mientras que hasta un 70% de los casos presentaban una o más causas no anatómicas de colapso, y hasta el 19% de los casos presentaban una VAS “no colapsable”, semejante a los sujetos control sin AOS. Entre los mecanismos fisiopatológicos no anatómicos identificados en la obstrucción de la VAS estarían una musculatura dilatadora de la VAS
poco eficaz, una inestabilidad del control ventilatorio o un umbral del despertar bajo (Figura 2).
Esta identificación del mecanismo (único o varios) fisiopatológico fundamental impli cado en la obstrucción de la VAS permitiría elegir el tratamiento o la combinación de tratamientos más eficaces y adecuados en cada paciente16 17.
1. Problema anatómico. Los casos en los que predomine este mecanismo se be neficiarán, además de CPAP, de terapias dirigidas a aliviar dicho problema, como la pérdida de peso, los DAM, la cirugía de la VAS o la terapia posicional.
2. Disfunción o ineficacia de la musculatura dilatadora de la VAS. Se ha observado que en pacientes con AOS puede existir una menor actividad del mús culo geniogloso o una reducción de la respuesta refleja a las presiones negativas de la VAS. Algunos investigadores han encontrado una hipertrofia de las fibras musculares que podría ser secundaria a esfuerzos repetidos para mantener una VAS permeable. Todas estas alteraciones pueden provocar que en algunos sujetos esta disfunción o ineficacia muscular sea el principal mecanismo implicado en la obstrucción de la VAS18.
En estos casos, terapias como la estimulación del nervio hipogloso o la terapia miofuncional con ejercicios destinados a fortalecer la musculatura dilatadora pue den ser de elección para el tratamiento de la AOS. Algunos fármacos, como la desipramina, han demostrado en un ensayo clínico reducir la colapsabilidad farín gea, si bien este efecto ocurrió en un subgrupo de pacientes con menor capacidad compensadora de la musculatura de la VAS19.
3. Umbral de despertar respiratorio bajo. Los despertares corticales en res puesta a un evento obstructivo ocurren cuando la presión negativa intratorácica aumenta hasta superar un umbral. Existen estudios que indican que hasta el 30% de los pacientes con AOS (la mayoría no obesos) pueden despertar precozmente ante pequeños cambios de presión intratorácica (entre 0 y 15 cmH2O) inestabili zando la respiración y provocando patrones de respiración cíclica16 20.
Además, estos despertares frecuentes impiden que el sujeto entre en fases de sueño más profundo, en las que la respiración suele ser mucho más estable. Inclu so, se ha postulado que estos despertares “precoces” impedirían el reclutamiento y la activación de la musculatura dilatadora faríngea.
En estos pacientes, los fármacos hipnóticos podrían tener un papel importante, al menos hipotéticamente, para evitar estos despertares precoces. La zoplicona y la trazodona aumentan el umbral del despertar a la presión negativa intratorácica y han demostrado reducir el IAH un 25-50% sin provocar hipoxemia en pacientes seleccionados21. Sin embargo, las dosis altas también podrían provocar el efecto contrario, es decir, prolongar los eventos apneicos y empeorar la hipoxemia. Por el contrario, otros fármacos favorecedores del sueño, como el nitrazepam o la tiagabina, no han demostrado reducir el umbral de despertar ni mejorar el IAH, por lo que no todos los hipnóticos se comportarían de forma similar. Por tanto, la utilización de fármacos hipnóticos es un campo de desarrollo inte resante, pero lastrado por la limitación que supone el riesgo de empeorar la AOS y la necesidad de seleccionar muy cuidadosamente a los sujetos que se podrían beneficiar de esta aproximación terapéutica14.
4. Sistema de control ventilatorio inestable o de alta ganancia (High Loop Gain). El mecanismo fundamental para la reapertura de la VAS ante un evento obstructivo es la presencia de un despertar, que determina un incremento de la ac tividad de los músculos dilatadores y un incremento de la ventilación. La magnitud de los cambios ventilatorios y la susceptibilidad individual a los cambios gasomé tricos asociados determinarán la evolución hacia una respiración estable o hacia la desestabilización del sistema. Si el sistema de control de la ventilación tiene una hiperrespuesta a la hipoxia/hipercapnia, el periodo inmediatamente posterior a la apnea se caracterizará por una marcada hiperventilación y, posteriormente, por una disminución del impulso respiratorio, lo que provocará la inestabilidad del sis tema respiratorio y perpetuará un colapso recurrente de la VAS22 23. Un 30% de AOS podrían tener un sistema de control ventilatorio inestable o de alta ganancia. En estos pacientes, la aplicación de oxígeno ha demostrado reducir este exceso de ganancia y el IAH en un 50%24. La acetazolamida reduce esta inestabilidad ventilatoria en un 40%, y el IAH noREM, en un 50%25.
5. Combinación de terapias dirigidas. Algunos estudios han analizado el efecto de combinar varias de estas terapias. Así, un trabajo observó que combinar DAM con terapia postural redujo el IAH un 75%, comparado con una mejoría del 50% de cada una de estas terapias por separado26. Otro estudio que combinó oxige noterapia para reducir la inestabilidad ventilatoria con un hipnótico para aumentar el umbral del despertar redujo el IAH en el 95% de un grupo seleccionado de pacientes27.
El principal problema para poner en práctica esta estrategia de tratamiento personali zado es la identificación de estos fenotipos. Las herramientas utilizadas en los estudios de investigación son demasiado complejas para emplearlas en la práctica clínica diaria. Por tanto, para avanzar en la identificación de los mecanismos fisiopatológicos y que de ello se derive un tratamiento dirigido, necesitamos herramientas simples, accesibles y de amplio uso, basadas en la poligrafía o polisomnografía. Algunos trabajos recientes están intentando utilizar señales polisomnográficas procesadas obtenidas de la señal de flujo nasal a fin de valorar la colapsabilidad VAS y la estabilidad del control ventila torio28. Otros trabajos han utilizado el IAH, la saturación de oxígeno mínima y la ratio apenas/hipopneas para determinar el umbral de despertar respiratorio29.
En conclusión, aunque disponemos de diversas terapias diferentes a la CPAP para el tratamiento de la AOS, actualmente todas ellas juegan un papel secundario en la prác tica clínica diaria. Es necesaria más investigación de alta calidad para saber cómo se posicionarían cada una de ellas frente a CPAP, lo que probablemente incidiría en aumentar el interés de las autoridades sanitarias en su financiación, y así se llegaría a un mayor número de pacientes.
Por otro lado, el desarrollo de una medicina personalizada abre un amplio campo al uso de estas terapias no-CPAP. Sin embargo, este es aún un campo en investigación, por lo que se requiere tanto mayor evidencia científica como el desarrollo de herramientas accesibles y fáciles de utilizar que permitan identificar estos fenotipos fisiopatológicos en cada paciente concreto. Cuando esto se consiga, es probable que estas terapias diferentes a la CPAP adquieran aún mayor relevancia como primeras opciones de tra tamiento en un considerable número de pacientes con AOS.
En pacientes con AOS, existen diversas terapias alternativas a la CPAP, si bien todas ellas tienen un papel secundario en la práctica clínica habitual.
Este papel secundario es debido a:
1. Falta de superioridad clara frente a CPAP.
2. Falta de evidencia científica en la mayoría de ellas, o al menos de una eviden cia tan fuerte como la que tiene la CPAP.
3. Falta de financiación por la sanidad pública de muchas de ellas. Los dispositivos de avance mandibular (DAM) son la principal alternativa terapéutica a la CPAP. Si bien su eficacia para corregir el IAH es inferior a CPAP, mejoran en similar medida la clínica y la hipersomnia, con una mejor tolerancia.
Dentro de los tratamientos quirúrgicos de la AOS, sólo el avance maxilo-mandibu lar se recomienda como alternativa, y al mismo nivel que la CPAP, en AOS graves que rechacen otros tratamientos, especialmente si los pacientes son jóvenes y no obesos.
El tratamiento posicional podría tener un papel como tratamiento único en pacientes con eventos respiratorios únicamente en posición de supino o con un IAH <15/h en otras posiciones, o bien como terapia adyuvante que permita disminuir la presión de CPAP.
Otros tratamientos, como la terapia miofuncional o la estimulación del nervio hipo gloso, presentan mucha menos evidencias y no se recomiendan como tratamientos de primera elección en ningún caso.
Hasta un 70% de los pacientes con AOS pueden presentar una o más causas no anatómicas de colapso, entre ellas: una musculatura dilatadora de la VAS poco efi caz, una inestabilidad del control ventilatorio, o un umbral de despertar bajo. La identificación del mecanismo fisiopatológico fundamental implicado en la obs trucción de la VAS permitiría elegir el tratamiento más eficaz y adecuado en cada paciente, acercándonos a una medicina personalizada. En muchos de estos casos, el uso de otras terapias no CPAP de las que se han descrito antes podrían tener un papel como primera elección.
Existen diversos tratamientos farmacológicos que podrían jugar un papel en el tra tamiento de la AOS, sobre todo en casos seleccionados en los que el mecanismo de obstrucción predominante sea la inestabilidad del control ventilatorio, o un umbral de despertar bajo.
Esta terapia dirigida en la AOS está aún limitada al ámbito de la investigación. Se necesitan herramientas simples, accesibles, y de uso amplio, que permitan identifi car estos fenotipos en la práctica clínica habitual.
1. Sullivan CE, Issa FG, Berthon-Jones M, Eves L. Reversal of obstructive sleep apnoea by continuous positive airway pressure applied through the nares. Lancet. 1981;1:862-865.
2. Ramar K, Dort LC, Katz SG, et al. Clinical Practice Guideline for the Treatment of Obstructive Sleep Apnea and Snoring with Oral Appliance Therapy: An Update for 2015. J Clin Sleep Med. 2015;11:773-827.
3. Dal-Fabbro C, Garbuio S, D’Almeida V, Cintra FD, Tufik S, Bittencourt L. Mandibular advancement device and CPAP upon cardiovascular parameters in OSA. Sleep Breath. 2014;18:749-759.
4. Chen H, Eckert DJ, Stelt PF van der, et al. Phenotypes of responders to mandibular advancement device therapy in obstructive sleep apnea patients: A systematic review and meta-analysis. Sleep Med Rev. 2020;49:101229.
5. Mediano O, González Mangado N, Montserrat JM, et al. Documento internacional de consenso sobre apnea obstructiva del sueño. Arch Bronconeumol. 2022;58:52-68.
6. Randerath W, Verbraecken J, De Raaff CAL, et al. European Respiratory Society guideline on non-CPAP therapies for obstructive sleep apnoea. Eur Respir Rev. 2021;30:210200.
7. Aurora RN, Casey KR, Kristo D, et al. Practice parameters for the surgical modifications of the upper airway for obstructive sleep apnea in adults. Sleep. 2010;33:1408-1413.
8. Smith DF, Cohen AP, Ishman SL. Surgical management of OSA in adults. Chest. 2015;147:1681-1690.
9. Srijithesh PR, Aghoram R, Goel A, Dhanya J. Positional therapy for obstructive sleep apnoea. Cochrane Database Syst Rev. 2019;2019 (5):CD010990.
10. Camacho M, Certal V, Abdullatif J, et al. Myofunctional Therapy to Treat Obstructive Sleep Apnea: A Systematic Review and Meta-analysis. Sleep. 2015;38:669-675.
11. Strollo PJ, Soose RJ, Maurer JT, et al. Upper-Airway Stimulation for Obstructive Sleep Apnea. N Engl J Med. 2014;370:139-149.
12. Gaisl T, Haile SR, Thiel S, Osswald M, Kohler M. Efficacy of pharmacotherapy for OSA in adults: A systematic review and network meta-analysis. Sleep Med Rev. 2019;46:74-86.
13. Avellar ABCC, Carvalho LBC, Prado GF, Prado LBF. Pharmacotherapy for residual excessive sleepiness and cognition in CPAP-treated patients with obstructive sleep apnea syndrome: A systematic review and meta-analysis. Sleep Med Rev. 2016;30:97-107.
14. Aishah A, Eckert DJ. Phenotypic approach to pharmacotherapy in the management of obstructive sleep apnoea. Curr Opin Pulm Med. 2019;25:594-601.
15. Martinez-Garcia MA, Campos-Rodriguez F, Barbé F, Gozal D, Agustí A. Precision medicine in obstructive sleep apnoea. Lancet Respir Med. 2019;7:456-464.
16. Eckert DJ, White DP, Jordan AS, Malhotra A, Wellman A. Defining phenotypic causes of obstructive sleep apnea. Identification of novel therapeutic targets. Am J Respir Crit Care Med. 2013;188:996-1004.
17. Carberry JC, Amatoury J, Eckert DJ. Personalized Management Approach for OSA. Chest. 2018;153:744-755.
18. Pierce R, White D, Malhotra A, et al. Upper airway collapsibility, dilator muscle activation and resistance in sleep apnoea. Eur Respir J. 2007;30:345-353.
19. Taranto-Montemurro L, Sands SA, Edwards BA, et al. Desipramine improves upper airway collapsibility and reduces OSA severity in patients with minimal muscle compensation. Eur Respir J. 2016;48:1340-1350.
20. Gray EL, McKenzie DK, Eckert DJ. Obstructive Sleep Apnea without Obesity Is Common and Difficult to Treat: Evidence for a Distinct Pathophysiological Phenotype. J Clin Sleep Med. 2017;13:81-88.
21. Smales ET, Edwards BA, Deyoung PN, et al. Trazodone Effects on Obstructive Sleep Apnea and Non-REM Arousal Threshold. Ann Am Thorac Soc. 2015;12:758-764.
22. Gleeson K, Zwillich CW, White DP. The influence of increasing ventilatory effort on arousal from sleep. Am Rev Respir Dis. 1990;142:295-300.
23. Younes M, Ostrowski M, Atkar R, Laprairie J, Siemens A, Hanly P. Mechanisms of breathing instability in patients with obstructive sleep apnea. J Appl Physiol. 2007;103:1929-1941.
24. Wellman A, Malhotra A, Jordan AS, Stevenson KE, Gautam S, White DP. Effect of oxygen in obstructive sleep apnea: role of loop gain. Respir Physiol Neurobiol. 2008;162:144-151.
25. Edwards BA, Connolly JG, Campana LM, et al. Acetazolamide attenuates the ventilatory response to arousal in patients with obstructive sleep apnea. Sleep. 2013;36:281-285.
26. Dieltjens M, Vroegop AV, Verbruggen AE, et al. A promising concept of combination therapy for positional obstructive sleep apnea. Sleep Breath. 2015;19:637-644.
27. Edwards BA, Sands SA, Owens RL, et al. The Combination of Supplemental Oxygen and a Hypnotic Markedly Improves Obstructive Sleep Apnea in Patients with a Mild to Moderate Upper Airway Collapsibility. Sleep. 2016;39:1973-1983.
28. Terrill PI, Edwards BA, Nemati S, et al. Quantifying the ventilatory control contribution to sleep apnoea using polysomnography. Eur Respir J. 2015;45:408-418.
29. Edwards BA, Eckert DJ, McSharry DG, et al. Clinical predictors of the respiratory arousal threshold in patients with obstructive sleep apnea. Am J Respir Crit Care Med. 2014;190:1293-1300.
Dispositivos de avance mandibular (DAM)
Principal alternativa terapéutica a la CPAP. Consisten en una prótesis que avanza la mandíbula y la lengua, lo que aumenta el área de sección de la VAS y disminuye su colapsabilidad. Deben ser a medida y no prefabricados. Menos eficaces que CPAP para reducir el IAH, pero similares a CPAP y mejores que placebo para mejorar la calidad de sueño, ESD y calidad de vida. Suelen ser mejor tolerados que CPAP. Poca evidencia sobre su efecto en riesgo cardiovascular.
Cirugía Ver tabla II y figura 1
Terapia posicional Consiste en dispositivos que eviten que el paciente duerma en supino. Tradicionalmente se ha usado la técnica de la pelota de tenis, pero en la actualidad se han desarrollado dispositivos vibrátiles que tiene mejor aceptación. Escasa evidencia. Aunque reduce el IAH, es menos eficaz que CPAP. En pacientes seleccionados, la terapia posicional podría ser equivalente a CPAP en cuanto a mejoría en la ESD y la calidad de vida. No se dispone de evidencia a largo plazo, ni de su efecto sobre parámetros cardiovasculares.
Estimulación del nervio hipogloso Consiste en la implantación de un neuroestimulador, que proporciona una corriente eléctrica al nervio hipogloso sincronizada con la fase inspiratoria de la respiración, con el objetivo de aumentar el tono del músculo geniogloso (principal dilatador faríngeo) y evitar el colapso de la VAS. Aunque hay ensayos clínicos que han demostrado su eficacia en la AOS, la evidencia, en general, es muy escasa. La colocación requiere personal entrenado, es un procedimiento invasivo, no está exento de potenciales efectos secundarios, está aún poco estandarizado, no está claro qué perfil de pacientes se podrían beneficiar de la técnica y su coste es elevado
Terapia miofuncional Consiste en el entrenamiento durante la vigilia de las estructuras orales (labios y lengua) y orofaríngeas (paladar blando, pared lateral de la faringe) mediante ejercicios isotónicos e isométricos con el objeto de estabilizar la VAS Mejora el ronquido y podría mejorar el IAH en casos seleccionados. La evidencia disponible es muy escasa Dilatadores nasales Actuarían ensanchando las fosas nasales. No se recomiendan en el tratamiento de la AOS, aunque podrían ser útiles en algunos pacientes con obstrucción nasal para mejorar la respiración nasal y reducir el ronquido Cánulas nasales (insuflación transnasal) Consiste en la insuflación transnasal de aire calefactado y humidificado, a flujo muy alto (20 litros/minuto) a través de cánulas nasales.
Hay poca experiencia en su uso y su papel no está bien está establecido. Presión positiva espiratoria en la vía aérea Mediante unas válvulas nasales con una resistencia alta durante la espiración y muy baja durante la inspiración, se genera una presión positiva en la vía aérea durante la espiración que dilata la vía aérea superior Los estudios son escasos, y los resultados, discordantes Presión oral Consiste en un dispositivo que aplica una succión sutil sobre la boca, desplazando anterior y superiormente la lengua y el paladar blando.
Existen muy pocos datos sobre su eficacia.
Estimulación del nervio frénico transvascular
Tratamiento del edema faríngeo nocturno
Implantes palatales
Se utilizaría para el tratamiento de la apnea de sueño central en pacientes con fallo cardiaco y baja fracción de eyección del ventrículo izquierdo.
El estimulador se introduce vía subclavia hasta la vena braquiocefálica derecha o izquierda.
En pacientes con AOS e insuficiencia venosa crónica, el uso de medias de compresión puede reducir el volumen de fluido en las extremidades inferiores y la circunferencia del cuello durante la noche, con una reducción del IAH.
En pacientes con fallo cardiaco y congestión pulmonar, el tratamiento diurético reduce la acumulación rostral de fluido durante la noche aumentando el calibre de la vía aérea superior
Consiste en colocar 3 implantes cilíndricos de poliéster no reabsorbible, de forma paralela, en la línea media del paladar blando para inducir una fibrosis que estabilice esta zona de la VAS e impedir su colapso.
Existe poca evidencia de su eficacia, con estudios discordantes. Podría tener un papel en el tratamiento del ronquido.
Abreviaturas: AOS: apnea obstructiva del sueño; IAH: índice de apneas hipopneas; VAS: vía aérea superior; ESD: excesiva somnolencia diurna
Fosas nasales Septoplastia Rinoplastia Turbinectomía Polipectomía
Amígdalas Amigdalectomía
La cirugía nasal aislada casi nunca produce una mejoría significativa de la AOS; sin embargo, suele mejorar la respiración nasal y puede facilitar la adaptación a la CPAP
Es el tratamiento de elección en niños, combinada con la adenoidectomía.
En adultos, la hipertrofia amigdalar importante es rara, pero, cuando existe (grado 3 o superior), la amigdalectomía suele mejorar la AOS, aunque en muchos casos persiste enfermedad residual.
Adenoides Adenoidectomía
Cirugía retropalatal Uvulopalatofaringoplastia (UPFP) (quirúrgica o por láser)
Colgajo uvulopalatal Faringoplastia
Implantes en paladar blando
Es el tratamiento de elección en niños, combinada con la amigdalectomía
La UPFP es la intervención quirúrgica que se utiliza con más frecuencia en el tratamiento de la AOS
Sin embargo, el éxito de la UPFP sólo se consigue en un 40 50% de los casos, con una reducción media del IAH del 33% con respecto al basal. La eficacia quirúrgica puede disminuir a largo plazo.
Los resultados de la intervención son mejores en la AOS leve moderada, en pacientes no obesos y en los casos en que la obstrucción está localizada en el área retropalatal
Actualmente, la UPFP no está indicada en el tratamiento de la AOS, salvo en casos muy concretos.
La UPFP asistida por láser no consigue mejoría significativa ni del IAH ni de los síntomas, y no está recomendada para el tratamiento de la AOS
Los implantes en paladar blando son una técnica poco invasiva en la que se insertan unos cilindros de poliéster en la submucosa del paladar blando con la finalidad de hacerlo más rígido. Sólo se recomienda en casos muy concretos con AOS leve moderada y no obesos.
La UPFP es útil para el tratamiento del ronquido simple, una vez descartada la AOS, aunque puede perder eficacia con el paso del tiempo.
Macizo facial Avance maxilo mandibular (AMM)
Osteogénesis por distracción maxilo mandibular
El AMM es el procedimiento quirúrgico más eficaz en el tratamiento de la AOS, y sus resultados se mantienen a largo plazo
El porcentaje de éxito de AMM es del 65% 86%, con una reducción media del IAH del 87%, aunque un IAH<5 sólo se consigue en <50% de los casos.
La AMM amplía la vía aérea retropalatal y retrolingual a través de un avance (10 15 mm) del maxilar superior y la mandíbula, tras realizar una osteotomía bilateral de ambas estructuras
La osteogénesis por distracción está indicada en niños con malformaciones craneofaciales con micrognatia grave. Apenas se usa en adultos.
Cirugía multinivel
Cirugía multinivel y cirugía multinivel mínimamente invasiva
Se refiere a una intervención realizada sobre al menos dos de las zonas anatómicas habitualmente alteradas en la AOS, ya sea de forma simultánea o en un protocolo escalonado, en el que solo se recurre a los procedimientos de la segunda fase (casi siempre el AMM) cuando los resultados de la primera no han sido satisfactorios.
Los resultados son difíciles de evaluar, en parte porque las combinaciones de técnicas utilizadas son muy diversas.
La tasa de éxito estaría en torno al 50 60%, aunque suele ser poco predecible y se considera menor que con CPAP.
Se considera una opción aceptable como último recurso en casos en que la CPAP y otras medidas conservadoras hayan fracasado.
La cirugía multinivel mínimamente invasiva consiste en una combinación de procedimientos, como la radiofrecuencia de cornetes, paladar blando y/o base de la lengua.
Traqueotomía Actualmente en desuso.
Abreviaturas: AOS: apnea obstructiva del sueño; CPAP: presión positiva continua en la vía aérea superior; IAH: índice de apneas hipopneas; UPFP: Uvulopalatofaringoplastia; AMM: Avance maxilo-mandibular
Tomado de: Mediano O, Gonzalez-Mangado N, Montserrat J, Alonso Alvarez M, Al mendros I, Alonso-Fernandez A, Barbe F, Borsini E, et al. Documento Internacional de Consenso sobre Apnea Obstructiva del Sueño. Arch Bronconeumol. 2022;58:52-68. doi:10.1016/j.arbres.2021.03.017.
Abreviaturas: CAPSO: cautery-assisted palatal stiffening operation; CELL: coblator en doscopic lingual lightening; CPAP: presión positiva continua en las vías respiratorias; DAM: dispositivo de avance mandibular; DISE: drug-induced sleep endoscopy; DOME: distraction osteogenesis maxillary expansión; ORL/MXF: otorrinolaringología/maxilo facial; PR: poligrafía respiratoria; PSG: polisomnografía; Rx/TC: estudios radiológicos; TORS: cirugía robótica transoral; UPPP: uvulopalatofaringoplastia; VAS: vía aérea su perior.

Miguel Ángel Martínez-García
Amina Bekki
José Daniel Gómez-Olivas
Además de otros aspectos, la presencia de hipersomnia o somnolencia es uno de los síntomas clave a la hora de sospechar el diagnóstico de un síndrome de apnea obs tructiva del sueño (AOS). Su presencia no solo define la gravedad de esta enfermedad, sino que marca también la priorización en la derivación a las Unidades de Sueño para su diagnóstico, el inicio de un tratamiento precoz y la respuesta del mismo. Es, sin duda, uno de los síntomas más invalidantes, de modo que incluso se ha descrito un fenotipo especial de paciente con hipersomnia más asociado a complicaciones de la esfera neurocognitiva y cardiovascular, una mayor probabilidad de sufrir accidentes de tránsito o laborales y, por lo tanto, un mayor coste sanitario¹. A pesar de todo ello, dado que es un síntoma subjetivo, su medición dista mucho de ser la adecuada, debido a múltiples factores: por un lado, la vivencia es diferente según la edad o el sexo, es un síntoma enormemente inespecífico, por lo que puede aparecer por múltiples causas independientes de una AOS; por el contrario, un porcentaje importante de AOS, incluso casos graves según su valor en el índice de apneas-hipopneas (IAH) o del índice de desaturación (ID), no presentan hipersomnia, su impacto en la calidad de vida de los individuos que la padecen es muy diferente, su presencia presenta una elevada varia bilidad entre los distintos individuos y los instrumentos de medición de la hipersomnia, tanto objetiva como subjetiva, en la mayoría de casos no están validados para su utili zación en todos los grupos de edad o sexo, además de que presentan poca correlación entre los mismos1 2 .
Si la hipersomnia que padece un individuo es debida al impacto del exceso de trastor nos respiratorios durante el sueño (TRS) que padece, sería esperable que desapareciera (al menos que sus medidas se normalizaran) tras el tratamiento efectivo de la AOS. Sin embargo en ocasiones no es así, lo que lleva a que la calidad de vida del individuo (y probablemente su pronóstico) se vean mermados y a la necesidad del tratamiento de la misma3. Dado que en el presente curso ya existe un capítulo dedicado a la hipersomnia y su medición, en este capítulo nos centraremos en la epidemiología, diagnóstico y manejo de este grupo de pacientes con AOS que permanece con hipersomnia a pesar del tratamiento.
En el contexto de un paciente con AOS en el que después del tratamiento sigue ob servándose un incremento del valor registrado mediante los test de medición de la hipersomnia, hay que diferenciar tres situaciones fundamentales, que exponemos a continuación4 .
• Hipersomnia persistente. Se define como la hipersomnia que persiste a pe sar del correcto tratamiento de la AOS y tras haber comprobado que el número de TRS se ha normalizado. Esta hipersomnia no es debida a la AOS, por lo que deben buscarse otras causas que la provoquen. Las causas más frecuentes son la inactividad en ancianos, la falta de sueño, los trastornos neurocognitivos o de la conducta, como la depresión, la toma de fármacos u otras menos frecuentes, como la narcolepsia o la hipersomnia idiopática (Tabla I). En estos casos, son fundamentales una anamnesis completa y correcta y una batería de pruebas com plementarias necesarias según la sospecha clínica.
• Pseudohipersomnia o falsa hipersomnia. El paciente presenta un valor anó malo en el test de Epworth que no se corresponde con la vuelta a la normalidad de los valores en los test objetivos de hipersomnia. El test de Epworth es una herramienta cuya principal ventaja es su sencillez, si bien no está validada para mujeres, ancianos o individuos con comorbilidades, por lo que en ocasiones puede presentar valores anómalos, lo cual no indica una verdadera hipersomnia. Por ello, en pacientes con persistencia de hipersomnia tras tratamiento con CPAP, esta debe ser corroborada mediante la realización de medidas objetivas.
• Hipersomnia residual. Es la hipersomnia (comprobada) que se presenta a pesar del tratamiento de la AOS y como consecuencia del mismo. Puede coexistir con una hipersomnia persistente. En la mayoría de los casos, la hipersomnia residual es debida a una falta de adherencia al tratamiento (habitualmente la CPAP), una presión subterapéutica, cambios en el peso u otras condiciones a lo largo del tiempo que implican que el tratamiento deba ser modificado, o una falta de ajuste de presión de CPAP (o tratamientos alternativos). El presente capítulo se dedicará fundamentalmente a este tipo de hipersomnia y su manejo.
No existen en la literatura estudios que muestren claramente la prevalencia de hiper somnia residual diferenciándola de la hipersomnia persistente. Se estima que entre un 12 y un 55% de los pacientes con AOS tratados pueden presentarla, si bien puede disminuir hasta el 6% tras la exclusión correcta de otras causas conocidas de hiper somnia 5 7 .
Teniendo siempre en mente que la mayoría de estudios no distingue entre hipersomnia persistente y residual, algunos autores han intentado valorar cuáles son los factores de riesgo “a priori” o tras tratamiento que se relacionen con persistencia de medidas anó
malas de hipersomnia. De ellos, probablemente la gravedad de la hipersomnia inicial es el más importante5 7 .
También se ha asociado con menor número de TRS o menor desaturación de oxígeno inicial. La presencia de antecedentes de diabetes o enfermedades cardiovasculares como factor de riesgo de hipersomnia residual ha presentado resultados dispares. Otros factores asociados en diferentes estudios han sido: edad más joven, poca adherencia a la CPAP (en uso de horas diarias), mayor número de efectos adversos a la CPAP, disminución de la latencia del sueño, reducción de ondas lentas, mayor número de movimientos anómalos de las piernas, mayor duración sueño diurno y menor latencia del sueño diurna8 .
Probablemente, las tres medidas fundamentales a tener en cuenta son8:
1. Asegurar el diagnóstico de AOS. Comprobar que el estudio realizado sea téc nicamente correcto. Si es necesario, realizar un estudio vigilado mediante PSG completa.
2. Descartar enfermedades concomitantes relacionadas con hipersomnia. Es tas enfermedades pueden estar asociadas o no a la AOS. Hay que realizar una anamnesis completa del paciente, evaluación de toma de fármacos, test o pruebas complementarias necesarios, utilización de un diario del sueño y actigrafía, PSG para valorar diagnósticos alternativos o concomitantes a la AOS, analítica general y metabolismo del hierro, así como estudio de HLA (según sospecha clínica).
3. Valorar la cumplimentación y la eficacia de la CPAP (o tratamiento alter nativo para la AOS). En estos casos, es necesario asegurar una buena cumpli mentación (que en el caso de algunos pacientes puede ser superior a las 4 horas por noche, cifra que marca, de forma arbitraria, una buena cumplimentación), asegurar un correcto uso y elección de interfaces y valorar una titulación correcta de la presión de CPAP durante varias noches asegurando que el número de TRS en todas las posiciones al dormir se normaliza. Puede ser necesario realizar una titulación vigilada mediante PSG o utilizar una autoCPAP.
Una vez comprobado el diagnóstico de AOS, es evidente que la presencia de enferme dades o tratamientos concomitantes susceptibles de provocar hipersomnia deben deser corregidos. Por otro lado, también deben realizarse todos los esfuerzos necesarios para conseguir una adecuada utilización de la CPAP a una presión correcta y monitorizar los
cambios clínicos. Si, a pesar de todo ello, no se consigue controlar estos factores o bien, a pesar de ser controlados, persiste la hipersomnia, existe la posibilidad del tratamiento farmacológico de la hipersomnia (que se trata en el apartado siguiente).
Modafinil. Es un inhibidor de la recaptación de dopamina con una dosis habitual de 200 mg/día. En los ensayos clínicos aleatorizados (ECA) realizados hasta la fecha (habitualmente son los más antiguos), produce una reducción del valor de Epworth de entre 1,8 y 4,5 puntos comparado con placebo. Entre las reacciones adversas más frecuentes (y ocasionalmente graves) están las reacciones cutá neas. La Agencia Europea del Medicamento (AEM) retiró su autorización para el tratamiento de la hipersomnia residual en 2011. En un metanálisis de los ECA realizados entre 2011 y 2007 con una duración de entre 1 y 12 meses, la OR para conseguir la normalización del valor del Epworth (menos de 10 puntos) respecto a placebo fue del 1,95 (IC95%: 1,48-2,56).
Produce una interacción frecuente con otros fármacos por su metabolismo por citocromos hepáticos. Este mismo metanálisis observó un incremento de efectos adversos (casi 4 veces más que en el grupo placebo; 3,84 [1,08-13,9]9 10 .
Armodafinil. Con un mecanismo de acción semejante al modafinil. Un metanálisis de los ECA realizados entre 2001 y 2007 con una duración de entre 1 y 12 meses observó una disminución de 2,24 (IC95%: 3,15-1,32) puntos en el Epworth res pecto a placebo. También presenta una interacción frecuente con otros fármacos por metabolismo por citocromos hepáticos. Este mismo metanálisis no observó un incremento en los efectos adversos, por lo que aparecía como un fármaco más seguro que el modafinil9 10 .
Derivados anfetamínicos. Relacionados con una inhibición de la recaptación de dopamina, noradrenalina y serotonina. Produce una disminución del valor del Epworth de entre 1,5 y 2,7 puntos. Sin embargo, su riesgo cardiovascular y la posibilidad de abuso del fármaco provocaron que actualmente su uso no esté autorizado8 .
Metilfenidato. Es un estimulante directo del sistema nervioso central. Produce una reducción de entre 2,3 y 4,4 puntos en el Epworth. Asimismo, produce un aumento del riesgo cardiovascular y psiquiátrico, así como de abuso del fármaco. Tampoco aprobado para su uso en hipersomnia residual en pacientes con AOS8
Oxibato de sodio. Activador del GABA a una dosis de 6-9 g/día. Reduce el valor del Epworth entre 1,5 y 4,5 puntos. Entre los efectos adversos, destaca la altera ción de los electrolitos y la posibilidad de abuso del fármaco. No aprobado por las agencias reguladoras para esta indicación8 .
Fármaco recientemente aprobado por la EMA para su uso en hipersomnia residual relacionada con la AOS. Su principal mecanismo es actuar como un antagonista hista minérgico. Se utiliza a dosis crecientes de 4,5 a 18 mg/d y ha probado disminuciones del valor del test de Epworth de entre 1,5 y 4,0 puntos. Entre sus efectos adversos, está una posible prolongación del intervalo QT, así como interacciones con otros fármacos. En el contexto de pacientes con AOS, actualmente existen dos estudios fundamentales en forma de ECA (programa HAROSA) que marcan su efectividad tanto en pacientes que rechazan el tratamiento con CPAP como en aquellos que presentan buena adhe rencia al mismo pero hipersomnia persistente. En el primer ECA se aleatorizaron 20 mg/d de pitolisant (n=200) versus placebo (n=68) durante 12 semanas en un análisis por intención de tratar en pacientes con OSA (IAH >15) y un Epworth inicial superior a 12 puntos que rechazaron el tratamiento con CPAP. El principal resultado fueron los cambios del valor del Epworth. Entre los resultados principales destacó un descenso significativo del valor del Epworth respecto a placebo de 2,8 puntos (95%CI:1,5-4) sin diferencias en cuanto a efectos adversos11. El segundo de los ECA presentó ca racterísticas muy similares en cuanto a duración, diagnóstico de OSA e hipersomnia y número de pacientes, pero en este caso en pacientes que a pesar de llevar la CPAP una media de 4,2 horas por noche persistían con un valor de Epworth >12. Se observó un descenso de 2,6 puntos (95%CI:1,4- 3,9), si bien en el grupo pitolisant se observó más frecuencia de insomnio y cefalea. En general, las mejorías de los parámetros subjetivos de hipersomnia (Epworth) fueron paralelas a las mejorías en las mediciones objetivas de hipersomnia12
En un reciente metanálisis de datos individuales en el que se incluyó a 384 pacientes tratados con pitolisant (20 mg) y 128 con placebo, se observó una reducción respecto a placebo de 3,1 (IC95%:2,1-4.1) sin aumento en la incidencia de efectos adversos 13
Otro fármaco de reciente comercialización. Su principal mecanismo de acción es la inhibición de la recaptación de dopamina y serotonina en el sistema nervioso central. La dosis habitual es desde 37,5 mg hasta 150 mg al día, que se va incrementando de forma progresiva hasta alcanzar la mejoría clínica. En estos momentos es el fármaco
que más estudios presenta con resultados positivos. Como efectos adversos, destaca un posible aumento de las cifras de tensión arterial y la interacción con fármacos inhi bidores de la monoaminooxidasa 14. Como indicación para la hipersomnia secundaria a AOS, ha sido aprobado tanto por la EMA como por la FDA (Agencia Americana del Medicamento).
En cuanto a los estudios (en forma de ECA o derivados de los mismos) realizados, destaca el programa TONES.
• Estudio de eficacia y dosis. En el estudio TONES 3 fueron incluidos 476 pacientes con AOS en tratamiento con CPAP (o tratamiento alternativo), pero con un valor del Epworth de al menos 10 puntos. La duración del estudio fue de 4 semanas y se establecieron 4 grupos: 37,5 mg (n=56); 75 mg (n=58); 150 mg (n=116); 300 mg (n=115) de solriamfetol comparados con un grupo placebo (n=114). Como muestra la figura, pudo comprobarse que los mayores descensos del valor de Epworth se produjeron con las dosis de 150 mg (-7,7 puntos) y 300 mg (-7,9 puntos), mientras que con placebo se produjo un descenso de -3,3 puntos. Sin embargo en los grupos con dosis intermedias (37,5 y 75 mg) se produjeron des censos de entre 5 y 5,1 puntos15. Es interesante observar que en el propio grupo placebo los descensos del valor de Epworth fueron clínicamente significativos (la diferencia mínima clínicamente significativa del valor del Epworth se estima entre 2-3 puntos)16-18. Por lo tanto, con respecto a placebo los grupos de menor dosis hicieron disminuir el valor de Epworth en 2,3-2,4 puntos, mientras que en el grupo de 150-300 mg lo hicieron disminuir entre 4,4 y 4,6 puntos. En concreto, en el grupo de 300 mg -4,6 (IC95%: -3,5, -7,9). No hubo diferencia de respuesta entre el grupo de 150 mg y 300 mg, mientras que los efectos adversos fueron dosis-de pendientes, por lo que se concluyó una dosis de 150 mg como la ideal para el manejo de la hipersomnia residual en este sentido. En la mayoría de los casos, los efectos adversos fueron leves.
• Estudio de retirada del fármaco. En el estudio TONES 4, 112 pacientes con AOS en tratamiento con CPAP o tratamiento alternativo pero con un Epworth al menos de 10 puntos fueron tratados en su totalidad con solriamfetol durante 4 semanas, con lo que se consiguió una reducción aproximada de 10 puntos en el test de Epworth (si bien estos pacientes partían de un Epworth inicial superior a 15 puntos de media). En una segunda fase del estudio, 60 pacientes mantuvieron el tratamiento con solriamfetol durante 2 semanas más sin cambios en el valor del Epworth (6.4 vs 6.4), mientras que a 62 pacientes se les proporcionó placebo con aumento significativo de la hipersomnia desde 5,9 a 10,8 puntos en el valor del Epworth19 .
• Estudio de efecto a largo plazo. En el estudio TONES 5, dos series de pacientes (n=333 y n=84) con AOS fueron seguidos durante 40 y 52 semanas respecti vamente. Se observó un descenso inicial en las dos primeras semanas de trata miento del valor de Epworth desde valores de alrededor de 15 puntos a valores de alrededor de 6-7 puntos que se mantuvieron hasta que finalizaron los estudios20 .
• Estudio según adherencia a la CPAP. Se compararon 225 pacientes con AOS bien adheridos al tratamiento con CPAP con 78 con mala adherencia, todos ellos con un valor de Epworth de al menos 10 puntos, seguidos durante 40 semanas. Se observó que, independientemente de la adherencia a la CPAP, el descenso del valor del Epworth desde 15-16 puntos hasta 6,5-6,8 puntos fue muy semejante en ambos grupos hasta finalizar el estudio. Este hecho parece indicar que este fármaco actúa sobre la hipersomnia como tal más allá de la relacionada con la AOS. De hecho, algunos estudios con solriamfetol también han sido realizados con éxito en pacientes con narcolepsia sin AOS21
Finalmente, en un reciente metanálisis de los estudios anteriormente descritos, se observó que el solriamfetol hizo descender la hipersomnia de forma clínicamente y estadísticamente significativa en 4,4 puntos (95%CI: 3,8- 5,5) frente a placebo. En general, las mejorías de los parámetros subjetivos de hipersomnia fueron paralelas a las mejorías de las mediciones objetivas de hipersomnia.
Por último, los efectos adversos son leves y dosis dependientes. Así, no se observó un mayor riesgo de efectos adversos con dosis bajas, pero sí con dosis de 150 mg-300 mg (OR1,56, IC95%: 1,31-1,87 para 150 mg). La mayoría de estos efectos son leves y re versibles, relacionados con cefalea, faringitis, insomnio, nauseas, boca seca o ansiedad.
En la figura 1 se muestran los descensos del valor del test de Epworth según los resul tados de los diferentes metanálisis realizados.
1. La hipersomnia es un síntoma clave que marca la gravedad clínica de la apnea obstructiva del sueño (AOS), su preferencia de derivación, diagnóstico y tratamiento, así como probablemente su pronóstico.
2. Se denomina hipersomnia residual a la que sigue apareciendo a pesar del trata miento de la AOS (sea correcto o no), mientras que se denomina hipersomnia per sistente aquella que por causas ajenas a la AOS persiste tras el correcto tratamiento de la misma.
3. El diagnóstico de ambos tipos de hipersomnia precisa una anamnesis (buscar cau sas alternativas a la AOS en el caso de hipersomnia persistente) y pruebas comple mentarias correctas.
4. En el caso de la hipersomnia residual de la AOS, es necesario asegurar un diagnósti co correcto, una buena adherencia al tratamiento y una normalización de la cantidad de trastornos respiratorios durante el sueño.
5. En el caso de que persista la hipersomnia residual como consecuencia de la impo sibilidad de aplicar un tratamiento de la AOS correcto o eficaz, existen alternativas farmacológicas, de las cuales el pitolisant y el solriamfetol son las más actuales.
1. Bonsignore MR, Randerath W, Schiza S, et al. European Respiratory Society statement on sleep apnoea, sleepiness and driving isk. Eur Respir J. 2021;57(2):2001272.
2. Leger D, Stepnowsky C. The economic and societal burden of excessive daytime sleepiness in patients with obstructive sleep apnea. Sleep Medicine Reviews. 2020;51:101275.
3. Lai C, Weaver TE, Bae CJ, Strohl KP. Excessive Daytime Sleepiness in Obstructive Sleep Apnea Mechanisms and Clinical Management. Ann Am Thorac Soc. 2021;18(5):757-768.
4. Dongol EM, Williams AJ. Residual excessive sleepiness in patients with obstructive sleep apnea on treatment with continuous positive airway pressure. Curr Opin Pulm Med. 2016;22:589-594
5. Pepin JL, Viot-Blanc V, Escourrou P, et al. Prevalence of residual excessive sleepiness in CPAP-treated sleep apnoea patients: the French multicentre study. Eur Respir J. 2009;33:1062-1067.
6. Koutsourelakis I, Perraki E, Economou NT, et al. Predictors of residual sleepiness in adequately treated obstructive sleep apnoea patients. Eur Respir J. 2009;34:687-693.
7. Gasa M, Tamisier R, Launois SH, et al. Residual sleepiness in sleep apnea patients treated by continuous positive airway pressure. J Sleep Res. 2013;22:389-397.
8. Craig S, Pepin JL, Rabderath W, Causse C, Venbraecken J, Asin J, Barbe F, Bonsignore MR. Investigation and management of residual sleepiness in CPAP-treated patients with obstructive sleep apnoea: the European view. Eur Respir Rev. 2022;31:210230.
9. Kuan Y-C, Wu D, Huang K-W, et al. Effects of modafinil and armodafinil in patients with obstructive sleep apnea: a meta-analysis of randomized controlled trials. Clin Therapeut. 2016;38:874e88.
10. Chapman JL, Vakulin A, Hedner J, et al. Modafinil/armodafinil in obstructive sleep apnoea: a systematic review and meta-analysis. Eur Respir J. 2016;47:1420.
11. Dauvilliers Y, Verbraecken J, Partinen M, et al. Pitolisant for daytime sleepiness in patients with obstructive sleep apnea who refuse continuous positive airway pressure treatment. A randomized trial. Am J Respir Crit Care Med. 2020;201(9):1135-1145.
12. 1Pépin JL, Georgiev O, Tiholov R, et al. Pitolisant for residual excessive daytime sleepiness in OSA patients adhering to CPAP: a randomized trial. Chest. 2020;S0012–3692(20):351059.
13. Lehert P. Efficacy of Pitolisant 20 mg in Reducing Excessive Daytime Sleepiness and Fatigue in Patients with Obstructive Sleep Apnoea Syndrome: An Individual Patient Data Meta analysis. Clinical Drug Investigation. 2022;42:65-74.
14. Markham A. Solriamfetol: first global approval. Drugs. 2019;79:785e90.
15. Schweitzer PK, Rosenberg R, Zammit GK, et al. Results of a randomized, placebo-controlled, double-blind, 12-week, multicenter study of solriamfetol (JZP-110) for the treatment of excessive sleepiness in patients with obstructive sleep apnea. Sleep Med. 2017;40:e298.
16. Patel S, Kon SSC, Nolan CM, et al. The Epworth sleepiness scale: minimum clinically important difference in obstructive sleep apnea. Am J Respir Crit Care Med. 2018;197(7):961-963.
17. Lehert P. Epworth sleepiness scale ESS: determination of a minimum clinically relevant difference. Sleep Med. 2017;40(1):186-187.
18. Crook S, Sievi NA, Bloch KE, et al. Minimum important difference of the Epworth Sleepiness Scale in obstructive sleep apnoea: estimation from three randomized controlled trials. Thorax. 2019;74(4):390-396.
19. Strollo P, Redline S, Hedner J, et al. Treatment of excessive sleepiness in patients with OSA: efficacy and safety results of a 6-week, double- blind, placebo-controlled, randomizedwithdrawal trial of JZP-110. Chest. 2017;152:A1092e3.
20. Malhotra A, Shapiro C, Pepin JL, et al. Long-term study of the safety and maintenance of efficacy ofsolriamfetol (JZP-110) in the treatment of excessive sleepiness in participants with narcolepsy or obstructive sleep apnea. Sleep. 2020;43:zsz220.
21. Schweitzer PK, Strohl KP, Mayer G, et al. Effects of solriamfetol in a long-term of participants with obstructive sleep apnea who are adherent or nonadherent to airway therapy. J Clin Sleep Med. 2021;17: 659-668.
22. Subedi R, Singh R, Thakur RK, Bibek KC, Jha D, Ray BK. Efficacy and safety of solriamfetol for excessive daytime sleepiness in narcolepsy and obstructive sleep apnea: a systematic review and meta-analysis of clinical trials. Sleep Med. 2020;75:510e521.

Reducción del valor del Epworth
Armodafinil Pitolisant Solriamfetol
Fármaco
BIOMARCADORES Y MEDICINA DE PRECISIÓN EN APNEA DEL SUEÑO
Autor
Manuel Sánchez de la Torre
El sueño es una función biológica esencial con una implicación importante para la bioe nergética celular y del organismo, en particular para la recuperación, la conservación y la supervivencia. Una calidad y una cantidad de sueño adecuadas son esenciales para mantener una buena salud y una buena calidad de vida. Sin embargo, millones de personas no duermen lo suficiente y están expuestas a una pérdida crónica del sueño. La pérdida de cantidad y calidad de nuestro sueño es una característica dominante en el estilo de vida de la sociedad actual, una sociedad que todavía resta importancia a los efectos adversos asociados a la habitual insuficiencia de sueño. La duración promedio del sueño ha caído por debajo de las 7 horas por noche, lo que refleja una disminución de unas 2 horas de la duración del sueño durante el último siglo, que parece debida principalmente a cambios ambientales (p. ej., exposición a la luz artificial) y sociales. La duración del sueño no es solo un hábito que las personas adoptan por voluntad propia, sino que también puede verse influida por situaciones físicas, mentales, laborales y otras muchas condiciones sociales. Los efectos nocivos que la pérdida crónica del sueño supone para la salud se han reconocido de manera amplia y concluyente en numerosos estudios epidemiológicos¹.
Además de tendencias actuales que limitan la cantidad y la calidad de nuestro sueño, también resulta evidente que algunas personas padecen una variedad de trastornos del sueño. Dichos trastornos afectan la vida laboral y aumentan el riesgo de desarrollar obesidad y de padecer mortalidad prematura. Entre todos los trastornos del sueño, una de las condiciones más recurrentes que ponen en peligro la calidad y la duración del sueño es el desarrollo de trastornos respiratorios durante el sueño, siendo la apnea obstructiva del sueño (AOS) la patología más prevalente.
La AOS es un trastorno respiratorio caracterizado por la oclusión total o parcial de la vía aérea durante el sueño y que ocurre en todas las edades². Se trata de una patología crónica, frecuente y multifactorial que afecta al 10-20% de la población adulta, siendo más prevalente entre la población masculina y de mayor edad3. La AOS acarrea impor tantes consecuencias fisiopatológicas que conducen a deterioro de la calidad de vida, aumento de los accidentes de tráfico y laborales, depresión, deterioro cognitivo, enfer medades cardiovasculares y metabólicas y, más recientemente, también cáncer4 5. Las manifestaciones clínicas de la AOS son marcadamente heterogéneas, de modo que dos pacientes con la misma gravedad de la enfermedad definida por sus estudios de sueño no necesariamente manifestarán síntomas o consecuencias similares. La fisiopatología de la AOS incluye la reducción de las dimensiones de la vía aérea superior como re
sultado de alteraciones anatómicas y/o funcionales (obesidad o cambios estructurales maxilofaciales). La AOS se caracteriza clínicamente por ronquido intermitente, sueño no reparador y somnolencia diurna. Los eventos asociados con el colapso de la vía aérea superior dan lugar a microdespertares encefalográficos (también denominados arousals) que generan fragmentación del sueño, cambios de la presión intratorácica y episodios de hipoxia-reoxigenación. Los eventos provocados por cada episodio de apnea ocurren repetidamente durante el sueño e inducen la activación de mecanismos intermedios que se relacionan con las consecuencias fisiopatológicas asociadas a la AOS, tales como activación simpática, disfunción endotelial, hipercoagulabilidad, estrés oxidativo, inflamación y desregulación metabólica3 .
La apnea del sueño es una enfermedad compleja y multifactorial causada por la in teracción de la expresión de distintos genes y factores ambientales a los que está expuesto el individuo. De los factores de riesgo que predisponen al desarrollo de la AOS, la obesidad es el más determinante. La obesidad es, en sí misma, una patología compleja que se manifiesta por la interacción gen-ambiente. Además de la obesidad, el consumo de alcohol en horas previas al sueño y el consumo de fármacos sedantes son factores de riesgo para el desarrollo de la AOS. Además de los factores externos, numerosos estudios que han explorado la contribución genética a la manifestación de esta patología han proporcionado evidencia del posible vínculo entre la AOS y los fac tores genéticos. Así, se estima que un porcentaje del 35-40% de su varianza se puede atribuir a factores genéticos6 (Figura 2)
La medicina de precisión es una realidad en la práctica clínica asistencial que ha co menzado a cambiar los paradigmas de la medicina e incluso a modificar la forma de clasificación de las enfermedades complejas. La medicina de precisión tiene como objetivo principal identificar tratamientos específicos y personalizados dirigidos a las necesidades individuales de cada paciente en base a las características genéticas, biomarcadores, características fenotípicas o psicológicas que distinguen a un paciente de otro con rasgos similares. Inherente a esta definición está el objetivo de mejorar los resultados de salud de cada paciente de manera individual minimizando a la vez los efectos adversos no deseados7
La aplicación de la medicina de precisión proporciona una nueva dimensión en el diag nóstico y tratamiento de las enfermedades complejas. Por un lado, implica nuevas y más detalladas clasificaciones diagnósticas basadas en los factores anteriormente in dicados que diferencian subgrupos de pacientes dentro de una enfermedad específica. Por el otro, implica el desarrollo de nuevos tratamientos personalizados, solo aplicables
a grupos específicos de pacientes entre los que padecen la enfermedad. Estos trata mientos serían más específicos, más efectivos y menos nocivos. Por lo tanto, se evitaría indicaciones de tratamientos en pacientes no respondedores, lo que generaría una re ducción significativa de los costes del sistema sanitario y una mejora de los resultados del paciente. La medicina de precisión contempla la aproximación de la medicina 4P, una medicina basada en el uso de herramientas Predictivas, Preventivas, Personaliza das y Participativas. La medicina de precisión potencia la efectividad y la eficiencia, pues permite emplear las estrategias terapéuticas más apropiadas en función de las características de cada paciente. Además, favorece la aplicación del esquema terapéutico más oportuno en los pacientes, ya que toma en consideración la variabilidad genética, junto a factores ambientales que también inciden en su manifestación. Así, evita aplicar a los pacientes tratamientos que no sean útiles para ellos, reduce los efectos adversos derivados de aplicar tratamientos en pacientes sin posibilidades de respuesta, disminuye las compli caciones secundarias derivadas de tratar a los pacientes con tratamientos ineficaces y evita la pérdida de oportunidad que ello supone. Finalmente, desde un punto de vista económico y de coste-eficacia, la medicina de precisión se presenta como una oportu nidad para desarrollar un sector industrial de alto valor estratégico, sanitario, científico y económico. Además, contribuye a racionalizar el gasto y a mejorar la sostenibilidad del sistema sanitario.
La biología de sistemas, junto con la revolución digital y tecnológica, ha permitido de sarrollar la medicina de sistemas, cuyo objetivo es cuantificar la salud y centrarse en el paciente, no en la enfermedad, con una asistencia sanitaria 4P8. Las enfermedades pueden conceptualizarse como fenotipos, destacando una interacción gen-ambiente, o pueden verse como un estado del sistema, con patrones de estabilidad y resiliencia en que las transiciones de estado sano a enfermo estén guiadas por alteraciones homeos táticas. Los biomarcadores establecen un vínculo entre estas dos concepciones, lo que facilita la transición de “molécula y célula” a “individuo y población”.
Los biomarcadores pueden definirse como características susceptibles de ser evalua das y medidas como indicadores de procesos biológicos normales, patogénesis o de respuesta a una determinada intervención terapéutica. Los biomarcadores son, pues, características biológicas medibles, sólidas, indicativas de procesos biológicos asocia dos con el estado clínico de un paciente. Aunque los biomarcadores han sido parte de la atención clínica estándar desde que se desarrollaron las primeras prácticas médicas, el avance tecnológico ha acelerado su utilidad y aplicabilidad haciendo que, de simples
pruebas fisicoquímicas, pasen a ser marcos complejos que allanan el camino para la transformación de la atención médica personalizada y basada en el valor.
En el siglo XVIII, Matthew Dobson ya indicaba la utilidad del dulzor de la orina como biomarcador de presencia de glucosa, que también podía medirse en la sangre del paciente9. Hoy en día, la diabetes es uno de los trastornos más ampliamente estudiados y ha dispuesto de alguno de los sistemas tecnológicamente más avanzados que nacen de la combinación de la medida de biomarcador y acción terapéutica, como es el caso de los sistemas de administración de insulina sensibles a la glucosa, que miden y mo nitorean con precisión los niveles de azúcar.
La utilidad de los biomarcadores no solo reside en su utilización como factor medible de un estado fisiológico alterado, sino como signo de evolución clínica (pronóstico) y/o de respuesta en intervención terapéutica (predicción). Tal y como se detalla en la tabla I, los biomarcadores pueden clasificarse según su utilidad clínica.
Actualmente, el porcentaje de biomarcadores que termina validando y demostrando su utilidad clínica y recibe la aprobación por parte de las distintas agencias reguladoras para su explotación es muy bajo. A modo de ejemplo, solo un 3% de los biomarcadores reportados en la bibliografía se utilizan en la práctica clínica habitual. Un informe pu blicado en 2010 informó que solo 24 biomarcadores para cáncer de 1.261 proteínas citadas en la literatura y con potencial utilidad habían recibido la aprobación para su explotación por parte de la agencia reguladora de la FDA (USA Food and Drug Admi nistration)10 .
Así pues, a pesar de que a menudo se indican nuevos biomarcadores con potencial clínico, resulta necesario comprender el largo periodo que transcurre actualmente hasta su implantación en la práctica clínica, fruto de la necesidad de validar y contrastar dicho potencial. La investigación de biomarcadores se ha visto revolucionada por el desarrollo de tecnologías de alto rendimiento (mayoritariamente “ómicas”: genómica, proteómica, metabolómica, lipidómica, transcriptómica, etc.) y métodos de inteligencia artificial, lo que ha dado lugar a una prolífica fase de descubrimiento de biomarcadores. Ahora se necesitan esfuerzos adicionales a fin de desarrollar la infraestructura analítica necesaria para generar, integrar y analizar datos multiómicos de manera efectiva. El éxito en este esfuerzo depende de lograr mayores niveles de armonización entre los diferentes tipos de datos e integración multiómica eficiente de los resultados de estudios individuales.
En patologías crónicas, frecuentes y complejas como la AOS, la medicina de precisión aporta un destacable valor para la mejora de su manejo integral11 12. El escenario presente y futuro ya reporta una sobrecarga en la gestión de ciertas patologías crónicas
como la AOS, íntimamente relacionadas con el envejecimiento progresivo de la pobla ción de nuestro entorno y el aumento de casos de obesidad. En este contexto de siste mas de atención de salud con limitaciones de gasto y aumento del número de casos, resulta imperativo implementar sistemas de mejora integral del manejo del paciente basados en herramientas de medicina de precisión. Así, la mejora en el manejo de estas patologías contempla la necesidad de incorporar nuevas herramientas rentables de diagnóstico, tratamiento y seguimiento, junto con nuevos escenarios clínicos que per mitan un manejo certero y preciso de los pacientes con enfermedades crónicas y pre valentes, reservando la asignación de servicios muy especializados a los pacientes más complejos que son difíciles de manejar o tienen mayor riesgo de morbilidad y mortalidad.
En el manejo integral de la AOS, es necesario incluir acciones específicas orientadas a la mejora del diagnóstico de la enfermedad y la estratificación del riesgo. Además, resulta necesario implementar nuevas herramientas que ayuden a mejorar la toma de decisiones en la elección del tratamiento, especialmente en el perfil de paciente en que sea posible predecir una respuesta positiva al tratamiento de la AOS. Asimismo, la bibliografía disponible describe ampliamente la necesidad de una adecuada adherencia al tratamiento con presión positiva continua en la vía aérea (CPAP, del inglés continuos positive airway pressure), que es el tratamiento gold-standard para la AOS, igual o superior a 4 horas por noche, para obtener un beneficio de dicho tratamiento, en es pecial para prevención primaria cardiovascular. Así, es necesario desarrollar sistemas personalizados que mejoren la adherencia al tratamiento y los sistemas predictivos de mala adherencia. Finalmente, para una gestión integral de la enfermedad median te herramientas de medicina de precisión es fundamental disponer de biomarcadores pronósticos de buena o mala evolución clínica y predictivos de respuesta adecuada al tratamiento de la AOS.
Hoy en día, la AOS sigue siendo una enfermedad infradiagnosticada. Se estima que hasta un 90% de los pacientes no están diagnosticados. En la actualidad se dispone de sistemas simplificados para el diagnóstico de la AOS, principalmente los basados en sistemas de poligrafía respiratoria, que han demostrado su precisión y capacidad diag nóstica, especialmente en los pacientes con varios factores de riesgo y alta probabilidad pretest de sufrir AOS13. No obstante, es necesario desarrollar un sistema de cribado o screening que permita mejorar la identificación de los pacientes que puedan sufrir esta enfermedad. Durante los últimos años, se ha explorado un gran número de moléculas con potencial diagnóstico. No obstante, pocos casos han demostrado ser más cos te-efectivos que los sistemas habituales simplificados.
Durante los últimos años, se ha reportado la validación independiente y la utilidad para el cribado de AOS en hombres del análisis combinado de varios biomarcadores, que incluyen la proteína C reactiva (CRP), la hemoglobina glicada (HbA1c) y la eritropoyetina (EPO)14. El análisis combinado de estos biomarcadores aportó un área bajo la curva (AUC, del inglés, area under de curve) de 0,78 (superior a la escala de somnolencia de Epworth (AUC; 0,53) o al cuestionario de STOP-bang (AUC; 0,70).
Otros estudios han explorado una amplia batería de marcadores proteicos. Concreta mente, de un análisis que incluía 1.300 proteínas se reportó la existencia de 65 pro teínas asociadas con AOS. Entre ellas, destacaba la laminina, aminoacilasa-1, receptor de la hormona del crecimiento e interleucina 8 (IL-8) y la proteína activadora tisular del plasminógeno (tPA). Estas proteínas se encontraron correlacionadas positivamente con el índice de apnea-hipopnea (AH), principal variable que define la gravedad de la AOS. Por el contrario, los niveles en suero de las proteínas anhidrasa carbónica I, UNC5H4 -un receptor de la familia UNC5D- y factor de crecimiento similar a la insulina (IGFBP-1) estaban disminuidos en pacientes con AOS15. Otros trabajos que tenían como objetivo realizar una revisión sistemática de la evidencia disponible en biomarcadores para el diagnóstico de la AOS reportó interleucina 6 (IL-6) e interleucina 10 (IL-10), detectadas en muestras de sangre periférica, como los biomarcadores candidatos más fiables16 .
Recientemente, un estudio metabolómico y lipidómico en pacientes que acuden a la unidad de sueño por sospecha de AOS ha reportado que aquellos con el diagnóstico de la enfermedad confirmado por polisomnografía presentaban un perfil metabolómico específico. Concretamente, mostraron un perfil compuesto por 33 metabolitos (princi palmente glicerofosfolópidos y ácidos biliares)17. Estos biomarcadores se correlacio naban con variables específicas de la polisomnografía relacionadas con la gravedad de la AOS, concretamente con variables de fragmentación de sueño e hipoxemia. Un proceso basado en machine learning identificó que el análisis de 4 de estos biomar cadores reportaba un AUC de 0,98. Cabe destacar que se trata de un estudio piloto cuya utilidad aún debe demostrarse mediante la validación de estos biomarcadores en otras poblaciones independientes. Además de la utilidad de estos estudios para identi ficar potenciales biomarcadores, resulta destacable también su utilidad para identificar, mediante técnicas de análisis masivo no sesgado, nuevos biomarcadores que señalen rutas específicas que contribuyan al conocimiento de la enfermedad y de sus conse cuencias fisiopatológicas. Además de los biomarcadores proteicos, los microRNAs (miRNAs) han surgido recien temente como candidatos potenciales para el diagnóstico de la AOS18 19. Los miRNAs son ácidos ribonucleicos pequeños no codificantes con una longitud de entre 19 y 25 nucleótidos que regulan la expresión de genes diana. Así, se han reportado distintos estudios que han señalado la utilidad potencial de estas moléculas como biomarcado res para el screening de AOS19. Recientemente, un estudio realizado en una población
de hombres con sospecha de AOS identificó un conjunto de miRNAs (miR-181a, miR199b, miR-345, miR-133a, miR-340 and miR-486-3p) con utilidad para la identifi cación AOS con una AUC de 0,81. Este estudio demostró que incluir otras variables clínicas y antropométricas accesibles en la práctica clínica, tales como el índice de masa corporal, la circunferencia del cuello, la edad y el sexo, junto con los niveles de estos miRNAs, mejoran este modelo con una AUC que se ve incrementada hasta 0,86. Resulta necesario, una vez más, destacar el carácter exploratorio de este estudio. Así, la utilidad y la solidez de estos resultados como biomarcadores para el screening de la AOS debe confirmarse independientemente. Cabe destacar la necesidad de explorar una firma molecular basada en estos biomarcadores en la población de mujeres. Es tudios previos han demostrado un claro efecto del sexo en el perfil de expresión de los miRNAs20. Esta investigación debe abordarse de manera prioritaria para dilucidar la utilidad potencial de estos biomarcadores para el screening de la AOS en la población de mujeres.
Además de sugerir la posible utilidad de los miRNAs en el screening y diagnóstico de AOS, estos biomarcadores también han señalado su posible utilidad como predictores de respuesta al tratamiento con CPAP en pacientes con hipertensión resistente21. No obstante, estos estudios seminales aún deben ser explorados y confirmados en otras cohortes de pacientes más amplias e independientes.
Además de los esfuerzos realizados en la población adulta, numerosos estudios tam bién han evaluado el potencial diagnóstico de una larga batería de biomarcadores para el diagnóstico de la AOS en la población infantil. A diferencia de los estudios realizados en adultos, con un perfil clínico en muchos casos de mayor comorbilidad y complejidad que el que presentan los niños, los resultados obtenidos en estos últimos han sido más sólidos. Entre los biomarcadores explorados, la combinación de urocortina-3, oroso mucoide-1, calicreína-1 y uromodulina evaluadas en muestras de orina demostró una magnífica precisión diagnóstica con una sensibilidad del 100% y una especificidad del 97%22. También se ha reportando en niños la potencial utilidad del análisis de neuro transmisores en orina para el diagnóstico de la AOS con una sensibilidad de 82% y una especificidad del 90%23 . Además de los biomarcadores para el cribado y el diagnóstico de la AOS, resultan de gran interés los que mejoren la clasificación de los pacientes y puedan ayudar a mejorar la estratificación de la gravedad de la patología. El diagnóstico y la gravedad de la AOS se basan en medidas convencionales, como son el IAH y/o el índice de desaturación de oxígeno, un método excesivamente simplista que no aborda la complejidad de la manifestación de esta patología. Así, el diagnóstico basado exclusivamente en estas medidas resulta muy limitado, y numerosos estudios han reportado que estas variables no se correlacionan con la manifestación clínica de la enfermedad24. Asimismo, el IAH tampoco ha demostrado de manera uniforme su utilidad pronóstica de evolución clíni ca25 26. Resulta necesario identificar nuevas métricas para el diagnóstico y la estrati
ficación de la gravedad de la AOS. En este sentido, nuevos biomarcadores basados en señales obtenibles de los estudios de sueño, tales como la carga hipóxica, han demos trado su utilidad para el pronóstico de las complicaciones cardiovasculares asociadas a la AOS26. Así, estudios recientes demostraron que los pacientes con mayor carga hipóxica presentaban una mayor incidencia de eventos cardiovasculares, por lo que los pacientes de este grupo serían los más susceptibles a los efectos deletéreos de la AOS27. Debido a la creciente generación de evidencia en la contribución para el manejo personalizado de la AOS en base a la medida de este biomarcador, la incorporación de este en el sistema de clasificación de los pacientes con AOS comienza a ser una priori dad. Así, la incorporación de la carga hipóxica y de otros biomarcadores, como los ba sados en la frecuencia cardíaca (delta heartrate)28 o la medida de la amplitud de onda de pulso29, pueden mejorar la clasificación de pacientes, la estratificación de riesgo, el pronóstico de la enfermedad y la predicción de respuesta al tratamiento.
Además de la demostrada utilidad de distintos y novedosos biomarcadores para el diagnóstico y la estratificación del riesgo de la enfermedad, también se han descrito otros cuya contribución se busca para otra de las facetas claves de la medicina de pre cisión en la AOS, como es el pronóstico y la predicción de respuesta al tratamiento del paciente tratado. Los biomarcadores pueden desempeñar una función pronóstica con especial relevancia en su función predictiva del desarrollo de eventos adversos. La AOS es una patología prevalente en pacientes con patología cardiovascular. Así, la evidencia disponible apoya una asociación causal de la AOS con la incidencia y la morbilidad de la hipertensión, enfermedad coronaria, arritmia, insuficiencia cardíaca y accidente cerebrovascular.
Estudios recientes han señalado la utilidad de explorar el patrón circadiano de presión arterial en pacientes con AOS, siendo la presencia de un patrón nondipper un biomar cador de mala evolución clínica. Este patrón, caracterizado por un descenso insuficiente de los niveles de presión arterial durante la noche, se relaciona con un elevado riesgo de desarrollo futuro de una complicación cardiovascular grave. Recientemente, se ha reportado que este patrón anómalo es frecuente en pacientes con AOS y que el trata miento efectivo con CPAP disminuye los niveles de presión arterial nocturna. Así, actual mente resultaría prioritario evaluar el patrón circadiano de presión arterial en pacientes con AOS, dado que el paciente con un patrón anómalo non-dipper se beneficiaría del tratamiento con CPAP para el control de su presión arterial30 31 .
En el proceso de identificación de biomarcadores candidatos para el manejo persona lizado de la AOS, resulta de interés el análisis sesgado que explora aquellos biomarca dores previamente descritos e íntimamente ligados a losmecanismos fisiopatológicos de la AOS. Esta estrategia de búsqueda tiene como objetivo identificar en el paciente niveles alterados de biomarcadores relacionados con los principales mecanismos in termedios desencadenados por las consecuencias de la AOS y que contribuyen, entre
otros, al desarrollo de complicaciones cardiovasculares32. La identificación y monitori zación de la expresión de biomarcadores específicos de dichos mecanismos interme dios podría contribuir a estratificar adecuadamente el riesgo del paciente con AOS y ayudaría a mejorar el manejo individualizado y personalizado del paciente11 12. Así, en pacientes con AOS se han estudiado un amplio número de biomarcadores relacionados con activación simpática, disfunción endotelial, hipercoagulabilidad, estrés oxidativo, inflamación y desregulación metabólica, siendo estos algunos de los principales meca nismos que relacionan la AOS con la enfermedad cardiovascular (Figura 1).
Además de la relación ampliamente descrita entre la AOS y las enfermedades cardio vasculares y la hipertensión, también se reconoce como un factor de riesgo de demen cia y se asocia con posibles mecanismos que podrían conducir a la neurodegeneración. Así, se han explorado biomarcadores que permitan identificar trastornos cognitivos y neurodegenerativos en pacientes con AOS. Distintos estudios han reportado un au mento de angiopoietina-1, inhibidor 1 del activador del plasminógeno, insulina e inter leuquina 1ꞵ33. También se han explorado biomarcadores de demencia en apnea del sueño. El ꞵ-amiloide, las proteínas Tau, la homocisteína, marcadores de estrés oxidativo y la clusterina serían biomarcadores candidatos clave para predecir y comprender el desarrollo de la neurodegeneración en pacientes con apnea obstructiva del sueño34 .
Finalmente, también se ha sugerido el papel de la AOS en procesos tumorogénicos y en cáncer. Algunos estudios de carácter observacional han sugerido que la AOS se asocia con una mayor prevalencia, incidencia y mortalidad del cáncer35 36. Estudios seminales que han tratado de explorar biomarcadores que señalan la relación entre am bas enfermedades han mostrado que, en pacientes con melanoma cutáneo, la AOS se asocia con niveles circulantes elevados de VCAM-1 que podrían indicar la contribución de la AOS a la tumorogénesis a través de la adhesión basada en integrinas37. También se ha reportado recientemente el papel del PD-L1 soluble como potencial biomarcador de agresividad y metástasis en pacientes con melanoma cutáneo y AOS.
1. El sueño es una función biológica esencial con una implicación importante para la bioenergética celular y del organismo, en particular la recuperación, la conservación y la supervivencia. Una calidad y una cantidad de sueño adecuadas son esenciales para mantener una buena salud y una buena calidad de vida. Los efectos nocivos para la salud de la pérdida crónica del sueño se han reconocido de manera amplia y concluyente en numerosos estudios epidemiológicos. Entre todos los trastornos del sueño, una de las condiciones más prevalentes que limitan la calidad y la duración del sueño es el desarrollo de trastornos respiratorios durante el sueño, siendo la apnea obstructiva del sueño (AOS) la patología más prevalente.
2. La AOS es un trastorno respiratorio caracterizado por la oclusión total o parcial de la vía aérea durante el sueño y que ocurre en todas las edades. Se trata de una patología crónica, frecuente y multifactorial que afecta al 10-20% de la población adulta siendo más prevalente en la población masculina y de mayor edad. La apnea del sueño es una enfermedad compleja multifactorial causada por la interacción de la expresión de distintos genes y factores ambientales a los que está expuesto el in dividuo. La AOS impone importantes consecuencias fisiopatológicas que conducen a deterioro de la calidad de vida, aumento de los accidentes de tráfico y laborales, depresión, deterioro cognitivo, enfermedades cardiovasculares y metabólicas y, más recientemente, también cáncer.
3. La medicina de precisión tiene como principal objetivo identificar tratamientos es pecíficos y personalizados dirigidos a las necesidades individuales de cada paciente en base a las características genéticas, biomarcadores, características fenotípicas o psicológicas, que distinguen a un paciente de otro con rasgos similares. Inherente a esta definición está el objetivo de mejorar los resultados de salud de cada pacien te de manera individual minimizando a la vez los efectos adversos no deseados.
4. La aplicación de la medicina de precisión proporciona una nueva dimensión en el diagnóstico y tratamiento de las enfermedades complejas. Por un lado, impli ca nuevas y más detalladas clasificaciones diagnósticas basadas en los factores anteriormente indicados que diferencian subgrupos de pacientes dentro de una enfermedad específica. Por el otro, implica el desarrollo de nuevos tratamientos personalizados, solo aplicables a grupos específicos de pacientes entre los que padecen la enfermedad. Estos tratamientos serían más específicos, más efectivos y menos nocivos. Por lo tanto, se evitaría indicaciones de tratamientos en pacientes no respondedores, lo que generaría una reducción significativa de los costes del sistema sanitario y una mejora de los resultados del paciente. La medicina de pre cisión contempla la aproximación de la medicina 4P, una medicina basada en el uso de herramientas Predictivas, Preventivas, Personalizadas y Participativas.
5. Los biomarcadores pueden definirse como características susceptibles de ser evaluadas y medidas como indicadores de procesos biológicos normales, patogénesis o de respuesta a una determinada intervención terapéutica. Los biomarcadores son, pues, características bio lógicas medibles, sólidas, indicativas de procesos biológicos asociados con el estado clínico de un paciente.
6. En patologías crónicas, frecuentes y complejas como la AOS, la medicina de precisión aporta un destacable valor para la mejora del manejo integral de esta enfermedad. En el manejo in tegral de la AOS es necesario incluir acciones específicas orientadas a mejorar el diagnóstico de la enfermedad y la estratificación del riesgo. Además, resulta necesario implementar nue vas herramientas que ayuden mejorar la toma de decisiones en la elección del tratamiento, especialmente en el perfil de paciente en que sea posible predecir una respuesta positiva al tratamiento de la AOS.
7. El diagnóstico de la AOS basado exclusivamente en medidas como el IAH y el índice de desaturación de oxígeno resulta muy limitado. Es necesario identificar nuevas métricas para el diagnóstico y la estratificación de la gravedad de la AOS. En este sentido, nuevos biomarca dores basados en señales obtenibles de los estudios de sueño, tales como la carga hipóxica, y otros biomarcadores, como los basados en la frecuencia cardíaca (delta heartrate) o la medida de la amplitud de onda de pulso, pueden contribuir a mejorar la clasificación de pacientes, estratificación de riesgo, pronóstico de la enfermedad y predicción de respuesta al tratamien to. Además, la caracterización del patrón circadiano de presión arterial en pacientes con AOS contribuye al manejo personalizado de esta patología. Así, el paciente con un patrón anómalo non-dipper se beneficiaría del tratamiento con CPAP para el control de su presión arterial.
8. La AOS sigue siendo hoy día una enfermedad infradiagnosticada. Se estima que hasta un 90% de los pacientes no están diagnosticados. Durante los últimos años, se ha reportado la validación independiente y la utilidad para el cribado de AOS en hombres del análisis com binado de varios biomarcadores, que incluyen la proteína C reactiva (CRP), la hemoglobina glicada (HbA1c) y la eritropoyetina (EPO). Recientemente, se ha reportado un perfil meta bolómico específico asociado con AOS. Concretamente, mostraron un perfil compuesto por 33 metabolitos (principalmente glicerofosfolópidos y ácidos biliares). Estos biomarcadores se correlacionaban con variables específicas de la polisomnografía relacionadas con la gravedad de la AOS.
9. En el proceso de identificación de biomarcadores candidatos para el manejo personalizado de la AOS, resulta de interés el análisis sesgado que explora aquellos biomarcadores previa mente descritos e íntimamente ligados a los mecanismos fiosiopatológicos de la AOS. Esta estrategia de búsqueda tiene como objetivo identificar en el paciente niveles alterados de bio marcadores relacionados con los principales mecanismos intermedios desencadenados por las consecuencias de la AOS y que contribuyen, entre otros, al desarrollo de complicaciones cardiovasculares. Así, en pacientes con AOS, se han estudiado un amplio número de bio marcadores relacionados con activación simpática, disfunción endotelial, hipercoagulabilidad, estrés oxidativo, inflamación y desregulación metabólica, siendo estos algunos de los princi pales mecanismos que relacionan la AOS con la enfermedad cardiovascular. También se han descrito biomarcadores asociados con AOS en pacientes con procesos neurodegenerativos o cáncer. La determinación de dichos biomarcadores contribuiría a caracterizar el estado del paciente y relacionar la manifestación de estas patologías con la presencia de AOS.
1. Givens ML, Malecki KC, Peppard PE, Palta M, Said A, Engelman CD, et al. Shiftwork, sleephabits, and metabolic disparities: results from the Survey of the Health of Wisconsin. SleepHeal. 2015;1(2):115-120.
2. Mediano O, Mangado NG, Montserrat JM, Alvarez MLA, Almendros I, Alonso- Fernández A, et al. Documento internacional de consenso sobre apnea obstructiva del sueño. Archivos de bronconeumología. 2021;1-19.
3. Benjafield AV, Ayas NT, Eastwood PR, Heinzer R, Ip MSM, Morrell MJ, et al. Estimation of the global prevalence and burden of obstructive sleep apnoea: a literature-based analysis. LancetRespir Medicine. 2019;7(8):687-698.
4. Sánchez-de-la-Torre M, Campos-Rodriguez F, Barbé F. Obstructive sleep apnoea and car diovascular disease. The Lancet Respiratory Medicine. 2013;1(1):61-72.
5. Campos-Rodriguez F, Martinez-Garcia MA, Martinez M, Durán-Cantolla J, De la Peña M, Masdeu MJ, et al. Association between obstructive sleep apnoea and cancer incidence in a large multicenter Spanish cohort. American journal of respiratory and criticalcare medicine. 2013 1;187(1):99-105.
6. Redline S, Tishler PV. The genetics of sleep apnea. SleepMed Rev. 2000;4(6):583- 602.
7. Jameson JL, Longo DL. Precision Medicine - Personalized, Problematic, and Promising. New Engl J Medicine. 2015;372(23):2229-2234.
8. Aderem A. Systems biology: its practice and challenges. Cell. 2005;121(4):511-513.
9. Eknoyan G, Nagy J. A history of diabetes mellitus or how a disease of the kidneys evolved into a kidney disease. AdvChronicKidney D. 2005;12(2):223-229.
10. Dunn BK, Wagner PD, Anderson D, Greenwald P. Molecular Markers for Early Detection. SeminOncol. 2010;37(3):224-242.
11. Sánchez-de-la-Torre M, Gozal D. Obstructive sleep apnea: in search of precision. Expert Review of Precision Medicine and Drug Development. 2017;2(4):217-228.
12. Martinez-Garcia MA, Campos-Rodriguez F, Barbé F, Gozal D, Agustí A. Precision medicine in obstructive sleep apnoea. Lancet Respir Medicine. 2019;7(5):456-454.
13. Masa JF, Corral J, Pereira R, Durán-Cantolla J, Cabello M, Hernández-Blasco L, et al. Effec tiveness of home respiratory polygraphy for the diagnosis of sleep apnoea and hypopnoea syndrome. Thorax. 2011;66(7):567-573.
14. Fleming WE, Holty JEC, Bogan RK, Hwang D, Ferouz-Colborn AS, Budhiraja R, et al. Use of blood biomarkers to screen for obstructive sleep apnea. Nature and Science of Sleep. 2018;10:159-167.
15. Ambati A, Ju YE, Lin L, Olesen AN, Koch H, Hedou JJ, et al. Proteomic biomarkers of sleep apnea. Sleep. 2020;43(11).
16. Canto GDL, Pachêco-Pereira C, Aydinoz S, Major PW, Flores-Mir C, Gozal D. Biomar kers associated with obstructive sleep apnea: A scoping review. Sleep medicine reviews. 2015;23:28-45.
17. Pinilla L, Benítez ID, Santamaria-Martos F, Targa A, Moncusí-Moix A, Dalmases M, et al. Plasma profiling reveals a blood-based metabolic fingerprint of obstructive sleep apnea. BiomedPharmacother. 2022;145:112425.
18. Santamaría-Martos F, Benítez I, Zapater A, Girón C, Pinilla L, Fernandez-Real JM, et al. Iden tification and validation of circulating miRNAs as endogenous controls in obstructive sleep apnea. Taguchi Y h, editor. PLoS ONE. 2019;14(3):e0213622.
19. Santamaría-Martos F, Benítez I, Ortega F, Zapater A, Girón C, Pinilla L, et al. Circulating microRNA profile as a potential biomarker for obstructive sleep apnea diagnosis. Scientific reports. 2019;9(1):13456-13459.
20. Guo L, Zhang Q, Ma X, Wang J, Liang T. miRNA and mRNA expression analysis reveals potential sex-biased miRNA expression. Scientific reports. 2017;7(1):39812.
21. Sánchez-de-la-Torre M, Khalyfa A, Sánchez-de-la-Torre A, Martinez-Alonso M, Marti nez-García MA, Barceló A, et al. Precision Medicine in Patients With Resistant Hypertension and Obstructive Sleep Apnea Blood Pressure Response to Continuous Positive Airway Pres sure Treatment. J Am CollCardiol. 20151;66(9):1023-1032.
22. Gozal D, Jortani S, Snow AB, Kheirandish-Gozal L, Bhattacharjee R, Kim J, et al. Two-di mensional differential in-gel electrophoresis proteomic approaches reveal urine candidate biomarkers in pediatric obstructive sleep apnea. American journal of respiratory and critical care medicine. 2009;180(12):1253-1261.
23. Kheirandish-Gozal L, McManus CJT, Kellermann GH, Samiei A, Gozal D. Urinary neurotrans mitters are selectively altered in children with obstructive sleep apnea and predict cognitive morbidity. Chest. 2013;143(6):1576-1583.
24. Pevernagie DA, Strazisar BG, Grote L, Heinzer R, McNicholas WT, Penzel T, et al. Ontherise and fall of the apnea−hypopnea index: A historical review and critical appraisal. J Sleep Res. 2020 may 14;86(4):51-20.
25. Sánchez-de-la-Torre M, Torre AS de la, Bertran S, Abad J, Durán-Cantolla J, Cabriada V, et al. Effect of obstructive sleep apnoea and its treatment with continuous positive airway pressure on the prevalence of cardiovascular events in patients with acute coronary syndro me (ISAACC study): a randomised controlled trial. The Lancet Respiratory Medicine. 2019;
26. Azarbarzin A, Sands SA, Stone KL, Taranto-Montemurro L, Messineo L, Terrill PI, et al. The hypoxic burden of sleep apnoea predicts cardiovascular disease-related mortality: the Os teoporotic Fractures in Men Study and the Sleep Heart Health Study. European Heart Jour nal. 2019;40(14):1149-1157.
27. Trzepizur W, Blanchard M, Ganem T, Balusson F, Feuilloy M, Girault JM, et al. Sleep Ap nea Specific Hypoxic Burden, Symptom Subtypes and Risk of Cardiovascular Events and All-Cause Mortality. Am J RespCritCare. 2021;
28. Azarbarzin A, Zinchuk A, Wellman A, Labarca G, Vena D, Gell L, et al. Cardiovascular Benefit of CPAP in Adults with Coronary Artery Disease and OSA without Excessive Sleepiness. Am J RespCritCare. 2022;
29. Hirotsu C, Betta M, Bernardi G, Marques-Vidal P, Vollenweider P, Waeber G, et al. Pulse wave amplitude drops during sleep: clinical significance and characteristics in a general population sample. Sleep. 2020;43(7).
30. Sapiña-Beltrán E, Torres G, Benítez I, Santamaría-Martos F, Durán-Cantolla J, Egea C, et al. Differential blood pressure response to continuous positive airway pressure treatment according to the circadian pattern in hypertensive patients with obstructive sleep apnoea. European Respiratory Journal. 2019;54(1):1900098.
31. Sapiña-Beltrán E, Benítez I, Torres G, Masa JF, Sánchez-de-la-Torre M, Barbé F, et al. Normotensive patients with obstructive sleep apnoea: changes in 24-h ambulatory blood pressure monitoring with continuous positive airway pressure treatment. J Hypertens. 2018;37(4):1-727.
32. Kohler M, Stradling JR. Mechanisms of vascular damage in obstructive sleep apnea. NatRe vCardiol. 2010;7(12):677-685.
33. Lal C, Hardiman G, Kumbhare S, Strange C. Proteomic biomarkers of cognitive impairment in obstructive sleep apnea syndrome. SLEEP BREATH. 2019;23(1):251-
34. Baril AA, Carrier J, Lafrenière A, Warby S, Poirier J, Osorio RS, et al. Biomarkers of dementia in obstructive sleep apnea. Sleep medicine reviews. 2018;42:139-148.
35. Gozal D, Ham SA, Mokhlesi B. Sleep Apnea and Cancer: Analysis of a Nationwide Population Sample. Sleep. 2016;39(8):1493-500.
36. Martínez-García MA, Campos-Rodriguez F, Almendros I, Farré R. Relationship Between Sleep Apnea and Cancer. Archivos de bronconeumología. 2015;51(9):456-461.
37. Santamaria-Martos F, Benítez I, Girón C, Barbé F, Martínez-García MA, Hernández L, et al. Biomarkers of carcinogenesis and tumour growth in patients with cutaneous melanoma and obstructive sleep apnoea. EurRespir J. 2018;51(3):1701885.



Tabla 1. Clasificación y definición de un biomarcador según su utilidad clínica





Figura 1. Mecanismos intermedios que relacionan la AOS con patología cardiovascular y principales biomarcadores identificados



DE LA ATENCIÓN PRIMARIA A LAS UNIDADES ESPECIALIZADAS: MANEJO INTEGRAL DE LA APNEA
Mikel Azpiazu Blocona Carlos Egea Santaolalla
En nuestro país, se estima que la AOS moderada-grave tratable (IAH ≥ 15) tiene una prevalencia del 12% en adultos de mediana edad¹. Probablemente, más de 2 millones desconocen que sufren AOS relevante y no están siendo tratados.
Es comprensible pensar que la gestión del infradiagnóstico de la AOS no puede ser exclusiva de las unidades de sueño. Es necesario realizar una planificación colabora tiva para esta enfermedad, a la que se sumen los pacientes, los profesionales sani tarios, otros proveedores de salud, como las empresas de terapias respiratorias, y la administración. Los profesionales sanitarios de los distintos niveles asistenciales deben organizarse y trabajar en red, coordinados por las unidades de sueño de referencia, para diagnosticar y acelerar el tratamiento de los pacientes con AOS y garantizar la continuidad del proceso asistencial (Figura 1).
Se debe plantear una gestión de la AOS como enfermedad crónica que requiere un manejo multidisciplinar a largo plazo. Es imprescindible una atención centrada en el pa ciente que implique la reordenación de los flujos de trabajo y la inclusión de herramien tas de telemedicina, de modo que aporten un valor añadido dirigido a incrementar el nivel de salud y la satisfacción del paciente y a facilitar las tareas de los profesionales².
El documento internacional de consenso (DIC) sobre AOS³ considera imprescindible im plicar la Atención Primaria a fin de superar el infradiagnóstico de la AOS desarrollando y consensuando protocolos de derivación a las unidades de sueño de referencia y de manejo de la enfermedad. En esta colaboración, debemos destacar tres aspectos clave para mejorar la gestión de este problema:
1. Sensibilización y formación. La formación y la especialización de los profesio nales implicados es una pieza clave para asegurar una atención de calidad, junto con la acreditación de los centros que participan en estas redes para asegurar unos estándares de calidad.
Diversos estudios4-5 han identificado que la falta de conocimientos y habilidades y el bajo nivel de concienciación de los médicos de atención primaria impiden abordar la evaluación de la AOS y que la implementación de un programa de for mación específico mejora la calidad y la cantidad de derivaciones por sospecha de AOS. Por ello, creemos necesario que las unidades de sueño pongan en marcha
programas de sensibilización y formación, entendiendo la AOS como un proceso continuo que se inicia con una sospecha diagnóstica, continúa con un estudio del sueño, un diagnóstico y una decisión terapéutica y finaliza con el seguimiento del tratamiento indicado.
Por último, es importante sensibilizar y formar a la población en general, y a los pacientes AOS en particular, sobre el sueño saludable, la AOS y la importancia de la adherencia al tratamiento, así como fomentar el compromiso de los pacientes con su tratamiento.
2. Cribado AOS. La identificación temprana de los síntomas de la AOS mediante el cribado es un paso inicial importante para reducir el infradiagnóstico de la AOS. El médico de atención primaria debe conocer los síntomas cardinales que hacen sospechar AOS (ronquido, apneas presenciadas y somnolencia diurna excesiva), sin olvidar otros síntomas asociados menos frecuentes (sueño fragmentado, sueño no reparador, insomnio, fatiga o deterioro neurocognitivo, entre otros) y que existen pacientes paucisintomáticos.
También es importante contemplar la búsqueda activa de casos en pacientes con comorbilidad cardiovascular o metabólica asociada, con patologías en las que la AOS es un factor de riesgo o que tienen profesiones de riesgo.
Consideramos que la utilización rutinaria de herramientas de cribado sencillas y validadas, como el cuestionario STOP-BANG6 8, pueden facilitar esta labor en este nivel asistencial habitualmente saturado.
3. Educación sanitaria del paciente. Los profesionales de atención primaria es tán suficientemente capacitados para dar consejo a los pacientes con sospecha/ diagnóstico de AOS sobre hábitos de vida saludables y aplicación de medidas de higiene de sueño para mantener una rutina de sueño saludable.
La obesidad es el factor de riesgo más importante en el desarrollo de la AOS y está relacionada con su gravedad. Su abordaje requiere una colaboración multidisci plinar con intervenciones para perder peso que se mantenga a largo plazo: cam bios de estilo de vida, hábitos nutricionales que favorezcan una dieta equilibrada y ejercicio aeróbico. Un estudioreciente9 demuestra que este tipo de programas disminuye la gravedad de la AOS y mejora el control de las comorbilidades, y que más de la mitad de los pacientes dejan de necesitar la terapia con CPAP.
El consumo de alcohol y el consumo de tabaco se reconocen como factores agra vantes de la AOS, por ello son importantes el consejo y las intervenciones para abandonar estos hábitos.
Por último, es importante asesorar a los pacientes diagnosticados sobre los be neficios del tratamiento de la AOS, así como de potenciales complicaciones si la enfermedad no se trata. En este último caso, es importante realizar un seguimiento periódico para detectar complicaciones.
Otros aspectos relacionados con la gestión de la AOS, como el diagnóstico y la deci sión terapéutica, deben ser responsabilidad de una unidad de sueño a criterio del DIC. Creemos que se debe seguir explorando el papel activo de los profesionales de atención primaria en los siguientes aspectos:
• Estudio diagnóstico. Hay suficiente evidencia a favor de la gestión diagnóstica ambulatoria de la AOS por parte de especialistas de sueño utilizando poligrafía respiratoria, al ser una estrategia más coste-efectiva, en comparación con una gestión hospitalaria con polisomnografía10. Sin embargo, los datos son limitados en cuanto a la posibilidad de llevar a cabo el diagnóstico ambulatorio en un entor no de atención primaria. Muchos de estos estudios introducen un sesgo de selec ción al estar realizados con equipos de atención primaria previamente instruidos y formados para las tareas requeridas.
Estudios multicéntricos realizados por la Spanish Sleep Network (SSN) sugieren que implementar en atención primaria métodos diagnósticos ambulatorios simpli ficados con dispositivos sencillos validados con análisis automático podría ser una estrategia coste-efectiva para reducir el infradiagnóstico11 12
En nuestra opinión, una gestión diagnóstica centralizada y coordinada desde la unidad de sueño sería más eficiente, dada la habitual insuficiente disponibilidad de dispositivos diagnósticos con relación a la demanda de estudios.
• Decisión terapéutica. Existe la posibilidad de establecer una decisión terapéutica desde la atención primaria de forma coordinada con el nivel especializado, a un coste inferior a la gestión hospitalaria en unidades de sueño y con una aceptación por parte del paciente y un cumplimiento a largo plazo similares13 14 .
Los valores, preferencias y expectativas de los pacientes impactan sobre la elec ción del tratamiento y la adherencia al mismo, y por ello es imprescindible tenerlos en cuenta para una toma de decisiones compartida con el médico de atención primaria o el especialista.
• Seguimiento del tratamiento. Consideramos factible derivar pacientes a atención primaria para continuar el seguimiento de la terapia, siempre que el tratamiento indicado (CPAP u otro alternativo) esté establecido, sea bien tolerado, el paciente cumpla y haya una buena respuesta clínica. Se ha demostrado que este segui miento en un entorno de atención primaria no da lugar a un peor cumplimiento en comparación con un modelo especializado y que es una alternativa coste-efecti
.
• Control de comorbilidades. Dentro de la consideración de la AOS como enfer medad crónica, el abordaje integral de la enfermedad debe incluir el control y el manejo de los factores de riesgo y de las comorbilidades asociadas.
Para establecer un modelo a partir del cual se puedan establecer adaptaciones y mo dificaciones, presentamos el modelo Primaria/Sueño denominado Apnea Virtual Lab (AVL), un programa comunitario de gestión de la AOS iniciado en 2015 en la Unidad Funcional del Sueño (UFS) OSI Araba. Sus objetivos son reducir el infradiagnóstico de la AOS, mejorar la calidad de vida del paciente y contribuir a la sostenibilidad del sistema sanitario público.
Se trata de un original proceso asistencial continuo, simplificado, ambulatorio y virtual que mejora la eficiencia sin perder calidad, basado en 4 criterios:
1. Metodología lean thinking: filosofía de mejora continua (ciclo Deming PDCA) para obtener la máxima eficiencia operativa eliminando lo que no crea valor y reduciendo tiempos y costes, pero sin perder calidad y con la satisfacción del usuario.
2. Metodología learning by doing: aprendizaje natural basado en la premisa de “aprender haciendo”, en un contexto real y concreto, trabajando en equipo. Los aciertos y los errores son la base para descubrir qué elementos funcionan y cuáles no.
3. eHealth: apuesta por los procesos virtuales, utilizando tecnologías de información y comunicación (TICs) y herramientas de telemedicina16 .
4. Network: trabajo en red con médicos de atención primaria y especializada de OSI Araba coordinando protocolos de cribado y búsqueda activa de casos AOS, con transferencia virtual y asíncrona de información a través de la historia clínica electrónica (HCE).
En la gestión de la AOS deberíamos desarrollar un proceso asistencial continuo, empe zando por la sensibilización sobre la AOS, el cribado, el diagnóstico y la indicación de tratamiento y terminando por el control de la adherencia y la eficacia de ese tratamiento (Figura 2)
El programa de cribado AOS se debería realizar trabajando en red con los profesionales de atención primaria con un cribado consensuado, basado en cuestionarios (ejemplo: STOP-Bang21). El cuestionario, acompañado de una entrevista clínica estructurada y en el marco de una atención integrada, permitiría seleccionar en atención primaria a los pacientes que deberían ser referidos a otro ámbito (Figura 4).
Como modelo, en el programa AVL 2022, además de primaria, se pueden introducir no vedades a través de la colaboración voluntaria de profesionales sanitarios comunitarios, tales como farmacéuticos22, dentistas, dietistas-nutricionistas y médicos con actividad exclusivamente privada, a través de convenios con sus Colegios Profesionales.
El uso de un cuestionario, como ejemplo STOP-Bang, podría ser ofrecido en modo pre sencial a través de la historia clínica electrónica en consulta de atención primaria, o en modo virtual a través de formulario electrónico (eForm, Google Forms®) con acceso al mismo mediante un folleto con enlace QR (Figura 3). Una adecuada historia clínica y el STOP-Bang pueden permitir seleccionar mejor a los pacientes con apnea moderada, disminuir estudios del sueño innecesarios y mejorar la gestión de las listas de espera. Este eForm autoadministrado permite un cribado instantáneo y el envío automático de datos a la unidad del sueño, y es una ventaja para pacientes que contactan con profe sionales sanitarios sin acceso a la HCE o que tienen dificultad para acceder a su médico de atención primaria, como ha sucedido durante la pandemia de Covid-19.
Habitualmente, se indica un estudio domiciliario con poligrafía cardiorespiratoria (HSAT). Procederíamos con estudio polisomnográfico en caso de que el paciente presentara comorbilidad cardiorespiratoria grave o inestable o cuando se sospechara un trastorno no respiratorio de sueño comórbido.
Es muy plausible, y actualmente está en vías de exploración, la introducción en los modelos de programa diagnóstico de estudios con dispositivos SW23 comercializados y validados que permiten realizar estudios de varias noches. Se suelen conectar a una aplicación de teléfono móvil y utilizan software en la nube con aprendizaje automático que procesa y analiza señales cardio-respiratorias, ofreciendo un diagnóstico preciso y automático. Esto permitiría al sistema reducir el tiempo de ciclo de un proceso (respecto a un proceso actual con HSAT) e incrementar el número de pacientes diagnosticados sin contratar más personal para la unidad de sueño.
Se ha demostrado que este seguimiento en un entorno de atención primaria no da lugar a un peor cumplimiento en comparación con un modelo especializado y que es una alternativa coste-efectiva15. Existe la posibilidad de establecer una decisión tera péutica en atención primaria de forma coordinada con el nivel especializado, pero estos modelos pueden ser menos generalizables, aunque subsidiarios de aplicarse en áreas concretas con una validación previa. Es muy importante que el médico de AP sepa discernir qué tipo de problemas debe solucionar, qué tipo de problemas puede intentar solucionar y qué tipo de problemas debe derivar (Figura 5)
En conclusión, con una formación adecuada y herramientas de manejo simplificadas, datos clínicos y estudio de nivel IV, los médicos y enfermeros de atención primaria pue den asumir un papel importante en el manejo de la AOS en coordinación con los centros del sueño seleccionando pacientes que deban ser derivados a atención especializada para iniciar un tratamiento específico y evitando la derivación innecesaria de un alto porcentaje de pacientes con AOS leve-moderada.
El documento internacional de consenso (DIC) sobre AOS considera im prescindible implicar a la Atención Primaria para reducir el infradiagnóstico de la AOS, desarrollando y consensuando protocolos de derivación a las unidades de sueño de referencia y de manejo de la enfermedad. Estudios multicéntricos sugieren que la implementación desde atención pri maria de métodos diagnósticos ambulatorios simplificados con dispositivos sencillos validados con análisis automático podría ser una estrategia costeefectiva para reducir el infradiagnóstico.
En el futuro, debemos continuar explorando nuevas vías para desarrollar programas y protocolos con participación activa de la atención primaria y de otros profesionales, para abordar la pandemia oculta del infradiagnóstico AOS.
Palabras clave: Atención Primaria; AOS; Wereables; Poligrafía.
1. Durán J, Esnaola S, Rubio R, Iztueta A. Obstructive sleep apnea-hypopnea and related cli nical features in a population-based sample of subjects aged 30 to 70yr. Am J Respir Crit Care Med. 2001;163:685-689. https://doi.org/10.1164/ajrccm.163.3.2005065
2. Pendharkar S, Blades K, Kelly JE, Tsai WH, Lien DC, Clement F, et al. Perspectives on pri mary care management of obstructive sleep apnea: a qualitative study of patients and heal th care providers. J Clin Sleep Med. 2021;17(1):89-98.https://doi.org/10.5664/jcsm.8814
3. Mediano O, Gonzalez Mangado N, Montserrat JM, Alonso-Alvarez ML, Almendros I, Alonso-Fernandez A, et al. Documento internacional de consenso sobre apnea obstruc tiva del sueño. Arch Bronconeumol. 2022;58(1):52-58. https://doi.org/10.1016/j.ar bres.2021.03.017
4. Reuveni H, Tarasiuk A, Wainstock T, Ziv A, Elhayany A, Tal A. Awareness level of obstruc tive sleep apnea syndrome during routine unstructured interviews of a standardized pa tient by primary care physicians. SLEEP. 2004;27(8):1518-1525. https://doi.org/10.1093/ sleep/27.8.1518
5. Martínez-García MA, Soler-Cataluña JJ, Román-Sánchez P, Amorós C, Quiles L, Chiner-Vi ves E, et al. Efficacy of a training program on sleep apnea-hypopnea syndrome aimed at primary care physicians. Arch Bronconeumol. 2008;44(1):15-21. https://doi.org/10.1016/ s1579-2129(08)60004-x
6. Chung F, Abdullah RH, Liao P. STOP-Bang Questionnaire: A Practical Approach to Screen for Obstructive Sleep Apnea. Chest. 2016;149(3):631-638. https://doi.org/10.1378/ chest.15-0903
7. Ononye T, Nguyen K, Brewer E. Implementing protocol for obstructive sleep apnea scree ning in the primary care setting. Appl Nurs Res. 2019;46:67-71.https://doi.org/10.1016/j. apnr.2019.02.005
8. Nagappa M, Liao P, Wong J, Auckley D, Ramachandran SK, Memtsoudis S, et al. Validation of the STOP-Bang Questionnaire as a Screening Tool for Obstructive Sleep Apnea among Different Populations: A Systematic Review and Meta-Analysis. PLoS ONE. 2015; 10(12) e0143697. https://doi.org/10.1371/journal.pone.0143697
9. Carneiro-Barrera A, Amaro-Gahete FJ, Guillén-Riquelme A, Jurado-Fasoli L, Sáez-Roca G, Martín-Carrasco C, et al. Effect of an interdisciplinary weight loss and lifestyle intervention on obstructive sleep apnea severity: The INTERAPNEA Randomized Clinical Trial. JAMA Netw Open. 2022;5(4):e228212. https://doi.org/10.1001/jamanetworkopen.2022.8212
10. Corral J, Sánchez-Quiroga MA, Carmona-Bernal C, Sánchez-Armengol A, Sánchez de la Torre AS, Durán-Cantolla J, et al; Spanish Sleep Network. Conventional polysomnography is not necessary for the management of most patients with suspected obstructive sleep apnea. Non inferiority, randomized controlled trial. Am J Respir Crit Care Med. 2017;196(9):11811190. https://doi.org/10.1164/rccm.201612-2497OC
11. Masa JF, Duran-Cantolla J, Capote F, Cabello M, Abad J, García-Rio F, et al; Spanish Sleep Network. Efficacy of home single-channel nasal pressure for recommending continuous positive airway pressure treatment in sleep apnea. SLEEP. 2015;38(1):13-21. https://doi. org/10.5665/sleep.4316
12. Sánchez Quiroga MA, Corral J, Gomez de Terreros FJ, Carmona Bernal C, Asensio Cruz MI, Cabello M, et al; Spanish Sleep Network. Primary care physicians can comprehensively ma nage patients with sleep apnea. Am J Respir Crit Care Med. 2018;198(5):648-656. http:// dx.doi.org/10.1164/rccm.201710-2061OC
13. Scharf SM, DeMore J, Landau T, Smale P. Comparison of primary-care practitioners and sleep specialists in the treatment of obstructive sleep apnea. Sleep Breath. 2004;8:111124. https://doi.org/10.1007/s11325-004-0111-6
14. Tarraubella N, Sánchez-de-la-Torre M, Nadal N, De Batlle J, Benítez I, Cortijo A, et al. Management of obstructive sleep apnoea in a primary care vs sleep unit setting: a ran domised controlled trial. Thorax. 2018;73:1152-1160. http://dx.doi.org/10.1136/thorax jnl-2017-211237
15. Sánchez-de-la-Torre M, Nadal N, Cortijo A, Masa JF, Duran-Cantolla J, Valls J, et al; Spanish Sleep Network. Role of primary care in the follow-up of patients with obstructive sleep ap noea undergoing CPAP treatment: a randomised controlled trial. Thorax. 2015;70(4):346352. https://doi.org/10.1136/thoraxjnl-2014-206287
16. Shamim-Uzzaman QA, Bae, CJ, Ehsan Z, Setty AR, Devine M, Dhankikar S, et al. The use of telemedicine for the diagnosis and treatment of sleep disorders: an American Aca demy of Sleep Medicine update. J Clin Sleep Med. 2021;17(5):1103-1107. https://doi. org/10.5664/jcsm.9194
17. Pépin JL, Bailly S, Tamisier R. Big Data in sleep apnoea: Opportunities and challenges. Respirology. 2020; 25:486-494. https://doi.org/10.1111/resp.13669
18. Pack A. Application of Personalized, Predictive, Preventative, and Participatory (P4) Me dicine to Obstructive Sleep Apnea. A Roadmap for Improving Care?. Ann Am Thorac Soc, 2016;13(9):456-1467. https://doi.org/10.1513/AnnalsATS.201604-235PS
19. Goldstein A, Berry RB, Kent DT, Kristo DA, Seixas AA, Redline S, et al. Artificial intelligence in sleep medicine: an American Academy of Sleep Medicine position statement. J Clin Sleep Med. 2020;16(4):605-607. https://doi.org/10.5664/jcsm.8288
20. Goldstein A, Berry RB, Kent DT, Kristo DA, Seixas AA, Redline S, et al. Artificial intelli gence in sleep medicine: background and implications for clinicians. J Clin Sleep Med. 2020;16(4):609-618. https://doi.org/10.5664/jcsm.8388
21. Chung F, Abdulah HR, Liao P. STOPBang Questionnaire: A practical Approach to Screen for Obstructive Sleep Apnea. Chest. 2016;149:631-638. http://dx.doi.org/10.1378/ chest.15-0903
22. Cawley MJ, Warning WJ. A systematic review of pharmacists performing obstructive sleep apnea screening services. Int J Clin Pharm. 2016;38:752-760. https://doi.org/10.1007/ s11096-016-0319-0
23. Devani N, Pramono RXA, Imtiaz SA, Bowyer S, Rodriguez-Villegas E, Mandal S. Accuracy and usability of AcuPebble SA100 for automated diagnosis of obstructive sleep apnoea in the home environment setting: an evaluation study. BMJ Open. 2021;11(12):e046803. https:// doi: 10.1136/bmjopen-2020-046803.
Atención centrada en el paciente con organización y trabajo en red entre profesionales sanitarios, proveedores de salud, administración sanitaria y pacientes, coordinados por las unidades de sueño, que garantizan la continuidad del proceso asistencial.
Proceso asistencial continuo, simplificado, ambulatorio y virtual.


Folleto de cribado AOS virtual con enlace QR a formulario de cribado.

Figura 4.
de algoritmo diagnóstico en pacientes con sospecha de apnea obstructiva del sueño (AOS) en atención primaria en coordinación con el laboratorio de sueño de referencia
Documento internacional de consenso. DT: decisión terapéutica; ECP: enfermedad cardiopulmonar; ES: estudio simplificado (uno o 2 canales correspondientes a presión nasal y oximetría); ESD: excesiva somnolencia diurna; IAH: índice de apneas-hi popneas; IMC: índice de masa corporal. *Se define alta probabilidad de AOS por la presencia de ESD con Epworth≥12 y de 2 de los siguientes 3 criterios: ronquido alto habitual, despertares asfícticos o apneas observadas y/o hipertensión arterial. **En estos casos, puede ofrecerse la opción de un análisis manual del registro por parte del laboratorio de sueño coordinador para un diagnóstico más preciso.

Tomado de Duran Cantolla J y Martinez MA. (2009). Apnea del sueño en atención primaria. Madrid. Editorial Respira.

¿CÓMO DEBEMOS REALIZAR LA INVESTIGACIÓN FUTURA EN APNEA DEL SUEÑO?
Autor
José María Marín
Como en toda investigación biomédica, la investigación en apnea obstructiva de sueño (AOS) debe hacerse: 1) enunciando una pregunta que responda a una necesidad de conocimiento sobre la fisiopatología y la historia natural de una determinada entidad clínica, en este caso la AOS; y 2) estableciendo una hipótesis y objetivos concretos. El estado actual de conocimientos sobre la AOS, y sobre los trastornos de sueño en general, es todavía deficiente, y desde la generalización del tratamiento con presión po sitiva sobre la vía aérea (CPAP) y la poligrafía respiratoria, pocos avances radicalmente sustanciales se han producido en los últimos 25-30 años. En la tabla I se resume la clasificación de los tipos de investigación clínica y su aplicación a la apnea obstructiva del sueño. El otro “cómo” debemos realizar de forma práctica y efectiva la investigación en AOS, se refiere a la metodología, la estructura y los medios. La respuesta también es obvia:
a. Mediante estudios clínicos unicéntricos, que suelen intentar responder a pro blemas asistenciales locales o mecanísticos concretos. Por ejemplo, en una uni dad específica de trastornos respiratorios de sueño (TRS): ¿Cuál es el rendimiento de manejar a los nuevos pacientes con sospecha de TRS mediante un nuevo equi po de poligrafía domiciliaria versus el procedimiento estándar de polisomnografía vigilada? O bien, ¿Cuál es la relación entre el nivel de gravedad de un TRS y la presencia de microalbuminuria en orina?
b. Mediante estudios multicéntricos que suelen plantear problemas de validación tecnológica, estudios randomizados o de cohortes observacionales para conocer mejor la historia natural de la enfermedad, su tratamiento y sus complicaciones.
c. Mediante estudios colaborativos (inter-laboratorios) que plantean estudios “ómicos” de conocimiento sobre endotipos-fenotipos de la enfermedad. Por ejem plo, en una cohorte observacional multicéntrica de pacientes con TRS, ¿Cuál es la relación entre los niveles basales pre-tratamiento de un biomarcador y los resul tados de salud a largo plazo?
Nuestro país es reconocido internacionalmente por su modelo de “cómo” ha abordado la investigación en AOS. Lo ha hecho mediante una propuesta integradora y multidis ciplinar promovida por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) y que se ha dado en llamar “Spanish Sleep Network”¹. Esta estructura debe reforzarse para alcanzar nuevas metas en la investigación de los TRS. En este capítulo se enuncian
algunas de las necesidades de conocimiento e investigación que me parecen priorita rias y que se resumen en investigación sobre los endotipos que conducen a padecer OSA, sus fenotipos y la personalización del tratamiento.
En la figura 1 se presenta un esquema estándar del concepto actual de medicina personalizada (MP) aplicada a la AOS y los principales retos de investigación futura en este campo.
Estudios genómicos. La secuenciación del genoma humano está permitiendo en tender por qué aparecen muchas enfermedades y valorar su pronóstico. Las nuevas técnicas de secuenciación de ADN y los microarrays de ADN han permitido identificar un gran número de genes asociados a enfermedades específicas. Los microarrays eva lúan fragmentos de ADN o ARN y miden el grado de expresión de cada gen. También permiten determinar las variaciones en las secuencias de los nucleótidos (SNP) y, por tanto, determinar los polimorfismos de cada gen de una enfermedad específica en individuos o poblaciones. Pocas enfermedades dependen de un solo gen (por ej., la fibrosis quística), mientras que la mayoría tienen una base genética (genotipo) compleja o desconocida (por ej., la diabetes). En AOS se han realizado pocos estudios al respecto y con resultados irregulares² En España no disponemos de esta información, y sería de interés conocer qué variaciones genéticas se asocian con los diferentes fenotipos de AOS (por ej., sujetos sin o con hipersomnia diurna) y respuesta al tratamiento (por ej., pacientes con/sin reducción de las cifras de presión arterial por efecto de la CPAP). Este tipo de investigación debería basarse en la “constitución” de una cohorte multicéntrica abierta (no-intervención) de base clínica y contar con la colaboración de laboratorios de genética.
Estudios de proteómica. La proteómica ofrece información complementaria de la ge nómica. Dado que las funciones biológicas las realizan las proteínas, la proteómica clí nica tiene por objetivo definir patrones de proteínas que indiquen susceptibilidad a una enfermedad y/o tengan valor diagnóstico y pronóstico. Algunos de estos perfiles son definidos como “biomarcadores”. Este es un campo de extraordinarias oportunidades de investigación en la AOS³. Nuestros grupos de investigación promovidos por SEPAR en los PII tienen aquí una gran oportunidad.
Endotipos. Son los mecanismos intermedios (desde el genoma/proteoma hasta el fe notipo) que inducen cambios metabólicos, fisiológicos o biológicos en los sistemas u órganos afectados en una determinada enfermedad. En el caso de la AOS, un buen ejemplo es determinar los factores anatómicos y/o fisiológicos implicados en la colap sabilidad de la vía aérea superior o de la estabilidad del centro respiratorio4. Se deben
realizar más estudios sobre el efecto de los tratamientos disponibles en AOS para esta bilizar la vía aérea y su papel en AOS, tales como CPAP, oxígeno, avances mandibulares, fármacos, estimuladores locales, etc. (Figura 1).
Fenotipos. Este término denota una combinación de características de una enferme dad que se manifiestan en un subgrupo de sujetos (síntomas, respuesta al tratamiento, resultados de salud) y que la diferencian de otra categoría de pacientes con la misma enfermedad, en este caso, de AOS5. La AOS es una entidad de presentación clínica heterogénea, por lo que un análisis de clusters en una gran cohorte observacional como la arriba propuesta sería el método adecuado para su estudio. Una investigación de este tipo, prospectiva, abierta, sin intervención predeterminada y de larga duración (por ej., más de 10 años), sería un estudio que pocos países son capaces de desarrollar como el nuestro. El resultado del estudio vendría dado por diferentes biomarcadores de pronóstico, resultados sobre la sintomatología, respuesta terapéutica, comorbilidades desarrolladas y, en definitiva, la supervivencia de los potenciales diferentes fenotipos de AOS. Ejemplos de análisis de clusters que han definido algunos fenotipos de AOS son el estudio europeo European Sleep Apnoea Database6 y la cohorte del US Veterans 7 . Los fenotipos encontrados en estos estudios han sido muy dispares y deben validarse en nuevas cohortes.
Rasgos tratables. He tenido la oportunidad de ser espectador de la evolución del manejo de la AOS desde los años 80 del siglo pasado. Al principio, los neumólogos contemplábamos con “frustración” cómo muchos pacientes con AOS eran sometidos a cirugías ineficaces de la vía aérea superior sin claras indicaciones. Posteriormente, de la colaboración con otras especialidades (especialmente ORL) aprendimos todos como “fenotipar” mejor el perfil de paciente que mejor podría beneficiarse de estas cirugías y elaboramos guías terapéuticas para “ordenar” un poco la inmensidad de la carga asistencial que supone la AOS8. Con la simplificación del diagnóstico (por ej., poligrafías domiciliarias), la demanda desbordada, y con la prescripción masiva de los sistemas de autoCPAP, hemos vuelto al manejo “uniforme” y a la estrategia del “onesize-fits-all” de los pacientes con AOS. La consecuencia es que cada vez se ven más fallos diagnósticos, más indicaciones terapéuticas inapropiadas y, en definitiva, menos personalización de la medicina en esta área. De alguna manera, hemos vuelto a los años 1980. Precisamente, el estudio de endotipos-fenotipos tiene por objeto ofrecer a cada paciente su tratamiento apropiado.
La investigación de “rasgos tratables” sigue siendo un tema pendiente, y su principal enemigo es la homogeneidad actual creciente descrita arriba en el manejo de la AOS. En AOS, el objetivo primario de la investigación en endotipos-fenotipos es aplicar un tratamiento con respuesta favorable. Se trata, no ya de reducir el índice apnea-hipop nea (IAH), sino de predecir qué tratamiento mostrará la mejor respuesta sintomática y
pronóstica. Por tanto, la investigación en los próximos años debe centrase en identificar “rasgos” de sueño más allá del IAH, biomarcadores, clusters de síntomas y “defectos anatómicos, biológicos, fisiopatológicos” fáciles de identificar que permitan personalizar el tratamiento.
En la figura 1 se sugieren algunas líneas de investigación a desarrollar en futuros es tudios evitando enumerar una larga lista de temas concretos. Se han razonado futuras líneas de trabajo urgentes sobre conocimiento en AOS9 10. SEPAR y su PII de sueño tienen la experiencia, el “know-how”, y sobre todo el componente humano para seguir liderando investigación en AOS de primer nivel. La estructura del PII de sueño es el marco adecuado para plantear estudios unicéntricos, multicéntricos y colaborativos con otras especialidades. La búsqueda de financiación para estudios de investigación en sueño puede iniciarse tras la presentación/discusión/aceptación en el PII. El propio PII dispone de algunos fondos para iniciar las primeras fases del proyecto como palanca para obtener una financiación suficiente en las convocatorias competitivas públicas o procedentes de la iniciativa privada. En definitiva, la investigación es para SEPAR nada más y nada menos que la razón de su existencia como sociedad científica com prometida con proporcionar excelencia asistencial a los pacientes con enfermedades respiratorias.
1. La investigación en apnea obstructiva del sueño (AOS) muestra una cierta desaceleración en los últimos años.
2. SEPAR, a través de su PII de sueño, es el marco adecuado para desarrollar proyectos unicéntricos, multicéntricos y colaborativos interdisciplinares en AOS.
3. Estamos pendientes de conocimiento sobre múltiples aspectos de investi gación en AOS, desde la genómica hasta los rasgos tratables.
4. La complejidad, la sofisticación tecnológica y los costos de la investigación biomédica (también en AOS) solo puede desarrollarse de forma efectiva en un marco colaborativo.
1. Mediano O, Cano-Pumarega I, Sánchez-de-la-Torre M, Alonso-Álvarez ML, Troncoso MF, García-Río F, et al; Spanish Sleep Network; Spanish Sleep Network. Upcoming Scenarios for the Comprehensive Management of Obstructive Sleep Apnea: An Overview of the Spanish Sleep Network. Arch Bronconeumol. 2020;56(1):35-41.
2. Kiley JP, Twery MJ, Gibbons GH. The National Center on Sleep Disorders Research-progress and promise. Sleep. 2019;42(6):zsz105. doi: 10.1093/sleep/zsz105.
3. Feliciano A, Torres VM, Vaz F, Carvalho AS, Matthiesen R, Pinto P, et al. Overview of proteo mics studies in obstructive sleep apnea. Sleep Med. 2015;16(4):437-445.
4. Malhotra A, Mesarwi O, Pepin JL, Owens RL. Endotypes and phenotypes in obstructive sleep apnea. Curr Opin Pulm Med. 2020;26(6):609-614.
5. Zinchuk AV, Gentry MJ, Concato J, Yaggi HK. Phenotypes in obstructive sleep apnea: A definition, examples and evolution of approaches. Sleep Med Rev. 2017;35 (2):113-123.
6. Saaresranta T, Hedner J, Bonsignore MR, Riha RL, McNicholas WT, Penzel T, et al; ESADA Study Group. Clinical Phenotypes and Comorbidity in European Sleep Apnoea Patients. PLoS One. 2016; 4;11(10):e0163439.
7. Zinchuk A, Yaggi HK. Sleep Apnea Heterogeneity, Phenotypes, and Cardiovascular Risk. Implications for Trial Design and Precision Sleep Medicine. Am J Respir Crit Care Med. 2019;200(4):412-413.
8. Lloberes P, Durán-Cantolla J, Martínez-García MA, Marín JM, Ferrer A, Corral J, et al. Diag nosis and treatment of sleep apnea-hypopnea syndrome. Spanish Society of Pulmonology and Thoracic Surgery. Arch Bronconeumol. 2011;47(3):143-156.
9. Martínez-García MA, Lévy P. Some forgotten issues in sleep apnoea. Eur Respir J. 2022;59(4):2101627.
10. Hilbert J, Yaggi HK. Patient-centered care in obstructive sleep apnea: A vision for the future. Sleep Med Rev. 2018;37:138-147.
Prevención
Busca formas de prevenir la aparición o la reincidencia de enfermedades
· Cambios de estilo de vida para evitar la AOS
· Medicaciones que aumenten el tono muscular de la faringe y eviten su colapso
· Medicaciones que estabilicen elcentro respiratorio
Genética
Diagnóstico
Identificar genes que determinan la aparición de enfermedades
· Estudios genéticos que expliquen la colapsabilidad de la faringe y/o el depósito de grasa local Detección
Encontrar la forma de detectar un trastorno a nivel poblacional
Mejor forma de identificar un trastorno
· Difusión en medios de masas del problema de la AOS, su clínica y sus consecuencias
· Formación en AOS de todos los profesionales sanitarios
· Nuevos dispositivos de diagnós tico de AOS más eficientes, menos invasivos y más baratos
Estudios epidemiológicos
Identificar pautas, causas y con trol de trastornos en subgrupos de sujetos
Implica intervención
· Largos estudios observacionales desde la infancia hasta la edad adulta de hijos de pacientes con AOS, incluyendo estudios genó micos y epigenéticos
· Ensayar nuevas moléculas que aumenten el tono muscular de la fa ringe
· Ensayar dispositivos estimuladores del tono muscular de la faringe más baratos
· Idem. de avance mandibular
· Mejorar por telemedicina la adheren cia y la eficiencia de la CPAP
Diseño de estrategias de evalua ción de la gravedad del trastorno
· Ajustar los algoritmos de manejo de la AOS al riesgo de desarrollar eventos de salud
Figura 1. Medicina personalizada y ejemplos de su aplicación en la apnea obstructiva del sueño


 Patrocinado por
Patrocinado por